微胶囊化是一种广泛用于制药工业的技术,近年来在食品工业中也开始广泛应用[1]。微胶囊包封能够赋予活性化合物一定程度的稳定性,其壁材可充当氧或其他分子的物理屏障,防止有害反应,同时还可以控制芯材的释放[2]。由于微胶囊的稳定性和释放性高度依赖于壁材的组成,目前已经使用了各种载体,包括环糊精、麦芽糖糊精、改性淀粉、树胶、蛋白质和纳米颗粒、胶束或脂质体[3]。但考虑到以上壁材有些可能存在化学试剂残留,价格昂贵等问题,近年来发现一种容易获得、成本低廉且安全无毒的酵母细胞,可作为新型微胶囊壁材[4]。酵母细胞含丰富的营养成分,它的磷脂膜可以表现为脂质体,细胞壁则是由β-1,3-葡聚糖网络、甘露糖蛋白层和少量几丁质组成,该壁能为细胞提供机械强度,并允许分子质量高达760 Da的分子自由扩散,而细胞膜是渗透分子的主要渗透屏障[5]。因此芯材可能包裹在细胞壁内部与细胞膜之间。同时酵母细胞的通透性较高,在包埋时有助于芯材的进入,将制备的微胶囊冻干后保藏,有利于芯材稳定的存储。使用酵母细胞作为壁材的微胶囊制备方法一般需要借助于不同的渗透压,使物质渗透到细胞壁进入到细胞内,从而可形成微胶囊。目前大部分壁材用于包裹疏水脂溶性的物质,如白藜芦醇[6]、马齿苋籽油[7]、鱼油[8]。PARAMERA等[4]通过荧光显微镜,差示扫描量热法和傅立叶变换红外光谱证实,酵母细胞具有包埋姜黄素的可能性。在所有制备的微胶囊中,姜黄素被整合到质膜双层中,但也与细胞壁网络的成分相互作用。而国内外关于包埋水溶性物质的报道甚少。
茶多酚(tea polyphenols,TP)是从茶叶中提取的天然多酚类物质,是一种天然的水溶性食品抗氧化剂[9],同时具有抑菌、络合金属离子[10]、抗癌和降脂等多种功效。TP的脂溶性较差,在存在光照、酸性或碱性溶液、氧化剂等条件下稳定性较差,容易被氧化,从而限制了TP的应用。因此利用微胶囊技术将TP包裹在壁材内可以防止氧化剂、水分以及环境中其他成分对其造成破坏[11],近年来相关研究也日益增多。尽管目前有少量报道TP微胶囊的制备,但尚不清楚微胶囊化TP的稳定性是否可以得到改善。有研究以纳米颗粒为载体,将TP包埋于纳米粒子中,发现一定程度上可减缓胃肠道酶、微生物、电解质成分对TP的损害,从而达到有一定缓释作用以及保护TP的目的[12]。有研究将多酚用于商业多孔膜上与铀形成超分子网络以用做从海水中提取铀的高效且经济上可行的材料[13]。GÜLSEREN等[14]使用大豆磷脂和牛奶磷脂制备脂质体包埋TP,所制备的纳米粒子提高了游离TP的稳定性,并且包封的TP具有缓释作用。WANG等[15]为了提高TP的稳定性,采用喷雾干燥法,以邻苯二甲酸羟丙基甲基纤维素为涂料,将其微胶囊化。对所获得的微胶囊的性质研究发现,储存稳定性和抗氧化能力得到显著提高。从而可得,微胶囊化不失为拓宽TP在食品工业中储存和应用的好方法。
本研究选用实验室保藏的库德毕赤酵母(Pichia kudriavzevii A16)来作为新型微胶囊壁材,探究以其为载体包埋水溶性TP的可行性。同时确定了有效包封的最佳优化条件,并对包埋过程和释放过程进行了研究。最后,还探究了微胶囊的贮藏稳定性。旨在提高TP等环境敏感性功能成分的生物稳定性,拓展其在食品工业中的应用。
1 材料与方法
1.1 材料与试剂
TP(纯度98%):索莱宝生物科技有限公司;酵母菌:库德毕赤酵母菌(Pichia kudriavzevii A16),本实验室保藏;福林酚、Na2CO3、没食子酸、NaCl、HCl、NaOH、Fe2(SO4)3:国药集团化学试剂有限公司;胃蛋白酶、胰蛋白酶:诺维信(中国)有限公司;实验用水均为去离子水。
1.2 仪器与设备
QYC-2102C振荡培养箱,上海福马设备有限公司;Nicolet iS10傅里叶红外光谱仪,美国Thermo Fisher公司;CX21FS1,日本Olympus公司;JEM-1200EX,日本JEOL公司;真空冷冻干燥机,美国Sim公司;UV-2102型紫外分光光度计,上海尤尼柯公司。
1.3 实验方法
1.3.1 TP的检测方法
TP测定参照GB/T 31740.2—2015 《茶制品第2部分:茶多酚》[16]的方法,按公式(1)计算:
茶多酚含量![]()
(1)
式中:A-样品测试液吸光度;V-样品溶液体积,100 mL;d-稀释因子;SLOPEstd-没食子酸标准曲线的斜率;m-样品质量,g;w-样品干物质含量,%。
1.3.2 茶多酚酵母微胶囊的制备
1.3.2.1 酵母细胞壁材的制备
将酵母细胞经斜面活化24 h,然后接种至液体YEPD培养基中继续培养24 h,再继续扩大培养24 h,离心得到酵母细胞,用超纯水清洗3遍后离心得到酵母菌泥,备用。
将收集到的酵母细胞按固液比1∶20加入到3%(质量分数) NaCl,调至pH 5.5,于54 ℃,150 r/min水浴振荡20 h,离心(6 000 r/min,10 min)。质壁分离完成后,水洗3次,冷冻干燥,得到酵母菌壁材。
1.3.2.2 茶多酚酵母微胶囊的制备方法
称取预处理的酵母细胞与TP样品,加入去离子水,恒温振荡,离心,收集细胞,水洗3次,再次离心收集酵母细胞,冷冻干燥,得到包埋茶多酚的酵母微胶囊产品即茶多酚微胶囊(microcapsules of tea polyphenols,MTPs)。
1.3.3 包埋率的计算
包埋率是指微胶囊产品中被包埋的芯材含量与微胶囊产品中总的芯材含量之比。它是衡量包埋效果的指标。包埋率计算公式(2)如下:
包埋率/%=
(2)
1.3.4 MTPs制备工艺的研究
单因素实验:以包埋率为指标,研究壁芯比例、包埋温度和包埋时间等单因素对酵母细胞包埋TP的影响。
壁芯比例:分别按壁芯比例1∶2,1∶1,2∶1,4∶1,6∶1,8∶1,10∶1 (质量比)称取一定量预处理的酵母细胞壁材与TP样品,加入30 mL去离子水,在28℃条件下恒温振荡4 h,离心(4 000 r/min,5 min),测定包埋率。
包埋温度:按壁芯比例8∶1(质量比)称取一定量预处理的酵母细胞壁材与TP样品,加入30 mL去离子水,分别在20、28、36、44、52、60℃条件下恒温振荡4 h,离心(4 000 r/min,5 min),测定包埋率。
包埋时间:按壁芯比例8∶1(质量比)称取一定量预处理的酵母细胞壁材与TP样品,加入30 mL去离子水,在28℃条件下恒温振荡0、1、2、4、6、8 h,离心(4 000 r/min,5 min),测定包埋率。
响应面实验:为得到制备MTPs的最佳工艺条件,在单因素试验结果的基础上,以(A)壁芯比例(6∶1,8∶1,10∶1)、(B)振荡时间(2、4、6 h)和(C)温度(20、28、36 ℃)为试验因素及水平,以包埋率为响应值,采用响应面分析法设计3因素3水平Box-Behnken实验。
1.3.5 傅里叶变换红外光谱(fourier transform infrared spectrometer,FTIR)
将2 mg的TP样品、冻干的酵母细胞和MTPs粉末碾磨均匀,使其分布在200 mg的KBr中压片。压片后放置在傅里叶变换红外分光镜中测定。
1.3.6 MTPs的形态观察
1.3.6.1 电子显微镜观察
分别将质壁分离后的酵母细胞和MTPs经Fe2(SO4)3染色后固定,于普通电子显微镜(electron microscope,EM)下观察其微观形态。
1.3.6.2 透射电子显微镜观察
对包埋前后微胶囊微观结构进行透射电子显微镜(transmission electron microscope,TEM)观察。分别将质壁分离后的酵母细胞和MTPs用4%(体积分数)的戊二醛固定6 h以上,经固定与冲洗后,完成纯白胶包埋,烘干。取出胶粒,经修块和超薄切片后在80 kV加速电压下进行观察。使用Nano Measurer 1.2测量200个样品中壁膜间隙的大小以及通过SPSS软件进行统计学分析。
1.3.7 MTPs的释放
参照文献的方法[17],将MTPs在模拟胃肠液中的释放来模拟体外消化过程。根据参考文献[18]描述制备模拟胃液和肠液,并进行一些修改。模拟胃液:3.2 g胃蛋白酶,7 mL HCl并调至pH(1.2±0.1),定容至1 000 mL。模拟肠液:6.80g KH2PO4溶解于水中并定容至500 mL,190 mL 0.20 mol/L NaOH以及400 mL蒸馏水,10.00 g胰蛋白酶,调pH(7.5±0.1)并定容至1 000 mL。称取一定量MTPs样品于(37±0.5) ℃,150 r/min恒温水浴振荡,在模拟胃液、肠液中消化时间分别为10 h,每隔一段时间取样,测定MTPs的释放情况。
1.3.8 MTPs的贮藏稳定性分析
1.3.8.1 光照对MTPs稳定性的影响
将MTPs样品分别置于光照和黑暗条件下,每隔5 d取样,每次通过测定释放TP的含量来计算剩余TP的含量,公式(3)如下:
TP保留率![]()
(3)
1.3.8.2 相对湿度对MTPs稳定性的影响
将MTPs样品分别置于饱和MgCl2溶液(RH=(32.78±0.16)%),Mg(NO3)2溶液(RH=(52.89±0.22)%)和KCl溶液(RH=(84.34±0.26)%)[19],每隔5 d取样,每次通过测定释放TP的含量来计算剩余TP的含量,计算方法同公式(3)。
2 结果与分析
2.1 MTPs包埋工艺
2.1.1 单因素研究
壁芯比例、温度和包埋时间对包埋率的影响见图1。随着壁芯比例的增大,包埋率随之增大,最后趋向于稳定,当壁芯比例为8∶1时,TP包埋率达到68.75%,而殷佳雅等[20]用酿酒酵母包埋茶多酚其包埋率最高能达到35.71%。说明库德毕赤酵母是可用且效率较高的新型微胶囊壁材。随着温度的升高,微胶囊的包埋率先升高后降低,在28 ℃达到最大,温度过高,分子运动加快,促进TP的细胞内扩散,可另一方面也会使酵母细胞膜通透性增大,导致TP的溶出,包埋率也会随之降低,同时TP氧化严重,溶液红度增大。在振荡时间为4 h左右,包埋率最大,而随后包埋率又逐渐降低,可能是因为在包埋的过程中有一部分TP通过物理吸附作用吸附在了细胞壁上,随着时间的增长,TP与细胞壁的弱相互作用[21],导致一部分吸附稀疏的TP脱离酵母菌,回到溶液中。
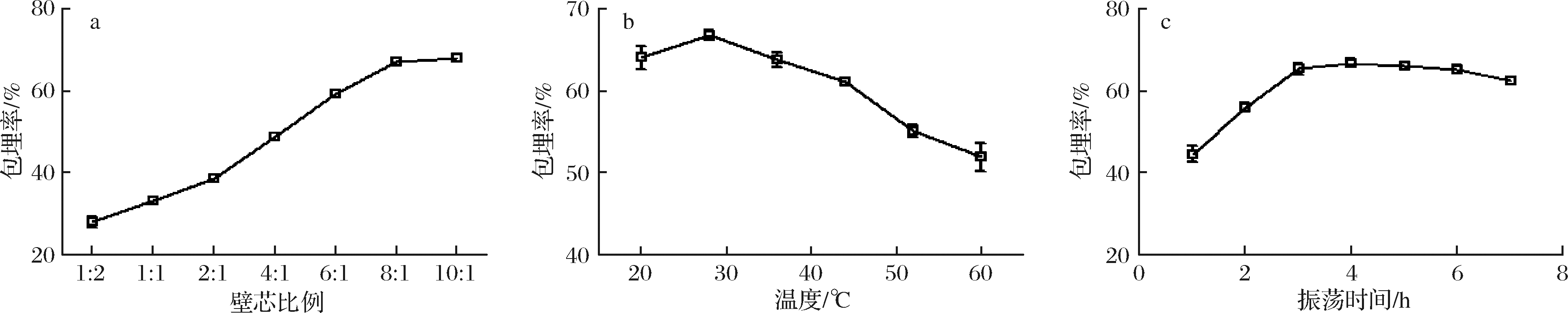
a-不同壁芯比例的包埋率;b-不同温度下的包埋率;c-不同振荡时间的包埋率
图1 不同因素对包埋率的影响
Fig.1 The influence of different factors on the embedding rate
2.1.2 响应面优化
根据表1结果利用Design Export(8.0.6版)软件,可得二次多项回归方程为:
Y=68.48+3.89×A+0.22×B-0.82×C+0.048×A×B+0.36×A×C+0.21×B×C-4.38×A2-1.49×B2-2.81×C2
表1 响应面设计及结果
Table 1 Design and results of response surface
methodology experiment

实验编号壁芯比例(A)时间(B)/h温度(C)/℃包埋率/%11(10∶1)1(6)0(28)66.982-1(6∶1)-1(2)058.3330(8∶1)-1-1(20)65.01400(4)069.21500067.97600068.23710164.5381-1066.77901-165.3610-101(36)56.791101163.77120-1162.571310-165.0714-11058.351500068.021600068.9817-10-158.78
通过表2回归方差分析表可以看出,二次回归方差模型极显著(P<0.000 1),失拟项P=0.308 4不显著,模型![]() 说明该模型拟合良好,可以用该回归方程对酵母菌包埋TP进行分析和预测,从而确定MTPs的最佳工艺条件。同时,根据F值大小,可判断出各因素对包埋率的影响:壁芯比例(A)>温度(C)>时间(B),其中壁芯比例对包埋率的影响极显著,提示在生产过程中应严格控制其工作参数。
说明该模型拟合良好,可以用该回归方程对酵母菌包埋TP进行分析和预测,从而确定MTPs的最佳工艺条件。同时,根据F值大小,可判断出各因素对包埋率的影响:壁芯比例(A)>温度(C)>时间(B),其中壁芯比例对包埋率的影响极显著,提示在生产过程中应严格控制其工作参数。
表2 回归方程系数显著性检验
Table 2 Test for significance of regression coefficients
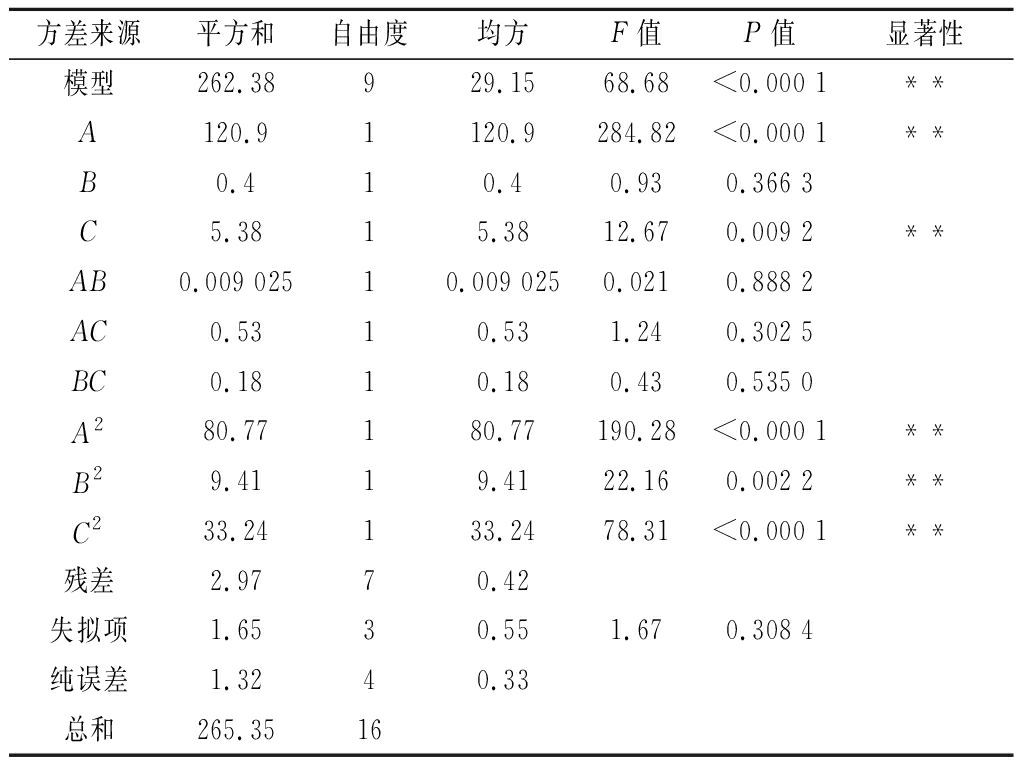
方差来源平方和自由度均方F值P值显著性模型262.38929.1568.68<0.000 1**A120.91120.9284.82<0.000 1**B0.410.40.930.366 3C5.3815.3812.670.009 2**AB0.009 02510.009 0250.0210.888 2AC0.5310.531.240.302 5BC0.1810.180.430.535 0A280.77180.77190.28<0.000 1**B29.4119.4122.160.002 2 **C233.24133.2478.31<0.000 1**残差2.9770.42失拟项1.6530.551.670.308 4纯误差1.3240.33总和265.3516
注:“**”表示差异极显著(P<0.01);“*”表示差异显著(P<0.05)。
经响应面法优化得到酵母菌包埋TP的最佳工艺条件为:壁芯比例为8.88 ∶1,温度27.08℃,时间为4.15 h,此时包埋率可达到69.39%。考虑实际操作的方便性和可行性,将理论值修订为:壁芯比例为9∶1, 温度28 ℃,时间为4 h。在此条件下进行验证实验,实测包埋率为(68.12±0.35)%,与理论值较接近,说明优化得到的工艺条件与实际情况拟合度较好,验证了模型的可靠性。
2.2 傅里叶变换红外光谱
图2是MTPs、酵母菌壁材、TP以及TP与酵母菌物理混合物的傅里叶红外光谱图。从图中可以看出TP在3 342 cm-1处左右有个大且宽的特征吸收峰,是O-H的伸缩振动;1 692 cm-1是羰基C=O的伸缩振动;在1 610、1 517、1 463 cm-13个“指峰”是苯环骨架C=C伸缩振动,1 314 cm-1是多种烷烃-CH2的叠加峰,在1 000~1 300 cm-1是C-O-C,C-OH,C-C3的振动,650~900 cm-1是芳香取代基的面外变形振动吸收峰。在酵母菌的光谱图中,1 657cm-1处的吸收峰为酰胺Ⅰ带,是C=O的伸缩振动,1 548 cm-1的吸收峰是酰胺Ⅱ带,是N-H的弯曲振动和C-N的伸缩振动,1 244 cm-1是酰胺Ⅲ带,是C-N的伸缩振动和N-H的弯曲振动引起的。
1 064 cm-1处的吸收峰是由酵母中的RNA、DNA或细胞壁中存在的碳水化合物或醇中的C-O伸缩振动引起的。图3的结果显示,MTPs与酵母菌壁材的图谱高度一致,无明显差异,并且没有出现TP的特征峰,可能是TP与蛋白质主链的肽基-NH-CO,侧链上的OH、NH2以及COOH以氢键的形式多点结合[22],发生了相互作用,而TP与酵母菌的简单混合物中确实保留了TP的特征峰,因此可以看出TP确实包埋在了酵母菌内部,而并非只是二者的简单混合[23]。
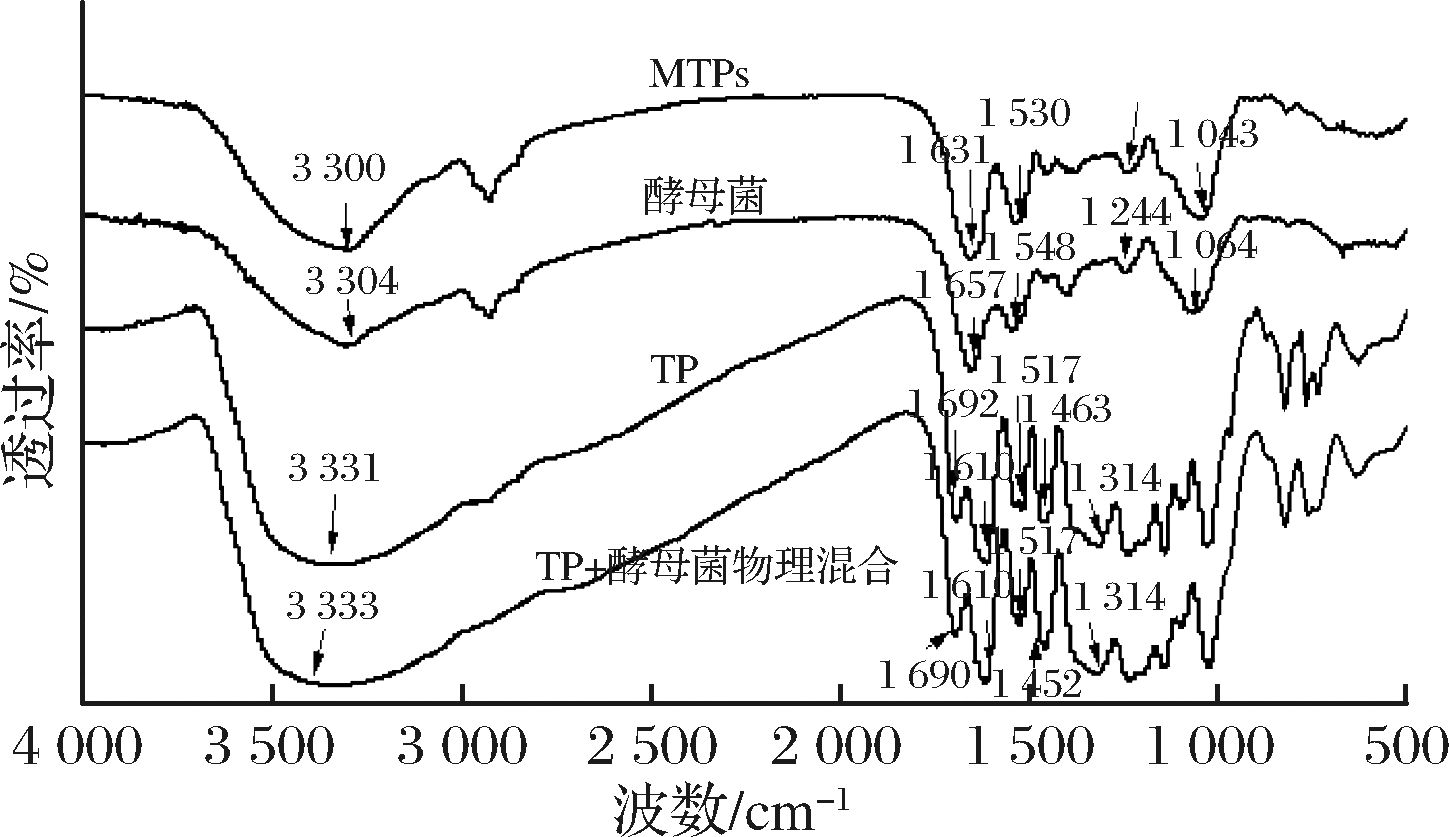
图2 TP、酵母细胞、微胶囊的傅里叶红外光谱图
Fig.2 FTIR of TP, yeast cells and MTPs
2.3 MTPs的形态观察
2.3.1 电子显微镜观察
使用电子显微镜观察Fe3+染色后的酵母壁材与MTPs,如图3-a、图3-b所示。Fe3+与TP邻二羟基结合,形成络合物从而使之呈现深蓝色[24]。由图3-a与图3-b对比可明显观察到酵母细胞发生了明显的质壁分离,同时能看出在酵母细胞壁膜间隙颜色变深,即TP与Fe3+反应生成深蓝色络合物,因此可以得出TP已进入酵母细胞壁内,同时包埋过程也未明显改变酵母细胞结构。

a-酵母壁材组(×2 000);b-MTPs组(×2 000)
图3 电子显微镜观察酵母壁材和MTPs
Fig.3 EM of Pichia kudriavzevii A16 wall material and MTPs
2.3.2 透射电子显微镜观察
对未包埋TP的酵母壁材(图4-a,图4-b)和MTPs(图4-c,图4-d)进行透射电镜观察。

a-酵母壁材组(×30 000);b-酵母壁材组(×5 000);
c-MTPs组(×30 000);d-MTPs组(×5 000)
图4 透射电镜观察酵母壁材和MTPs
Fig.4 TEM of Pichia kudriavzevii A16 wall materials and MTPs
由图4-a可以看出,细胞壁与细胞膜之间界限明显,说明酵母菌经过NaCl处理后发生了质壁分离;与图4-a相比,图4-c能明显看出MTPs细胞膜与细胞壁之间的空隙减小,同时通过Nano Measurer 1.2测量了200个酵母细胞中壁膜间隙的大小以及SPSS软件统计学分析得出,包埋前后间隙大小分别为(0.17± 0.03)、(0.11± 0.03)μm,说明TP主要被包埋在酵母菌细胞壁和细胞膜之间,与红外图谱结果相一致。由图4-c和图4-d可以看出,包埋TP后并没有明显改变酵母菌的结构,酵母菌起到了封装TP的载体作用。
2.4 胃肠液模拟释放
MTPs在体外模拟条件下的释放曲线见图5。由图可知,在最初的1 h内,在胃液中释放的比较快,在3 h趋于稳定,这也符合人体胃液消化的基本规律。在肠液中0~6 h TP的释放率一直呈上升趋势,并且在模拟肠液中的释放率要高于在胃液中的释放率。肠液pH值环境和酶的作用会改变MTPs结构,使TP更容易释放。TAMIZHARASI等[25]也有相似的研究结果。6 h后释放量相对平缓,释放率最高能达到47.11%。累计在胃液与肠液中的释放率能达到78.12%。

图5 MTPs在模拟胃肠液中的释放
Fig.5 Release of MTPs in simulated gastric
and intestinal fluids
2.5 MTPs的贮藏稳定性
2.5.1 光照对MTPs稳定性的影响
图6表明了光照条件对MTPs贮藏稳定性的影响。
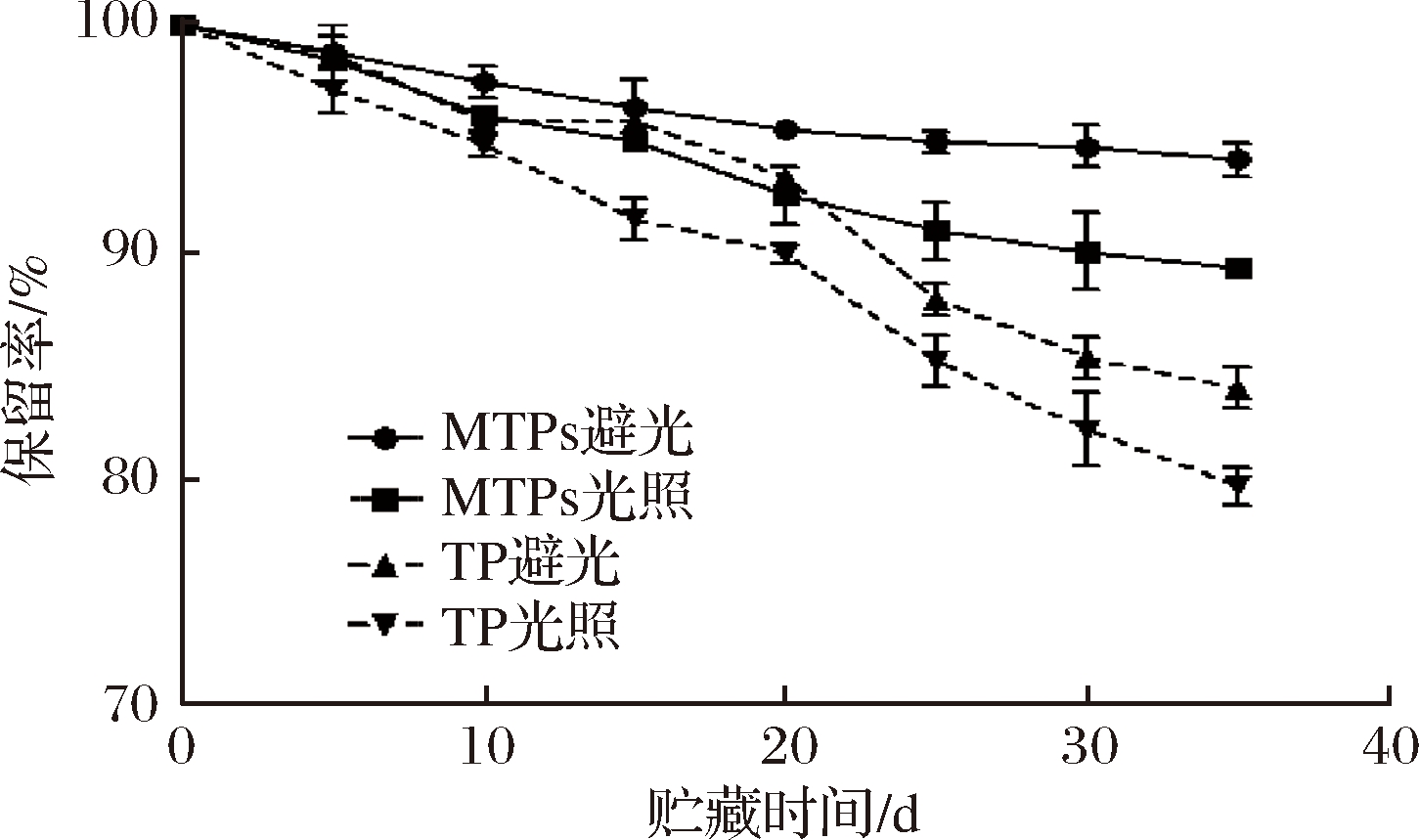
图6 光照条件下TP及MTPs的保留率
Fig.6 Retention rate of TP and MTPs under
light or dark conditions
从图6中可以看出,避光储存条件能明显提高TP以及MTPs的稳定性。同时酵母细胞一定程度上保护了TP不受光照的影响,在有光照条件下,贮藏35 d后,TP的保留率仅为79.33%,而MTPs的保留率为90.15%,这说明MTPs在一定程度上能保护TP,降低光照对TP的降解作用。曹龙奎等[26]也研究过微胶囊化玉米黄色素具有一定的光保护作用,明显提高玉米黄色素的保留率。
2.5.2 相对湿度对MTPs稳定性的影响
相对湿度对MTPs稳定性的影响如图7所示。在35 d后,MTPs在不同湿度下的保留率仍均在90%左右,明显高于相同质量的TP的保留率,说明MTPs壁材料能在一定程度上保护TP减少其损失。且随着相对湿度越大,TP以及MTPs的保留率都会随之降低,35 d左右,MTPs在RH=(32.78±0.16)%下的保留率最高,能达到91.47%,相对于相同条件下的TP的保留率提高了约(13.40±0.89)%。王华[27]在研究VA微胶囊的贮存稳定性时表明,在低RH条件下稳定性比较好。因此适当降低湿度,保持干燥环境可以一定程度上保护TP,提高其保留率。
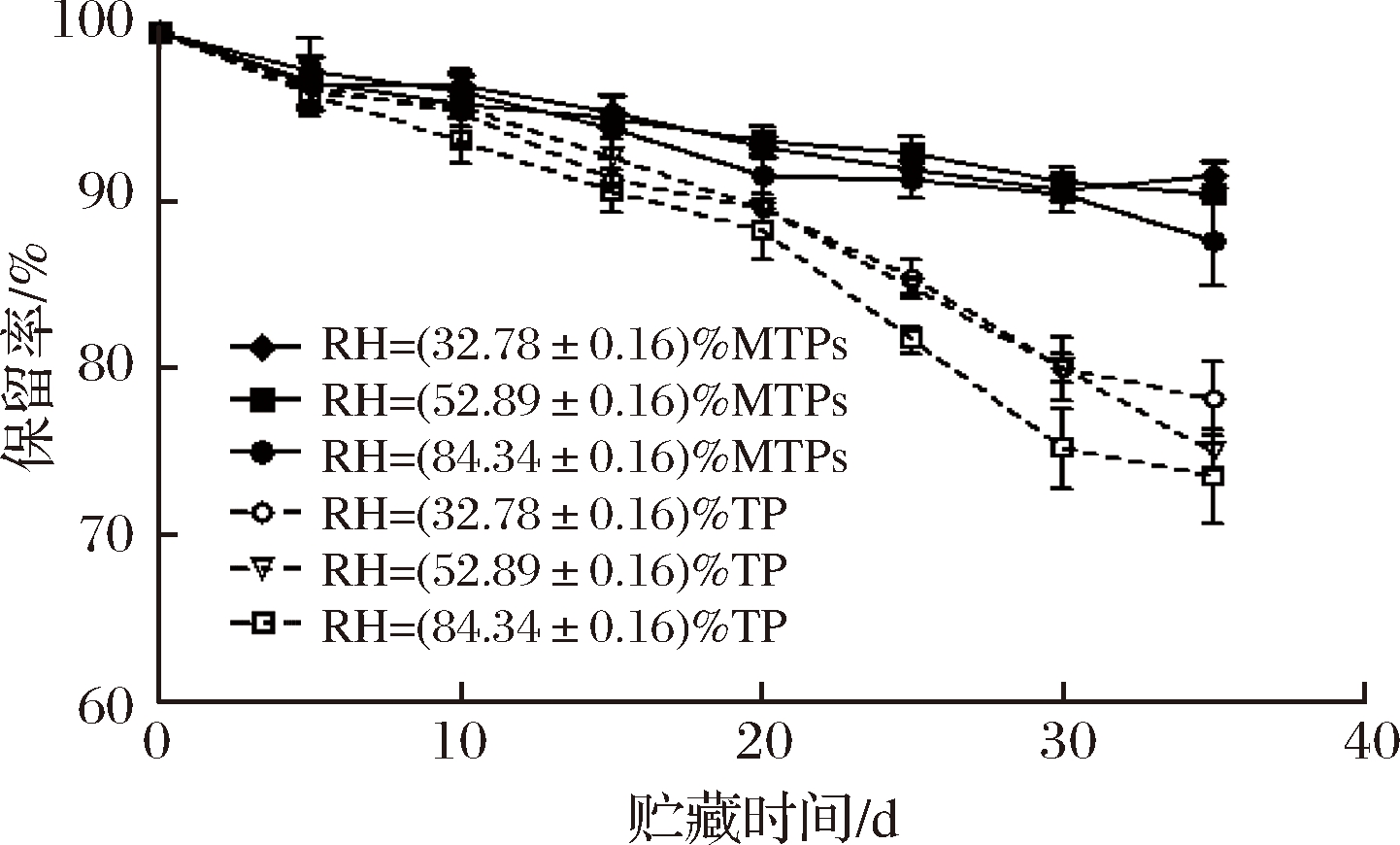
图7 不同相对湿度下TP及MTPs的保留率
Fig.7 Retention rate of TP and MTPs under different RH
3 结论
库德毕赤酵母(Pichia kudriavzevii A16)作为壁材,能有效地包埋TP,起到了封装TP的载体作用,在最优条件下即壁芯比例9 ∶1,包埋时间为4 h,以及包埋温度28℃,MTPs的包埋率为(68.12±0.35)%。MTPs能有效地减缓光照和湿度对TP的不利影响。胃肠液模拟消化实验表明MTPs总释放率高于文献报道的释放率。本文探究了库德毕赤酵母Pichia kudriavzevii A16作为新型微胶囊壁材包埋水溶性TP的可行性,为酵母的多重利用提供理论依据,同时也为解决生产中TP等环境敏感性成分的稳定性问题提供了重要参考。
[1] DAVIDOV-PARDO G, MCCLEMENTS D J. Nutraceutical delivery systems: Resveratrol encapsulation in grape seed oil nanoemulsions formed by spontaneous emulsification [J]. Food Chemistry, 2015, 167: 205-212.
[2] 王芳,田建文.微胶囊技术在食品抗氧化剂中的应用研究进展[J].食品与机械,2010,26(4):149-152.
[3] GIBBS F, SELIM K, INTEA Z, et al. Encapsulation in the food industry: A review [J]. International Journal of Food Sciences & Nutrition, 1999, 50(3): 213-224.
[4] PARAMERA E I, KONTELES S J, KARATHANOS V T. Microencapsulation of curcumin in cells of Saccharomyces cerevisiae [J]. Food Chemistry, 2011, 125(3):892-902.
[5] DE NOBEL J G, KLIS F M, PRIEM J, et al. The glucanase - soluble mannoproteins limit cell wall porosity in Saccharomyces cerevisiae [J]. Yeast, 1990, 6(6): 491-499.
[6] SHI G, RAO L, YU H, et al. Yeast-cell-based microencapsulation of chlorogenic acid as a water-soluble antioxidant[J]. Journal of Food Engineering, 2007, 80(4): 1 060-1 067.
[7] KAVOSI M, MOHAMMADI A, SHOJAEE-ALIABADI S, et al. Characterization and oxidative stability of purslane seed oil microencapsulated in yeast cells biocapsules[J]. Journal of the Science of Food & Agriculture, 2017, 98(7):2 490-2 497.
[8] BAIK M Y, SUHENDRO E L, NAWAR W W, et al. Effects of antioxidants and humidity on the oxidative stability of microencapsulated fish oil[J]. Journal of the American Oil Chemists Society, 2004, 81(4): 355-360.
[9] 贾之慎, 杨贤强. 茶多酚抗氧化作用的研究与应用[J]. 食品科学, 1990, 11(11): 1-5.
[10] 廖春丽, 周亚巍,周凯,等. 茶多酚及其金属离子对肉源腐败菌和致病菌抑制效果的研究[J]. 食品科技, 2015, 40(1):292-296.
[11] SA NZ C, TAPIA S, CH
NZ C, TAPIA S, CH VEZ J, et al. Microencapsulation by spray drying of bioactive compounds from cactus pear (Opuntia ficus-indica)[J]. Food Chemistry, 2009, 114(2): 616-622.
VEZ J, et al. Microencapsulation by spray drying of bioactive compounds from cactus pear (Opuntia ficus-indica)[J]. Food Chemistry, 2009, 114(2): 616-622.
[12] ELGOGARY A, XU Q, POORE B, et al. Combination therapy with BPTES nanoparticles and metformin targets the metabolic heterogeneity of pancreatic cancer[J]. Proc Natl Acad Sci U S A, 2016, 113(36): E5 328- E5 336.
[13] LUO W, XIAO G, TIAN F, et al. Engineering robust metal-phenolic network membranes for uranium extraction from seawater[J]. Energy & Environmental Science, 2019.DOI:10.1039/C8EE01438H.
[14] GÜLSEREN  , GURI A, CORREDIG M. Encapsulation of tea polyphenols in nanoliposomes prepared with milk phospholipids and their effect on the viability of HT-29 human carcinoma cells[J]. Food Digestion, 2012, 3(1-3): 36-45.
, GURI A, CORREDIG M. Encapsulation of tea polyphenols in nanoliposomes prepared with milk phospholipids and their effect on the viability of HT-29 human carcinoma cells[J]. Food Digestion, 2012, 3(1-3): 36-45.
[15] WANG J, LI H, CHEN Z, et al. Characterization and storage properties of a new microencapsulation of tea polyphenols[J]. Industrial Crops and Products, 2016, 89: 152-156.
[16] GB 31740.2—2015, 茶制品第2部分:茶多酚[S]. 北京:中国标准出版社, 2015.
[17] FALLER A L, FIALHO E, LIU R H. Cellular antioxidant activity of feijoada whole meal coupled with an in vitro digestion.[J]. J Agric Food Chem, 2012, 60(19): 4 826-4 832.
[18] HSIEH C W, LU W C, HSIEH W C, et al. Improvement of the stability of nattokinase using γ-polyglutamic acid as a coating material for microencapsulation[J]. LWT - Food Science and Technology, 2009, 42(1): 144-149.
[19] 廖霞, 杨小兰,李瑶,等. 槲皮素微胶囊的贮藏稳定性及抗氧化活性[J]. 食品科学, 2017, 38(1):60-66.
[20] 殷佳雅, 冯瑛,杨晓萍. 酵母微胶囊包埋茶多酚工艺研究[J]. 食品工业, 2017, 38(11):117-121.
[21] MEKOUE N J, SIECZKOWSKI N, ROI S, et al. Sorption of grape proanthocyanidins and wine polyphenols by yeasts, inactivated yeasts, and yeast cell walls[J]. Journal of Agricultural & Food Chemistry, 2015, 63(2): 660-670.
[22] ASANO K, SHINAGAWA K, HASHIMOTO N. Characterization of haze-forming proteins of beer and their roles in chill haze formation[J]. Journal of the American Society of Brewing Chemists, 1982, 26: 45-48.
[23] 卢琪, 曹少谦,吕思伊,等. 绿原酸酵母细胞微胶囊工艺研究[J]. 食品科学, 2010, 31(10):137-141.
[24] HYNES M J, COINCEANAINN M O. The kinetics and mechanisms of the reaction of iron(Ⅲ) with gallic acid, gallic acid methyl ester and catechin[J]. Journal of Inorganic Biochemistry, 2001, 85(2-3): 131-142.
[25] TAMIZHARASI S, RATHI J C, RATHI V. Formulation, and evaluation of pentoxifylline-loaded poly(ε-caprolactone) microspheres[J]. Indian Journal of Pharmaceutical Sciences, 2008, 70(3): 333.
[26] 曹龙奎, 李丽. 玉米黄色素的微胶囊化和稳定性研究[J]. 中国粮油学报, 2009, 24(7): 45-49.
[27] 王华. 维生素A微胶囊制备与性能的研究[D]. 合肥:合肥工业大学, 2007.