猪肝作为屠宰猪的一种主要副产物,肝脏中的蛋白质含量丰富,价格低廉,且氨基酸组成接近人体所需,是优质的完全蛋白,研究肝脏蛋白可以为食品工业的生产及应用增添新的蛋白资源[1]。然而,由于猪肝有独特腥味、味苦、切片性不好且容易褐变等缺点,致其应用范围受到极大限制,大部分还是传统意义上的烹饪食用,工业应用率较低。有研究证明猪肝中水溶性蛋白占猪肝蛋白总量的78.6%,可利用价值很高[2]。与大豆蛋白、乳清蛋白等相比,目前国内外针对猪肝蛋白乳化特性影响的文献报道还相对较少,因此这方面的研究还需要进一步深化,提高猪肝蛋白的商业利用率和开发潜力。
热处理是食品加工中应用最广泛的一种方式,对改善食物的品质、杀灭病菌和保证食品的品质安全等各方面均起着重要的作用。同时,加热处理也是一种经常用到的蛋白质改性手段。加热破坏了蛋白质的折叠结构,其内部疏水基团充分暴露,致使其性质随之产生了变化。其中,蛋白的乳化特性受温度影响较大,不同热处理温度对蛋白乳化性质的影响程度差异较大。PENG等[3]研究了热处理对豌豆蛋白乳化性能的影响,结果表明,豌豆蛋白在95 ℃加热30 min后形成的乳化液中蛋白质吸附百分比和乳化稳定性高于未加热的对照组。CORREDIG等[4]在研究用大豆蛋白稳定的水包油体系的热诱导变化时,用经过75和95 ℃热处理后的大豆蛋白制成的乳化液的油滴粒径比未经热处理的蛋白小,但大豆蛋白聚集程度增加。易建华等[5]通过研究影响乳清分离蛋白乳化性的因素发现,温度对其改变较大,且pH不同时,乳化稳定性差异较大。
本课题以猪肝水溶性蛋白为研究对象,经过25、40、50、60、70、80 ℃加热处理,通过测定蛋白与大豆油形成的乳化体系的乳化活性和稳定性、乳析指数、界面蛋白浓度等指标来研究乳化性质的变化,为猪肝蛋白在乳化食品领域中的应用提供参考依据。
1 材料与方法
1.1 材料与试剂
猪肝(猪屠宰后约3 h购于重庆市北碚区天生菜市场),清洗去血后去除多余脂肪和结缔组织,切成小块,绞碎为猪肝泥,放置于烧杯中,保鲜膜封口后冷藏于4 ℃冰箱备用。
1.2 仪器与设备
PHS-4C+酸度计,成都世纪方舟科技有限公司;XHF-D内切式匀浆机,宁波新芝生物科技股份有限公司; Avanti J-30I贝克曼冷冻离心机,美国贝克曼库尔特公司;ZEN3690马尔文激光粒度分析仪,英国马尔文仪器公司;FD-1-50真空冷冻干燥机,北京博医康实验仪器有限公司;L8900氨基酸分析仪,日本日立公司;Power Pac Basic小型垂直电泳仪,美国Bio-Rad公司;DXR2拉曼光谱仪,美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 水溶性猪肝蛋白的提取
参考STEEN等[2]的方法并稍作修改。称量一定量的猪肝泥添加到4倍体积0.05 mol/L,pH 7.4的磷酸缓冲溶液A液中,在转速为10 000 r/min下持续匀浆30 s,重复2次以使蛋白充分溶解;将匀浆物在9 327×g,4 ℃前提下离心30 min,取上层清液,向沉淀中继续加入磷酸缓冲溶液A液,重复以上步骤3次,将所得的上清液混合,用透析袋透析脱盐,冷冻干燥即为水溶性猪肝蛋白粉。
1.3.2 实验设计
分别称取一定量的水溶性猪肝蛋白粉,溶解在磷酸缓冲溶液A液中,配制成质量浓度为2.5 g/L的猪肝蛋白溶液,把试验样品分别在常温(25 ℃)、40、50、60、70、80 ℃环境下加热 30 min,探究不同温度对猪肝水溶性蛋白乳化特性的作用。
1.3.3 猪肝水溶性蛋白粉基本成分的测定
水分的测定:直接干燥法(GB 5009.3—2010);粗脂肪的测定:索氏提取法(GBT 5009.6—2003);粗蛋白的测定:凯氏定氮法(GB 5009.5—2010);灰分测定:高温灰化法(GB 5009.4—2010)。
1.3.4 猪肝水溶性蛋白粉氨基酸组成分析
参照GB/T 5009.124—2003。
1.3.5 猪肝水溶性蛋白粉蛋白浓度的测定
采用双缩脲法[6]进行测定。
1.3.6 乳化性和乳化稳定性的测定
参考张聪聪[1]的方法并稍作修改。称取一定质量的猪肝水溶性蛋白添加至4 ℃磷酸缓冲溶液A液内,转速2 800 r/min匀浆30 s促使蛋白溶解充分,匀浆过程中尽量减少气泡的产出,得到1.3.2中描述的蛋白溶液。于25 mL塑料离心管中添加6.0 mL制得溶液和2.0 mL大豆油,转速10 000 r/min匀浆30 s,立刻于距离离心管底0.5 cm位置取50 μL蛋白乳化液添加到5 mL 0.1% SDS溶液中,振荡混合均匀后静置10 min,用紫外分光光度计在500 nm处测定其吸光值记作A0。乳化匀浆液静置10 min后,按照上述同样方法测定其吸光值记作A10,用0.1% SDS溶液为空白对照。猪肝水溶性蛋白乳化活性EAI和乳化稳定性ESI的计算公式(1)、(2)如下:
乳化活性指数![]() 稀释倍数
稀释倍数
(1)
乳化稳定性![]()
(2)
式中:φ为油相体积分数,%;ρ为蛋白质质量浓度,g/mL;A0、A10分别为乳浊液在0、10 min时的吸光值;稀释倍数为101。
1.3.7 乳析指数的测定
参考SOLEIMANPOUR等[7]的方法并略作修改。制备新鲜乳液后,立刻移至透明试管(10 mL附有刻度)中,用保鲜膜将其密封,于4 ℃温度下贮存。猪肝水溶性蛋白乳液静置后分成上下两部分,上层乳白色部分为油脂层,下层为清液层。记录14 d分层情况,乳液分层指数(creaming index,CI,%)的计算如式(3):
(3)
式中:HS为上清液高度; HE为乳液体系的总高度。
1.3.8 表面疏水性的测定
参照CHIN等[8]的方法测定。称量一定质量的猪肝水溶性蛋白粉添加至磷酸缓冲溶液A液内,转速2 800 r/min匀浆30 s,分散过程中尽量减少气泡产出,得到1.3.2中描述的蛋白溶液。取1 mL样液于2.5 mL离心管中,加入200 μL 1 mg/mL溴酚蓝,在常温下振荡均匀,8 000 r/min离心10 min,将所得上层清液用蒸馏水稀释10倍后在595 nm处测定吸光值A,用磷酸盐缓冲液替代样液做空白。猪肝水溶性蛋白表面疏水性计算如式(4):
溴酚蓝![]()
(4)
式中:A对照为空白对照组的吸光度值;A样品为不同温度处理的样品。
1.3.9 蛋白粒径分析
参照崔珊珊[9]的方法测定猪肝水溶性蛋白乳化液颗粒粒度分布。从新鲜乳化液试管底部取200 μL添加至 5 mL 10 g/L SDS溶液中,混合摇匀,用马尔文激光粒度分析仪检测猪肝水溶性蛋白乳化液乳化颗粒粒度分布情况。用体积等效平均粒径(D4,3)表示乳化颗粒粒径分布。参数设定为:激光衍射波长λ=633 nm,傅里叶构象焦距为45 mm;进样器为Hydro 2000MU(A);颗粒折射率为1.520,颗粒吸收率为0.1; 水为分散剂,折射率为1.330,噪音为30 s;背景测试持续时间为15 s;搅拌速度为2 000 r/min。
1.3.10 蛋白吸附量的测定
参考PALAZOLO等[10]的测定方法并稍作改动。配制好新鲜猪肝水溶性蛋白乳液后立刻移至50 mL离心管中,在25 ℃条件下10 000×g离心30 min。利用注射器把下层清液取出,测定其蛋白浓度。乳液蛋白吸附量计算如式(5):
(5)
式中:Cinitial为猪肝水溶性蛋白溶液的浓度;Caq为乳液离心后清液中的蛋白浓度;C0 为猪肝水溶性蛋白溶液经相同条件离心后(10 000×g,30 min)上清液中的蛋白浓度,每个样品重复测定3次。
1.3.11 SDS-PAGE凝胶电泳
参考白登荣[11]的方法并加以修改。取1.3.10中离心分离出的蛋白质溶液进行电泳样品的制备。分离胶浓度为10%,浓缩胶浓度为5%,样品进入分离胶之前电流为15 mA,进入分离胶之后改为25 mA。
1.3.12 微观结构测定
先将猪肝水溶性蛋白-大豆油乳化体系均质,再从底部取10 μL乳液滴在干净载玻片上,确保没有气泡产生,用盖玻片盖紧后,放置于光学显微镜下,在10倍目镜、40倍物镜的条件下,观察并拍照。
1.3.13 拉曼光谱测定
分别从不同处理条件下制得的乳化体系底部取20 μL乳液,滴在载玻片上,样品的拉曼光谱(600~1 800 cm-1)测试在DXR2型显微成像光谱仪上进行,所使用功率大约为15 mW,由CCD进行信号接收和光电转换,用50倍长焦距镜头将激光聚焦到放于洁净载玻片的样品上。根据SHAO等[12]的方法设定光谱条件为:激发波长785 nm,狭缝宽50 μm,400 g/mm、3次扫描、积分时间30 s、分辨率2 cm-1。每个样品测定3次。用ALIX等[13]的方法计算蛋白质不同二级结构(α-螺旋、β-折叠、β-转角和无规则卷曲)含量。
1.3.14 数据处理
实验设计为每个样品3个重复。用Excel 2016进行数据处理;用Origin软件进行作图;用SPSS Statistics 17.0进行显著性分析,P<0.05表示结果具有显著差异。
2 结果与分析
2.1 猪肝水溶性蛋白粉的基本成分
新鲜猪肝用水溶性提取法得到的猪肝蛋白粉是多种成分的混合物,以蛋白成分为主,含量为85.15%;其次是灰分,含量为7.69%;水分约为4.82%; 脂肪约为1.45%。其蛋白含量明显高于大豆35%[14]、牛肉的16.17%[15]、牛乳的4.66%和羊乳的3.73%[16],可作为优质蛋白源,且价格低廉,潜在的经济价值很高。
2.2 猪肝水溶性蛋白粉的氨基酸构成分析
氨基酸含量及组成是评价蛋白质营养价值的重要指标,表1表明猪肝水溶性蛋白内含包括8种必需氨基酸在内的17种氨基酸。其中,Glu含量最高,其次是Pro、Leu和Lys。Glu是一种重要的风味氨基酸,在食品领域常用作鲜味剂、代盐剂、营养增补剂等,也是人体中枢神经系统含量最多的兴奋性神经递质之一,在中枢神经系统中起着关键的作用[17]。Lys是一种人体健康所必需的氨基酸,对促进智力发育、身体正常生长和改善营养不良状况等非常重要。支链氨基酸包括Val、Ile和Leu,是一种高效的营养补充剂,可以减少大脑5-羟色胺的产生来缓解人体疲倦感,还具有非常好的抗分解作用。按照WHO/FAO的标准模式,理想蛋白源的必需氨基酸含量约占蛋白所有氨基酸含量的40%,必需氨基酸与非必需氨基酸比例为3∶5[18]。由表1可知,猪肝水溶性蛋白的氨基酸构成满足上述条件,因此猪肝蛋白属于优质蛋白源。
表1 猪肝水溶性蛋白粉氨基酸构成分析 单位:g/100g
Table 1 The amino acid composition of the pork liver
water-soluble protein fractions
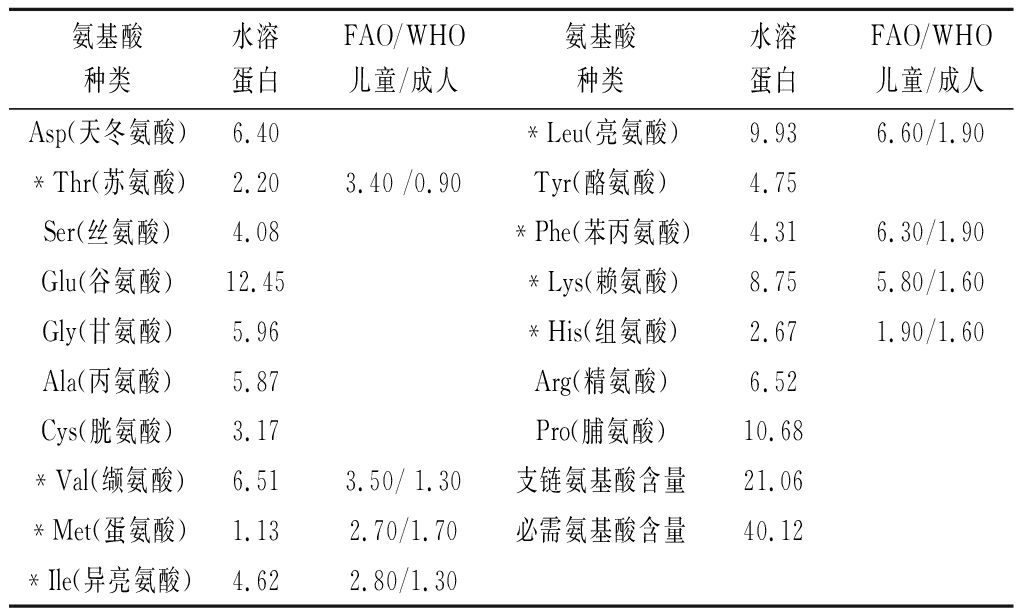
氨基酸种类水溶蛋白FAO/WHO儿童/成人氨基酸种类水溶蛋白FAO/WHO儿童/成人Asp(天冬氨酸)6.40*Leu(亮氨酸)9.936.60/1.90*Thr(苏氨酸)2.203.40 /0.90Tyr(酪氨酸)4.75Ser(丝氨酸)4.08*Phe(苯丙氨酸)4.316.30/1.90Glu(谷氨酸)12.45*Lys(赖氨酸)8.755.80/1.60Gly(甘氨酸)5.96*His(组氨酸)2.671.90/1.60Ala(丙氨酸)5.87Arg(精氨酸)6.52Cys(胱氨酸)3.17Pro(脯氨酸)10.68*Val(缬氨酸)6.513.50/ 1.30支链氨基酸含量21.06*Met(蛋氨酸)1.132.70/1.70必需氨基酸含量40.12*Ile(异亮氨酸)4.622.80/1.30
注:*表示必需氨基酸,支链氨基酸包括缬氨酸、异亮氨酸和亮氨酸3种氨基酸。
2.3 热处理温度对猪肝水溶性蛋白乳化性的影响
蛋白质是一种具有表面活性的化学物质,兼有亲水性和疏水性。乳化性是蛋白其中一项重要功能性质,是指水和油脂形成乳状液的能力,可以反映蛋白质-蛋白质、蛋白质-脂肪彼此之间的交联能力。乳化活性和乳化稳定性是评价蛋白乳化性质最常用的两项指标。乳化活性定义为蛋白质在加速油水混合过程中,稳定油水界面的能力,即指单位质量的蛋白质可以稳定的油水界面的面积。乳化稳定性指的是蛋白维持油水混合后不相互分离的乳化特性抗,外界条件干扰的应变能力。
不同热处理温度对猪肝水溶性蛋白乳化活性和乳化稳定性的影响如图1所示。随着热处理温度的增高,猪肝水溶性蛋白的乳化活性和乳化稳定性变化保持一致,都表现出共增加后减小的态势。在60 ℃时,EAI值和ESI值均最大,分别为40.42 m2/g和52.36%。刘禹[19]在研究桑葚籽的蛋白乳化特性时发现,蛋白的乳化活性随温度的升高先增大后减小,在60 ℃取得最高值。刘慧清[20]得出,热处理后的罗非鱼分离蛋白在50~60 ℃乳化稳定性较好,液滴颗粒较小,没有明显絮凝现象。这与本研究结论一致。可能是因为适当加热处理后,猪肝水溶性蛋白内部复杂结构舒展开,疏水性基团充分暴露在蛋白分子外面,与油滴接触面积增多,更有利于蛋白在油水界面的吸附,从而增大了乳化稳定性。当温度大于60 ℃时,热运动更加剧烈,蛋白结构被破坏,甚至蛋白因此严重变性,溶解度和疏水性发生变化,絮凝和聚集加剧,乳化活性和稳定性下降。
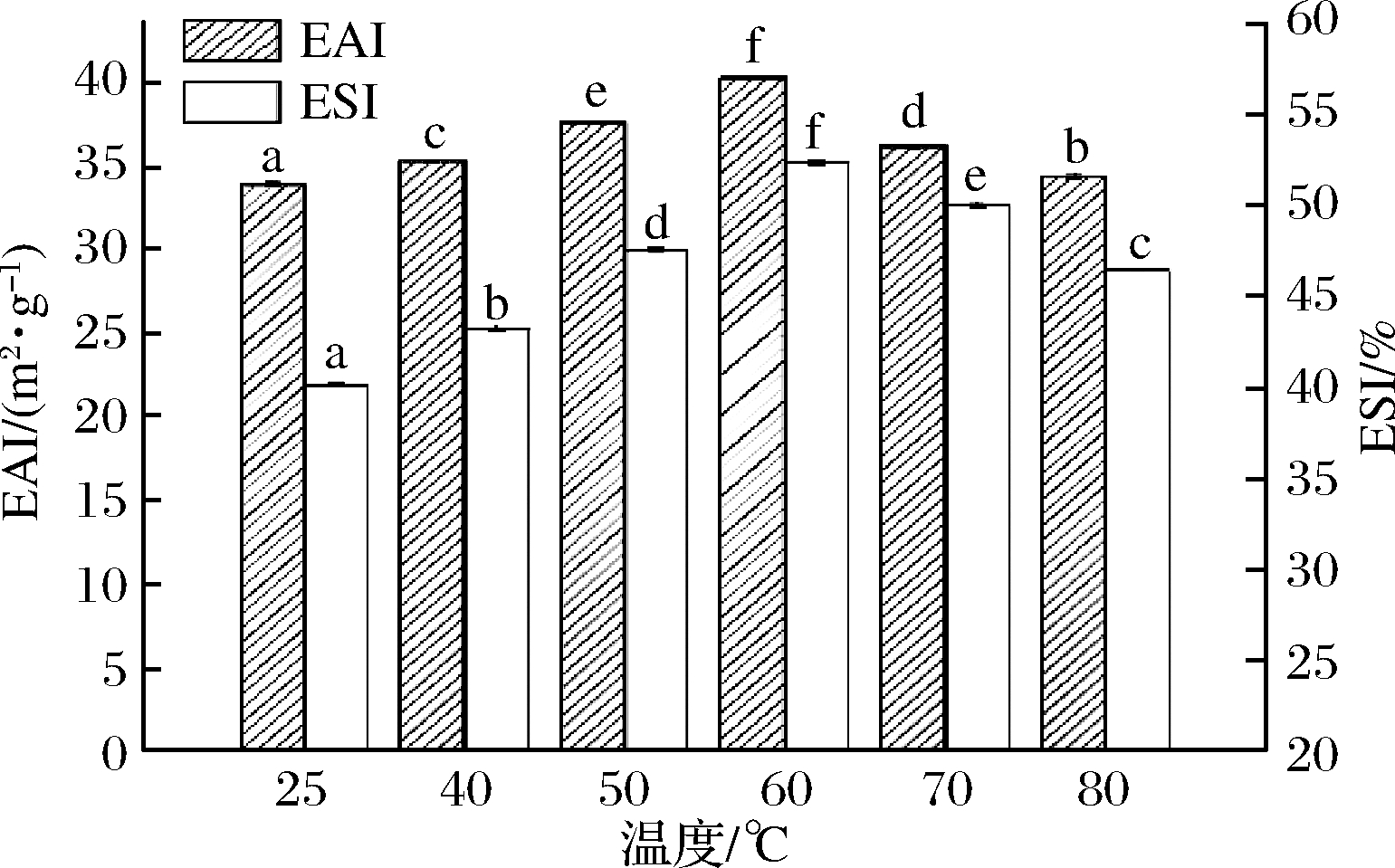
图1 热处理温度对猪肝水溶性蛋白乳化性的影响
Fig.1 Effects of temperature on emulsifying of
pork liver water-soluble protein
注:图中不同小写字母表示差异显著。下同。
2.4 热处理温度对猪肝水溶性蛋白乳化液乳析指数的影响
乳析指数是评价乳化液稳定性的重要参数之一。在4 ℃冰箱中将不同加热条件下配制好的猪肝水溶性蛋白乳化液放置储藏14 d,乳化液滴在放置过程中会发生上浮、聚结、絮凝等而导致发生不同程度的分层现象,包括上层乳化层和下层清液层。
不同的热处理对猪肝水溶性蛋白乳化液乳析指数的作用如图2所示。伴随储藏时间延长,不同加热温度处理得到的蛋白乳化液乳析指数均不断提高。储藏1 d后,乳化液已经发生明显分层,体系脱稳,乳析指数均超过50%,且在30~70 ℃,随着温度升高,同一储藏天数的乳析指数逐渐减小,证明蛋白经适当热处理可以促进乳化液的稳定性。可能是因为热处理后的猪肝水溶性蛋白黏度值增加,乳液液滴在油滴表面结合更加紧密,空间结构更加牢固,相对活动速度减缓,一定程度上抑制了分层现象。蛋黄热变性后的乳化性质研究结果[21]与彭伟伟[22]研究的热处理对豌豆蛋白乳化液分层稳定性研究结论支持了这一推断。蛋白在80 ℃热处理后制得的乳液放置3 d后乳析指数迅速增加,最终分层指数明显大于其他组,可能是由于温度过高使乳液黏度剧烈变化,油水分离,乳化液发生絮凝变得不稳定。
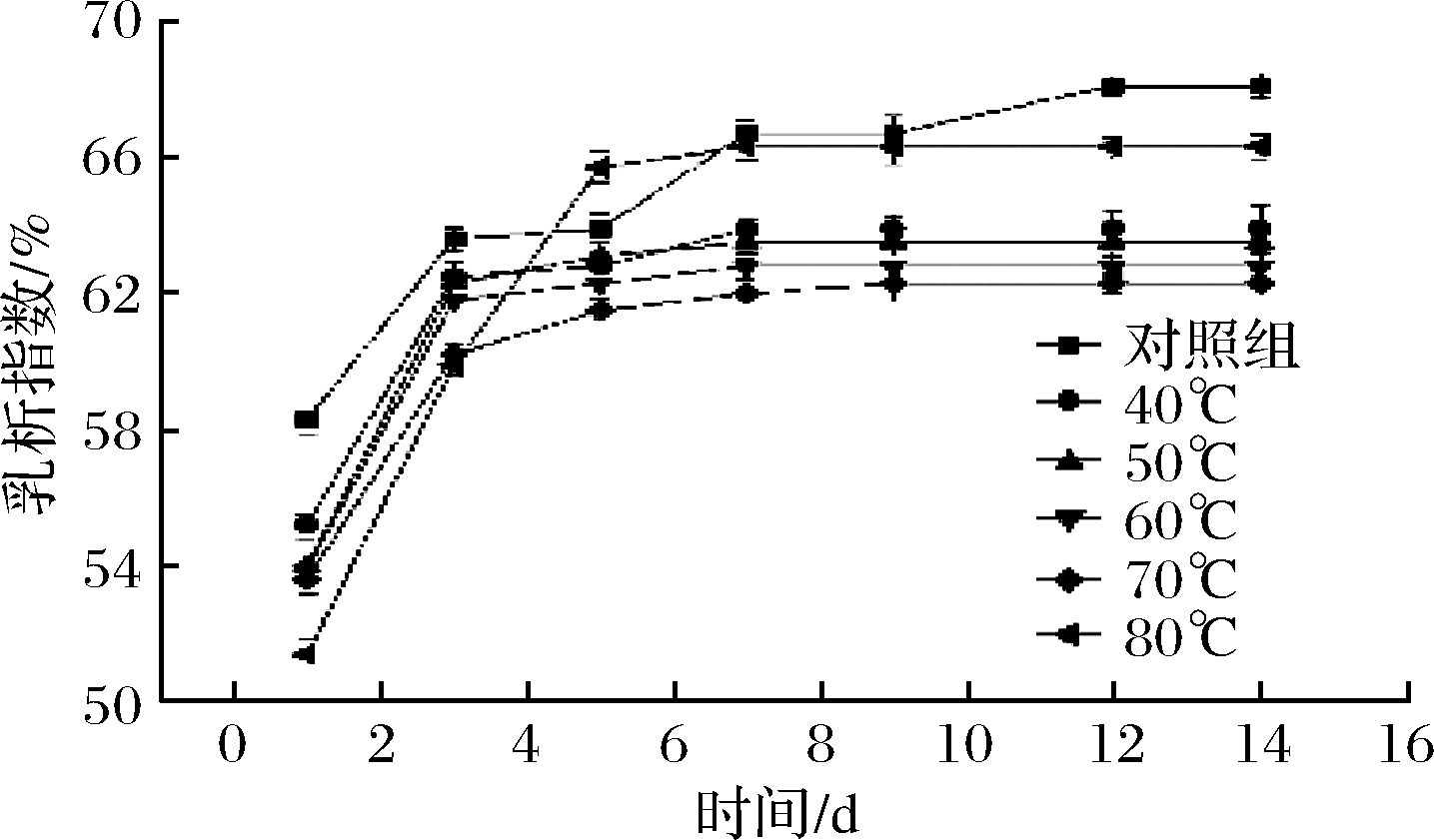
图2 热处理温度对猪肝水溶性蛋白乳化液乳析指数的影响
Fig.2 Effects of temperature on the creaming index of
pork liver water-soluble protein emulsion
2.5 热处理温度对猪肝水溶性蛋白表面疏水性的影响
表面疏水性可以间接表明蛋白质结构是否发生变化,也是评价蛋白质表面活性的重要指标,它可以反映在极性环境中蛋白质分子内部疏水性基团的暴露程度,暴露程度越大时,疏水性越强[23]。在极端环境下,蛋白质结构容易被破坏,疏水性基团暴露程度增加,蛋白质表面疏水性增加,溶解度和乳化性就会随之发生变化。
不同热处理条件对猪肝水溶性蛋白表面疏水性的影响如图3所示。随着温度增加,蛋白质表面疏水性先降低后升高,在50 ℃时取得最低值5.35 μg。在30~50 ℃,猪肝水溶性蛋白表面疏水性显著降低(P<0.05),可能是因为适当加热致使蛋白结构发生改变,猪肝水溶性蛋白的表面亲水性基团与水交互作用程度增加使其表面疏水性降低。在50~80 ℃,蛋白结构更加舒展,使蛋白分子内部的疏水基团充分暴露,猪肝水溶性蛋白的溶解度减小,表面疏水性显著增大(P<0.05),这与已报道的鳕鱼蛋白乳化性研究结论保持一致[24]。
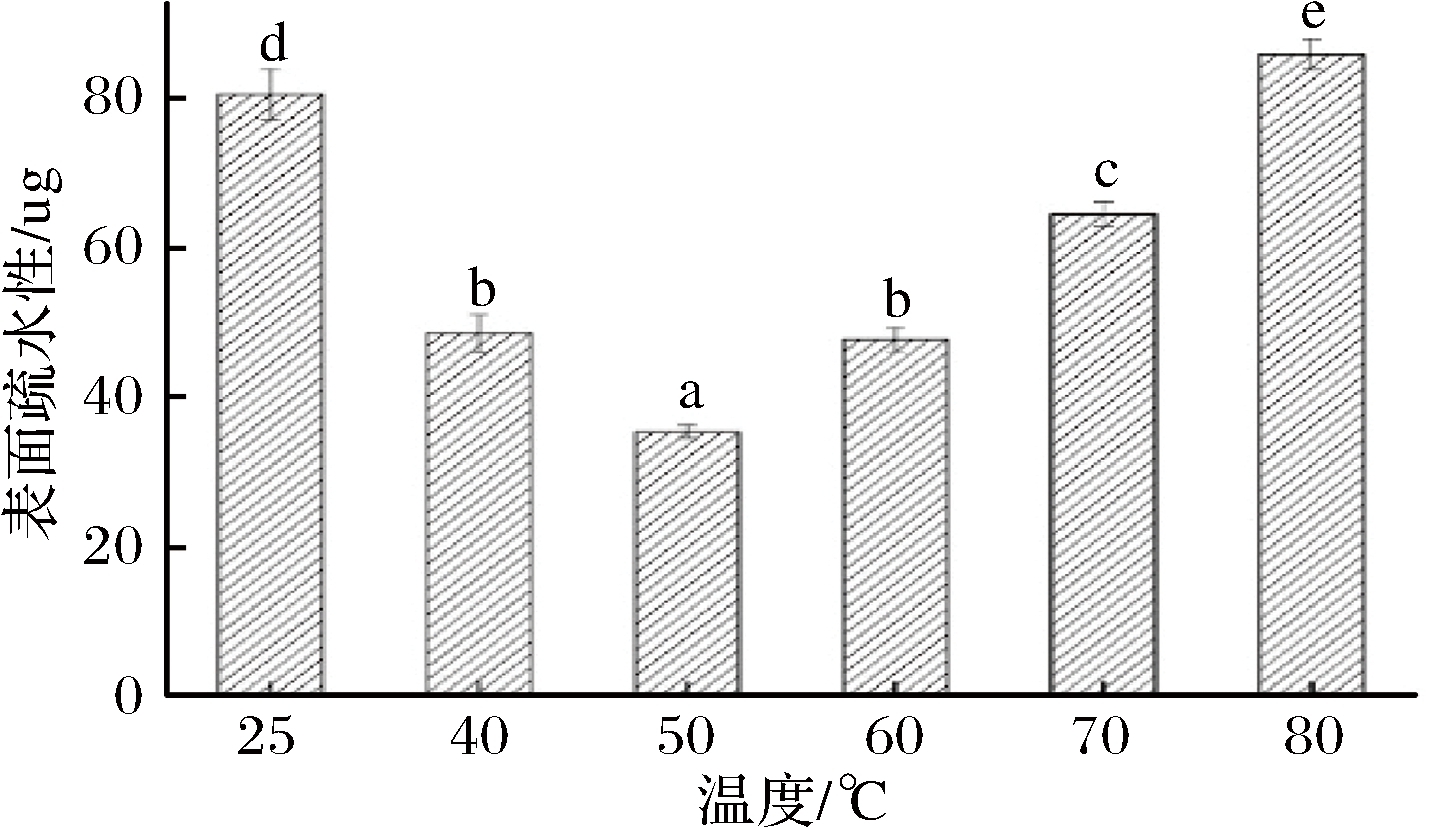
图3 热处理温度对猪肝水溶性蛋白表面疏水性的影响
Fig.3 Effects of temperature on hydrophobicity of
pork liver water-soluble protein
2.6 热处理温度对猪肝水溶性蛋白乳化液界面蛋白吸附量的影响
界面蛋白吸附量是表明乳化液稳定性的关键指标。通常,界面蛋白吸附量越多,乳化液稳定性越高[25]。温度对猪肝水溶性蛋白乳化液界面蛋白吸附量的影响如图4所示。伴随温度提升,界面蛋白吸附量先增多后减少,60 ℃达到最大值,为54.52%,此时乳化液最稳定,这和2.1得出的结论一致。可能是因为热处理降低了蛋白质的表面疏水性,使乳化颗粒相互分散开,能够让乳化液中的油滴更好地与水溶性蛋白相互作用,大量肌球蛋白或肌动蛋白会包裹在油滴表面,形成一层比较厚的蛋白膜,从而提高了界面蛋白吸附量。LI等[26]得出的热处理后的大豆蛋白制备的乳化液中的蛋白吸附量高于未经处理的大豆蛋白乳化液中的蛋白吸附量证明了这一推论。

图4 热处理温度对猪肝水溶性蛋白乳化液
界面蛋白吸附量的影响
Fig.4 Effects of temperature on the interfacial protein
content of pork liver water-soluble protein emulsion
2.7 热处理温度对猪肝水溶性蛋白乳化液界面蛋白组成的影响
不同温度加热的猪肝水溶性蛋白稳定的乳化液吸附蛋白电泳图如图5所示。通过与标准蛋白分子质量电泳图对照可知,各组样品中界面蛋白膜主要成分为肌球蛋白重链(200 kDa)、肌动蛋白(41~61 kDa)、原肌球蛋白(34~36 kDa)、肌钙蛋白(30~37 kDa),且蛋白膜组分中肌球蛋白的含量最高。从电泳条带数量和条带颜色深浅可以看出,60 ℃猪肝水溶性蛋白-大豆油乳化体系中界面蛋白吸附量与其他温度组相比有所增加,MHC和Actin条带颜色加深比较明显,与2.6 得出的伴随温度上升,界面蛋白吸附量先增多后减少,60 ℃达到最大值的结论一致。

泳道M-标准蛋白(marker);泳道1~6为温度分别为25、40、50、
60、70、80 ℃;MHC-肌球蛋白重链;Actin-肌动蛋白
图5 不同温度加热蛋白稳定的乳液中吸附蛋白电泳图
Fig.5 Electrophoretogram of adsorbed proteins in emulsions
stabilized by proteins heated at different temperature
2.8 热处理温度对猪肝水溶性蛋白乳化液颗粒粒径分布的影响
颗粒粒径是评价乳化液乳化性能的一个重要指标。不同温度处理的猪肝水溶性蛋白溶液制得的乳化液颗粒平均粒径如图6所示。
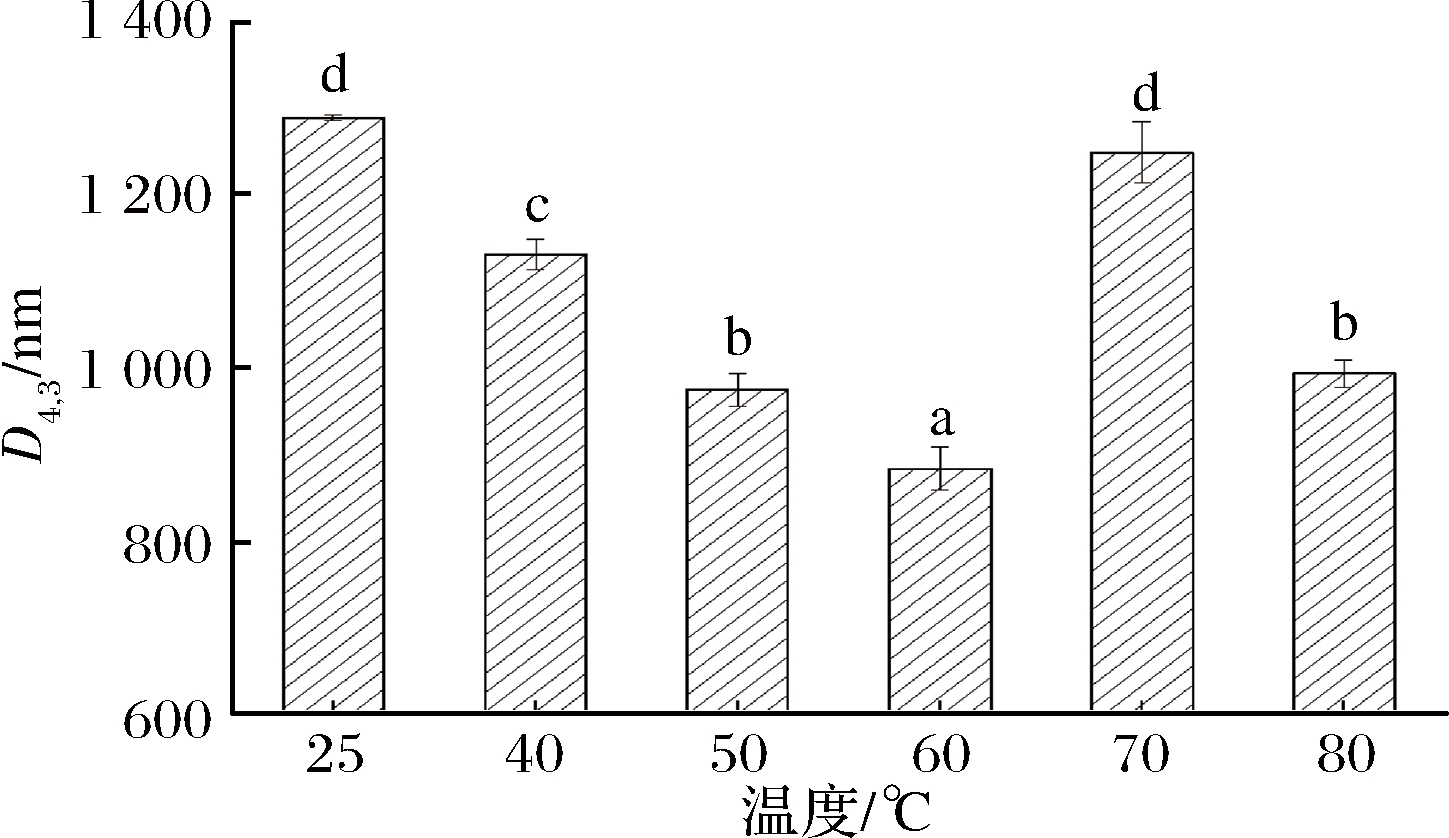
图6 热处理温度对猪肝水溶性蛋白乳化液
平均粒径的影响
Fig.6 Effects of temperature on the average particle size of
pork liver water-soluble protein emulsion
由图6可知,在25~60 ℃,乳化颗粒粒径逐渐减小且差异性显著(P<0.05),乳化体系粒径范围为0.88~1.29 μm,60~80 ℃,乳化颗粒粒径先增加后减小且差异性显著(P<0.05),乳化体系粒径范围为0.99~1.25 μm。不同加热温度处理的猪肝水溶性蛋白溶液制得的乳化液颗粒粒度分布如图7所示。
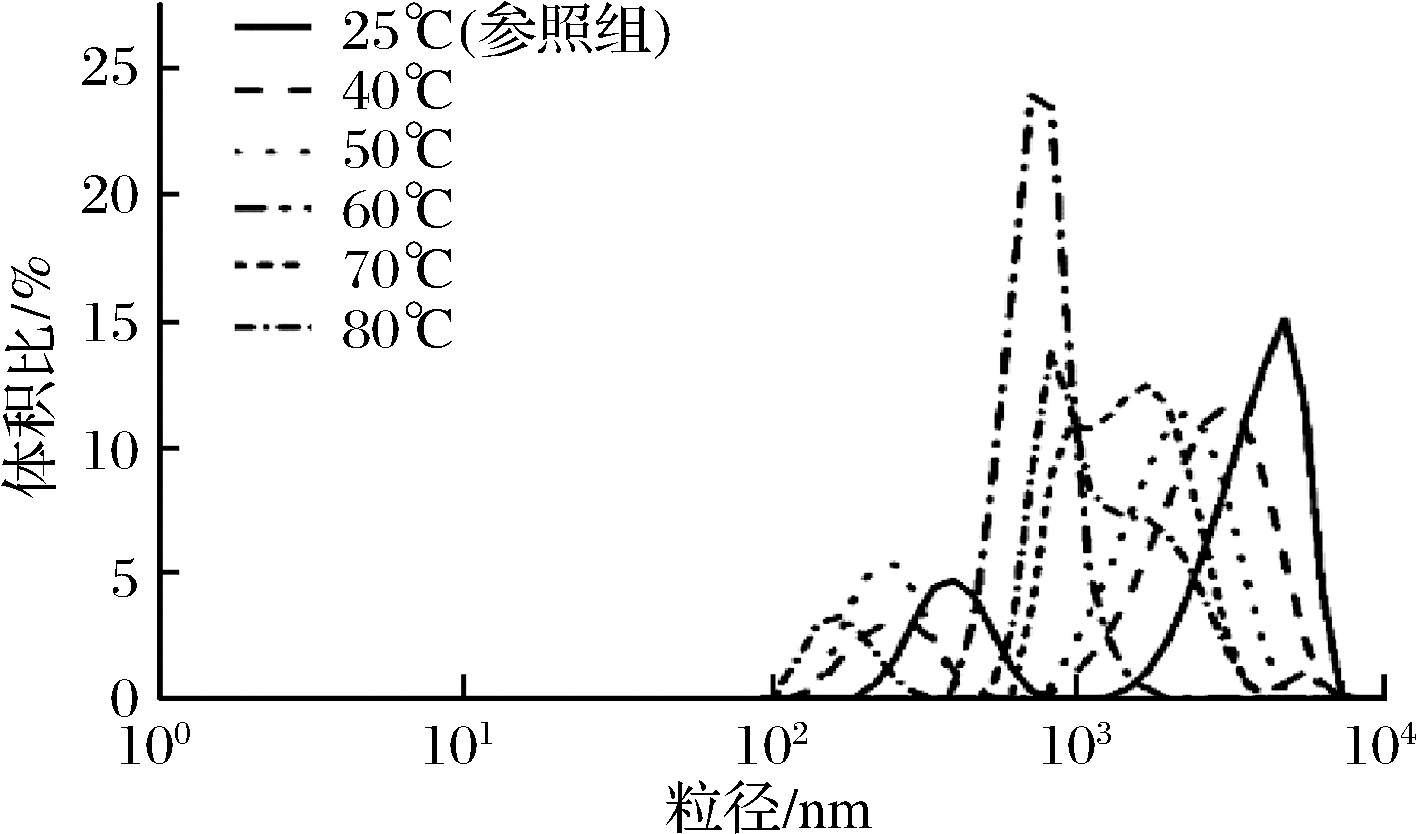
图7 热处理温度对猪肝水溶性蛋白乳化液
微粒粒度分布的影响
Fig.7 Effects of temperature on droplet size distribution of
pork liver water-soluble protein emulsion
不同温度乳液样品中微粒均呈现双峰分布,即占主导地位的主峰和从属地位的肩峰。温度为25、40、50 ℃的猪肝水溶性蛋白乳液样品粒径峰值都有向较小方向移动的趋势,但当60 ℃时,乳化体系为单峰分布,在850 nm处峰值最大为23%左右,符合图6温度为60 ℃时粒径最小的结论。70和80 ℃粒径范围大致相同,但80 ℃峰面积较小,符合图6温度80 ℃时粒径较小的结论。
一般来说,乳化液液滴颗粒粒径越小,粒径分布越均匀,证明乳液乳化稳定性越好[27]。随着温度升高(25~60 ℃),乳液粒径逐渐减小,乳液稳定性逐渐增加,与2.1结论一致。说明适当加热会使猪肝水溶性蛋白与油滴更好地结合,减小了界面张力,致使形成的液滴粒径较小。SHAO等[25]探究加热处理对大豆分离蛋白乳化液颗粒粒径影响的结果证明了这一推论。70 ℃时,乳化液粒径增加,说明乳液液滴在热处理时发生了部分聚集或絮凝现象,但80 ℃时,发生聚集或者絮凝现象的液滴数量少于70 ℃,所以粒径会变小,符合图6的变化趋势。
2.9 热处理温度对猪肝水溶性蛋白乳化液液滴微观结构的影响
光学显微镜可以直观地反映出乳化液的液滴颗粒分布情况。不同加热条件处理的猪肝水溶性蛋白稳定的乳化液液滴微观结构如图8所示。25、70和80 ℃处理的蛋白溶液制得的乳化液体系液滴颗粒较大且分布不均匀,出现明显聚集现象,40、50和60 ℃处理的样品乳化液的液滴颗粒较小且分布均匀,无明显液滴聚集现象。蛋白稳定的乳化液发生聚集或絮凝现象是乳液失稳的重要表征。由图8可知,60 ℃乳液颗粒粒径最小,颗粒大小较为均匀,证明乳化稳定性最好,符合上述结论。

图8 热处理温度对猪肝水溶性蛋白乳化体系
微观结构的影响
Fig.8 Effects of temperature on microstructure of pork
liver water-soluble protein emulsion
2.10 乳化层蛋白质构象的拉曼光谱
不同温度的猪肝水溶性蛋白制得的乳化液在600~1 800 cm-1进行拉曼光谱扫描的结果如图9所示。
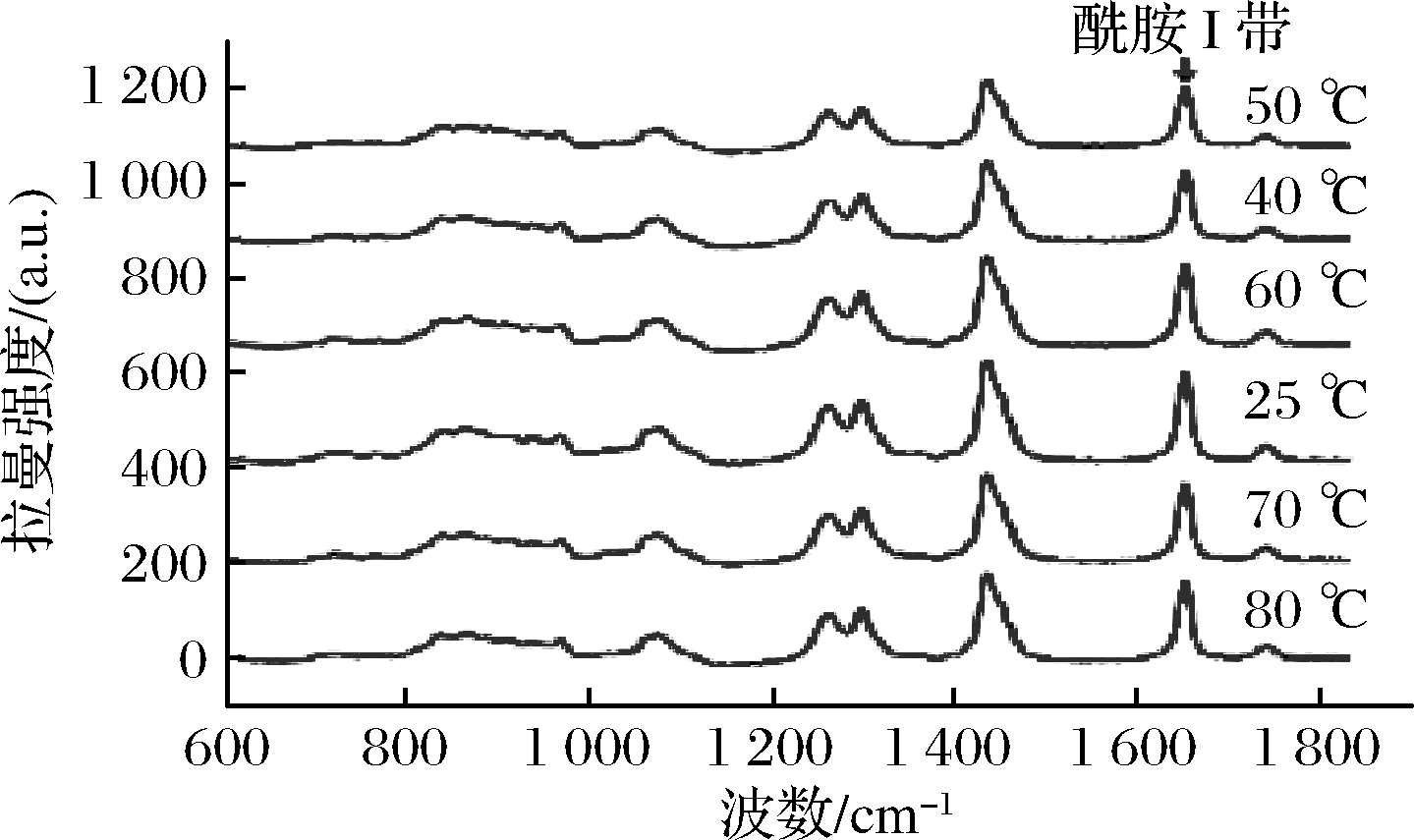
图9 温度对猪肝水溶性蛋白乳化液拉曼光谱的影响
Fig.9 Effects of temperature on raman spectroscopy of
pork liver water-soluble protein emulsion
拉曼光谱频率和密度的变化可以作为不同条件处理的蛋白乳化液二级结构和微环境变化的标志。拉曼光谱条带的指认参考文献LI等[28]、XU等[29]、HERRERO等[30-31]。
拉曼光谱的酰胺Ⅰ带((1 655±5)cm-1)对其他物质或分子的抗干扰能力极强,因此具有显著的拉曼效应,是分析鉴定蛋白质二级结构的可靠模型[32]。一般来说,拉曼图谱中α-螺旋含量最高的波长区域为1 645~1 660 cm-1,β-折叠结构的主区域为1 665~1 680 cm-1,β-转角结构主带为1 680~1 690 cm-1,无规则卷曲结构主区域为1 660~1 665 cm-1。由图9可知,当温度逐渐升高时,酰胺Ⅰ带峰值发生明显的变化,且向右发生了一些偏移,这说明经过热处理后的猪肝水溶性蛋白吸附在大豆油滴表面时涉及到二级结构含量的变化。用Alix的方法进行猪肝水溶性蛋白二级结构含量估算结果如图10所示,当温度上升时,α-螺旋含量逐渐降低,β-折叠含量先增加后减小,无规则卷曲和β-转角结构含量增加,结合以上内容,说明温度增加能够使猪肝水溶性蛋白分子解螺旋,蛋白构象发生转变,α-螺旋转变成其他二级结构,使蛋白溶解度增加。有研究表明,β-折叠结构含量的增加能够提高蛋白乳化液的乳化稳定性,同时可以改进乳化体系的保水保油性[33]。本研究中β-折叠结构含量先增加后减小,证明乳化液稳定性先增加后减小,符合2.3的结论。
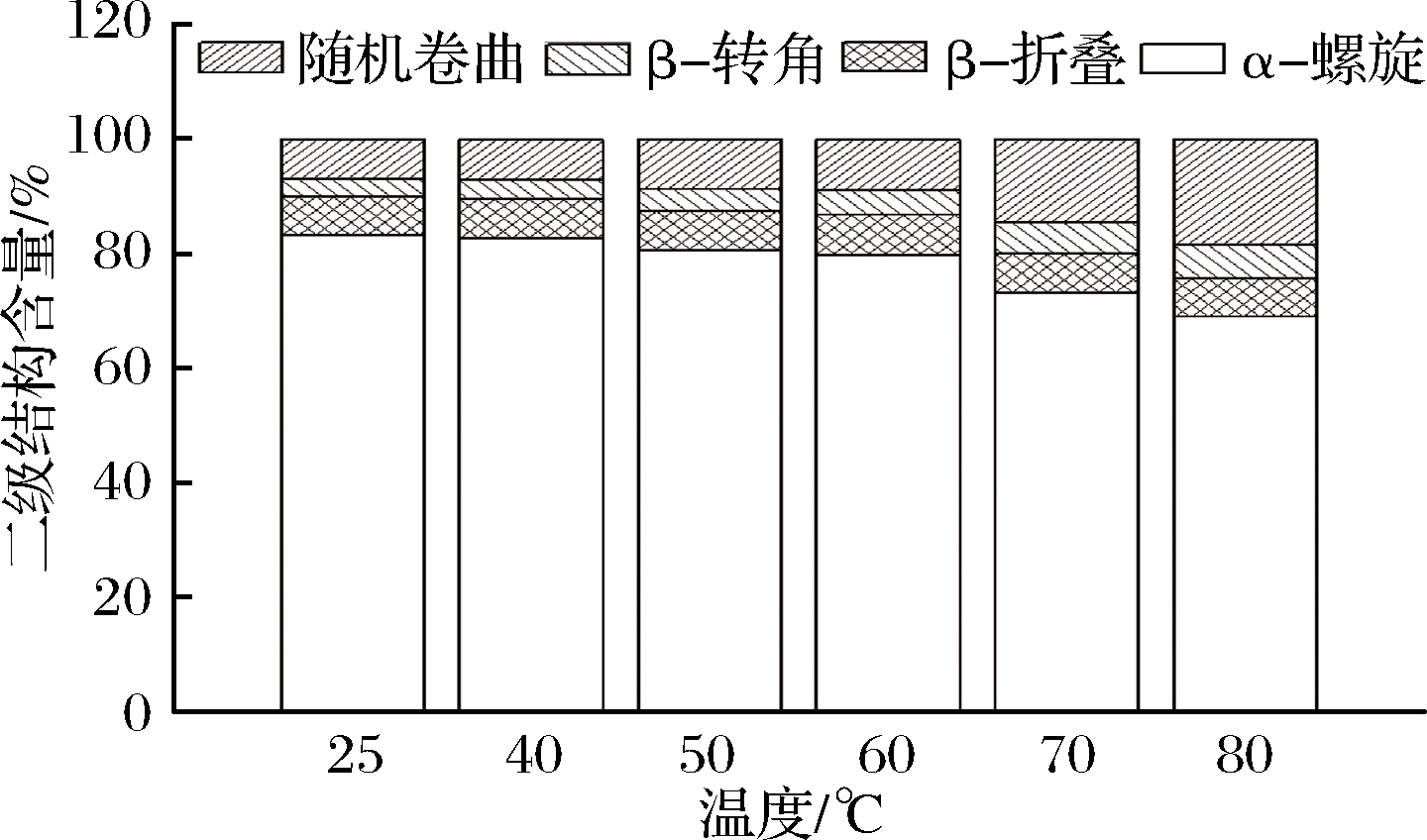
图10 温度对猪肝水溶性蛋白乳化液
二级结构含量的影响
Fig.10 Effects of temperature on secondary structure content of
pork liver water-soluble protein emulsion
3 结论
猪肝水溶性蛋白氨基酸组成合理,营养价值高,属于优质蛋白源。本研究所用的热处理温度均能对猪肝水溶性蛋白乳化特性产生不同程度的影响,60 ℃热处理组的乳化活性和乳化稳定性、乳析指数、界面蛋白含量和种类、液滴粒径大小和分布、液滴微观结构、乳化层蛋白质构象的拉曼光谱等指标的变化情况明显优于其他组,处理效果最佳。此结论为猪肝蛋白的合理利用和猪肝产品的开发提供了理论依据,对于开发猪副产品的市场潜力、应用前景及提高猪副产品的经济利益具有积极意义。
[1] 张聪聪. 水溶性猪肝蛋白功能特性及其在肉制品中的应用[D].重庆:西南大学,2017.
[2] STEEN L, GLORIEUX S, GOEMAERE O, et al. Functional properties of pork liver protein fractions[J]. Food & Bioprocess Technology, 2016, 9(6):970-980.
[3] PENG W, KONG X, CHEN Y, et al. Effects of heat treatment on the emulsifying properties of pea proteins[J]. Food Hydrocolloids, 2016, 52:301-310.
[4] CORREDIG M. Heat-induced changes in oil-in-water emulsions stabilized with soy protein isolate[J]. Food Hydrocolloids, 2009, 23(8):2 141-2 148.
[5] 易建华, 孙艺飞,朱振宝. 影响乳清分离蛋白乳化特性的因素研究[J]. 陕西科技大学学报, 2017, 35(4):112-116.
[6] 刘琴. 金枪鱼肌原纤维蛋白冻藏过程中生化及流变特性研究[D].上海:上海海洋大学,2013.
[7] SOLEIMANPOUR M, KOOCHEKI A, KADKHODAEE R. Influence of main emulsion components on the physical properties of corn oil in water emulsion: Effect of oil volume fraction, whey protein concentrate and Lepidium perfoliatum, seed gum[J]. Food Research International, 2013, 50(1):457-466.
[8] CHIN K B, GO M Y, XIONG Y L. Konjac flour improved textural and water retention properties of transglutaminase-mediated, heat-induced porcine myofibrillar protein gel: Effect of salt level and transglutaminase incubation[J]. Meat Science, 2009, 81(3):565-572.
[9] 崔珊珊. 超高压处理甘薯蛋白酶解产物乳化特性的研究[D]. 乌鲁木齐:新疆农业大学, 2015.
[10] PALAZOLO G G, SOBRAL P A, WAGNER J R. Freeze-thaw stability of oil-in-water emulsions prepared with native and thermally-denatured soybean isolates[J]. Food Hydrocolloids, 2011, 25(3):398-409.
[11] 白登荣. γ-聚谷氨酸复合TGase对鸡肉肌原纤维蛋白功能特性的影响及机理研究[D].重庆:西南大学,2018.
[12] SHAO J H, ZOU Y F, XU X L, et al. Evaluation of structural changes in raw and heated meat batters prepared with different lipids using raman spectroscopy[J]. Food Research International, 2011, 44(9):2 955-2 961.
[13] ALIX A J P, PEDANOU G, BERJOT M. Fast determination of the quantitative secondary structure of proteins by using some parameters of the Raman amide I band[J]. Journal of Molecular Structure, 1988, 174:159-164.
[14] 赵鑫,陆鹏,庄苏.不同产地对大豆及其制品常规营养成分影响的研究[J].饲料博览,2018,320(12):17-21;31.
[15] 金显栋,杨凯,王安奎,等.云岭牛高档牛肉主要营养成分和氨基酸含量分析及评价[J].中国草食动物科学,2016,36(6):21-24.
[16] 范丽霞,李腾,赵善仓,等.四种生鲜乳营养成分的比较分析[J].中国食物与营养,2018,24(9):57-61.
[17] 石玉锋, 虞燕琴. 谷氨酸在睡眠和觉醒中的作用研究进展[J]. 浙江大学学报(医学版), 2013, 42(5):583-590.
[18] World Health Organization, U N University. Energy and Protein Requirements[M].1985.
[19] 刘禹.桑椹籽蛋白质的乳化性及其稳定性研究[J].陕西农业科学,2011,57(5):43-45.
[20] 刘慧清. 罗非鱼蛋白乳化特性的研究[D]. 湛江:广东海洋大学, 2013.
[21] GUILMINEAU F, KULOZIK U. Impact of a thermal treatment on the emulsifying properties of egg yolk. Part 1: Effect of the heating time[J]. Food Hydrocolloids,2005,20(8):1 105-1 113.
[22] 彭伟伟. 热处理对豌豆蛋白乳化性质及界面吸附行为的影响[D]. 无锡:江南大学, 2016.
[23] MAHMOUDI N, AXELOS M A V, RIAUBLANC A. Interfacial properties of fractal and spherical whey protein aggregates[J]. Soft Matter, 2011, 7(17):7 643-7 654.
[24] SRINIVASAN S, HULTIN H O. Chemical, physical, and functional properties of cod proteins modified by a nonenzymic free-radical-generating system[J]. Journal of Agricultural & Food Chemistry, 1997, 45(2):310-320.
[25] SHAO Y, TANG C H. Characteristics and oxidative stability of soy protein-stabilized oil-in-water emulsions: Influence of ionic strength and heat pretreatment[J]. Food Hydrocolloids, 2014, 37(2):149-158.
[26] LI F, KONG X, ZHANG C, et al. Effect of heat treatment on the properties of soy protein-stabilised emulsions[J]. International Journal of Food Science & Technology, 2011, 46(8):1 554-1 560.
[27] RELKIN P, SOURDET S. Factors affecting fat droplet aggregation in whipped frozen protein-stabilized emulsions[J]. Food Hydrocolloids, 2005, 19(3):503-511.
[28] LI-CHAN E, NAKAI S, HIROTSUKA M. Raman Spectroscopy as a Probe of Protein Structure in Food Systems[M]//Protein structure-function relationships in foods,Springer US, 1994:163-197.
[29] XU X L, HAN M Y, FEI Y, et al. Raman spectroscopic study of heat-induced gelation of pork myofibrillar proteins and its relationship with textural characteristic[J]. Meat Science, 2011, 87(3):159-164.
[30] HERRERO A M. Raman spectroscopy a promising technique for quality assessment of meat and fish: A review[J]. Food Chemistry, 2008, 107(4):1 642-1 651.
[31] HERRERO A M. Raman spectroscopy for monitoring protein structure in muscle food systems[J]. Critical Reviews in Food Science & Nutrition, 2008, 48(6):512-523.
[32] 李鹏,王红提,孙京新,等. 超声辅助变压滚揉对鸡肉蛋白质结构及含水量的影响[J]. 农业工程学报, 2017,33(16): 308-314.