利用丰富的木质纤维素生物质可再生资源生产纤维素乙醇可有效缓解当前能源危机。然而,目前过高的生产成本严重阻碍了纤维素乙醇的商业化进程。WINGREN等[1]研究发现,当基质浓度每提高3%,相应的操作成本会降低 19%。而当基质浓度从 20%上升到 30%时,燃料乙醇的成本能降低 0.1美元/加仑。因此,高基质浓度(浓醪)酶解工艺相比于低基质浓度酶解工艺,其在经济效益方面的优势非常巨大。可见,纤维素生物质原料生产燃料乙醇的一个关键在与如何实现高基质浓度的酶解产糖。
针对此问题[2],不少研究者围绕糖化发酵工艺和改进办法进行了不懈探索,如添加辅助酶及添加剂、分批补料和改变浓醪混合方式等。ZHANG等[3]在酶解实验中分别添加150 mg/g干基BSA和Tween 80后,酶解24 h时葡萄糖产率较对照组(22.7%)分别提高至61.6%和62.2%。赵晓斌在10 FPU/g干基和20%基质浓度条件下以甲酸预处理甘蔗渣为底物进行批次酶解和分批补料实验,酶解144 h后分批补料方式的葡萄糖产量比批次酶解提高15%。余恒以预处理后玉米秸秆为基质,采用圆底烧瓶和机械搅拌方式进行20%浓度的基质酶解,葡萄糖产量达到120.7 g/L,较摇床振荡水解(葡萄糖产量96.4 g/L)提高25%。这些结果显示,采用辅助水解策略,如添加剂、辅助酶、机械搅拌和分批补料等,有可能改善纤维基质浓醪水解黏度大和传质传热困难等不足,实现木质纤维素基质在低酶载条件下的高效浓醪水解糖化。
基于此,本文以实验室已有的碱催化常压甘油有机溶剂预处理甘蔗渣为原料,尝试开展低酶载量(6 FPU/g DM)下基质浓醪(350 g/L)水解糖化的研究。
1 材料与方法
1.1 试剂材料与仪器设备
甘蔗渣(广西壮族自治区)过筛,筛选尺寸5 mm×1 mm左右的甘蔗渣,烘干后存于塑封袋备用。使用前测定其3大主要组分含量:纤维素43.3%、半纤维素27.6%、木质素21.5%。工业甘油(纯度99.5%),购自无锡化工站;纤维素酶Cellic CTecⅡ滤纸酶活140 FPU/mL,来自诺维信(中国)生物技术有限公司;溶菌酶,来自国药集团;木聚糖酶蛋白(含量158 mg/g),来自青岛蔚蓝生物有限公司馈赠。高效液相色谱仪,日本HITACHI公司;SBA-40E 生物传感分析仪,山东省科学院生物研究所;HYG-A全温摇瓶柜,江苏太仓实验设备厂。
1.2 方法
1.2.1 甘蔗渣的碱催化常压甘油有机溶剂预处理
准确称量150 g筛选好的绝干甘蔗渣放入5 000 mL三口烧瓶中,随后缓缓加入1 500 g工业甘油,接着添加4.45 g NaOH。将上述装置放入恒温加热套中,设定预处理温度257 ℃,待温度上升至257 ℃后开始计时18 min。反应结束后,首先将1 500 mL自来水倒入烧瓶内使基质充分解离后用G1砂芯漏斗进行过滤,接着用2 000 mL自来水对上步滤饼先后洗涤2次并用G1砂芯漏斗进行过滤,最终所获滤饼即为al-AGOP甘蔗渣基质。预处理后将基质自然晾至水分含量为50%,存于塑封袋并置于4 ℃层析柜备用。
1.2.2 酶解
(1)摇瓶振荡酶解
在250 mL锥形瓶中准确加入9.5 g甘蔗渣基质,按5 FPU/g干基质添加纤维素酶,加入相应的添加剂和辅酶后添加50 mL柠檬酸缓冲液(pH 4.8)。将锥形瓶置于全温摇瓶柜中进行酶解,条件设定为50 ℃,180 r/min,分别于6、12、24、36、48、60和72 h取样并测定葡萄糖浓度。
(2)机械搅拌酶解
准确称量相应质量甘蔗渣基质放入250 mL圆底烧瓶中,加入适量的pH 4.8柠檬酸缓冲液至总体积为45 mL,加入6 FPU/g干基纤维素酶和适量添加剂或辅酶,接着将带有橡胶塞的双叶搅拌桨放入圆底烧瓶中并与机械搅拌(转速150 r/min)装置固定于50 ℃恒温水浴锅中进行酶解。高浓酶解采取分批补料方式,在所需补料时间点暂停机械搅拌补入相应补料量后继续进行机械搅拌酶解,并在6、12、24、36、48、60和72 h取样并检测样品中的葡萄糖浓度。
1.3 分析测定方法
滤纸酶活(FPA)依照国际理论和应用化学协会(IUPAC)推荐的国际标准法测定[4]。通过高效液相色谱(HPLC)法(色谱柱BioRad Aminex HPX-87H,300 mm×7.8 mm)检测组分含量中葡萄糖、木糖浓度,流动相为5 mmol/L H2SO4,流速为0.6 mL/min,柱温60 ℃,示差检测器(日立HITACHI)。酶水解过程中葡萄糖浓度采用SBA-40E 生物传感分析仪法确定。所有实验均重复3次并取平均值且标准偏差小于2%。
2 结果与分析
2.1 添加剂的选择
2.1.1 单因素实验
相关文献显示[5-6],添加剂可以通过疏水作用和氢键作用于木质素,阻止纤维素酶和木质素之间无效吸附,进而促进纤维素酶解进程。因此,本实验考察了3种添加剂(牛血清白蛋白(bovine albumin,BSA)、Tween 20、茶皂素)对预处理后甘蔗渣的酶解影响。首先通过单因素实验确定BSA、Tween 20、茶皂素相对较优的浓度,实验结果如图1所示。
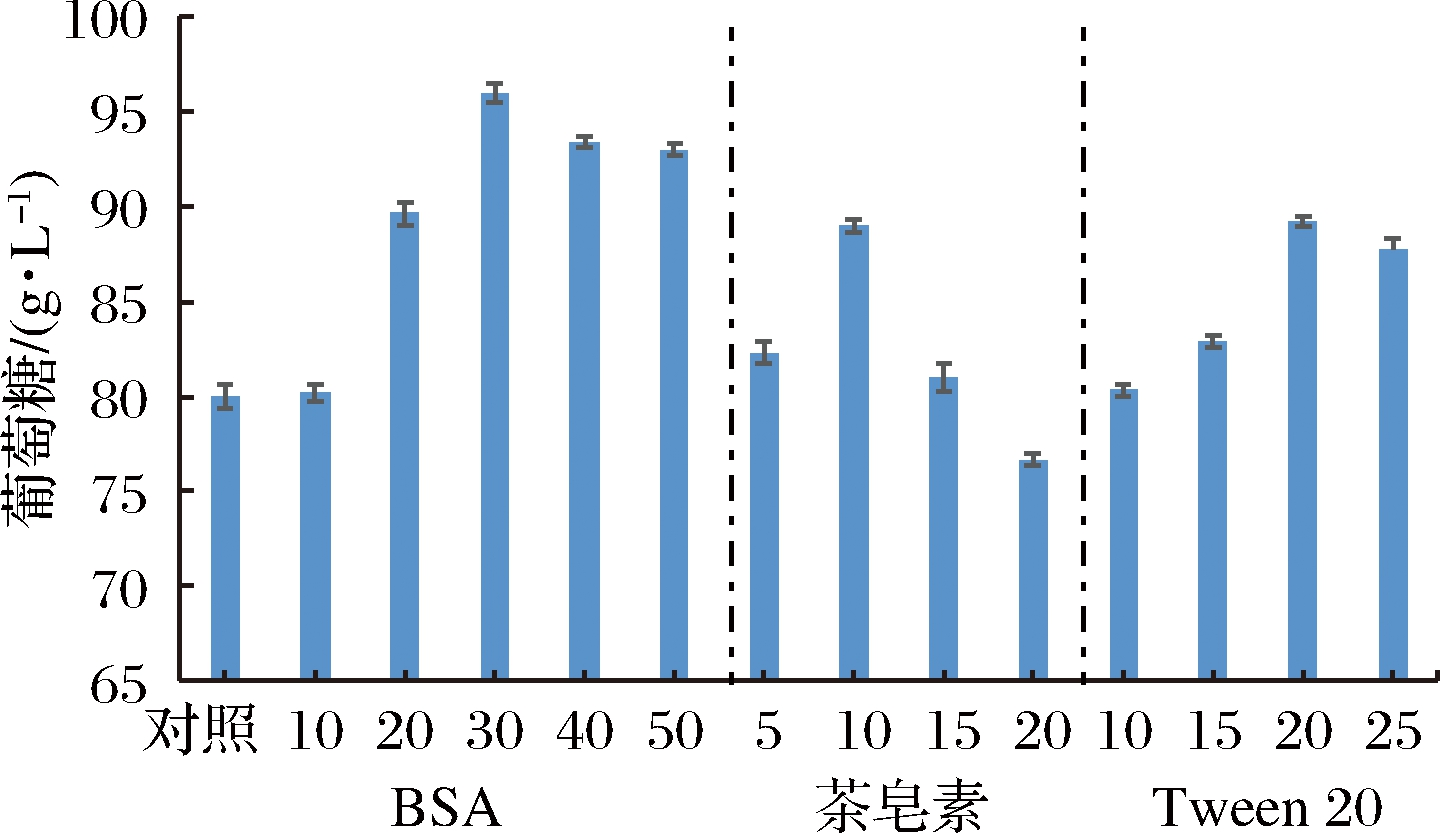
图1 单因素实验优化添加剂浓度
Fig.1 Single factor experiment of additive concentration
如图1所示,随着BSA添加量的增大,al-AGO预处理甘蔗渣酶解产葡萄糖浓度呈现先增长后降低的趋势。当BSA质量浓度达到30 mg/g干基时,葡萄糖质量浓度达到最高为96 g/L,比对照组(80 g/L)提高了20%。因此,实验选择BSA添加量为30 mg/g干基。添加茶皂素时,葡萄糖浓度随着茶皂素添加量也呈先增加后降低的趋势。当茶皂素添加量为10 mg/g干基时,葡萄糖质量浓度达到最大为89.0 g/L,相较于空白组(78.0 g/L)提高了14%。因此,选择10 mg/g干基茶皂素用于后续实验。添加Tween 20时,葡萄糖质量浓度随着Tween 20添加量的增加呈先上升后降低的趋势。当Tween 20 添加量低于20 mg/g干基时,葡萄糖浓度均随着Tween 20添加量的增大而增大;添加量为20 mg/g干基时葡萄糖质量浓度达到最高为89.0 g/L,较对照组(80 g/L)提高了约11%。因此,选择添加量为20 mg/g干基Tween 20用于后续实验。
2.1.2 正交实验优化
经过上述对添加剂的单因素优化后,本实验最终确定添加剂种类及质量浓度为:30 mg/g干基BSA、10 mg/g干基茶皂素、20 mg/g干基Tween 20。为了进一步考察各因素之间对酶解作用的相互影响,实验接着使用软件minitab针对BSA、茶皂素和Tween 20三个参数进行L9(34)正交试验,实验设计及结果如表1所示。
表1 糖化条件因素水平正交试验分析
Table 1 Orthogonal analysis of saccharification conditions
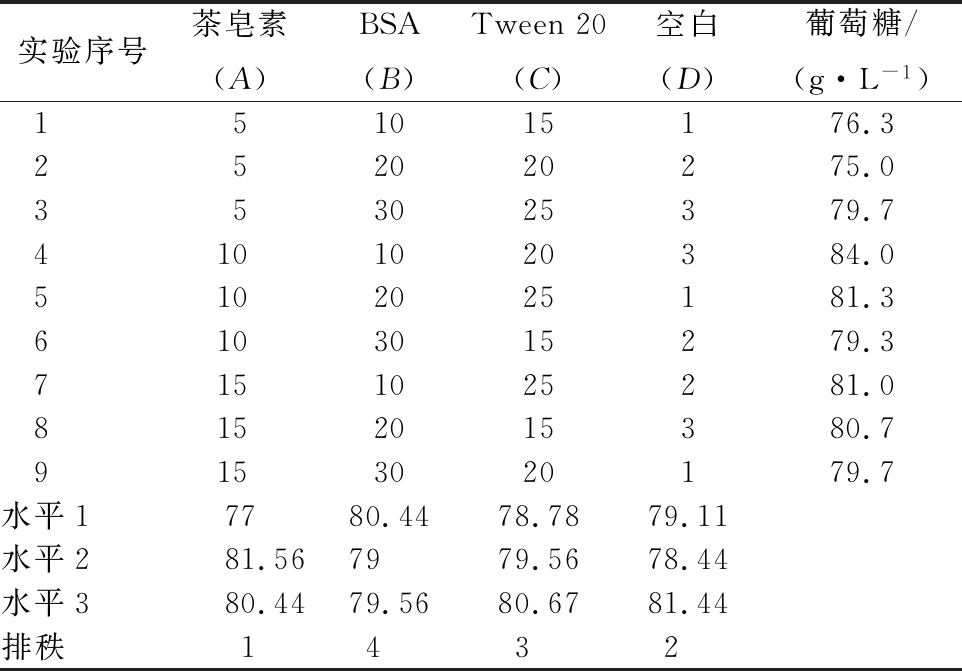
实验序号茶皂素(A)BSA(B)Tween20(C)空白(D)葡萄糖/(g·L-1)151015176.3252020275.0353025379.74101020384.05102025181.36103015279.37151025281.08152015380.79153020179.7水平17780.4478.7879.11水平281.567979.5678.44水平380.4479.5680.6781.44排秩1432
经过软件分析,3个参数对基质酶解糖化影响大小的排秩顺序为:茶皂素、Tween 20、BSA。最优组合为A2D2C3B1,即:10 mg/g干基茶皂素、25 mg/g干基Tween 20、10 mg/g干基BSA。结果表明,在此条件下酶解60 h时葡萄糖质量浓度达95.0 g/L。
2.2 辅助酶的选择
2.2.1 溶菌酶最适浓度的确定
有文献报道[7],在纤维素酶解过程中添加适量溶菌酶可以减少木质素的无效吸附,进而促进酶解。因此,本实验在酶解开始时添加10、20、30、40 mg/g干基的溶菌酶,考察溶菌酶添加量对酶解效果的影响。结果如图2所示,添加不同浓度的溶菌酶,对酶解并没有促进效果,各实验组与对照组葡萄糖浓度基本持平,因此,本实验不采用溶菌酶作为额外辅酶使用。
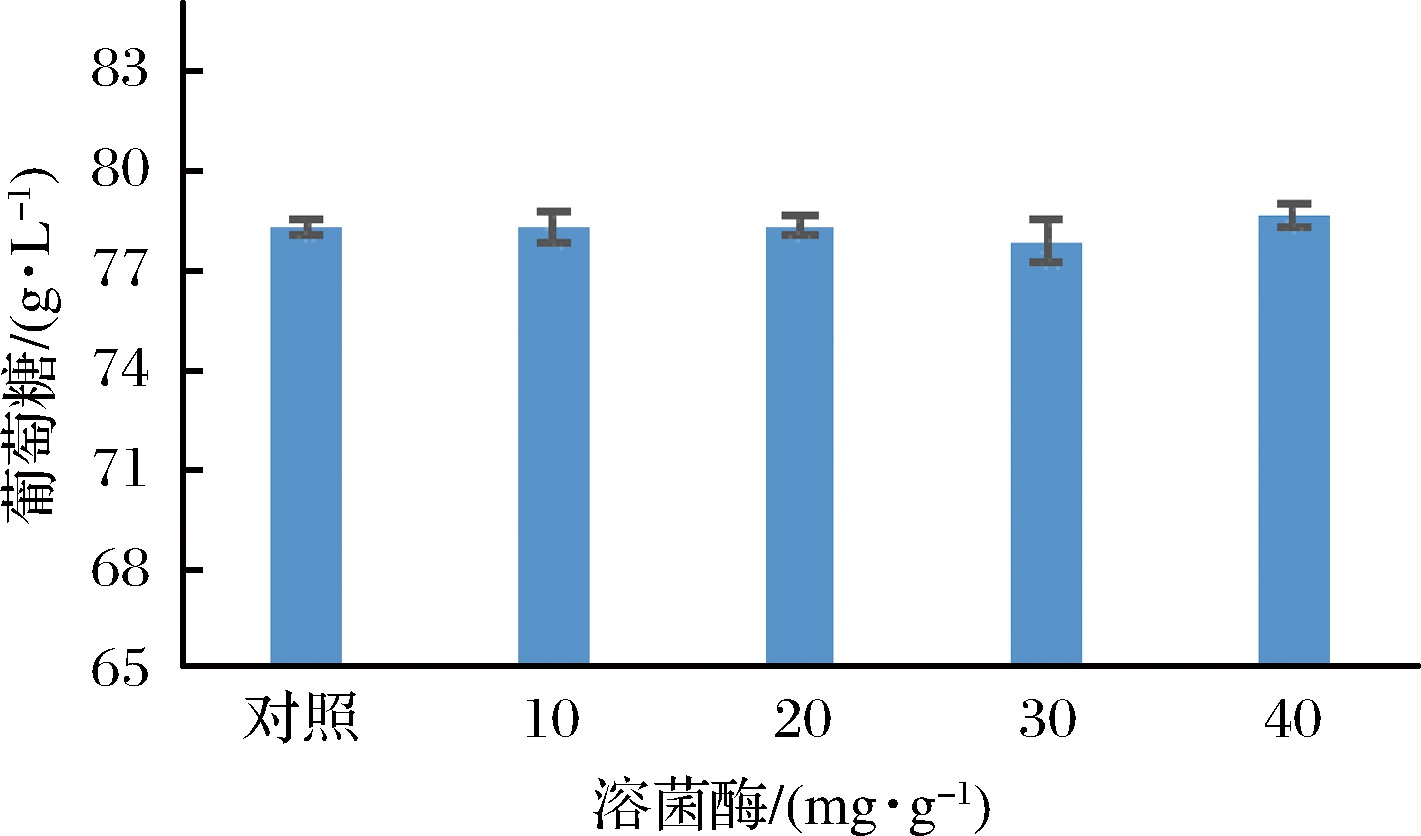
图2 溶菌酶对酶解的影响
Fig.2 The influence of lysozyme on hydrolysis
2.2.2 木聚糖酶最适浓度的确定
一些报道显示[1,8],预处理后木质纤维原料的细胞壁结构破碎,使得纤维素暴露于外部,但在细胞壁结构中仍存在部分半纤维素缠绕在纤维素外部,还有部分半纤维素可经纤维素孔延伸至原纤维丝中阻碍纤维素酶吸附纤维素。因此,本实验在酶解初始时添加0.3、0.6、0.9、1.2、1.5、1.8 mg/g干基的内切木聚糖酶(endoxylanase,EX),考察其对基质酶解的影响。结果如图3所示,在EX存在下纤维素和半纤维素的酶解能力均有明显提高。随着EX添加量增大,酶解过程中葡萄糖和木糖浓度也随之增大;但当添加量超过0.6 mg/g干基时增幅变缓,产糖量基本持平。因此,后续实验按0.6 mg/g干基添加EX。在此条件下酶解60 h后葡萄糖质量浓度为97.4 g/L,相较于空白组(80.0 g/L)提高了21.8%;木糖质量浓度为39.1 g/L,相较于空白组(28.2 g/L)提高了38.7%。
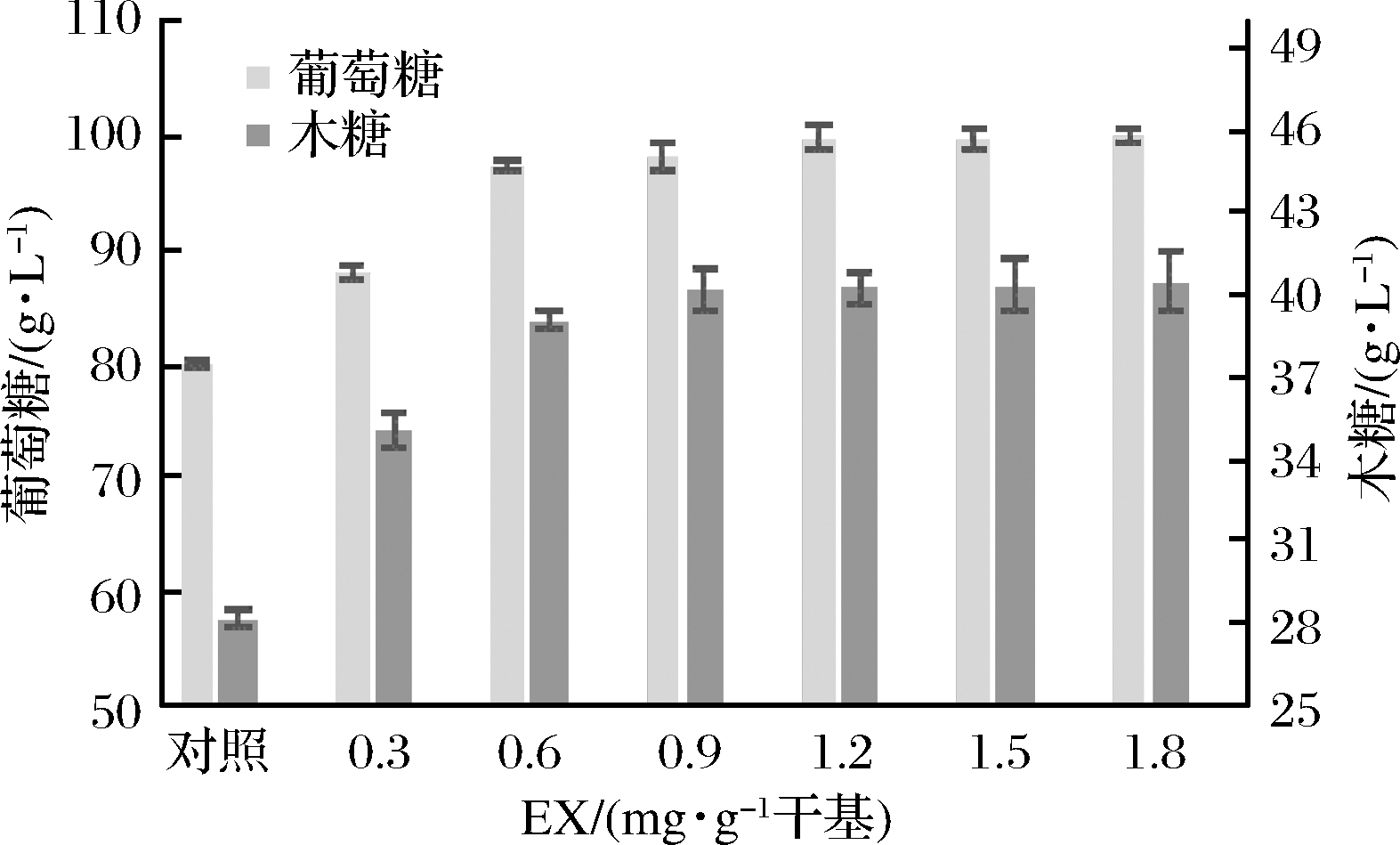
图3 木聚糖酶对酶解的影响
Fig.3 The influence of xylanase on hydrolysis
2.3 浓醪酶解糖化
根据相关文献报道[9-10],当基质质量浓度大于150 g/L时,可认定为高基质浓度。但在实际生产中,基质质量浓度高于150 g/L时,酶水解液将变得非常黏稠,使其难以在摇瓶中摇匀和高效酶解。同时,高质量浓度基质水解液中自由水含量较低,影响微粒的润滑特性,阻碍纤维素酶与甘蔗渣基质有效结合。因此,本实验为了实现高浓基质的酶解糖化,采用机械搅拌和全湿基分批补料方式进行酶解以促进纤维素酶与甘蔗渣基质的有效结合。
2.3.1 初始基质浓度的选择
本实验在总基质质量浓度保持在350 g/L不变的情况下,考察不同初始基质浓度对批次酶解(酶载量6 FPU/g干基)产糖的影响。实验结果如图4所示,葡萄糖浓度随着初始基质浓度的增大而提高,在基质质量浓度大于190 g/L时,葡萄糖浓度增幅变缓。在基质质量浓度为190 g/L时,葡萄糖浓度最高,达到 94.7 g/L。据相关文献报道,在进行分批补料过程中若初始基质浓度偏低,则导致后期补料量过高,酶解过程中醪液黏度增大不利于糖化;若初始基质浓度偏高,醪液过于黏稠影响传质,导致纤维素酶和基质难以有效接触,基质无法彻底液化从而无法进行补料。因此,本实验选择190 g/L作为初始基质质量浓度。
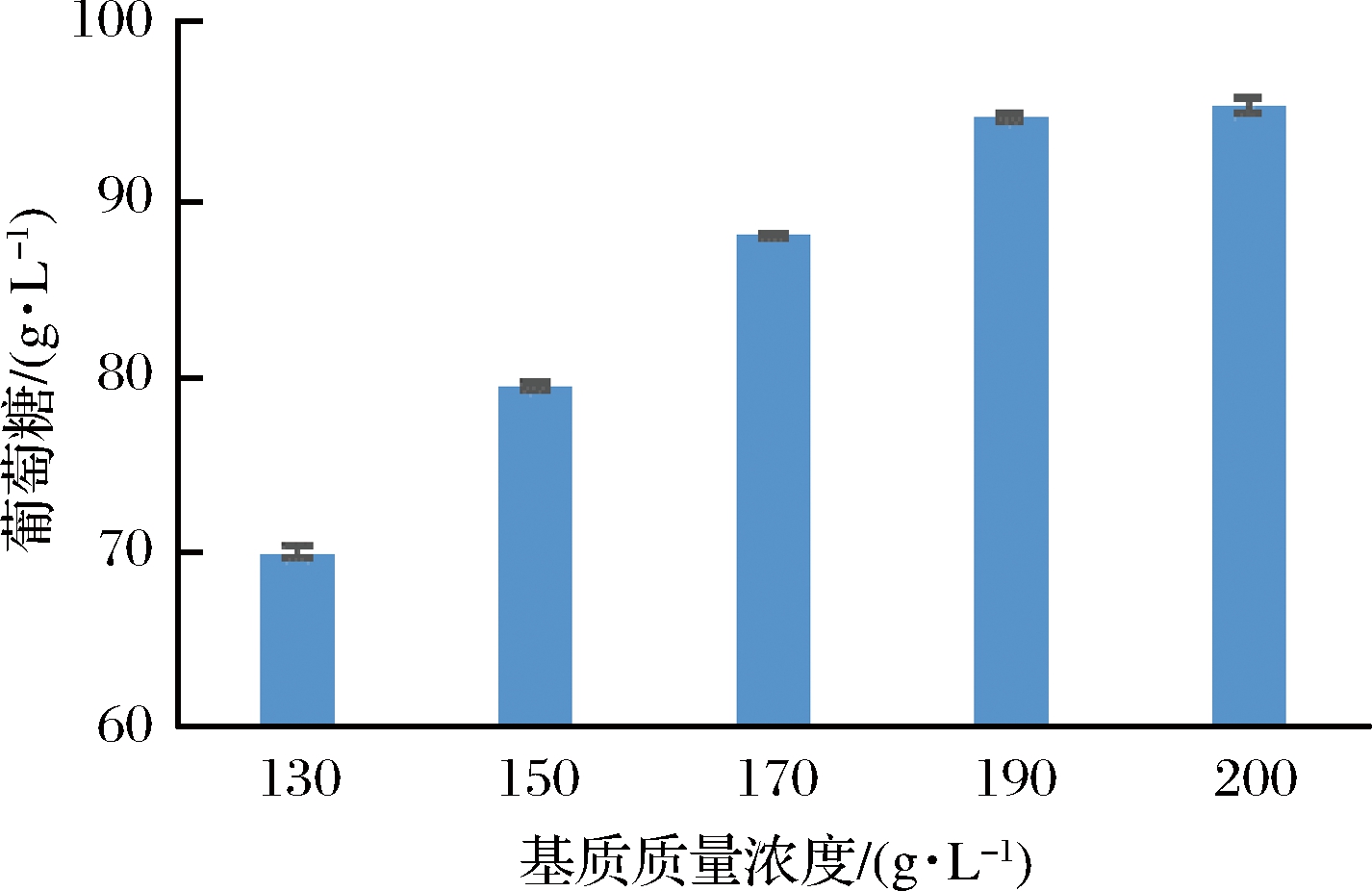
图4 初始基质浓度的选择
Fig.4 The selection of initial substrate concentration
2.3.2 补料方式的确定
根据一些资料报道[1,11],在补料过程中若单次补料量过高(高于10%),会短时间内造成醪液过于黏稠,对后期补料造成困难;若单次补料量过少,则需要补料多次,纤维素酶酶活不足以支撑整个补料过程。可见,整个补料过程受到补料次数和补料量两者相互作用的影响。因此,本实验在前期实验基础上,以190 g/L为初始基质浓度,设计5种不同的补料量、补料次数,初步选择最适合本实验的补料方式,具体设计方案及结果如表2所示。
表2 分批补料次数选择
Table 2 The selection of feeding time
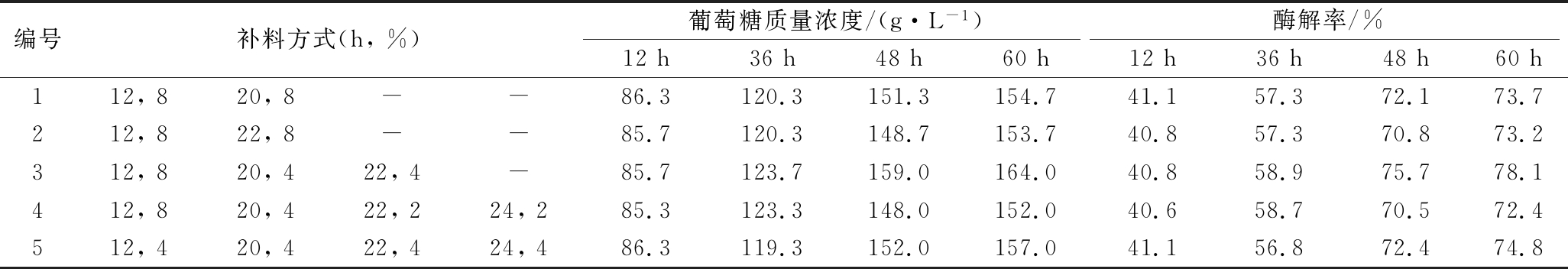
编号补料方式(h,%)葡萄糖质量浓度/(g·L-1)酶解率/%12h36h48h60h12h36h48h60h112,820,8--86.3120.3151.3154.741.157.372.173.7212,822,8--85.7120.3148.7153.740.857.370.873.2312,820,422,4-85.7123.7159.0164.040.858.975.778.1412,820,422,224,285.3123.3148.0152.040.658.770.572.4512,420,422,424,486.3119.3152.0157.041.156.872.474.8
注:2%、4%、8%表示单次补料量(W/W)。
如表2所示,第1、2种补料方式,无论是葡萄糖浓度还是酶解率均相差不大;第3种补料方式的葡萄糖产量和酶解率在酶解全程均显著高于其他实验组,说明补料次数偏少影响酶解效果,补料3次的方式最适宜;第4、5种补料方式均为补料5次,但是第5种补料方式的葡萄糖产量和酶解率相对较高,说明第5种补料量相对合理,首次补料量不宜过高。因此,实验初步选择第3种补料方式,即分别在12、20和22 h补料8%、4%和4%。
在确定了3次补料方式为最优补料次数后,实验在此基础上进一步考察不同时间点、补料量的3次补料模式,以期缩短补料时间。因此实验考察在第7、10和13 h分别补料6%、5%和5%;第12、18和21 h分别补料8%、4%和4%;第13、17和20 h分别补料7%、5%和4%三种补料模式。实验条件为:酶载量6 FPU/g干基,酶解起始添加0.6 mg/g干基EX、10 mg/g干基茶皂素、25 mg/g干基Tween 20、10 mg/g干基BSA,补料最终浓度35%。实验结果如表3所示。
补料方式1,由于补料时间较为集中且最终补料在13 h结束,因此在12 h基质尚未液化无法检测,但后期酶解液液化时间充足,在24 h时基质已液化可检测,在48 h时葡萄糖质量浓度及酶解率分别为160.6 g/L和76.5%;补料方式2的初始补料时间相对较晚(推迟5 h),因此在初始补料时体系中葡萄糖质量浓度较高(86.3 g/L),较补料方式1(76.9 g/L)高出约12%,但是在48 h时葡萄糖质量浓度(147.8 g/L)和酶解率(70.4%)相对补料方式1实验组较低,可能的原因是该补料方式补料时间偏后,导致纤维素酶酶活在后期削弱与基质的结合能力变差;补料方式3在10 h时初始基质已液化并检测到葡萄糖质量浓度79.3 g/L,该实验组48 h葡萄糖质量浓度及酶解率分别为141.3 g/L和67.3%,明显低于补料方式1。因此,补料方式1不论是补料时间还是单次补料量相对是较好的。因此,实验最终选定补料方式1,即在7、10和13 h分别补料6%、5%和5%。
表3 3种不同补料方式对酶解的影响
Table 3 The influence of feeding method on hydrolysis
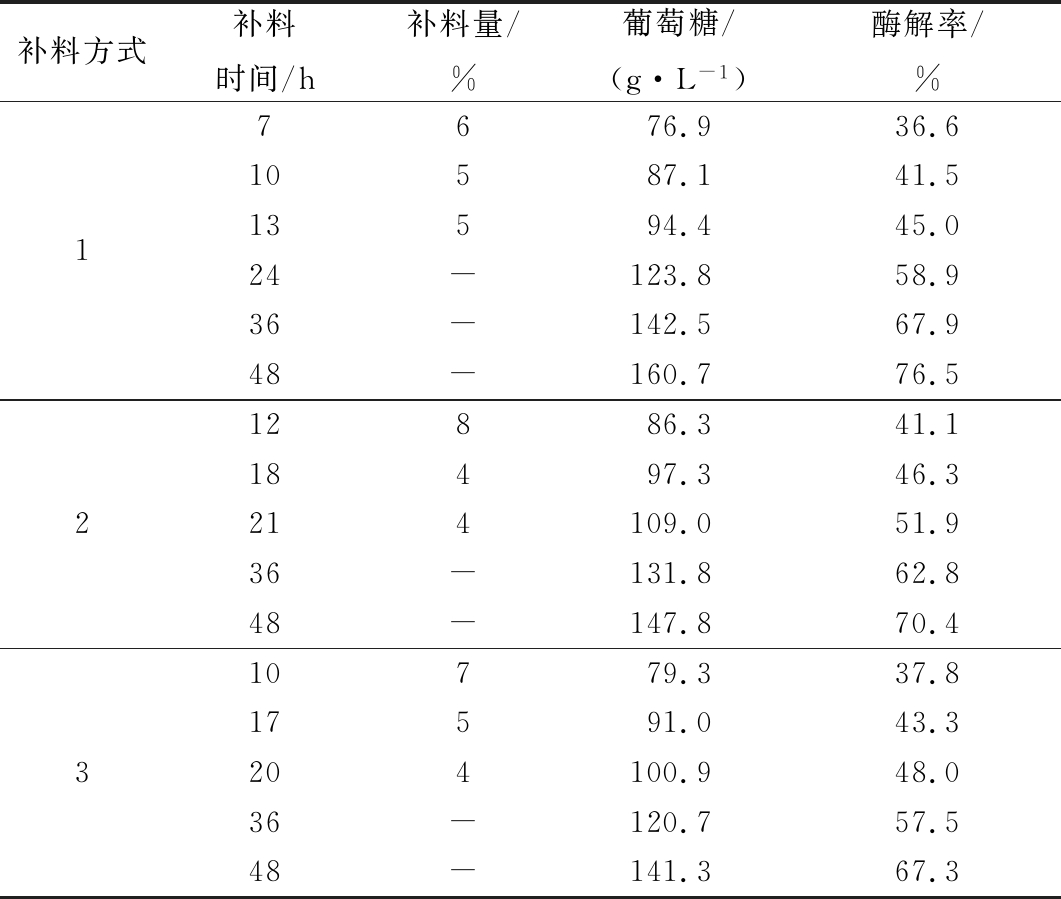
补料方式补料时间/h补料量/%葡萄糖/(g·L-1)酶解率/%17676.936.610587.141.513594.445.024-123.858.936-142.567.948-160.776.5212886.341.118497.346.3214109.051.936-131.862.848-147.870.4310779.337.817591.043.3204100.948.036-120.757.548-141.367.3
实验确定浓醪酶解条件为:在纤维素酶酶载量6 FPU/g干基、初始基质质量浓度190 g/L条件下,于酶解初始时一次性添加0.6 mg/g干基EX、10 mg/g茶皂素、10 mg/g BSA和25 mg/g干基Tween 20,接着于7、10和13 h分别补料6%、5%和5%,至最终质量浓度为350 g/L。在此条件下,运行浓醪酶解糖工艺全程,最终结果如下:预酶解48 h时,葡萄糖质量浓度高达160.7 g/L,酶解率为76.5%;木糖质量浓度达到58.7 g/L,半纤维素水解率为57.8%。工艺运行全程糖浓度变化如图5所示。
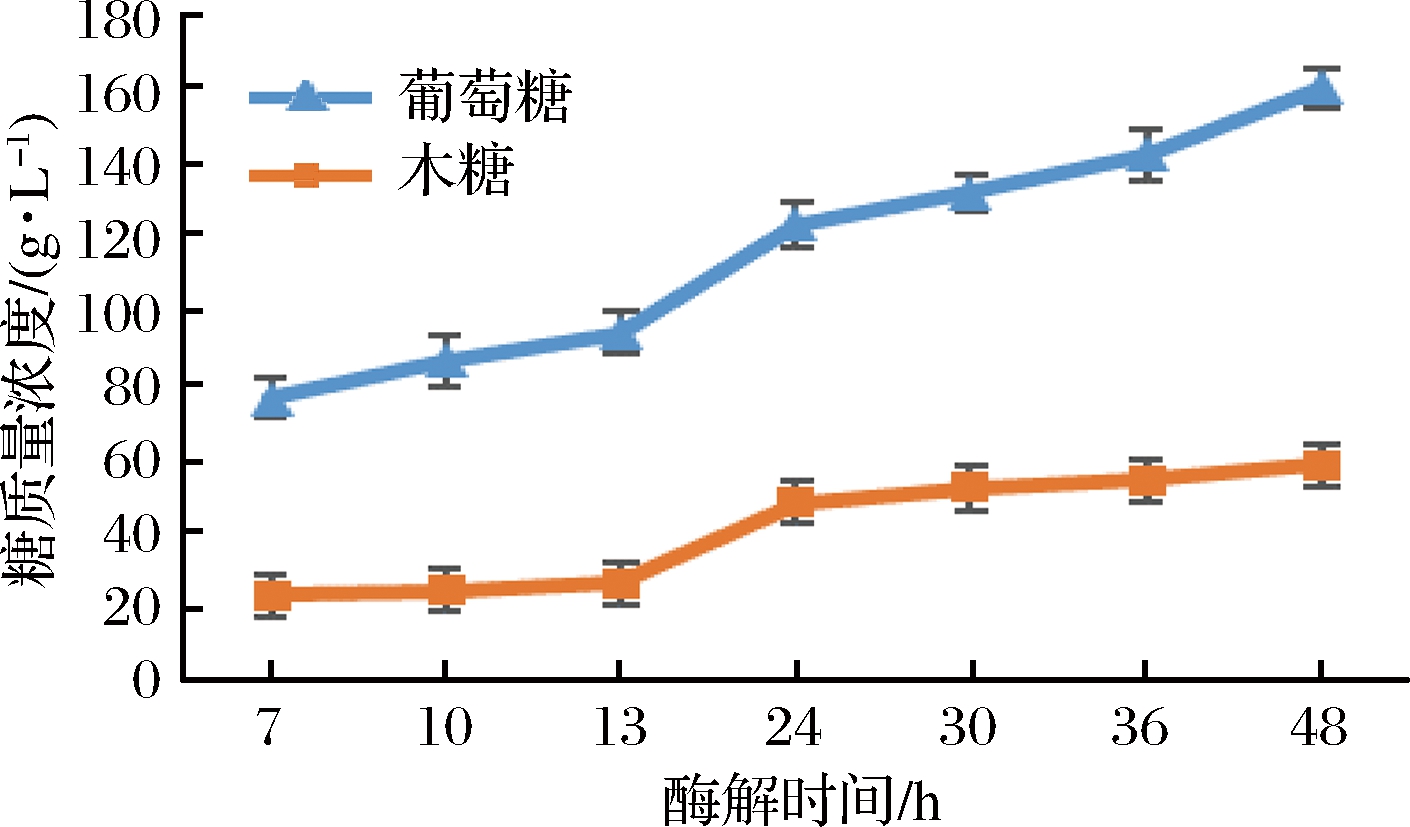
图5 浓醪酶解全程糖浓度变化
Fig.5 The change of glucose concentrations during the high concentration hydrolysis
DAVID等[12]在加酶量为 10.7 FPU/g纤维素的条件下,通过分批补料的方式使基质质量分数达到 25%,240 h的水解液中的葡萄糖质量浓度将近 140 g/L,本实验相较其不仅提高了基质浓度,且酶解时间缩短了192 h。该结果与我们实验室前期工作相比也取得了明显进步:王亮[13]曾以自催化常压甘油有机溶剂预处理麦草,基质在30 FPU/g干基条件下进行半同步浓醪发酵(基质质量浓度350 g/L),24 h时葡萄糖质量浓度为58.2 g/L;本实验酶载量仅为6 FPU/g,24 h葡萄糖质量浓度达到123.8 g/L,约为其2倍。洪嘉鹏[14]以碱催化常压甘油有机溶剂预处理后甘蔗渣为基质,在6 FPU/g干基条件下进行半同步浓醪发酵(基质质量浓度350 g/L),预酶解72 h,葡萄糖质量浓度为132 g/L,本实验相比其不仅酶解时间缩短了24 h,且葡萄糖质量浓度提高了约22%。可见,本文确定的辅助酶和添加剂的种类、浓度和分批补料模式可显著提高高基质浓度体系的酶解产糖量,为后续实现高浓度纤维素乙醇发酵提供可能。
3 结论
碱催化常压甘油有机溶剂预处理甘蔗渣在6 FPU/g干基酶载量条件下,通过分批补料方式(初始基质质量浓度190 g/L)达到浓醪(350 g/L)酶解,使用添加剂(10 mg/g茶皂素、10 mg/g BSA、25 mg/g Tween 20)和木聚糖酶(0.6 mg/g干基)酶解48 h,可发酵性糖高达220 g/L,其中葡萄糖和木糖产量分别为160.7和58.7 g/L,具有明显的工业意义。分批补料方式是实现木质纤维素基质浓醪水解糖化的有效途径,添加剂和辅助酶不但有助于底物的常规酶解糖化,在浓醪基质糖化过程中仍具有积极作用。
[1] KERSTIN H,MATS G,GUIDO Z.Effects of enzyme feeding strategy on ethanol yield in fed-batch simultaneous saccharification and fermentation of spruce at high dry matter[J].Biotechnology for Biofuels,2010,3(1):14-14.
[2] L PEZ-LINARES J C,ROMERO I,CARA C,et al.Bioethanol production from rapeseed straw at high solids loading with different process configurations[J].Fuel,2014,122(12):112-118.
PEZ-LINARES J C,ROMERO I,CARA C,et al.Bioethanol production from rapeseed straw at high solids loading with different process configurations[J].Fuel,2014,122(12):112-118.
[3] ZHANG X,QIN W J,PAICE M G,et al.High consistency enzymatic hydrolysis of hardwood substrates[J].Bioresource Technology,2009,100(23):5 890-5 897.
[4] GHOSE T K.Measurement of cellulase activities[J].Pure &Applied Chemistry,1987,59(2):257-268.
[5] YU-AN C,YAN Z,YANLIN Q,et al.Evaluation of the action of Tween 20 non-ionic surfactant during enzymatic hydrolysis of lignocellulose:pretreatment,hydrolysis conditions and lignin structure[J].Bioresource Technology,2018,269:329-338.
[6] KAAR W E,HOLTZAPPLE M T.Benefits from Tween during enzymic hydrolysis of corn stover[J].Biotechnology &Bioengineering,2015,59(4):419-427.
[7] TOYOSAWA Y,IKEO M,TANEDA D,et al.Quantitative analysis of adsorption and desorption behavior of individual cellulase components during the hydrolysis of lignocellulosic biomass with the addition of lysozyme[J].Bioresource Technology,2017,234:150-157.
[8] KÖHNKE T,LUND K,BRELID H,et al.Kraft pulp hornification:A closer look at the preventive effect gained by glucuronoxylan adsorption[J].Carbohydrate Polymers,2010,81(2):226-233.
[9] MOHAGHEGHI A,TUCKER M,GROHMANN K,et al.High solids simultaneous saccharification and fermentation of pretreated wheat straw to ethanol[J].Applied Biochemistry &Biotechnology,1992,33(2):67-81.
[10] CASPETA L,![]() M A,PONCE-NOYOLA T,et al.Enzymatic hydrolysis at high-solids loadings for the conversion of agave bagasse to fuel ethanol[J].Applied Energy,2014,113(1):277-286.
M A,PONCE-NOYOLA T,et al.Enzymatic hydrolysis at high-solids loadings for the conversion of agave bagasse to fuel ethanol[J].Applied Energy,2014,113(1):277-286.
[11] LIU Y,XU J,ZHANG Y,et al.Optimization of high solids fed-batch saccharification of sugarcane bagasse based on system viscosity changes[J].Journal of Biotechnology,2015,211(66):5-9.
[12] HODGE D B,M NAZMUL K,SCHELL D J,et al.Model-based fed-batch for high-solids enzymatic cellulose hydrolysis[J].Applied Biochemistry &Biotechnology,2009,152(1):88.
[13] 王亮,刘建权,张喆,等.常压甘油自催化预处理麦草浓醪发酵纤维素乙醇[J].生物工程学报,2015,31(10):1 468-1 483.
[14] 洪嘉鹏,岳春,赵晓琴,等.常压甘油有机溶剂预处理甘蔗渣的浓醪酶解[J].食品与发酵工业,2017,43(10):36-42.