菜粕是菜籽榨油后的副产物,其中粗蛋白含量为35%~40%,与豆粕蛋白相比蛋氨酸和胱氨酸含量更高,且含有丰富的金属元素,如铁、锰、铜、钙、磷、硒等,是一种价廉易得的优质植物蛋白资源[1]。但菜粕中含有多种抗营养因子,如硫苷、植酸、芥酸和单宁酸等[2],限制了其在食品、饲料行业中的应用。其中硫苷为主要的抗营养因子,分解后会生成恶唑烷硫酮、异硫氰酸酯、腈等有毒物质,这些物质对动物甲状腺、肝、肾都会产生毒害作用[3]。植酸主要能与蛋白质、铜、锌、钙等营养物质结合形成难以消化的络合物[4],降低菜粕的营养价值。另一方面,由于菜粕蛋白中小肽含量低,相比于豆粕、鱼粉蛋白更难被消化[5]。因此,降低菜粕中抗营养因子硫苷、植酸含量并提高小肽含量,对提高菜粕的营养价值,解决蛋白质原料供应紧缺的问题具有重要意义。
为了改善菜籽粕的营养价值,国内外许多学者对菜粕的脱毒方法进行了大量研究,包括物理脱毒法、化学脱毒法、微生物发酵法和遗传育种法。微生物固态发酵法经济高效、重现性好[6],近年来常被用于菜粕脱毒、提取菜籽抗氧化肽等[7-8]。CROAT等[9]利用正己烷预处理菜粕后,通过里氏木霉30 ℃发酵168 h后将菜粕中硫苷降至0.4 μmol/g。但存在有机试剂残留,发酵时间长等问题。MAHAJAN等[10]通过添加纯酶制剂降解植酸、硫苷,其降解率分别达到71%、60%。但通过添加纯酶制剂处理菜粕降解抗营养因子,一方面降低了酶和底物的耦合度使得酶解效率低下,另一方面也增加了处理成本。
目前大部分研究侧重于通过微生物一步发酵法降解抗营养因子[11-13],但未考察过通过发酵后结合酶解的方式进一步降解菜粕中抗营养因子,提高营养物质。由于黑曲霉具有产酶系较全且安全性高的特点[14],并符合农业部颁布的安全发酵菌株要求,因此,本实验选择一株能降解硫苷、植酸的黑曲霉发酵菜粕,发酵结束后利用黑曲霉在发酵过程中产生的各种酶进一步酶解发酵后的菜粕,通过发酵、酶解两步法降低菜粕中的抗营养因子硫苷和植酸含量,提高菜粕中小肽含量。
1 材料与方法
1.1 材料
1.1.1 菌种
黑曲霉,购买于中国工业菌种保藏中心(CICC)。
1.1.2 原料
菜籽粕(水分含量10.57%)、麸皮(水分含量9.31%),乐山恒峰华邦科技有限公司。
1.1.3 培养基
保藏培养基:察氏琼脂培养基(质量分数)(蔗糖3%;NaNO3 0.3%;K2HPO4 0.1%;MgSO4·7H2O 0.05%;KCl 0.05%;FeSO4 0.001%;琼脂1.5%~2%;121 ℃灭菌20 min)。
黑曲霉麸皮种子培养基:麸皮∶水=2∶1 (g∶mL),自然pH;混匀取 30 g装于500 mL三角瓶,121 ℃灭菌15 min。
发酵培养基:菜粕(绝干)∶麸皮(绝干)∶水=7∶3∶15 (g∶g∶mL),自然pH;混匀取 60 g装于500 mL三角瓶,121 ℃灭菌15 min。
1.2 仪器设备
T-114型分析天平,北京赛多利斯仪器系统有限公司;T6紫外-可见分光光度计,北京普析通用仪器有限公司;QYC-2102C型恒温培养摇床,上海福马实验设备有限公司;MF 80BSH-2型霉菌培养箱,上海新苗医疗器械制造有限公司;LS-75HD立式高压蒸汽灭菌器,江阴滨江医疗设备有限公司;SW-CJ-2F 型超级洁净工作台,苏州安泰空气技术有限公司;K9840自动凯氏定氮仪,山东海能科学仪器有限公司。
1.3 试验方法
1.3.1 种子制备
勾取5~7环保藏的黑曲霉接种于种子培养基中,混匀,30 ℃恒温培养72 h。
1.3.2 固态发酵
将黑曲霉麸皮种子以5%(质量分数)的接种量接种于发酵培养基中,混匀,30 ℃恒温培养;发酵一定时间后取30 g发酵菜粕于70 ℃烘干至恒重,粉碎过40目筛网测定指标。
1.3.3 酶解
取固态发酵结束后的30 g发酵菜粕装入自封袋,45 ℃密闭恒温酶解24 h;之后将菜粕于70 ℃烘干至恒重,粉碎过40目筛网测定指标。
1.3.4 发酵、酶解时间对硫苷、植酸含量的影响
固态发酵时间:分别考察发酵一定时间(12、24、36、48、60、72 h)和发酵相应时间并酶解24 h后硫苷、植酸含量的变化情况。
酶解时间:考察经一定时间发酵并经过不同时间(0、6、12、18、24、30、36 h)酶解后硫苷、植酸含量的变化情况。
1.3.5 底物组成、表面活性剂、初始发酵水分对硫苷、小肽含量及产酶的影响
底物组成:考察发酵底物中麸皮与菜粕的比例(0∶10、1∶9、2∶8、3∶7、4∶6)对发酵后产酶及酶解后硫苷、小肽含量的影响。
表面活性剂:考察含水混合发酵底物中不同吐温80添加量(质量分数0%、0.05%、0.1%、0.15%、0.2%、0.25%)对发酵后产酶及酶解后硫苷、小肽含量的影响。
初始发酵水分:考察不同初始发酵水分(51%、55%、59%、63%、67%、71%)对发酵后产酶及酶解后硫苷、小肽含量的影响。
1.3.6 理化指标测定
硫苷按照氯化钯法[15]测定。
植酸按照文献[16-17]测定。
小肽按照文献[18]测定;蛋白质含量测定按照凯氏定氮法。
酸性蛋白酶活按照文献[19]测定。
CMC酶活按照文献[20]测定。
1.3.7 数据分析
采用SPSS 22.0进行单因素方差分析,用Duncan检验法进行显著性多重比较,试验结果采用平均值±标准误差表示,以P<0.05作为差异性显著判断标准。
2 结果与分析
2.1 发酵时间对硫苷、植酸含量变化的影响
如表1所示,经过酶解后,硫苷,植酸含量相比于单步固态发酵明显降低,且发酵时间对降解硫苷、植酸的影响十分明显。发酵前36 h,硫苷、植酸含量基本不变,发酵至48 h时硫苷含量降至最低;当发酵时间超过48 h,植酸含量随发酵时间的增加而下降,但硫苷含量随发酵时间增加。将经过各时间发酵后的菜粕进一步酶解,相比于单步发酵,除发酵12 h外,硫苷、植酸含量均明显降低。发酵48 h后继续酶解24 h,硫苷含量降至最低,相比于固态发酵降低了30.51%,植酸含量降解至1 mg/g以下。
表1 发酵时间对降解硫苷、植酸含量的影响
Table 1 Effect of fermentation time on degrading glucosinolates and phytic acid
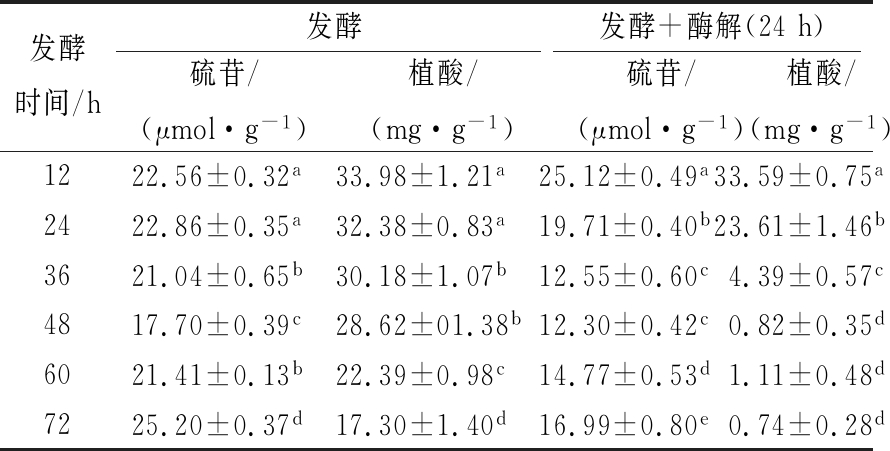
发酵时间/h发酵发酵+酶解(24h)硫苷/(μmol·g-1)植酸/(mg·g-1)硫苷/(μmol·g-1)植酸/(mg·g-1)1222.56±0.32a33.98±1.21a25.12±0.49a33.59±0.75a2422.86±0.35a32.38±0.83a19.71±0.40b23.61±1.46b3621.04±0.65b30.18±1.07b12.55±0.60c4.39±0.57c4817.70±0.39c28.62±01.38b12.30±0.42c0.82±0.35d6021.41±0.13b22.39±0.98c14.77±0.53d1.11±0.48d7225.20±0.37d17.30±1.40d16.99±0.80e0.74±0.28d
注:同列数据肩标不同小写字母表示差异显著(P<0.05)。下同。
发酵前36 h,黑曲霉产生降解硫苷、植酸的酶量少,经酶解后只有少量硫苷、植酸被降解;发酵至36~48 h,黑曲霉大量分泌降解硫苷、植酸的酶,经酶解后硫苷、植酸均降至最低水平;发酵60~70 h后酶解,硫苷含量相比于发酵48 h后酶解显著增加(P<0.05)。到发酵后期,碳水化合物被大量消耗,蛋白质成分富集[21],也可能导致硫苷含量相对增加。发酵48 h后酶解的硫苷、植酸含量均处于最低水平,因此选择48 h为最佳发酵时间。
2.2 酶解时间对硫苷植酸含量变化的影响
将发酵的菜粕继续酶解后,硫苷和植酸进一步被降解,结果如表2所示。经过6 h酶解后,相比于黑曲霉单独发酵48 h,植酸含量降低了69.88%;酶解12 h后,植酸含量从1.40%降低至0.1%以下,王晓东等[22]使用黑曲霉单步固态发酵菜粕将植酸从2.81%降低至0.63%,本研究结果优于王晓东等[22]的研究结果。酶解前12 h,硫苷降解速率较快,12 h后降解速率相对减慢。可能是由于12 h后,可降解的底物浓度减少且45 ℃保温时间过长使相关酶酶活下降,从而导致硫苷降解速率下降。当经过24 h酶解后,硫苷含量降低至12.13 μmol/g,且不随酶解时间增加而变化(P>0.05)。
表2 酶解时间对降解硫苷、植酸含量的影响
Table 2 Effect of enzymatic hydrolysis time on degrading glucosinolates and phytic acid

酶解时间/h硫苷/(μmol·g-1)植酸/(mg·g-1)018.52±0.67a27.32±0.79a615.86±0.51b8.23±0.93b1214.03±0.54c0.77±0.31c1813.74±0.71c0.69±0.17c2412.13±0.37d0.87±0.35c3012.79±0.48cd0.97±0.39c3611.98±0.52d0.57±0.23c
发酵过程中,黑曲霉产生的植酸酶可能受到温度及底物平衡等条件限制导致植酸降解效果不好。当酶解温度升高时,植酸酶分解植酸的能力也有较显著的提高,且植酸的降解不受黑曲霉生长代谢影响,因而使得大量植酸易在短时间内被分解。与降解植酸不同,可能在黑曲霉固态发酵过程中产生的分解硫苷的酶类有限[23],因此在酶解过程中不能将硫苷完全降解。再经过24 h酶解后硫苷和植酸含量均不再发生变化,因而选择酶解24 h为最佳酶解时间。由于经酶解后,植酸几乎完全降解,因此后续研究主要通过优化菌酶协同条件进一步降解硫苷,同时提高小肽含量。
2.3 底物组成对降解硫苷提高小肽含量的影响
麸皮作为一种良好的碳源及营养物质,适量混入菜粕中能使底物变得疏松透气,有利于黑曲霉在发酵过程中生长产酶[24]。如图1-a所示,麸皮∶菜粕=2∶8和3∶7时,黑曲霉发酵酶解后硫苷含量差异不显著(P>0.05),且当麸皮∶菜粕=3∶7时,菜粕中的小肽含量最高(P<0.05)。如图1-b所示,麸皮∶菜粕=3∶7时,黑曲霉发酵后蛋白酶活最高,因此麸皮∶菜粕=3∶7可能是黑曲霉生长产酶最适碳氮比。因为麸皮∶菜粕=3∶7时黑曲霉产蛋白酶活最高,所以酶解后小肽含量也最高。当麸皮比例超过底物的40%后,可能因为麸皮的添加量增大使得发酵底物中硫苷及可降解的大分子蛋白质含量相对减少,导致硫苷及小肽含量均呈现下降趋势。综上,麸皮∶菜粕=3∶7有利于降解硫苷及提高小肽含量和产酶量,因此确定麸皮与菜粕的比例为3∶7。
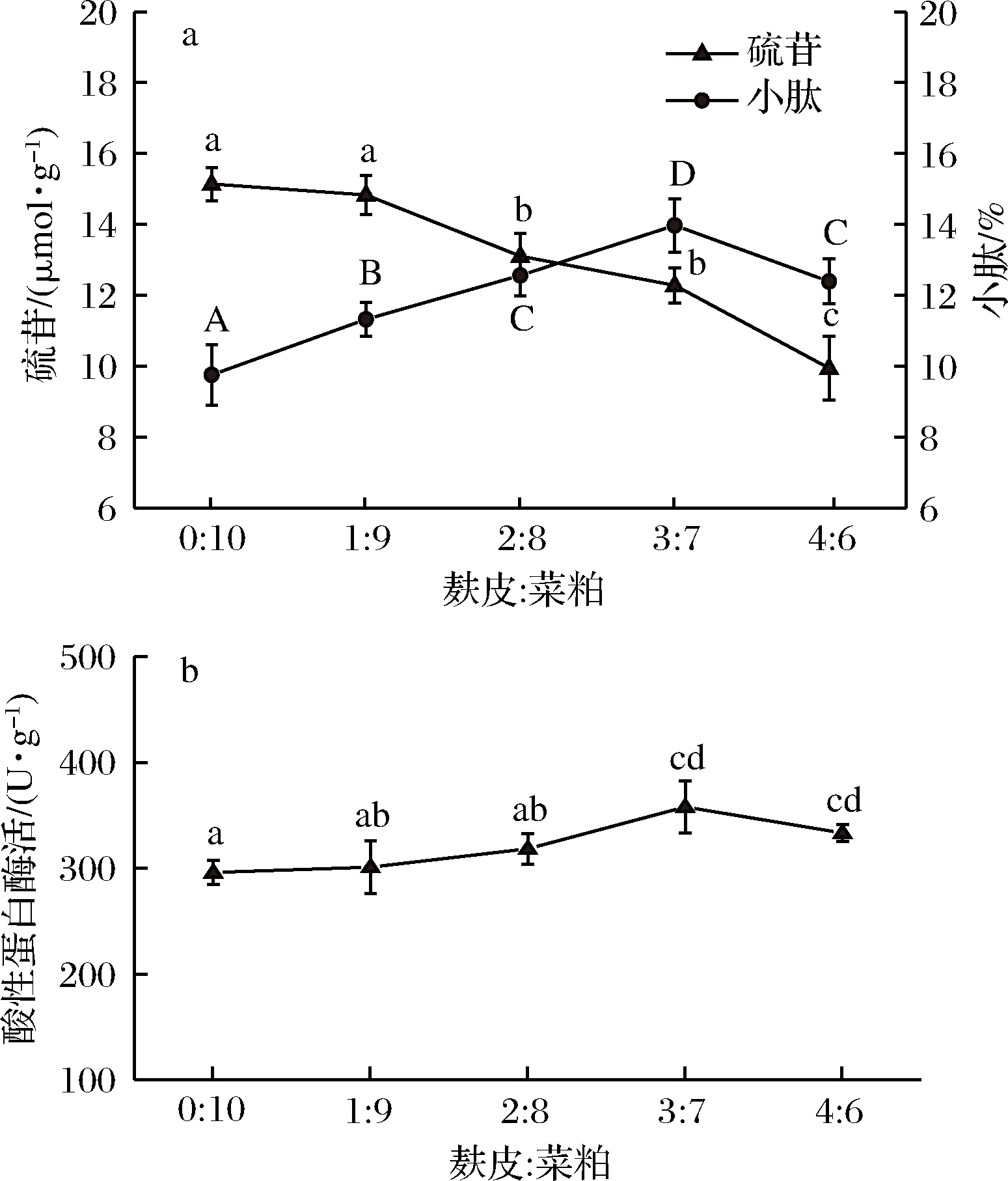
图1 底物组成对硫苷、小肽含量及蛋白酶活的影响
Fig.1 Effect of substrate composition on glucosinolates,small peptide content and protease activity
2.4 添加表面活性剂对降解硫苷,提高小肽含量的影响
在菜粕与麸皮的混合底物中加入适量的吐温80有利于提高蛋白酶酶活和小肽含量,结果如图2-a所示。当在麸皮菜粕混合底物中添加0.05%的吐温80进行发酵酶解后,小肽含量明显增加,相比于未添加吐温80,小肽含量提高了42.66%,但硫苷含量无明显差异(P>0.05),可能由于菜粕中剩余的硫苷种类无法被此株黑曲霉产生的酶分解,因此硫苷含量变化不大。图2-b结果表明,小肽含量变化与蛋白酶活变化趋势相似。黑曲霉在含有0.05%~0.2%吐温80的混合底物发酵后,酸性蛋白酶显著提高,再经酶解后,菜粕中大分子蛋白质进一步被分解为小分子肽,因此小肽含量显著提高。由于添加0.05%~0.2%的吐温80对小肽及硫苷含量无显著影响(P>0.05),因此确定吐温80最适添加量为0.05%。
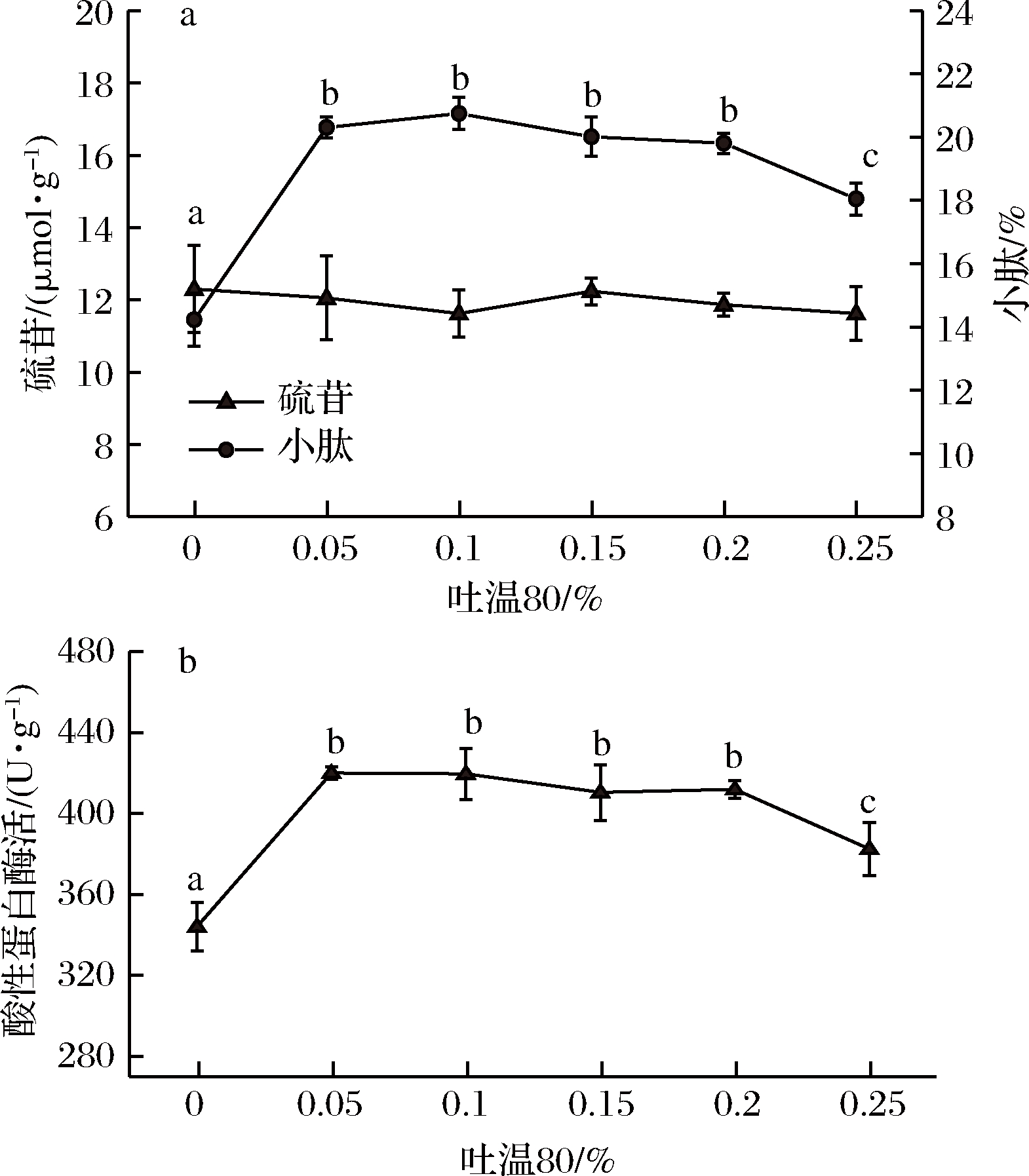
图2 吐温80添加量对硫苷、小肽含量及蛋白酶活的影响
Fig.2 Effect of addition of tween 80 on glucosinolates,small peptide content and protease activity
2.5 初始发酵水分对降解硫苷提高小肽含量的影响
如图3-a所示,当初始发酵水分低于67%时,小肽含量随水分增加而增加,当水分超过67%时,小肽含量明显下降(P<0.05)。初始水分在55%~71%,经发酵酶解后,硫苷含量无明显变化(P>0.05)。图3-b结果表明,初始水分的变化对蛋白酶活的影响不显著(P>0.05),且酶解后,小肽含量的变化与蛋白酶活的变化趋势不同。根据WANG等[25]报道,菜粕中的蛋白质被纤维素形成的结构所包裹,在酶解过程中,小肽的产生可能也受纤维素酶影响。因此当水分过高时,纤维素酶活力下降(图3-b),导致酶解后小肽含量下降。虽然黑曲霉于67%的初始水分发酵酶解后小肽含量最高,但由于水分过高,底物结团严重,且易污染杂菌,不利于扩大生产,因此确定最佳的初始发酵水分为59%~63%,为方便后续试验,确定最佳初始发酵水分为60%。
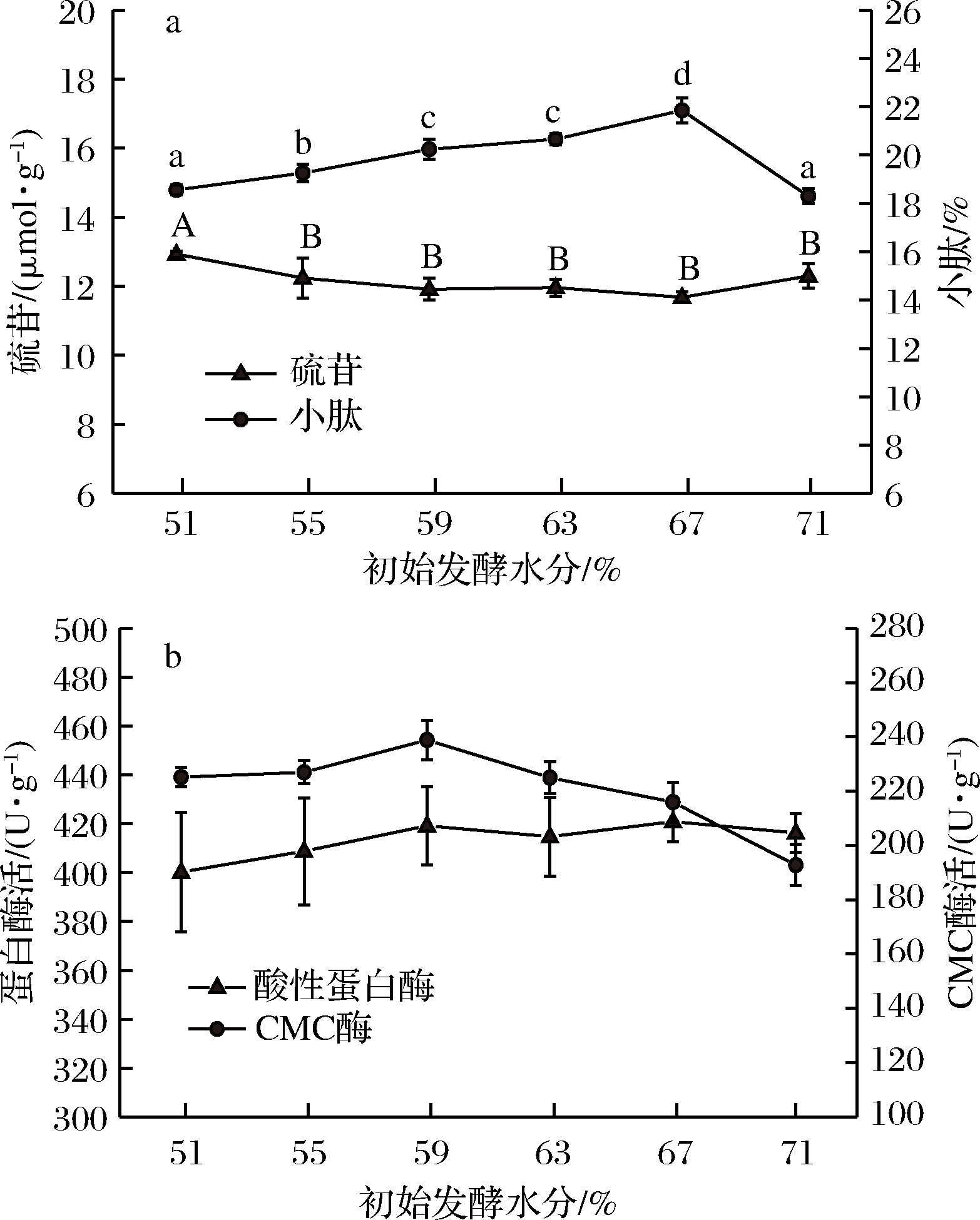
图3 初始发酵水分添加量对硫苷、小肽含量及蛋白酶、CMC酶酶活的影响
Fig.3 Effect of initial fermentation moisture on glucosinolates,small peptide content and protease,CMCase activity
2.6 灭菌和不灭菌对发酵酶解后营养成分和抗营养因子含量的影响
表3结果表明,黑曲霉在灭菌与不灭菌的菜粕麸皮混合培养基(初始发酵水分60%、吐温80添加量0.05%)中发酵酶解后,除小肽含量外,硫苷、植酸、粗蛋白含量均无明显差异(P>0.05)。
表3 灭菌与不灭菌对发酵酶解后营养成分和抗营养因子含量的影响
Table 3 Effect of non-sterile and sterile conditions on antinutritional and nutritional components
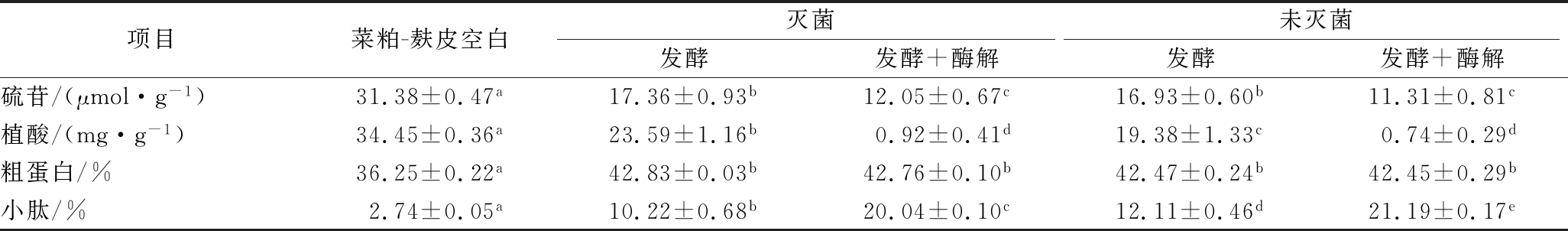
项目菜粕-麸皮空白灭菌未灭菌发酵发酵+酶解发酵发酵+酶解硫苷/(μmol·g-1)31.38±0.47a17.36±0.93b12.05±0.67c16.93±0.60b11.31±0.81c植酸/(mg·g-1)34.45±0.36a23.59±1.16b0.92±0.41d19.38±1.33c0.74±0.29d粗蛋白/%36.25±0.22a42.83±0.03b42.76±0.10b42.47±0.24b42.45±0.29b小肽/%2.74±0.05a10.22±0.68b20.04±0.10c12.11±0.46d21.19±0.17e
同时结果表明,未灭菌发酵对硫苷、植酸的降解及小肽含量的提高效果均优于灭菌后发酵,推测由于灭菌后导致培养基中部分营养成分流失,使得黑曲霉发酵效果变差。最终经未灭菌的麸皮菜粕混合培养基发酵酶解后,硫苷含量从31.38 μmol/g降解为11.31 μmol/g,植酸含量从34.45 mg/g降低至1 mg/g以下,小肽含量提高至21.19%,占粗蛋白含量的49.92%。
3 结论
通过对发酵、酶解时间,发酵酶解、产酶条件优化后,确定了最优固态发酵时间、酶解时间分别为48 h、24 h,菜粕与麸皮比例、吐温80添加量、初始发酵水分分别为7∶3、0.05%、60%。与单步固态发酵相比,经菌酶协同处理的菜粕,硫苷、植酸含量分别降低了33.20%、96.18%;与空白对照相比,硫苷、植酸含量分别降低了63.96%、97%以上;同时,菜粕中小肽含量提高至21.19%,相比于空白和单步发酵分别提高了74.98%和673.36%。综上,菌酶协同处理菜粕后,有效降低了菜粕中抗营养因子硫苷、植酸含量,大幅提高了小肽含量,对扩大菜粕蛋白的使用具有重要意义。
[1] 陈佳毅,叶元土,张伟涛,等.双低菜粕是水产饲料中的优质植物蛋白源[J].饲料研究,2008(2):58-60.
[2] 倪海球,杨玉娟,于纪宾,等.挤压膨化加工对菜籽粕中抗营养因子含量及膨化菜籽粕对生长育肥猪生长性能的影响[J].动物营养学报,2017,29(7):2 295-2 306.
[3] 贺永惠,王清华,刘长忠,等.蒸汽爆破参数对菜籽粕中总硫苷脱毒效果的影响[J].动物营养学报,2017,29(2):529-535.
[4] CABAHUG S,RAVINDRAN V,SELLE P H,et al.Response of broiler chickens to microbial phytase supplementation as influenced by dietary phytic acid and non-phytate phosphorus contents.I.Effects on bird performance and toe ash[J].British Poultry Science,1999,40(5):660-666.
[5] KIRAN E U,SALAKKAM A,TRZCINSKI A P,et al.Enhancing the value of nitrogen from rapeseed meal for microbial oil production[J].Enzyme &Microbial Technology,2012,50(6-7):337-342.
[6] SINGHANIA R R,PATEL A K,SOCCOL C R.Recent advances in solid-state fermentation[J].Biochemical Engineering Journal,2009,44(1):13-18.
[7] 何小丽,生物发酵法改善菜粕品质的研究[D].武汉:华中农业大学,2015.
[8] 张瑞,吴彩红,凡海佳,等.发酵菜粕中菜籽小肽分离纯化及其体外抗氧化活性研究[J].饲料工业,2014,35(5):28-31.
[9] CROAT J R,BERHOW M A,KARKI B,et al.Conversion of canola meal into a high-protein feed additive via solid-state fungal incubation process[J].Journal of the American Oil Chemists' Society,2016,93(4):499-507.
[10] MAHAJAN A,DUA S.Improvement of functional properties of rapeseed (Brassica campestris var toria)meal by reducing antinutritional factors employing enzymatic modification[J].Food Hydrocolloids,1998,12(3):349-355.
[11] SHI C,HE J,JIE Y,et al.Solid state fermentation of rapeseed cake with Aspergillus niger for degrading glucosinolates and upgrading nutritional value[J].Journal of Animal Science and Biotechnology,2015,6(3):1-7.
[12] 邱良伟,顾拥建,沙文锋,等.复合微生物固态发酵菜籽粕的研究[J].安徽农业科学,2015,43(3):209-211.
[13] 蒋边,潘进权,谢瑞敏,等.固态发酵菜籽粕生产多肽及降解硫苷菌种的筛选[J].食品工业科技,2015,36(24):164-168.
[14] ANDERSEN M R,SALAZAR M P,SCHAAP P J,et al.Comparative genomics of citric-acid-producing Aspergillus niger ATCC 1015 versus enzyme-producing CBS 513.88[J].Genome Research,2011,21(6):885-897.
[15] 吴正可,刘国华,蔡辉益,等.硫甙脱毒菌株的筛选及其发酵菜籽粕的效果[J].动物营养学报,2018,30(1):313-320.
[16] HAUG W,LANTZSCH H.Sensitive method for the rapid determination of phytate in cereals and cereal products[J].Journal of the Science of Food and Agriculture,1983,34(12):1 423-1 426.
[17] NAIR V C,DUVNJAK Z.Reduction of phytic acid content in canola meal by Aspergillus ficuum in solid state fermentation process[J].Applied Microbiology &Biotechnology,1990,34(2):183-188.
[18] SHI C,ZHANG Y,LU Z,et al.Solid-state fermentation of corn-soybean meal mixed feed with Bacillus subtilis and Enterococcus faecium for degrading antinutritional factors and enhancing nutritional value[J].Journal of Animal Science and Biotechnology,2017,8(4):50.
[19] ANSON M L,MIRSKY A E.The estimation of trypsin with hemoglobin[J].The Journal of General Physiology,1933,17(2):151-157.
[20] GHOSE T K.Measurement of cellulase activities[J].Pure and Applied Chemistry,1987,59(2):257-268.
[21] CHEN C C,SHIH Y C,CHIOU P W,et al.Evaluating nutritional quality of single stage- and two stage-fermented soybean meal[J].Asian-australasian Journal of Animal Sciences,2010,23(5):598-606.
[22] 王晓东,麦康森,张彦娇,等.双低菜粕中植酸和单宁的黑曲霉发酵降解及条件优化[J].中国海洋大学学报(自然科学版),2013,43(2):15-22.
[23] WANG X,JIN Q,Tong W,et al.Screening of glucosinolate-degrading strains and its application in improving the quality of rapeseed meal[J].Annals of Microbiology,2012,62(3):1 013-1 020.
[24] BIGELIS R.ChemInform abstract:Solid-phase fermentation:aerobic and anaerobic [J].Cheminform,2010,41(49).
[25] WANG L P,SHEN Q R,YU G H,et al.Fate of biopolymers during rapeseed meal and wheat bran composting as studied by two-dimensional correlation spectroscopy in combination with multiple fluorescence labeling techniques[J].Bioresource Technology,2012,105(2):88-94.