皱纹盘鲍(Haliotis discus hanai)主要出产于我国山东半岛和辽东半岛,是我国北方地区著名的海珍品主要养殖品种之一[1]。皱纹盘鲍在所有鲍品种中,虽然其个体为中等大小,但由于皱纹盘鲍腹足处的肌肉鲜嫩,肉质口感极佳,深受消费者欢迎。目前,我国的皱纹盘鲍主要产业利用方向集中在生鲜及食品热加工等领域,主要产品加工形式相对单一,例如生鲜鲍、冷冻鲍、干鲍、煮制风味鲍、鲍罐头,对于皱纹盘鲍肉质资源的精深加工领域的研究极少。研究表明,皱纹盘鲍的腹足含有丰富的蛋白质,其中,除含有少量胶原蛋白外,大部分为不易被人体消化吸收的大分子蛋白质[2-3]。因此,如何高效地开发利用皱纹盘鲍腹足的蛋白质资源成为当前亟待研究开发的热点。
本研究以成熟的皱纹盘鲍腹足为原料,利用蛋白酶酶解技术及响应面法,设计优化酶解制备皱纹盘鲍抗氧化肽的最佳工艺,探索深加工途径,为皱纹盘鲍腹足蛋白质资源的高效精深加工提供依据。
1 材料与方法
1.1 材料与试剂
成熟的皱纹盘鲍腹足,威海长青海洋科技股份有限公司提供。
酪蛋白、福林酚试剂,北京索莱宝科技有限公司;菠萝蛋白酶、木瓜蛋白酶、碱性蛋白酶、中性蛋白酶,天津诺维信生物技术有限公司;NaOH标准滴定溶液(0.5 mol/L)、HCl标准滴定溶液(0.1 mol/L),天津标准科技有限公司;DPPH标准品,华夏科技有限公司;铁氰化钾、三氯乙酸(TCA)、FeCl3、水杨酸、无水乙醇、维生素C、HCl、KOH、酒石酸钾钠、甲醛(36%)、NaOH、硼酸、H2SO4、CuSO4、K2SO4,国药集团化学试剂有限公司。
1.2 仪器与设备
恒温水浴锅,上海森信实验仪器有限公司;pH计,上海雷磁创益仪器仪表有限公司;UV2800SPC紫外可见分光光度计,苏州江东精密仪器有限公司;电子天平,上海奥豪斯仪器有限公司;分析天平,上海梅特勒;电热恒温鼓风干燥箱,上海博迅实业有限公司医疗设备厂;索氏脂肪提取器,上海洪纪仪器设备厂;台式离心机,上海力康医疗器械有限公司;磁力搅拌器,宁波市群安实验仪器有限公司;消化仪、凯氏定氮仪,上海纤检仪器有限公司;程控箱式电炉,上海精宏实验设备有限公司;电炉,龙口市先科仪器有限公司。
1.3 皱纹盘鲍腹足营养成分分析方法
总蛋白质含量的测定:半微量凯氏定氮法;脂肪测定:索氏抽提法;灰分:炭化灼烧法;水分:恒温干燥法。
1.4 酶解上清液的制备
选择菠萝蛋白酶、木瓜蛋白酶、碱性蛋白酶、中性蛋白酶为水解酶,以酶解上清液的水解度和还原力为评价指标。从冰箱中取出皱纹盘鲍腹足,打浆处理后解冻混匀,称取5 g原料加蒸馏水配制成500 mL溶液,并按上述4种酶制剂产品标注的最适条件充分酶解后,100 ℃加热灭酶,直至冷却至室温,4 000 r/min离心10 min,取离心后的酶解上清液备用[4-5]。
1.5 最佳用酶的筛选
1.5.1 多肽得率的测定[6]
1.5.2 水解度的测定
(1)酶解液中总氮含量的测定:GB 5009.5。
(2)酶解液中氨基酸态氮含量的测定:GB 5009.235。
(3)水解度按公式(1)计算:
水解度![]()
(1)
1.5.3 还原力的测定[7]
取酶解上清液1.0 mL于洗净干燥的离心管中,加入pH 6.6,1.0 mL 0.2 mol/L磷酸盐缓冲液,然后加入1.0 mL的1%(体积分数)铁氰化钾溶液,摇匀后将离心管置于50 ℃的恒温水浴锅中加热2 min,将K3Fe(CN)6还原为K4Fe(CN)6·3H2O。结束加热之后,取出离心管立即制冷放凉,加入1.0 mL的10%(体积分数)TCA溶液,充分反应之后,于4 000 r/min条件下离心5 min。取上清液2.0 mL,依次加入2.0 mL蒸馏水与0.8 mL的0.1%(体积分数)的FeCl3溶液,混合均匀,静置10 min之后,于700 nm波长处测定吸光值,其值即可表征产物的还原能力。Vc代替样品作为阳性对照,所有反应条件同上。并用蒸馏水作为空白调零。
1.5.4 DPPH·清除率的测定[7-8]
准确称取一定量DPPH·标准品,用氯仿配制成2 mol/L溶液,然后用无水乙醇将其稀释成0.1 mmol/L的DPPH·储备溶液。分别按不同浓度吸取0.4 mL各酶解上清液,再加入0.4 mL的DPPH·储备溶液,充分混匀后作为样品组A;吸取不同浓度范围的酶解上清液0.4 mL,再加入0.4 mL无水乙醇,充分混匀后作为对照组A1;吸取0.4 mL的蒸馏水,加入0.4 mL的DPPH·,混匀后作为空白组A0,然后在室温条件下避光反应,放置30 min,将反应后的溶液置于离心机中,在8 000 r/min条件下离心10 min。取离心后的上清液在517 nm波长处测定吸光值。同时用Vc作为该实验的阳性对照,如公式(2)所示:
DPPH·清除率![]()
(2)
1.6 酶解工艺的优化
根据单因素预实验选择主要因素为酶解时间、酶解温度、pH,以DPPH·清除率为响应值,分别对每个影响因素选取3个水平。按照曲面响应相应的实验组合设计表进行实验,对所有实验数据进行二次回归拟合,得到多元二次回归方程,并分析各因素产生的主效应和交互效应,在一定的水平范围内求最佳值[9-11]。Box-Benhnken实验设计因素水平表见表1。
表1 响应面实验因素水平表
Table 1 Factors and levels of response surface experiments
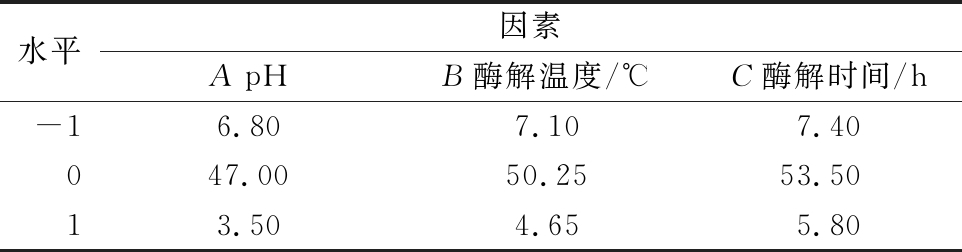
水平因素ApHB酶解温度/℃C酶解时间/h-16.807.107.40047.0050.2553.5013.504.655.80
2 结果与分析
2.1 皱纹盘鲍腹足营养成分分析
皱纹盘鲍腹足的基础营养成分见表2。
表2 皱纹盘鲍腹足营养成分 单位:%
Table 2 Nutritional composition of abdomen of Haliotis discus
总蛋白质脂肪水分灰分18.770.9474.652.17
李苹苹[12]曾测定几种贝类的蛋白质含量:栉孔扇贝12.30%、文蛤10.70%、太平洋牡蛎9.83%和毛蚶8.20%;另外,据相关文献论证杂色鲍、绿鲍、皱纹盘鲍腹足的蛋白质含量分别为20.36%、21.63%、16.87%左右[13-14]。由表2可知,本实验中皱纹盘鲍腹足的蛋白含量测定结果为18.77%,相比之下,蛋白质含量高于上述其他贝类,且与上述研究中的其他品种鲍鱼的蛋白质含量大致相同。由此可见,皱纹盘鲍属于高蛋白类贝类,是制备抗氧化肽酶解液的理想原料。
2.2 最佳蛋白酶的筛选
不同蛋白酶对鲍腹足的作用位点和作用环境不同,所获得的多肽肽链长短及性质不同[15],酶解相同的原料,会产生不同的短肽,因此对于酶解同一种原料而言,最优蛋白酶的筛选成为本实验的关键点。
2.2.1 不同蛋白酶对水解度的影响
水解度即蛋白质被水解的肽键数占蛋白质水解的总肽键数的百分数[16]。由图1可知,中性蛋白酶和碱性蛋白酶在前3 h迅速酶解蛋白质,水解度迅速升高。木瓜蛋白酶和菠萝蛋白酶在1 h内迅速酶解蛋白质,在1~2 h酶解速度放缓,2~3 h酶解蛋白质速度又迅速升高,水解度也随之迅速升高。在酶解6 h之后,4种蛋白酶酶解液的水解度逐渐趋于稳定,说明对皱纹盘鲍腹足蛋白质的酶解反应基本完成,此时,中性蛋白酶的水解度最高,达到20.11%,碱性蛋白酶水解度最低,为15.96%,菠萝蛋白酶和木瓜蛋白酶的水解度分别为18.91%、16.95%。
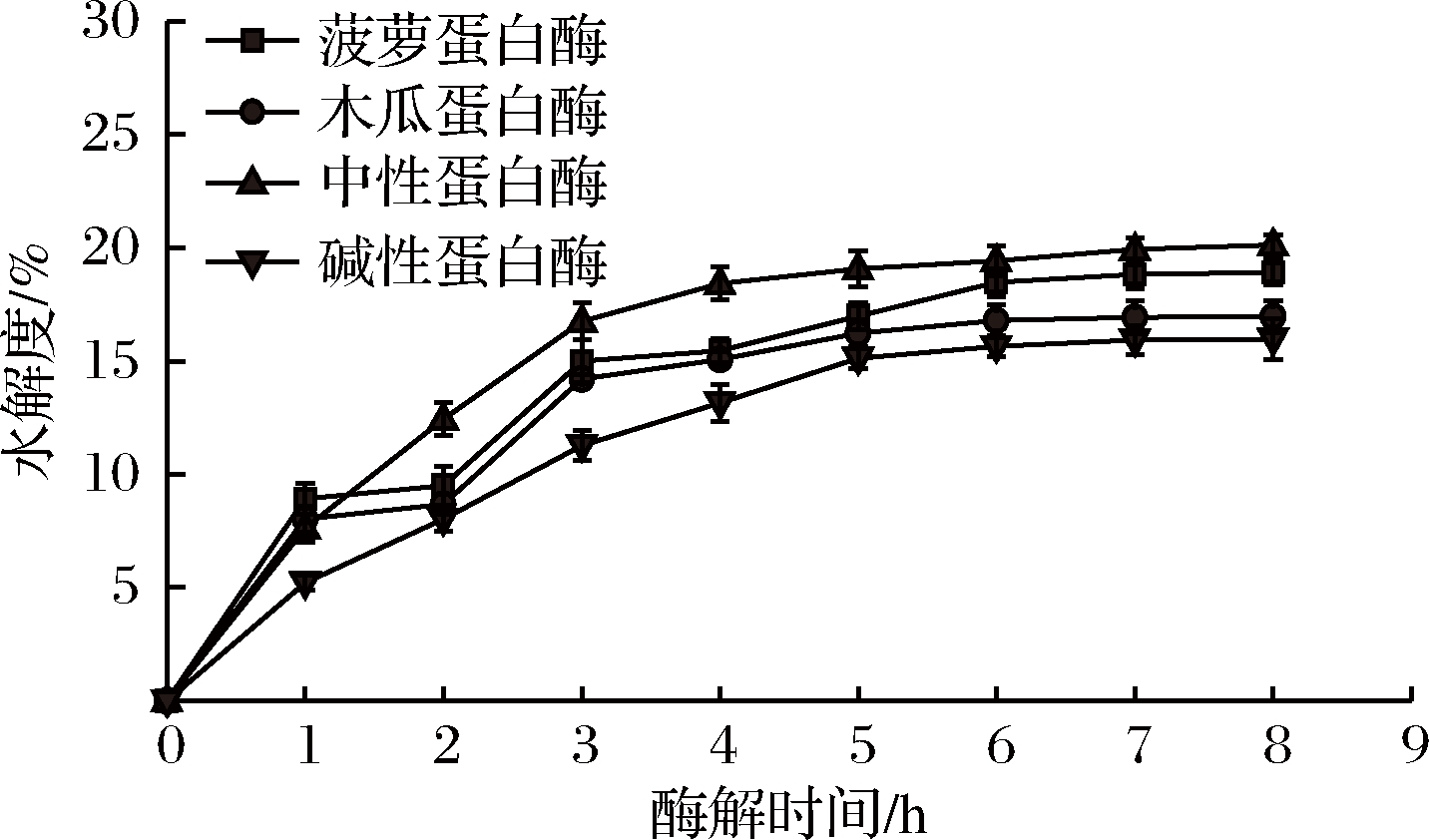
图1 不同蛋白酶对水解度的影响
Fig.1 Effect of different proteases on degree of hydrolysis
2.2.2 不同蛋白酶对多肽得率的影响
多肽得率是不同蛋白酶对皱纹盘鲍腹足蛋白质的酶解程度的象征性指标,同时也是反映抗氧化肽酶解液中多肽含量的重要指标之一[10,17]。酶解1 h内,4种蛋白酶的多肽得率迅速增加,1 h后仍在逐渐增加直至趋于稳定。文献显示,蛋白酶酶解产生的多肽会被进一步分解成氨基酸[6],酶解5 h后,菠萝蛋白酶的多肽得率降低可能是上述原因所致。6 h后,中性蛋白酶的多肽得率持续升高,至8 h时,多肽得率达到最高,为72.16%,碱性蛋白酶的多肽得率最低,仅为55.93%(图2)。
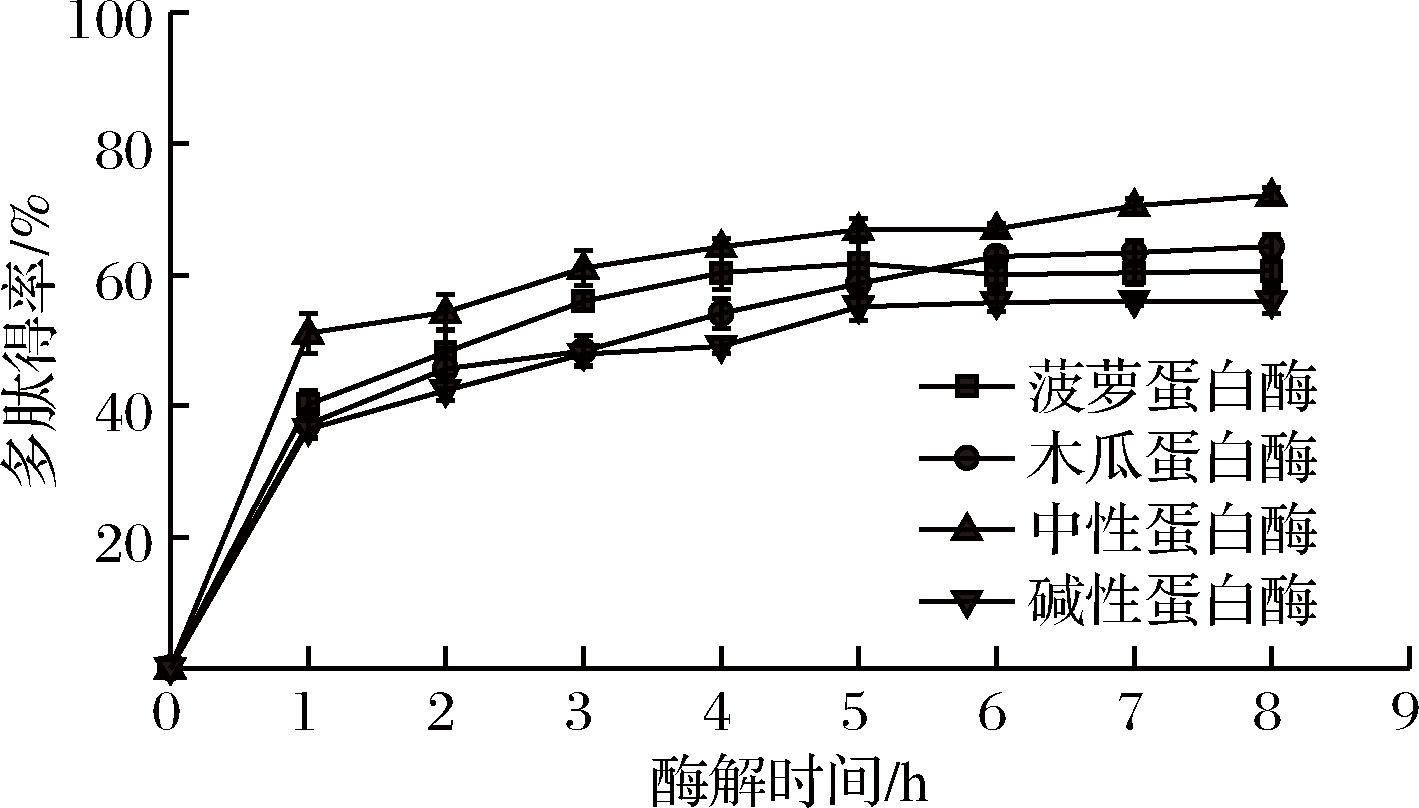
图2 不同蛋白酶对多肽得率的影响
Fig.2 Effect of different proteases on polypeptide yield
2.2.3 不同蛋白酶对还原力的影响
从图3可以看出,随着酶解时间的延长,还原力均不断提高,说明部分氨基酸和抗氧化肽的抗氧化活性较强[18]。酶解前4 h,随酶解时间延长,酶解产物的还原力逐渐提高,木瓜蛋白酶的酶解产物还原力在酶解1 h后提升速率变缓:酶解4 h后,中性蛋白酶和碱性蛋白酶的升高速率均呈现先升高后降低的趋势,中性蛋白酶酶解液在酶解7 h还原力达到最高,为0.589;碱性蛋白酶酶解液在酶解第6 h还原力达到最高,为0.578。由此可见,中性蛋白酶和碱性蛋白酶酶解液的还原力相差不大,但是碱性蛋白酶需要较高的酶解pH条件,考虑到工业成本选用中性蛋白酶(图3)。
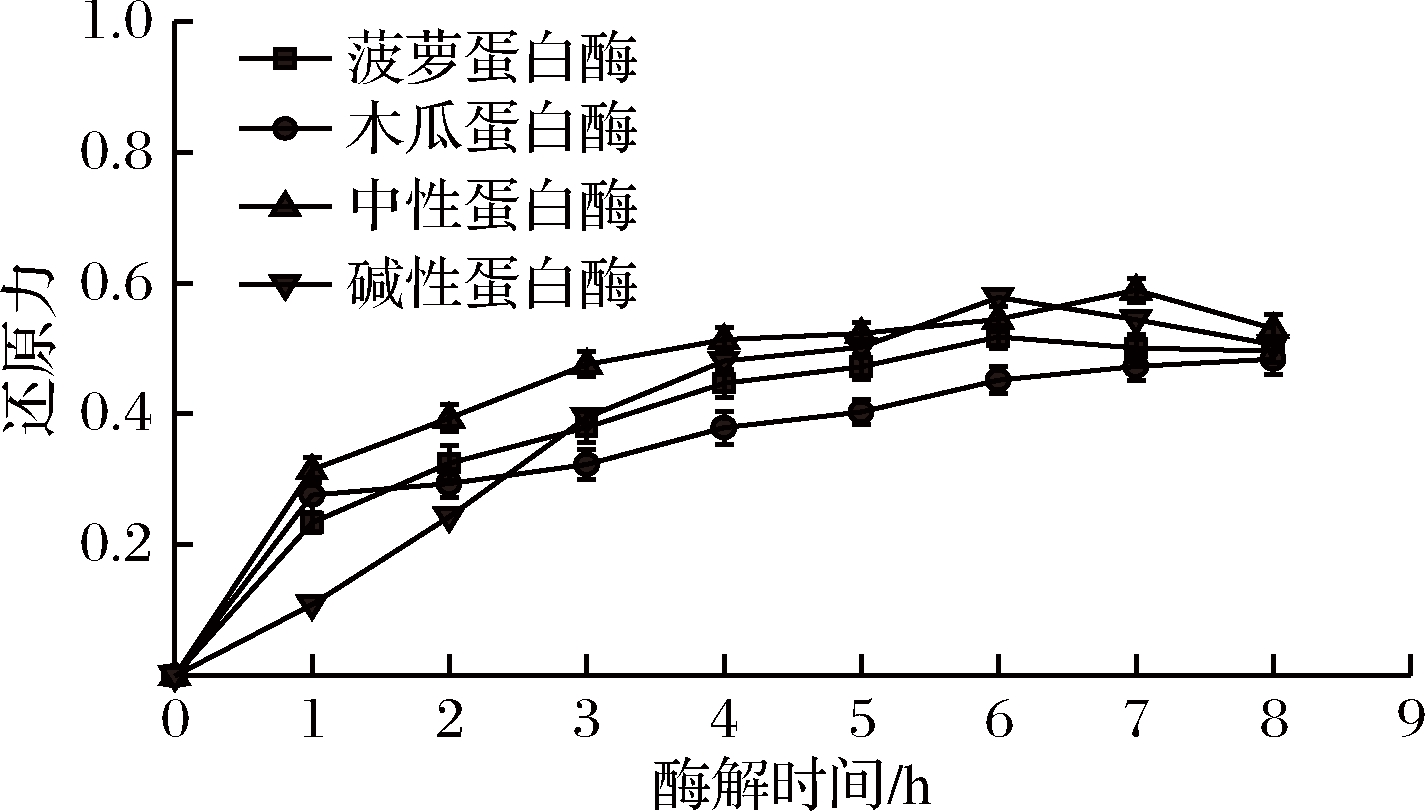
图3 不同蛋白酶对还原力的影响
Fig.3 Effect of different proteases on reducing capacity
2.2.4 不同抗氧化肽酶解液对DPPH·的清除作用
DPPH·清除率是研究蛋白酶水解产物的体外抗氧化活性的一项重要指标[19]。如图4所示,4种抗氧化肽酶解液对DPPH·清除作用各不相同,但对DPPH·的清除作用均很强,清除率一直保持在50%以上。中性蛋白酶酶解液的DPPH·清除率保持最高,5 h时达到最高,为95.63%;菠萝蛋白酶和木瓜蛋白酶均在酶解3 h时达到最高,分别为83.97%和89.63%;碱性蛋白酶在6 h时达到最高,为83.36%。
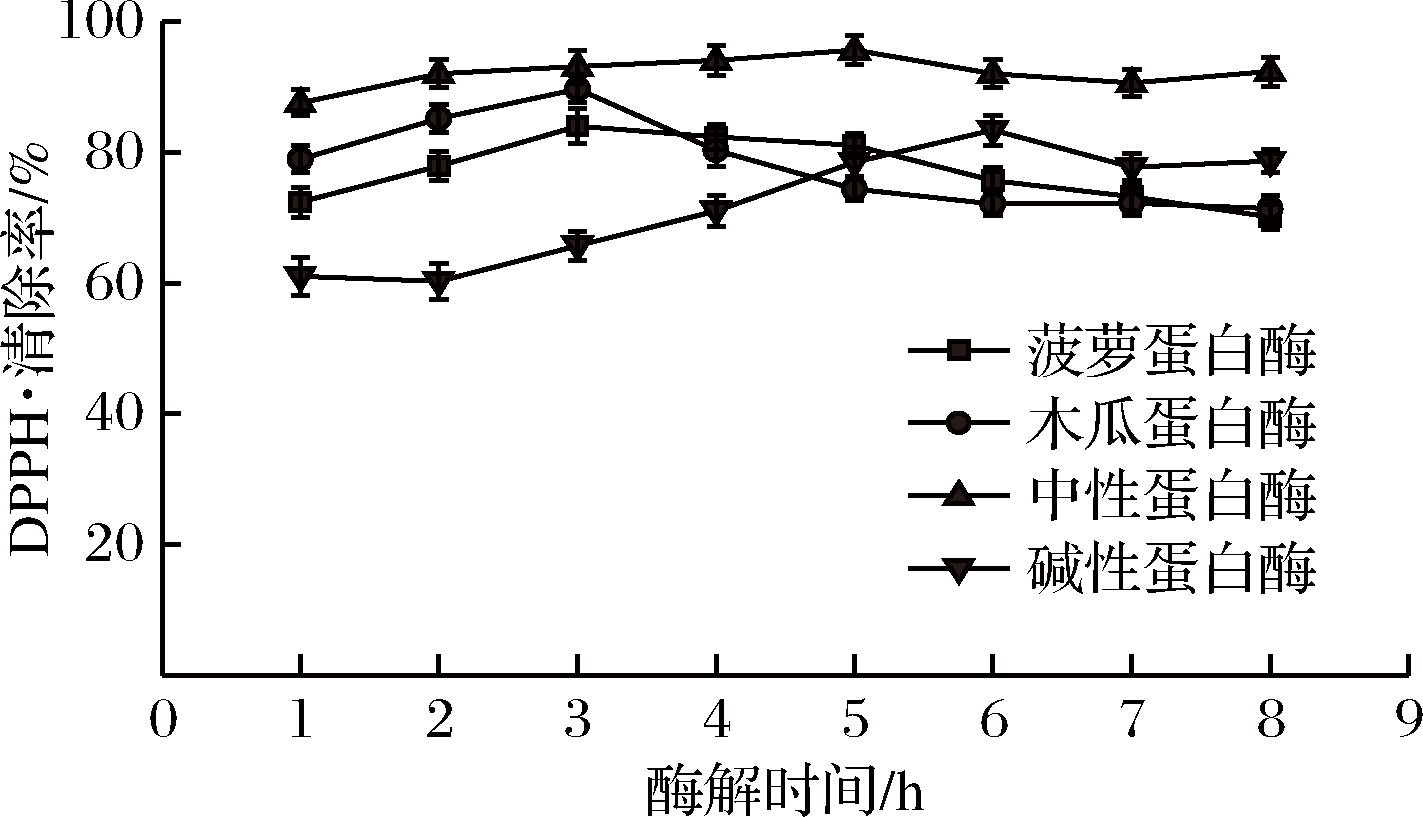
图4 不同抗氧化肽酶解液对DPPH·的清除作用
Fig.4 Clearance of DPPH· by different antioxidant peptidyl hydrolysate
综合以上分析,中性蛋白酶和菠萝蛋白酶酶解产生的抗氧化肽酶解液具有较高的水解度,中性蛋白酶和碱性蛋白酶酶解产生的抗氧化肽酶解液具有较高的还原力,但中性蛋白酶酶解液对DPPH·的清除作用明显优于另外3种。考虑成本,选择中性蛋白酶。
2.3 响应面工艺优化
2.3.1 响应面实验设计及结果
综合预实验中单因素所得结果,以DPPH·清除率为响应值,选取3个影响最大的因素:酶解时间、酶解温度、pH,优化中性蛋白酶酶解皱纹盘鲍腹足的工艺。Box-Behnken组合实验设计及结果见表3。
表3 Box-Behnken实验设计及结果
Table 3 Results of response surface experiments
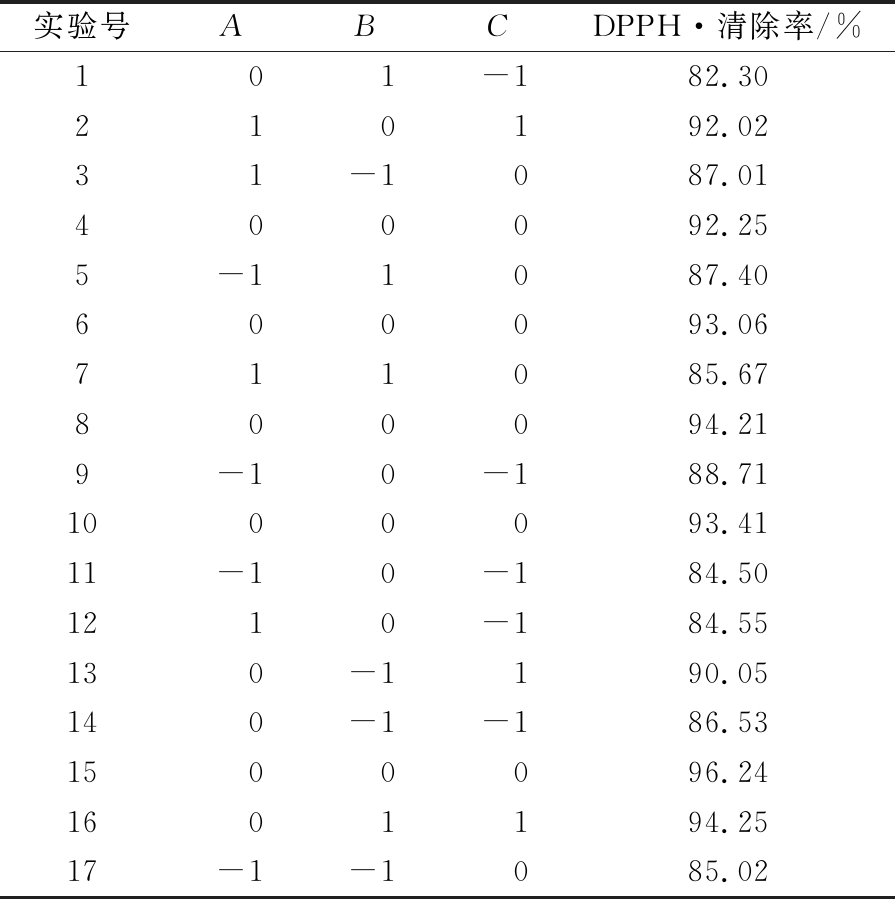
实验号ABCDPPH·清除率/%101-182.30210192.0231-1087.01400092.255-11087.40600093.06711085.67800094.219-10-188.711000093.4111-10-184.501210-184.55130-1190.05140-1-186.531500096.241601194.2517-1-1085.02
运用Design Expert软件,对以上17个实验点响应值进行二次回归分析,经回归拟合后,得到以下多元回归方程:
Y=93.83+0.45A+0.13B+3.39C-0.93AB+0.82AC+2.11BC-4.20A2-3.36B2-2.19C2
2.3.2 回归模型的建立及分析
如表4回归模型的各项方差分析结果所示,F检验可以反映回归方程的有效性,失拟检验反映所用模型与实验拟合的程度即二者差异的程度,校正决定系数R2用来评价回归方程的优劣,变异系数反映数据离散程度的绝对值[20]。
表4 回归模型显著性分析
Table 4 Analysis of significance with regression model
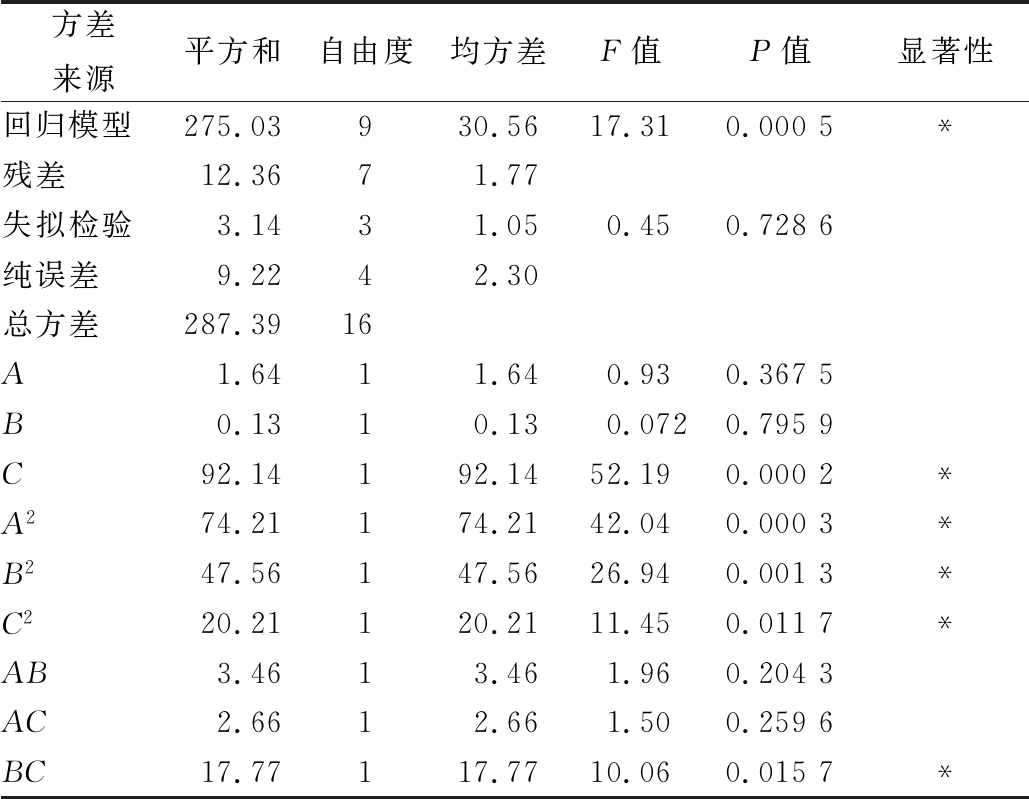
方差来源平方和自由度均方差F值P值显著性回归模型275.03930.5617.310.0005*残差12.3671.77失拟检验3.1431.050.450.7286纯误差9.2242.30总方差287.3916A1.6411.640.930.3675B0.1310.130.0720.7959C92.14192.1452.190.0002*A274.21174.2142.040.0003*B247.56147.5626.940.0013*C220.21120.2111.450.0117*AB3.4613.461.960.2043AC2.6612.661.500.2596BC17.77117.7710.060.0157*
注:校正决定系数R2=0.957 0;*,在P<0.05水平上显著。
本实验设计中,模型F值为17.31,P值<0.05,表明该二次方程模型显著;失拟检验P值>0.05,对模型是有利的,因此可以用该回归方程代替真实实验点对实验结果进行分析。并且,复相关系数R2=0.957 0,这说明该模型的拟合性较好。综合对上述各参数的分析,表明该实验方法可靠,各因素水平的区间设计合理,可以用来对皱纹盘鲍腹足抗氧化肽的制备工艺进行初步分析和预测。
2.3.3 响应面优化分析
图5、图6和图7为回归方程得出的AB、AC、BC之间交互作用的响应面图。
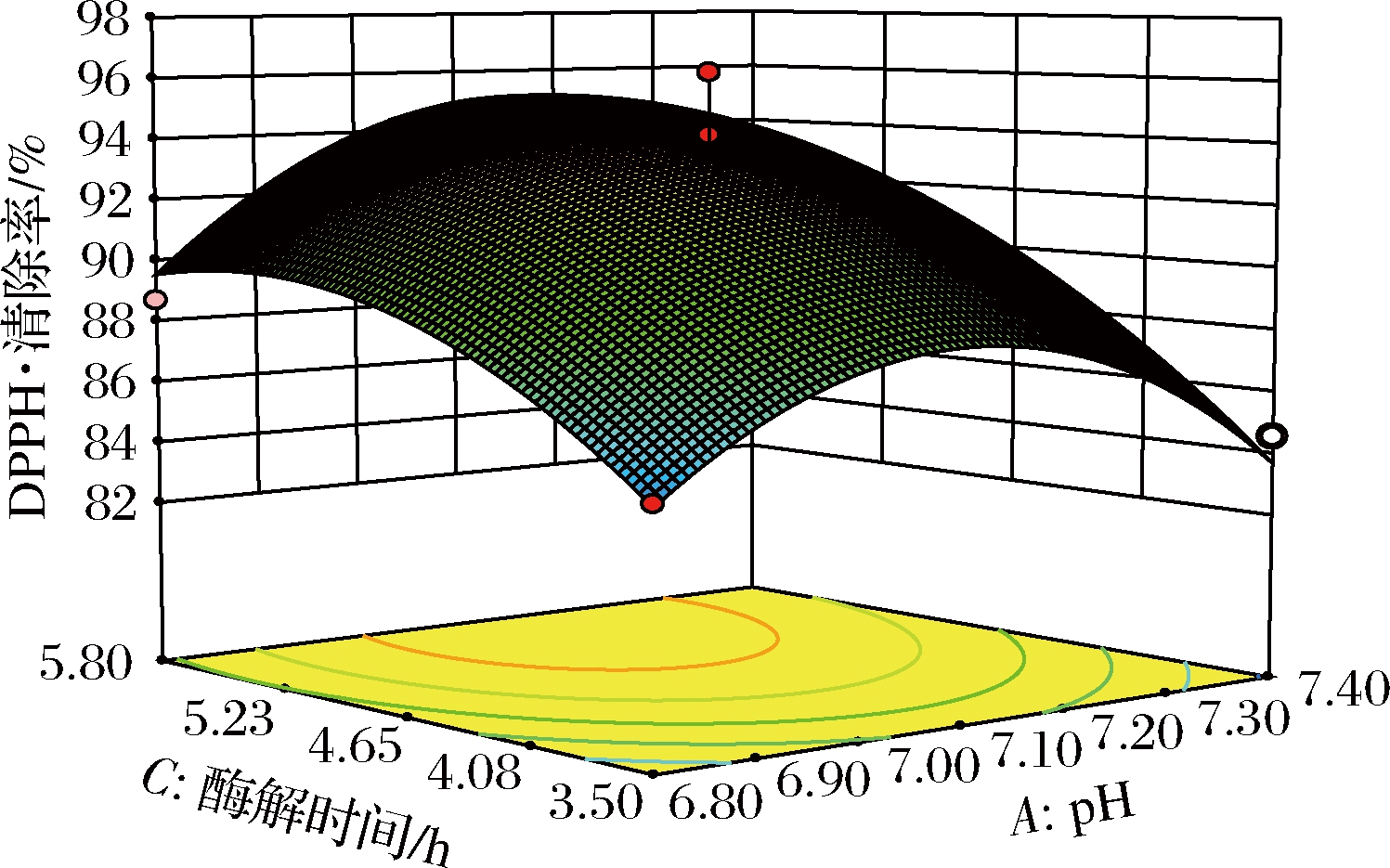
图5 酶解时间与pH对DPPH·清除率影响的响应面图
Fig.5 Response surface diagram of the effect of enzymatic hydrolysis time and pH on DPPH· clearance

图6 酶解温度与pH对DPPH·清除率影响的响应面图
Fig.6 Response surface diagram of the effects of enzymatic hydrolysis temperature and pH on DPPH· clearance
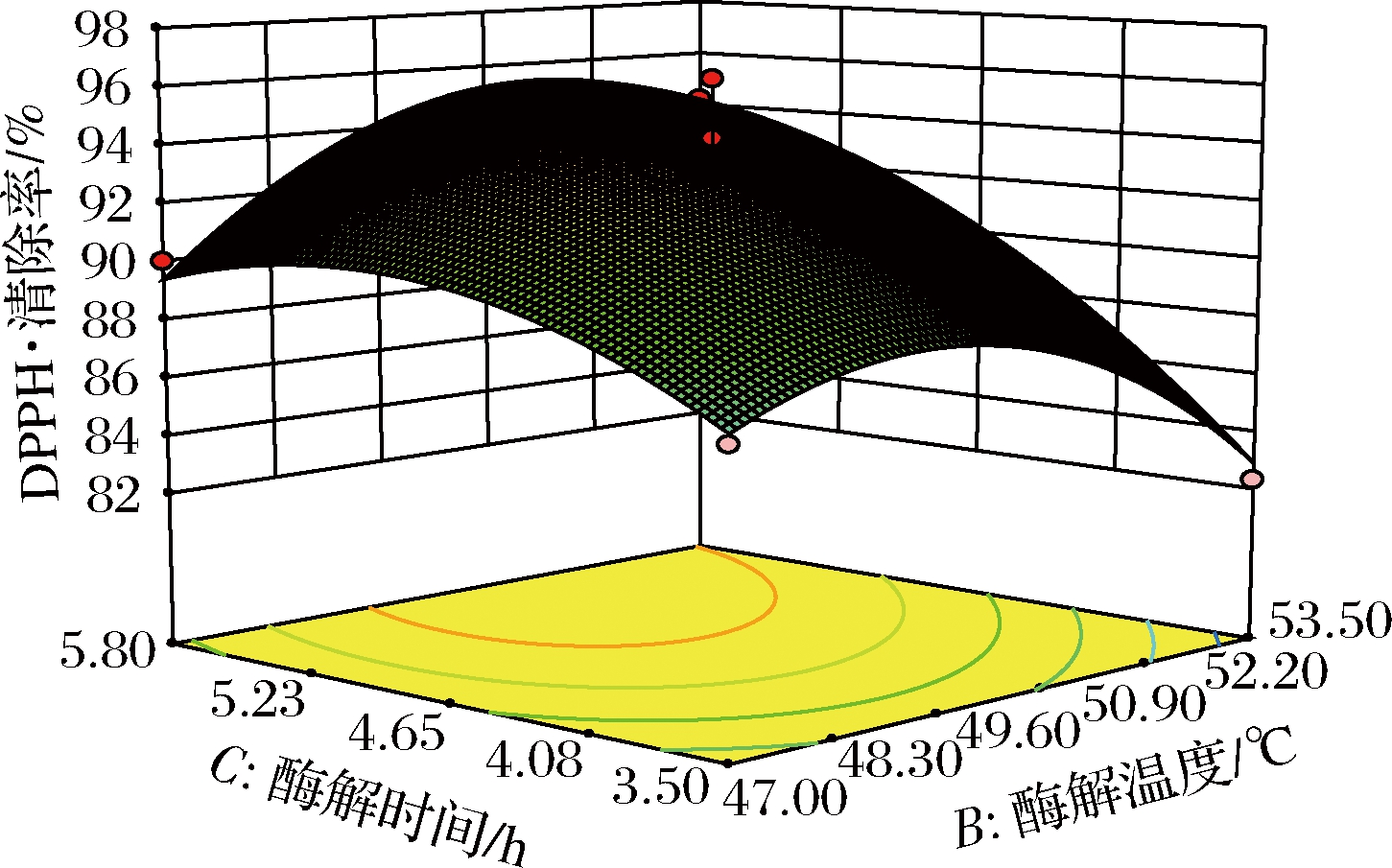
图7 酶解时间和酶解温度对DPPH·清除率影响的响应面图
Fig.7 Response surface diagram of the effects of enzymatic hydrolysis time and hydrolysis temperature on DPPH· clearance
通过对回归方程的求导计算极大值,得到了对应的各主要因素分别为pH 7.10、酶解温度50.25 ℃、酶解时间4.65 h。此条件下,抗氧化肽酶解液的DPPH·清除率的理论最高值为96.24%。
2.3.4 最优酶解工艺条件的验证
采用上述优化后得到的酶解工艺条件:pH 7.10、酶解温度50.25℃、酶解时间4.65 h,进行3次重复实验,得到DPPH·清除率分别为:96.07%、95.88%、96.41%,多肽含量分别为:81.17%、79.93%、80.59%,平均多肽含量为80.56%,平均DPPH·清除率为96.12%,与预测理论值相比,其相对误差仅为0.12%,这说明通过响应面设计实验优化后得出的该回归方程对本实验具有重要的实践指导意义。
3 结论
皱纹盘鲍腹足蛋白质含量高达18.77%,是一种很好的蛋白质利用资源。优化得到皱纹盘鲍腹足抗氧化肽的酶解工艺为:pH 7.10、酶解温度50.25 ℃、酶解时间4.65 h。验证显示,实际值与预测理论值的相对误差仅为0.12%,且平均多肽含量可达到80.56%,说明在该工艺条件下制备出的抗氧化肽酶解液效果较好。本文所研究制备的皱纹盘鲍腹足抗氧化肽是以纯天然的皱纹盘鲍腹足为原材料提取,与传统人工合成的抗氧化剂相比较,其抗氧化性能更加稳定、更加绿色环保,更容易被消费者接受。同时,该研究也可为食品添加剂和化妆品产业带来巨大的商业潜力,为促进皱纹盘鲍腹足的精深加工和开发提供有力的支持。
[1] 郭远明,张小军,严忠雍,等.皱纹盘鲍和杂色鲍肌肉主要营养成分的比较[J].营养学报,2014,36(4):403-405.
[2] 郭战胜,侯旭光,张军伟,等.三种鲍腹足肌胶原多肽抗氧化性研究[J].山东大学学报(理学版),2016,51(11):66-73.
[3] ZHONG M,CHEN T,HU C,et al.Isolation and characterization of collagen from the body wall of sea sucumber Stichopus monotuberculatus[J].Journal of Food Science,2015,80(4):C671-C679.
[4] 陈秀琴.鲍鱼内脏酶解蛋白质制备抗氧化肽的研究[D].福州:福建农林大学,2013.
[5] 姜卉,金文刚,许景光,等.热变性对海参肠酶解物活性的影响[J].食品工业科技,2018,39(14):29-33.
[6] 任佰萍,张铭振,孔繁东,等.扇贝裙边抗氧化肽酶解液的体内体外抗氧化性研究[J].食品工业科技,2013,34(8):290-294.
[7] 金坤.皱纹盘鲍性腺抗氧化肽的制备及其活性分析[D].厦门:集美大学,2014.
[8] 穆姣姣,赵前程,李建伟,等.风味酶辅助下蛤蛋白酶解物自由基清除能力研究[J].食品科技,2011,36(9):50-54.
[9] 曾健辉,朱宝君,王娟,等.响应面法优化酶解海洋低值鱼肉制备抗氧化肽工艺[J].安徽农业科学,2016,44(22):80-83.
[10] 曹荣,李冬燕,刘淇,等.刺参、性腺酶解多肽体外抗氧化作用研究[J].南方水产科学,2013,9(6):47-51.
[11] 梁晓芳,牟建楼,严超,等.响应面优化虾夷扇贝抗氧化肽酶解液工艺研究[J].食品研究与开发,2017,38(20):85-90.
[12] 李苹苹.五种经济贝类的营养成分及蛋白质质量分析[J].食品研究与开发,2014,35(15):99-101.
[13] 刘先进,陈胜军,李来好,等.四种鲍鱼肌肉营养成分分析与品质评价[J].食品与发酵工业,2018,44(5):227-231.
[14] TAHERI A,SABEENA FARVIN K H,JACOBSEN C,et al.Antioxidant activities and functional properties of protein and peptide fractions isolated from salted herring brine[J].Food Chemistry,2014,142:318-326.
[15] 肖桂华,朱蓓薇,董秀萍,等.鲍鱼腹足不同部位的质构特性及组织结构研究[J].食品科技,2010,35(11):155-159.
[16] 李哲,张彬,顾铭,等.贻贝抗菌肽的分离纯化[J].安徽农业科学,2012,40(10):5 768-5 770.
[17] 王一帆.扇贝加工副产物抗氧化活性肽的纯化及性质的研究[D].威海:哈尔滨工业大学,2017.
[18] 郭战胜,侯旭光,张海涛,等.皱纹盘鲍(Haliotis discus hannai)、黑足鲍(Haliotis iris)及其杂交F1代营养成分的比较分析[J].山东大学学报(理学版),2014,49(1):15-19.
[19] 张超,唐志红,赵振军.碱性蛋白酶水解扇贝边条件的优化[J].食品科技,2015,40(1):162-165.
[20] 赵强忠,刘丹.秋刀鱼抗氧化肽制备及其抗氧化活性的研究[J].现代食品科技,2014,30(10):165-171.