L-缬氨酸是人体所必需的8种氨基酸之一,属于分支链氨基酸,是用来合成各类抗体、激素以及酶等的原料,在人体内有特殊的生理功能,是维持生命活动的重要物质[1-2]。任何高级生物都必须通过外源摄取的途径来补充L-缬氨酸,因此,L-缬氨酸在氨基酸生产中具有重要地位[3-4]。在工业生产中,通常是以谷氨酸棒状杆菌作为生产菌株,利用微生物发酵的方法生产L-缬氨酸[5-10]。L-缬氨酸通常作为营养增补剂添加至各类综合氨基酸输液及制剂中,其市场需求量呈逐年上升趋势,然而,目前发酵法生产L-缬氨酸的产量仍未达到理想水平,无法满足庞大的市场需求[11-12]。
胆碱[13]是所有生物膜的组成成分,同时作为乙酰胆碱的前体物质,它在各类生物体的生长发育中均起到了非常重要的调控作用,目前,氯化胆碱的添加在鱼类养殖[14]、作物保护[14]、畜禽类增产[15-17]的方面皆起到了明显的作用。在生物体内,重金属修饰、基因表达的调控、蛋白质功能的调节以及RNA的加工都需要在酶的催化作用下进行甲基化才能实现[18-21]。一分子氯化胆碱携带3个活性甲基基团,在必要的时候能够将甲基提供给高半胱氨酸,合成谷氨酸棒状杆菌生长所必须的蛋氨酸,因此,氯化胆碱的外源添加对谷氨酸棒状杆菌发酵生产L-缬氨酸必然会产生影响[21]。
为探究氯化胆碱在谷氨酸棒状杆菌发酵生产L-缬氨酸过程中的作用,本研究从添加方式以及添加量2个方面出发,旨在验证外源添加氯化胆碱对于工业微生物菌体生长产酸是否具有促进作用,同时初步确定一种合适的添加方法,为谷氨酸棒状杆菌工业化生产L-缬氨酸提供一个可行方案。
1 材料与方法
1.1 菌种
谷氨酸棒状杆菌XV0505(Leu-+Ile-+2-TAr+α-ABr+SGr),天津科技大学代谢工程研究室保藏菌种。
1.2 主要仪器与设备
SBA-40E生物传感分析仪,山东省科学院生物研究所;5 L自动控制发酵罐,上海保兴生物设备工程有限公司;30 L自动控制发酵罐,上海保兴生物设备工程有限公司;KQ-C高压蒸汽发生器,上海奉贤协新机电厂;Agilent1200高效液相色谱仪,Agilents Technologies;Agilent C18(15 mm×4.6 mm,3.5μm),Agilents Technologies;HH-4恒温水浴锅,金坛市科学仪器厂;752分光光度计,上海分析仪器厂;SS-325全自动灭菌锅,日本TOMY仪器有限公司;OLYMPUS生物显微镜,日本OLYMPUS会社;FA2204B电子天平,上海精密科学仪器有限公司。
1.3 培养条件[22]
1.3.1 保藏条件
于-80 ℃环境下,2.8 mol/L的丙三醇溶液中保藏。
1.3.2 活化培养基
牛肉膏10 g/L、蛋白胨5 g/L、酵母粉10 g/L、玉米干粉10 g/L、NaCl 2.5 g/L、KH2PO5 1 g/L、MgSO4·7H2O 0.5 g/L。121 ℃灭菌20 min,制成试管斜面培养基以及200 mL茄型瓶培养基。
1.3.3 种子培养基
葡萄糖30 g/L、KH2PO5 1.5 g/L、MgSO4·7H2O 0.4 g/L、VB1 0.3 mg/L、VH 200 μg/L、玉米干粉20 g/L(121 ℃、20 min单独灭菌)、豆粕水解液10 mL/L、酵母粉5 g/L、微量元素混合液1 mL/L、蛋氨酸1 g/L,115 ℃灭菌15 min。
1.3.4 发酵培养基
葡萄糖80 g/L、KH2PO5 2.5 g/L、MgSO4·7H2O 0.8 g/L、VB1 0.2 mg/L、VH 50 μg/L、玉米干粉16 g/L(121 ℃、20 min单独灭菌)、豆粕水解液20 mL/L、微量元素混合液1 mL/L、谷氨酸5 g/L、亮氨酸 0.22 g/L、异亮氨酸 0.1 g/L、蛋氨酸 0.7 g/L。115 ℃灭菌15 min。
1.4 培养方法[22]
1.4.1 种子活化培养方法
将保藏于-80 ℃甘油管中的菌种涂布于试管斜面中,于32 ℃恒温条件下培养24 h;利用接菌环将试管斜面上的菌落涂布于茄型瓶中,于32 ℃扩大培养24 h。
1.4.2 种子罐培养方法
用无菌水将茄型瓶中的菌体洗脱下来,接种于5 L发酵罐中并最终定容至3 L进行种子培养,温度32 ℃,初始转速200 r/min,通风量2.0 L/min,通过自动流加氨水控制pH 7.0~7.2,以泡敌消泡,通过溶氧反馈调节转速,使得溶氧水平保持在20%~30%,培养14 h左右,菌体生长至OD600为22时接种2.5 L体积于30 L发酵罐中进行发酵。
1.4.3 发酵罐培养方法
定容至13 L,温度32 ℃,初始转速200 r/min,通风量0.5 m3/h,通过自动流加氨水控制pH维持7.0~7.2,以泡敌消泡,通过溶氧反馈调节转速,维持罐内溶氧水平于20%左右,通过一定脉冲比进行流加补糖,控制发酵液内残糖浓度保持在10~15 g/L,培养时间52 h。
1.4.4 氯化胆碱梯度添加控制发酵
以氯化胆碱添加量作为变量,在不同批次发酵培养基底物中分别添加质量浓度为0、0.3、0.5、1、2 g/L的氯化胆碱进行培养,选择最优的浓度,在此基础上采取氯化胆碱随糖流加的方式,同时选择在不同批次的流加糖中添加质量浓度为0、0.3、0.5、1、2 g/L的氯化胆碱进行对比实验。
1.5 分析测定方法[23-25]
每间隔4 h取样,用去离子水稀释样品20倍,在600 nm波长下测定分光光度值,离心取上清液,利用SBA生物传感分析仪测定发酵液内的残糖;电子天平称重并记录每4 h流加补糖的量;梅特勒电极在线实时监测pH、DO、温度,精密pH试纸(6.4~8.0)辅助矫正pH。高效液相色谱法分析测定氨基酸含量,采用Agilent C18色谱柱,衍生剂为2,4-二硝基氟苯,柱前衍生,有机相为50%的乙腈、无机相为4.1 g/L的乙酸钠溶液,柱温33 ℃,流速1 mL/min,检测波长360 nm。
1.6 数据分析
所有试验数据取3次实验的平均值。单因素方差分析之后Dunnet t检验来确定数据差异的显著性(P<0.05)。
2 结果与讨论
2.1 底物中氯化胆碱的不同添加量对发酵菌体量及产酸的影响
如图1和图2所示,在发酵培养基底料中添加了5个不同质量浓度的氯化胆碱,测定了菌体在生长过程中的密度变化以及产量增长。随着底物中氯化胆碱添加量的增加,菌体生长速度也随之增加,当底物中氯化胆碱添加质量浓度提高至0.5 g/L以上时,菌体生长速率变化不明显,所有浓度添加下,最终菌体总量趋于一致,菌液最高OD600nm达到39.56;随着底物中氯化胆碱添加浓度的增加,L-缬氨酸的产量也随之增加,当氯化胆碱添加量提高至0.5 g/L以上时,L-缬氨酸产量随氯化胆碱添加量变化不明显,最终维持在76 g/L左右。
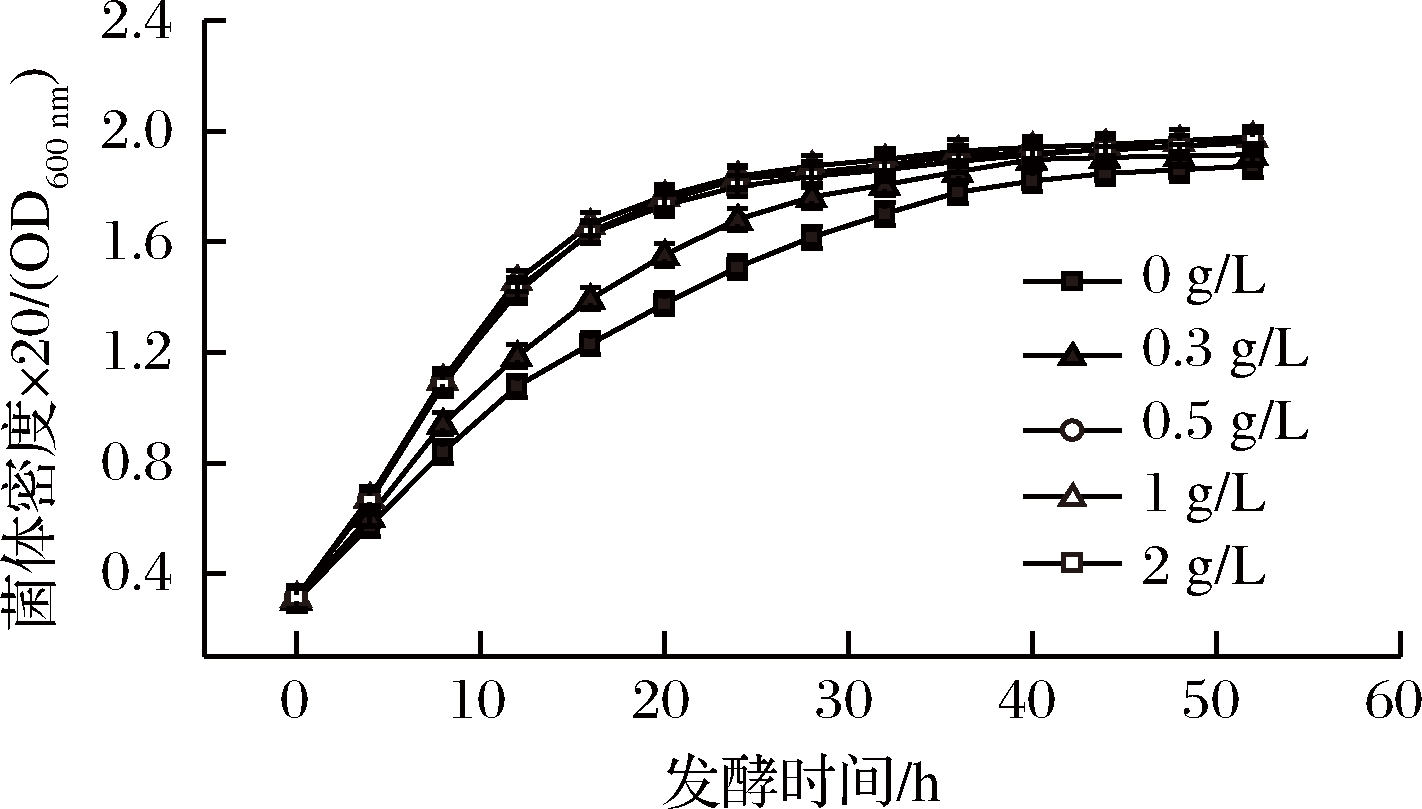
图1 不同氯化胆碱添加量对菌体OD影响
Fig.1 The value of optical density under different contents of choline chloride
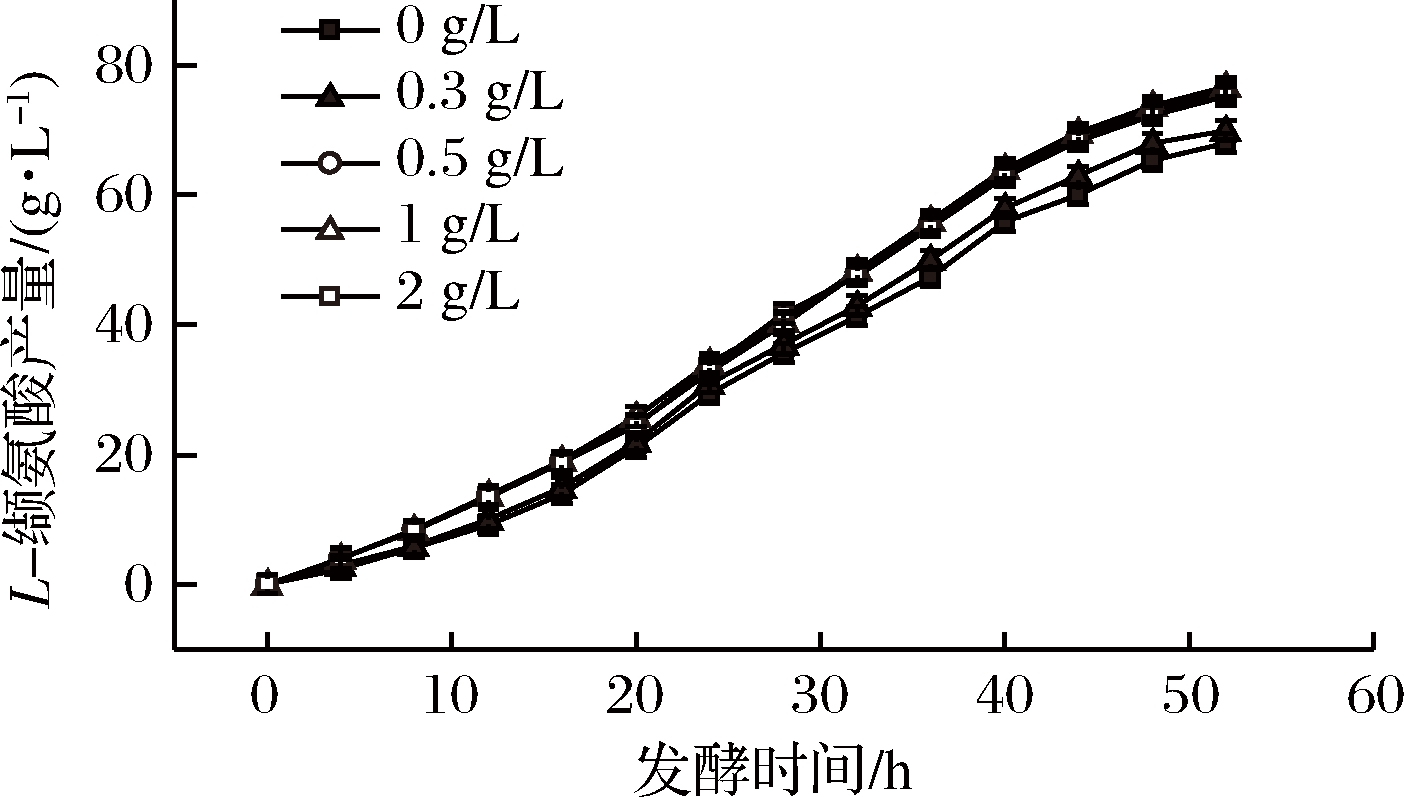
图2 不同氯化胆碱添加量对L-缬氨酸产量的影响
Fig.2 the production of L-valine under different contents of choline chloride
2.2 底物中氯化胆碱的不同添加量对菌体耗糖与糖酸转化率的影响
在发酵结束之后,对不同氯化胆碱添加量的批次进行耗糖速率与糖酸转化率的测算,绘制耗糖速率曲线,见图3。随着底物中氯化胆碱添加量的增加,菌体耗糖速率加快,当底物中氯化胆碱添加量提高至0.5 g/L以上时,耗糖速率不再随着氯化胆碱添加量增加而大幅增加,而是趋于稳定;如表1所示,氯化胆碱添加量的不同对菌体糖酸转化率的提高没有很明显的作用,糖酸转化率依旧保持在36%左右。
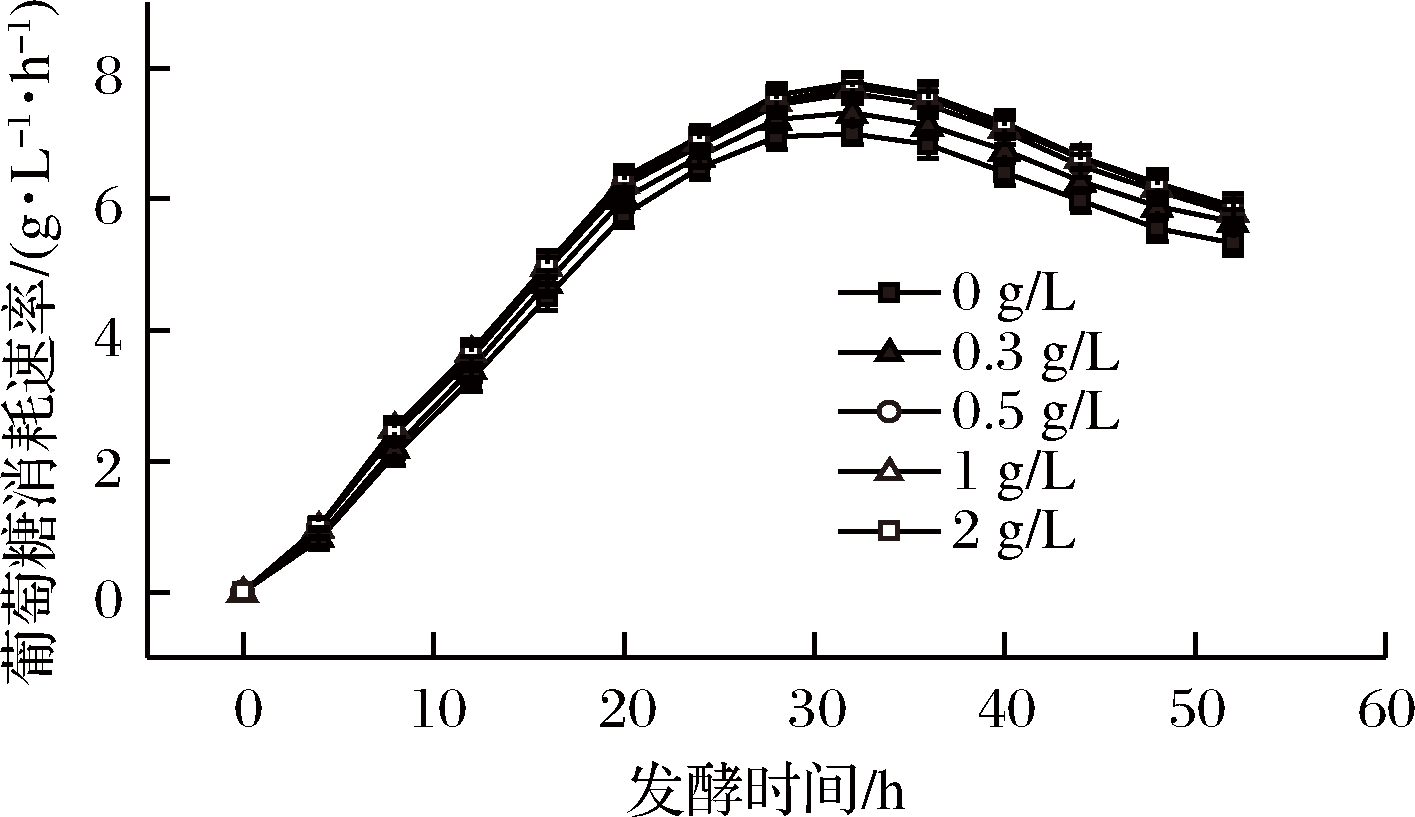
图3 不同氯化胆碱添加量对菌体耗糖的影响
Fig.3 the glucose consumption under different contents of choline chloride
表1 不同氯化胆碱添加量下的糖酸转化率
Table 1 conversion rate of glucose and acid under different contents of choline chloride

氯化胆碱添加量/(g·L-1)发酵液总体积/L总耗糖/gL-缬氨酸产量/(g·L-1)糖酸转化率/%0.017.7±0.23380.4±2568.2±135.7±0.50.317.8±0.23443.6±2570.1±136.2±0.50.518.3±0.23843.5±2576.5±136.5±0.51.018.4±0.23867.0±2576.2±136.2±0.52.018.4±0.23876.5±2575.7±135.9±0.5
注:表中累计耗糖量为已除去所含结晶水和溶剂水的葡萄糖含量。下同。
2.3 联合流加补充氯化胆碱的不同添加量对发酵菌体量及产酸的影响
为探究是否在整个发酵过程中保持罐内氯化胆碱浓度在一定值时最有利于发酵产酸及糖酸转化率的提高,我们在发酵中期开始补糖的时候进行随糖流加一定浓度的氯化胆碱,并且同样选择了0、0.3、0.5、1、2 g/L五个质量浓度的添加量,对比发酵过程中的菌体生长密度变化以及目的氨基酸产物的增长状况(图4、图5)。发现,随着氯化胆碱添加量的增加,菌体活力提高,菌体增长速度加快,当随糖流加的氯化胆碱浓度达到1 g/L时,菌体增速达到峰值;L-缬氨酸的产量与氯化胆碱的流加浓度呈正比,当随糖流加的氯化胆碱质量浓度达到1 g/L时,L-缬氨酸的产量也达到峰值,此时增加所流加氯化胆碱的浓度时,L-缬氨酸产量没有明显提高,基本维持在86 g/L左右。
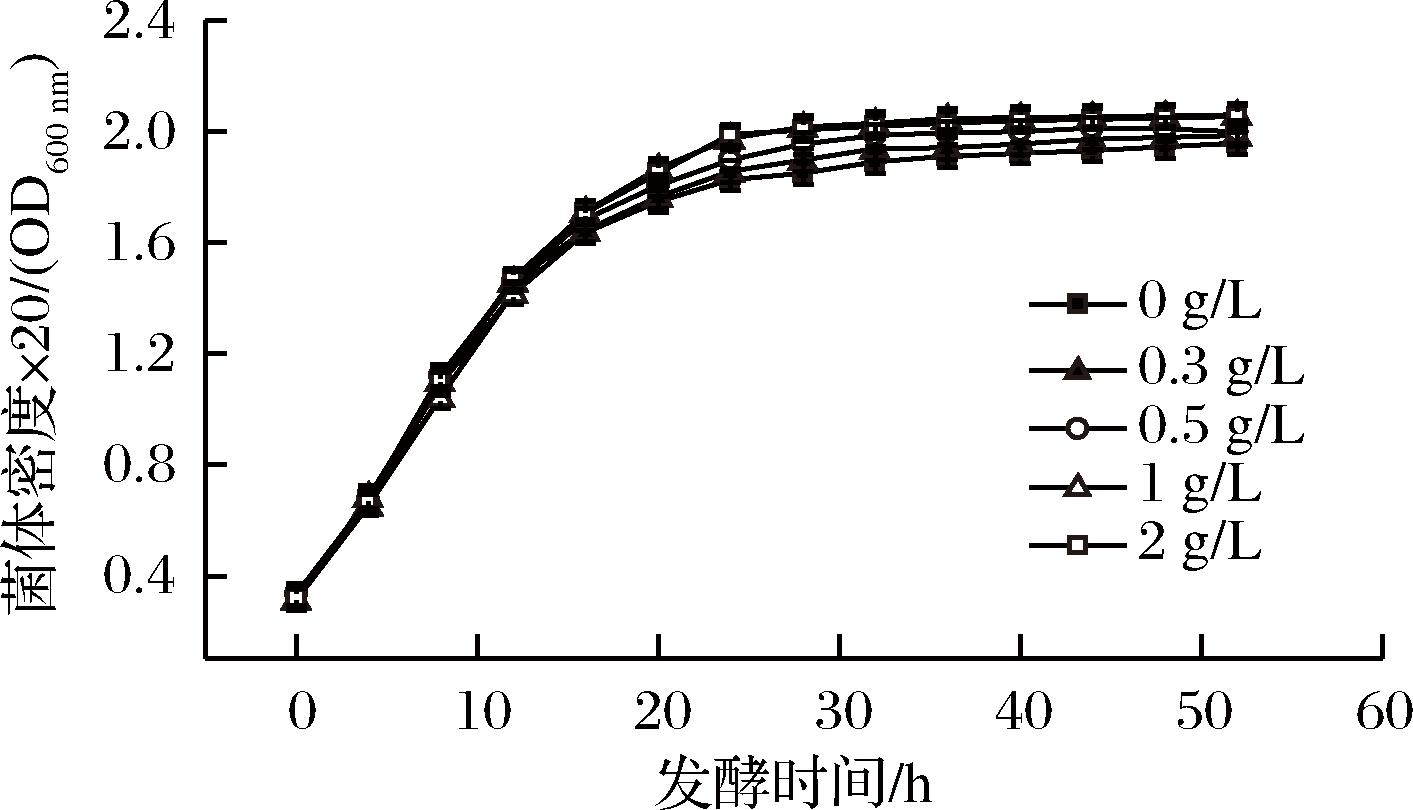
图4 不同氯化胆碱流加量对菌体OD的影响
Fig.4 the value of optical density under different fed-batch contents of choline chloride
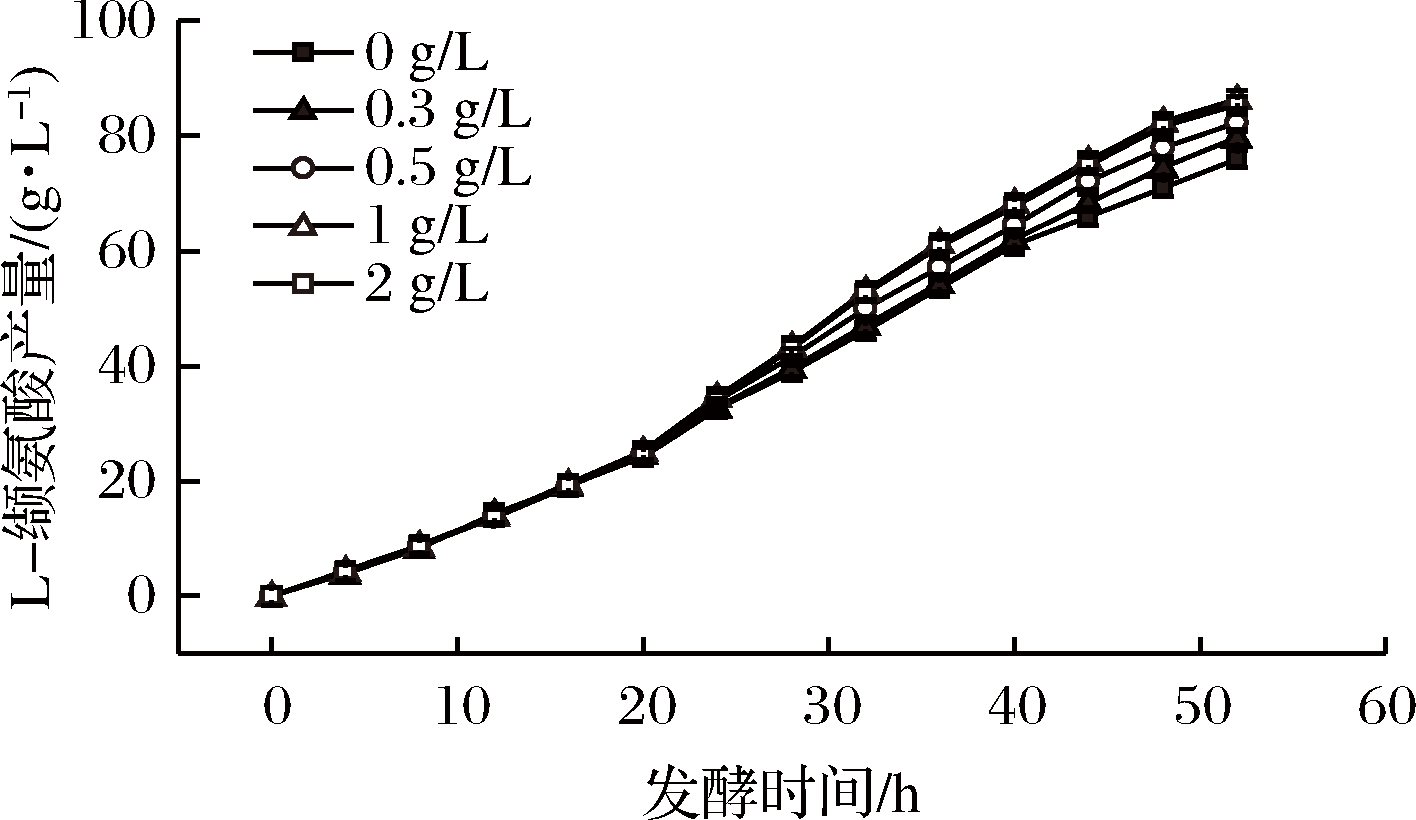
图5 不同氯化胆碱流加量对L-缬氨酸产量的影响
Fig.5 the production of L-valine under different fed-batch contents of choline chloride
2.4 联合流加补充氯化胆碱的不同添加量对菌体耗糖与糖酸转化率的影响
对不同浓度流加氯化胆碱的发酵批次进行耗糖速率以及糖酸转化率的统计测算,绘制曲线图表,如图6、表2所示。菌体的活力与流加氯化胆碱的浓度成正比,当随糖流加的氯化胆碱质量浓度达到1 g/L时,菌体耗糖速率达到峰值;与在底糖中添加氯化胆碱情况相似,菌体发酵的最终糖酸转化率没有较大地提高,依旧稳定在36%左右(表2)。
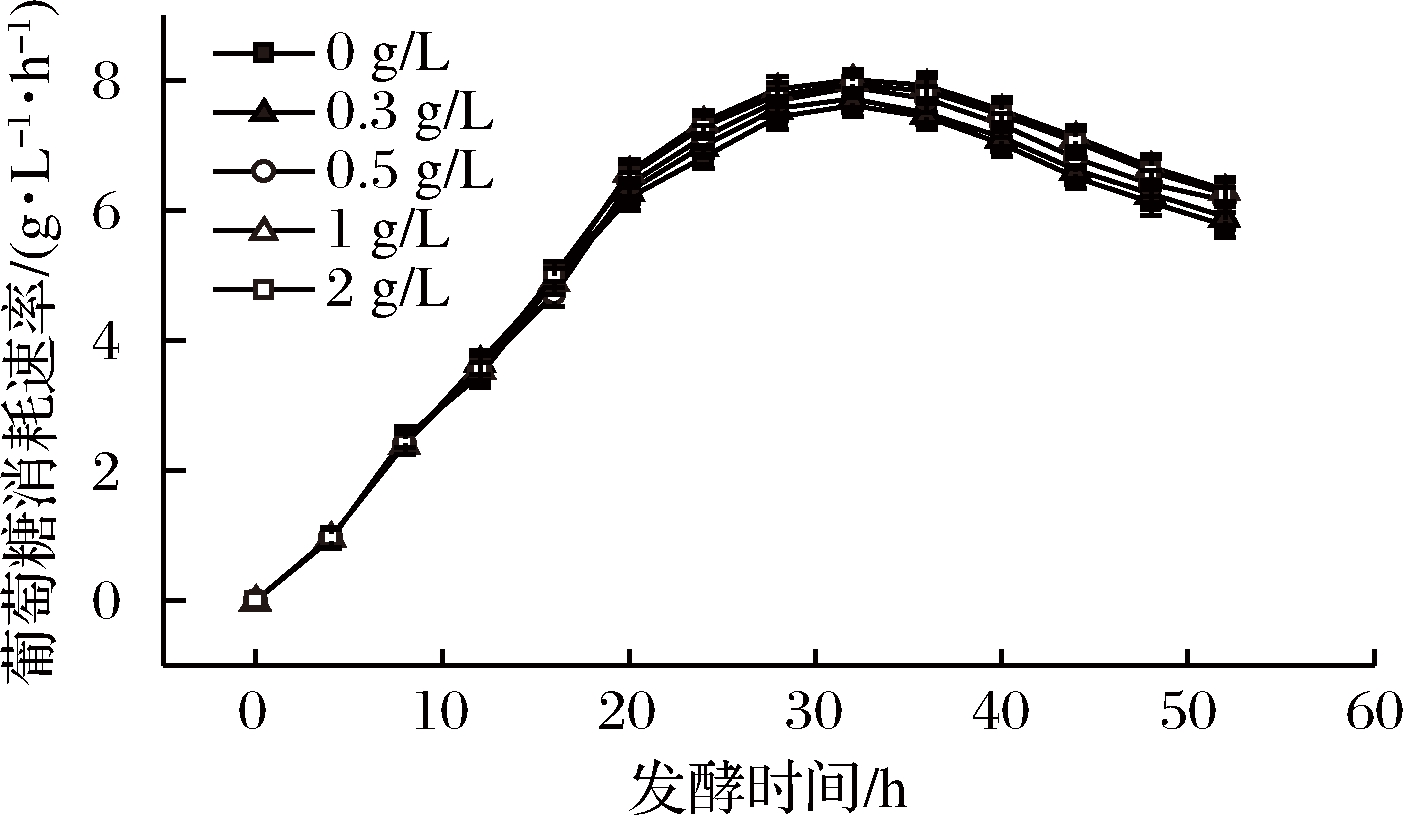
图6 不同氯化胆碱流加量对菌体耗糖的影响
Fig.6 the glucose consumption under different contents of choline chloride
表2 不同氯化胆碱流加量下的糖酸转化率
Table 2 Conversion rate of glucose and acid under different fed-batch contents of choline chloride
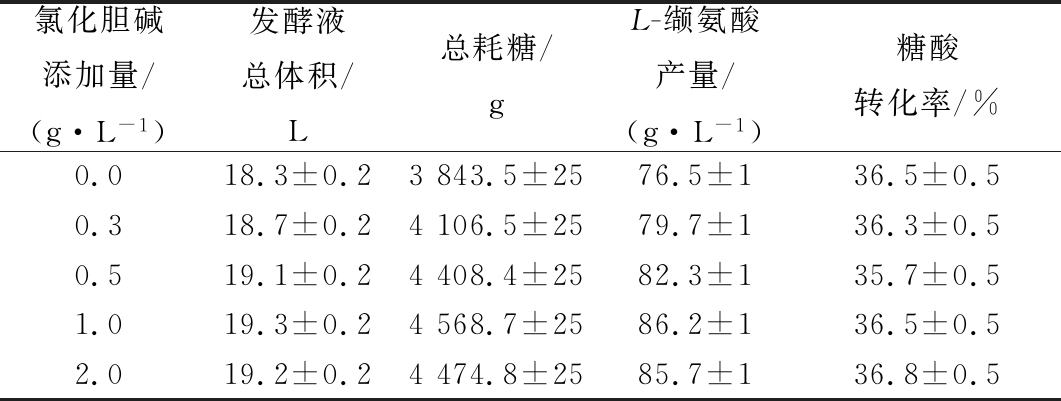
氯化胆碱添加量/(g·L-1)发酵液总体积/L总耗糖/gL-缬氨酸产量/(g·L-1)糖酸转化率/%0.018.3±0.23843.5±2576.5±136.5±0.50.318.7±0.24106.5±2579.7±136.3±0.50.519.1±0.24408.4±2582.3±135.7±0.51.019.3±0.24568.7±2586.2±136.5±0.52.019.2±0.24474.8±2585.7±136.8±0.5
2.5 氯化胆碱的添加对单位菌体产酸速率的影响
对未添加氯化胆碱的发酵批次与添加最适浓度的氯化胆碱的发酵批次进行对比,计算其单位菌体每小时的产酸,绘制曲线,如图7所示,氯化胆碱最适添加量下的发酵批次中,每个时间点的单位菌体产酸速率均高于未进行添加的发酵批次,因此可见,氯化胆碱的添加有效提高了菌体的活力和产酸能力。
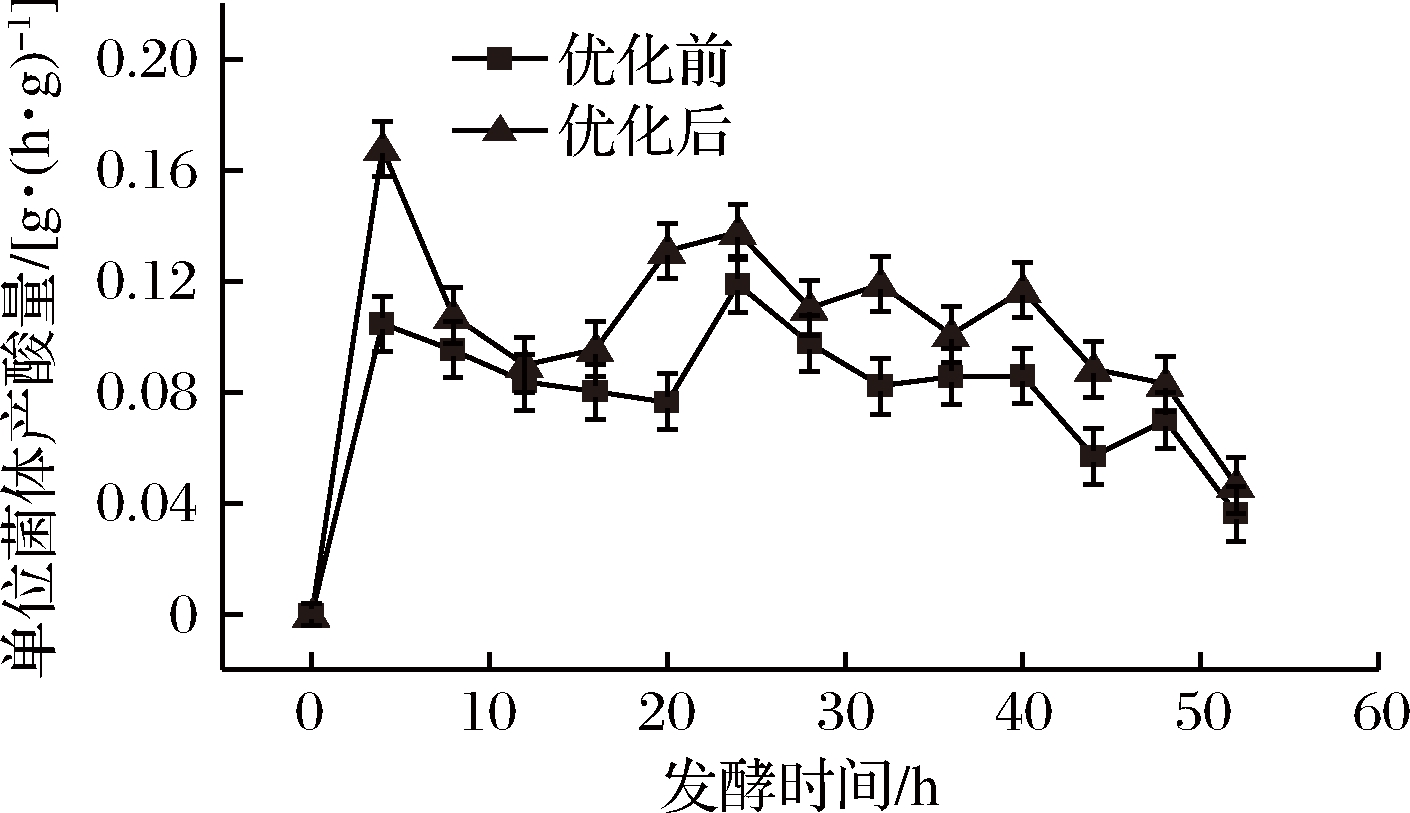
图7 优化前后单位菌体产酸对比
Fig.7 Comparison of acid production per gram of bacteria before and after optimization
胆碱作为甲基供给的前体物,是参与磷脂、卵磷脂合成的重要物质,同时还是乙酰胆碱的前体物,在调节细胞生命活动中起着非常重要的作用[26-27]。在畜禽、水产等养殖行业中向动物饲料中添加适量的氯化胆碱,能够有效提高产品产量与质量,而在微生物的培养过程中,氯化胆碱的实际应用相对较少[28]。研究表明,氯化胆碱作为卵磷脂的重要合成物质,对微生物细胞膜的合成有着较大的影响,而细胞膜的合成对菌体生长的速度有着限制性的作用,在细胞膜合成不足的情况下,菌体生长速率必然受到限制,提供足够的氯化胆碱有利于菌体细胞膜的合成,进而提高菌体生长速率[28];作为多甲基供体,氯化胆碱能够提供微生物生长代谢过程中多种甲基化反应所需的活性甲基,当菌体生长过程中营养供应不足或出现转甲基反应上调时,甲基群可能成为限制性因素,这些情况会影响甲硫氨酸在蛋白质合成中的有效性,从而降低生长速度,此时,氯化胆碱作为甲基供体可以有效缓解这种情况,提高菌体生长速率[26];作为一种渗透保护剂,氯化胆碱能够调节细胞的渗透压,减少菌体生长过程中的应激反应,稳定菌体内酶的活性以及生物大分子的功能,从而减弱因环境因素的变化对菌体活力造成的负面影响,使得菌体活力能够维持在一个较高的水平[29];作为一种参与细菌热保护作用的物质,氯化胆碱能够保护柠檬酸合成酶不受热变性影响,并刺激其复性,保护了三羧酸循环,使菌体在生长方面表现出更强的稳定[30]。
在谷氨酸棒状杆菌发酵生产L-缬氨酸过程中适量添加氯化胆碱,有效加快了菌体的生长速率,但由于发酵培养基中菌体生长所需的广泛类营养元素如磷盐等的总量控制在同一水平,所有批次的发酵实验中,最终菌体的总量也都维持在同一水平。从实验中可以看出,L-缬氨酸产量幅增的原因主要有2点:(1)氯化胆碱的添加使得菌体的生物量提前达到峰值,单位菌体产酸不变的情况下,菌体总量提高,L-缬氨酸单位时间内产酸势必增加,这与本研究实验结果相符;(2)氯化胆碱的添加使得菌体内各类酶以及生物大分子的活性增强,菌体耗糖速率增加,在后期菌体总量一致的情况下,单位菌体单位时间转化葡萄糖的速率增大,从而导致L-缬氨酸的产量增加,与本研究实验结果相符。氯化胆碱的添加对于提高菌体生长速率以及产酸速率方面有着显著效果,使产酸高峰期提前,压缩了整个发酵周期,与优化前发酵实验相比较,优化后批次发酵进行至40 h产酸即达到前者进行至52 h时的水平,极大地提高了发酵的效率。同时,本研究的结果为谷氨酸棒状杆菌发酵生产L-缬氨酸在高密度菌体发酵方面的研究提供了思路,同时也为缩短L-缬氨酸发酵生产周期提供了方案。
3 结论
氯化胆碱的外源添加能够有效增强菌体的活力,加快菌体生长,提高菌体产酸速率。本研究通过对氯化胆碱的添加量以及添加方式进行探索,确定了谷氨酸棒状杆菌发酵生产L-缬氨酸过程中添加氯化胆碱的一种有效方式以及添加量;实验表明,当在谷氨酸棒状杆菌发酵生产L-缬氨酸的发酵培养基底物中添加0.5 g/L的氯化胆碱,同时在发酵过程中随糖流加1 g/L浓度的氯化胆碱,能够有效提高菌体活力,加快菌体生长以及产酸速率,经过52 h的发酵培养,L-缬氨酸产量最终达到86.2 g/L,较添加前的产量提升了26.4%,糖酸转化率稳定在36%左右。
[1] 范镇基.L-缬氨酸[J].氨基酸通讯,1979,2:41-44.
[2] ZEISEL S H,BLUSZTAJN J K.Choline and human nutrition [J].Annual Review of Nutrition,1994,14:269-296.
[3] 汪多仁.缬氨酸的开发与应用进展[J].发酵科技通讯,2011,40(4):38-40.
[4] ZHANG J,HE W,YI D,et al.Regulation of protein synthesis in porcine mammary epithelial cells by l-valine [J].Amino Acids,2019,51(4):717-726.
[5] 潘毅,张雪洪.L-缬氨酸生产工艺研究进展[J].广东化工,2013,40(3):79-80.
[6] 陈诚.代谢工程改造谷氨酸棒状杆菌生产L-缬氨酸[D].无锡,江南大学,2015.
[7] 徐庆阳,刘树海,陈宁.L-缬氨酸的发酵工艺研究[J].生物技术通讯,2006,17(3):381-383.
[8] 张伟国,钱和.L-缬氨酸发酵条件的研究[J].氨基酸和生物资源,2001,23(3):28-31.
[9] 苏跃稳,张昕,王健.L-缬氨酸代谢工程研究进展[J].发酵科技通讯,2016,45(2):118-122.
[10] ZHANG H L,LI Y Y,WANG C H,et al.Understanding the high L-valine production in Corynebacterium glutamicum VWB-1 using transcriptomics and proteomics [J].Scientific Reports,2018,8(1):3 632.
[11] 黄平.提高L-缬氨酸发酵生产水平的几种方法[J].当代化工研究,2016(4):47-48.
[12] WANG X Y,ZHANG H L,QUINN P J.Production of L-valine from metabolically engineered Corynebacterium glutamicum [J].Applied Microbiology And Biotechnology,2018,102(10):4 319-4 330.
[13] 朱惠莲.胆碱[J].营养学报,2013,35(2):121-124.
[14] 朱瑞俊,李小勤,谢骏,等.饲料中添加氯化胆碱对草鱼成鱼生长、脂肪沉积和脂肪代谢酶活性的影响[J].中国水产科学,2010,17(3):527-535.
[15] 王宏,霍启光.动物营养中胆碱同其它甲基供体间的关系[J].动物营养学报,1999,11(2):1-5.
[16] 周旭萍.胆碱在养殖业上的应用研究[J].现代农业,2018(6):88-89.
[17] JANIST N,SRICHANA P,ASAWAKARN T,et al.Effect of supplementing the laying hen diets with choline,folic acid,and vitamin B 12 on production performance,egg quality,and yolk phospholipid [J].Livestock Science,2019,223:24-31.
[18] WEBSTER W.Choline in animal tissues and fluids [J].The Biochemical Journal,1909,4(3-4):117-126.
[19] ZEISEL S H.Choline:An essential nutrient for humans [J].Nutrition,2000,16(7-8):669-671.
[20] HAYARELIS M G,DIAMELA C P,ISABEL D B S.Dietary choline during periadolescence attenuates cognitive damage caused by neonatal maternal separation in male rats [J].Nutritional Neuroscience,2017,20(6):327-335.
[21] 王磊,王良,赵芹.甲基代谢的生理功能[J].饲料博览,2018,316(8):16-20.
[22] 徐达,梅漫莉,徐庆阳等.生物素对L-缬氨酸发酵的影响[J].食品科学,2019,12:1-12.
[23] 李晓华,陈宁,张克旭.化学比色法测定发酵液中L-缬氨酸的研究[J].氨基酸和生物资源,2003,25(4):55-57.
[24] 莫少文,姚城镇,张云开,等.纸层析法测定缬氨酸含量的改良[J].食品工业科技,2012,33(6):111-112;123.
[25] 张灿丽,陈学兵.对L-缬氨酸检测方法的探讨[J].发酵科技通讯,2002,31(2):30-30.
[26] BERTOLO R F,MCBREAIRTY L E.The nutritional burden of methylation reactions[J].Current Opinion In Clinical Nutrition And Metabolic Care,2013,16(1):102-108.
[27] 褚海燕.氯化胆碱的再认识[J].饲料博览,2018,319(11):93.
[28] SOHLENKAMP C,LOPEZ-LARA I M,GEIGER O.Biosynthesis of phosphatidylcholine in bacteria [J].Progress In Lipid Research,2003,42(2):115-162.
[29] ROZWADOWSKI K L,KHACHATOURIANS G G,SELVARAJ G.Choline oxidase,a catabolic enzyme in Arthrobacter pascens,facilitates adaptation to osmotic stress in Escherichia coli [J].Journal of Bacteriology,1991,173(2):472-478.
[30] CALDAS T,DEMONT-CAULET N,GHAZI A,et al.Thermoprotection by glycine betaine and choline [J].Microbiology-Sgm,1999,145:2 543-2 548.