红枣是中国的特色果品,具有较高的营养价值和药用价值。据报道,每百克干枣中含糖类物质约60%以上、蛋白质1.2%、脂肪0.2%[1],此外红枣中还含有丰富的有机酸、氨基酸[2]、维生素、矿物质和微量元素[3],以及大量的多糖[4]、总酚、总黄酮类化合物[5]、环磷酸腺苷[6]、皂甙等,具有抗衰老、抗肿瘤、降低血糖等的作用[1],是一种药食同源的食品。近年来枣树作为国家脱贫致富的经济林树种,种植面积迅速扩大,产量迅速增加,仅新疆维吾尔自治区栽培面积就达40多万公顷,致使红枣价格急剧下降,每年均有大量的原料剩余,亟待扩大红枣精深加工和利用[7]。
γ-氨基丁酸(γ-aminobutyric acid,GABA)是天然存在活性成分、一种非蛋白组成的氨基酸,广泛存在于动植物体内,具有重要的生理功能,如镇静、催眠,尤其对更年期的失眠、压抑和自身失调疗效良好[8]。如今,利用乳酸菌发酵生产高含量GABA的功能性饮料越来越受到消费者的青睐,使得开发富含天然营养的功能性饮料已成为研究的热点之一,通过微生物发酵生产高含量GABA的研究越来越多,KANTACHOTE等[9]用植物乳杆菌发酵椰子汁,发酵后GABA含量为128 μg/mL,卢嘉懿等[10]的研究表明,经植物乳杆菌发酵后苹果汁和梨汁中的GABA含量增加到0.11和0.14 mg/kg,左金磊[11]用霉菌生产GABA,通过优化得出GABA的产量为0.59 g/L。王振斌等[12]用葛根汁等经乳酸菌和酵母菌混合发酵,使GABA质量浓度从未发酵时的0.98 g/L增加到3.64 g/L,同比增加了279.17%。
虽利用果蔬汁发酵产GABA的研究在不断增多,但用短乳杆菌发酵红枣汁生产GABA及其对发酵过程中红枣汁营养成分和抑菌特性的影响却鲜有报道。本研究以红枣汁为原料,利用短乳杆菌进行液态发酵,对发酵期间红枣汁中GABA、有机酸等营养成分、抗氧化能力和抑菌能力进行分析,并探究红枣汁在发酵过程中品质及营养成分的动态变化,通过短乳杆菌发酵红枣汁产生功能性成分,可作膳食补充剂,开发一种纯天然发酵的GABA饮品[13],增加红枣的附产品值。同时,本实验的研究结果可为红枣汁发酵饮料的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
选用干净、无病虫害、无霉变的新疆产干制骏枣;甲醇、乙腈均为色谱纯,KH2PO4、邻苯二甲醛(o-phthalaldehyde,OPA)、β-巯基乙醇、福林酚、L-谷氨酸、MRS培养基等试剂均为国产分析纯,天津科密欧化学试剂有限公司;GABA、酒石酸、苹果酸、乳酸、乙酸、琥珀酸、柠檬酸、富马酸均为标准品,美国Sigma公司。
短乳杆菌:短乳杆菌(Lactobacillus brevis,LB)YM1301。
1.2 仪器与设备
BSA224S型分析天平,赛多利斯科学仪器(北京)有限公司;PHS-3C型pH计,上海仪电科学股份有限公司;HWS智能恒温恒湿培养箱,宁波江南仪器厂;Multiskan Go酶标仪,美国Thermo Electron公司;Ultimate3000型高效液相色谱仪,Thermo公司;HC-3018高速离心机,安徽中科中佳科学仪器有限公司。
1.3 试验方法
1.3.1 红枣汁的制备
将干红枣清洗干净,去核,按照m(红枣)∶m(水)=1∶3加入纯净水,100 ℃预煮10 min,冷却后用打浆机破碎,按质量比加入0.2 %的果胶酶,50 ℃下酶解3 h,用200目尼龙筛网过滤取汁,备用。
1.3.2 菌种的活化和培养
将试验用的短乳杆菌在MRS固体培养基上进行涂布,放入恒温培养箱,37 ℃条件下培养24 h,挑取固体培养基上的单菌落转接到MRS液体培养基中,经过2次MRS液体培养基继代培养进行扩培;将菌悬液转移至无菌离心管中,用离心机在8 000 r/min条件下离心10 min,弃去上清液,加入0.85%的无菌生理盐水清洗2次,再用无菌生理盐水悬浮后,调整菌悬液浓度为1×108CFU/mL,作为红枣汁发酵备用菌种。
1.3.3 红枣汁乳酸菌发酵饮料的制备
红枣汁在105 ℃下杀菌10 min,冷却至室温后将短乳杆菌按8%的添加量接种到红枣汁中,L-谷氨酸添加量为5 g/L[9],在37 ℃培养箱中发酵72 h,每隔12 h取样1次,通过测定GABA含量、pH值、酸度、有机酸含量、抗氧化活性、抗菌活性,分析发酵过程中红枣汁品质的变化。
1.4 指标测定
1.4.1 高效液相色谱法测定GABA含量
HPLC色谱条件:色谱柱:C18柱;流动相A:甲醇;流动相B:V(四氢呋喃)∶V(甲醇)∶V(0.05 mol/L醋酸钠(pH 6.2))=5∶75∶420;紫外检测波长254 nm,进样量20 μL,柱温30 ℃,流速0.8 mL/min[14]。
衍生试剂的配制:称取邻苯二甲醛(OPA)10 mg先后加入10 μL β-巯基乙醇和2.5 mL乙腈溶解、混匀,避光保存[15]。
0.4 mol/L硼酸缓冲液:称取硼酸24.7 g加入1 L超纯水溶解,调节pH值为10.4。
样品测定:取离心后的红枣发酵样液100 μL,加入0.4 mol/L的硼酸缓冲液1 mL和OPA衍生液200 μL,混匀后,衍生化反应30 min,进行样品测定,之后利用已建立的标准曲线计算得出发酵液中GABA的含量[16]。
标准曲线的建立:以GABA标准溶液浓度为横坐标,高效液相色谱法测得的峰面积为纵坐标,建立标准曲线并得到回归方程,即y=0.080 3x-2.072 8,相关系数R2=0.999 2。
1.4.2 理化指标的测定
总酸:酸碱滴定法[17](以乳酸计);pH值:用pH计直接测定;还原糖:3,5-二硝基水杨酸(DNS)比色法测定,以葡萄糖浓度为横坐标,以吸光值为纵坐标,建立标准曲线并得到回归方程,即y=0.628 7x-0.001 9,相关系数R2=0.999 1;总酚:采用福林酚法测定[18],以没食子酸浓度为横坐标,以吸光值为纵坐标,建立标准曲线并得到回归方程,即y=0.059x+0.061 5,相关系数R2=0.998 8。
1.4.3 有机酸的检测
色谱条件:流动相:pH 2.7的0.04 mol/L KH2PO4,流速0.5 mL/min,柱温30 ℃,紫外检测波长210 nm,进样量20 μL[19]。
样品测定:将红枣发酵液在转速8 000 r/min条件下离心10 min,取上清液用流动相稀释10倍,之后用0.22 μm的有机滤膜过滤,滤液上机分析。
1.4.4 抗氧化检测
(1)清除DPPH自由基能力
配制浓度为0.4 mmol/L的DPPH溶液,用95%无水乙醇定容于100 mL棕色容量瓶中,配好后避光低温保存备用[20]。
精确移取100 μL样品于96孔板中,并加入100 μL新鲜配制的DPPH乙醇溶液,充分混匀,黑暗反应30 min,于波长517 nm处测定吸光值Ai,以无水乙醇溶液作参比。
空白组用100 μL无水乙醇代替DPPH溶液,测定吸光值Aj。
对照组用100 μL DPPH溶液与100 μL无水乙醇混合,测定吸光值Ac。清除率计算如公式(1)所示:
清除率![]()
(1)
(2)清除ABTS+自由基能力
ABTS+工作液配制:将ABTS配成浓度为7.4 mmol/L的溶液,K2S2O8配成浓度为2.6 mmol/L的水溶液,各取1 mL等体积混合后,于室温下避光12~16 h。用80%乙醇将溶液稀释至40~50倍,在734 nm波长下测定吸光度,使其吸光值为0.7±0.02,即为配制好的ABTS工作液[21]。
精确移取100 μL样品于96孔板中,再加入100 μL ABTS+工作液,振摇10 s,避光静置6 min,于波长734 nm下测定吸光度A。
对照组用100 μL甲醇代替100 μL样液,测定吸光值A0。计算如公式(2)所示:
清除率![]()
(2)
1.4.5 抑菌性能的测定
取含量为106~107 CFU/mL的大肠杆菌、金黄色葡萄球菌、鼠伤寒沙门氏菌3种指示菌各200 μL涂布于LB固体培养基表面,轻放上牛津杯,取200 μL离心后的样液加入牛津杯中(n=3),平稳轻移至37 ℃培养基培养24 h,十字交叉法测定抑菌圈直径作为指标,测定产品的抑菌性能[22]。
抑菌效果判定标准:抑菌圈直径可以反映各种抑菌液的抗氧化能力,通过比较不同发酵时间段培养基表面抑菌圈直径大小,从而对乳酸发酵液的抗菌性作出较全面的评判。
1.5 数据统计与处理
本实验利用Excel 2010和DPS 2005对试验数据进行分析,实验重复测定3次,结果用平均值±标准偏差表示。采用Duncan新复极差分析法,P<0.05为显著相关,P<0.01为极显著相关。
2 结果与分析
2.1 发酵过程中GABA的变化
通过对红枣汁中加入5 g/L的L-谷氨酸后接入短乳杆菌进行发酵,与直接用短乳杆菌发酵红枣汁进行对比,探究随着发酵时间的不同,发酵液中GABA的变化如图1所示。
发酵时间对GABA有一定的影响。当红枣汁未发酵时,GABA的含量为58.7 μg/mL,发酵时间在0~60 h时,未添加和添加5 g/L的L-谷氨酸中GABA含量随着时间增加均呈现上升的趋势,当发酵时间达到60 h时,添加L-谷氨酸的红枣汁GABA产量达到最大值288.04 μg/mL,分析其原因可能是由于菌种被接入红枣汁后快速繁殖,菌体数量快速增加,使得GABA含量呈现上升的趋势;继续增大发酵时间,GABA均呈现下降的趋势,这可能是由于发酵后期红枣汁中营养物质贫乏,一些菌体消耗了GABA,使得消耗量大于产生量,导致其含量下降[7]。
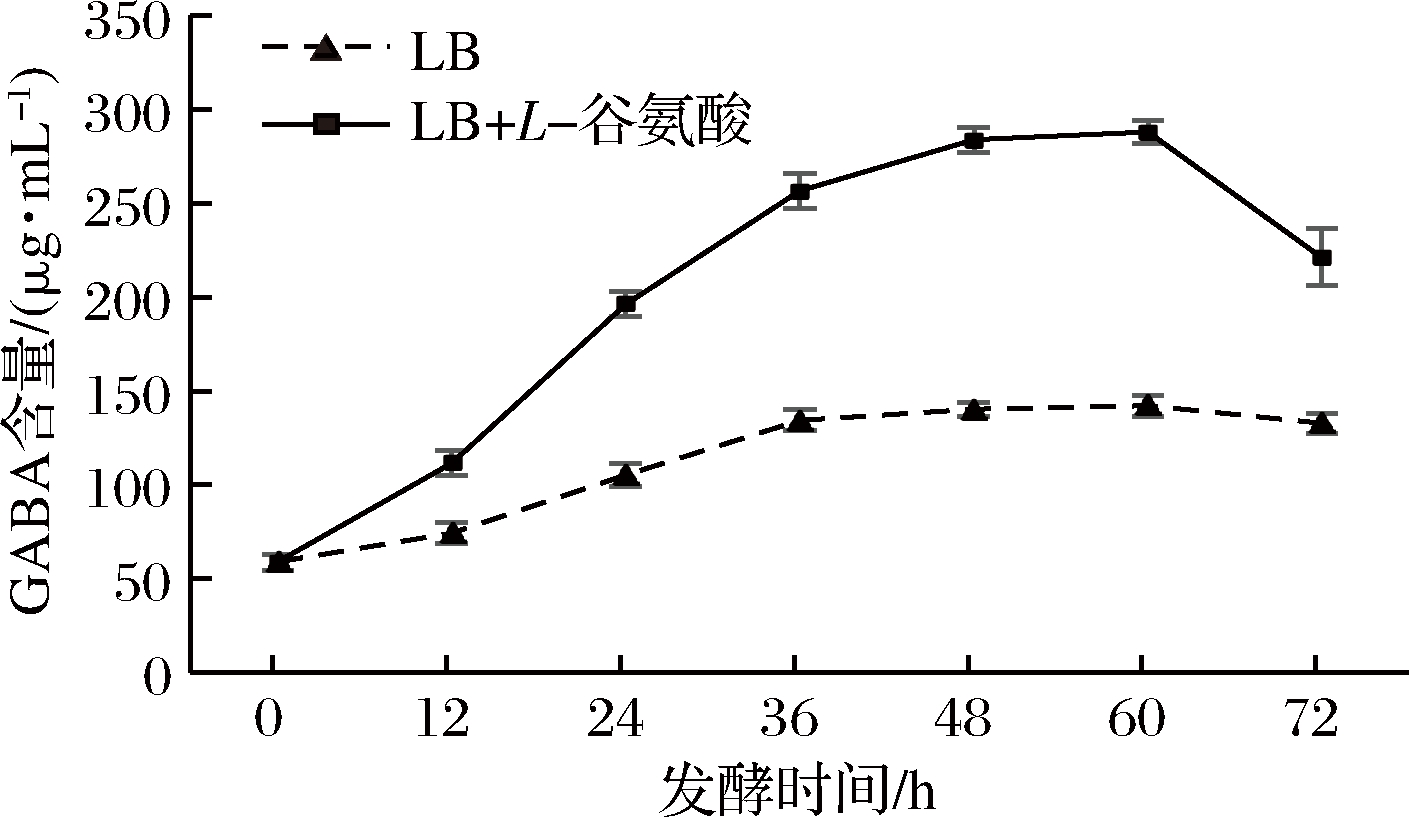
图1 发酵过程中GABA的变化
Fig.1 The change of the GABA during fermentation
发酵时间在48~60 h 2组GABA合成速度明显变缓,当发酵时间为60 h时,未添加L-谷氨酸的红枣汁GABA含量最高为142.17 μg/mL,相比于添加L-谷氨酸的红枣汁中GABA含量明显较低,这可能是由于短乳杆菌能够通过谷氨酸脱羧酶催化谷氨酸盐脱羧合成GABA,使加入L-谷氨酸的红枣汁中GABA含量提高。从该结果可以看出,通过乳酸菌的发酵作用能提高红枣汁中GABA的含量,同时L-谷氨酸的添加对红枣汁中GABA的产生具有显著的促进作用。
2.2 发酵过程中总酸和pH值的变化
红枣汁在发酵过程中总酸和pH值变化如图2所示。从图中可以看出随着发酵时间不断增加,总酸含量不断上升,pH值不断下降的趋势,这是由于短乳杆菌消耗糖类物质代谢产生乳酸使酸度上升而产生的结果[23],当发酵时间超过60 h时,总酸含量的增加和pH值的降低都趋于稳定,这是由于发酵液中积累大量的有机酸,低酸环境影响了短乳杆菌的生长和代谢使产酸能力受到影响[24];发酵时间为72 h时,总酸的含量达到1.87 g/(100 mL),此时pH值为3.39。
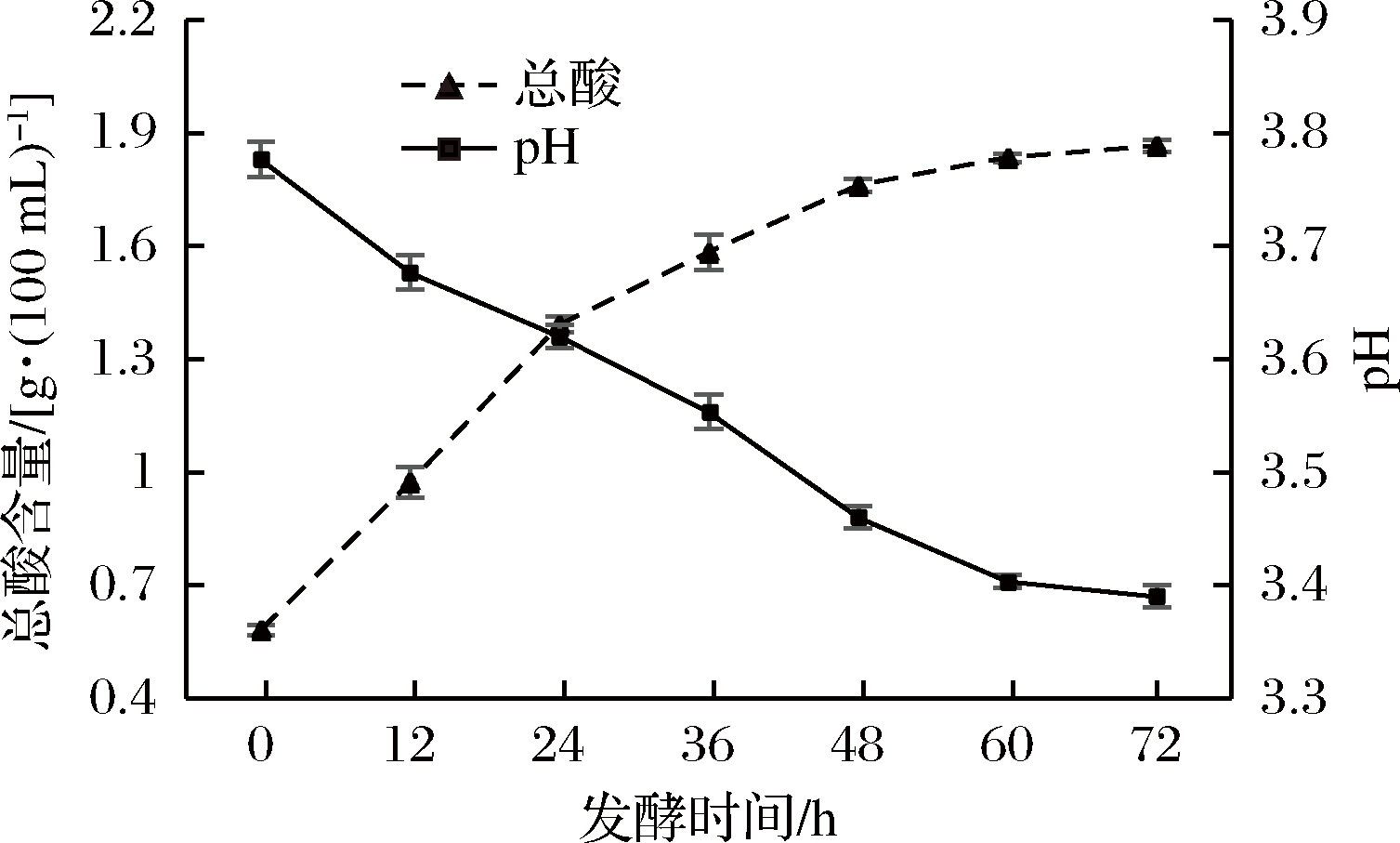
图2 发酵过程中总酸含量和pH的变化
Fig.2 Changes in total acids and pH during fermentation
2.3 发酵过程中总酚含量的变化
随着菌种的发酵,红枣汁中的总酚含量变化如图3所示。
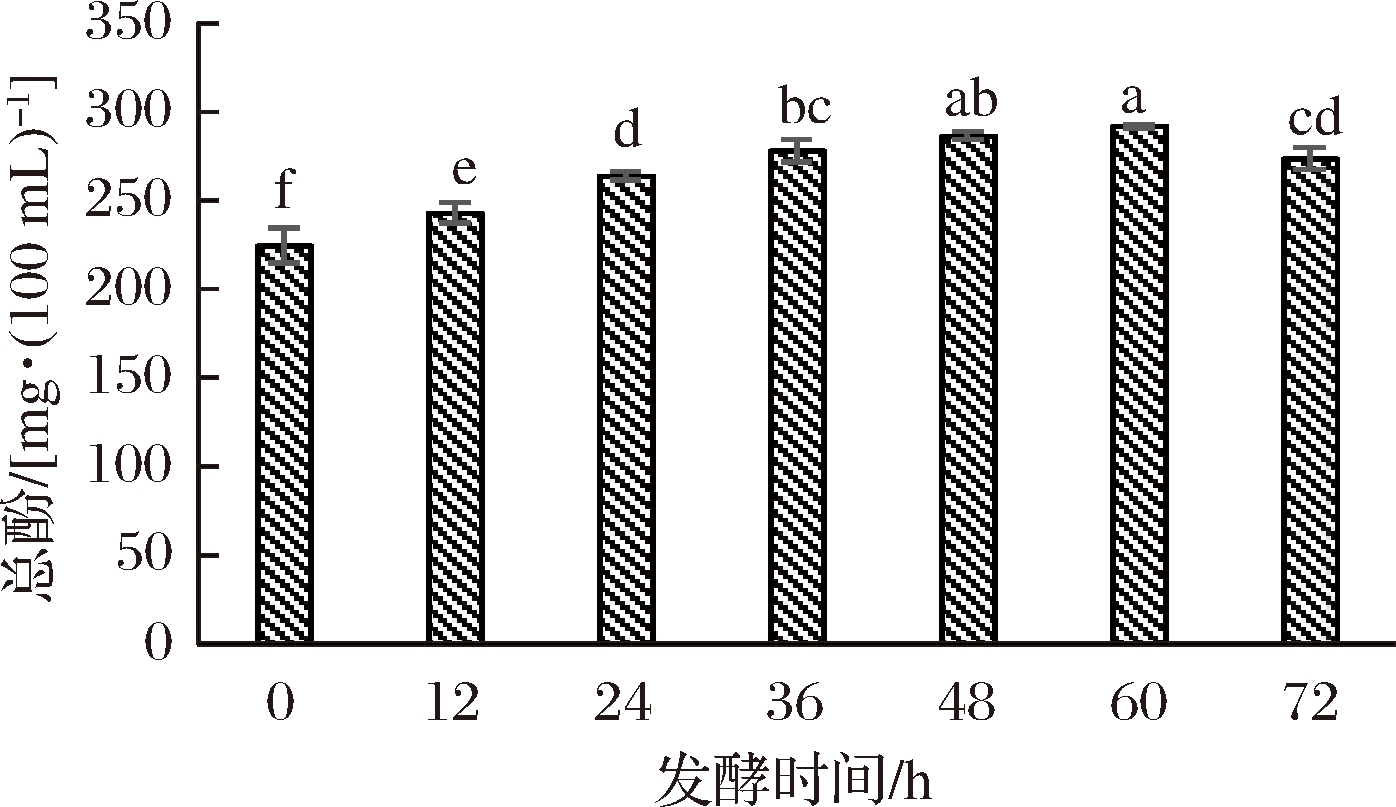
图3 发酵过程中总酚含量的变化
Fig.3 The change of total phenol content during fermentation
注:不同小写字母表示差异显著(P<0.05)。下同。
从图3中可以看出,随着发酵时间的增加,红枣发酵液中总酚含量呈现先增加后降低的趋势;发酵时间在0~36 h时,总酚含量呈现显著的增加,这是由于经短乳杆菌发酵后,可溶性结合酚被释放,使得总酚含量上升[25]。当发酵时间达到60 h时,总酚含量达到最大值,为292.07 mg/(100 mL)。随着发酵时间的延长,总酚含量逐渐降低,其原因可能是在发酵后期酚类物质被微生物分解。
2.4 发酵过程中还原糖含量的变化
随着菌种的发酵,红枣汁中的还原糖含量变化如图4所示。
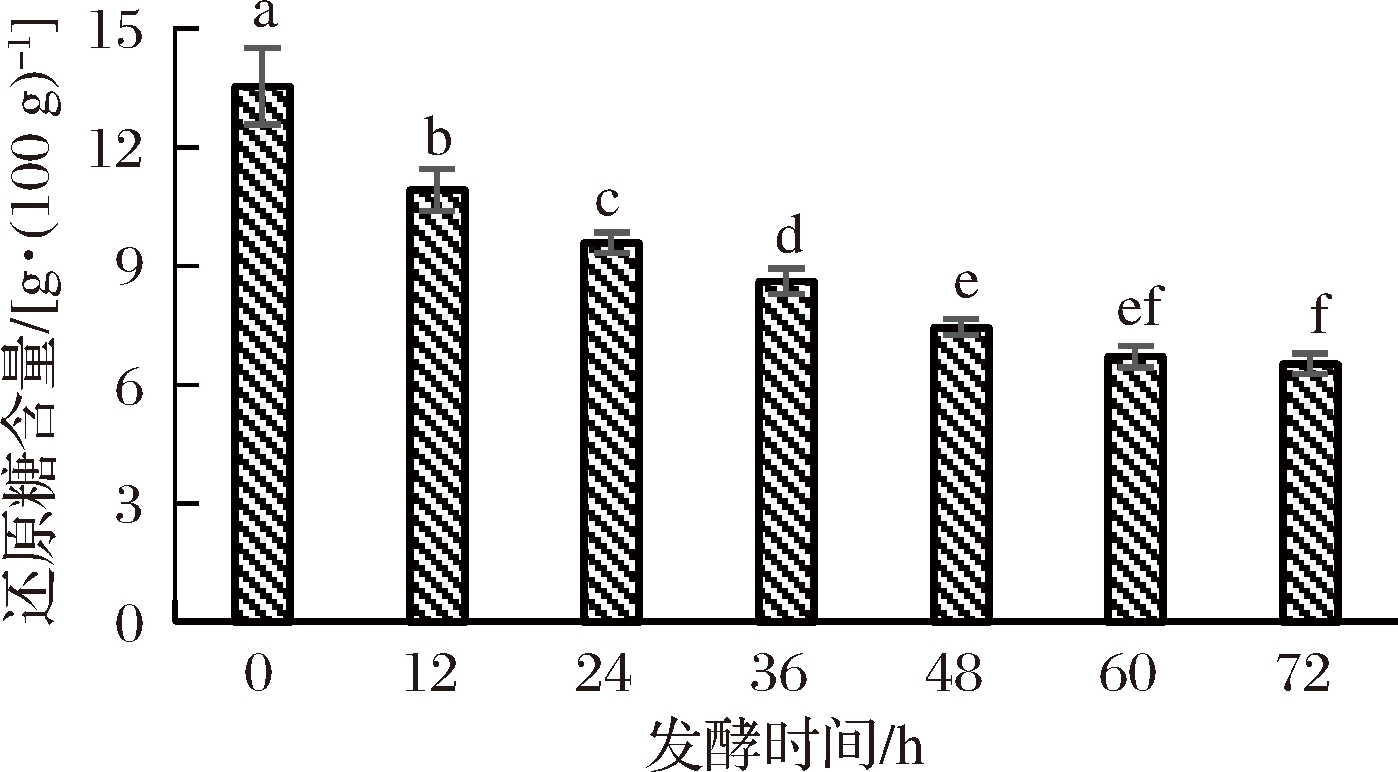
图4 发酵过程中还原糖含量的变化
Fig.4 The change of reducing sugar content during fermentation
从图4中可以看出,发酵时间在0~60 h,还原糖含量不断下降,这是由于短乳杆菌不断生长繁殖,还原糖被快速的消耗,使得发酵液中还原糖含量急剧下降[26];60 h之后,红枣汁中的还原糖含量没有明显的变化,基本保持稳定;未发酵时红枣汁中还原糖含量13.54 g/(100 mL),发酵至72 h时还原糖含量减少至 6.53 g/(100 mL),消耗掉原红枣汁中还原糖含量的51.77%。
2.5 发酵过程中有机酸的变化
从表1中可以看出,各有机酸与峰面积均呈现良好的线性关系,相关系数(R2)都大于0.991 9,采用外标法对各种有机酸进行定量分析[27]。通过高效液相色谱法测定红枣汁发酵过程中有机酸含量变化的结果见表2和图5。
表1 有机酸的标准曲线及保留时间
Table 1 Organic acid standard curve and the retention time
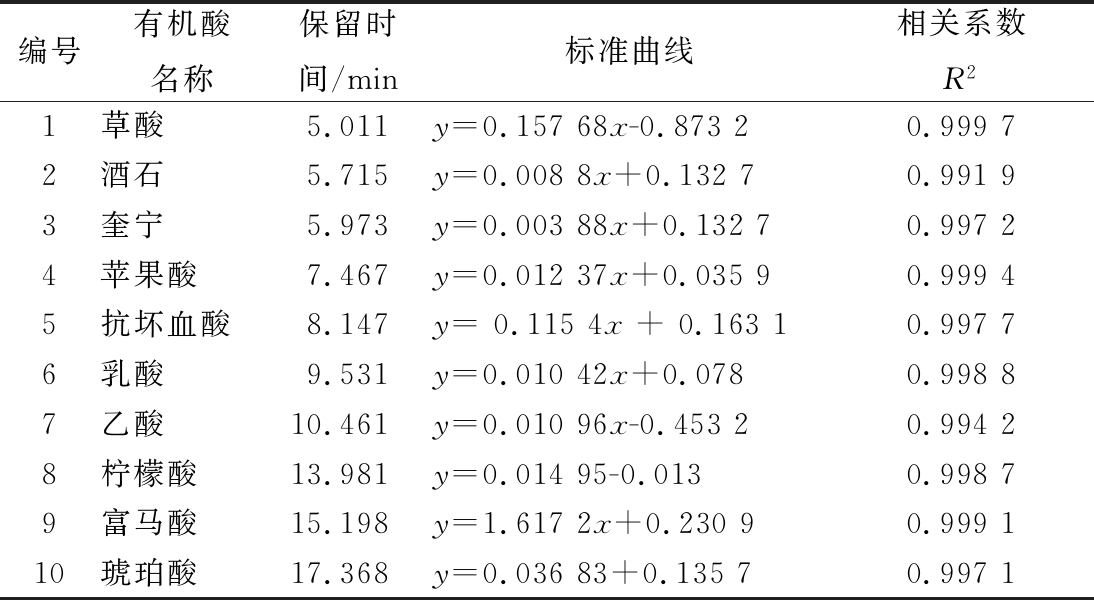
编号有机酸名称保留时间/min标准曲线相关系数R21草酸5.011y=0.15768x-0.87320.99972酒石5.715y=0.0088x+0.13270.99193奎宁5.973y=0.00388x+0.13270.99724苹果酸7.467y=0.01237x+0.03590.99945抗坏血酸8.147y=0.1154x+0.16310.99776乳酸9.531y=0.01042x+0.0780.99887乙酸10.461y=0.01096x-0.45320.99428柠檬酸13.981y=0.01495-0.0130.99879富马酸15.198y=1.6172x+0.23090.999110琥珀酸17.368y=0.03683+0.13570.9971

图5 有机酸混标的高效液相色谱图
Fig.5 Chromatogram of organic acids from a standard mixture
利用高效液相色谱法对红枣汁发酵过程中的有机酸进行分析,从表2可以看出,红枣汁中检测出8种有机酸,发酵后检测出9种,且发酵时间长短影响着发酵液中有机酸的含量。草酸是红枣汁主要的有机酸之一,在初始红枣汁中含量为182.17 mg/(100 g),随着发酵时间的延长,发酵至72 h,草酸含量下降至103.21 mg/(100 g),这可能是因为其参与了风味物质的形成或转化为乳酸[22],使草酸随着发酵的进行含量不断的降低;发酵过程中乳酸含量从51.65 mg/(100 g)增加到1 718.91 mg/(100 g),发酵前后含量极显著的增加,这是由于乳酸作为乳酸菌发酵的主要产物,其变化基本符合乳酸菌生长代谢过程中产物合成机制[28]。
表2 不同发酵时间红枣汁中有机酸的含量 单位:mg/(100 g)
Table 2 Content of organic acid in jujube juice at different fermentation time
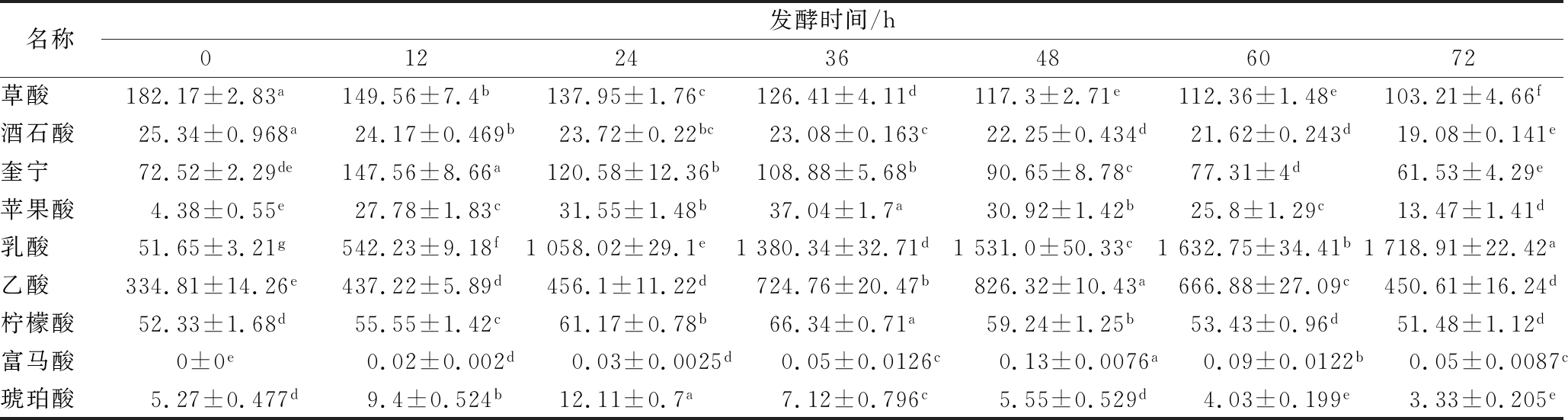
名称发酵时间/h0122436486072草酸182.17±2.83a149.56±7.4b137.95±1.76c126.41±4.11d117.3±2.71e112.36±1.48e103.21±4.66f酒石酸25.34±0.968a24.17±0.469b23.72±0.22bc23.08±0.163c22.25±0.434d21.62±0.243d19.08±0.141e奎宁72.52±2.29de147.56±8.66a120.58±12.36b108.88±5.68b90.65±8.78c77.31±4d61.53±4.29e苹果酸4.38±0.55e27.78±1.83c31.55±1.48b37.04±1.7a30.92±1.42b25.8±1.29c13.47±1.41d乳酸51.65±3.21g542.23±9.18f1058.02±29.1e1380.34±32.71d1531.0±50.33c1632.75±34.41b1718.91±22.42a乙酸334.81±14.26e437.22±5.89d456.1±11.22d724.76±20.47b826.32±10.43a666.88±27.09c450.61±16.24d柠檬酸52.33±1.68d55.55±1.42c61.17±0.78b66.34±0.71a59.24±1.25b53.43±0.96d51.48±1.12d富马酸0±0e0.02±0.002d0.03±0.0025d0.05±0.0126c0.13±0.0076a0.09±0.0122b0.05±0.0087c琥珀酸5.27±0.477d9.4±0.524b12.11±0.7a7.12±0.796c5.55±0.529d4.03±0.199e3.33±0.205e
注:不同字母表示有显著性差异(P<0.05)。
酒石酸对于微生物发酵来说是一种含量相对稳定的酸,因此在发酵过程中变化较小[29];柠檬酸在发酵前后也比较稳定,奎宁、苹果酸、乙酸、富马酸在发酵过程中先增加,后下降。其中奎宁在12 h时达到最大,苹果酸在发酵36 h时达到最大,乙酸、富马酸在发酵48 h时达到最大;分析其原因可能是在发酵过程中先产生此类有机酸,随后这类有机酸作为营养物质被微生物利用和代谢使其含量下降。乙酸在发酵前48 h含量不断的增加,随后逐渐降低。这可能是由于被氧化分解成为CO2和H2O,以及挥发损失所致[29]。
2.6 发酵过程中抗氧化活性的变化
红枣汁通过发酵得到具有较高总酚含量的发酵液,这会增加发酵液的抗氧化活性,通过对发酵液中抗氧化活性指标(ABTS清除能力、DPPH清除能力)的测定,从而判断发酵液抗氧化活性成分的变化。通过ABTS、DPPH等方法对2种培养基上清液的抗氧化活性进行测定。从图6可以看出,随着发酵时间的增加,红枣发酵液中的抗氧化活性也在增加,基于ABTS+自由基的清除能力在57.17%~81.61%,DPPH自由基清除能力在61.85%~83.08%;此外,2种发酵液对ABTS+和DPPH+清除力产生相同的趋势,在0~60 h抗氧化活性不断增强,这可能是由于在微生物的作用下,红枣汁中的酚类物质发生了复杂的变化[30],将一些结合酚类物质水解成游离酚,并且释放大量的有机酸,防止酚类物质的降解,从而提高了清除ABTS和DPPH自由基的能力[31]。当发酵时间超过60 h之后,红枣汁对ABTS和DPPH自由基的清除能力呈下降的趋势,可能是由于在微生物作用下,红枣汁中的酚类物质组分及其含量一直处于动态变化中所造成的现象[32]。结果表明,红枣汁经短乳杆菌发酵后能使其抗氧化活性提高。
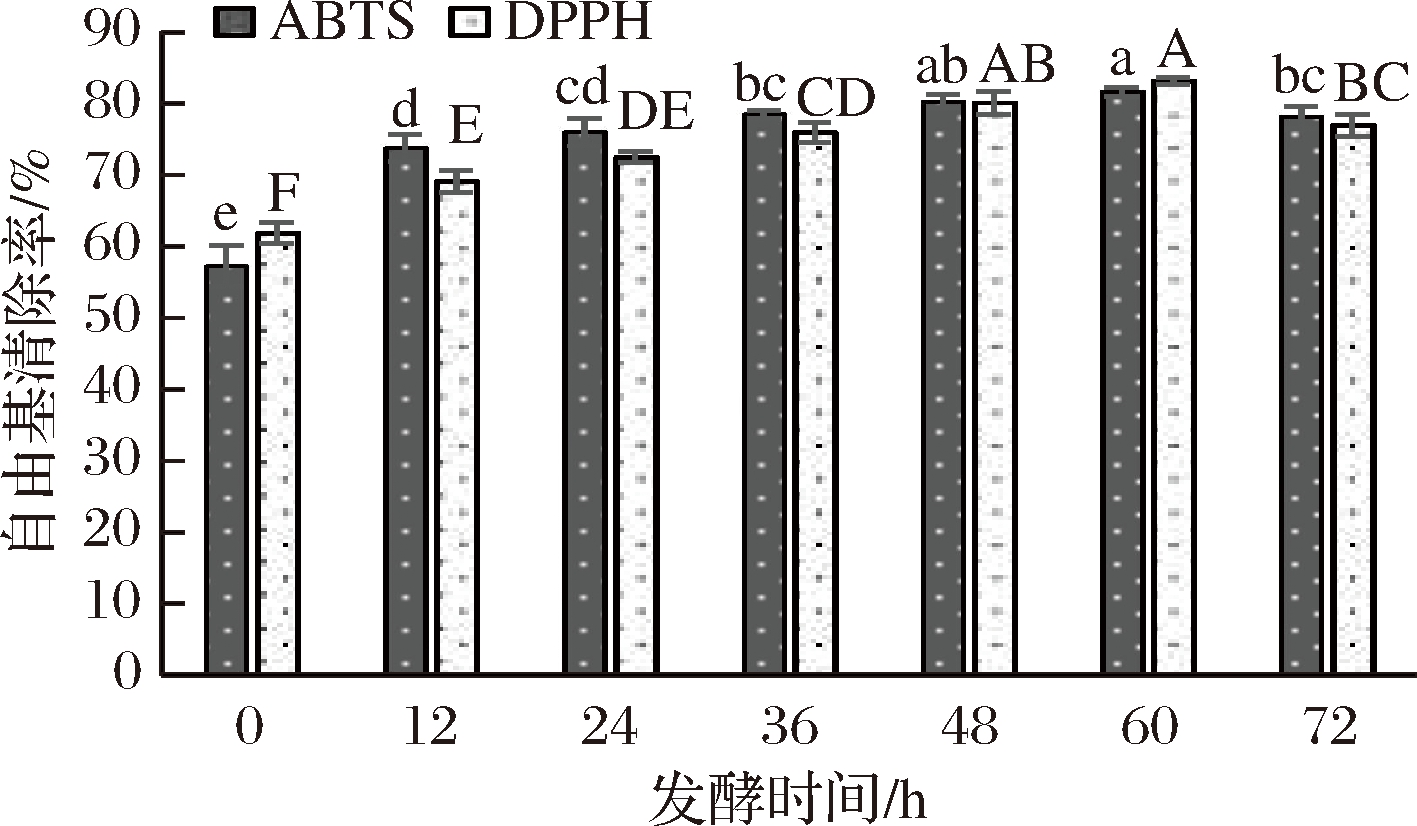
图6 发酵过程中抗氧化活性的变化
Fig.6 Changes in antioxidant activity during fermentation
注:小写字母不同表示ABTS+自由基清除率差异显著;大写字母不同表示DPPH+自由基差异显著(P<0.05)。
2.7 发酵过程中发酵液抑菌活性的变化
红枣汁发酵过程抑菌性能变化如图7所示,当发酵时间在12 h之前,红枣汁对这3种菌的生长抑菌效果不佳,其原因可能是由于短乳杆菌刚接入红枣汁中,刚开始生长繁殖,酸度不高,同时发酵液中糖含量高和pH值偏高[22],使得发酵液抑菌性较差;24 h之后,红枣汁抑菌性能显著的增加。同时可以看出,红枣汁发酵液对3种菌抑菌顺序依次为:大肠杆菌>鼠伤寒沙门氏菌>金黄色葡萄球菌,其中大肠杆菌对发酵液最为敏感,对其抑菌效果最好;随着发酵时间的增加,发酵液对这3种菌的抑菌性呈现增大的趋势,这可能是因为随着短乳杆菌的不断发酵,抑菌物质如乳酸、乙酸等不断的积累,使得红枣发酵液酸度降低[17],同时产生细菌素、胞外多糖、小肽等,从而抑制或杀死更多的致病菌和腐败菌,使红枣汁抑菌性能显著上升[33-34],发酵液的抑菌性能有助于红枣发酵液的保存,也在一定程度上保证了产品的饮用安全。
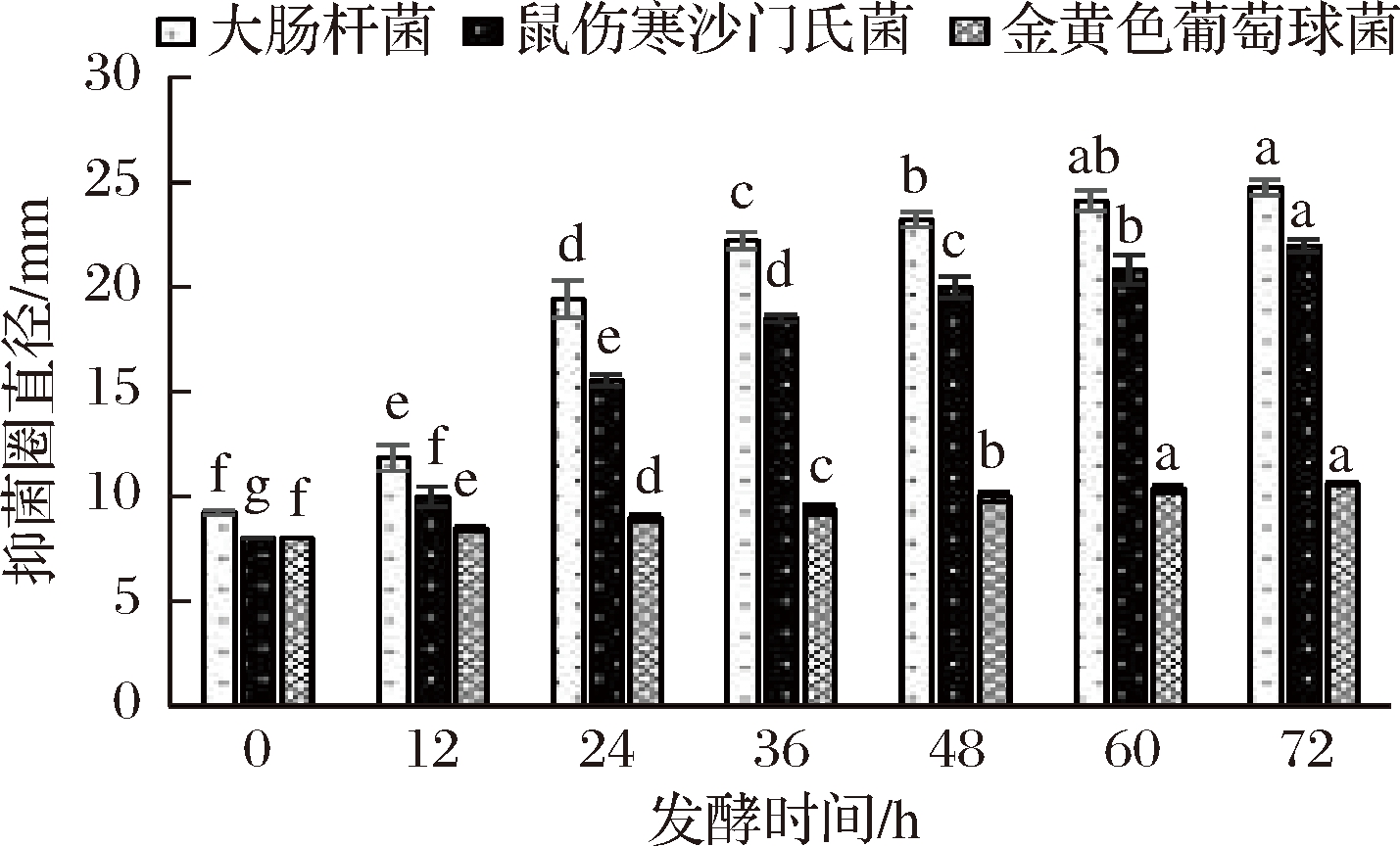
图7 发酵过程中发酵液抑菌活性的变化
Fig.7 The change of antibacterial activity of fermentation broth during fermentation
3 结论与讨论
本研究以红枣汁为原料,经短乳杆菌发酵后可制得含有GABA活性物质的乳酸菌饮料,若初始红枣汁中添加L-谷氨酸,则最终发酵液中GABA含量更高。通过测定和分析发酵前后红枣汁中营养成分、抗氧化能力及其抑菌特性的变化,发现短乳杆菌发酵红枣汁的最佳发酵时间为60 h时,发酵后红枣汁中GABA的含量从58.70 μg/mL增加到288.04 μg/mL;红枣汁总酸含量从0.58 g/(100 mL)增加到1.84 g/(100 mL),总酚含量从224.62 mg/(100 mL)增加到292.07 mg/(100 mL),发酵后酸度和酚类物质显著上升,赋予了红枣汁更佳的口感;DPPH和ABTS自由基清除率也达到最大;与发酵前相比,红枣发酵液的抑菌性能也有一定的增加。发酵液的抑菌性能跟酸的含量变化有一定的相关性,随着酸度的增加,抑菌效果也在增强,与原红枣汁相比能够极大提高产品的贮藏稳定性,将有助于绿色健康产品的开发。
综上所述,利用短乳杆菌发酵红枣汁生产含GABA的功能性饮品,是一种经济、安全的方法[35],同时经过短乳杆菌发酵后,红枣汁的品质和抑菌性能得到明显地改善。以上结果为开发富含GABA的红枣汁发酵饮品提供一定的理论依据。
[1] 黄哲真.红枣的营养成分及功用价值[J].科技视界,2014(29):325-325.
[2] 冯新光,吕吉鸿,郭泽峰,等.中国不同产地红枣的组分分析与评价[J].中国酿造,2012,31(9):30-33.
[3] LI J W,FAN L P,DING S D,et al.Nutritional composition of five cultivars of Chinese jujube[J].Food Chemistry,2007,103(2):454-460.
[4] WANG D,ZHAO Y,JIAO Y,et al.Antioxidative and hepatoprotective effects of the polysaccharides from Zizyphus jujube cv.Shaanbeitanzao[J].Carbohydrate Polymers,2012,88(4):1 453-1 459.
[5] CHENG D,ZHU C,CAO J,et al.The protective effects of polyphenols from jujube peel (Ziziphus Jujube Mill)on isoproterenol-induced myocardial ischemia and aluminum-induced oxidative damage in rats[J].Food and Chemical Toxicology,2012,50(5):1 302-1 308.
[6] PAREEK S.Nutritional composition of jujube fruit[J].Emirates Journal of Food and Agriculture,2013,25(6):463-470.
[7] 魏朝晖,陈继红,张丽.新疆红枣种植规模对产量的滞后影响分析[J].现代园艺,2018(20):18.
[8] 韩昱姝,李永转,胡凤山,等.一株高产GABA乳酸菌的筛选及应用[J].中国酿造,2017,36(12):72-75.
[9] KANTACHOTE D,RATANABUREE A,HAYISAMA-AE W,et al.The use of potential probiotic Lactobacillus plantarum DW12 for producing a novel functional beverage from mature coconut water[J].Journal of Functional Foods,2017,32:401-408.
[10] 卢嘉懿,张驰,李汴生,等.乳酸菌发酵对荔枝汁中γ-氨基丁酸含量的影响[J].食品与发酵工业,2018(12):97-102.
[11] 左金磊.生物转化法产γ-氨基丁酸菌种筛选及条件优化[D].济南:齐鲁工业大学,2015.
[12] 王振斌,王晴,刘加友,等.葛根汁发酵前后营养及风味成分变化研究[J].中国酿造,2016,35(7):93-98.
[13] LEE B J,KIM J S,KANG Y M,et al.Antioxidant activity and γ-aminobutyric acid (GABA)content in sea tangle fermented by Lactobacillus brevis BJ20 isolated from traditional fermented foods[J].Food Chemistry,2010,122(1):271-276.
[14] 黄俊.利用短乳杆菌制备γ-氨基丁酸相关过程研究[D].杭州:浙江大学,2006.
[15] 江英英,李海星,曹郁生.响应面法优化γ-氨基丁酸发酵培养基[J].食品科技,2007,32(5):44-49.
[16] 张晓杰,孙君社,张秀清,等.γ-氨基丁酸分批发酵动力学的研究[J].中国酿造,2013,32(2):16-19.
[17] 张宏志,马艳弘,李亚辉,等.乳酸菌发酵菊芋马齿苋复合饮料及其抑菌活性[J].江苏农业科学,2015,43(11):362-365.
[18] 王毓宁,李鹏霞,胡花丽,等.福林酚法测定水蜜桃果酒中总多酚[J].酿酒,2012,39(5):60-62.
[19] 马倩倩,吴翠云,蒲小秋,等.高效液相色谱法同时测定枣果实中的有机酸和VC含量[J].食品科学,2016,37(14):149-153.
[20] DAS D,GOYAL A.Antioxidant activity and γ-aminobutyric acid (GABA)producing ability of probiotic Lactobacillus plantarum DM5 isolated from Marcha of Sikkim[J].Food Science and Technology,2015,61(1):263-268.
[21] 韩锐,陈亚运,季君洋,等.HPLC测定番荔枝果实中酚类成分及抗氧化相关性研究[J].食品科学,2019,40(12):203-209.
[22] 苏能能,关倩倩,彭珍,等.乳酸菌发酵对桑葚浆品质及抑菌性能的影响[J].食品与发酵工业,2018,44(9):121-128.
[23] 邵齐.乳酸菌发酵果蔬浆加工及藏期间品质的变化研究[D].南昌:南昌大学,2018.
[24] 闫征,王昌禄,顾晓波.pH值对乳酸菌生长和乳酸产量的影响[J].食品与发酵工业,2003,29(6):35-38.
[25] 赖婷,刘磊,张名位,等.不同乳酸菌发酵对桂圆肉中酚类物质及抗氧化活性的影响[J].中国农业科学,2016,49(10):1 979-1 989.
[26] 赖婷.燕麦桂圆乳酸菌发酵饮料加工活性成分变化分析与工艺优化[D].福州:福建农林大学,2016.
[27] 梁艳花.红枣乳酸饮料功能性研究[D].杨凌:西北农林科技大学,2015.
[28] 孙淑夷.荔枝汁混菌发酵工艺及其功能活性成分研究[D].广州:华南农业大学,2016.
[29] 向进乐.枳椇果梗发酵特性及其果醋功能性研究[D].杨凌:西北农林科技大学,2012.
[30] 靳玉红,李志西,乔艳霞,等.红枣乳酸发酵饮料的抗氧化活性[J].西北农林科技大学学报(自然科学版),2016,44(1):199-205.
[31] 韩雪,王毕妮,张富新,等.不同乳酸菌发酵对红枣浆游离态酚酸及其抗氧化性的影响[J].食品与发酵工业,2018,44(2):121-127.
[32] 王行,张海宁,马永昆,等.蓝莓酒发酵过程中酚类物质动态变化及其抗氧化活性研究[J].现代食品科技,2015(1):90-95.
[33] L O’SULLIVAN,ROSS R P,Hill C.Potential of bacteriocin-producing lactic acid bacteria for improvements in food safety and quality[J].Biochimie,2002,84(5-6):0-604.
[34] K TIA G DE CARVALHO,BAMBIRRA F H S,KRUGER M F,et al.Antimicrobial compounds produced by Lactobacillus sakeisubsp sakei2a,a bacteriocinogenic strain isolated from a Brazilian meat product[J].Journal of Industrial Microbiology and Biotechnology,2010,37(4):381-390.
TIA G DE CARVALHO,BAMBIRRA F H S,KRUGER M F,et al.Antimicrobial compounds produced by Lactobacillus sakeisubsp sakei2a,a bacteriocinogenic strain isolated from a Brazilian meat product[J].Journal of Industrial Microbiology and Biotechnology,2010,37(4):381-390.
[35] 李理,刘冶,满朝新,等.产γ-氨基丁酸乳酸菌及其应用[J].中国乳品工业,2014,42(2):31-34.