我国是洋葱(Allium cepa L.)种植和出口大国,生产加工过程中通常会产生2%~3%的洋葱外皮,均被当作废弃物丢弃。洋葱皮中的黄酮类物质含量远远高于内部鳞茎[1-2],具有抗氧化活性和保健的功效[3-4]。不同品种洋葱中,又以紫皮洋葱皮中黄酮含量最高,黄皮次之,白皮最少[5]。
目前,国内外学者对洋葱中酚类物质及活性研究主要集中在洋葱鳞茎,对酚类的组成成分研究较多[6-8],而对洋葱皮中酚类物质的研究较少。KIM等[9]发现,洋葱皮提取物具有抗氧化活性和抗基因毒性的能力;SHIM等[10]发现,洋葱皮提取物具有抗生肉糜脂类氧化的作用;RAHIMi-MADISEH等[11]发现,洋葱皮提取物能改善高脂饮食/链脲佐菌素诱导的糖尿病大鼠的高血糖和胰岛素胰岛素抵抗。由于洋葱品种不同,酚类物质的含量和抗氧化性存在差异,但之前的报道,多是单一品种的洋葱皮提取物中酚类物质和抗氧化剂的研究,难以揭示品种间的差异。本试验以不同溶剂提取紫、黄、白3个品种洋葱皮中的总酚、总黄酮的含量,及抗氧化活性的差异,旨在为洋葱副产物资源的深度开发和利用提供依据。
1 材料与方法
1.1 材料与试剂
紫、黄、白洋葱均购于黑龙江省齐齐哈尔市农贸市场。选取大小均匀、颜色统一、表皮无腐烂、无机械损伤的果实备用。福林酚试剂、ABTS[2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二胺盐]、DPPH(1,1-二苯基-2-三硝基苯肼)、TPTZ(三吡啶三吖嗪)、没食子酸(gallic acid)、芦丁(rutin)、抗坏血酸(ascorbic acid)标准品购于美国SIGMA公司,甲醇、乙醇、丙酮均为分析纯。
1.2 仪器与设备
LG10-24A离心机,北京京立离心机有限公司;5HA-C数显水浴恒温振荡器,常州荣华仪器有限公司;UV-2600紫外-可见分光光度计,日本岛津公司;PZF-6050电热鼓风干燥箱,上海精密实验设备有限公司;XW-80A涡旋仪,海门市其林贝尔仪器制造有限公司。
1.3 试验方法
1.3.1 样品制备
剥取洋葱外层表皮,用蒸馏水冲洗表面泥沙,在40 ℃烘箱中烘干,粉碎,过40目筛备用。
1.3.2 酚类物质提取
准备称取紫、黄、白洋葱表皮干粉0.5 g,分别加入20 mL纯水、体积分数70%甲醇水溶液、70%乙醇水溶液、70%丙酮水溶液,25 ℃浸提20 min,离心取上清液。将离心残渣重复上述操作2遍,合并上清液,转移至50 mL棕色容量瓶,并定容至刻度。贮存于4 ℃冰箱备用。
1.3.3 总酚含量的测定
总酚含量测定采用福林-酚法,参考XUE等[12]的方法并略有改动。取0.15 mL洋葱表皮酚类物质提取液于10 mL具塞比色管中,加入1.5 mL的福林酚试剂,用涡旋混匀器混匀,静置6 min。再加入1.5 mL 7 g/L的Na2CO3溶液,将此混合液在75 ℃下水浴10 min,随后立即冰浴终止反应,用蒸馏水定容至刻度。于725 nm波长处测定反应液的吸光值。同时以0.15 mL甲醇代替提取液作空白对照,配置不同浓度梯度没食子酸标准品制作标准曲线。总酚含量以每100 g洋葱皮粉末干基中所含没食子酸当量(mg gallic acid equivalents/100 g dry weight)表示,简写为mg GAE/100 g DW。重复测定3次。
1.3.4 总黄酮含量的测定
总黄酮含量测定参考ZHANG等[13]的三氯化铝分光光度法并略加改动。取2 mL提取液于10 mL具塞比色管中,加入0.3 mL 5 g/L NaNO2溶液摇匀,静置6 min后再加入0.3 mL 10 g/L AlCl3·6H2O溶液,静置6 min。然后加入4.0 mL 100 g/L NaOH溶液,再用蒸馏水定容至10 mL,静置15 min,于510 nm波长下测其吸光值。同时以2 mL甲醇代替提取液作空白对照,配置不同浓度梯度芦丁标准品制作曲线。总黄酮含量结果以干基每100 g洋葱皮所含的芦丁当量(mg rutin equivalents/100 g dry weight)表示,简写为mg Rutin/100 g DW。重复测定3次。
1.3.5 DPPH自由基清除性能测定
DPPH自由基清除性能测定参考ABU等[14]并略有改动。吸取洋葱表皮提取液0.4 mL于试管中,再加入4.5 mL 0.1 mmol/L DPPH甲醇溶液(现用现配),充分摇匀后避光反应30 min,以甲醇代替样品提取液为空白调零,在517 nm波长下测定吸光度值,配置不同质量梯度抗坏血酸(ascorbic acid)标准品制作曲线。回归方程为Y=0.01X+1.047(0~60 μg R2=0.994),其中Y为吸光值,X为抗坏血酸质量(μg)。结果以干基每100 g洋葱皮所含抗坏血酸当量来表示(mg ascorbic acid equivalents/100 g dry weight),简写mg AAE/100 g DW。重复测定3次。
1.3.6 FRAP抗氧化能力测定
参考BENZIE等[15]的方法并略有改动。工作溶液配制:300 mmol/L pH 3.6的醋酸钠缓冲液(0.364 g无水醋酸钠加入3.2 mL冰乙酸,用蒸馏水定容至200 mL)、10 mmol/L的TPTZ(0.0313 g TPTZ以40 mmol/L盐酸定容至100 mL)和20 mmol/L FeCl3溶液,按照体积比10∶1∶1混合,混匀后于37 ℃水浴备用。以FeSO4为标准溶液,根据反应后的吸光度值,在标准曲线上求得相应FeSO4的浓度(μg/mL),定义为FRAP值。回归方程为Y=0.665X-0.008(0~1 μg/mL R2=0.995 6)。结果以FeSO4当量浓度表示,单位为mg/mL。重复测定3次。
1.3.7 ABTS自由基清除能力测定
ABTS自由基清除能力测定参考RE等[16]和李青等[17]的方法并略有改动。ABTS+·工作液的制备:将7 mmol/L ABTS水溶液与2.45 mmol/L过硫酸钾溶液混合,将混合液在室温条件下避光放置12~16 h,形成ABTS+·自由基储备液。用无水乙醇稀释,在734 nm波长调整其吸光度为0.700±0.020,得到ABTS+·工作液,于30 ℃下储存备用。
吸取200 μL洋葱皮提取液加入1 mL ABTS+·工作液混合均匀,室温下避光放置30 min后于734nm波长下测其吸光度值,以甲醇作为空白对照。试验以抗坏血酸为标准物质计,得回归方程:Y=-0.004X+0.604(0~120 μg R2=0.997),其中Y为吸光值,X为抗坏血酸质量(μg)。结果以干基每100 g洋葱皮所含抗坏血酸当量来表示(mg ascorbic acid equivalents/100 g dry weight),简写mg AAE/100 g DW。重复测定3次。
1.4 数理统计
所有试验结果均表示为平均值±标准偏差。采用SPSS11.0软件进行方差分析,并进行Duncan’s差异显著性分析和相关性分析。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 不同溶剂提取对洋葱皮多酚含量的影响
不同溶剂提取紫、黄、白洋葱皮总酚含量见表1。3种洋葱皮在70%丙酮提取物中总酚(1.60~95.46 mg GAE/100 g DW)含量最高。溶剂根据提取物总酚含量顺序为:水<70%乙醇<70%甲醇<70%丙酮,且70%丙酮与水之间有极显著差异(P<0.01)。总体来看,紫洋葱皮提取物总酚含量极显著高于黄、白洋葱(P<0.01)。各品种提取物总酚含量顺序为紫洋葱皮>黄洋葱皮>白洋葱皮。
2.2 不同溶剂提取对洋葱皮总黄酮含量的影响
不同溶剂提取紫、黄、白洋葱皮总黄酮含量见表1。白洋葱皮提取物的总黄酮含量未检出。紫、黄洋葱皮在70%丙酮提取物中总黄酮(36.55~40.75 mg Rutin/100 g DW)含量最高。溶剂根据提取物总黄酮含量顺序为:水<70%甲醇<70%乙醇<70%丙酮,且70%丙酮与水提取液差异显著(P<0.05)。70%甲醇与70%乙醇提取液总黄酮含量差异不显著。总体来看,紫洋葱皮提取物总黄酮含量显著高于黄洋葱(P<0.05)。这与宋彦显等[18]结果一致。
表1 不同溶剂洋葱皮提取物总酚、总黄酮含量
Table 1 Total phenolic and flavonid contents of solvent extracts prepared from various onion peels

品种溶剂总酚含量/[mgGAE·(100gDW)-1]总黄酮含量/[mgRutin·(100gDW)-1]紫洋葱皮70%丙酮95.46±6.60a40.75±0.99a70%甲醇80.29±1.09b19.55±0.46bc70%乙醇76.96±6.36b21.19±0.57b水41.24±1.93c16.91±0.69d黄洋葱皮70%丙酮83.17±1.26a36.55±1.89a70%甲醇66.31±1.25b26.20±1.33ab70%乙醇58.93±0.74c27.12±0.25ab水19.45±2.98d12.49±0.17c白洋葱皮70%丙酮1.60±0.07and70%甲醇0.89±0.02bnd70%乙醇0.89±0.02cnd水0.77±0.03bdnd
注:同一品种同一列不同字母表示差异显著性(P<0.05);nd-未检出。
2.3 不同溶剂提取洋葱皮的DPPH自由基清除能力的影响
不同溶剂提取紫、黄、白洋葱皮DPPH自由基清除能力见图1。
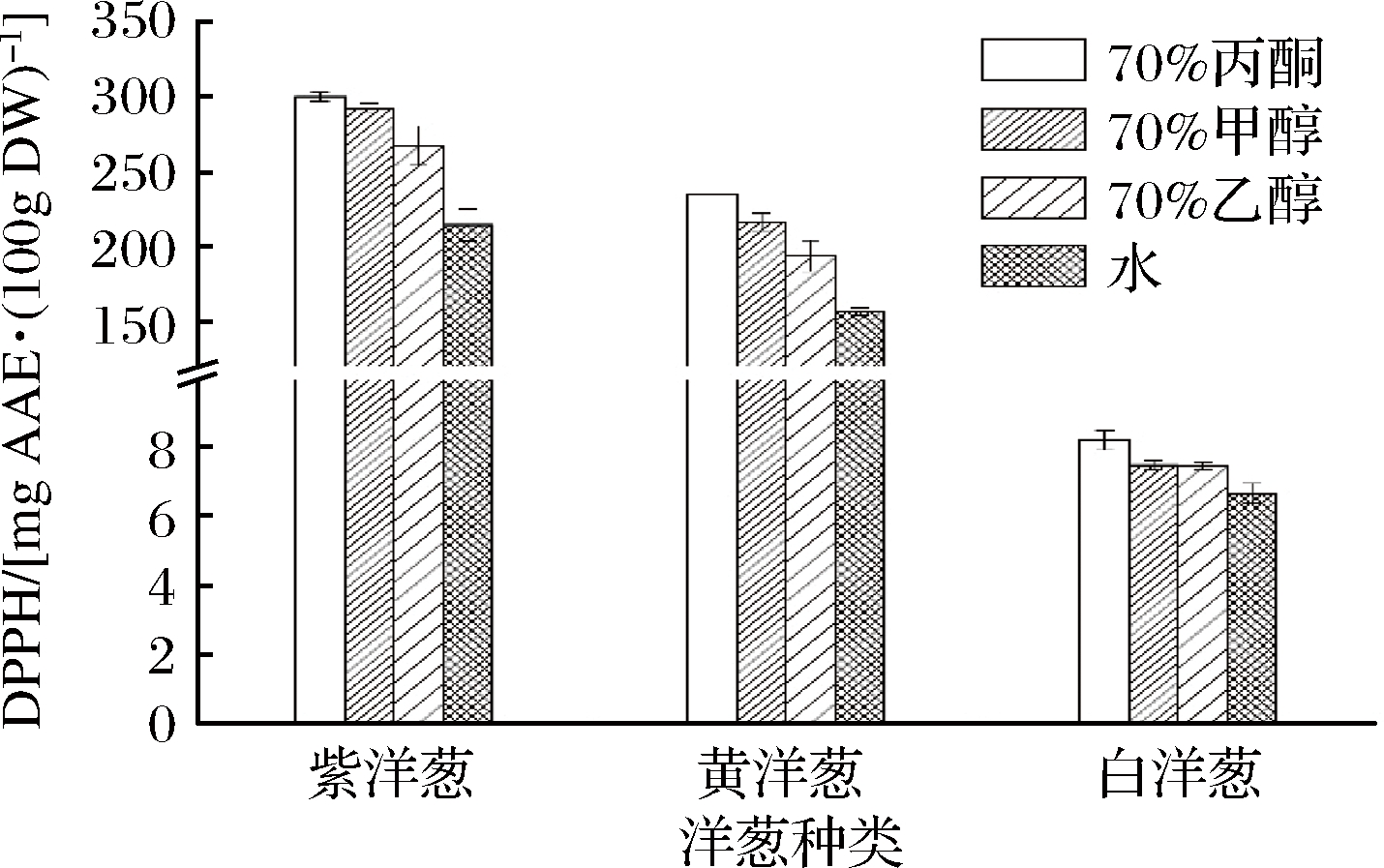
图1 不同溶剂提取不同品种洋葱皮DPPH自由基清除能力
Fig.1 DPPH radical scavenging activity of solvent extracts prepared from various onion peels
3种洋葱皮在70%丙酮提取物中DPPH自由基清除能力(8.23~300.4 mg AAE/100 g DW)最强。溶剂根据提取物总酚含量顺序为:水<70%乙醇<70%甲醇<70%丙酮,且70%丙酮与水提取液差异显著(P<0.05)。70%甲醇与70%乙醇提取液DPPH自由基清除能力差异不显著。总体来看,紫洋葱皮提取物DPPH自由基清除能力显著高于黄、白洋葱(P<0.01),DPPH自由基清除能力值顺序为紫洋葱皮>黄洋葱皮>白洋葱皮,存在品种间差异。
2.4 不同溶剂提取洋葱皮的FRAP抗氧化能力的影响
不同溶剂提取紫、黄、白洋葱皮FRAP抗氧化能力见图2。3种洋葱皮在70%丙酮提取物中FRAP抗氧化能力(0.045~7.12 mg/mL)最强。溶剂根据提取物FRAP抗氧化能力顺序为:水<70%甲醇<70%乙醇<70%丙酮,且70%丙酮与水提取液差异显著(P<0.05)。70%甲醇与70%乙醇提取液FRAP抗氧化能力差异不显著。总体来看,紫洋葱皮提取物FRAP抗氧化能力最高,白洋葱皮提取物FRAP抗氧化能力最低,且紫、黄洋葱皮FRAP抗氧化能力均极显著高于白洋葱(P<0.01),存在品种间差异。
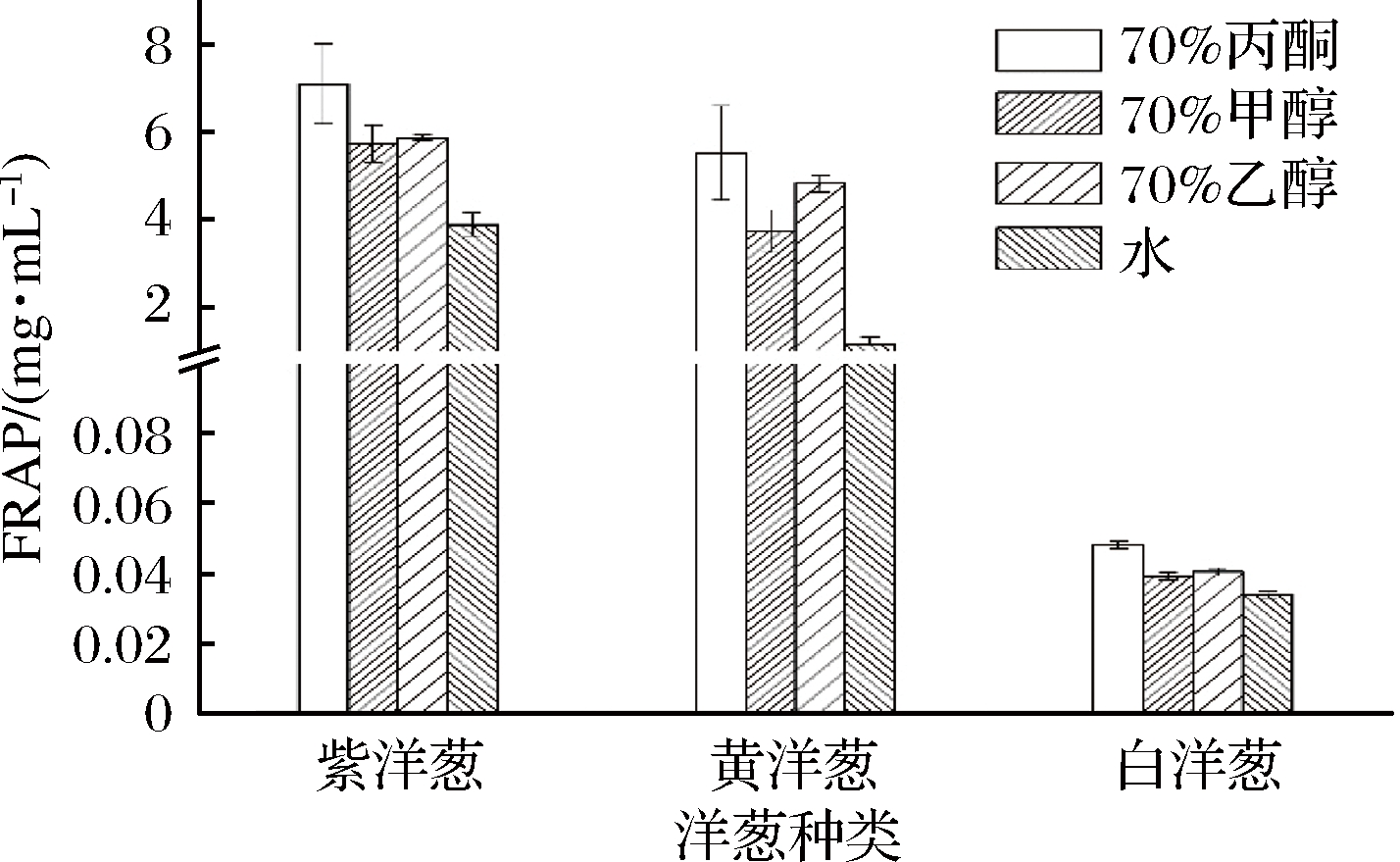
图2 不同溶剂提取不同品种洋葱皮FRAP抗氧化能力
Fig.2 FRAP values of solvent extracts prepared from various onion peels
2.5 不同溶剂提取洋葱皮的ABTS自由基清除能力的影响
不同溶剂提取紫、黄、白洋葱皮ABTS自由基清除能力见图3。

图3 不同溶剂提取不同品种洋葱皮ABTS自由基清除能力
Fig.3 ABTS radical scavenging activity of solvent extracts prepared from various onion peels
3种洋葱皮在70%丙酮提取物中ABTS自由基清除能力(8.934~494.67 mg AAE/100 g DW)最强。溶剂根据提取物ABTS自由基清除能力顺序为:水<70%乙醇<70%甲醇<70%丙酮,且70%丙酮与水提取液差异显著(P<0.05)。70%甲醇与70%乙醇提取液ABTS自由基能力差异不显著。总体来看,紫洋葱皮提取物ABTS自由基清除能力最强,白洋葱皮提取物ABTS自由基清除能力最低,且紫、黄、白洋葱皮ABTS自由基清除能力均存在极显著差异(P<0.01),存在品种间差异。
3 讨论
本试验分析紫、黄、白3种不同品种的洋葱皮提取物中抗氧化物质发现,其总酚含量、总黄酮及体外抗氧化能力在各品种间差异较大。总体趋势是紫洋葱皮抗氧化物质含量最高,抗氧化能力最强,其次是黄洋葱,白洋葱最低。多酚、黄酮类物质作为植物的次级代谢产物,与其生长环境和品种有密切关系。这种差异既可能是遗传基因长期积累的结果,也可能是气候等生态环境和成熟度条件引起的。
由于具有抗氧化活性的生物组成不同,本试验采用4种不同极性溶剂提取洋葱皮,检测总酚、总黄酮物质含量及抗氧化性。根据“相似相容”原理,提取液中酚类物质与提取溶剂有直接关系[19-21]。本试验采用溶剂的极性顺序为:70%丙酮<70%甲醇<70%乙醇<水。如表1所示,随着提取溶剂的极性增强,洋葱皮提取液中总酚、总黄酮含量降低,即70%丙酮提取液中总酚(1.60~95.46 mg GAE/100 g DW)、总黄酮(36.55~40.75 mg Rutin/100 g DW)含量均最高,水提取液中总酚(0.77~41.24 mg GAE/100 g DW)、总黄酮(12.491~16.91 mg Rutin/100 g DW)含量最低。
多项研究指出,果蔬的抗氧化活性与其酚类物质含量有关。本试验总酚含量、总黄酮含量与总抗氧化能力的相关系数均达到极显著水平,且各抗氧化指标之间的相关系数也达到极显著水平(见表2),该结论与HUKKANEN等[22]研究花楸浆果总酚含量与其抗氧化能力显著正相关一致。
表2 抗氧化能力与总酚、总黄酮含量的相关系数
Table 2 Correlation coefficient between antioxidant capacity and the total phenolic and flavonid contents
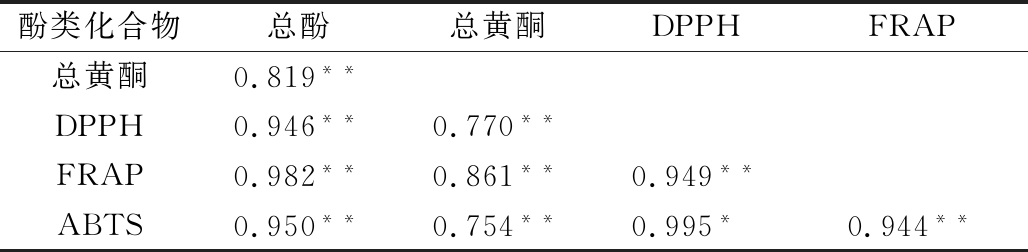
酚类化合物总酚总黄酮DPPHFRAP总黄酮0.819**DPPH0.946**0.770**FRAP0.982**0.861**0.949**ABTS0.950**0.754**0.995*0.944**
注:**表示P<0.01。
本试验结果表明总酚含量与抗氧化能力的相关性最高;紫、黄、白3种洋葱皮提取液总酚含量、总黄酮含量以及其体外抗氧化能力的差异大,表明品种间存在差异。鉴于洋葱皮中含有较多的酚类物质和较强的抗氧化活性,可以将其作为一种潜在的天然抗氧化剂资源进行开发利用。
[1] ALBISHI T,JOHN J A,AL-KHALIFA A S,et al.Antioxidative phenolic constituents of skins of onion varieties and their activities[J].Journal of Functional Foods,2013,5(3):1 191-1 203.
[2] SCHIEBER A,STINTXING F C,CARLE R.By-products of plant food processing as asource of functional compounds recent developments[J].Trends in Food Science &Technolpgy,2001,12:401-413.
[3] SRINIVASAN K.Antoxidant potential of spices and their active constituents[J].Critical Review in Food Science and Nutrion,2014,54:352-372.
[4] PUCCINELLI M T,STAM S D.Dietary bioactive diallyl trisulfide in cancer prevention and treatment[J].Internationl Journal of Molecular Sciences,2017,18(8):1 645.
[5] BEN TEZ V,MOLL
TEZ V,MOLL E,MART
E,MART N-CABREJAS M A,AGUILERA Y,et al.Characterization of industrial onion wastes (Allium cepa L.):Dietary fibre and bioactive compounds[J].Plant Foods for Human Nutrition,2011,66(1):48-57.
N-CABREJAS M A,AGUILERA Y,et al.Characterization of industrial onion wastes (Allium cepa L.):Dietary fibre and bioactive compounds[J].Plant Foods for Human Nutrition,2011,66(1):48-57.
[6] LEE K A,KIM K T,KIM H J,et al.Antioxidant activities of onion (Allium cepa L.)peel extracts produced by ethanol,hot water,and subcritical water extraction[J].Food Science and Biotechnology,2014,23(2):615-621.
[7] LESJAK M,BEARA I,SIMIN M,et al.Antioxidant and anti-inflammatory activities of quercetin and its derivatives[J].Journal of Functional Foods,2018,40:68-75.
[8] LEE J,HWANG S,HA I,et al.Comparison of bulb and leaf quality,and antioxidant compounds of intermediate-day onion from organic and conventional systems[J].Horticulture,Environment,and Biotechnology,2015,56(4):427-436.
[9] MURAYYAN A I,MANOHAR C M,HAYWARD G,et al.Antiproliferactive activity of Ontario grown onions against colorectal adenocarcinoma cells[J].Food Research International,2017,96:12-18.
[10] SHIM S Y,CHOI Y S,KIM H Y,et al.Antioxidative properties of onion peel extracts against lipid oxidation in raw ground pork[J].Food Science and Biotechnology,2012,21(2):565-572.
[11] RAHIMI-MADISEH M,HEIDARIAN E,KHEIRI S,et al.Effect of hydroalcoholic Allium ampeloprasum extract on oxidative stress,diabetes mellitus and dyslipidemia in alloxan-induced diabetic rats[J].Biomedicine &Phaermacotherapy,2017,86:363-367.
[12] XUE Z P,CAO J K,JIANG W B.Antioxidant activity and total phenolic contents in peel and pulp of Chinese jujube (Ziziphus jujube Mill)fruits[J].Journal of Food Biochemistry,2009(33):613-629.
[13] ZHANG H ,JIAN G L,YE S,et al.Systematic evaluation of antioxidant capacities of t he ethanolic extract of different tissues of jujube (Ziziphus jujuba Mill.)from China[J].Food and Chemical Toxicology,2010,48:1 461-1 465.
[14] ABU BAKAR M F,MOHAMDE M,RAHMAT A,et al.Phytochemicals and antioxidant activity of different parts of bambangan(Mangifera pajang)and tarap(Artocarpus odoratissimus)[J].Food Chemistry,2009,(113):479-483.
[15] BENZIE I F F,STRAIN J J.The ferric reducing ability of plasma (FRAP)as a measure of "Antioxidant Power":The FRAP Assay[J].Analytical Biochemistry,1996,239:70-76.
[16] RE R,PELLEGRINI N,PROTEGGENTE A,et al.Antioxidant activity applyingan improved ABTS radical cation decolorization assay[J].Free Radical Biology and Medicine,1999,26(9):1 231-1 237.
[17] 李青,张名位,张瑞芬,等.5种籼稻品种谷壳中游离态和结合态酚类物质含量及其抗氧化活性比较[J].中国农业科学,2012,45(6):1 150-1 158.
[18] 宋彦显,闵玉涛,张芳,等.红黄紫洋葱皮中黄酮含量的测定及比较[J].中国调味品,2012,37(11):94-95;105.
[19] ÇELIK S E,ÖZYÜREK M,GÜÇLÜ K,et al.Solvent effects on the antioxidant capacity of lipophilic and hydrophilic antioxidants measured by CUPRAC,ABTS/persulphate and FRAP methods[J].Talanta,2010,81(4-5):1 300-1 309.
[20] BOEING J S,BARIZ O É O,E SILVA B C,et al.Evaluation of solvent effect on the extraction of phenolic compounds and antioxidant capacities from the berries:application of principal component analysis[J].Chemistry Central Journal,2014,8(1):48.
O É O,E SILVA B C,et al.Evaluation of solvent effect on the extraction of phenolic compounds and antioxidant capacities from the berries:application of principal component analysis[J].Chemistry Central Journal,2014,8(1):48.
[21] CHAN P T,MATANJUN P,YASIR S M,et al.Antioxidant activities and polyphenolics of various solvent extracts of red seaweed,Gracilaria changii[J].Journal of Applied Phycology,2014,27(6):2 377-2 386.
[22] HUKKANEN A T,PÖLÖNEN S S,K RENLAMPI S O,et al.Antioxidant capacity and phenolic content of sweet rowanberries[J].Journal of Agricultural and Food Chemistry,2006,54:112-119.
RENLAMPI S O,et al.Antioxidant capacity and phenolic content of sweet rowanberries[J].Journal of Agricultural and Food Chemistry,2006,54:112-119.