γ-氨基丁酸(GABA)是一种天然非蛋白质类氨基酸,存在于动物、植物及微生物内,具有降血糖、降血压及抗抑郁等重要的生理功能,目前主要作为功能性食品应用,在市场上具有较广前景[1-4]。其主要是由谷氨酸脱羧酶(GAD)催化L-谷氨酸形成。目前获取GABA的方法主要为化学合成法、植物富集法及微生物发酵法[5-7],但化学合成的GABA不能用于食品领域,只能用于化工和医药领域;植物富集法得到的GABA产量较低,不能大量提取;通过微生物发酵能够产生大量的GABA,已报道的有酵母菌、乳酸菌、大肠杆菌[8-10]等,因大肠杆菌存在安全隐患,乳酸菌为食用菌且口感好,受到人们的广泛青睐,因此利用乳酸菌生产GABA较为常见。
发酵动力学能够研究发酵过程中底物的消耗速率、菌体的生长速率与产物的合成速率之间的关系,通过分析发酵动力学,可进一步了解微生物的生理特性、菌体生长与产物合成的最适条件,为后续工业化中发酵罐的过程控制以及发酵工艺的优化提供理论依据[11-12]。
粪肠乳酸球菌是兼性厌氧微生物,在有氧和无氧条件下均可生长,但在厌氧条件可促进GAD表达,并有利于乳酸菌的GABA合成,因而摇瓶水平一般采取静置发酵的形式[13-14]。但是转速直接影响基质的利用,通常静置发酵时菌株生长缓慢且生物量较低,限制了GABA的大量合成。本文通过分析不同转速下(0和100 r/min)的发酵曲线和动力学参数,基于不同转速发酵过程中菌体生长及产物合成的变化,发现72 h、0 r/min产量最高,稳定期、100 r/min生物量最高。提出了两阶段转速调控策略,并对影响此调控策略的发酵条件(阶段时间、装液量及转速)进行正交优化,进一步提高粪肠乳酸球菌合成GABA的产量,为进一步大规模生产GABA提供了基础条件。
1 材料与方法
1.1 菌种
粪肠乳酸球菌En1202由本实验室保藏。
1.2 试剂与材料
新华一号滤纸、正丁醇、冰醋酸、茚三酮、无水乙醇、CuSO4·5H2O,均购于上海生工(分析纯)。
层析液:V(正丁醇)∶V(冰醋酸)∶V(水)=2∶1∶1,并在层析液中添加8 g/L的茚三酮。
洗脱液:V(75%乙醇)∶V(6 g/L CuSO4·5H2O)=39∶1。
1.3 培养基
斜面培养基(g/L):胰蛋白胨10,酵母浸出粉10,葡萄糖5,吐温-80 0.1 mL,K2HPO4 0.2,柠檬酸二铵0.2,MgSO4 0.2,MnSO4 0.05,三水合乙酸钠5,琼脂粉20,pH 6.5;115 ℃,灭菌30 min。
种子培养基(g/L):胰蛋白胨10,酵母浸出粉10,葡萄糖5,吐温-80 0.1 mL,K2HPO4 0.2,柠檬酸二铵0.2,MgSO4 0.2,MnSO4 0.05,三水合乙酸钠5,pH 6.5;115 ℃,灭菌30 min,100 mL/250 mL摇瓶。
发酵培养基(g/L):胰蛋白胨5,酵母浸出粉5,葡萄糖10,丁二酸钠5,MSG 10,pH 6.5;115 ℃,灭菌30 min,75 mL/250 mL摇瓶。
1.4 培养方法
将斜面活化后的粪肠乳酸球菌接种于种子培养基中,30 ℃静置培养24 h。以10 %(体积分数)接种量将种子液接入75 mL/250 mL摇瓶中,30 ℃静置或100 r/min厌氧发酵72 h。
1.5 分析方法
1.5.1 生物量测定
按1.4培养方法,每隔2 h取样在酶标仪600 nm处检测吸光度,并将菌液适当稀释后涂布于斜面上于30 ℃培养48 h,观察并计算平板单菌落数(×109 CFU/mL),建立菌液吸光度与生物量的标准曲线[15],后续操作按此方法测定生物量。
1.5.2 GABA产量的测定
采用纸层析-酶标仪法[16],用微量取样器吸取1 μL发酵上清液滴在滤纸上,待滤纸干后将滤纸放进已饱和12 h的层析缸内进行层析,一段时间后取出并吹干,然后将GABA斑点剪下并放进5 mL洗脱液中洗脱,洗脱条件为40 ℃、80 r/min洗脱30 min,用酶标仪于512 nm处测定吸光度。
1.5.3 残余还原糖的测定
利用3,5-二硝基水杨酸法检测[17]。
2 结果与分析
2.1 菌体生物量标准曲线的建立
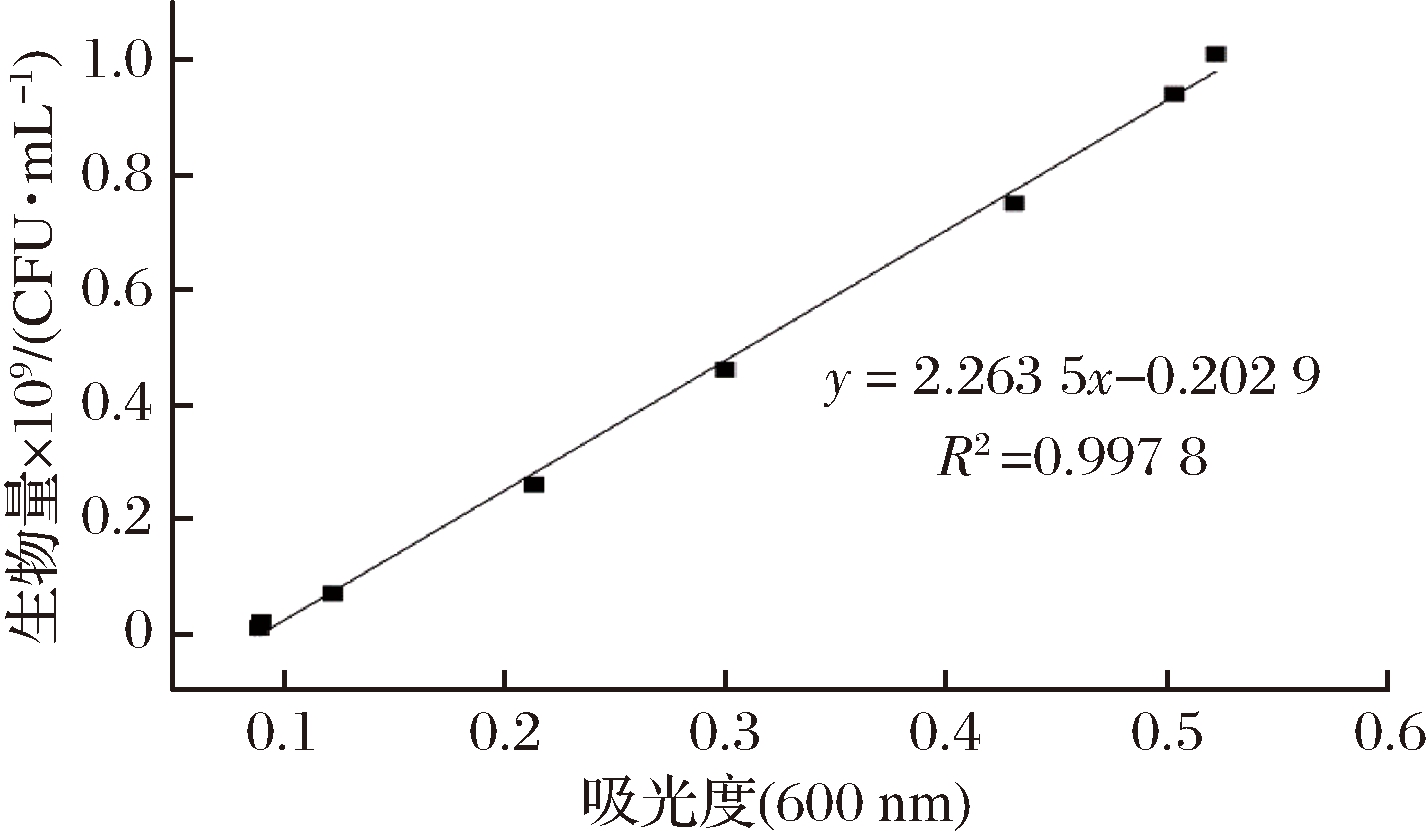
图1 菌体生物量标准曲线
Fig.1 Standard curve of bacterial biomass
由图1可见,粪肠乳酸球菌菌液的吸光度与平板单菌落数(×109 CFU/mL)之间的线性关系良好,回归方程为y=2.263 5×x-0.202 9 (R2=0.997 8),后续试验的菌体生物量可用平板单菌落数(×109 CFU/mL)表示。
2.2 不同转速下GABA发酵曲线及动力学参数分析
试验研究了不同的转速下(0和100 r/min)菌体生长与产物合成的关系,结果见图2,图中各试验点为3组重复试验后的平均值±标准差。可以看出,当转速为0时,菌体生长缓慢,32 h才达到稳定期(此时生物量为(2.755±0.055)×109 CFU/mL,稳定期仅能维持4 h);GABA产量在72 h达到最大((5.985±0.116)g/L)且趋于稳定,此时葡萄糖已基本消耗殆尽,无法继续提供菌体生长所需能量,菌体大量衰亡(此时生物量仅为(0.751±0.017)×109 CFU/mL),虽然菌体自溶会释放一定量的GAD,但由于之前GABA的积累、GAD参与的耐酸机制[18](主要体现在2方面:一是细胞进入GABA合成期时,谷氨酸脱羧合成GABA需要消耗H+,二是生成的产物GABA的碱性强于底物L-谷氨酸)对环境pH起到了调节效果,pH呈上升趋势,此时pH接近中性(pH=6.80±0.05),GAD失去活性[19],无法继续催化L-谷氨酸合成GABA。

图2 不同恒定转速条件下粪肠乳酸球菌产GABA发酵进程曲线
Fig.2 Times courses of GABA production by Enterococcus lactic acid faecalis at various constant rotational speed
而适当增加转速(100 r/min)时,12 h内菌体迅速生长,20 h便达到稳定期(此时生物量为(3.964±0.079)×109 CFU/mL,稳定期能维持28 h);GABA产量在72 h后仍再继续增长,虽然此时葡萄糖已基本消耗殆尽,无法继续提供菌体生长所需能量,菌体开始衰亡(此时生物量为(3.484±0.065)×109 CFU/mL),发酵初期由于厌氧发酵导致乳酸等有机酸积累,引起pH下降并激活GAD开始生产GABA,虽然GAD参与的耐酸机制会对环境pH起到调节效果,使pH呈上升趋势,但此时pH=4.70±0.04(LI等[20-24]研究发现发酵过程中控制pH=5.0左右,更有利于GABA的合成),还未衰亡的菌体仍可利用L-谷氨酸继续合成GABA。
综上所述,最适菌体生长和GABA合成的最佳转速并不一致,0 r/min有利于GABA的合成,100 r/min有利于菌体的生长,发酵过程中设定单一的转速,不能使菌体生长和产物合成同时达到理想状态。为在保证菌体生长的同时提高GABA产量,提出了一种两阶段转速控制策略。
2.3 不同转速下发酵动力学模型的建立与分析
发酵动力学是研究菌体生长、底物消耗以及产物生成之间的关系,通过数学建模的方法来分析参数变化及发酵规律,将复杂的发酵过程通过数学方程简化,有利于进一步探究菌体新陈代谢过程,从而对发酵过程中的参数进行准确地预测或对现有工艺进行改进[11-12]。
本试验通过建立不同转速下(0和100 r/min)的发酵动力学模型,比较不同转速发酵过程中菌体生长及产物合成的变化,并验证菌体生长与产物合成之间是否为偶联或部分偶联关系,为后续两阶段转速调控策略的优化提供理论基础。
2.3.1 菌体生长模型
Logistic方程是典型的S型曲线,可以很好地反应菌体浓度的增加对自身生长产生的抑制作用,且达到稳定期后菌体停止生长,因此微生物生长过程可以用Logistic方程来描述[25],如公式(1)所示:
(1)
式中:X,菌体生物量(×109 CFU/mL);μm,最大菌体比生长速率(h-1);Xm,最大菌体浓度(×109 CFU/mL)。
2.3.2 产物生成模型
菌体生长与产物形成之间的关系有3种,当α≠0,β=0时为一类发酵,又称偶联模型;当α≠0,β≠0时为二类发酵,又称部分偶联模型;当α=0,β≠0时为三类发酵,又称非偶联模型。由式2可知,菌体生长与产物合成之间符合部分偶联型的特征,因此可以采用Luedeking-Piret方程来描述产物的积累过程并进一步验证其是否为部分偶联关系[25]:
(2)
式中:P,产物浓度(g/L);α,菌体生长有关的产物生成比例常数;β,菌体浓度有关的产物生成比例系数。
2.3.3 底物消耗模型
GABA发酵过程中葡萄糖的消耗主要用于菌体生长及细胞代谢,假设葡萄糖参与产物的形成过程,那么还原糖消耗模型可以表示为公式(3)[26]:
(3)
式中:S,葡萄糖浓度,g/L;Yx/s,对基质的细胞得率系数;Yp/s,对基质的产物得率系数,即产物GABA得率系数;ms,微生物维持系数;此模型主要反映关键底物消耗与菌体生长、产物形成的关系。
2.3.4 发酵动力学公式的求解
当t=0时,X=X0,P=P0,S=S0求得的方程(4)、(5)和(6)分别为:
(4)
(5)
(6)
选取48 h的发酵参数作为试验数据,此阶段菌体生长达到稳定期且有衰退趋势,符合Logistic方程所描述的模型,用1stOpt软件对上述动力学方程采用Levenberg-Marquardt加通用全局优化算法,以方程误差的平方和最小化为目标,无需设置初始值,根据试验所得数据求出模型最优参数估计值,结果见表1与表2。
由表1和表2可以看出,0 r/min分批发酵的参数估计值明显小于100 r/min,进一步说明0 r/min分批发酵比100 r/min分批发酵的合成GABA多,但生物量低;2种培养的参数估计值均不等于0,证实了菌体生长与产物合成之间为部分偶联关系,部分相关型发酵过程较复杂,数学模型只能描述其动态趋势;对于以获得更大GABA产量的菌种培育工作来讲,从1-3式可知,通过培养条件和培养工艺的改善,尽可能降低维持系数ms,获得更大的u值及更长um维持时间,以及更高菌体生物量X,是提高GABA产量的有效手段,因此ms在工业上要求越小越好,所以100 r/min分批发酵相对0 r/min分批发酵更加耦合动力学模型;通过比较0与100 r/min分批发酵的实验值与模型拟合值,从表3和表4可看出,细胞的生长、产物的合成和底物的消耗均能很好地与实验值吻合,说明该模型均能较好地反映粪肠乳酸球菌在250 mL摇瓶水平上0和100 r/min分批发酵过程中的生物反应动力学。
表1 0 r/min分批发酵动力学模型参数估计值
Table 1 Parameter estimation of the shake flask (0 r/min)batch fermentation kinetics model
参数X0XmμmαβS0Yx/sYp/sms估计值0.10152.56150.19890.47390.06079.5221727.36270.14210.0390
表2 100 r/min分批发酵动力学模型参数估计值
Table 2 Parameter estimation of the shake flask (100 r/min)batch fermentation kinetics model
参数X0XmμmαβS0Yx/sYp/sms估计值0.55653.96870.45080.22620.00949.66490.42793.09170.0029
表3 0 r/min分批发酵实验值与模型预测值比较
Table 3 The experimental value of zhake flask (0 r/min) fermentation was compared with the predicted value

时间/h生物量×10-9/(CFU·mL-1)GABA产量/(g·L-1)残糖量/(g·L-1)实验值拟合值实验值拟合值实验值拟合值00.32220.10150.00000.000010.00009.522140.37860.214730.10230.09039.39769.140280.54570.43180.22530.26908.30988.4068120.71450.79420.45540.58626.76927.1802161.18051.27821.01751.06544.87215.5342201.61141.76281.58761.66563.50983.8691242.17822.12672.12872.31332.99022.5925282.53682.34512.98762.96242.20981.7917322.75502.45913.69763.60141.68961.3343362.78332.51434.49644.23220.97841.0709402.57432.53995.03454.85840.76350.9046442.35352.55175.46895.48230.68790.7842482.08922.55715.83916.10520.63840.6851
表4 100 r/min分批发酵实验值与模型预测值比较
Table 4 The experimental value of shake flask(100 r/min) fermentation was compared with the predicted value
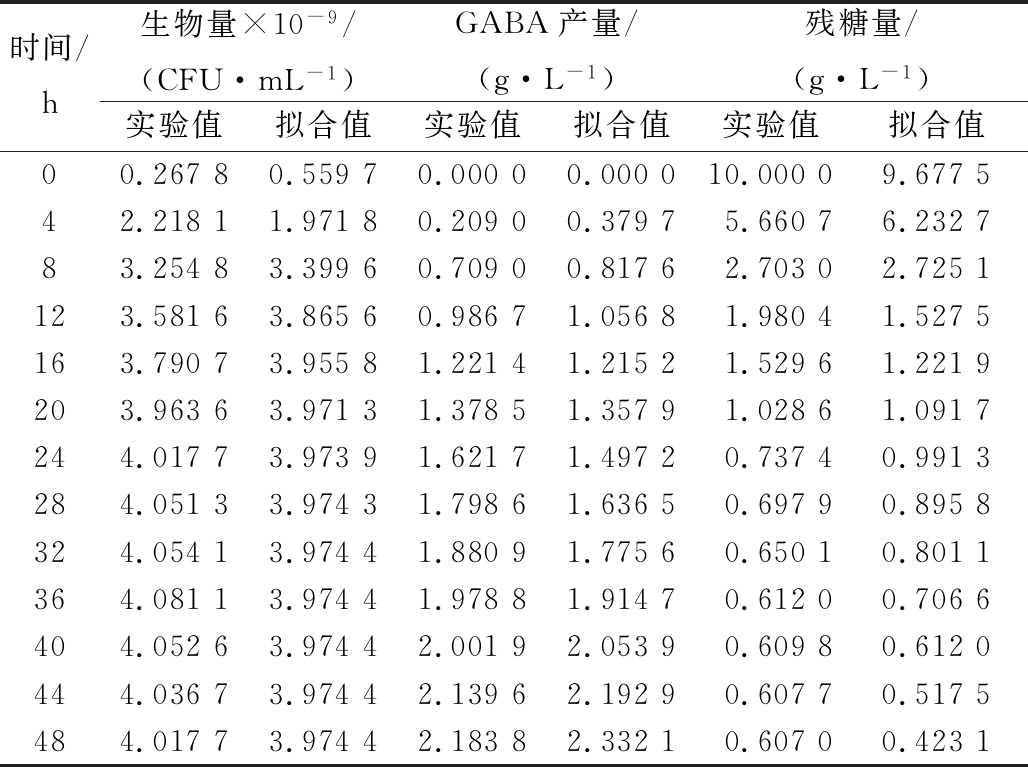
时间/h生物量×10-9/(CFU·mL-1)GABA产量/(g·L-1)残糖量/(g·L-1)实验值拟合值实验值拟合值实验值拟合值00.26780.55970.00000.000010.00009.677542.21811.97180.20900.37975.66076.232783.25483.39960.70900.81762.70302.7251123.58163.86560.98671.05681.98041.5275163.79073.95581.22141.21521.52961.2219203.96363.97131.37851.35791.02861.0917244.01773.97391.62171.49720.73740.9913284.05133.97431.79861.63650.69790.8958324.05413.97441.88091.77560.65010.8011364.08113.97441.97881.91470.61200.7066404.05263.97442.00192.05390.60980.6120444.03673.97442.13962.19290.60770.5175484.01773.97442.18382.33210.60700.4231
表5 试验因素水平表
Table 5 Factor level table

水平因素A阶段时间/h因素B装液量/mL因素C转速/(r·min-1)112505022475100336100150
2.4 两阶段转速控制策略发酵条件的优化
根据上述不同转速下(0和100 r/min)GABA发酵曲线及动力学参数分析可知72 h、0 r/min时产量最高,稳定期、100 r/min时生物量最高;结合不同转速下发酵动力学模型的理论验证,证实了菌体生长与产物合成之间为部分偶联关系。现提出两阶段转速调控策略,并对影响其的发酵条件(阶段时间、装液量及转速)进行正交优化,试验设置3个水平,采用L9(34)正交试验设计方法[27],每组试验设置3个重复。
由表6正交试验结果的极差分析可知,3个因素影响粪肠乳酸球菌发酵产GABA的主次顺序为A(阶段时间/h)、B(装液量/mL)、C(转速/(r/min))。正交试验的最优组合为试验3,且从表中可以直观看出试验3最优:装液量100 mL,在发酵前期(0~12 h)控制转速150 r/min,发酵后期(12~72 h)控制转速0 r/min,GABA产量可达到(6.713±0.135)g/L,比优化前(0 r/min和100 r/min分批发酵)分别提高了12.2%与60.1%。由此可见,该方案稳定可行,两阶段转速控制策略可以有效地提高粪肠乳酸球菌合成GABA的能力,对GABA工业化生产具有重要的参考价值和指导意义。
表6 L9(34)正交试验结果
Table 6 The Orthogonal test result of Shake flask fermentation
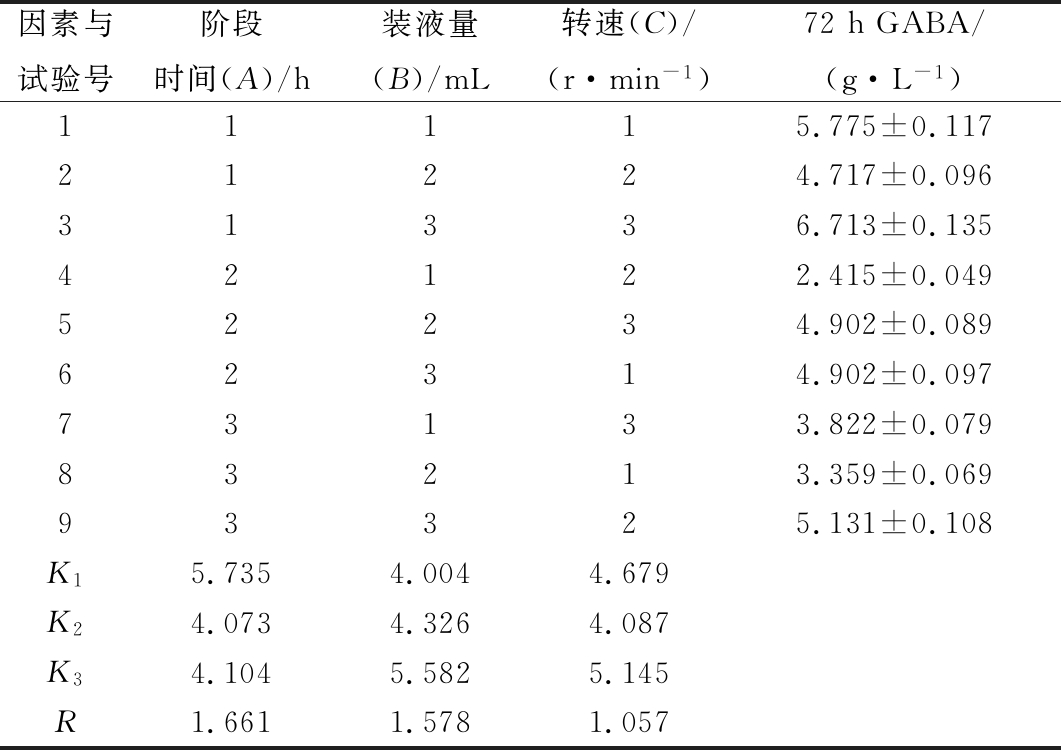
因素与试验号阶段时间(A)/h装液量(B)/mL转速(C)/(r·min-1)72hGABA/(g·L-1)11115.775±0.11721224.717±0.09631336.713±0.13542122.415±0.04952234.902±0.08962314.902±0.09773133.822±0.07983213.359±0.06993325.131±0.108K15.7354.0044.679K24.0734.3264.087K34.1045.5825.145R1.6611.5781.057
3 结论
本文通过分析不同转速下发酵曲线和动力学参数,基于不同转速发酵过程中菌体生长及产物合成的变化,且利用建立的发酵动力学模型验证了菌体生长与产物合成之间为部分偶联关系,提出了两阶段转速控制策略,并对影响此调控策略的发酵条件进行正交优化。结果表明,装液量100 mL,在发酵前期(0~12 h)控制转速150 r/min,发酵后期(12~72 h)控制转速0 r/min,GABA产量可达到(6.713±0.135)g/L,比优化前(0和100 r/min分批发酵)分别提高了12.2%与60.1%。基于两阶段转速控制策略,粪肠乳酸球菌合成GABA的能力显著提高,为下一步大规模生产GABA提供了基础条件和理论依据。
[1] LIANG F,HATANAKA Y,SAITO H,et al.Differential expression of gamma-aminobutyric acid type B receptor-1a and -1b mRNA variants in GABA and non-GABAergic neurons of the rat brain [J].Journal of Comparative Neurology,2015,416(4):475-495.
[2] MEKONNEN D W,FLÜGGE U I,LUDEWIG F.Gamma-aminobutyric acid depletion affects stomata closure and drought tolerance of Arabidopsis thaliana [J].Plant Science,2016,245:25-34.
[3] CONTI F,MELONE M,DE B S,et al.Neuronal and glial localization of GAT-1,a high-affinity gamma-aminobutyric acid plasma membrane transporter,in human cerebral cortex:with a note on its distribution in monkey cortex [J].Journal of Comparative Neurology,2015,396(1):51-63.
[4] BOONBURAPONG B,LALOKNAM S,INCHAROENSAKDI A.Accumulation of gamma-aminobutyric acid in the halotolerant cyanobacterium Aphanothece halophytica under salt and acid stress [J].Journal of Applied Phycology,2016,28(1):141-148.
[5] 尹先清,孙芳,葛胜祥.α-氨基丁酸化学合成研究进展[J].精细化工中间体,2010(1):12-14.
[6] 王斌,丁俊胄,贾才华,等.环境胁迫植物富集γ-氨基丁酸的研究进展[J].食品工业科技,2018,39(18):348-352;358.
[7] 刘佳荣.微生物发酵合成γ-氨基丁酸(GABA)的研究[D].哈尔滨:哈尔滨商业大学,2015.
[8] ANDO A,NAKAMURA T.Prevention of GABA reduction during dough fermentation using a baker's yeast dal81 mutant [J].Journal of Bioscience &Bioengineering,2016,122(4):441-445.
[9] LEE N K,PAIK H D.Bioconversion using Lactic Acid Bacteria:Ginsenosides,GABA,and Phenolic Compounds [J].Journal of Microbiology &Biotechnology,2017,27(5).
[10] PHAM V D,SOMASUNDARAM S,LEE S H,et al.Gamma-aminobutyric acid production through GABA shunt by synthetic scaffolds introduction in recombinant Escherichia coli [J].Biotechnology &Bioprocess Engineering,2016,21(2):261-267.
[11] DIVYASHRI G,PRAPULLA S G.An insight into kinetics and thermodynamics of gamma-aminobutyric acid production by Enterococcus faecium CFR 3003 in batch fermentation [J].Annals of Microbiology,2015,65(2):1 109-1 118.
[12] SHI X,CHANG C,MA S,et al.Efficient bioconversion of L-glutamate to γ-aminobutyric acid by Lactobacillus brevis resting cells [J].Journal of Industrial Microbiology &Biotechnology,2016,44(4-5):697-704.
[13] ZHAO A,HU X,PAN L,et al.Isolation and characterization of a gamma-aminobutyric acid producing strain Lactobacillus buchneriWPZ001 that could efficiently utilize xylose and corncob hydrolysate [J].Applied Microbiology and Biotechnology,2015,99(7):3 191-3 200.
[14] TAMURA T,NODA M,OZAKI M,et al.Establishment of an efficient fermentation system of gamma-aminobutyric acid by a Lactic acid bacterium,Enterococcus avium G-15,isolated from carrot leaves [J].Biological &Pharmaceutical Bulletin,2010,33(10):1 673-1 679.
[15] CAO S,ZHOU X,JIN W,et al.Improving of lipid productivity of the oleaginous microalgae Chlorella pyrenoidosa,via atmospheric and room temperature plasma (ARTP)[J].Bioresource Technology,2017,244:1 400-1 406.
[16] LIGNY C L D,REMIJNSE A G.Efficiency of chromatographic procedures.Part IV:The efficiency of paper chromatography on various kinds of Whatman paper and of thin-layer chromatography on various kinds of cellulose powder for the separation of amino-acids [J].Recueil des Travaux Chimiques des Pays-Bas,1967,86(4):421-435.
[17] PROCENTESE A,RAGANATI F,OLIVIERI G,et al.Continuous lactose fermentation by Clostridium acetobutylicum-Assessment of solventogenic kinetics [J].Bioresource Technology,2015,180:330-337.
[18] FEEHILY C,KARATZAS K A G.Role of glutamate metabolism in bacterial responses towards acid and other stresses [J].Journal of Applied Microbiology,2013,114(1):11-24.
[19] CHO Y R,CHANG J Y,CHANG H C.Production of γ-aminobutyric acid (GABA)by Lactobacillus buchneri isolated from Kimchi and its neuroprotective effect on neuronal cells[J].Journal of Microbiology and Biotechnology,2007,17(1):104-109.
[20] LI H,QIU T,GAO D,et al.Medium optimization for production of gamma-aminobutyric acid by Lactobacillus brevisNCL912 [J].Amino Acids,2010,38(5):1 439-1 445.
[21] LI H,QIU T,HUANG G,et al.Production of gamma-aminobutyric acid by Lactobacillus brevis NCL912 using fed-batch fermentation [J].Microbial Cell Factories,2010,9(1):85-85.
[22] KOMATSUZAKI N,SHIMA J,KAWAMOTO S,et al.Production of γ-aminobutyric acid (GABA)by Lactobacillus paracasei isolated from traditional fermented foods [J].Food Microbiology,2005,22(6):497-504.
[23] 夏江,梅乐和,黄俊,等.产γ-氨基丁酸的乳酸菌株筛选及诱变[J].核农学报,2006,20(5):379-382.
[24] 黄俊,LE-HE M,盛清,等.γ-氨基丁酸液体发酵过程的条件优化及补料研究[J].高校化学工程学报,2008,22(4):618-623.
[25] 张晓杰,孙君社,张秀清,等.γ-氨基丁酸分批发酵动力学的研究[J].中国酿造,2013,32(2):16-19.
[26] 黄俊,梅乐和,胡升,等.pH值控制下γ-氨基丁酸分批发酵动力学模型[J].化学工程,2008,36(9):51-54.
[27] ZHANG G,LI Y.Orthogonal experimental design method used in particle swarm optimization for multimodal problems[C]//Sixth International Conference on Advanced Computational Intelligence.IEEE,2014:183-188.