蛋白水解酶是水解蛋白质肽链的酶的总称,是一类重要的工业酶制剂,在食品、发酵、医药、纺织和洗涤等工业中具有重要应用价值[1-7]。依据蛋白质水解后新生成的氨基和羧基的数量、肽键减少数或特定游离氨基酸生成量,蛋白水解酶活力的检测方法主要有双缩脲法(Biuret法)、福林法(Folin法)、茚三酮法、三硝基苯磺酸法(2,4,6-trinitrobenzenesulfonic acid sol,TNBS法)和邻苯二甲醛法(o-phthalaldehyde,OPA法)等[8]。我国现行有关蛋白酶酶活测定的国家和行业标准中,主要采用福林法[9-11]。此法的检测原理是,依据蛋白质底物经水解后游离酪氨酸和色氨酸释放量,定量蛋白酶的活力水平[12]。
蛋白水解酶是现今研究中最为复杂的水解酶系,成员众多,水解方式迥异。通过上述原理建立起来的酶活检测方法,存在明显的局限性。例如,内肽酶是制备功能性寡肽的重要酶类,偏好水解远离多肽链末端的内部肽键,通过上述酶活测定方法显然无法满足对其酶活的快速和灵敏检测[12-16]。因为部分内肽酶水解蛋白质后,所释放的新生氨基和羧基的数量、肽键减少数或特定游离氨基酸量都处于相对较低的水平,甚至不会释放福林法检测所依赖的酪氨酸和色氨酸。
1997年,JONES等采用氟硼荧荧光素标记酪蛋白,基于荧光共振能量转移(fluorescence resonance energy transfer,FRET)技术原理,建立了胃蛋白酶等活力的均相检测方法,此法在无需对检测产物进行分离的情况下,首次实现了对蛋白酶活力的快速灵敏检测,可检测到极微量(ng级)蛋白酶的活力[17]。此法及其衍生方法先后成功用于多种蛋白水解酶或其抑制剂的检测、动力学分析及高通量筛选与分析研究[18-21]。
为了高效开发应用于食品加工、皮革制造、制药、环保和发酵工业等领域的新型蛋白酶制剂,本文以氟硼荧荧光素标记大豆分离蛋白,以此为底物建立起蛋白水解酶活力的快速均相检测方法,并就其方法学特征与可能的应用价值进行分析。所建立的新方法可以应用于现有工业蛋白酶制品的快速定量检测,并有助于蛋白水解酶新酶的研究与开发。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白,上海源叶生物科技有限公司;胰蛋白酶1∶250(>250 U/mg),北京索莱宝生物科技有限公司;木瓜蛋白酶(≥100 000 U/g)、米曲霉酸性蛋白酶(≥100 000 U/g)、枯草杆菌中性蛋白水解酶(≥200 000 U/g)和地衣芽胞杆菌碱性蛋白水解酶(≥200 000 U/g),江苏锐阳生物科技有限公司;其他蛋白水解酶为本实验室前期制备与保存。
BODIPY NHS Ester,西安瑞禧生物科技有限公司;PD-10脱盐柱,上海根生生物科技有限公司;冷冻干燥机,北京博医康实验仪器有限公司;Tecan infinite 200多功能酶标仪,瑞士Tecan公司;L-酪氨酸和二甲基亚砜(dimethyl sulfoxide,DMSO),阿拉丁试剂(上海)有限公司;福林酚,索莱宝生物科技有限公司;所用的其他化学品均为分析纯。
1.2 方法
1.2.1 荧光素分子标记大豆分离蛋白
参考HAUGLAND[22]的方法以BODIPY NHS Ester标记大豆分离蛋白制备荧光底物。基本步骤为:适量荧光素溶液(5 mg BODIPY NHS Ester溶于0.5 mL DMSO)与10倍体积蛋白溶液(10 mg大豆分离蛋白溶于1 mL 0.1 mol/L NaHCO3缓冲液,pH 8.5)混合,置于200 r/min摇床,室温下避光反应2 h;反应混合物通过PD-10脱盐柱去除游离荧光素分子,收集蛋白组分,冷冻干燥,于-20 ℃避光保存备用。
1.2.2 均相法检测蛋白水解酶活力
以缓冲液溶解荧光底物至10 μg/mL,与适度稀释的酶液分别预热至40 ℃,各取100 μL加入96孔板混匀,40 ℃下反应10 min,用酶标仪在激发波长500 nm、发射波长530 nm条件下检测荧光。以底物和酶液作为对照。蛋白水解酶的活力用相对荧光强度(RFU)表示,按公式(1)计算:
RFU=FC-(FA+FB)
(1)
式中:FC为样品荧光值;FA为底物荧光值;FB为酶液荧光值。
1.2.3 均相法的线性检测范围
以福林法[9]检测胰蛋白酶、木瓜蛋白酶、米曲霉酸性蛋白酶、枯草杆菌中性蛋白水解酶和地衣芽胞杆菌碱性蛋白水解酶,5种工业蛋白酶活力。适度稀释酶液,按1.2.2项方法于相应最适pH下反应并检测荧光。以各蛋白酶福林法活力为横坐标(X),均相法相对荧光强度为纵坐标(Y)绘制标准曲线。
1.2.4 均相法的检测限(DL)和定量限(QL)
按照1.2.3项建立的回归直线方程确定DL和QL[23],由方程(2)和(3)计算所得:
DL=3×Sb1/b
(2)
QL=10×Sb1/b
(3)
式中:Sb1为10个空白溶液的标准偏差;b为回归方程的斜率。
1.2.5 均相法的检测稳定性
配制一定浓度的胰蛋白酶溶液,按1.2.2项方法于pH 7.0(0.02 mol/L磷酸盐缓冲液)下反应并检测荧光,每个浓度检测6个平行样品,计算6次检测结果的相对标准偏差(RSD)。
1.2.6 均相法筛选新型蛋白水解酶
以本实验室制备的8种内肽酶SubA、MepB、NadA、Sed2、PepX、HypB、DppD和ProtB为检测对象,用福林法检测酶活,适度稀释后用均相法检测酶活。
2 结果与分析
2.1 均相法的线性范围
福林法标定的5种蛋白酶分别稀释后用均相法进行酶活测定,结果汇总于图1。

图1 均相法相对荧光值和福林法酶活力之间的线性关系
Fig.1 Linearity between relative fluorescence value of homogeneous method and enzyme activity determined by Folin method
胰蛋白酶检测线性范围为0.025~0.4 U/mL,拟合回归方程为:y = 461 988x-744.45(R2=0.999 6);米曲霉酸性蛋白酶检测线性范围为0.02~0.5 U/mL,拟合回归方程为:y=473 787x+4 831.6(R2=0.999);枯草杆菌中性蛋白酶检测线性范围为0.02~0.4 U/mL,拟合回归方程为:y=470 829x-786.29(R2=0.993 5);地衣芽胞杆菌碱性蛋白酶检测线性范围为0.025~0.4 U/mL,拟合回归方程为:y=572 251x+6 592.9(R2=0.996 8);木瓜蛋白酶检测线性范围为0.02~0.5 U/mL,拟合回归方程为:y=494 355x+319.87(R2=0.999 6)。在特定酶活范围内,所测相对荧光强度与相应蛋白酶活力均呈现良好的线性关系,但各回归方程斜率及线性范围有所不同,这是基于2种检测方法的原理不同。均相法检测中,高浓度荧光分子以酰胺键结合在底物蛋白分子的N-末端氨基或侧链(赖氨酸、精氨酸、谷氨酰胺、天冬酰胺)氨基,各荧光分子在空间距离上足够接近而处于FRET状态,只显示极低荧光值,底物水解后肽键断裂,底物蛋白构象发生改变,各荧光分子空间距离随之变化,打破原来的FRET状态,在激发光照射时显示较高的荧光强度[24]。均相法检测中荧光强度变化可以真实反映蛋白底物的肽键水解情况。福林法[12]检测中,部分水解产物被三氯乙酸沉淀,而可溶部分又仅以酪氨酸和色氨酸进行显色,不能全面反映蛋白底物的肽键水解情况。蛋白酶具有水解肽键的偏好性,作用于同一底物,不同蛋白酶对应产物的大小及氨基酸组成均有不同[1]。因此,对于5种所测试的工业蛋白酶,相同的福林法酶活力对应的均相法相对荧光强度有所不同,表现为回归方程斜率和线性范围差异。
2.2 均相法的检测限(DL)和定量限(QL)
检测10个空白溶液平行样本并计算标准偏差,根据5种工业蛋白酶均相法检测的回归方程,确定相应检测限和定量限,结果汇总于表1。
表1 均相法的检测限和定量限
Table 1 Detection limit and quantitative limit of homogeneous method

蛋白酶检测限/(U·mL-1)定量限/(U·mL-1)胰蛋白酶1.4×10-44.5×10-4米曲霉酸性蛋白酶1.3×10-44.4×10-4枯草杆菌中性蛋白酶1.3×10-44.4×10-4地衣芽胞杆菌中性蛋白酶1.1×10-43.7×10-4木瓜蛋白酶1.3×10-44.2×10-4
均相法检测5种工业蛋白酶的检测限和定量限结果接近但存在一定差异。如前所述,此差异仍由均相法和福林法检测原理不同所致。均相法检测5种工业蛋白酶的检测限范围为1.1×10-4~1.4×10-4 U/mL,定量限范围为3.7×10-4~4.5×10-4 U/mL,相比国标福林法推荐的检测范围10~15 U/mL,均相法检测灵敏度提高20 000倍以上。
2.3 均相法的稳定性
选择胰蛋白酶考察均相法的稳定性,在线性范围最低浓度(0.025 U/mL)、中间浓度(0.25 U/mL)及最高浓度(0.4 U/mL)做平行检测,结果汇总于表2。各检测点6次平行检测确定的相对标准偏差都小于3%,表明均相法稳定性较好。
表2 均相法的稳定性分析结果
Table 2 Stability analysis of homogeneous method
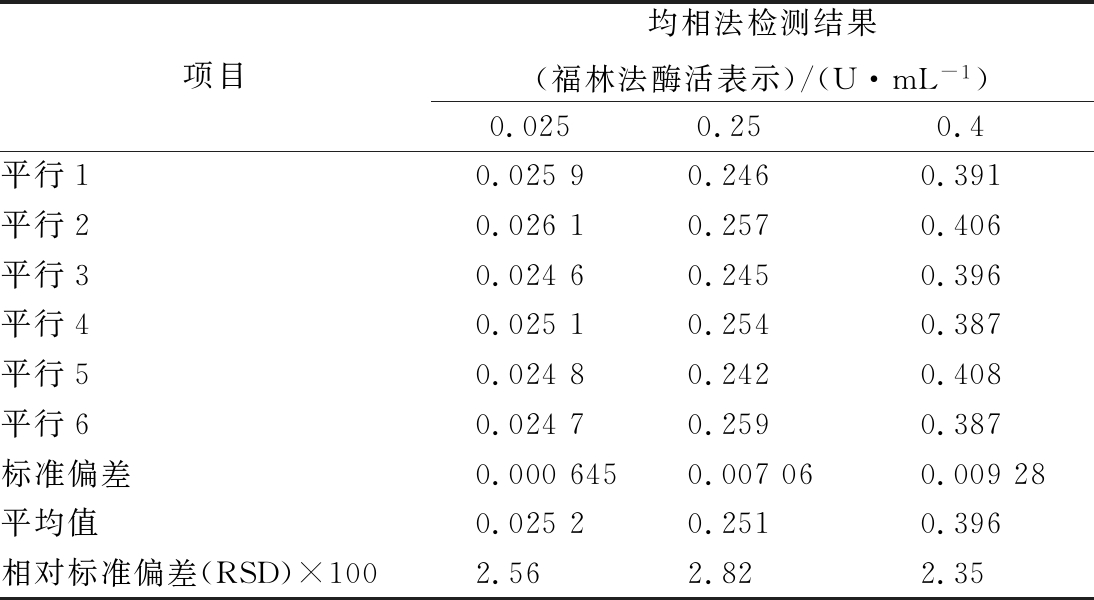
项目均相法检测结果(福林法酶活表示)/(U·mL-1)0.0250.250.4平行10.02590.2460.391平行20.02610.2570.406平行30.02460.2450.396平行40.02510.2540.387平行50.02480.2420.408平行60.02470.2590.387标准偏差0.0006450.007060.00928平均值0.02520.2510.396相对标准偏差(RSD)×1002.562.822.35
2.4 均相法用于蛋白水解酶的筛选
用均相法和福林法同时检测8种内肽酶的酶活,结果汇总于表3。8种内肽酶的酶活用均相法全部检出,而福林法仅检测出其中3种内肽酶(SubA、MepB和PepX)的酶活。在均相法检测结果中,NadA和Sed2酶活均高于PepX,后者以福林法可检测出酶活,前2者却未能检出。根据检测原理可知,NadA和Sed2对底物的水解作用强于PepX,但酶解产物中酪氨酸、色氨酸或相关寡肽的浓度却低于PepX。HypB、DppD和ProtB以均相法检测显示出活力,说明其对底物有水解作用,但因酶解产物中酪氨酸、色氨酸或相关寡肽的浓度过低而不能由福林法检测出酶活。
表3 均相法和福林法检测多种内肽酶酶活比较
Table 3 Detection of endopeptidases by homogeneous method and Folin method
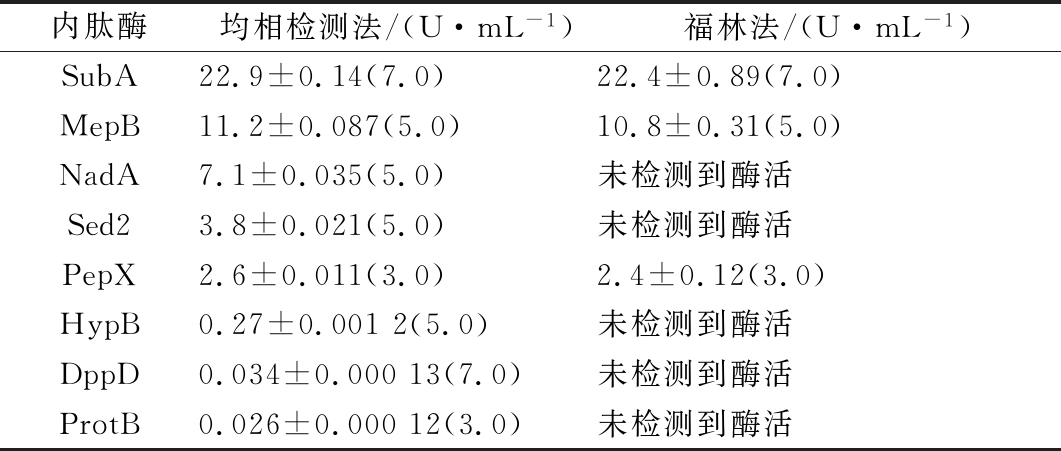
内肽酶均相检测法/(U·mL-1)福林法/(U·mL-1)SubA22.9±0.14(7.0)22.4±0.89(7.0)MepB11.2±0.087(5.0)10.8±0.31(5.0)NadA7.1±0.035(5.0)未检测到酶活Sed23.8±0.021(5.0)未检测到酶活PepX2.6±0.011(3.0)2.4±0.12(3.0)HypB0.27±0.0012(5.0)未检测到酶活DppD0.034±0.00013(7.0)未检测到酶活ProtB0.026±0.00012(3.0)未检测到酶活
注:括号内数值为酶活检测pH值。
3 讨论
本文以BODIPY NHS Ester荧光素分子标记大豆分离蛋白作为荧光底物,成功建立起工业蛋白酶活力的快速微量检测方法。其线性检测范围、检测限、定量限和稳定性等,可以满足对常见工业蛋白酶活力的定量分析,与福林法所获得的活力检测结果也具有良好的对应关系。
福林法、茚三酮法、OPA法等传统的蛋白水解酶活力测定方法,都需要对产物和底物进行分离后检测,并需要显色过程,操作步骤多,检测耗时长[12,14,16]。本文建立的均相检测法无需分离产物和底物,酶和底物反应完成后可以立刻读取荧光值计算酶活,显著提高了检测效率,且灵敏度远高于福林法。
均相法检测是依据底物(蛋白质)在蛋白水解酶作用后,其空间结构被破坏,FRET状态解除,经直接读取反应体系的荧光强度变化,进行酶活检测与定量[24]。据此原理,除以小分子量寡肽为底物的蛋白水解酶外,其他蛋白水解酶都可用均相法进行活力检测与定量分析。运用所建立的方法,对采用福林法检测活力比较困难的内肽酶,实现了活力测定,印证了均相法的检测范围更广、灵敏度更高,结果显示本法在研究新型蛋白水解酶时具有重要价值。
综上所述,本文建立了一种高效快速、可以替代福林法进行工业蛋白水解酶活力检测的方法。该方法的最大价值体现在对新型蛋白水解酶的检测中,可以拓展新酶的发现。
[1] 胡学智,王俊.蛋白酶生产和应用的进展[J].工业微生物,2008,38(4):49-61.
[2] RAO M B,TANKSALE A M,GHATGE M S,et al.Molecular and biotechnological aspects of microbial proteases[J].Microbiol Mol Biol Rev,1998,62(3):597-635.
[3] SARROUH B,SANTOS T M,MIYOSHI A,et al.Up-to-date insight on industrial enzymes applications and global market[J].Journal of Bioprocessing &Biotechniques,2012,4(002).DOI:10.4172/2155-9821.S4-002.
[4] FURHAN J,AWASTHI P,SHARMA S.Biochemical characterization and homology modelling of cold-active alkophilic protease from Northwestern Himalayas and its application in detergent industry[J].Biocatalysis and Agricultural Biotechnology,2019,17:726-735.
[5] FANG Z,YONG Y C,ZHANG J,et al.Keratinolytic protease:a green biocatalyst for leather industry[J].Applied Microbiology and Biotechnology,2017,101(21):7 771-7 779.
[6] THERON L W,DIVOL B.Microbial aspartic proteases:current and potential applications in industry[J].Applied Microbiology and Biotechnology,2014,98(21):8 853-8 868.
[7] GUENTHER F,MELZIG M F.Protease-activated receptors and their biological role-focused on skin inflammation[J].Journal of Pharmacy and Pharmacology,2015,67(12):1 623-1 633.
[8] KASANA R C,SALWAN R,YADAV S K.Microbial proteases:detection,production,and genetic improvement[J].CRC Critical Reviews in Microbiology,2011,37(3):15.
[9] GB/T 23527—2009,蛋白酶制剂[S].北京:中国标准出版社,2009.
[10] GB/T 28715—2012,饲料添加剂酸性、中性蛋白酶活力的测定分光光度法[S].北京:中国标准出版社,2013.
[11] SB/T 10317—1999,蛋白酶活力测定法[S].北京:中国标准出版社,1999.
[12] MCDONALD C E,CHEN L L.The lowry modification of the folin reagent for determination of proteinase activity[J].Analytical Biochemistry,1965,10 (1):175-177.
[13] GOA J.A micro biuret method for protein determination;determination of total protein in cerebrospinal fluid[J].The Scandinavian Journal of Clinical &Laboratory Investigation,1953,5 (3):218-222.
[14] MOORE S,STEIN W H.Photometric nin-hydrin method for use in the chromatography of amino acids[J].Journal of Biological Chemistry,1948,176:367-388.
[15] ADLER-NISSEN J.Determination of the degree of hydrolysis of food protein hydrolysates by trinitrobenzenesulfonic acid[J].Journal of Agricultural and Food Chemistry,1979,27(6):1 256-1 262.
[16] CHURCH F C,SWAISGOOD H E,PORTER D H,et al.Spectrophotometric assay using o-phthaldialdehyde for determination of proteolysis in milk and isolated milk proteins[J].Journal of Dairy Science,1983,66(6):1 219-1 227.
[17] JONES L J,UPSON R H,HAUGLAND R P,et al.Quenched bodipy dye-labeled casein substrates for the assay of protease activity by direct fluorescence measurement[J].Analytical Biochemistry,1997,251(2):144-152.
[18] THOMPSON V F,SALDANA S,CONG J,et al.A bodipy fluorescent microplate assay for measuring activity of calpains and other proteases[J].Analytical Biochemistry,2000,279(2):170-178.
[19] AGGARWAL M,SHARMA R,KUMAR P,et al.Kinetic characterization of trans-proteolytic activity of Chikungunya virus capsid protease and development of a FRET-based HTS assay[J].Scientific Reports,2015,5:14 753.
[20] CHOUGULE N P,DOYLE E,FITCHES E,et al.Biochemical characterization of midgut digestive proteases from Mamestra brassicae (cabbage moth;Lepidoptera:Noctuidae)and effect of soybean Kunitz inhibitor (SKTI)in feeding assays[J].Journal of Insect Physiology,2008,54(3):563-572.
[21] OWICKI J C.Fluorescence polarization and anisotropy in high throughput screening:perspectives and primer[J].Journal of Biomolecular Screening,2000,5(5):297-306.
[22] HAUGLAND R P.Coupling of monoclonal antibodies with fluorophores[M].Monoclonal Antibody Protocols:Humana Press,1995:205-221.
[23] MILLER J N.Basic statistical methods for analytical chemistry Part 2.Calibration and regression methods a review[J].Analyst,1991,116:3-14.
[24] RUNNELS L W,SCARLATA S F.Theory and application of fluorescence homotransfer to melittin oligomerization[J].Biophysical Journal,1995,69(4):1 569-1 583.