目前市场的饮料品种繁多,为了使其具有更好的口感和更好的功能作用,不法商家违规滥用、超范围使用添加剂。咖啡因与茶碱属于生物碱类,可乐型碳酸饮料、茶、咖啡及植物类饮料中含有上述一种或两种成分。适量的摄入,可缓解紧张情绪,改善血管功能,利尿,扩血管;过量摄入,则会产生心动过速、高血压、胃病、失眠等不良反应[1]。糖精钠、安赛蜜、阿斯巴甜、纽甜和三氯蔗糖是饮料中常用的非糖类甜味剂,一般甜度很高,用量极少[2]。2017年10月31日《关于爱德万甜等6种食品添加剂新品种、环己基氨基磺酸钠(又名甜蜜素)等6种食品添加剂扩大用量和使用范围》的公告(2017年第8号)中增补新型甜味剂爱德万甜[3],在茶、咖啡、植物(类)饮料中的限量为0.003 g/kg,固体饮料的限量为0.004 g/kg。
咖啡因和非糖类甜味剂检测的国家标准[4-9]采用不同的检测方法。糖精钠、安赛蜜、阿斯巴甜、纽甜、咖啡因和三氯蔗糖均采用高效液相色谱法,其中,糖精钠、安赛蜜、阿斯巴甜、纽甜和咖啡因使用紫外检测器或二极管阵列检测器,三氯蔗糖使用蒸发光散射检测器,且样品的预处理方法各不相同。爱德万甜和茶碱目前暂无国标方法,爱德万甜主要采用高效色谱法和高效液相串联质谱法[10-11],茶碱主要采用高效色谱法[12]。可见,目前检测上述几种成分主要采用高效液相色谱法,且均只针对某种或某几种成分的检测,尚未见对同一样品中2种生物碱和6种甜味剂同时进行测定的报道。采用高效液相色谱法可能会遇到以下问题:(1)仅靠保留时间对色谱峰定性,对保留时间相近的色谱峰定性不准确;(2)很难排除复杂基质样品中基质对成分的干扰。因此,建立一种能同时测定这些成分,且定性定量准确的方法十分必要。本实验超高效液相色谱-串联三重四极杆质谱(ultra-performance liquid chromatography-mass spectrometry/mass spectrometry,UPLC-MS/MS),能在较短的时间内对2种生物碱和6种甜味剂进行一次性的分离和测定,填补了饮料中新型甜味剂爱德万甜和2种生物碱同时测定的空白。
1 材料与方法
1.1 材料与试剂
甲醇、乙腈(色谱纯),默克股份两合公司;甲酸铵、甲酸(色谱纯),Aladdin公司;乙酸铵(色谱纯),Macklin公司。爱德万甜(含量≥97.0%),美国SIGMA公司;糖精钠(1.0 g/L),中国计量科学研究院;安赛蜜(1.0 g/L),农业部环境保护科研监测所;三氯蔗糖(含量为98.5%),德国Dr Ehrenstorfer公司;阿斯巴甜(含量为97.7%),德国Dr Ehrenstorfer公司;纽甜(含量100%),美国stanford公司;咖啡因(含量为100%)、茶碱(含量为100%),中国检验测疫科学研究院。
10批样品(3批茶饮料和7批果蔬汁),均来源2018年湖北省抽检样品。
1.2 仪器与设备
XEVOTMTQ-S液相色谱-串联质谱,美国Waters公司;Milli-Q超纯水器,美国Millipore公司;LC-250超声波清洗机,山东济宁鲁超超声设备有限公司;台式离心机,德国Thermo Biofuge公司;ACQUITY UPLC® BEH C18,美国Waters公司;XP504电子天平,瑞士梅特勒公司。
1.3 方法
1.3.1 标准溶液的配制
分别精密称取一定量各标准物质于棕色容量瓶中,加甲醇溶解并定容至刻度,配制成质量浓度为10 mg/L标准储备溶液。临用时,用空白样品提取液逐级稀释,根据每种目标化合物的定量限,配制成不同浓度的系列基质混合标准工作液。
1.3.2 前处理方法
精确称取1.0 g样品置于10 mL比色管中,加入V(乙腈)∶V(水)=20∶80混匀,定容至刻度,超声10 min,以10 000 r/min离心5 min,上清液过0.22 μm有机滤膜,待测。
1.3.3 色谱-质谱条件
色谱柱:ACQUITY UPLC® BEH C18(1.7 μm,2.1 mm×50 mm);进样量2 μL;柱温35 ℃;流速0.3 m/min;流动相:A相为0.1%甲酸溶液,B相为乙腈;流动相梯度洗脱程序:0~2.00 min,97%A~90%A;2.00~8.00 min,90%A~60%A;8.00~10.00 min,60%A~10%A;10.00~10.10 min,10%A~97%A;10.10~13.00 min,97% A;离子源:电喷雾离子源(ESI);扫描方式:正负离子扫描;扫描模式:多反应监测(MRM);毛细管电压3.5 kV;去溶剂温度350 ℃;去溶剂气流速800 L/Hr。详细的质谱参数列于表1。
2 结果与分析
2.1 样品提取的优化
8种目标化合物中,咖啡因和爱德万甜更易溶于有机溶剂,其他6种易溶于水,所以选择了乙腈∶水的体积比分别为:2∶8、5∶5、8∶2等3种提取液,对8种目标化合物的提取回收率进行比较。结果表明,阿斯巴甜、纽甜、爱德万甜、三氯蔗糖和咖啡因3种溶剂提取回收率相近。当提取溶剂中乙腈体积分数为80%时,糖精钠,安赛蜜的回收率显著下降;当提取溶剂中乙腈体积分数≥50%时,茶碱回收率显著下降。回收率下降的原因可能是3种物质均为水溶性,有机相比例增大时,降低了提取效率。故本文选用V(乙腈)∶V(水)=2∶8作为提取溶剂。
表1 八种化合物的保留时间和质谱参数
Table 1 Retention times and MS parameters for 8 target compounds
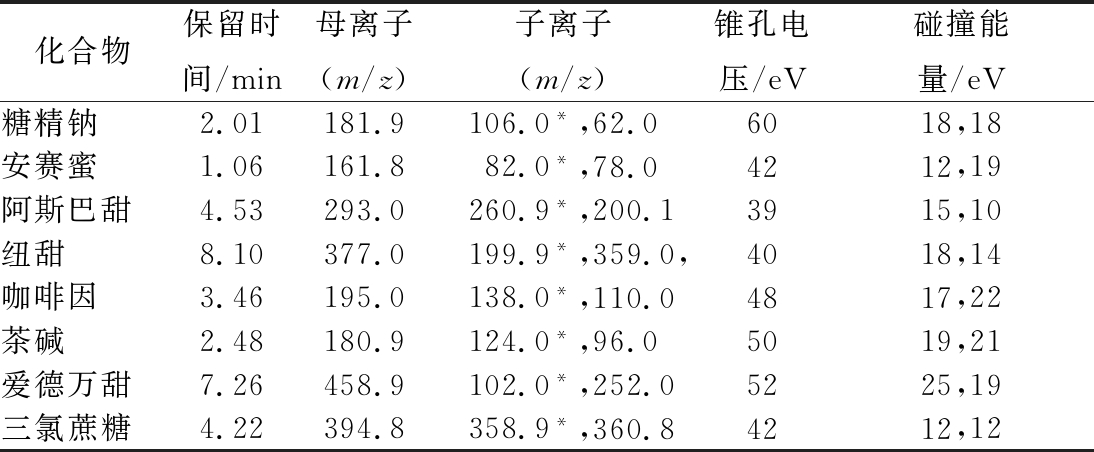
化合物保留时间/min母离子(m/z)子离子(m/z)锥孔电压/eV碰撞能量/eV糖精钠2.01181.9106.0*,62.06018,18安赛蜜1.06161.882.0*,78.04212,19阿斯巴甜4.53293.0260.9*,200.13915,10纽甜8.10377.0199.9*,359.0,4018,14咖啡因3.46195.0138.0*,110.04817,22茶碱2.48180.9124.0*,96.05019,21爱德万甜7.26458.9102.0*,252.05225,19三氯蔗糖4.22394.8358.9*,360.84212,12
注:*表示定量离子对。
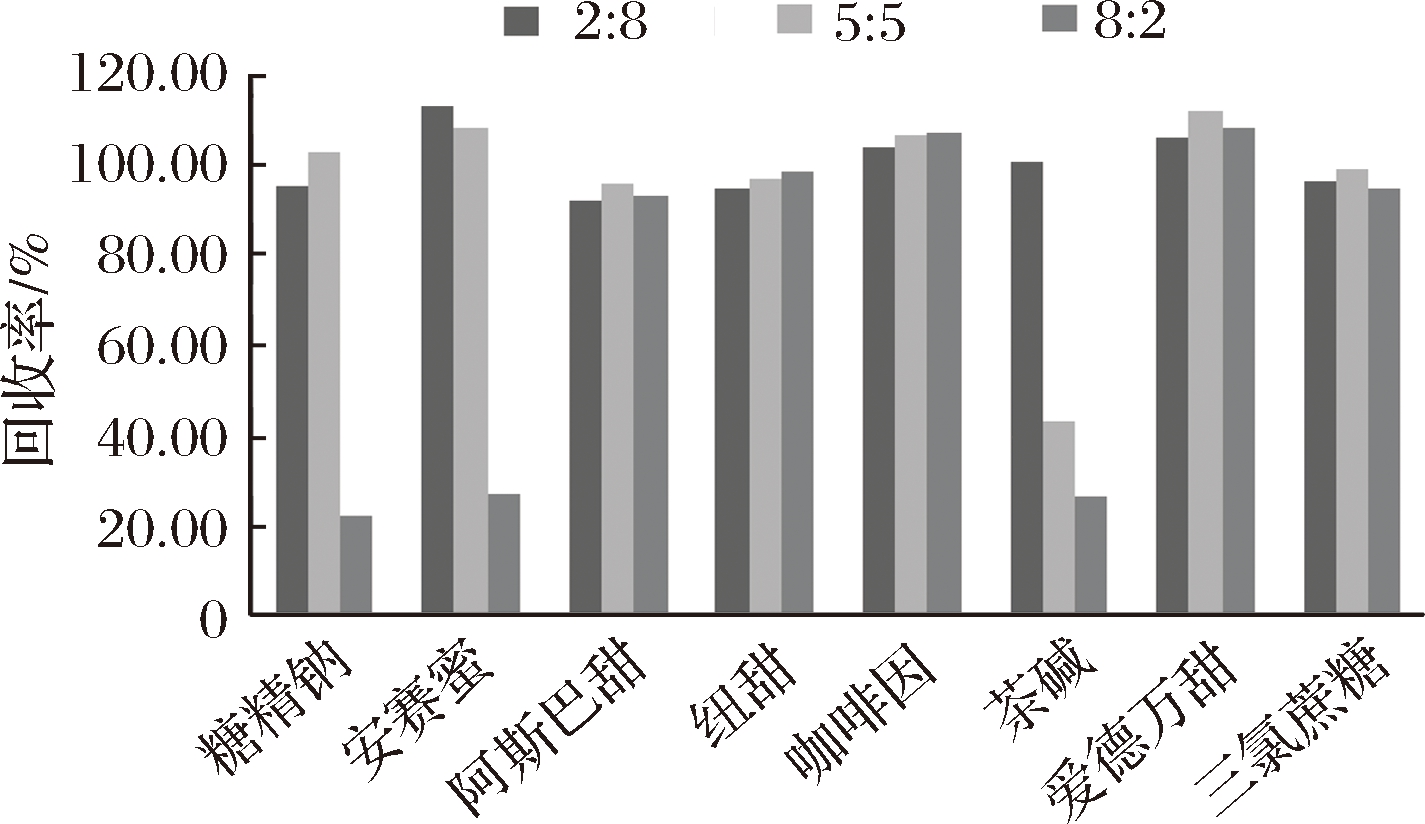
图1 三种提取溶剂提取回收率的比较
Fig.1 Comparison of the recovery of three extracting solvents
2.2 色谱条件的优化
流动相的选择对于目标物的分离、灵敏度以及峰形有较大的影响。本文考察了乙腈-0.1%甲酸溶液、乙腈-0.01 mol/L甲酸铵溶液、乙腈-0.01 mol/L乙酸铵溶液(含0.05%甲酸)和乙腈-0.01 mol/L乙酸铵溶液四种流动相体系,见图2。
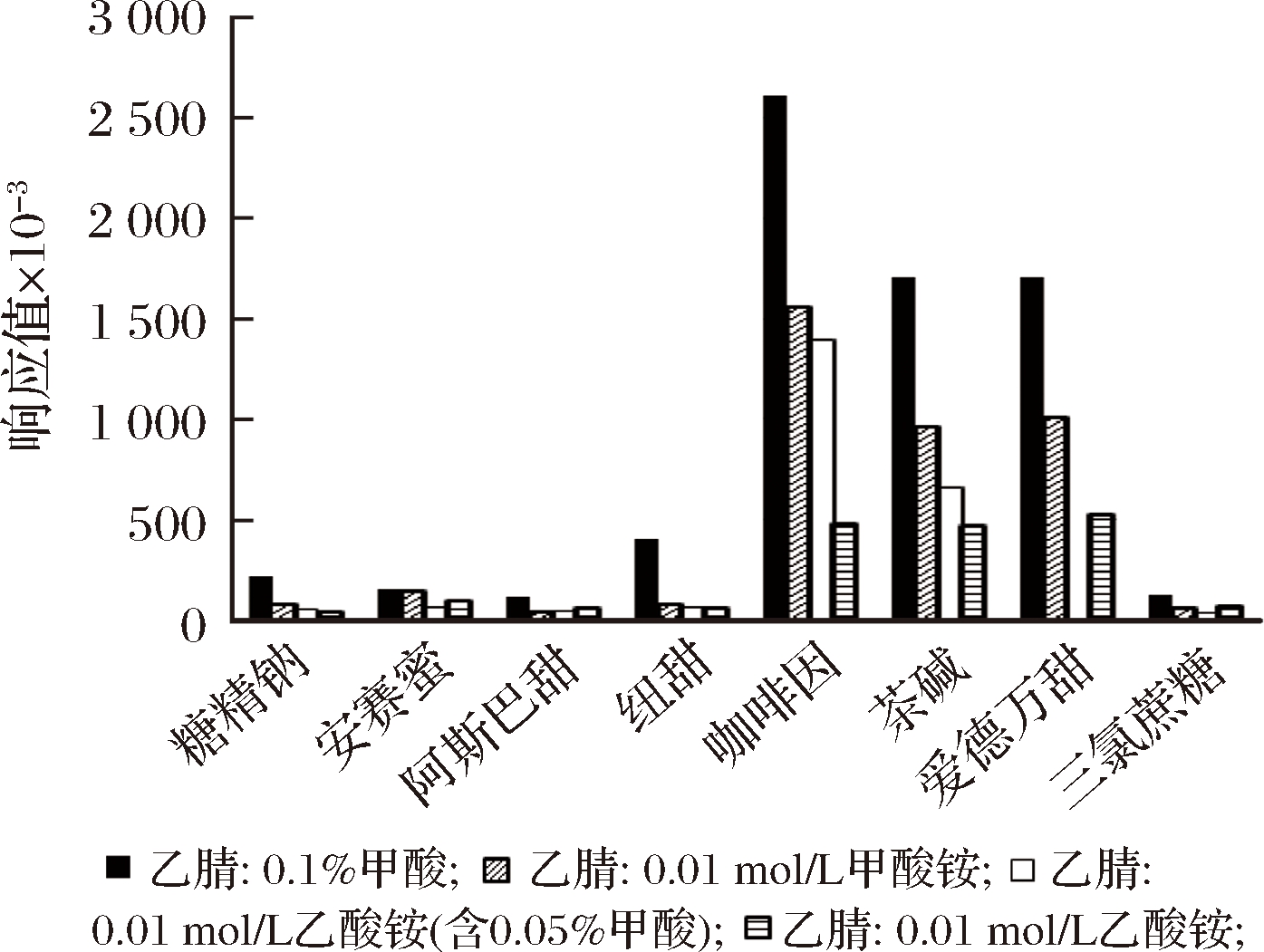
图2 四种流动相体系的比较
Fig.2 Comparison of four mobile phase systems
结果表明,以乙腈-0.1%甲酸溶液作为流动相体系时,8种目标化合物的响应均优于其他流动相体系,且峰形较好。故选择乙腈-0.1 %甲酸溶液作为流动相体系。
2.3 质谱条件的优化
分别在正离子和负离子模式下对各质量浓度为200 ng/mL的目标化合物单一对照溶液进行全扫描,选出合适的电离方式及母离子;在确定ESI离子监测模式后,分别以分子离子为母离子,对其子离子进行全扫描,选取丰度较强及干扰较小的2个子离子分别作为定量离子和定性离子;以子离子扫描(daughter scan)方式,优化了目标化合物二级质谱的碰撞能量等质谱分析参数(表1),色谱图见图3。
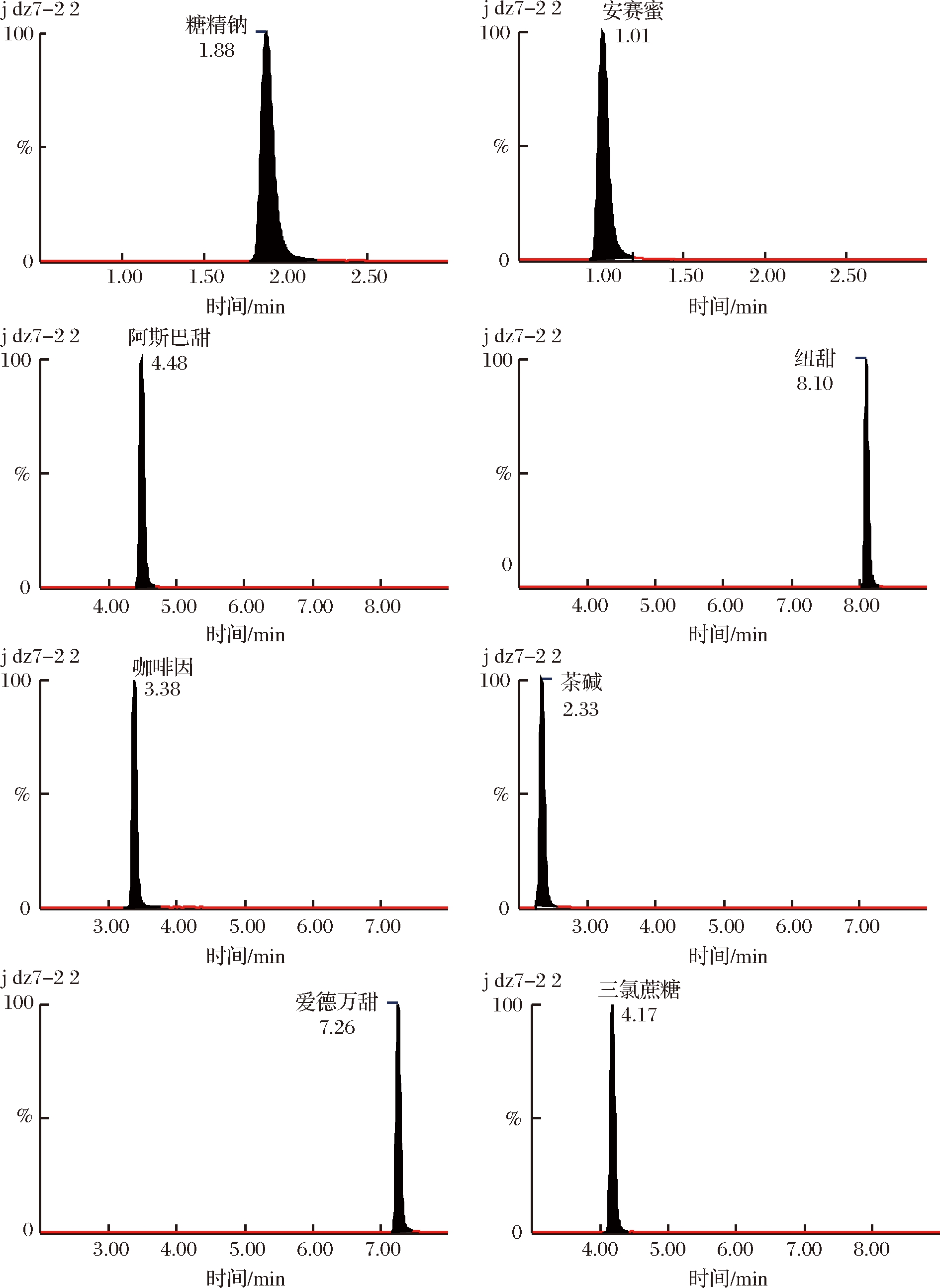
图3 混合标准样品的定量离子色谱图
Fig.3 Quantitative ion chromatograms of mixed standards
2.4 基质效应(matrix effect,ME)
评价基质效应是指样品中除被分析物以外的化合物在分析过程中对目标物有显著干扰,并影响结果准确性的现象。以典型样品果蔬汁为样品基质,建立的快速测定方法中虽然采用V(乙腈)∶V(水)=20∶80提取溶液可以沉淀部分蛋白质,但未对样品溶液进行净化处理,可能存在一定的基质效应,所以采用基质标准曲线与溶剂标准曲线的斜率百分比和样品加标回收率两种方式来评价基质效应(ME)[13-15]。当ME>100%时,基质存在离子化增强作用;当ME<100%时,基质存在离子化抑制作用。结果见图4。
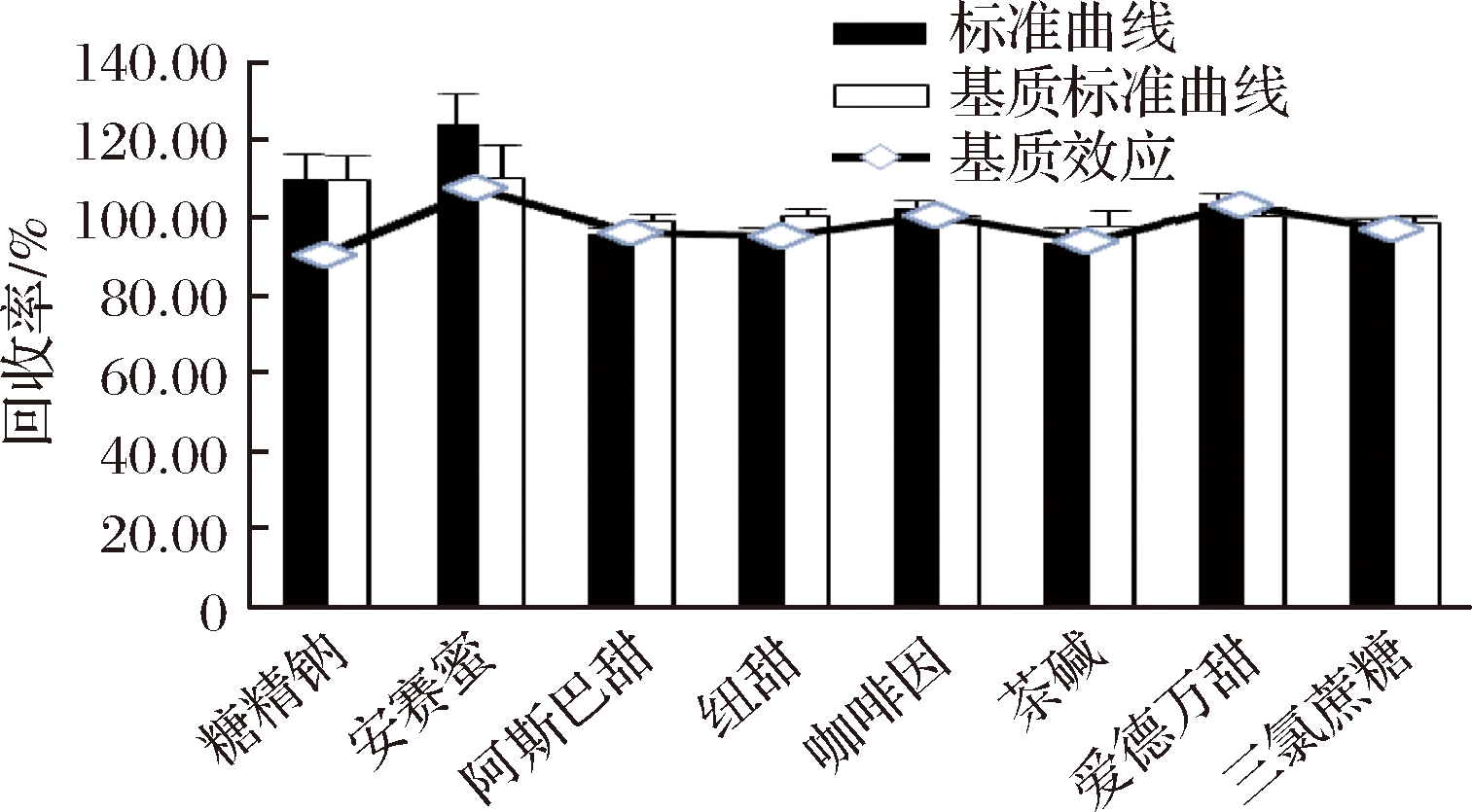
图4 饮料基质对8种目标化合物的基质效应
Fig.4 Matrix effect of 8 target compounds in drink
由图4可见,安赛蜜、咖啡因和爱德万甜存在离子化增强作用,糖精钠、阿斯巴甜、纽甜、茶碱和三氯蔗糖存在离子化抑制作用。由基质标准曲线和溶液标准曲线分别测定的加标回收率可见,咖啡因和三氯蔗糖的溶液标准曲线回收率略优于基质标曲回收率,其他6种目标测定物基质回收率均优于溶液标准曲线回收率。虽然基质效应值在85%~115%,为了获取更准确的定性、定量结果,综合考虑加标回收率结果,本文采用系列基质标准工作液进行分析。
2.5 检出限、定量限和线性范围
用饮料空白样品按照1.3节前处理方法得到样品提取液,根据目标化合物的质谱响应强弱配制成不同浓度的混合标准溶液系列、以目标化合物的色谱峰面积Y对其质量浓度x(μg/mL)进行线性回归,用空白基质提取液稀释标准溶液,直到获得每种目标化合物的信噪比S/N≥3和S/N≥10的浓度,确定其为该化合物的检出限和定量限,结果见表2。
表2 线性方程、线性范围及相关系数
Table 2 Linear equations,linear ranges and correlation coefficient

化合物线性方程线性范围/(μg·mL-1)相关系数(r)糖精钠Y=45.1283X+2768.220.2~40.9956安赛蜜Y=220.14X+10770.50.04~80.9955阿斯巴甜Y=429.884X+7731.530.0300~3.5830.9970纽甜Y=651.394X-75.68850.014~0.2710.9996咖啡因Y=783.893X+10185.40.004~14.0880.9994茶碱Y=2140X+2537.330.006~0.8730.9984爱德万甜Y=3327.2X-25.77260.001~0.020.9994三氯蔗糖Y=15.9481X-8.79970.126~2.3230.9996
饮料中各目标化合物在相应的浓度范围内,线性关系良好,相关系数均大于0.995,检出限为0.009~0.5 mg/kg,定量限均为0.03~2 mg/kg。与咖啡因和非糖类甜味剂检测的国家标准相比较,其灵敏度显著提高(表3)。
表3 本方法与国标方法的LODs和LOQs比较
Table 3 Comparison of LODs and LOQs with the method and national standards
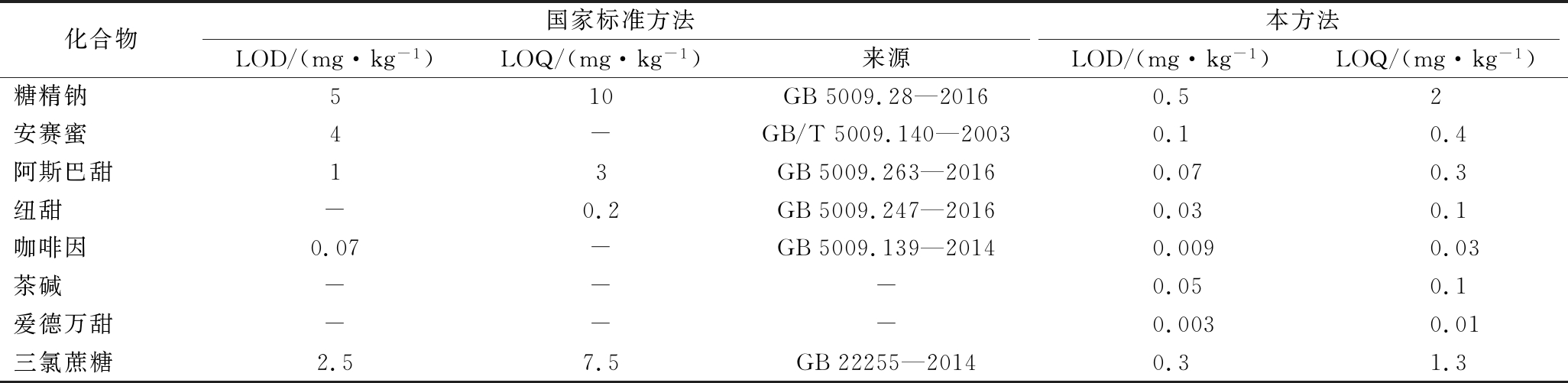
化合物国家标准方法本方法LOD/(mg·kg-1)LOQ/(mg·kg-1)来源LOD/(mg·kg-1)LOQ/(mg·kg-1)糖精钠510GB5009.28—20160.52安赛蜜4-GB/T5009.140—20030.10.4阿斯巴甜13GB5009.263—20160.070.3纽甜-0.2GB5009.247—20160.030.1咖啡因0.07-GB5009.139—20140.0090.03茶碱---0.050.1爱德万甜---0.0030.01三氯蔗糖2.57.5GB22255—20140.31.3
注:“-”表示没有检出。
2.6 回收率与精密度
在空白饮料样品添加8种标准溶液,添加水平为LOQ、3LOQ和5LOQ,每个添加水平平行分析6次,平均回收率为92.3%~110.4%,相对标准偏差(RSD)为0.9%~10.8% (n=6)(见表4)。
表4加标样品的回收率和相对标准偏差(n= 6)
Table 4 Recoveries and RSDs of target compoudsad- vantame in spiked samples
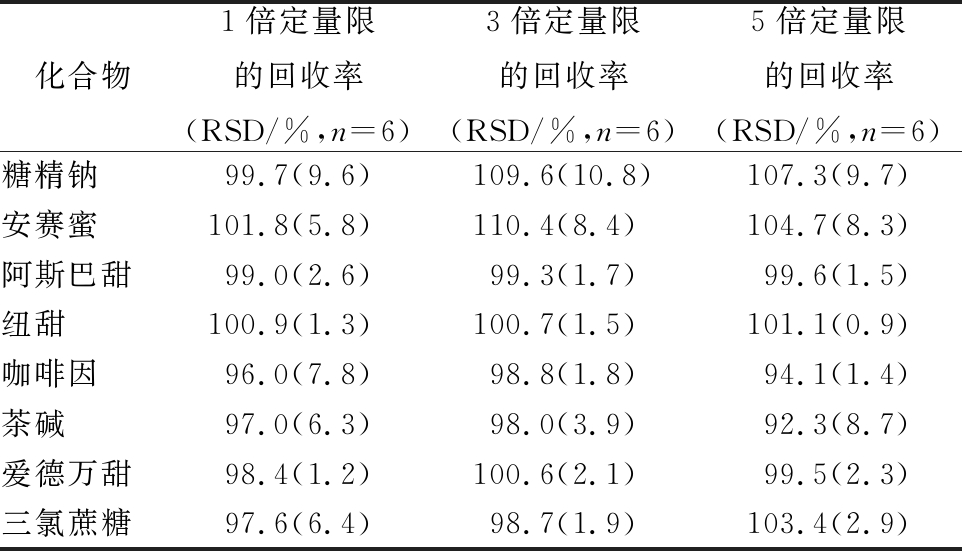
化合物1倍定量限的回收率(RSD/%,n=6)3倍定量限的回收率(RSD/%,n=6)5倍定量限的回收率(RSD/%,n=6)糖精钠99.7(9.6)109.6(10.8)107.3(9.7)安赛蜜101.8(5.8)110.4(8.4)104.7(8.3)阿斯巴甜99.0(2.6)99.3(1.7)99.6(1.5)纽甜100.9(1.3)100.7(1.5)101.1(0.9)咖啡因96.0(7.8)98.8(1.8)94.1(1.4)茶碱97.0(6.3)98.0(3.9)92.3(8.7)爱德万甜98.4(1.2)100.6(2.1)99.5(2.3)三氯蔗糖97.6(6.4)98.7(1.9)103.4(2.9)
2.7 实际样品测定
采用本文建立的方法对市售的10个饮料样品进行前处理(3个茶饮料,7个果蔬汁饮料),并采用超高效液相色谱-串联质谱进行了检测,其中3个样品检出咖啡因和茶碱,1个样品检出安赛蜜和阿斯巴甜,其他成分未检出,结果见表5。
3 结论
本文建立了超高效液相色谱-串联三重四极杆质谱快速测定饮料中2种生物碱和6种甜味剂的方法。以V(乙腈)∶V(水)=20∶80超声提取样品后,用超高效液相色谱-串联质谱分析检测,并进行了方法学验证和10个实际样品的测定。该方法简单、快速,灵敏,准确,其定量限低于国家标准,适用于饮料中2种生物碱和6种甜味剂检测,填补了饮料中新型甜味剂爱德万甜和2种生物碱同时测定的空白,可为食品安全监管提供有效保障。
表5 样品测定结果表 单位:mg/kg
Table 5 The results of the samples

化合物样品编号1#2#3#4#5#6#7#8#9#10#糖精钠NDNDNDNDNDNDNDNDNDND安赛蜜NDNDNDND18.4NDNDNDNDND阿斯巴甜NDNDNDND12.1NDNDNDNDND纽甜NDNDNDNDNDNDNDNDNDND咖啡因NDNDNDNDNDNDND98.3100.9128.1茶碱NDNDNDNDNDNDND0.110.10.11爱德万甜NDNDNDNDNDNDNDNDNDND三氯蔗糖NDNDNDNDNDNDNDNDNDND
注:ND表示没有检出。
[1] 王翔,李萍艳,万再聪,等.绿茶中提取咖啡因的方法研究[J].安徽农业科学,2009,37(8):3 598-3 599.
[2] 张倩勉,盘正华,范兴,等.HPLC-MS法测定饮料中甜蜜素等6种非糖类甜味剂含量[J].安徽农业科学,2017,45(13):99-102;118.
[3] 国家卫生计生委.中华人民共和国国家卫生和计划生育委员会第 8号公告[EB/OL].(2017-10-20).http://www.nhfpc.gov.cn/sps/s7890/201710/c4cc46c01005 445f88ad169c8e 820aee.Shtml
[4] GB 5009.28-2016食品安全国家标准食品中苯甲酸.山梨酸和糖精钠的测定[S].北京:中国标准出版社,2016.
[5] GBT 5009.140-2003饮料中乙酰磺胺酸钾的测定[S].北京:中国标准出版社,2012.
[6] GB 5009.263-2016食品安全国家标准食品中阿斯巴甜和阿力甜的测定[S].北京:中国标准出版社,2016.
[7] GB 5009.247-2016食品安全国家标准食品中纽甜的测定[S].北京:中国标准出版社,2016.
[8] GB5009.139-2014食品安全国家标准食品中咖啡因的测定[S].北京:中国标准出版社,2014.
[9] GB 22255-2014食品安全国家标准食品中三氯蔗糖(蔗糖素)的测定[S].北京:中国标准出版社,2014.
[10] 汪辉,黄小贝,刘江,等.超高效液相色谱-串联质谱快速测定食品中的新品种甜味剂爱德万甜[J].色谱,2018,36(7):700-704.
[11] 汪辉,曹阳,曹雄杰,等.高效液相色谱法测定食品中的爱德万甜[J].分析测试学报,2018,37(5):635-638.
[12] 曾永芳,覃昆飞,李莜.超高效液相色谱法同时测定奶茶饮品中的10种添加剂[J].中国卫生检验杂志,2018,28(15):1 806-1 809;1 813.
[13] 郑佳,郗存显,曹淑瑞,等.QuEChERS-超高效液相色谱-串联质谱法同时测定保健食品中21种非法添加化学药物[J].色谱,2017,35(12):1 257-1 265.
[14] TSO J,AGA D S.A systematic investigation to optimize simultaneous extraction and liquid chromatography tandem mass spectrometry analysis of estrogens and their conjugated metabolites in milk [J].J Chromatogr A,2010,1217(29):4 784-4 795.
[15] 茹歌,王柯,陈丹丹,等.超高效液相色谱-串联质谱法同时测定化妆品中13种性激素含量[J].分析测试学报,2018,37(4):464-470.