20世纪60年代初,MORISE等[1]从多管水母(Aequorea victoria)中分离出一种发光蛋白,并命名为aequorin。由于aequorin在紫外光(UV)或蓝光激发下会发出绿色荧光,所以被称为绿色荧光蛋白(green fluorescent protein,GFP)。后来,PRASHER等[2]发现GFP发出的绿色荧光是由于接受了来自荧光素酶-羟基荧光素激发态复合物或Ca2+激活发光蛋白的能量而产生。这个发光过程发生在水母伞底部的一种特殊的上皮细胞中,属于一种生物的通讯功能或防御机制。绿色荧光蛋白的编码基因(gfp)可以被整合到其他生物体,而使其他生物体发出荧光。因此,利用基因工程技术将gfp基因与其他蛋白质融合表达为研究细胞生物学的重要手段[3]。TSIEN基于GFP发光机理,通过基因突变得到一系列不同颜色的荧光蛋白。这些不同颜色的荧光蛋白HEIM和SAITO等[4-5]可以实现同时跟踪多种蛋白质的状态和多个生物事件[6-7]、过程[8]。微生物育种是食品和生物工程领域不可缺少的工作。但是微生物筛选步骤费时费力,制约了微生物的快速、高通量筛选。多种荧光蛋白的出现为微生物育种提供了有力工具[9]。本文从不同种类的荧光蛋白性质出发,介绍荧光蛋白在微生物育种方面应用的进展,为微生物育种的开展提供参考。
1 荧光蛋白
1.1 GFP
目前不同颜色的荧光蛋白主要有5种。其中GFP的研究最早,也最成熟。GFP是由238个氨基酸组成的单体蛋白,分子量为27 kD[10]。GFP分子呈β-圆筒状,由11条β-链形成外壁,圆筒的直径为3 nm,长为4 nm,两端由α-螺旋覆盖,将负责发光的基团紧紧地包裹在筒中央[11-12]。GFP在300~500 nm波长激发下发出绿色荧光[13],并且能保持10 min以上。马金石等[14]研究表明,从C-端除去多于7个氨基酸或者带蛋氨酸的片段就会导致失去荧光。圆筒内第一条β-折叠片开始于N-端的第10个氨基酸,N-端前10个氨基酸形成帽子的主要成分,保护发色团在筒内中心位置,形成非常紧密牢固的结构。这种状态下的荧光不会由于和氧的相互碰撞而被碎灭从而导致量子产率降低。GFP发色团由位于65~67处的Ser-Tyr-Gly环状三肽组成,该氨基酸三联体以共价形式与GFP的骨架相连[15]。INOUYE等[16]和HEIM等[17]的研究证实氧气是GFP发出荧光的必要成分。野生型GFP的生色团在β-筒状结构中与周围的氨基酸残基、少量水分子形成氢键网络结构,如图1所示[18]。
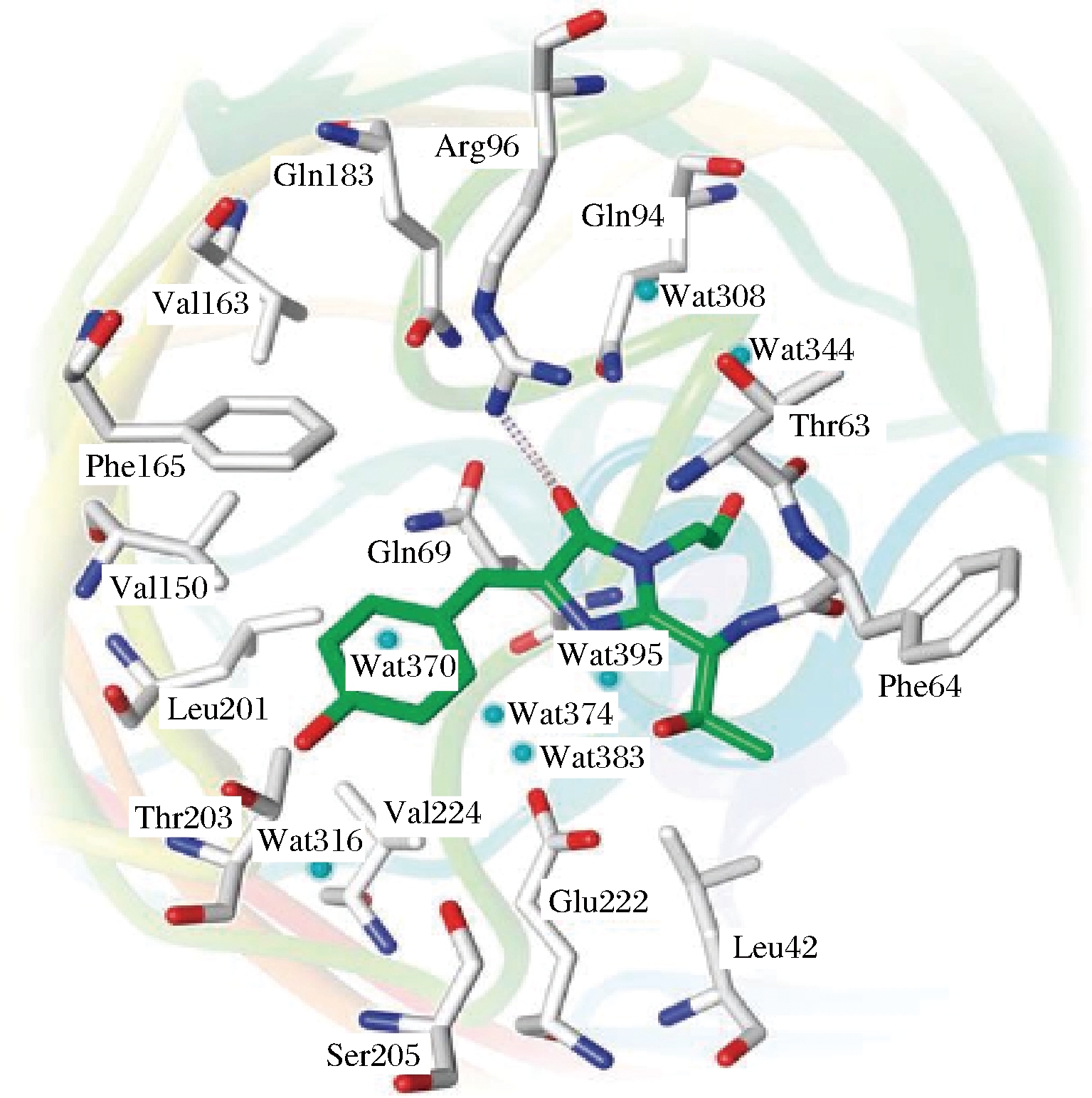
图1 GFP生色团及其所处环境
Fig.1 GFP chromophore and its environment
注:生色团为绿色,灰色虚线为氢键。
GFP的一个引人注目的特点是,其生色团的形成没有物种的特异性,可以在生成2~4 h后自动催化得到[19]。CORMACK等[20]对野生型GFP定点突变可以增强GFP荧光强度的绿色荧光蛋白,称为增强型GFP绿色荧光蛋白。GFP的突变体也会改变荧光蛋白的发光特征。野生型GFP的主激发峰为397 nm,副激发峰为476 nm,发射峰约509 nm。GFP突变体S6ST的激发峰红移至484 nm,发射峰变为507 nm,且荧光强度比野生型GFP高5倍。进一步突变得到的突变体GFP F64L是一种在37℃下高效、成熟的增强型GFP[21]。这种突变体的缺陷是对pH值敏感且较易形成二聚体。近来,从温水珊瑚中分离得到的GFP趋向于形成二聚体,通过突变可以得到2个单体蛋白mGFP、mGFPI和二聚体蛋白dGFP的亮度是增强型GFP的2倍以上,具有很大的潜在应用价值[22]。
1.2 其他颜色的荧光蛋白
CORMACK等[20]改变野生型GFP基因,导致其吸收光谱和发射光谱发生变化,最终改变荧光蛋白的荧光强度与荧光颜色,由此可以获得不同颜色的荧光蛋白。蓝色荧光蛋白(blue flrorescent protein,BFP)是将珊瑚野生型GFP中的66位酪氨酸突变为组氨酸(Y66H)或双突变体Y66H/Y145F后得到能在约380 nm激发光产生448 nm蓝光的蛋白。但是这些突变体的蓝色荧光的荧光量子产率很低,是GFP的15%~20%。由于BFP的激发光接近于紫外光,不仅穿透力很弱,还容易在操作中伤害细胞以及导致细胞的自荧光现象,因此应用较少[23]。与得到BFP的方式类似,将GFP的66位酪氨酸突变为色氨酸得到青色荧光蛋白(cyan fluorescent protein,CFP)。CFP的激发波为433和445 nm,发射波长为475和503 nm。研究者们观察GFP晶体结构,发现第203位苏氨酸和荧光基团的空间距离非常近,所以把苏氨酸突变为酪氨酸(T203Y)来稳定激发态下荧光生色团的偶极矩。这个突变体(T203Y)使荧光蛋白的激发波长和发射波长红移约20 nm,呈现出黄绿色的荧光,被称为黄色荧光蛋白(yellow fluorescent protein,YFP)[11]。对YFP进一步突变可得到荧光更加强烈的增强型黄色荧光蛋白(enhanced yellow fluorescent protein,eYFP)。当前研究致力于降低YFP对于氯离子和pH的敏感性,以实现其在成像方面的应用[24]。后来,将GFP的第65位丝氨酸突变为苏氨酸,得到突变体S65T。突变体S65T的激发谱中只有一个峰,且红移至490 nm,呈现红色荧光,称为红色荧光蛋白(red fluorescent protein,RFP)。表1比较了上述多种荧光蛋白的性质和各种荧光蛋白的应用。
表1 各种颜色荧光蛋白性质和应用特点的比较
Table 1 Comparison of properties and application characteristics of fluorescent proteins
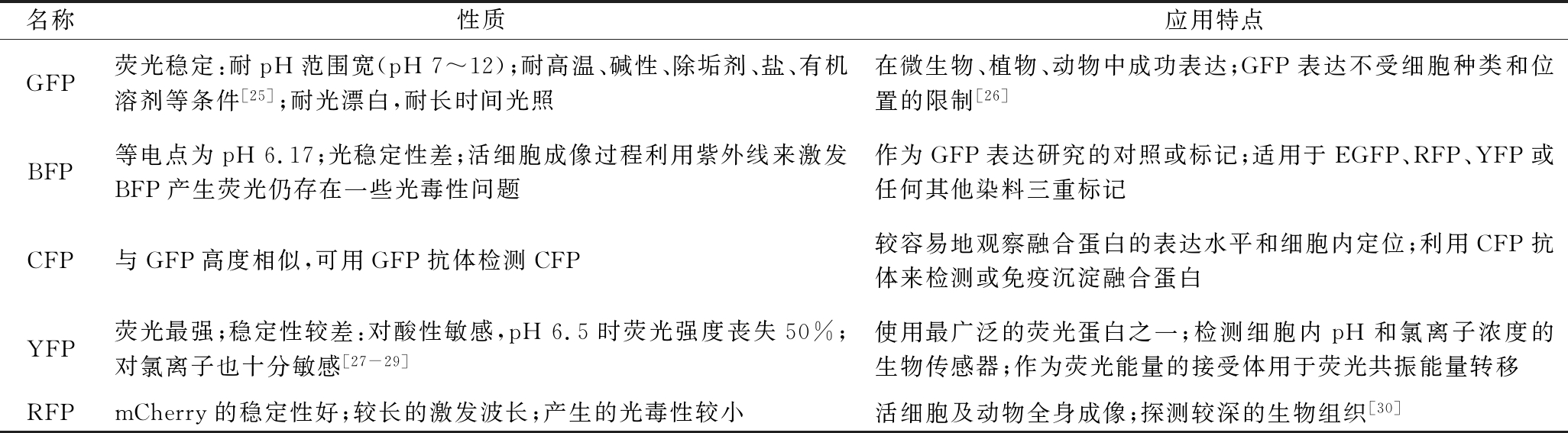
名称性质应用特点GFP荧光稳定:耐pH范围宽(pH7~12);耐高温、碱性、除垢剂、盐、有机溶剂等条件[25];耐光漂白,耐长时间光照在微生物、植物、动物中成功表达;GFP表达不受细胞种类和位置的限制[26]BFP等电点为pH6.17;光稳定性差;活细胞成像过程利用紫外线来激发BFP产生荧光仍存在一些光毒性问题作为GFP表达研究的对照或标记;适用于EGFP、RFP、YFP或任何其他染料三重标记CFP与GFP高度相似,可用GFP抗体检测CFP较容易地观察融合蛋白的表达水平和细胞内定位;利用CFP抗体来检测或免疫沉淀融合蛋白YFP荧光最强;稳定性较差:对酸性敏感,pH6.5时荧光强度丧失50%;对氯离子也十分敏感[27-29]使用最广泛的荧光蛋白之一;检测细胞内pH和氯离子浓度的生物传感器;作为荧光能量的接受体用于荧光共振能量转移RFPmCherry的稳定性好;较长的激发波长;产生的光毒性较小活细胞及动物全身成像;探测较深的生物组织[30]
2 利用荧光蛋白作为标记筛选目的细胞
随着科技的发展,重组DNA技术(recombinant DNA technology)在微生物育种方面应用越来越普遍。甚至全基因组改组(genome shuffling)已经应用到微生物育种过程中[31]。为了筛选到性状优良的微生物,很多科学家也都在细胞筛选重组微生物领域不断进行深入研究。与常规的筛选方法相比,利用荧光蛋白作为探针筛选目的菌株具有快速有效、简单易行和实用性强等特点。近年来,各种荧光蛋白在工业微生物菌种改良的多个方面取得进展。
荧光蛋白具有基因片段相对较短(700 bp),表达载体构建相对容易,基因错配几率小等优点。近年来,很多学者将荧光蛋白作为筛选标记用于细胞、基因、代谢物的筛选。例如单志新等[32]以GFP作为报告蛋白筛选能够有效抑制目的基因表达的siRNA;王弘[33]等构建了通用载体质粒融合系统(UPS),获得了高效、简便的带有GFP的酿酒酵母,为GFP的重组表达提供了良好的技术储备。目前,利用荧光蛋白作为标记筛选微生物也用于解决实际问题中,例如徐明等[34]利用GFP标记棉花黄萎病菌成功获得大丽轮枝菌转化株。大丽轮枝菌转化株的获得为后续大丽轮枝菌侵染棉花过程的组织学和致病机理研究提供了良好的基础。荧光蛋白也被用于筛选一些能够表达特定功能的药物细胞。泛素-蛋白酶体通路(UPP)是细胞内重要的蛋白质降解系统,影响恶性肿瘤等细胞发生与发展[35]。蛋白酶体抑制剂通过阻断UPP,可抑制肿瘤细胞生长,成为肿瘤治疗的新方法。方海同等[36]基于GFP的筛选模型,得到大量、稳定表达蛋白酶体抑制剂的细胞株,推进了治疗肿瘤的研究。目前,微生物育种过程中单细胞基因分析较难。将荧光蛋白与一些可以和DNA片段结合的蛋白质融合,例如组蛋白结合蛋白和荧光蛋白融合(H-NS-mCherry and HMG-mCherry),来筛选已经发生突变的细胞[37]。
3 基于荧光蛋白表征细胞内状态
细胞内的状态影响细胞内蛋白质构象,例如蛋白质错误折叠和聚集。所以检测蛋白质的构象可以说明细胞内状态。VENTURA等[38]采用GFP作为模型蛋白,筛选可以阻止蛋白质错误折叠的化学分子。这种思路也被拓展应用于利用化学荧光分子表征细胞内蛋白质状态。例如KUCHERAK等[39]采用荧光分子(6FM-M和7AFM-M)标记突触核蛋白说明突触核蛋白的状态。GFP的生色团和目标蛋白融合表达可以指示目标蛋白是否错误折叠[40]。荧光蛋白还被开发为pH值敏感的分子[41],将pH变化转变为光颜色的变化,表征细胞内pH值。在pH 6.8~7.8之间,随着pH值的升高,荧光蛋白强度增强[42]。
4 基于荧光蛋白的细胞筛选策略
为了提高细胞表达外源蛋白的表达效率,借助一些物理化学因素(如UV诱变、NTG诱变等)引入随机突变,构建细胞文库,筛选出能够高效表达目的蛋白的突变体。传统的筛选方法(例如96孔板中的筛选)工作量很大,而且随机性大。因此,高通量筛选技术逐渐兴起,如液滴微流体技术,微流体技术最初用于电子领域中。MANZ等[43]提出了“微全分析系统”的概念,即把生物和化学领域涉及到的样品制备、分离和分析检测等基本操作单元集成到芯片上,以替代传统的生物和化学实验室的一种新型分析分离技术。液滴微流体技术筛选目的菌株需要在液滴观察之后恢复活性。然而,为防止液滴连续相和分散相的蒸发,微流体通道或腔室通常处于密封状态,对细胞正常生长不利[44]。因此为了改善这些不足,DAGKESAMANSKAYA等[45]提出光转换荧光蛋白在液滴微流筛选中的应用,该技术使用光驱动标记液滴,在微流体观察室中直接生长细胞,可以直接恢复目的细胞的活性。该方法基于绿色到红色可切换荧光蛋白的细胞内表达,在显微镜下监测液滴中细胞的生长,用荧光激活细胞分选机进行分选并回收[45]。此外,通过该方法筛选的细胞基本能恢复到初始状态,所以这种光转换荧光蛋白在液滴微流控筛选中具有广阔的应用前景。近几年,关于利用液滴流体技术筛选细胞的报道也与日俱增[44,46-47]。如HUANG等[48]利用微流控筛选和全基因组测序,结合荧光鉴定与酵母蛋白分泌α-淀粉酶改善相关的突变,经突变后的酵母细胞与标有绿色荧光蛋白的α-淀粉酶混合,然后用油包封形成液滴。通过荧光底物降解的液滴的荧光强度选择出更高产的淀粉酶突变体。
陈建武等[49]借助新潮霉素和荧光蛋白2类标记筛选建立了高效的基因敲除系统,称之为“双荧光”系统。该策略以GFP和新霉素基因为正筛选标记,以红色荧光蛋白基因为负筛选标记,筛选出目的细胞。WANG等[50]通过两个真正远红外的探针(最大发射波长为625 nm和649 nm)与青色、绿色、黄色和橙色荧光蛋白结合进行多色标记成像。
随着对荧光蛋白研究的深入,发现荧光蛋白发射的荧光可以通过不同波长的光来控制,从而产生3种荧光蛋白:光激活荧光蛋白(photoactivated fluorescent protein,PAFPs)、光转换荧光蛋白(photoconvertible fluorescent protein,PCFPs)、光开关荧光蛋白(reversible photoswitching fluorescent protein,PSFPs)。其中PCFPs是指光照后荧光蛋白从一种发射短波长的荧光状态不可逆地转变为另外一种发射长波长的荧光状态。目前为止,报道的由绿转红的荧光蛋白主要有Dendra2、Eos、Kaede和KikGR[51],这些荧光蛋白具有相同的生色团His-Tyr-Gly,光转换前发射绿色荧光,光转换后变成红色荧光,在细胞筛选方面发挥着重要作用。但是目前对于光转换蛋白的研究较少,需要继续开发更多种类生色团的荧光蛋白。
5 展望
目前,GFP的种类较为完全,在微生物过程工程研究中应用甚广,主要集中在细胞筛选。微流体技术能实现通过调节其“荧光强度阈值”将目的细胞分级筛选,进而,“双荧光”筛选和光转换筛选策略克服了单荧光筛选中筛选效率不高,复活率不高等问题。总之,荧光蛋白在细胞筛选的研究中仍然是热门领域。但是基于荧光蛋白筛选细胞也存在着一些问题与不足,如检测的灵敏度还有待进一步提高;荧光强度的非线性性质使其定量非常困难;紫外激发对某些荧光蛋白有光漂白和破坏作用;多数生物具有微弱的自发荧光现象,并有着类似的激发和发射波长等。所以,荧光蛋白在细胞筛选甚至其他领域的应用仍需要继续完善。
[1] MORISE H,SHIMOMURA O,JOHNSON F,et al.Intermolecular energy transfer in the bioluminescent system of Aequorea [J].Biochemistry,1974,13(12):2 656-2 662.
[2] PRASHER D C,ECKENRODE V K,WARD W W,et al.Primary structure of the Aequorea victoria green-fluorescent protein [J].Gene,1992,111(2):229-233.
[3] MISHIN A S,BELOUSOV V V,SOLNTSEV K M,et al.Novel uses of fluorescent proteins [J].Current Opinion in Chemical Biology,2015,27:1-9.
[4] HEIM R,TSIEN R Y.Engineering green fluorescent protein for improved brightness,longer wavelengths and fluorescence resonance energy transfer [J].Current Biology,1996,6(2):178-182.
[5] SAITO Y,OIKAWA M,NAKAZAWA H,et al.Machine-learning-guided mutagenesis for directed evolution of fluorescent proteins [J].ACS Synthetic Biology,2018,7(9):2 014-2 022.
[6] DUDA K,LONOWSKI L A,KOFOED-NIELSEN M,et al.High-efficiency genome editing via 2A-coupled co-expression of fluorescent proteins and zinc finger nucleases or CRISPR/Cas9 nickase pairs [J].Nucleic Acids Research,2014,42(10):e84.
[7] HOJLAND KNUDSEN C,ASGRIMSDOTTIR E S,RAHIMI K,et al.A modified monomeric red fluorescent protein reporter for assessing CRISPR activity [J].Frontiers in Cell and Developmental Biology,2018,6:54.
[8] KAMIYAMA D,SEKINE S,BARSI-RHYNE B,et al.Versatile protein tagging in cells with split fluorescent protein [J].Nature Communications,2016,7:11 046.
[9] BIALECKA-FORNAL M,MAKUSHOK T,RAFELSKI S M.A review of fluorescent proteins for use in yeast [J].Methods in Molecular Biology (Clifton,NJ),2016,1 369:309-346.
[10] CHALFIE M,KAIN S R.Green fluorescent protein:properties,applications,and protocols,second edition [M].2nd ed.John Wiley &Sons,Inc.,2005.
[11] ORM M,CUBITT A B,KALLIO K,et al.Crystal structure of the Aequorea victoria green fluorescent protein [J].Science,1996,273(5 280):1 392-1 395.
[12] YANG F,MOSS L G,PHILLIPS N G.The molecular structure of green fluorescent protein [J].Nature Biotechnology,1996,14(10):1 246-1 251.
[13] DELAGRAVE S,YOUVAN D C.Searching sequence space to engineer proteins:exponential ensemble mutagenesis [J].Bio/technology,1993,11(13):1 548-1 552.
[14] 马金石.绿色荧光蛋白[J].化学通报,2009,72(3):243-250.
[15] CODY C W,PRASHER D C,WESTLER W M,et al.Chemical structure of the hexapeptide chromophore of the Aequorea green-fluorescent protein [J].Biochemistry,1993,32(5):1 212-1 218.
[16] INOUYE S,TSUJI F I.Aequorea green fluorescent protein [J].FEBS Letters,1994,341(2-3):277-280.
[17] HEIM R,PRASHER D C,TSIEN R Y.Wavelength mutations and posttranslational autoxidation of green fluorescent protein [J].Proceedings of the National Academy of Sciences of the United States of America,1994,91(26):12 501-12 504.
[18] CRAGGS T D.Green fluorescent protein:structure,folding and chromophore maturation [J].Chemical Society Reviews,2009,38(10):2 865-2 875.
[19] 吴沛桥,巴晓革,胡海,等.绿色荧光蛋白GFP的研究进展及应用[J].生物医学工程研究,2009,28(1):83-86.
[20] CORMACK B P,VALDIVIA R H,FALKOW S.FACS-optimized mutants of the green fluorescent protein (GFP)[J].Gene,1996,173(1):33-38.
[21] HEIM R,CUBITT A B,TSIEN R Y.Improved green fluorescence [J].Nature,1995,373(6 516):663-664.
[22] ILAGAN R P,RHOADES E,GRUBER D F,et al.A new bright green-emitting fluorescent protein - engineered monomeric and dimeric forms [J].FEBS Journal,2010,277(8):1 967-1 978.
[23] DAY R N,DAVIDSON M W.The fluorescent protein palette:Tools for cellular imaging [J].Chemical Society Reviews,2009,38(10):2 887-2 921.
[24] GRIESBECK O,BAIRD G S,CAMPBELL R E,et al.Reducing the environmental sensitivity of yellow fluorescent protein mechanism and applications [J].Journal of Biological Chemistry,2001,276(31):29 188-29 194.
[25] 吴瑞,张树珍.绿色荧光蛋白及其在植物分子生物学中的应用[J].分子植物育种,2005,3(2):240-244.
[26] 汪恒英,周守标,常志州,等.绿色荧光蛋白(GFP)研究进展[J].生物技术,2004,14(3):228-233.
[27] LLOPIS J,MCCAFFERY J M,MIYAWAKI A,et al.Measurement of cytosolic,mitochondrial,and golgi pH in single living cells with green fluorescent proteins [J].Proceedings of the National Academy of Sciences of the United States of America,1998,95(12):6 803-6 808.
[28] JAYARAMAN S,HAGGIE P M,WACHTER R M,et al.Mechanism and cellular applications of a green fluorescent protein-based halide sensor [J].Journal of Biological Chemistry,2000,275(9):6 047-6 050.
[29] KUNER T,AUGUSTINE G J.A genetically encoded ratiometric indicator for chloride:capturing chloride transients in cultured hippocampal neurons [J].Neuron,2000,27(3):447-459.
[30] 郝丽梅,李唐棣,梅兴国.红色荧光蛋白的研究进展[J].国际药学研究杂志,2006,33(2):131-133.
[31] 李义勇,张亚雄.基因重组技术在工业微生物菌种选育中应用的研究进展[J].中国酿造,2009,28(1):11-14.
[32] 单志新,林秋雄,符永恒,等.用绿色荧光蛋白(GFP)作为报告分子筛选有效的siRNA [J].中国生物化学与分子生物学报,2007,23(3):231-235.
[33] 王弘,郑文岭,杨连生,等.以绿色荧光蛋白为报告基因的酿酒酵母表达载体的构建 [J].广东医学,2002,23(12):1 239-1 240.
[34] 徐明,桂月晶,祁伟彦,等.绿色荧光蛋白基因标记棉花黄萎病菌[J].植物保护,2013,39(5):128-133.
[35] 黄洁玉,张敏.蛋白酶体抑制剂在肺癌治疗中的研究进展[J].中国医药导报,2016,13(23):38-41.
[36] 方海同,胡政,周光飚.一种基于绿色荧光蛋白的蛋白酶体抑制剂细胞筛选模型[J].生物工程学报,2009,25(3):452-456.
[37] PARK J,LEE S,WON N,et al.Single-molecule DNA visualization using AT-specific red and non-specific green DNA-binding fluorescent proteins [J].The Analyst,2019,(3).
[38] VENTURA S,NAVARRO S.Screening protein aggregation in cells using fluorescent labels coupled to flow cytometry [J].Methods in Molecular Biology (Clifton,NJ),2019,1873:195-212.
[39] KUCHERAK O A,SHVADCHAK V V,KYRIUKHA Y A,et al.Synthesis of a fluorescent probe for sensing multiple protein states [J].European Journal of Organic Chemistry,2018(37):5 155-5 162.
[40] LIU Y,WOLSTENHOLME C H,CARTER G C,et al.Modulation of fluorescent protein chromophores to detect protein aggregation with turn-on fluorescence [J].Journal of the American Chemical Society,2018,140(24):7 381-7 384.
[41] SHINODA H,SHANNON M,NAGAI T.Fluorescent proteins for investigating biological events in acidic environments [J].International Journal of Molecular Sciences,2018,19(6):1 548.
[42] EUM KANG B,LEE S,BAKER B J.Optical consequences of a genetically-encoded voltage indicator with a pH sensitive fluorescent protein [J].Neuroscience Research,2018.
[43] MANZ A,GRABER N,WIDMER H M.Miniaturized total chemical analysis systems:A novel concept for chemical sensing [J].Sensors &Actuators B Chemical,1990,1(1):244-248.
[44] HOSOKAWA M,HOSHINO Y,NISHIKAWA Y,et al.Droplet-based microfluidics for high-throughput screening of a metagenomic library for isolation of microbial enzymes [J].Biosensors &Bioelectronics,2015,67:379-385.
[45] DAGKESAMANSKAYA A,LANGER K,TAUZIN A S,et al.Use of photoswitchable fluorescent proteins for droplet-based microfluidic screening [J].Journal of Microbiological Methods,2018,147:59-65.
[46] LONGWELL C K,LABANIEH L,COCHRAN J R.High-throughput screening technologies for enzyme engineering [J].Curr Opin Biotechnol,2017,48:196-202.
[47] SHEMBEKAR N,HU H,EUSTACE D,et al.Single-cell droplet microfluidic screening for antibodies specifically binding to target cells [J].Cell Reports,2018,22(8):2 206-2 215.
[48] HUANG M,BAI Y,SJOSTROM S L,et al.Microfluidic screening and whole-genome sequencing identifies mutations associated with improved protein secretion by yeast [J].Proc Natl Acad Sci U S A,2015,112(34):4 689-4 696.
[49] 陈建武,任红艳,华文君,等.一种用于提高基因打靶效率的双荧光筛选策略[J].中国生物工程杂志,2017,37(1):58-63.
[50] WANG L,JACKSON W C,STEINBACH P A,et al.Evolution of new nonantibody proteins via iterative somatic hypermutation [J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(48):16 745-16 749.
[51] 韩李阳.超分辨成像光转换荧光蛋白探针的筛选及应用[D].长沙:湖南大学,2014.