贝莱斯芽胞杆菌(Bacillus velezensis)最早是由RUIZ-GARC A等[1]在西班牙马拉加市的贝莱斯河中发现的。该菌种属于革兰氏阳性菌(G+),菌体呈杆状,大小为0.5 μm×(1.5~3.5)μm,常见单个或成对排列,有时也呈短链排列。芽胞呈椭圆状,位于非肿胀胞囊的中间或末端,不产生伴胞晶体和β-羟基丁酸,可通过鞭毛运动[2],普遍存在于自然界中,如河水[3]、海洋[4]、土壤[5]、植物组织[6]等。目前在NCBI的Taxonomy数据库中显示,贝莱斯芽胞杆菌属于枯草芽胞杆菌群(Bacillus subtilis group)分类单元中的解淀粉芽胞杆菌亚群(Bacillus amyloliquefaciens group),同时是解淀粉芽胞杆菌植物亚种(Bacillus amyloliquefaciens subsp.plantarum)、甲基营养型芽胞杆菌(Bacillus methylotrophicus)、“Bacillus oryzicola”的同物异名。在芽胞杆菌属中,“同物异名”现象比较常见,因为早期细菌分类学鉴定技术存在一定的局限,往往缺乏可靠性,特别是枯草芽胞杆菌群和蜡样芽胞杆菌群中的近源菌种不仅在表型上相似,而且在16S rDNA序列上也具有相当高的同源性,因此这些近源菌种之间常出现名称的误用。随着微生物分类鉴定技术的逐渐成熟,一些芽胞杆菌属的菌种也逐步得以正名,其中就包括贝莱斯芽胞杆菌分类学地位的变迁及确定。
A等[1]在西班牙马拉加市的贝莱斯河中发现的。该菌种属于革兰氏阳性菌(G+),菌体呈杆状,大小为0.5 μm×(1.5~3.5)μm,常见单个或成对排列,有时也呈短链排列。芽胞呈椭圆状,位于非肿胀胞囊的中间或末端,不产生伴胞晶体和β-羟基丁酸,可通过鞭毛运动[2],普遍存在于自然界中,如河水[3]、海洋[4]、土壤[5]、植物组织[6]等。目前在NCBI的Taxonomy数据库中显示,贝莱斯芽胞杆菌属于枯草芽胞杆菌群(Bacillus subtilis group)分类单元中的解淀粉芽胞杆菌亚群(Bacillus amyloliquefaciens group),同时是解淀粉芽胞杆菌植物亚种(Bacillus amyloliquefaciens subsp.plantarum)、甲基营养型芽胞杆菌(Bacillus methylotrophicus)、“Bacillus oryzicola”的同物异名。在芽胞杆菌属中,“同物异名”现象比较常见,因为早期细菌分类学鉴定技术存在一定的局限,往往缺乏可靠性,特别是枯草芽胞杆菌群和蜡样芽胞杆菌群中的近源菌种不仅在表型上相似,而且在16S rDNA序列上也具有相当高的同源性,因此这些近源菌种之间常出现名称的误用。随着微生物分类鉴定技术的逐渐成熟,一些芽胞杆菌属的菌种也逐步得以正名,其中就包括贝莱斯芽胞杆菌分类学地位的变迁及确定。
芽胞杆菌属(Bacillus sp.)包含了许多有特殊功能的菌种,它们在生物农药、生物肥料、生物保鲜、生物降污、食品加工等领域具有特殊的重要性[7]。目前市场上的微生物肥料和饲料中菌种添加剂主要以枯草芽胞杆菌(Bacillus subtilis)为主;苏云金芽胞杆菌(Bacillus thuringiensis)及其伴胞晶体是世界上产量最大的农业微生物杀虫剂,主要防治鳞翅目、双翅目、鞘翅目、螨类等害虫幼虫[8];国家卫生部在2016版《可食用菌种名单》中将能够进行乳酸发酵的凝结芽胞杆菌(Bacillus coagulans)列入其中。贝莱斯芽胞杆菌是芽胞杆菌属中一种新兴的功能性菌种,已经有很多研究证明,贝莱斯芽胞杆菌在植物促生功能和抗植物病原菌方面能够发挥重要作用。另外,由于其具有将外界一氧化碳物转化为自身营养物质这一特性,甲基营养型芽胞杆菌(即贝莱斯芽胞杆菌)被广泛应用于食品发酵领域,同时在环境保护、工业应用、养殖及医药等领域都具有相应的功能研究[9]。本文对贝莱斯芽胞杆菌的系统分类学地位和功能性研究进展进行概述,以期为进一步研究贝莱斯芽胞杆菌提供参考。
1 贝莱斯芽胞杆菌的分类学地位变迁
1.1 贝莱斯芽胞杆菌的分离和命名
贝莱斯芽胞杆菌最早是从西班牙马拉加市的贝莱斯河河口发现的,RUIZ-GARC A等[1]分别在1999年和2000年利用MY培养基从该河口淡盐水中分离获得CR-14b和CR-502T两株菌,随后通过表型与基因型鉴定手段发现它们是芽胞杆菌属的新种,并于2005年作为一个新的分类单元在IJSEM(International Journal of Systematic and Evolutionary Microbiology)杂志上正式发表,确立了贝莱斯芽胞杆菌的分类地位。在表型上,他们对这2株菌以及其他17株相关芽胞杆菌进行了122项表型测试,选择了92个不同的表型特征进行了聚类分析,发现菌株CR-14b和CR-502T二者之间的表型特征相似性高达94%,而它们与枯草芽胞杆菌枯草亚种(Bacillus subtilis subsp.subtilis)CECT 39T和解淀粉芽胞杆菌(Bacillus amyloliquefaciens)DSM 7T的相似度最高(约90%)。在分子水平上,B.velezensis CR-502T的16S rDNA序列与B.subtilis subsp.subtilis CECT-39T、B.amyloliquefaciens DSM 7T的相似度均大于99%。而B.velezensis CR-502T作为新种的主要依据在于它与相似度高于98%的相关菌种的DNA-DNA杂交(DNA-DNA hybridization,DDH)率均低于20%,其中与B.subtilis subsp.subtilis CECT-39T的杂交率为13.3%,与B.amyloliquefaciens DSM 7T的DNA-DNA杂交率为18.6%。1987年,国际系统细菌学委员会(International Committee on Systematic Bacteriology,ISCB)发表报告指出:通常将DNA-DNA相关性≥70%作为细菌“种”的界限[10],这一标准也被认为是细菌新种鉴定的黄金标准。
A等[1]分别在1999年和2000年利用MY培养基从该河口淡盐水中分离获得CR-14b和CR-502T两株菌,随后通过表型与基因型鉴定手段发现它们是芽胞杆菌属的新种,并于2005年作为一个新的分类单元在IJSEM(International Journal of Systematic and Evolutionary Microbiology)杂志上正式发表,确立了贝莱斯芽胞杆菌的分类地位。在表型上,他们对这2株菌以及其他17株相关芽胞杆菌进行了122项表型测试,选择了92个不同的表型特征进行了聚类分析,发现菌株CR-14b和CR-502T二者之间的表型特征相似性高达94%,而它们与枯草芽胞杆菌枯草亚种(Bacillus subtilis subsp.subtilis)CECT 39T和解淀粉芽胞杆菌(Bacillus amyloliquefaciens)DSM 7T的相似度最高(约90%)。在分子水平上,B.velezensis CR-502T的16S rDNA序列与B.subtilis subsp.subtilis CECT-39T、B.amyloliquefaciens DSM 7T的相似度均大于99%。而B.velezensis CR-502T作为新种的主要依据在于它与相似度高于98%的相关菌种的DNA-DNA杂交(DNA-DNA hybridization,DDH)率均低于20%,其中与B.subtilis subsp.subtilis CECT-39T的杂交率为13.3%,与B.amyloliquefaciens DSM 7T的DNA-DNA杂交率为18.6%。1987年,国际系统细菌学委员会(International Committee on Systematic Bacteriology,ISCB)发表报告指出:通常将DNA-DNA相关性≥70%作为细菌“种”的界限[10],这一标准也被认为是细菌新种鉴定的黄金标准。
1.2 B.velezensis、B.amyloliquefaciens subsp.plantarum、B.methylotrophicus互为同物异名
自B.velezensis命名后的10年里,其分类学地位一直受到人们的关注。在2008年,WANG等[11]选择B.amyloliquefaciens BCRC 11601T、BCRC 14193、BCRC 14711、BCRC 17038与B.velezensis BCRC 17467T进行16S rDNA、gyrB基因序列系统发育分析和DDH相关性分析,根据学名优先权原则,提出B.velezensis是B.amyloliquefaciens(1987年合法化发表)后期的同物异名,主要依据是B.velezensis BCRC 17467T与B.amyloliquefaciens BCRC 11601T、BCRC 14193、BCRC 14711、BCRC 17038的DNA-DNA杂交率分别为74%、89%、74%、76%。在2010年,一株分离于水稻根际土的甲基营养型芽胞杆菌(Bacillus methylotrophicus)CBMB 205T以新种的名义被发表[12],文章采用16S rDNA系统发育分析确定了8株与CBMB 205T相似性大于98.2%的相关模式菌株,然后将8株模式菌株分别与CBMB 205T进行DNA-DNA杂交,其中与其DNA相关性最高的菌株为B.amyloliquefaciens KACC 12067T(36.0%)。
BORRISS等[13]采用16S rDNA、gyrA、cheA基因序列系统发育分析,结合DNA-DNA杂交技术及比较基因组分析将11株B.amyloliquefaciens分成了两大类,其中基于基因组-基因组距离比较法(genome-to-genome distance comparison,GGDC)计算了模式菌株B.amyloliquefaciens DSM 7T和FZB 42T之间的DNA-DNA相关性大约为77%,同时利用传统的DNA-DNA杂交技术获得二者之间的杂交率为63.7%~71.2%,鉴于DNA-DNA杂交率在70%~80%范围内可用于区分同一种内不同亚种的细菌,他们认为这些结果不足以在种水平区分DSM 7T和FZB 42T,但可以将二者作为B.amyloliquefaciens的2个单独的亚种,并由此提出了以解淀粉芽胞杆菌解淀粉亚种(Bacillus amyloliquefaciens subsp.amyloliquefaciens)DSM 7T(=BCRC 11601T=ATCC 23350T)和解淀粉芽胞杆菌植物亚种(Bacillus amyloliquefaciens subsp.plantarum)FZB 42T(=DSM 23117T)为代表的2个新分类单元。
但在2015年,DUNLAP等[14]提出B.amyloliquefaciens subsp.plantarum应该作为B.methylotrophicus后期的同物异名,因为2个分类单元的模式菌株(FZB 42T和KACC 13105T=CBMB 205T)无论从形态学、生理生化还是核心基因组系统发育分析上都高度相似,并且二者之间基于GGDC方法的DNA-DNA杂交(DNA-DNA hybridization,DDH)率高达85.1%(>70%),核心基因组的平均核苷酸一致性(average nucleotide identity,ANI)值为98.4%(>95%)。对于物种划分而言,一般70%的DNA-DNA杂交率约对应95%的ANI[15]。同年,分离于水稻根部的内生细菌‘Bacillus oryzicola’YC7007与YC7010T以新种的名义在The Plant Pathology Journal杂志上有效发表[16],但该分类名称未在IJSEM杂志上合法化发表。直到2016年,DUNLAP等[17]又进一步对B.velezensis、B.amyloliquefaciens、B.methylotrophicus、B.amyloliquefaciens subsp.plantarum、‘B.oryzicola’的分类学地位重新进行了讨论,他们采用比较基因组学和数字DNA-DNA杂交(digital DNA-DNA hybridization,dDDH)的方法对5株菌B.velezensis NRRL B-41580T(=CR-502T=BCRC 17467T=KCTC 13102T=LMG 22478T)、‘B.oryzicola’KACC 18228T、B.methylotrophicus KACC 13105T、B.amyloliquefaciens subsp.plantarum FZB 42T、B.amyloliquefaciens DSM 7T进行分析,结果显示在核心基因组系统发育树上DSM 7T与其他4株菌位于不同的进化分支,且DSM 7T与NRRL B-41580T、KACC 18228T、KACC 13105T、FZB 42T之间的dDDH值分别为55.5%、55.2%、55.2%、56.2%,而后4株菌两两之间的dDDH值均大于84%,由此指出B.velezensis并不是B.amyloliquefaciens后期的同物异名,他们分别属于2个单独的种,而B.methylotrophicus、B.amyloliquefaciens subsp.plantarum、‘B.oryzicola’应该作为B.velezensis的后期同物异名。
2 贝莱斯芽胞杆菌的分类现状
2017年,FAN等[18]就B.amyloliquefaciens、B.velezensis、B.siamensis提出了一个全新的概念“operational group B.amyloliquefaciens”:他们首先对芽胞杆菌属(Bacillus sp.)中的23株代表性模式菌株的核心基因组进行系统发育分析,从中确定了4个与B.amyloliquefaciens DSM 7T高度相似并具有有效命名的菌种,分别是B.siamensis、B.velezensis、B.methylotrophicus、B.amyloliquefaciens subsp.plantarum;其次在NCBI数据库中获取这4个菌种和B.amyloliquefaciens系列内的66株细菌的全基因组序列进行比较基因组分析,包括rpoB基因系统发育分析、四核苷酸(tetra-nucleotide signatures,TETRA)回归系数、ANI、平均氨基酸一致性(average amino acid identity,AAI)、dDDH、GC mol%、16S rDNA序列相似性分析、核心基因组系统发育分析,其中从rpoB基因以及核心基因组系统发育树上可以清楚地将B.amyloliquefaciens、B.siamensis、B.velezensis/B.methylotrophicus/B.amyloliquefaciens subsp.plantarum分成3组,而且57株B.velezensis/B.methylotrophicus/B.amyloliquefaciens subsp.plantarum系列菌株与DSM 7T的ANI值均在93%左右,而dDDH值均在55%左右,这也进一步证实了之前DUNLAP等[17]的结论;然后他们还分别选择了7株来自于“operational group ‘B.subtilis’”和6株来自于“operational group ‘B.amyloliquefaciens’”的模式菌种,基于它们的ANI和TETRA的中值构建系统树图,结果显示6株“operational group ‘B.amyloliquefaciens’”的模式菌种之间是密切相关的;综上,他们建议将“operational group ‘B.amyloliquefaciens’”作为枯草芽胞杆菌群(Bacillus subtilis group)分类等级下的一个新分类单元。另外,部分菌株在分类学命名上存在长期的误用,如芽胞杆菌中的生物防控菌株GB03[19]和QST713[20]经常被当作B.subtilis,但实际上他们是B.velezensis,同时也是“operational group B.amyloliquefaciens”这一分类单元的成员[18];张欣等[21]采用微生物多相分类鉴定技术对中性蛋白酶生产菌种AS1.398枯草芽胞杆菌(B.subtilis)CICC 10888进行了复核鉴定,发现其分类学地位为解淀粉芽胞杆菌植物亚种(B.amyloliquefaciens subsp.plantarum)。
贝莱斯芽胞杆菌属于枯草芽胞杆菌群,与其近源菌种在表型和16S rDNA序列上难以鉴别,然而随着分子生物学的迅速发展和新技术在微生物分类鉴定中的应用,贝莱斯芽胞杆菌的分类学地位几经波折后终于得以确立。目前“operational group B.amyloliquefaciens”分类单元中包括B.amyloliquefaciens、B.siamensis、B.velezensis/B.methylotrophicus/B.amyloliquefaciens subsp.plantarum,而根据学名优先权原则,B.methylotrophicus、B.amyloliquefaciens subsp.plantarum、‘B.oryzicola’的当前科学命名应为B.velezensis。
3 贝莱斯芽胞杆菌的功能研究
3.1 农业应用
B.velezensis在农业生产上具有广谱的抗菌活性以及促进植物生长的作用。如表1所示,31株B.velezensis功能性菌株分别分离于河水、农作物土壤、鱼类肠道、植物组织、野牦牛牛粪等不同的基物,其中绝大部分功能研究都与抑制植物病原菌相关,而且B.velezensis常作为农业应用上的生物防控剂和植物生长促生剂。目前,已报道的B.velezensis的抗菌作用机理主要包括:产抗菌蛋白[22]、脂肽类抗生素[23]、由非核糖体多肽合成酶(NRPS)和聚酮化合物(PKS)合成的抗生素[24]、诱导系统抗性[16],同时研究表明B.velezensis具有ACC脱氨酶活性,能够分泌IAA,在促进植物生长的同时,可以提高植物的抗性[25]。如杨胜清等[22]提取了生防细菌B.velezensis S6的发酵液粗提物,经过分离纯化获得抗菌蛋白,并通过菌丝生长速率法和孢子萌发法发现S6的拮抗蛋白对番茄早疫病菌有明显的抑制作用。从受植物病原体侵染的甜菜土壤中分离出的菌株B.velezensis FZB42T,能够产生大量的次级代谢产物,包括bacillibactin、bacillomycin D、bacilysin、difficidin、fengycin、macrolactin、surfactin,其全基因组序列分析表明,有9个NRPS和PKS基因簇直接与生物活性肽和聚酮化合物的合成相关,其中有3个基因簇(mln、bae、dfn,基因长度共199 Kb)直接合成具有抗菌作用的聚酮类化合物:macrolactin、bacillaene、difficidin[26]。分离于水稻根际的B.velezensis CAU B946[27]能够生成脂肽类、聚酮类化合物(PKS)、芽胞杆菌溶素等抗生素,并且在控制烟草黑胫病、水稻纹枯病、棉花枯萎病、棉花黄萎病和小麦疮痂病等植物病害上显示出了巨大的潜力;从小麦根际分离的YAU B9601-Y2[28]同样能够产生bacillomycin D、fengycin和difficidin;菌株B.velezensis M75分离于用于蘑菇栽培的废棉,对植物病原真菌具有明显的拮抗作用[24];来源于野牦牛牛粪的菌株LM2303也能够分泌很多抗菌性次级代谢产物,可以有效抑制禾谷镰刀菌的分生孢子萌发和菌丝生长[29-30]。而且,菌株LM2303、CAU B946、YAU B9601-Y2和M75的全基因组序列分析中均发现了与FZB42T相似的9个具有抗菌功能的NRPS和PKS基因簇,此外,在YAU B9601-Y2中发现了负责合成和修饰mersacidin(一种B型羊毛硫抗生素)的完整基因簇,但在与B.velezensis物种亲缘关系比较近的其他菌株中未观察到[24]。而菌株M75和LM2303含有kijanimicin(氯丝菌素)操纵子片段,使它们能够对一些革兰氏阳性菌和厌氧微生物产生抗性[24,30]。
表1 B.velezensis不同菌株分离源及功能特性统计
Table 1 Habitats and functions of different B.velezensis strains
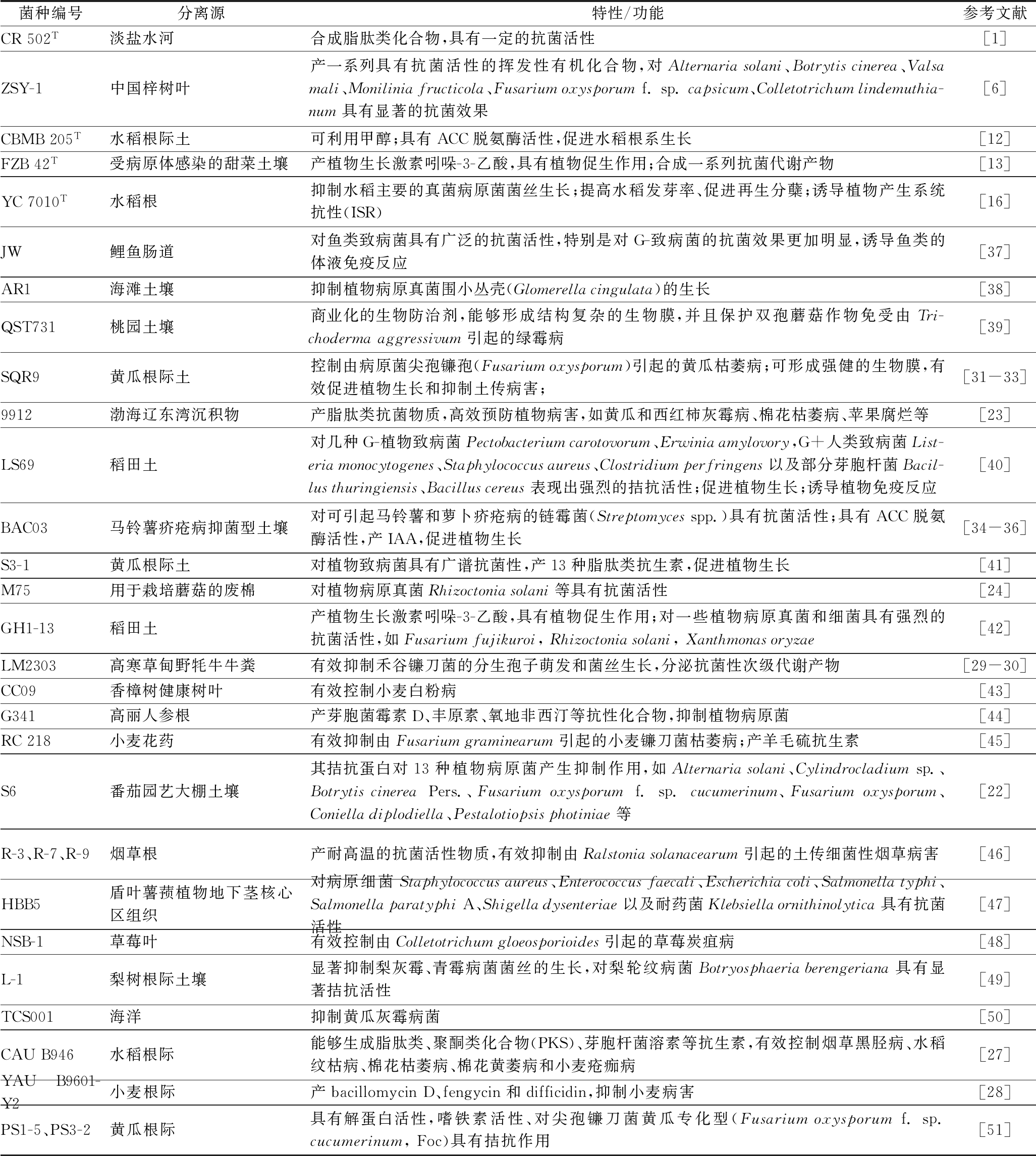
菌种编号分离源特性/功能参考文献CR502T淡盐水河合成脂肽类化合物,具有一定的抗菌活性[1]ZSY-1中国梓树叶产一系列具有抗菌活性的挥发性有机化合物,对Alternariasolani、Botrytiscinerea、Valsamali、Moniliniafructicola、Fusariumoxysporumf.sp.capsicum、Colletotrichumlindemuthia-num具有显著的抗菌效果[6]CBMB205T水稻根际土可利用甲醇;具有ACC脱氨酶活性,促进水稻根系生长[12]FZB42T受病原体感染的甜菜土壤产植物生长激素吲哚-3-乙酸,具有植物促生作用;合成一系列抗菌代谢产物[13]YC7010T水稻根抑制水稻主要的真菌病原菌菌丝生长;提高水稻发芽率、促进再生分蘖;诱导植物产生系统抗性(ISR)[16]JW鲤鱼肠道对鱼类致病菌具有广泛的抗菌活性,特别是对G-致病菌的抗菌效果更加明显,诱导鱼类的体液免疫反应[37]AR1海滩土壤抑制植物病原真菌围小丛壳(Glomerellacingulata)的生长[38]QST731桃园土壤商业化的生物防治剂,能够形成结构复杂的生物膜,并且保护双孢蘑菇作物免受由Tri-chodermaaggressivum引起的绿霉病[39]SQR9黄瓜根际土控制由病原菌尖孢镰孢(Fusariumoxysporum)引起的黄瓜枯萎病;可形成强健的生物膜,有效促进植物生长和抑制土传病害;[31-33]9912渤海辽东湾沉积物产脂肽类抗菌物质,高效预防植物病害,如黄瓜和西红柿灰霉病、棉花枯萎病、苹果腐烂等[23]LS69稻田土对几种G-植物致病菌Pectobacteriumcarotovorum、Erwiniaamylovory,G+人类致病菌List-eriamonocytogenes、Staphylococcusaureus、Clostridiumperfringens以及部分芽胞杆菌Bacil-lusthuringiensis、Bacilluscereus表现出强烈的拮抗活性;促进植物生长;诱导植物免疫反应[40]BAC03马铃薯疥疮病抑菌型土壤对可引起马铃薯和萝卜疥疮病的链霉菌(Streptomycesspp.)具有抗菌活性;具有ACC脱氨酶活性,产IAA,促进植物生长[34-36]S3-1黄瓜根际土对植物致病菌具有广谱抗菌性,产13种脂肽类抗生素,促进植物生长[41]M75用于栽培蘑菇的废棉对植物病原真菌Rhizoctoniasolani等具有抗菌活性[24]GH1-13稻田土产植物生长激素吲哚-3-乙酸,具有植物促生作用;对一些植物病原真菌和细菌具有强烈的抗菌活性,如Fusariumfujikuroi,Rhizoctoniasolani,Xanthmonasoryzae[42]LM2303高寒草甸野牦牛牛粪有效抑制禾谷镰刀菌的分生孢子萌发和菌丝生长,分泌抗菌性次级代谢产物[29-30]CC09香樟树健康树叶有效控制小麦白粉病[43]G341高丽人参根产芽胞菌霉素D、丰原素、氧地非西汀等抗性化合物,抑制植物病原菌[44]RC218小麦花药有效抑制由Fusariumgraminearum引起的小麦镰刀菌枯萎病;产羊毛硫抗生素[45]S6番茄园艺大棚土壤其拮抗蛋白对13种植物病原菌产生抑制作用,如Alternariasolani、Cylindrocladiumsp.、BotrytiscinereaPers.、Fusariumoxysporumf.sp.cucumerinum、Fusariumoxysporum、Conielladiplodiella、Pestalotiopsisphotiniae等[22]R-3、R-7、R-9烟草根产耐高温的抗菌活性物质,有效抑制由Ralstoniasolanacearum引起的土传细菌性烟草病害[46]HBB5盾叶薯蓣植物地下茎核心区组织对病原细菌Staphylococcusaureus、Enterococcusfaecali、Escherichiacoli、Salmonellatyphi、SalmonellaparatyphiA、Shigelladysenteriae以及耐药菌Klebsiellaornithinolytica具有抗菌活性[47]NSB-1草莓叶有效控制由Colletotrichumgloeosporioides引起的草莓炭疽病[48]L-1梨树根际土壤显著抑制梨灰霉、青霉病菌菌丝的生长,对梨轮纹病菌Botryosphaeriaberengeriana具有显著拮抗活性[49]TCS001海洋抑制黄瓜灰霉病菌[50]CAUB946水稻根际能够生成脂肽类、聚酮类化合物(PKS)、芽胞杆菌溶素等抗生素,有效控制烟草黑胫病、水稻纹枯病、棉花枯萎病、棉花黄萎病和小麦疮痂病[27]YAUB9601-Y2小麦根际产bacillomycinD、fengycin和difficidin,抑制小麦病害[28]PS1-5、PS3-2黄瓜根际具有解蛋白活性,嗜铁素活性、对尖孢镰刀菌黄瓜专化型(Fusariumoxysporumf.sp.cucumerinum,Foc)具有拮抗作用[51]
由于不同菌株具有不同的基因组特征,因此这些菌株的抗菌活性和次级代谢产物也有可能不同。菌株B.velezensis SQR9(曾用名B.subtilis SQR9[31]、B.amyloliquefaciens SQR9[32])是一株分离于黄瓜根际土的广谱性拮抗菌,常作为农作物生产中的生物肥料和生物防治剂,能够形成强健的生物膜,具有突出的根系定殖能力,有效促进植物生长和抑制土传病害[33]。来源于马铃薯疥疮病抑菌型土壤的B.velezensis BAC03(曾用名B.amyloliquefaciens BAC03[34]),能够有效抑制由Streptomyces scabies引起的马铃薯和萝卜疥疮病[35]。为了确定BAC03促进植物生长的功效,MENG等[36]测试了菌株BAC03对9种类型植物(包括甜菜,胡萝卜,黄瓜,胡椒,马铃薯,萝卜,南瓜,番茄和萝卜)的潜在促生作用,结果表明菌株BAC03具有ACC脱氨酶活性和分泌IAA的能力,对9种植物都具有一定的促生作用。
3.2 工业应用
甲基营养型芽胞杆菌(即贝莱斯芽胞杆菌)C412的胞外分泌物具有絮凝作用,对高岭土悬浊液的絮凝活性高达98.27%,微生物絮凝剂的产率约为4.25 g/L,该微生物絮凝剂的主要组分是多糖和极性官能团,具有较好的耐热性和耐酸碱性,具有潜在的工业应用价值[9]。另外,由于甲基营养型芽胞杆菌具有将外界一氧化碳物转化为自身营养物质这一特性,被广泛应用于食品发酵领域[9]:从自然发酵的豆豉中分离获得的甲基营养型芽胞杆菌B-1具有较高的酶活性,接种于豆粕中进行固态发酵时能够高效分解豆粕中的大分子蛋白质[52];从酱香型大曲中分离获得的甲基营养型芽胞杆菌FBKL 1.0190产中性蛋白酶、糖化酶、纤维素酶和脂肪酶的能力非常突出,对提高酱香型大曲的品质具有良好的应用前景[53]。从土壤中分离的甲基营养型芽胞杆菌SK19.001能够不依赖谷氨酸发酵生产无毒的γ-聚谷氨酸,可直接应用于食品工业等领域[54]。
3.3 环境保护应用
在环境保护方面,贝莱斯芽胞杆菌也发挥着一定的作用,然而绝大数相关研究同样是以甲基营养型芽胞杆菌的命名展开的。最初,RUIZ-GARC A等是为了筛选出产表面活性剂的新菌种而分离到了贝莱斯芽胞杆菌CR-14b和CR-502T,而事实也证明了这2株菌具有作为生物表面活性剂的潜力。目前的生物表面活性剂在污水处理[55]、生物修复、重金属提取以及油泥预处理等方面都有广泛的应用[56]。如从复合重金属污染场地分离的甲基营养型芽胞杆菌JY-04能够高效吸附水体环境中的重金属,而且能够在土壤中强化植物提取重金属的能力[57];谭泽文等[58]从土壤中筛选出的一株甲基营养型芽胞杆菌RF2具有餐厨垃圾防蝇产蛆效果,这可能与该菌在生长繁殖阶段分泌出大量的抗生素类或抗菌肽类物质有关。荣璐阁等[59]通过使用表面活性剂吐温80(Tween80)和鼠李糖脂(RL)强化了甲基营养型芽胞杆菌对柴油土壤的修复效果。
A等是为了筛选出产表面活性剂的新菌种而分离到了贝莱斯芽胞杆菌CR-14b和CR-502T,而事实也证明了这2株菌具有作为生物表面活性剂的潜力。目前的生物表面活性剂在污水处理[55]、生物修复、重金属提取以及油泥预处理等方面都有广泛的应用[56]。如从复合重金属污染场地分离的甲基营养型芽胞杆菌JY-04能够高效吸附水体环境中的重金属,而且能够在土壤中强化植物提取重金属的能力[57];谭泽文等[58]从土壤中筛选出的一株甲基营养型芽胞杆菌RF2具有餐厨垃圾防蝇产蛆效果,这可能与该菌在生长繁殖阶段分泌出大量的抗生素类或抗菌肽类物质有关。荣璐阁等[59]通过使用表面活性剂吐温80(Tween80)和鼠李糖脂(RL)强化了甲基营养型芽胞杆菌对柴油土壤的修复效果。
此外,贝莱斯芽胞杆菌还可以作为饲用微生物菌剂,同时有望在医疗保健方面发挥更重要的作用[9]。同一种不同株B.velezensis在功能上存在着差异,因此还需要进一步发掘自然界中B.velezensis的新菌株资源,以开发利用新功能菌株。
4 展望
近年来,由于微生物分类鉴定技术的迅速发展,微生物分类系统的更新速度也不断加快,不仅新种的数量不断增长,一些微生物的分类学地位也发生了变化,贝莱斯芽胞杆菌所属的枯草芽胞杆菌群即是分类变化快速的典型代表[60]。随着分子生物学的迅猛发展,特别是对基因组学研究的兴起,进一步完善了微生物的分类鉴定方法和标准。贝莱斯芽胞杆菌分类学地位的变迁及确立经历了一个相对曲折的过程,其后期的同物异名菌种出现的原因在于:一方面是所采用的细菌分类鉴定方法存在局限性;另一方面是已报道的同物异名现象对后期相关菌种的研究存在一定程度上的制约性。因此未来对于微生物新种的发表,建议在多项分类技术的基础上,与基因组学方法相结合,互为补充和验证,从而让菌种鉴定获得更科学、更准确的结论。
贝莱斯芽胞杆菌在农业、工业、环境保护、养殖等众多领域都有相应的功能研究,其中在农业推广上的运用最多,主要体现在其对多种植物病原微生物的广谱抗性以及促生作用。在过去几个世纪,化肥和农药在提高作物质量和产量方面发挥了非常重要的作用,但同时对地球环境、人类健康及生态系统的稳定性都构成了潜在的威胁,因此使用生物控制剂防治植物病原菌不失为一种更安全且可持续的战略措施[61]。目前,芽胞杆菌Bacillus spp.已经成为农业应用上非常广泛的一类生防细菌,它们能够产生芽胞,具有种群庞大、繁殖力强、抗逆性强、理化性质稳定、产物丰富等特点[62-63]。本文中已报道的贝莱斯芽胞杆菌(B.velezensis)来源于不同的生境,说明其在自然界中广泛存在,而且可以通过产抗菌性次级代谢产物、诱导抗性、分泌IAA等方式对多种植物病原微生物产生广谱抗性,促进植物生长。因此,开发利用贝莱斯芽胞杆菌(B.velezensis)作为生防制剂具有良好的农业应用前景。为了更好地利用贝莱斯芽胞杆菌控制植物病害,需重视特殊生境中的B.velezensis优良菌株的筛选,加强菌剂研发工作;利用分子生物学、基因组学和蛋白组学等方法明确生防相关基因在植物、病原微生物、贝莱斯芽胞杆菌三者之间发挥作用的机制;可考虑改良B.velezensis的功能基因,提高其抗菌活性、诱导抗性,增强抑菌广谱性等,以期尽早实现贝莱斯芽胞杆菌菌剂的商品化、规模化生产。另外,同物异名甲基营养型芽胞杆菌(B.methylotrophicus)在食品加工、工业等方面的应用已经有相对成熟的研究,这为今后进一步开发B.velezensis在其他领域的功能提供了新的思路。
[1] RUIZ-GARC A C,B
A C,B JAR V,MART
JAR V,MART NEZ-CHECA F,et al.Bacillus velezensis sp.nov.a surfactant-producing bacterium isolated from the river Velez in Malaga,southern Spain[J].International Journal of Systematic and Evolutionary Microbiology,2005,55(1):191-195.
NEZ-CHECA F,et al.Bacillus velezensis sp.nov.a surfactant-producing bacterium isolated from the river Velez in Malaga,southern Spain[J].International Journal of Systematic and Evolutionary Microbiology,2005,55(1):191-195.
[2] 蔡高磊,张凡,欧阳友香,等.贝莱斯芽孢杆菌(Bacillus velezensis)研究进展[J].北方园艺,2018(12):162-167.
[3] RUIZ-GARC A C,BÉJAR V,MART
A C,BÉJAR V,MART NEZ-CHECA F,et al.Bacillus velezensis sp.nov.a surfactant-producing bacterium isolated from the river Velez in Malaga,southern Spain[J].International Journal of Systematic and Evolutionary Microbiology,2005,55(1):191-195.
NEZ-CHECA F,et al.Bacillus velezensis sp.nov.a surfactant-producing bacterium isolated from the river Velez in Malaga,southern Spain[J].International Journal of Systematic and Evolutionary Microbiology,2005,55(1):191-195.
[4] 杨可,郑柯斌,黄晓慧,等.海洋生境贝莱斯芽孢杆菌TCS001的鉴定及抑真菌活性[J].农药学学报,2018,20(3):333-339.
[5] 孙平平,崔建潮,贾晓辉,等.贝莱斯芽孢杆菌L-1对梨灰霉和青霉病菌的抑制作用评价及全基因组分析[J].微生物学报,2018,58(9):1 637-1 646.
[6] GAO Z,ZHANG B,LIU H,et al.Identification of endophytic Bacillus velezensis,ZSY-1 strain and antifungal activity of its volatile compounds against Alternaria solani and Botrytis cinerea[J].Biological Control,2017,105:27-39.
[7] 刘波,陶天申,葛慈斌,等.芽胞杆菌.第一卷,中国芽胞杆菌研究进展[M].北京:科学出版社,2015.
[8] 刘国红,刘波,王阶平,等.芽胞杆菌分类与应用研究进展[J].微生物学通报,2017,44(4):949-958.
[9] 张妙宜,云天艳,周登博,等.甲基营养型芽胞杆菌的研究进展[J].热带农业科学,2017,37(9):66-71.
[10] WAYNE L G D,BRENNER D J,COLWELL R R,et al.Report of the ad hoc committee on reconciliation of approaches to bacterial systematics[J].International Committee on Systematic Bacteriology,1987,37:463-464.
[11] WANG L T,LEE F L,TAI C J,et al.Bacillus velezensis is a later heterotypic synonym of Bacillus amyloliquefaciens[J].International Journal of Systematic and Evolutionary Microbiology,2008,58(3):671-675.
[12] MADHAIYAN M,POONGUZHALI S,KWON S W,et al.Bacillus methylotrophicus sp.nov.a methanol-utilizing,plant-growth-promoting bacterium isolated from rice rhizosphere soil[J].International Journal of Systematic and Evolutionary Microbiology,2010,60(10):2 490-2 495.
[13] BORRISS R,CHEN X H,RUECKERT C,et al.Relationship of Bacillus amyloliquefaciens clades associated with strains DSM 7T and FZB42T:A proposal for Bacillus amyloliquefaciens subsp.amyloliquefaciens subsp.nov.and Bacillus amyloliquefaciens subsp.plantarum subsp.nov.based on complete genome[J].International Journal of Systematic and Evolutionary Microbiology,2011,61(8):1 786-1 801.
[14] DUNLAP C A,KIM S J,KWON S W,et al.Phylogenomic analysis shows that Bacillus amyloliquefaciens subsp.plantarum is a later heterotypic synonym of Bacillus methylotrophicus[J].International Journal of Systematic and Evolutionary Microbiology,2015,65(7):2 104.
[15] GORIS J,KONSTANTINIDIS K T,KLAPPENBACH J A,et al.DNA-DNA hybridization values and their relationship to whole-genome sequence similarities[J].International Journal of Systematic and Evolutionary Microbiology,2007,57(1):81-91.
[16] CHUNG E J,HOSSAIN M T,KHAN A,et al.Bacillus oryzicola sp.nov.an endophytic bacteriumi solated from the roots of rice with antimicrobial,plant growth promoting,and systemic resistance inducing activities in rice[J].Plant Pathology Journal,2015,31(2):152-164.
[17] DUNLAP C,KIM S J,KWON S W,et al.Bacillus velezensis is not a later heterotypic synonym of Bacillus amyloliquefaciens,Bacillus methylotrophicus,Bacillus amyloliquefaciens subsp.plantarum and ‘Bacillus oryzicola’ are later heterotypic synonyms of of Bacillus velezensis based on phylogenomics[J].International Journal of Systematic and Evolutionary Microbiology,2016,66:1 212-1 217.
[18] FAN B,BLOM J,KLENK H P,et al.Bacillus amyloliquefaciens,Bacillus velezensis,and Bacillus siamensis form an “Operational Group B.amyloliquefaciens” within the B.subtilis species complex[J].Frontiers in Microbiology,2017,8:22.
[19] CHOI S K,JEONG H,KLOEPPER J W,et al.Genome Sequence of Bacillus amyloliquefaciens GB03,an active ingredient of the first commercial biological control product[J].Genome Announcements,2014,2(5):e01092.
[20] KINSELLA K,SCHULTHESS C P,MORRIS T F,et al.Rapid quantification of Bacillus subtilis,antibiotics in the rhizosphere[J].Soil Biology and Biochemistry,2009,41(2):374-379.
[21] 张欣,刘勇,李金霞,等.中性蛋白酶生产菌种AS1.398的多相复核鉴定[J].食品与发酵工业,2015,41(5):54-58.
[22] 杨胜清,张帆,马贵龙.贝莱斯芽孢杆菌S6拮抗物质分离纯化及抑菌机理[J].农药,2017,56(9):645-648.
[23] PAN H Q,LI Q L,HU J C.The complete genome sequence of Bacillus velezensis 9912D reveals its biocontrol mechanism as a novel commercial biological fungicide agent[J].Journal of Biotechnology,2017,247:25-28.
[24] KIM S Y,LEE S Y,WEON H Y,et al.Complete genome sequence of Bacillus velezensis M75,a biocontrol agent against fungal plant pathogens,isolated from cotton waste[J].Journal of Biotechnology,2017,241:112-115.
[25] 蔡长平,黄军,曾艳,等.一株辣椒内生抗细菌的筛选及初步鉴定[J].湖南农业科学,2018,394(7):9-12.
[26] CHEN X H,KOUMOUTSI A,SCHOLZ R,et al.Genome analysis of Bacillus amyloliquefaciens FZB42 reveals its potential for biocontrol of plant pathogens[J].Journal of Biotechnology,2009,140(1):27-37.
[27] BLOM J,RUECKERT C,NIU B,et al.The complete genome of Bacillus amyloliquefaciens subsp.plantarum CAU B946 contains a gene cluster for nonribosomal synthesis of iturin A[J].Journal of Bacteriology,2012,194(7):1 845-1 846.
[28] HE P,HAO K,BLOM J,et al.Genome sequence of the plant growth promoting strain Bacillus amyloliquefaciens subsp.plantarum B9601-Y2 and expression of mersacidin and other secondary metabolites[J].Journal of Biotechnology,2013,164(2):281-291.
[29] 陈亮,李瑞静,秦素雅,等.小麦赤霉病拮抗菌株筛选及其抑制作用研究[J].中国植保导刊,2017,37(5):12-17.
[30] CHEN L,HENG J,QIN S,et al.A comprehensive understanding of the biocontrol potential of Bacillus velezensis LM2303 against Fusarium head blight[J].Plos One,2018,13(6):e0198560.
[31] CAO Y,ZHANG Z,LING N,et al.Bacillus subtilis SQR 9 can control Fusarium wilt in cucumber by colonizing plant roots[J].Biology and Fertility of Soils,2011,47(5):495-506.
[32] QIU M H,LI S Q,ZHOU X,et al.De-coupling of root-microbiome associations followed by antagonist inoculation improves rhizosphere soil suppressiveness[J].Biology and Fertility of Soils,2014,50(2):217-224.
[33] LI Q,LI Z F,LI X X,et al.FtsEX-CwlO regulates biofilm formation by a plant-beneficial rhizobacterium Bacillus velezensis SQR9[J].Research in Microbiology,2018,169(3):166-176.
[34] MENG Q X,JIANG H H,HANSON L E,et al.Characterizing a novel strain of Bacillus amyloliquefaciens BAC03 for potential biological control application[J].Journal of Applied Microbiology,2012,113(5):1 165-1 175.
[35] MENG Q,HANSON L E,DOUCHES D,et al.Managing scab diseases of potato and radish caused by Streptomyces spp.using Bacillus amyloliquefaciens BAC03 and other biomaterials[J].Biological Control,2013,67(3):373-379.
[36] MENG Q,JIANG H,HAO J J.Effects of Bacillus velezensis,strain BAC03 in promoting plant growth[J].Biological Control,2016,98:18-26.
[37] YI Y L,ZHANG Z H,ZHAO F,et al.Probiotic potential of Bacillus velezensis JW:Antimicrobial activity against fish pathogenic bacteria and immune enhancement effects on Carassius auratus[J].Fish and Shellfish Immunology.2018,78:322-330.
[38] REGASSA A B,TAEGYU C,YONG S L,et al.Supplementing biocontrol efficacy of Bacillus velezensis,against Glomerella cingulata[J].Physiological and Molecular Plant Pathology,2018,102:173-179.
[39] PANDIN C,LE D C,DESCHAMPS J,et al.Complete genome sequence of Bacillus velezensis QST713:a biocontrol agent that protects Agaricus bisporus crops against the green mould disease[J].Journal of Biotechnology,2018,278:10-19.
[40] LIU G,KONG Y,FAN Y,et al.Whole-genome sequencing of Bacillus velezensis LS69,a strain with a broad inhibitory spectrum against pathogenic bacteria[J].Journal of Biotechnology,2017,249:20-24.
[41] JIN Q,JIANG Q,LEI Z,et al.Complete genome sequence of Bacillus velezensis,S3-1,a potential biological pesticide with plant pathogen inhibiting and plant promoting capabilities[J].Journal of Biotechnology,2017,259:199-203.
[42] KIM S Y,SONG H,SANG M K,et al.The complete genome sequence of Bacillus velezensis strain GH1-13 reveals agriculturally beneficial properties and a unique plasmid[J].Journal of Biotechnology,2017,4:250-250.
[43] CAI X C,LIU C H,WANG B T,et al.Genomic and metabolic traits endow Bacillus velezensis CC09 with a potential biocontrol agent in control of wheat powdery mildew disease[J].Microbiological Research,2017,196:89-94.
[44] LEE H H,PARK J,LIM J Y,et al.Complete genome sequence of Bacillus velezensis G341,a strain with a broad inhibitory spectrum against plant pathogens[J].Journal of Biotechnology,2015,211:97-98.
[45] PALAZZINI J M,DUNLAP C A,BOWMAN M J,et al.Bacillus velezensis RC 218 as a biocontrol agent to reduce Fusarium head blight and deoxynivalenol accumulation:Genome sequencing and secondary metabolite cluster profiles[J].Microbiological Research,2016,192:30-36.
[46] 姜乾坤,彭阁,王瑞,等.抗青枯内生细菌的筛选及其对烟草青枯病的防治效果[J].中国烟草科学,2017,38(5):13-17.
[47] 金疏桐,王祖华,徐启燃,等.内生贝莱斯芽胞杆菌生物拮抗活性的研究[J].中国微生态学杂志,2017,29(4):385-389.
[48] NAM M H,KIM H S,LEE H D,et al.Biological control of anthracnose crown rot in strawberry using Bacillus velezensis NSB-1[J].Acta Horticulturae,2014,1049(1 049):685-688.
[49] 孙平平,崔建潮,贾晓辉,等.贝莱斯芽孢杆菌L-1对梨灰霉和青霉病菌的抑制作用评价及全基因组分析[J].微生物学报,2018,58(9):1 637-1 646.
[50] 杨可,郑柯斌,黄晓慧,等.海洋生境贝莱斯芽孢杆菌TCS001的鉴定及抑真菌活性[J].农药学学报,2018,20(3):333-339.
[51] 刘东岳,李敏,孙文献,等.拮抗尖孢镰刀菌的PGPR筛选与抑菌机制的初步研究[J].植物病理学报,2017,47(5):704-715.
[52] 熊涛,唐晓星,黄涛,等.产蛋白酶兼性厌氧菌株的筛选、酶学性质及发酵豆粕应用探究[J].食品科学,2014,35(9):162-167.
[53] 胡宝东,邱树毅,周鸿翔,等.酱香型大曲的理化指标、水解酶系、微生物产酶的关系研究[J].现代食品科技,2017,33(2):99-106.
[54] 江波,张涛,彭英云,等.一种甲基营养芽孢杆菌及其发酵生产γ-聚谷氨酸的方法:中国,102268389A[P].2011-12-07.
[55] 陆培志.生物表面活性剂在污水处理中的应用及前景[J].资源节约与环保,2018,198(5):110-114.
[56] 张元峰.生物表面活性剂在环境生物工程中的应用[J].农村科学实验,2018,4:101.
[57] 方晓航,陈佳亮,刘晓文,等.一株吸附及强化植物提取重金属的细菌JY-04及其应用:中国,104593292A[P].2015-05-06.
[58] 谭泽文,郜晨,张逸凡,等.甲基营养型芽孢杆菌的分离鉴定及在防蝇产蛆环境防治中的应用[J].应用与环境生物学报,2018,24(3):631-635.
[59] 荣璐阁,孙丽娜,刘春跃,等.表面活性剂强化甲基营养型芽孢杆菌修复柴油污染土壤[J].环境工程学报,2018,12(3):885-892.
[60] 曹凤明,杨小红,马鸣超,等.枯草芽孢杆菌近缘种群鉴定方法研究进展[J].微生物学通报,2014,41(5):968-974.
[61] SHAFI J,TIAN H,JI M.Bacillus species as versatile weapons for plant pathogens:a review[J].Biotechnology and Biotechnological Equipment,2017,31(3):446-459.
[62] 刘磊,梁昌聪,曾迪,等.芽胞杆菌次生代谢产物及其在土传病害防控中的应用研究进展[J].热带作物学报,2017,38(4):775-782.
[63] 马佳,李颖,胡栋,等.芽胞杆菌生物防治作用机理与应用研究进展[J].中国生物防治学报,2018,34(4):639-648.