乳品发酵剂(culture starter)是一种能够促进乳的酸化过程,含有高浓度乳酸菌的特定微生物培养物。它是用于制造干酪、奶油及发酵乳制品所用的特定微生物培养材料[1-3]。乳酸菌菌体细胞和培养基分离是乳产品发酵剂生产过程中的一个重要环节,常用的方法有离心分离和超滤分离。离心分离具有方法简单、处理量大、容易操作等优点,是目前工业上菌体浓缩分离的首选方法。但在离心过程中,菌体不仅受到间隙操作中的氧损伤,还受到剪切力的作用而被拉长,从而导致细胞膜的渗透性和抗冻能力下降,因此在实际操作中常通过添加一定量的离心保护剂对乳酸菌菌体进行保护[4-6]。
冷冻干燥(即冻干)是在真空条件下进行的使冻结物料中的固态水升华从而被除去的一种高效干燥方法,乳酸菌菌体细胞经离心分离后,与冻干保护介质混合,经冷冻干燥后可获得冻干发酵剂,因此其常用于乳品发酵剂的工业化制备。冷冻干燥可以减少菌体细胞在干燥过程中蛋白质失活的可能性,能够较好保持细胞原有的构架。干燥后发酵剂呈疏松多孔状,与水接触后能够快速溶解恢复原来的性状[7-11]。影响冻干过程中发酵剂存活率的主要因素有冻干保护介质、冻结速度和冻结温度等。选用合理的保护措施可以有效地减少菌体在冷冻干燥过程中的损伤和失活,影响乳酸菌冻干效果最突出的就是冻干保护剂。其不仅有利于提高菌体在冷冻干燥过程中存活率,还会影响保藏期间发酵剂的稳定性[12-14]。
按分子大小,离心和冻干保护剂可分为小分子化合物(如低聚糖、醇、缓冲盐、氨基酸、维生素)和大分子化合物(如蛋白质、多肽、多糖)[15-16]。小分子保护剂(主要是糖类)由于氢键的作用具有很强的亲水性,可以与菌体细胞膜磷脂中的磷酸基团或菌体蛋白质极性基团形成氢键,既能降低磷脂的转变温度,也可使磷脂膜之间不致于产生折叠黏连,从而保护菌体细胞膜和蛋白质结构和功能的完整性[17-18]。低聚半乳糖和低聚果糖同属于功能性低聚糖,功能性低聚糖作为被广泛认可的益菌因子在真空冷冻干燥中发挥着双重作用,既能使得益生菌维持较高的成活率,也能发挥促进益生菌生长的作用[19]。由于不同的乳酸菌所适用的保护剂不尽相同,因此需要根据菌体的自身特点筛选出适合的保护剂系统。本文在对分离自新疆传统食品赛里木酸奶中高产黏瑞士乳杆菌MB2-1(Lactobacillus helveticus MB2-1)和嗜热链球菌MB5-1(Streptococcus thermophilus MB5-1)发酵特性分析的基础上,通过测定离心和冷冻干燥后菌体的存活率,考察了低聚果糖(fructooligosaccharides,FOS)和低聚半乳糖(galactooligosaccharides,GOS)在菌体冷冻干燥过程中的保护作用,这对乳品发酵剂的生产及菌种的离心分离和冻干保存均具有一定的理论与实践意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
Lactobacillus helveticus MB2-1、Streptococcus thermophilus MB5-1为本实验室从新疆拜城县传统赛里木酸奶分离和保存,经多次传代遗传性状稳定[20-21]。
1.1.2 试剂与培养基
QHT-90 FOS(纯度≥90%)、QHT-600 GOS(纯度≥60%),广东江门量子高科生物股份有限公司;低蛋白乳清粉,法国LACTALIS公司;其他,国产分析纯。
80和120 g/L的低蛋白乳清培养基,108 ℃灭菌15 min。
MRS固体培养基[22](g/L):蛋白胨 10.0,牛肉膏 10.0,酵母膏 5.0,葡萄糖 20.0,吐温80 1.0 mL,无水乙酸钠 5.0,柠檬酸三铵 2.0,K2HPO4 2.0,MgSO4·7H2O 0.58,MnSO4·4H2O 0.25,蒸馏水 1 L,琼脂1.5%~2%,pH 6.2~6.6,121 ℃灭菌20 min。
1.1.3 仪器与设备
LRH系列生化培养箱,上海一恒科技有限公司;Avanti J-E冷冻离心机,美国Beckman Coulter公司;AIPHAPPHOT-2 YS2光学显微镜,日本Nikon公司;722可见分光光度计,上海精密科学仪器有限公司;Heto PowerDry LL3000冷冻干燥机,美国Thermo公司;pH计,德国Sartorius公司。
1.2 方法
1.2.1 菌种活化及发酵液制备
分别将L.helveticus MB2-1和S.thermophilus MB5-1从甘油管中按4%(体积分数)进行接种,在37 ℃条件下活化培养12 h,活化2次,培养基使用120 g/L的低蛋白乳清培养基;之后按3%(体积分数)的接种量接种到80 g/L低蛋白乳清培养基中发酵培养,分别于0、4、8、12、24、48 h取样测定活菌数、pH值、滴定酸度、残糖量和菌体密度(OD600)数值。
1.2.2 菌落平板计数
用灭菌后的生理盐水将菌液逐级稀释,对最后3个稀释度进行平板计数,每个稀释度计数2次。吸取1 mL菌液于灭菌平板中,再倾注冷却至45~50 ℃的MRS固体培养基。最后将平板置于37 ℃培养48 h,进行菌落计数。
1.2.3 细胞数量测定
在波长为600 nm条件下,用质量浓度80 g/L低蛋白乳清培养基调零,测量样液的吸光度。
1.2.4 pH值测定
将pH计的电极球泡完全浸入样液,读取示数。
1.2.5 滴定酸度测量
将样液稀释50倍,加入3~4滴酚酞,用0.05 mol/L的NaOH标准溶液标定至微红色,并在30 s内不褪色,记录消耗的NaOH标准滴定溶液毫升数。
1.2.6 残糖量测量
调节分光光度计波长至490 nm,预热30 min。将样液稀释100倍,在试管中按次序加入0.5 mL水、0.5 mL稀释样液、0.5 mL 6%苯酚、2.5 mL浓硫酸,另取1只试管做空白对照。
1.2.7 测定离心条件下低聚糖对菌体的保护作用
1.2.7.1 离心保护剂溶液的配制
分别将10、20、30 g的QHT-90 FOS、QHT-600 GOS和葡萄糖溶于100 mL的蒸馏水中,制成质量浓度分别为100、200、300 g/L的FOS、GOS和葡萄糖溶液,均在 115 ℃下灭菌15 min待用。
1.2.7.2 离心存活率的测定[15]
将L.helveticus MB2-1和S.thermophilus MB5-1在80 g/L的低蛋白乳清培养基中发酵12 h后,取10 mL于50 mL离心管中,分别加入40 mL 100、200和300 g/L的FOS和GOS溶液,对照组加入40 mL的生理盐水,混合均匀,以4 000×g离心10 min后弃去上清液,各洗涤3次,用生理盐水复溶至10 mL,进行菌落计数。实验重复3次。
离心存活率的测定如公式(1)所示:
离心存活率![]()
(1)
1.2.8 测定冻干条件下低聚糖对菌体的保护作用
1.2.8.1 冻干保护剂溶液的配制
配制方法同1.2.7.1。
1.2.8.2 冻干存活率测定[15]
将L.helveticus MB2-1和S.thermophilus MB5-1在8%的低蛋白乳清培养基中发酵12 h后,取10 mL于50 mL的离心管中,分别加入40 mL 100、200和300 g/L的FOS和GOS溶液,对照组加入40 mL的生理盐水,混合均匀,以4 000×g离心10 min后弃去上清液,再分别加入40 mL相同溶液进行复溶,放入冰柜中预冻8 h,置于冻干机内冻干48 h,再将其复溶至10 mL,进行菌落计数。实验重复3次。
冻干存活率的测定如公式(2)所示:
冻干存活率![]()
(2)
1.2.9 数据分析
采用Excel软件作图,SPSS软件进行差异显著性分析。
2 结果与分析
2.1 L.helveticus MB2-1和S.thermophilus MB5-1发酵特性分析
由图1可知,在8 h时L.helveticus MB2-1和S.thermophilus MB5-1生长缓慢,活菌数只有0.14×108 CFU/mL和0.21×108 CFU/mL,在12 h时活菌数同时达到最大值,分别为8.01×108 CFU/mL和7.10×108 CFU/mL,24 h后进入衰亡期,在48 h时2种菌的活菌数分别为1.61×108 CFU/mL和2.30×108 CFU/mL;OD600值在12 h前增长较快,L.helveticus MB2-1和S.thermophilus MB5-1的OD600值分别从初始时的0.03和0.04增加至12 h时的1.89和1.03,之后缓慢增加,在发酵结束时分别为2.08和1.23;发酵液的pH值和滴定酸度呈现相反的变化趋势,在8 h前接种L.helveticus MB2-1和S.thermophilus MB5-1的发酵液pH值分别从初始时的6.02和6.00急速下降到4.57和4.62,8 h后pH的变化趋势逐渐趋于平缓。而接种L.helveticus MB2-1的发酵液的滴定酸度从0 h的22.50 °T迅速增加到了8 h的最大值,为122.30 °T,接种S.thermophilus MB5-1的发酵液的滴定酸度则从0 h的20.80 °T迅速增加到了24 h的最大值,为98.20 °T。和LI等[21]使用巴氏灭菌鲜奶培养基相比,发酵过程中pH值和滴定酸度的变化趋势相似,但在鲜奶培养基中,pH值于12 h后才逐渐趋于平缓,最低pH值均比低蛋白乳清培养基中低(pH<4)。对于2种乳酸菌,在整个发酵时间内残糖量都呈现下降趋势,在24 h前,残糖量减少速度较快,24 h以后变化趋势逐渐趋于平缓,最终在48 h时L.helveticus MB2-1和 S.thermophilus MB5-1的残糖量只有5.60 g/L和5.30 g/L,说明在整个发酵过程中有80%的碳源被充分利用。以上结果表明L.helveticus MB2-1和 S.thermophilus MB5-1两种乳酸菌均具有较好的底物利用能力和生长情况,可以进一步作为乳品等产品的菌种发酵剂来源。
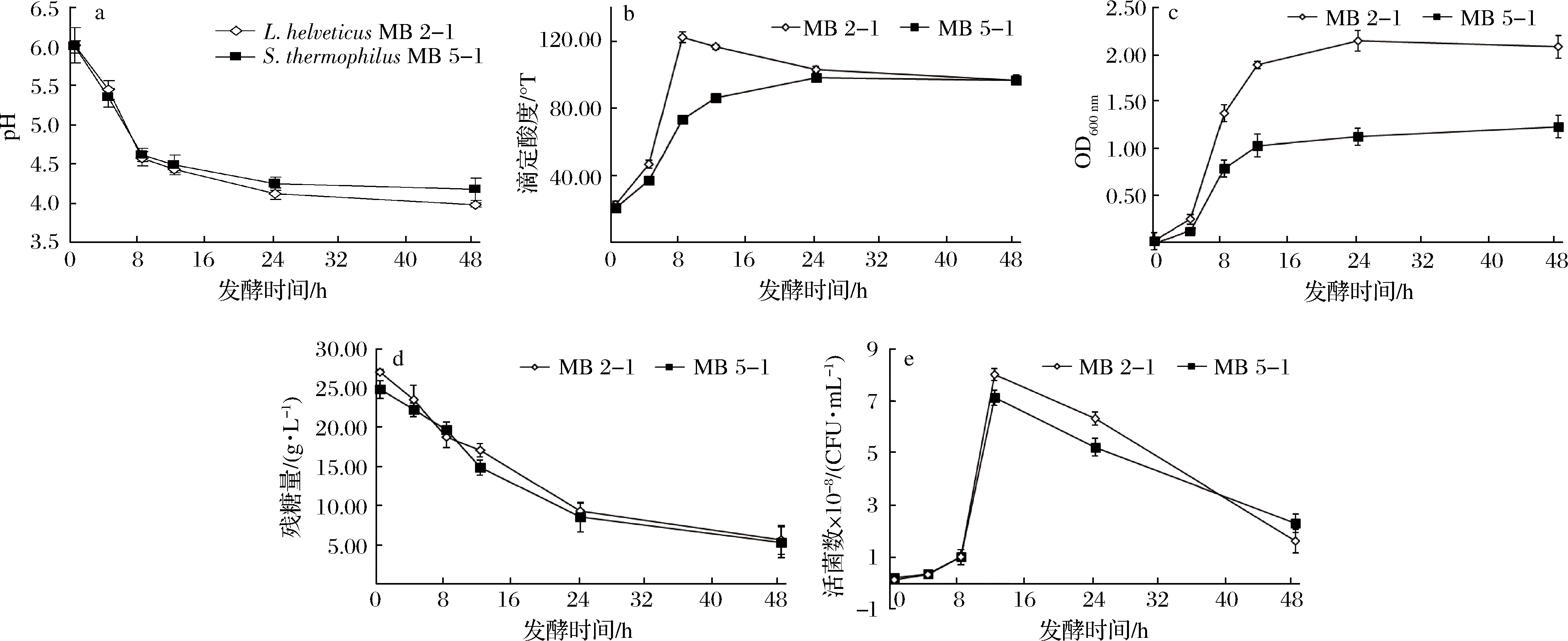
a-pH值的变化;b-滴定酸度的变化;c-OD600的变化;d-残糖量的变化;e-活菌数的变化
图1 L.helveticus MB2-1和S.thermophilus MB5-1发酵特性分析
Fig.1 Analysis of fermentation characteristics of L.helveticus MB2-1 and S.thermophilus MB5-1
2.2 不同种类和浓度的低聚糖对菌体离心的保护作用
将发酵12 h的L.helveticus MB2-1和S.thermophilus MB5-1于4 000×g的转速下离心,用不同浓度的GOS、FOS和葡萄糖溶液洗涤3次,空白对照组用生理盐水进行洗涤,利用平板计数法测定菌落数,结果如图2所示。在加入低聚糖保护剂之后,L.helveticus MB2-1和S.thermophilus MB5-1的活菌数均与空白样(生理盐水清洗)有显著性差异(P<0.05),即所选低聚糖保护剂对2种乳酸菌均有一定的保护作用,而葡萄糖组对菌体的保护作用不显著。在同样浓度条件下,FOS对乳酸菌的保护作用要优于GOS,且FOS的浓度越高,保护作用越强。在FOS质量浓度分别为200、300 g/L时,L.helveticus MB2-1的活菌数分别为5.67×108 CFU/mL和5.88×108 CFU/mL。因此,选用GOS和FOS作为L.helveticus MB2-1和S.thermophilus MB5-1的离心保护剂较葡萄糖具有显著优势,在同浓度下可优先选择FOS作为L.helveticus MB2-1和S.thermophilus MB5-1的离心保护剂。

图2 不同浓度的GOS和FOS对菌体离心后活菌数的影响
Fig.2 Effect of different concentrations of GOS and FOS on the viable cell counts after centrifugation
注:小写字母表示S.thermophilus MB5-1显著性差异(P<0.05);大写字母表示L.helveticus MB2-1的显著性差异(P<0.05)。下同。
L.helveticus MB2-1和S.thermophilus MB5-1的菌体存活率见图3。
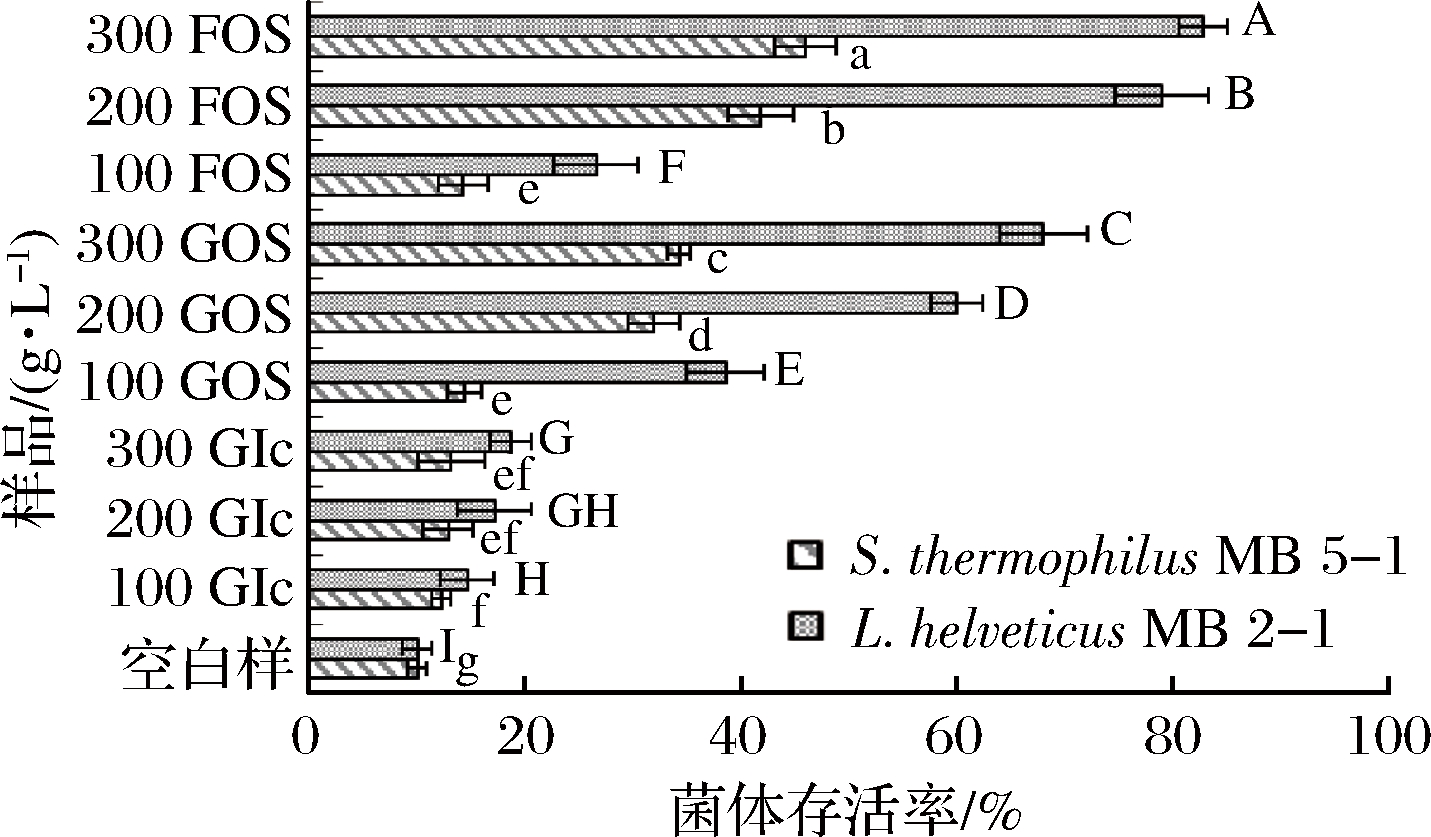
图3 不同浓度的GOS和FOS对菌体离心后存活率的影响
Fig.3 Effect of different concentrations of GOS and FOS on survival rate after centrifugation
结果表明,不同浓度葡萄糖作为保护剂时,对L.helveticus MB2-1离心保护作用差异不显著,菌体的存活率最高为18.73%,以低浓度(100 g/L)GOS和FOS作为保护剂,对菌体的保护作用较低,GOS作用下2株菌存活率分别为38.59%和14.38%,FOS作用下分别为26.62%和14.25%,而提高GOS和FOS浓度,对菌体的保护率也相应提高,GOS和FOS质量浓度300 g/L时,L.helveticus MB2-1存活率分别达到68.03%和82.82%;GOS和FOS在相同浓度条件下对S.thermophilus MB5-1的保护作用要低于L.helveticus MB2-1,在质量浓度300 g/L时,菌体存活率分别为34.25%和46.00%,对于2种乳酸菌,相同高浓度(200和300 g/L)条件下,FOS的保护效果均优于GOS。这说明对于不同类型的乳酸菌,低聚糖的保护作用具有较大差异,在实际生产应用中应根据不同菌种的特性选择最优的冻干保护剂以达到最理想效果。
2.3 不同种类和浓度的低聚糖对菌体冻干的保护作用
如图4所示,与对离心作用的保护作用相似,在加入低聚糖冻干后,L.helveticus MB2-1和 S.thermophilus MB5-1的活菌数均与空白样有显著性差异(P<0.05),表明2种低聚糖对2种乳酸菌均有一定的保护作用,而葡萄糖组对菌体的保护作用较差,在同样浓度条件下,GOS对2种乳酸菌的保护作用要优于FOS,且随着GOS浓度的增加,对乳酸菌的保护作用逐渐增强。从图4中可知,在GOS质量浓度分别为200和300 g/L时,L.helveticus MB2-1的活菌数分别为4.29×108和5.53×108 CFU/mL,而在此浓度下,S.thermophilus MB5-1的活菌数分别为2.56×108和2.90×108 CFU/mL。
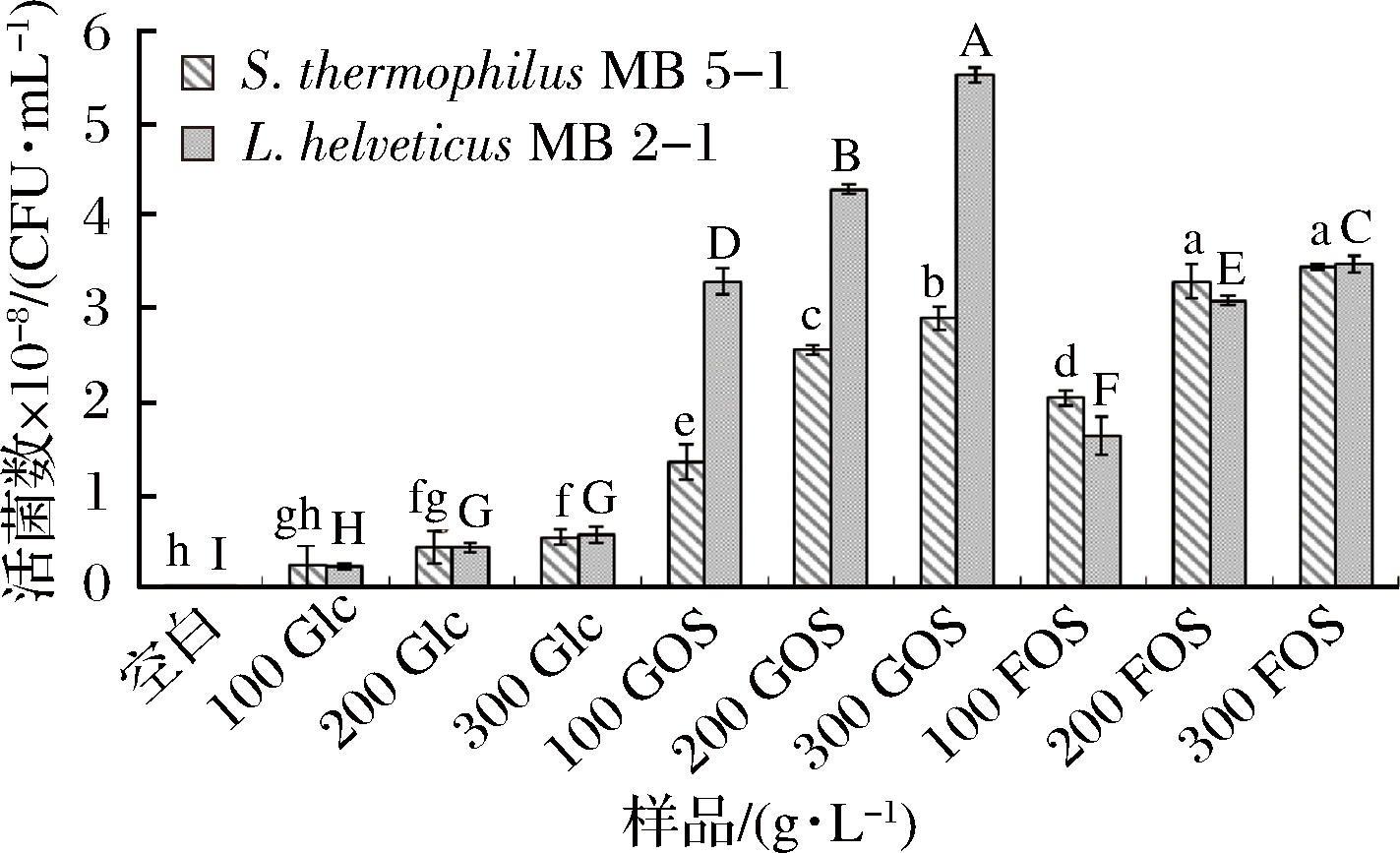
图4 不同浓度的GOS和FOS对菌体冻干后活菌数的影响
Fig.4 Effect of different concentrations of GOS and FOS on the viable cell counts after freeze drying
GOS和FOS作为冻干保护剂,L.helveticus MB2-1和 S.thermophilus MB5-1的菌体存活率如图5所示。高浓度的低聚糖保护作用总体优于低浓度低聚糖;冻干条件下,GOS作为保护剂,菌体存活率要明显高于同浓度的FOS,对于L.helveticus MB2-1的保护作用也要优于S.thermophilus MB5-1,在质量浓度100 g/L GOS存在的条件下,L.helveticus MB2-1的菌体存活率为46.48%,而在质量浓度300 g/L GOS条件下,L.helveticus MB2-1的菌体存活率可达到77.89%。因此在实际应用时,需根据不同处理步骤、菌种以及生产需要来确定保护剂的选择。考虑到实际生产的复杂性,可以开发高效复合保护剂[23],以提高应用的便利性。关于低聚糖对生物分子的保护作用,目前主要有2种假说解释低聚糖对生物分子的稳定机制:第1种为“水替代”假说,该假说认为在生物体大分子物质的周围有一层水化层,该水化层是维持生物大分子结构和功能的必要条件,当生物大分子失去这种功能性的水膜时,低聚糖能在生物大分子的失水部位以氢键形式相连接,形成一层类似于水化层的保护膜以代替失去的水化层;而另一种称为“玻璃态”假说,该理论认为通过低聚糖玻璃化转变的趋势,导致了无定形连续相的形成,在这种结构中分子运动和分子变性反应非常微弱[24-26]。低聚糖在菌体冻干时的这种保护作用,为提高工业化制备发酵剂的存活率[27-28]提供了一种思路。
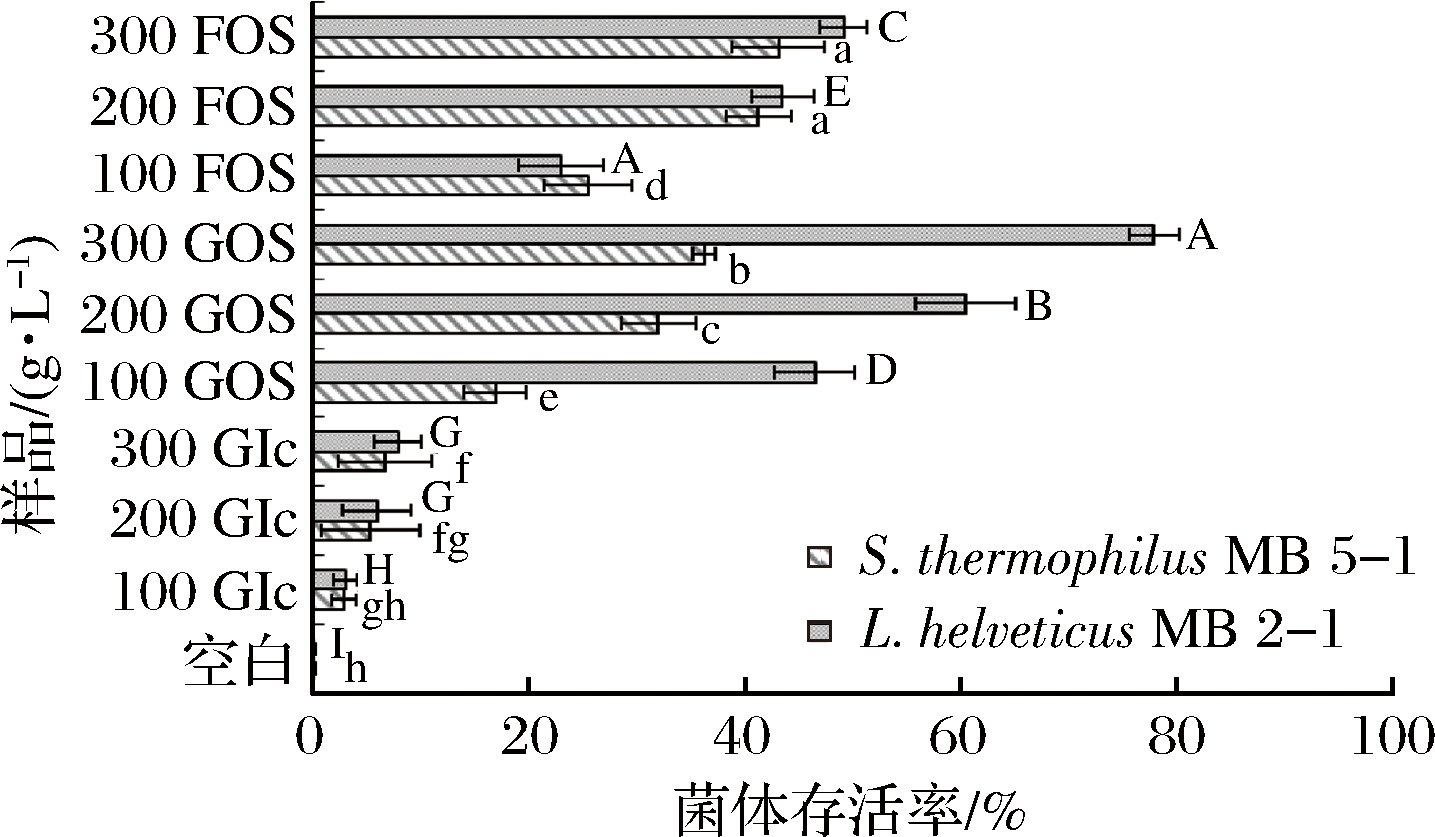
图5 不同浓度的GOS和FOS对菌体冻干后存活率的影响
Fig.5 Effect of different concentrations of GOS and FOS on the survival rate after freeze drying
3 结论
本研究对L.helveticus MB2-1和S.thermophilus MB5-1的发酵特性进行了分析,同时考察了不同浓度的低聚糖对2种乳酸菌在离心和冻干条件下活菌数和存活率的影响,结果表明,L.helveticus MB2-1和S.thermophilus MB5-1两种乳酸菌均具有较好的底物利用能力和生长情况,可以进一步作为乳品等产品的菌种发酵剂来源;对于2种乳酸菌,在对菌体离心的保护作用中,除100 g/L的低浓度之外,其余浓度下FOS的保护作用均优于GOS,而对菌体冻干的保护作用中,GOS的保护作用均优于FOS,这说明不同种类低聚糖发挥最优保护作用的操作步骤有所不同。2种低聚糖对L.helveticus MB2-1的保护作用均优于S.thermophilus MB5-1,说明对于不同类型的乳酸菌,低聚糖的保护作用具有较大的差异。本实验为今后更深入地研究低聚糖结构与乳酸菌抗逆境的关系提供了参考,同时也为低聚糖作为保护剂在乳酸菌发酵剂的应用奠定了良好的基础。
[1] 陈君石.益生菌和益生元对肠道健康的双效作用[J].中国食品,2015,685(21):118-119.
[2] PAN T,XIANG H Y,DIAO T T,et al.Effects of probiotics and nutrients addition on the microbial community and fermentation quality of peanut hull[J].Bioresource Technology,2018,273:144-152.
[3] 贾宏信,龚广予,郭本恒.益生菌干酪的研究进展[J].食品科学,2013,34(15):355-360.
[4] 王大欣,张丹,初少华,等.巨大芽孢杆菌NCT-2冻干菌剂的制备及冻干保护剂响应面优化[J].食品工业科技,2016,37(11):156-160;164.
[5] JOFRÉ A,AYMERICH T,GARRIGA M.Impact of different cryoprotectants on the survival of freeze-dried Lactobacillus rhamnosus and Lactobacillus casei/paracasei during long-term storage[J].Beneficial Microbes,2015,6(3):381-386.
[6] CUI L,NIU L Y,LI D J,et al.Effects of different drying methods on quality,bacterial viability and storage stability of probiotic enriched apple snacks[J].Journal of Integrative Agriculture,2018,17(1):247-255.
[7] 沈桂奇.发酵乳杆菌grx07发酵剂的制备及冻干保护机制的研究[D].扬州:扬州大学,2018.
[8] MUZAMMIL H S,RASCO B,SABLANI S.Effect of inulin and glycerol supplementation on physicochemical properties of probiotic frozen yogurt[J].Food &Nutrition Research,2017,61(1):1 290 314.
[9] 吴申懋,何逸尘,于华宁.响应面法筛选及优化嗜热链球菌GABA冻干保护剂[J].食品工业,2018,39(3):200-203.
[10] 曹琳,邢亚阁,苏菲烟,等.真空冷冻喷雾干燥下川藏高原冰酒发酵菌剂复合保护剂的配方优化[J].食品工业科技,2018,39(4):88-93.
[11] PINTO S S,FRITZEN-FREIRE C B,MU OZ I B,et al.Effects of the addition of microencapsulated Bifidobacterium BB-12 on the properties of frozen yogurt[J].Journal of Food Engineering,2012,111(4):563-569.
OZ I B,et al.Effects of the addition of microencapsulated Bifidobacterium BB-12 on the properties of frozen yogurt[J].Journal of Food Engineering,2012,111(4):563-569.
[12] 李佳君,刘璐,李晓东.干燥方式对鼠李糖乳杆菌微胶囊的活力及储藏稳定性的影响[J].中国乳品工业,2017,45(3):21-25.
[13] HARSHAD P P,SENTHIL M,JACQUELINEDE V,et al.Comparison of adjuvants for a spray freeze-dried whole inactivated virus influenza vaccine for pulmonary administration[J].European Journal of Pharmaceutics and Biopharmaceutics,2015,93:231-241.
[14] SHOBHARANI P,AGRAWAL R.Enhancement of cell stability and viability of probiotic Leuconostoc mesenteroides MTCC 5209 on freeze drying[J].International Journal of Dairy Technology,2011,64(2):276-287.
[15] SANTOS M I,GERBINO E,ARAUJO A,et al.Stability of freeze-dried Lactobacillus delbrueckii subsp.bulgaricus in the presence of galacto-oligosaccharides and lactulose as determined by near infrared spectroscopy[J].Food Research International,2014,59:53-60.
[16] 李艳,杨晶,黄玉军.真空冷冻干燥对乳酸菌发酵稳定性的影响[J].现代食品,2017(18):72-76.
[17] 夏晓风,王虎飞,吴晓玉.6种常用低聚糖对嗜热链球菌体外生长的影响[J].食品与生物技术学报,2016,35(3):310-317.
[18] HONGPATTARAKERE T,PATCHARAWANatc R.Improvement of freeze-dried Lactobacillus plantarum survival using water extracts and crude fibers from food crops[J].Food and Bioprocess Technology,2013,6(8):1 885-1 896.
[19] 张菊,李伟,李金敏,等.功能性低聚糖作为益生菌冻干保护剂的研究进展及其在畜牧生产中的应用[J].中国畜牧杂志,2012,48(24):56-59.
[20] 吴阳.赛里木酸奶中酵母菌筛选鉴定及发酵特性研究[D].南京:南京农业大学,2012.
[21] LI W,MUTUVULLA M,CHEN X,et al.Isolation and identification of high viscosity-producing lactic acid bacteria from a traditional fermented milk in Xinjiang and its role in fermentation process[J].European Food Research and Technology,2012,235(3):497-505.
[22] 周德庆.微生物学实验教程[M].2版,北京:高等教育出版社,2005.
[23] 曾小群,潘道东,包红燕,等.干酪乳杆菌冻干保护剂研究[J].中国食品学报,2013,13(1):44-50.
[24] 刘松玲,葛绍阳,武永超,等.乳双歧杆菌U9冷冻保护剂的优化研究[J].中国乳业,2016(2):74-79.
[25] OKOTRUB K A,SUROVTSEV N V.Raman scattering evidence of hydrohalite formation on frozen yeast cells[J].Cryobiology,2013,66(1):47-51.
[26] HAN B,BISCHOF J C.Direct cell injury associated with eutectic crystallization during freezing[J].Cryobiology,2004,48(1):8-21.
[27] 尚一娜,宋娇娇,王亚利,等.提高喷雾干燥益生菌发酵剂存活率的研究进展[J].中国乳品工业,2017,45(7):37-41.
[28] 李宝磊.真空冷冻干燥对乳酸菌损伤机制及关键保护技术研究[D].哈尔滨:哈尔滨工业大学,2011.