根皮素(phloretin)为具有二氢查尔酮结构的黄酮类化合物,具有多种生理活性。目前已探明的活性有抗氧化[1]、抑菌[2]、抑制肿瘤细胞增殖[3]、抑制酪氨酸酶活性[4]、抗炎[5]等活性,并且根皮素对人体安全无毒[6],因此在食品、药品、化妆品等领域中具有巨大的应用前景。天然产物中根皮素大多以糖苷形式存在于苹果树体的根、茎、叶、树皮、果实中,被看做是苹果中的特征酚类物质,可作为特征指纹用于苹果汁的质量控制和鉴伪[7]。目前研究发现,在多穗柯甜茶、荔枝果皮、海棠等植物中也发现了根皮素。人体摄入根皮苷后经胃酸或葡萄糖苷酶水解生成根皮素,进入循环系统发挥药效。研究者围绕根皮素进行了大量的研究,但目前国内外尚缺乏关于根皮素的综述,本文较详细地综述了根皮素的制备、生物活性及结构修饰研究现状,以期为根皮素应用及深入研究奠定基础。
1 根皮素的制备
1.1 天然产物中提取分离
从苹果树体及果皮中提取。法国化学家1835年就从苹果树皮中分离得到了根皮苷[8],后来发现根皮素及根皮苷大量存在于苹果树的根皮、茎、嫩叶以及苹果果实的各个部位[9]。采用有机溶剂(甲醇、乙醇等)从苹果树皮中进行提取,利用制备型高效液相色谱进行分离纯化可得到根皮苷,通过酸(盐酸或硫酸)水解可制得根皮素[10]。根皮苷在苹果树体各部位含量有所不同,其中苹果树皮含量最高,为64.32 mg/g,其次是树叶含量40.30 mg/g,树枝含量为30.43 mg/g[11]。从苹果疏落果(幼果)中提取苹果多酚,进而分离纯化得到根皮苷,产品的得率为0.104%。纯度可达97.52%[12]。在苹果渣多酚类物质中,主要成分为根皮苷、根皮素-低聚木糖苷、3-羟基根皮苷和3-羟基根皮素等[13]。一年中苹果树体根皮苷动态含量变化规律显示,叶中根皮苷在9、10月含量最高,平均含量为16.31 mg/g,树枝中根皮苷含量在6月最高,平均含量为11.93 mg/g,仅在苹果叶中检测到根皮素,5月份含量最高为2.541 mg/g[14]。研究发现苹果品种对根皮素的含量也有较大影响[15],用高效液相色谱-二极管阵列法测定不同苹果品种果皮和果肉中的酚类化合物,结果表明,几种苹果果皮和果肉中根皮素衍生物含量均不相同,其在果皮中含量分别为:红苹果61~122 mg/kg,青苹果29~31 mg/kg,金苹果58~71 mg/kg;在果实中含量分别为:红苹果2~4 mg/kg,青苹果7.00 mg/kg,金苹果5~8 mg/kg。
从其他植物中提取。近年来,在其他植物中也提取分离得到了根皮苷及根皮素。采用微波辅助Ca(OH)2水溶液从多穗柯甜茶中提取多穗柯黄酮,提取物黄酮含量达到40%,其中根皮苷含量达到29.5%[16]。荔枝果皮中亦发现含有根皮苷,可采用乙醇溶液超声波浸提法及热回流法提取获得[17]。
表1 自然界植物中根皮素及其衍生物结构式
Table 1 Phloretin derivatives described from nature plants

R1R2R3R4化合物HOHOHOH根皮素HOHGlcOH根皮苷OHOHOHOH3-羟基根皮素OHOHGlcOH3-羟基根皮素-2'-O-葡萄糖苷HOHO-Glc-XylOH根皮素-2'-O-低聚木糖苷HOHO-Gal-XylOH根皮素-2'-O-低聚半乳糖苷OHOHOHGlc3-羟基根皮素-4'-O-葡萄糖苷
藏药俄色叶(蔷薇科苹果属植物变叶海棠及花叶海棠)中也分离得到了根皮苷及根皮素,俄色叶中根皮苷平均含量为22.11%,根皮素平均含量为0.51%[18]。采用超声辅助甲醇提取山荆子(蔷薇科苹果属)鲜叶、茎皮和果实中根皮苷的含量分别为(12.00±3.60),(21.60±6.10)和(1.18±0.15)mg/g[19]。研究发现,杜梨叶中也含有丰富的根皮苷,且经日晒夜露传统制法的杜梨叶中根皮苷含量为1.01%,远高于经渥堆变红后晒干的杜梨叶中根皮苷含量(0.41%)[20]。采用超声辅助甲醇提取锁阳中根皮苷,结果表明,11个不同产地锁阳中均含有根皮苷,且内蒙古巴盟锁阳根皮苷含量最高,为0.046 mg/g[21]。据报道,在菊科莴苣;杜鹃花科马醉木、越桔;豆科佛来明豆;壳斗科石栎;百合科萱草、矮牵牛;石榴科石榴;蔷薇科草莓、希尔特凤梨、平邑藻及蔷薇;虎耳草科;山矾科山矾;山茶科山茶;马鞭草科过江天竺葵等植物中均含有根皮素及其衍生物[22]。
综上所述,根皮素及其衍生物在多种植物中均存在,而以苹果属植物(Malus species)中含量最多,不仅苹果树体含有丰富的根皮素,且果实、果渣等均可作为提取根皮素的来源。在不同苹果品种、树体不同部位及不同生长时间,根皮苷及根皮素的含量均有不同。可用微波或超声波辅助有机溶剂回流浸提法提取根皮苷,进而水解获得根皮素;可应用硅胶柱色谱、大孔吸附树脂法、高效离心分配色谱(HPCCC)等对根皮苷(素)进行纯化;酸、酶水解可以将根皮苷转化为根皮素;薄层色谱、高效液相色谱、毛细管电泳法等色谱方法可以作为方便快捷的检测方法。
1.2 化学法制备根皮素
由于根皮素在天然植物中的含量相对较低、提取成本高,因此研究人员尝试以化学法进行半合成及全合成制备根皮素。
1.2.1 半合成制备
利用根皮苷经酸(通常是盐酸或硫酸)水解或酶(葡萄糖苷水解酶)水解制备根皮素如图1所示。
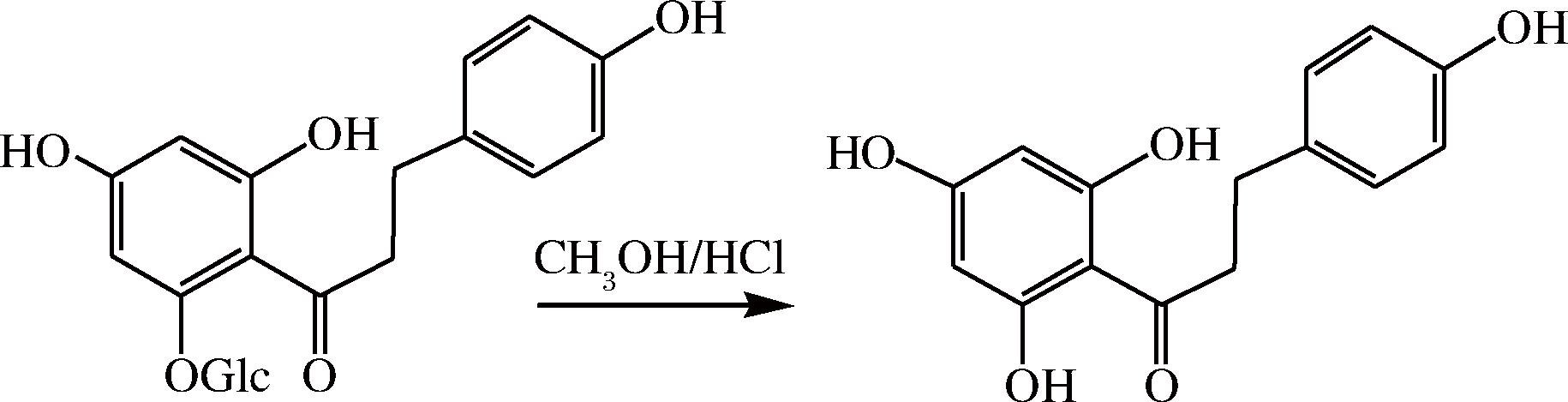
图1 根皮苷水解制备根皮素
Fig.1 Preparation of phloretin from hydrolysis of phlorizin
柚皮苷经两步法制取根皮素[23]:柚皮苷广泛存在于芸香科葡萄柚、橘、橙的果皮和果肉中,自然界中含量较为丰富。以柚皮苷为原料,催化氢化反应得柚皮苷二氢查尔酮,再在酸性条件下水解制得根皮素,反应过程如图2所示,此法可为根皮素的制备开辟新的途径。

图2 以柚皮苷为原料制备根皮素
Fig.2 Preparation of phloretin from naringin
1.2.2 全合成制备
以间苯三酚、羟基苯丙酸为原料,在BF3·Et2O为催化剂的条件下合成根皮素[24]。合成路线如图3所示。
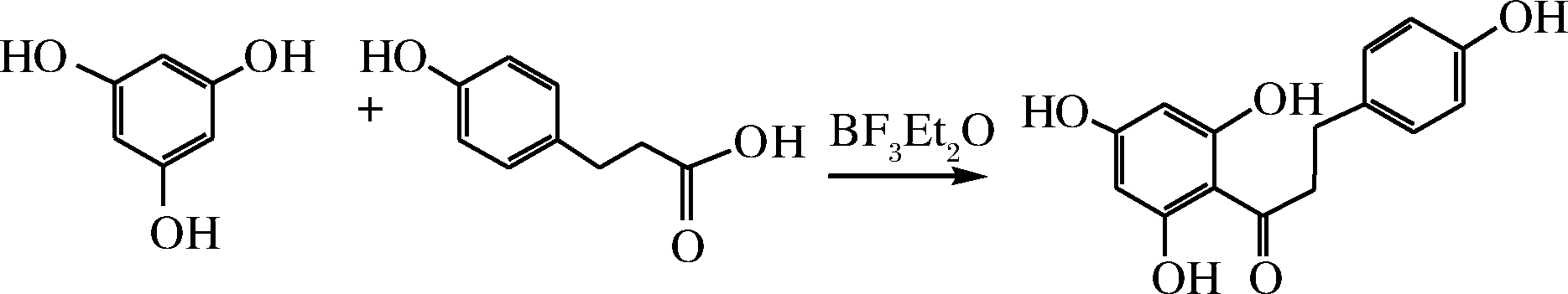
图3 由间苯三酚和对羟基苯丙酸制备根皮素
Fig.3 Preparation of phloretin from phloroglucinol and hydroxyphenyl propionate
以2’-羟基-4’,6’-双(甲氧甲氧基)苯乙酮和对甲氧基苯甲醛为原料经羟醛缩合,催化氢化,脱羟基保护基得到根皮素[25]。合成路线如图4所示。
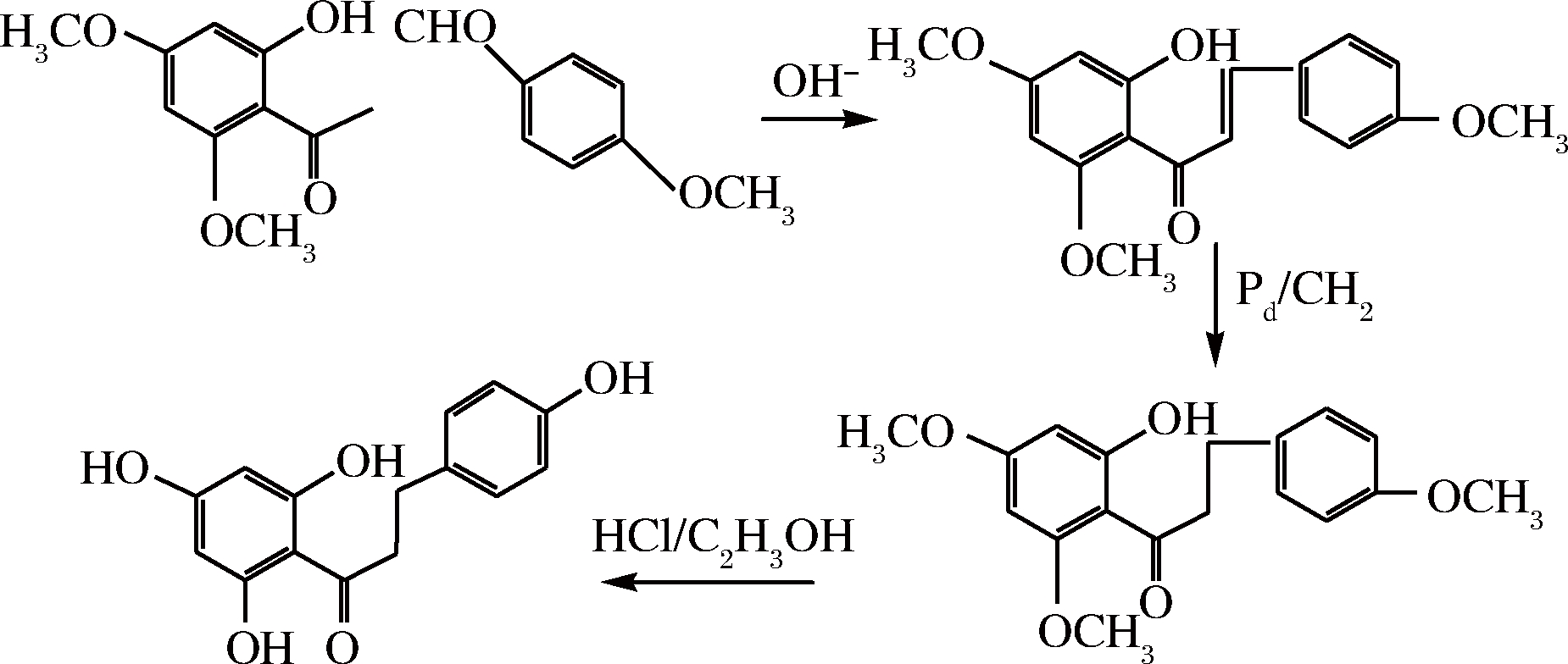
图4 由苯乙酮和对甲氧基苯甲醛制备根皮素
Fig.4 Preparation of phloretin from acetophenone and methoxy benzene formaldehyde
以丙二酸二乙酯为原料,先合成中间物对甲氧基苯丙酸;通过酰化反应和酯化反应,合成出目标中间体三对甲氧基丙酸均三酚酯;再以AlCl3为催化剂,硝基苯为溶剂,通过Fries重排反应合成根皮素[26]。主要合成路线如图5所示。
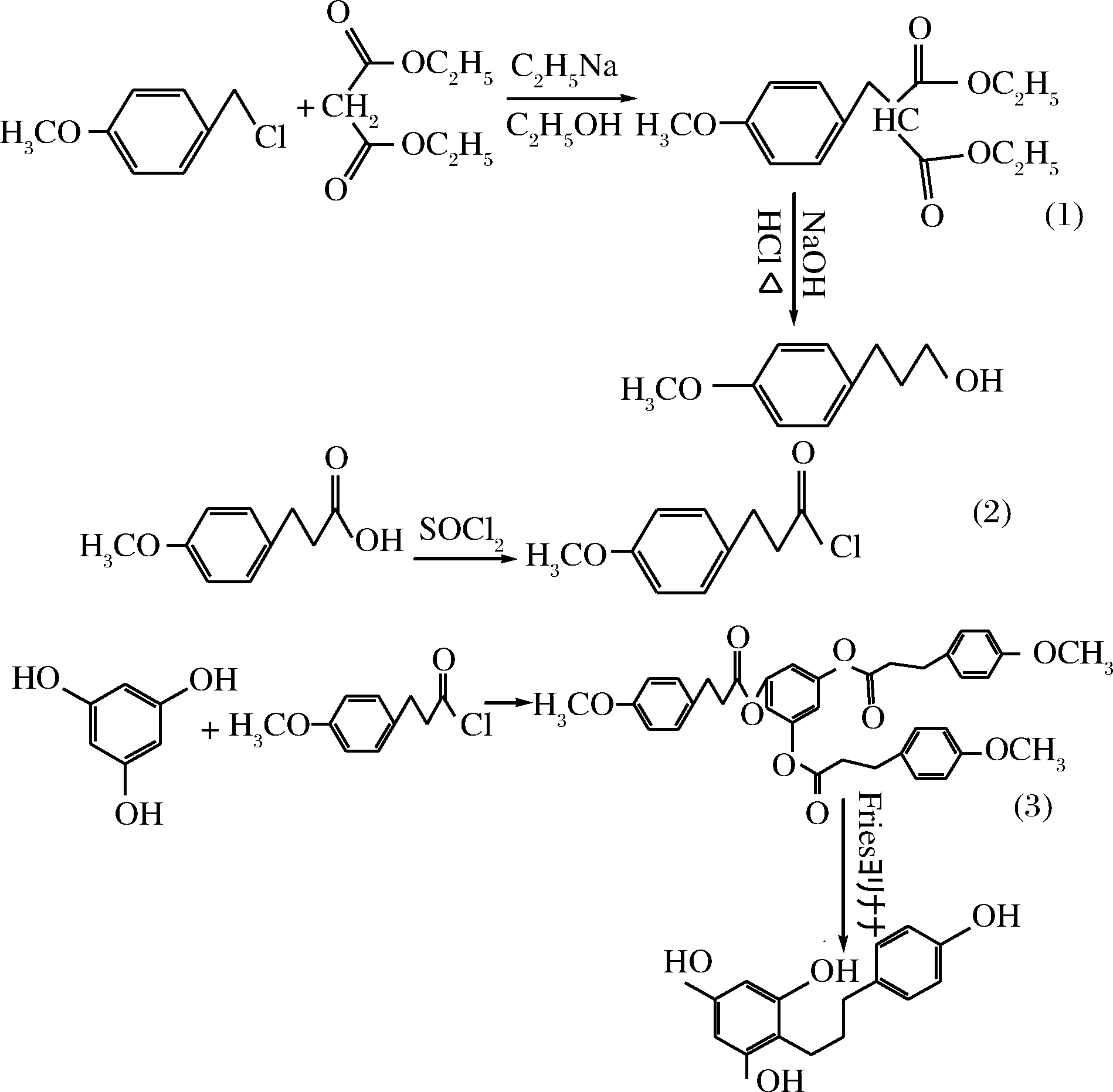
图5 由丙二酸二乙酯为原料制备根皮素
Fig.5 Preparation of phloretin from diethyl malonate
1.3 根皮素及根皮苷的生物合成
与其他合成方法相比,有关根皮素及根皮苷生物合成方法的相关研究报道目前还很少。有研究者用重组酶和植物蛋白提取物研究了根皮素及根皮苷的生物合成方法[27]。苹果属植物体内根皮素的生物合成的2种前体物质分别为:丙二酸单酰辅酶A(1)(Malonyl-CoA)、p-香豆酰-辅酶A(2)(p-coumaroyl-CoA)。合成途径如图6所示。

图6 根皮苷及根皮素的生物合成
Fig.6 Biosynthesis of phlorizin and phloretin
首先,对p-香豆酰-辅酶A (2)(p-coumaroyl-CoA)在还原型辅酶ⅱ(NADPH)的作用下生成p-二氢香豆酰辅酶A(4)(p-dihydrocoumaroyl-CoA);丙二酰辅酶A(1)(Malonyl-CoA)和p-香豆酰-辅酶A(2)(p-coumaroyl-CoA)在查尔酮合成酶的作用下生成柚皮素查尔酮(3)(naringenin chalcone)进而生成黄酮类化合物(flavonoids);而丙二酰辅酶A(1)(Malonyl-CoA)和p-二氢香豆酰辅酶A(4)(p-dihydrocoumaroyl-CoA)在查尔酮合成酶作用下生成根皮素(5)(phloretin),进而在P2’GT及UDP-glucose(根皮素-2’-O-葡萄糖基转移酶)作用下生成根皮苷(6)(phloridzin)[27]。研究发现烯酰还原酶类似基因ENRL-3和ENRL-5很有可能是促成根皮苷合成的关键基因[28]。
2 根皮素分子结构修饰
分子结构尤其是空间构象是化合物生理活性的决定性因素。根皮素虽然生物活性卓著,但是由于其分子间形成“砖尘”结构,分子间氢键作用力强,因此极难溶于水,根皮素在水中的溶解度仅为20 μg/mL。而药物要发挥生理活性需要具备适当的水溶性,一般认为其水溶性应该达到100 μg/mL[29]。极差的水溶性大大地制约了根皮素的应用范围。可对根皮素进行化学修饰以提高水溶性,使其更好发挥生物活性,拓展其应用范围。目前国内外开展根皮素的化学修饰的研究较少,仅有的研究主要围绕改善其水溶性,提高抗氧化活性等。方法主要包括醚化、缩合、酯化等。
2.1 酯化反应
根皮素乙酰阿魏酸酯:阿魏酸和根皮素酯化合成根皮素乙酰阿魏酸酯,其抗氧化活性显著优于根皮素[30]。合成途径如图7所示。
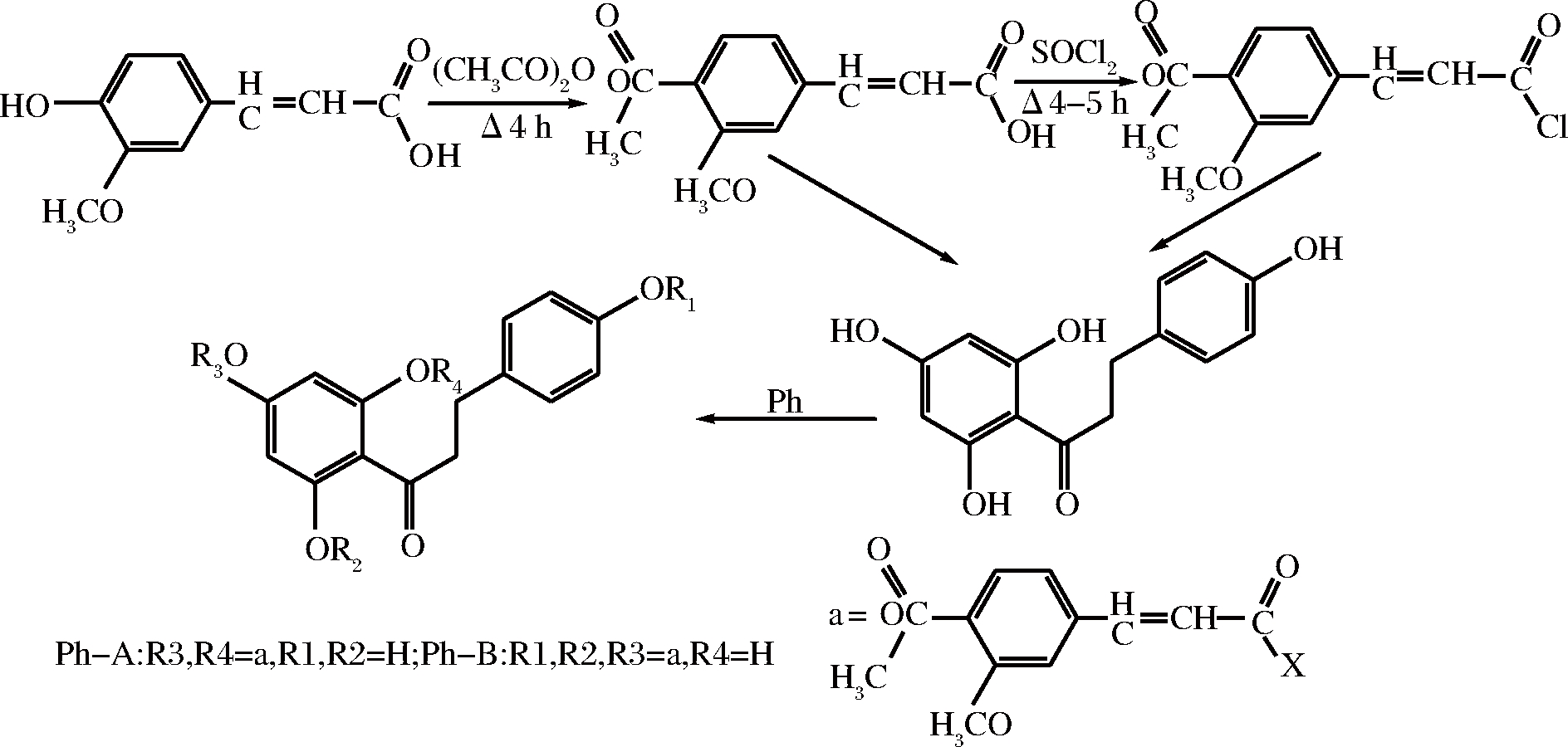
图7 根皮素乙酰阿魏酸酯的合成路线
Fig.7 Synthesis of phloretin acetylferulic acid esters
2.2 缩合反应
根皮素缩氨基硫脲类希夫碱:根皮素与氨基硫脲及其衍生物缩合得到缩氨基硫脲类席夫碱。根皮素缩氨基硫脲的水溶性比根皮素有较大提高;且抗氧化能力及抑制酪氨酸酶活性均比根皮素强[31]。合成途径如图8所示。
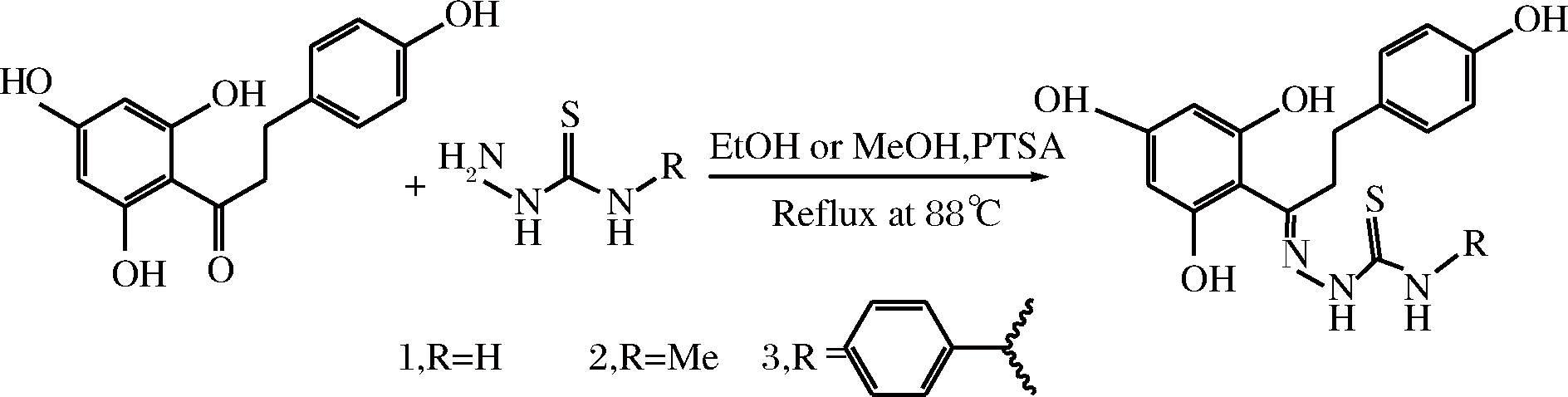
图8 根皮素缩氨基硫脲类席夫碱的合成路线
Fig.8 Synthesis of the phloretin thiosemicarbazones
根皮素腙类化合物:根皮素与异烟肼合成根皮素异烟酰基腙,结果表明根皮素异烟酰基腙的抗氧化活性显著优于根皮素[32]。合成途径如图9所示。

图9 根皮素异烟酰基腙的合成路线
Fig.9 Synthesis of phloretin isonicotinyl hydrazone
2.3 醚化修饰
通过引入亲水集团,对天然产物分子进行修饰从而提高其水溶性,是药物化学中的常用手段。本实验室通过对根皮素分子与溴乙胺氢溴酸盐进行醚化反应[33],对根皮素分子引入亲水性集团乙胺基,合成途径如图10所示。研究表明,根皮素溶解度达到9 163 μg/mL,较根皮素提高了430倍,极大提高了水溶液中使用效果。同时对单增李斯特菌、金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、荧光假单胞菌、鼠伤寒沙门氏菌都有较强的抑制作用,最小抑菌浓度可达到90、90、40、600、900、1 000 μg/mL。对DPPH、ABTS自由基具有较强的清除能力,对AAPH引发的pbr322质粒损伤具有明显的保护效果,IC50分别为78.00、48.20、230 μmol/L。这为根皮素在食品、药品及化妆品领域的应用奠定了基础。
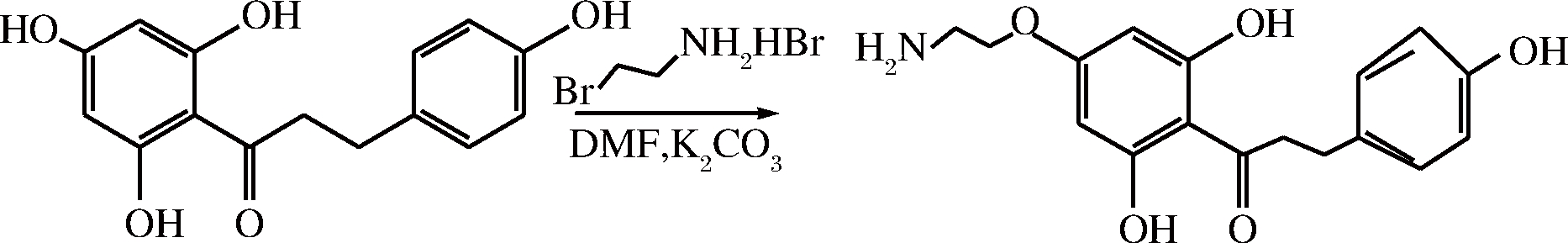
图10 根皮素胺乙基醚的合成
Fig.10 Synthesis of aminoethyl-phloretin
3 根皮素的生物活性及其作用机制
3.1 抗氧化活性
根皮素强抗氧化活性得益于其独特的二氢查尔酮活性结构,A环2′位及6′位的羟基对其抗氧化活性有重要的贡献。测定根皮素、根皮苷、间苯二酚、间苯三酚等10种与根皮素结构单元相近的化合物的抗氧化能力,发现根皮素的抗氧化特性取决于其结构中独特的2′,6′-二羟基苯乙酮结构,而根皮苷由于其6′位羟基被葡萄糖苷基取代,因而抗氧化活性大大降低(较之根皮素降低了18倍)[34]。研究发现二氢查尔酮类化合物均比与其拥有相应结构的黄酮类化合物具有更好的抗氧化活性。1H NMR分析发现,活性二氢查尔酮类化合物都拥有“时间平均”(time-average)的构象,芳环A环和C骨架垂直正交,而没有活性的二氢查尔酮化合物如2′-O-甲基根皮素,其分子中有强的酚羟基氢键作用,呈共面构像;A环2′位的羟基,即黄酮骨架C环开环形成的羟基,是抗氧化活性重要的活性基团[35]。
3.2 抑菌活性
根皮素对细菌及植物病原真菌都有抑菌作用。根皮素对革兰氏阳性菌的抑制作用明显强于阴性菌。根皮苷对微生物同样有抗菌性,其效果一般取决于物质的浓度和微生物对该物质的敏感性[36]。由于根皮苷抑制糖在肾脏部位的吸收,主要是发挥了腺苷酸参与的氧化磷酸化作用,因此,根皮素的抑菌作用可能是阻止了菌体细胞对磷的摄入[37]。根皮素对真菌也有抑制活性,对稻瘟病菌(Magnaporthe grisea)引起的稻瘟病、马铃薯晚疫病菌(Phytophthora infestans)引起的番茄晚疫病等9种植物病原菌都有抑菌作用[38]。根皮素可以抑制Escherichia coli O157∶H7生物膜的形成,大大降低了E.coli O157∶H7对于人结肠上皮细胞的黏附性,转录组学研究发现,根皮素抑制了毒性表达基因hlyE和stx2及自引导前体基因lsrACDBF及csgA、csgB的表达,同时大大刺激了噬菌体基因的表达[39]。根皮素可降低金黄色葡萄球菌细胞代谢关键酶—乳酸脱氢酶(LDH)及异柠檬酸脱氢酶(IDH)的活性,抑制了金黄色葡萄球菌的能量代谢,从而起到抑菌作用[40]。
3.3 抑制肿瘤细胞增殖
根皮素对多种恶性肿瘤细胞增殖具有抑制作用。根皮素(0~100 mol/L)可显著减少HT-29结肠癌细胞的存活数量并以剂量依赖的方式诱导细胞凋亡。根皮素能抑制ICAM-1蛋白和mRNA的表达,并且还能抑制单核细胞黏附炎性HaCaT细胞的能力[41]。根皮素可影响人肝癌细胞系SMMC-7721细胞形态分化,将细胞凋亡周期捕获在G0-G1期,同时降低细胞线粒体跨膜电位,干扰细胞内钙稳态,从而显著地抑制了肿瘤细胞增殖。根皮素可抑制人乳腺癌细胞MCF10A增殖,通过JNK及p38促分裂原活化蛋白激酶信号传导激活P53蛋白诱导乳腺癌细胞凋亡[42]。
3.4 抑制酪氨酸酶活性
根皮素具有显著的抑制酪氨酸酶活性能力。根皮素对酪氨酸酶抑制率优于曲酸和熊果苷[43],与曲酸和熊果苷复配,抑制率可达到100%。构效关系表明,对于查耳酮类化合物来说,芳环上羟基的位置对酪氨酸酶抑制活性影响最大;与A环相比较,B环被2′,4′-间苯二酚羟基取代对抑制活性有重要影响,A环和B环都被间苯二酚羟基取代,活性可以进一步增强。如2,4,2′,4′-四羟基查耳酮,其在A环的2位和4位,B环的2′位和4′位被羟基取代,是目前得到的活性最好的化合物[44]。由此可见,根皮素具有良好的抑制酪氨酸酶活性与其结构中的4个酚羟基息息相关。
3.5 免疫抑制及抗炎
根皮素具有出色的免疫抑制及抗炎作用。在对脂多糖刺激小鼠巨噬细胞RAW264.7的研究中发现,根皮素能显著抑制氧化氮,前列腺素E2、IL-6、TNF-α及iNOS和COX-2的水平,同时抑制NF-JB亚基p65蛋白的核转位,而在MAPK途径降低磷酸化,而根皮苷并没有以上抑制作用。因此,根皮素可有效降低促炎症因子在巨噬细胞RAW264.7中的水平而发挥抗炎作用[45]。在大鼠模型中,根皮素可抑制TNF-α诱导的结肠上皮细胞炎性反应,从而改善大鼠结肠炎的炎症。根皮素在体外对小鼠T淋巴细胞增殖、活化、周期和巨噬细胞NO释放、吞噬功能均有影响,同时可抑制T淋巴细胞增殖及CD69和CD25的表达。根皮素作用下巨噬细胞的NO释放量、吞噬率明显下降,表明根皮素通过抑制巨噬细胞功能来发挥抗炎作用[46]。
3.6 心血管保护作用
根皮素具有明显的心血管保护作用。对狗冠状动脉舒张影响机制研究表明,根皮素在离体冠脉血管环的舒张效应主要是通过抑制电压依赖性钙通道实现的,具有非内皮依赖性的舒血管效应。由于根皮素对血管具有直接作用,即可抑制VDCC[47]。根皮素可影响家兔离体主动脉收缩反应,对于家兔离体主动脉收缩反应具有直接的放松作用,根皮素能起到主动脉血管张力的调节作用,从而有利于血管保护。
3.7 细胞保护作用
根皮素对正常细胞具有保护作用。在丙烯醛毒性诱导实验中,根皮素强烈抑制了FDP-lysine(一种典型的丙烯醛赖氨酸加合物)的形成,并且阻止了FDP-lysine其余的亲电子集团。此外,根皮素可以直接捕获丙烯醛,从而抑制羰基结合BSA及RNase A的寡聚化反应;Western blotting结果表明,根皮素可以抑制神经母细胞瘤SH-SY5Y细胞在丙烯醛诱导下细胞蛋白羰基化水平,并对LDH泄漏具有明显的抑制作用。因此,根皮素在丙烯醛引起的人类疾病的预防和治疗中有应用价值[48]。根皮素是葡萄糖转运蛋白(GLUT1)的抑制剂,而GLUT1是葡萄糖通过血-视网膜屏障的唯一载体,因此,根皮素可通过抑制葡萄糖转运蛋白转运葡萄糖进入视网膜,限制视网膜局部含糖量,从而对光感受器视杆细胞的功能和形态均产生保护作用,在预防糖尿病视网膜病变(DR)中具有应用潜力[49]。
4 根皮素开发存在的问题及展望
根皮素具有广泛的生物活性,在食品、医药及化妆品领域都有极强的市场前景。在食品领域,根皮素无论是作为功能性食品还是食品添加剂都具有巨大潜力。在食品安全形势日益严峻的情况下,食品防腐剂安全问题也日益凸显,当下市场上防腐剂主要为分为三类[50]:(1)有抑菌作用而对人体有一定的潜在危害,如化学防腐剂。(2)有抑菌作用而且对人体无害,如生物防腐剂乳酸链球菌素,溶菌酶等。(3)有抑菌作用,对人体非但无毒而且有益作用,如植物源天然产物类防腐剂。而根皮素符合第三种防腐剂的要求,具有极强抗氧化性、抑菌性和宽广的抑菌谱,非但无毒且兼具对人体有益的生物活性,如将其开发为天然食品防腐剂,必将大有前景。同时,利用根皮素对酪氨酸酶极强的抑制能力,可将其开发为果蔬褐变保护剂加以利用。根皮素抑制癌细胞凋亡能力、抗炎及免疫抑制作用及心血管保护作用使其在临床用药方面有着巨大的应用潜力。目前,根皮素以其极强的酪氨酸酶抑制能力,已经作为新型天然美白剂在化妆品行业得以广泛应用,而根皮苷现已作为抗氧化剂被应用于食品中。
现今,学者们围绕根皮素开展了丰富的研究,但是根皮素的应用仍然存在诸多问题,主要有:(1)根皮素水溶性极差,在食品,药品领域应用时存在严重问题;(2)根皮素抗癌、抗心血管疾病等生物活性仍缺乏实验数据和临床数据的支持;根皮素抑菌机理仍需要进行深入探讨。(3)根皮素的安全性及生物利用度有待于深入研究。
根据根皮素研究现状,对于其开发主要应关注以下几个方面:(1)在正确认识其成分和结构的基础上,如何进一步提高根皮素功效和拓展其应用范围,是当前的研究热点。化学结构修饰方法技术多样,简便可靠,但目前有实效的化学修饰方法的研究还不多,应加强其化学修饰方面的研究,得到生理活性更强、实用价值更大的根皮素衍生物,同时注重对特殊功效修饰产物的开发。(2)通过对根皮素构效关系研究,深入探讨其抑菌、抑制肿瘤细胞增殖及抑制酪氨酸酶的机理,从而有针对性地进行防腐保鲜及果蔬制品防褐变产品开发。(3)开展体内实验研究,深入研究根皮素的生物利用度及在动物体内的代谢。为其安全性评价提供支持。
总之,随着各个学科交叉领域研究的不断深入,根皮素在食品、药品及化妆品领域中将会有巨大的应用前景。
[1] ANTIKA L D,LEE E J,KIM Y H,et a1.Dietary phlorizin enhanees osteoblastogenic bone formation through enhancing β-catenin activity via GSK-3B inhibition in amodel of senile osteoporosis[J].The Journal of Nutritional Biochemistry,2017,49:42-52.
[2] LIN C C,CHU C L,NG C S,et a1.Immunomodulation of phloretin by impairing dendritic cell activation and function[J].Food Function,2014,5(5):997-1 006.
[3] SHIN S,KUM H,RYU D,et al.Protective effects of new phloretin derivative against UVB-induced damage in skin cell model and human volunteers[J].Int J Mol Sci,2014,15(10):18 919-18 940.
[4] LIN Y P,HSU F L,CHEN C S,et al.Constituents from the Formosan apple reduce tyrosinase activity in human epidermal melanocytes[J].Phytochemistry,2007,68(8):1 189-1 199.
[5] SUN Yinshi,LI Wei,LIU Zhengbo.Preparative isolation,quantification and antioxidant activity of dihydrochalcones from Sweet Tea (Lithocarpus polystachyus Rehd.)[J].Journal of Chromatography B,2015,1002:372-378.
[6] 李穆琼,范引科,李晰,等.根皮苷及根皮素对小鼠的半数致死量测定[J].中国药师,2013(16):466-468.
[7] VERSARI A,BIESENBRUCH S,BARBANTI D,et al.Adulteration of fruit juices:Dihydrochalcones as quality markers for apple juice identification[J].Lebensm Wiss U Technol,1997,30:585-589.
[8] PETERSEN C.Analyse des phloridzins[J].Annales Academie Science Francaise,1835(15):178.
[9] LEE K W,KIM Y J,KIM D O,et al.Major phenolics in apple and their contribution to the total antioxidant capacity[J].J Agric Food Chem,2007,51(22):6 516-6 520.
[10] 张金宏,李俊娥,魏新元,等.苹果渣中结合酚不同提取方法的研究[J].食品工业科技,2016(20):160-165.
[11] 李荣涛,刘杰超,焦中高,等.RP-HPLC法测定苹果树枝、叶中根皮苷的含量[J].食品工业科技,2009(30):385-387.
[12] SUN Lijun,GUO Yurong,FU Chengcheng,et al.Simultaneous separation and purification of total polyphenols,chlorogenic acid and phlorizin from thinned young apples[J].Food Chem,2013,136(2):1 022-1 029.
[13] WALDBAUER K,MCKINNON R,KOPP B.Apple Pomace as potential source of natural active compounds[J].Planta Medica,2017,83(12):994-1010.
[14] 赵艳敏,王皎,宋光明,等.苹果树枝和叶中根皮苷及根皮素含量变化研究[J].食品研究与开发,2013(7):95-98.
[15] 李淑玲,陈笑笑,赵宝龙,等.10个苹果品种果实中酚类物质与褐变度分析[J].新疆农业科学,2016,53(7):1 199-1 203.
[16] DONG Huaqiang,NING Zhengxiang,YU Lijing,et al.Preparative separation and identification of flavonoid phloridzin from the crude extract of Sweet Tea(Lithocarpus polystachyus Rehd)[J].MOLECULES,2007(12):552-562.
[17] 侯雪瑞,谢阳,赖维,等.HPLC-MS检测荔枝果皮中的根皮苷[J].安徽医药,2014,18(12):2 255-2 257.
[18] 夏冬梅,李敏,王道清,等.藏药俄色叶中根皮苷、根皮素含量分析[J].中国现代医药,2014,16(8):618-622.
[19] 丁传波,赵婷,董岭,等.山荆子中根皮苷和黄酮含量的测定及其乙醇提取物的抗氧化活性[J].西北农林科技大学学报(自然科学版),2014,42(6):161-166.
[20] 殷法杰,秦国培,蒋海强,等.杜梨叶中根皮苷含量测定[J].山东中医杂志,2011,30(3):200-215.
[21] 李辰,陈卫林,郭玫,等.锁阳中儿茶素、根皮苷的提取及含量测定[J].五邑大学学报,2011,25(1):23-28.
[22] ROZMER Z,PERJESI PAL.Naturally occurring chalcones and their biological activities[J].Phytochemistry Reviews,2016(15):87-120.
[23] 李秉擘.具有生物活性的天然产物根皮素的合成与纯化的相关研究[D].杭州:浙江大学,2012.
[24] VIDAVALUR S,CHUNDURI V R,SOMEPAL V.A concisesynthesis of polyhydroxydihydrochalcones and homoisoflavonoids [J].Tetrahedron,2006,62:841-846.
[25] 石磊,班树荣,冯秀娥,等.二氢黄酮类衍生物的合成及抗肿瘤活性研究[J].中国药物化学杂质,2010(20):176-180.
[26] 陈艳君.大豆脂肪氧合酶抑制剂根皮素的合成及性能研究[D].无锡:江南大学,2008.
[27] CHRISTIAN G,HEIDI H,KARL S.Phloridzin:Biosynthesis,distri bution and physiological relevance in plants[J].Phytochem,2010 (71):838-843.
[28] DARE A,TOMES S,COONEY J,et al.The role of enoylreductase genes in phloridzin biosynthesis in apple[J].Plant Physiology and Biochemistry,2013,72:54-62.
[29] VALENTINO J S,KWAME W N A.Prodrug strategies to overcome poor water solubility[J].Adv Drug Delivery Rev,2007,59:677-694.
[30] 李翠萍,余燕影,曹树稳.根皮素乙酰阿魏酸酯的合成及抗氧化活性研究[J].天然产物研究与开发,2012,24:316-320.
[31] XU Bingbing,YU Yanying,WAN Pinghong,et al.Synthesis and antityrosinase,antioxidant activities of phloretinthiosemicarbazones [J].Res Chem Intermed,2013,3:19.
[32] 张宏宇,周武喜,赵余庆.根皮素衍生化的研究进展[J].中草药,2017,48 (20):4 353-4 360.
[33] 魏丽娜.根皮素胺乙基醚化修饰及其生物活性、安全性和对三文鱼片保藏效果[D].西安:陕西师范大学,2015.
[34] MINDAUGAS L,PRANAS V,RAIMONDAS R,et al.Phenolic composition and antioxidant activity of Malus domestica leaves[J].The Scientific World Journal,2014(9):1-10.
[35] XUE Yunsheng,ZHENG Youguang,AN Lin,et al.Density functional theory study of the structure-antioxidant activity of polyphenolic deoxybenzoins[J].Food Chemistry,2014,151(20):198-206.
[36] ALINA S,GRAZYNA Z,ALEKSANDRA S.Analysis of polyphenolic compounds in extracts from leaves of some malus domestica cultivars:antiradical and antimicrobial analysis of these extracts[J].Biomed Res Int,2016,2016:1-12.
[37] SHAPIRO B.The mechanism of phloridzin glucosuria[J].Biochem J,1947,41:151-154.
[38] GAUCHER M,BERNONVILLE D D,THOMAS,et al.Histolocalization and physico-chemical characterization of dihydrochalcones:Insight into the role of apple major flavonoids[J].Phytochemistry,2013,90:78-89.
[39] LEE J H,REGMI S C,KIM J A,et al.Apple flavonoid phloretin inhibits escherichia coli O157∶H7 biofilm formation and ameliorates colon inflammation in rats[J].Infection and Immunity,2011,79(12):4 819-4 827.
[40] DAVIDE B,ERSILIA B,GIUSEPPINA L,et al.Biochemical and antimicrobial activity of phloretin and its glycosylated derivatives present in apple and kumquat[J].Food Chem,2014,160:292-297.
[41] HUANG W C,DAI Y W,PENG H L,et al.Phloretin ameliorates chemokines and ICAM-1 expression via blocking of the NF-κB pathway in the TNF-α-induced HaCaT human keratinocytes[J].International Immunopharmacology,2015,27(1):32-37.
[42] MIN J,LI X,HUANG K,et al.Phloretin induces apoptosis of non-small cell lung carcinoma A549 cells via JNK1/2 and p38 MAPK pathways[J].Oncology Reports,2015.
[43] 杜鹏.根皮素酰腙衍生物的合成及其生物活性研究[D].南昌:南昌大学,2013.
[44] ZHENG Z P,CHENG K W,ZHU Q,et al.Tyrosinase inhibition constituents in roots of Morus nigra:a structure-activity relationship study[J].J Agric Food Chem,2010,58(9):5 368-5 373.
[45] CHANG,Weitien,HUANG Wenchung,LIOU Chianjiun.Evaluation of the anti-inflammatory effects of phloretin and phlorizin in lipopolysaccharide-stimulated mouse macrophages[J].Food Chem,2012,134:972-979.
[46] LU Xiaoyu,ZENG Yaoying,YE Yanxia,et al.Anti-inflammatory and immunosuppressive effect of phloretin[J].Acta Pharmaceutica Sinica,2009,44 (5):480-485.
[47] JIAO Pengfei.Study on cardiovascular protective effects of phloretin[J].J Mod Med Health,2012,28 (9):1 284-1 286.
[48] ZHU Qin,NATALIE,ZHANG Qishan,CHI F L,et al.In vitro attenuation of acrolein-induced toxicity by phloretin,a phenolic compound from apple[J].Food Chem,2012,135:1 762-1 768.
[49] 石珂,赵璐,游志鹏,等.根皮素对糖尿病小鼠光感受器视杆细胞的保护作用[J].眼科新进展,2014,34(9):809-812.
[50] WEI Lina,CHENG Jing,MENG Yonghong,et al.A novel formulation of thiamine dilaurylsulphate and its preservative effect on apple juice and sterilised milk[J].Food Chem,2014,152:415-422.