辣木是一种生长于热带或亚热带地区,具有优良保健和预防作用的多年速生作物,被称为“奇迹之树”。辣木籽是辣木中的主要食用部分,它不仅含有丰富的蛋白质(约36%),还含有大量的油脂(约40%)。辣木籽油的脂肪酸组成与橄榄油相似,属于高油酸型油脂,油酸含量约78%,并且含有少量亚麻酸(约0.20%)、亚油酸(约0.77%)等必需脂肪酸[1],这些不饱和脂肪酸有助于降低因胆固醇含量过高而引起的心血管疾病。此外,辣木籽油中还含有植物甾醇(4~5 g/kg)、生育酚(287~327 mg/kg)等活性成分[2]。脂肪酸和多种活性成分共同赋予了辣木籽油良好的抗氧化性和热稳定性,因此辣木籽油在食品领域上常常用于延长食品保质期[3]和作为深度油炸用油的原料(常与葵花籽油、大豆油等常用食用油混合使用)[4]。
截止至2016年,辣木在全国的种植面积约6万亩,其中云南约占70%[5]。随着辣木大规模种植,以辣木叶为辅料制作的花色面条、辣木酥、辣木松糕等辣木食品开始在当地市场上流通。然而,由于推广力度薄弱、生产技术不够成熟等原因,以辣木籽为原料进行深加工的商业化产品及相关研究尚未得到推广,还是以直接食用为主。目前,国内外主要集中在辣木籽的油脂、蛋白质提取方法及其理化性质的初步研究[6],以及辣木籽油在食品、化工领域的应用[7-8]。关于辣木籽的油脂的提取方法与应用等方面的综述报道较少,目前仅有对辣木籽油的特点及食用、药用价值方面的研究概述[9],有关辣木籽油提取方法及其对理化性质的影响,以及辣木籽油在食品、化妆品、生物柴油等领域上应用的研究综述尚未见探讨。因此,本文从辣木籽油的脂肪酸组成及其理化性质、提取方法(压榨法、溶剂浸提法、水酶法、超临界CO2流体萃取法)和应用上进行了概括与探讨,旨在更好地为辣木籽油的深入研究及相关产品的开发应用提供理论支持与借鉴。
1 辣木籽油的脂肪酸组成及理化特性
1.1 辣木籽油的脂肪酸组成
辣木籽油的脂肪酸组成与橄榄油近似,属于高油酸型油脂。不同提取方法得到的辣木籽油中均含有丰富的油酸(66.69%~79.50%);其次是棕榈酸(5.66%~6.80%)和硬脂酸(3.83%~6.50%),还含有少量的肉豆蔻酸(0.10%~0.30%)和人体自身不能合成的亚油酸(0.48%~0.90%)和亚麻酸(0.00~0.28%)。高油酸(约78%)和低多不饱和脂肪酸(约10%)赋予了辣木籽油可与橄榄油(油酸含量74.1~79.5%、多不饱和脂肪酸含量11.2%[10])相媲美的氧化稳定性,研究显示辣木籽油可以在20 ℃下避光保存304 d[11]。表1总结了以不同提取方法得到的辣木籽油的脂肪酸含量和得率,经不同提取方法得到的辣木籽油的脂肪酸含量基本相近,变异系数在0.02~0.29。经溶剂浸提法和超临界CO2流体萃取法提取的辣木籽油的得率最高,分别为38.63%和37.09%,与它们相比,压榨法和水酶法提取辣木籽油的得率较低,分别为25.45%和25.20%。这可能因为有机溶剂与油的极性相似,超临界CO2流体具有与液体相似的溶解性和与气体相似的扩散性,因此在有机溶剂和超临界CO2流体中传质效率更高,得率更高。即使提取方法相同,所得的辣木籽油的提取率和脂肪酸组成仍存在差异,这可能是由所用辣木籽的生长地理环境、气候等方面的差异造成的。LALAS等[1]研究结果显示2种提取方法(机械压榨法和溶剂浸提法)对所得的辣木籽油的脂肪酸组成的影响不显著。目前尚未见到关于提取方法对辣木籽油中脂肪酸组成有显著影响的情况,这可能与所报道的提取方法的条件温和性以及辣木籽油自身的良好化学稳定性有关。
表1 不同提取方法对辣木籽油的脂肪酸组成和得率(%)的影响
Table 1 Effect of extraction methods on the fatty acid composition and yield (%)of Moringa oleifera seed oil

脂肪酸提取方法压榨法[1,12-13]溶剂浸提法[1,12-16]水酶法[16-19]超临界CO2流体萃取[15,20-23]变异系数C14∶00.18±0.09[12-13](0.11~0.24)0.12±0.01[1,12,15](0.11~0.13)0.13±0.07[17-19](0.10~0.30)0.15±0.03[15,20-21,23](0.13~0.19)0.18C16∶06.00±0.33[1,12-13](5.73~6.34)6.18±0.29[1,12-16](5.82~6.50)6.20±0.52[16-19](5.90~6.80)6.04±0.32[15,20-23](5.66~6.53)0.02C18∶04.48±1.06[1,12-13](3.83~5.70)5.20±0.78[1,12-16](4.14~5.88)5.17±1.15[17-18](4.50~6.50)5.91±0.26[15,20-22](5.67~6.25)0.11C18∶175.50±3.95[1,12-13](71.6~79.50)74.90±3.25[1,12-14,16](71.21~78.80)74.10±3.55[17-18](70.00~76.20)68.90±2.62[15,20-22](66.69~72.26)0.04C18∶20.75±0.04[1,12](0.72~0.77)0.66±0.07[1,12,15](0.60~0.73)0.87±0.06[17-18](0.80~0.90)0.63±0.15[15,20-22](0.48~0.84)0.15C18∶30.20±0.00[1,12](0.20~0.20)0.15±0.10[1,12,15](0.00~0.22)0.10±0.14[17,19](0.00~0.20)0.20±0.05[15,20-22](0.17~0.28)0.29得率25.45±0.49[1,12](25.10~25.80)38.63±2.16[1,12,14,15](35.70~40.39)25.20±3.35[17-18](22.60~28.98)37.09±0.78[15,21,23](36.30~37.85)0.23
注:C14∶0-肉豆蔻酸;C16∶0-棕榈酸;C18∶0-硬脂酸;C18∶1-油酸;C18∶2-亚油酸;C18∶3-亚麻酸;表格中平均值是根据参考文献报道值进行求平均值得到;括号内数值是根据参考文献报道的阈值得到;变异系数是根据4种提取方法的平均值进行求标准差与平均值之比得到。
1.2 辣木籽油的理化特性
表2总结了不同提取方法对辣木籽油理化性质的影响。4种方法提取的辣木籽油黏度为43.60~103.00 (mPa·s),皂化价为125.75~199.32 mg KOH/g,碘价为64.29~59.45 g I/100 g,折射率为1.46~1.47,密度为0.87~0.94 mg/mL。提取过程中含水量的高低会影响辣木籽油黏度的大小,有较多水分参与时(如压榨法),所提取的辣木籽油表现出更大的黏度,这可能是由于辣木籽中的磷脂会与提取过程中的水充分结合导致的。
表2 不同提取方法对辣木籽油理化性质的影响
Table 2 Effect of extraction methods on the physical and chemical characteristics of Moringa oleifera seed oil
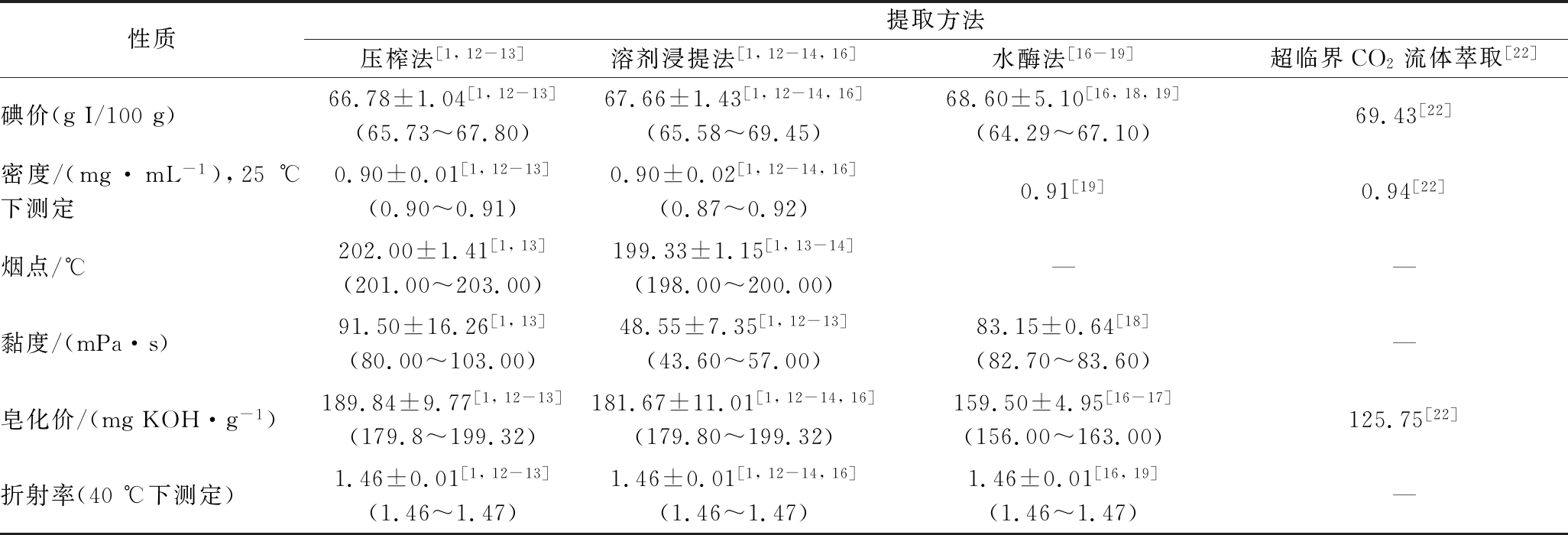
性质提取方法压榨法[1,12-13]溶剂浸提法[1,12-14,16]水酶法[16-19]超临界CO2流体萃取[22]碘价(gI/100g)66.78±1.04[1,12-13](65.73~67.80)67.66±1.43[1,12-14,16](65.58~69.45)68.60±5.10[16,18,19](64.29~67.10)69.43[22]密度/(mg·mL-1),25℃下测定0.90±0.01[1,12-13](0.90~0.91)0.90±0.02[1,12-14,16](0.87~0.92)0.91[19]0.94[22]烟点/℃202.00±1.41[1,13](201.00~203.00)199.33±1.15[1,13-14](198.00~200.00)——黏度/(mPa·s)91.50±16.26[1,13](80.00~103.00)48.55±7.35[1,12-13](43.60~57.00)83.15±0.64[18](82.70~83.60)—皂化价/(mgKOH·g-1)189.84±9.77[1,12-13](179.8~199.32)181.67±11.01[1,12-14,16](179.80~199.32)159.50±4.95[16-17](156.00~163.00)125.75[22]折射率(40℃下测定)1.46±0.01[1,12-13](1.46~1.47)1.46±0.01[1,12-14,16](1.46~1.47)1.46±0.01[16,19](1.46~1.47)—
注:表格中平均值是根据参考文献报道值进行求平均值得到;括号内数值是根据参考文献报道的阈值得到;“—”代表相关文献未报道。
目前,已有关于机械压榨法和溶剂浸提法制得的辣木籽油的理化性质(碘价、密度、烟点、黏度、皂化价、折射率)的文献报道,然而水酶法和超临界CO2流体萃取法对辣木籽油的烟点、黏度等理化性质的影响尚不清楚,尤其是采用不同提取方法对同一品种的辣木籽油的理化性质的影响尚不明确,这限制了生产者选择最匹配产品特性的油脂。油的理化性质对其品质高低具有重要意义,研究不同提取方法对辣木籽油理化性质的影响,对在食品、化妆品、生物柴油等领域有针对性选择提取方法具有重要作用。因而,比较多种提取方法对辣木籽油理化性质的影响研究有待加强。
2 辣木籽油的加工提取方法
2.1 机械压榨法
机械压榨法有冷压法和热压法2种类型。与热压法相比,冷压法能更好地保留油的芳香、化学性质和营养特征[24]。机械压榨法操作简单、安全、成本较低,且其所获得的油具有较好的品质,通常用于含油量高的种子提取。然而,采用机械压榨法提取的辣木籽油黏度较大(相较于溶剂浸法),这可能与压榨过程中含水量较高有关,在含水量较高情况下原料中极性比油脂较强的磷脂易与水结合[1]。此外,因为部分油会残留在压榨饼中,所以采用此方法的得率通常较低,约为溶剂浸提法的65%[1]。为了提高机械压榨法提取辣木籽油的得率,可以用溶剂浸提法对残渣中的油进行进一步提取。例如,FOTOUO-M等[25]将经压榨法提取后的辣木籽压榨饼,研磨后通过溶剂浸提法进行了二次提取,压榨法与溶剂浸提法两步法的得率比仅采用压榨法提高了约13%。近几年关于机械压榨法提取辣木籽油的文献报道较少,这可能是受实验室场地和机械压榨设备的限制。此外,虽然机械压榨法提取辣木籽油的得率较低且集中于辣木籽油理化性质的表征,但与其他提取方法相比其对辣木籽油理化性质及其产品品质的影响程度尚不明确。
2.2 溶剂浸提法
溶剂浸提法是一种常见的提取油脂的方法,利用的为油脂与有机溶剂间相似相溶的原理,具有高效、易于回收等特点[26]。溶剂的极性会对油脂的提取率与品质造成影响。提取时使用非极性溶剂(石油醚、乙醚、氯仿等)能获得比极性溶剂更高的提取率,但抗氧化性相对较弱,这可能是因为极性溶剂溶解辣木籽中抗氧化物、生育酚等物质的能力更强[27]。结合极性溶剂与非极性溶剂的提取效果与特点,可以采用两者按一定比例混合的形式对辣木籽油进行提取,以期获得较高提取率及富含生物酚、抗氧化物质等生物活性成分的脂质。LALAS等[1]发现当极性溶剂(甲醇)和非极性溶剂(氯仿)按照1∶1(体积比)混合使用后,辣木籽油的得率比单独使用非极性溶剂时提高,抗氧化性更强;但其中所含的胶溶性杂质的含量也增多。这些胶溶性杂质的存在不仅影响油脂的稳定性,而且影响油脂精炼的工艺效果,因此在采用极性较强的溶剂提取辣木籽油时,不仅应重视得率的高低,还应考虑和监控油样中的胶溶性杂质的水平。
在溶剂浸提法中,可以采用超声、微波等辅助手段缩短辣木籽油的提取时间以提高提取效率。例如,ZHONG等[6]在溶剂浸提法提取辣木籽油的过程中分别引入了超声波辅助和微波辅助提取,在获得相似的得率(约36%)时,这2种辅助手段分别比对照组(未加入超声、微波辅助的溶剂提取)缩短了25和41 min。这可能是因为超声波的空化作用和微波的快速升温作用使辣木籽细胞的结构变得松散,从而增大了传质速率。此外,超声、微波等辅助手段还可以提升辣木籽油的营养性。采用超声辅助溶剂浸提法提取的辣木籽油中含有更丰富的维生素E(是空白对照组的3.48倍)[19],这可能是因为在超声波辅助下,传质速率增大,维生素E能够更好地溶于有机溶剂中。尽管溶剂浸提法提取油脂的得率较大,也有了较成熟的发展,但仍然面临着因有机溶剂残留而带来的食用油安全性隐患、威胁生态环境等问题,这限制了溶剂浸提法在食品行业的广泛应用。
2.3 水酶法
水酶法是一种可以同时从油料种子中提取蛋白质和油的方法,具有环境友好[28]、提取温度较低[29]、制得的油质量较高[30]的特点。它通过果胶酶、纤维素酶等酶作用水解油料种子细胞壁中的结构多糖,以及通过蛋白酶破坏或水解组成细胞膜和油质体(Oleosome,含三酰基甘油基质的细胞器)膜上的蛋白质,从而促使油脂从油料种子细胞中释放[31]。通过酶破坏细胞的结构与水解非油组分来辅助水法提取辣木籽油,能使油得率从7.80%迅速升至22.50%[16]。
在相同提取条件下,酶的种类会对辣木籽油的得率产生较大影响。有研究表明,采用单一酶提取辣木籽油时,加入中性蛋白酶时的得率高于分别加入纤维素酶、果胶酶、α-淀粉酶时的得率[17]。LATIF等[16]也得到了相似的结论,即采用中性蛋白酶提取辣木籽油的得率最高(与纤维素酶、果胶酶等糖酶相比)。由于辣木籽油周围存在较多蛋白质(图1[32]),由此可推测,采用蛋白酶破坏细胞膜和油质体中的蛋白质要比采用其他种类酶作用于细胞壁中结构多糖的效果好。为了进一步提高得率,可以在水酶法提取辣木籽油的过程中加入复合酶(破坏植物细胞壁的纤维素酶和水解蛋白质的蛋白酶)。例如,ABDULKARIM等[18]发现4种酶(蛋白酶、纤维素酶、果胶酶、α-淀粉酶)复配使用时比单独使用某种酶能获得更大的回收率(约74.0%,分别是蛋白酶、果胶酶的1.02和1.31倍)。然而,酶的价格昂贵,复合酶的使用管理难度较大,且水酶法提取过程所耗时间较长(通常超过24 h)[16],这增加了生产成本,不利于产品的开发。因此,有不少研究者选择在酶解过程中或预处理时引入超声、微波、高压等辅助手段以提高得率。例如,孙燕等[33]发现,分别采用超声、微波和高压对相同品种的辣木籽进行预处理后再进行1 h的酶解,其提取率比对照组(未加辅助手段)分别提高了9.90%、5.64%和4.93%。这是因为经超声、微波和高压预处理辣木籽后,其表观结构被破坏,传质效率增高,油脂更易释放(图2)[6,31]。
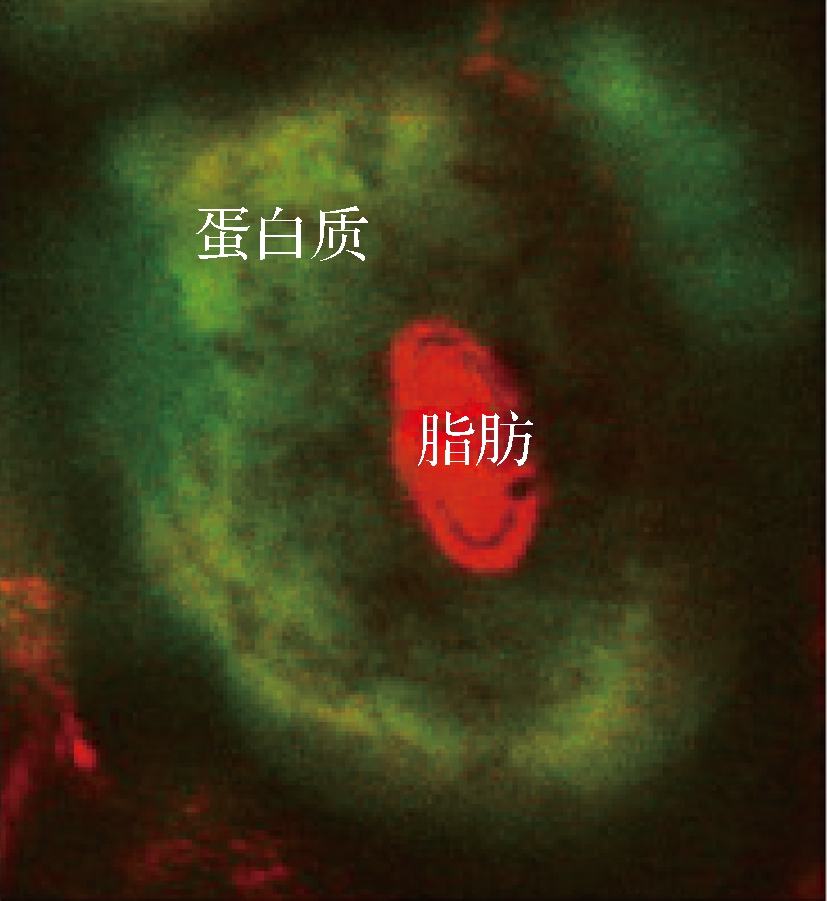
图1 辣木籽细胞的微观结构
Fig.1 The microstructure image of Moringa oleifera seed cell

图2 预处理前后辣木籽粉的扫描电镜图(×1 500)
Fig.2 The SEM images of Moringa oleifera seed before and after treated by different pretreatments
2.4 超临界CO2流体萃取法
超临界流体是指在超过临界温度和压力的环境中,介于液态和气态之间的物质。由于CO2独特的特性(环保、低毒、廉价、非极性、非爆炸性、易于从提取物中除去)[34]、温和的临界温度(31.1 ℃)和临界压力(7.38 MPa)[35],因此其被广泛地用于超临界流体萃取技术中。超临界CO2流体萃取法通常包括以下几个步骤(图3)。首先是将CO2液化、加热至高密度的超临界状态;然后将超临界CO2流体通过含有油料种子的萃取器中,利用其高溶解性溶解油脂;最后将含有油的超临界CO2流体通过分离柱,减压使油与CO2分离[15,21]。超临界CO2流体萃取法在有效规避有机溶剂残留和机械压榨得率低等问题的同时保证了较高的提取率(与溶剂浸提相近)和较好的油脂品质(与机械压榨相近)[22,36]。由此可见,超临界CO2流体萃取法是一种能够高效率利用油料种子并获得高品质油的方法。
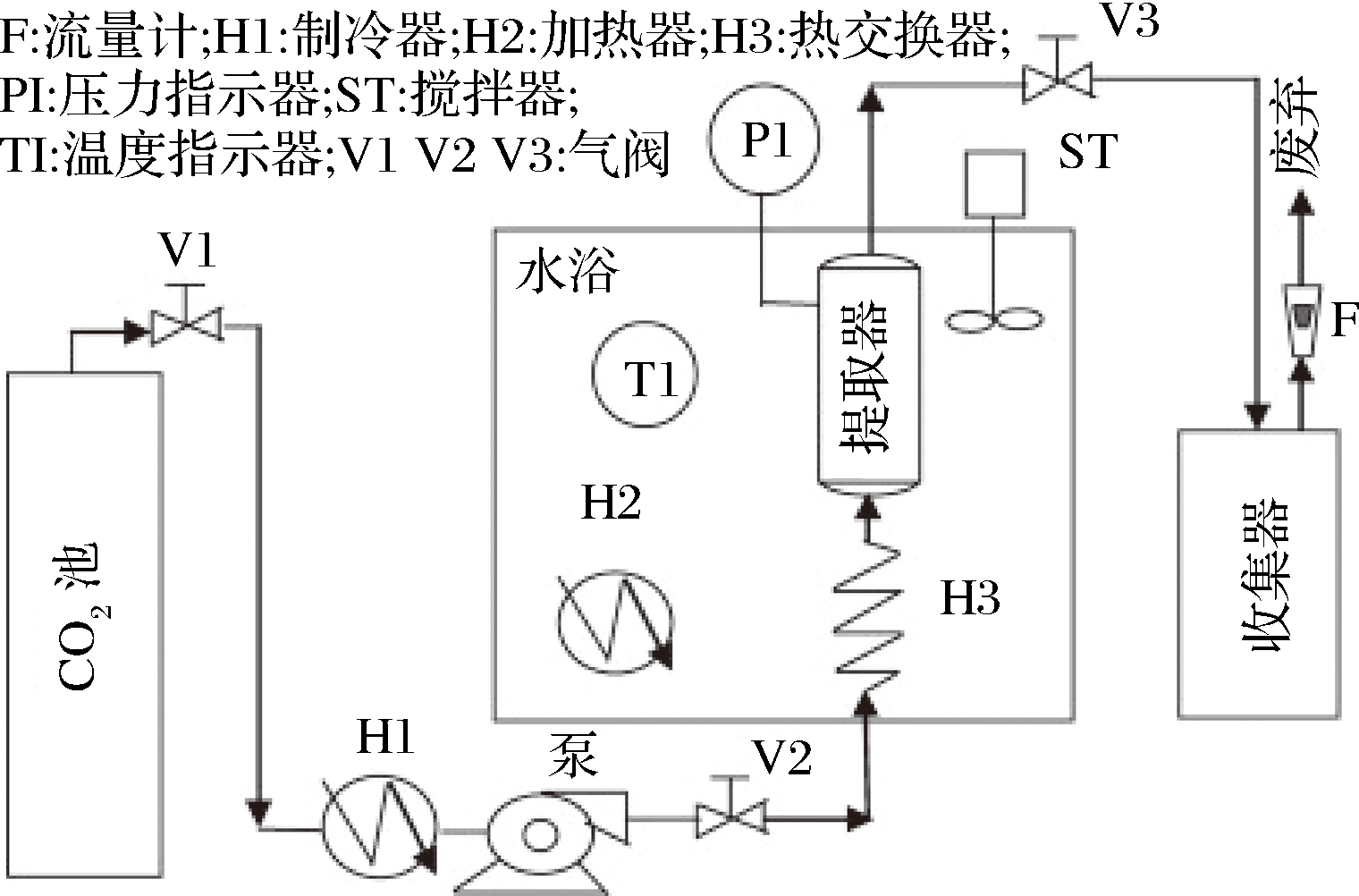
图3 超临界CO2流体萃取流程示意[21]
Fig.3 The experimental unit of supercritical carbon dioxide
与机械压榨法、水酶法相比,已有较多超临界CO2流体萃取辣木籽油的报道。有研究表明,在萃取压力20 MPa,萃取温度35 ℃,CO2流量20 kg/h的条件下,辣木籽油的提取率达97%[23]。另外,超临界CO2流体萃取可通过改变压力、温度、CO2流量等参数来改善油的品质。例如,RUTTARATTANAMONGKOL等[22]通过调整压力、温度等参数来研究其对提取率、辣木籽油理化性质、脂肪酸、生育酚和甾醇组成的影响,发现高压环境虽然能提高辣木籽油的提取率,但是所得油脂中的油酸、生育酚和甾醇含量偏低。这意味着在实际生产中,生产者可以根据产品定位和目标人群需要,通过适当调节超临界CO2流体萃取时的萃取压力或温度,来控制辣木籽油的品质。然而,由于超临界CO2流体萃取技术面临着设备成本高昂等现实问题,因此其主要被应用在富含生物活性物质或具有独特成分的油脂提取中[37]。
3 辣木籽油的潜在应用
3.1 食品用油方面
辣木籽油是一种理想的食品用油,原因有以下几点。第一,辣木籽油本身具有较好的感官品质。辣木籽油中过氧化物的水平较低,在室温下呈金黄色,并能散发出类似于花生的宜人坚果味[38]。因此,提取后的辣木籽油可以省略或简化多数商业植物油生产中不可缺少的脱色、脱臭等步骤,这有利于提高生产效率、降低生产成本。第二,辣木籽油具有较好的营养保健功能。辣木籽油不仅含有丰富的钾和镁(分别为36.67和5.86 mg/L),还含有丰富的油酸(含量高达78%),这有利于降低因血清中胆固醇水平过高引起的心血管疾病的风险[39]。第三,辣木籽油具有良好热稳定性。丰富的油酸和生育酚赋予了辣木籽油高度的热稳定性,是理想的煎炸用油。热重分析结果显示(图4),辣木籽油在304 ℃开始分解,高于菜籽油(298 ℃),表现出更好的热稳定性[7]。ABDULKARIM等[40]将辣木籽油与市售大豆油、菜籽油进行了连续煎炸试验(持续5 d),其中辣木籽油的碘值、过氧化值变化幅度最小,总极性化合物水平最低,热稳定性也优于这2种常见的商业用油。由此可见,辣木籽油具有部分或全部替代传统煎炸植物油的应用前景。此外,提取方法也是影响辣木籽油热稳定性的一个原因,相同的油炸条件下,冷压榨法提取得到的辣木籽油比溶剂浸提法(正己烷)表现出更好的抗劣化性[41]。

图4 辣木籽油与菜籽油的热重分析
Fig.4 The TG/DTG curves of Moringa oleifera seed and canola oils
3.2 防腐抑菌方面
基于避免由微生物引起的食品腐败变质和延长食品货架期的需要,食品防腐剂(苯甲酸、山梨酸、硝酸盐等)已经广泛用于食品行业中。但是,合成防腐剂的轻度蓄积性和生殖毒性使人们开始对其安全性产生了质疑。随着人们生活水平的提高和大众对健康问题重视程度的加深,天然防腐物质逐渐进入人们的视线。辣木籽油是一种优异的天然防腐物质,这归于其自身的安全性(急性毒性试验表明辣木籽油实际无毒,遗传毒性试验证明辣木籽油没有致畸和致突变风险[42])和良好的抗菌特性[43]。另一项研究显示,通过对辣木籽油处理前后的单增李斯特菌和金黄色葡萄球菌的形态结构和完整性进行观察后发现,处理后的细菌表面粗糙且不完整,细胞膜脱离细胞质,内容物流出(图5)[44]。
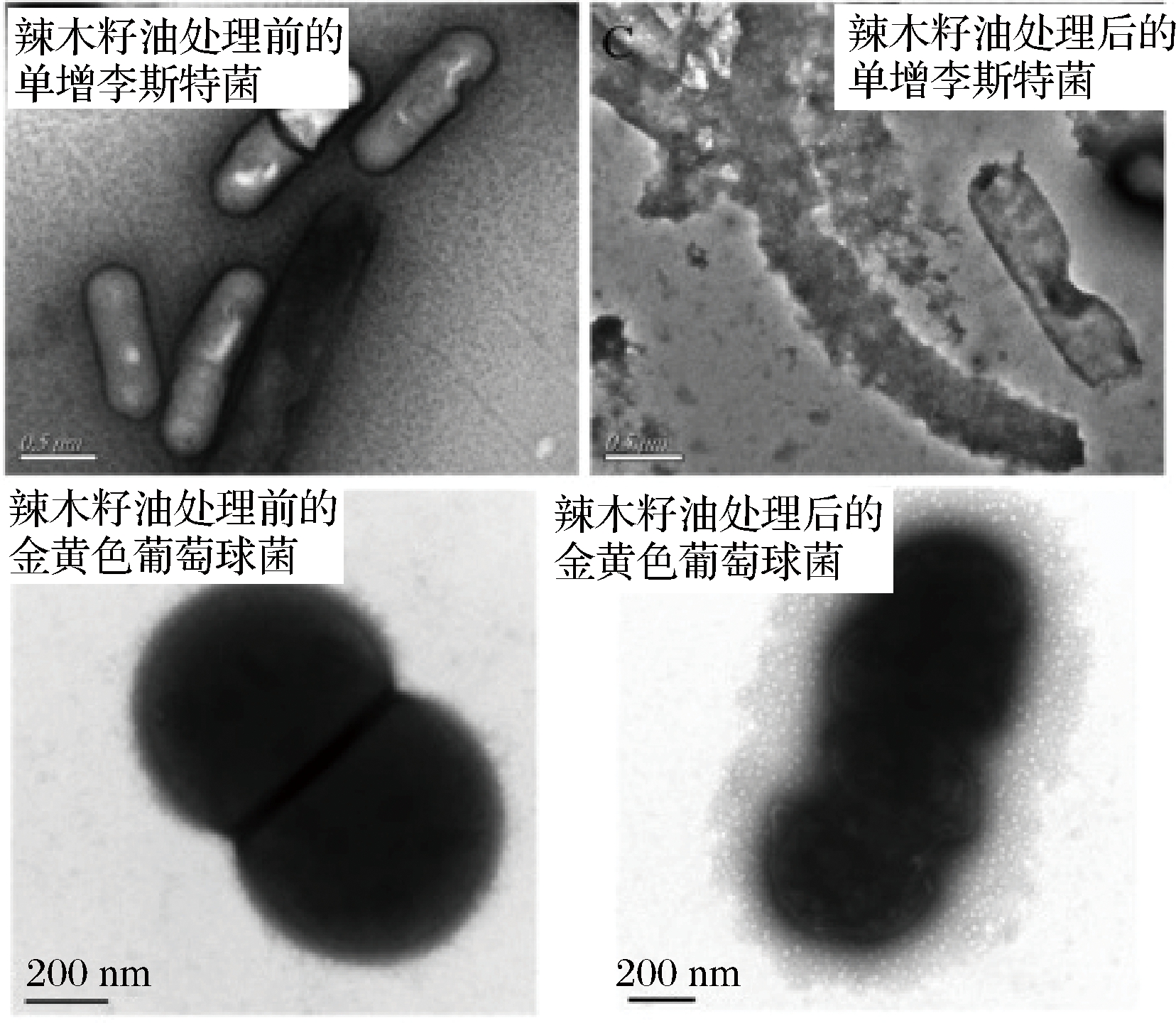
图5 辣木籽油处理前后的单增李斯特菌和金黄色葡萄球菌的SEM图
Fig.5 The SEM images of L.monocytogenes and S.aureus before and after treated by Moringa oleifera seed oils
这说明辣木籽油的抗菌特性是通过不可逆破坏细菌的细胞结构来实现的。辣木籽油的良好防腐特性,在延长发酵乳制品的保质期上有良好的研究应用。SALEM等[45]将加入不同比例辣木籽油的酸奶油在琼脂板上恒温培养2 d后发现,和未加辣木籽油的酸奶油相比,所有比例的细菌总数均有所下降。放置15 d后,未加辣木籽油的酸奶油中酵母菌和霉菌数量已接近酸奶油中允许检出数量的上限,而含辣木籽油的酸奶油在保存了28 d后,仍未检出酵母菌和霉菌。此外,该研究显示添加辣木籽油不仅不会对酸奶油的外观、酸度等产生不良影响,还能够起到改善酸奶油风味的作用。
3.3 其他方面
基于辣木在种植过程中不需要占用耕地和单位种植面积所得到的辣木籽油产量较高(产油量达900 kg/hm2)的特点[46],辣木籽油在除食品之外的其他领域有着更广泛的潜在应用。生物柴油是由植物油或动物脂肪在化学法或酶法等催化条件下与醇(主要是甲醇)发生酯交换反应产生的。它具有良好的环境效益(CO2和硫的排放量较低,几乎不产生颗粒污染物),是一种很有前途的矿物柴油替代品[47]。大量研究表明,辣木籽油是一种用于制作生物柴油的优异原料[48],由辣木籽油转化而成的生物柴油的运动黏度(4.83 mm2/s)、氧化稳定性(3.61 h)、润滑性(135 μm)均满足ASTM D6751标准,此外,它的十六烷值含量高达67.07%,在目前所报道的生物柴油中位于前列[49]。
除了用于制作生物柴油,辣木籽油还非常适合用于化妆品中。早在古埃及便有使用辣木籽油去除皱纹的记载;目前,仍可以在国际化妆品的配方中发现辣木籽油(如资生堂、科颜氏)。丰富的油酸赋予了辣木籽油较好的稳定性,这使其非常适用于需要加入FeO等还原性物质来赋予颜色(如口红)的化妆品中;此外,辣木籽油还表现出较好的顺滑性和较小的扩散性,这恰好是颜色较深、上色面积较小的化妆品(如眼影)所需要的[47]。段琼芬等[50]还发现辣木籽油具有防晒功能,防晒效果与SPF值为21的防晒霜相似;在小鼠背部分别涂抹食用油、防晒霜、辣木籽油,然后在紫外灯下照射6 h后与未经辐射的对照组小鼠相比,涂抹食用油的小鼠皮肤出现严重灼伤,而涂抹辣木籽油和防晒霜的小鼠背部没有发现损伤;皮肤组织的病理切片结果表明,辣木籽油对皮肤的保护作用可以达到真皮层。
4 展望
自2014年国家主席习近平访问古巴以来,辣木在我国广西、云南等地区已有大规模种植。辣木籽油优良的脂肪酸组成和丰富的生物活性成分使其在食品和非食品领域均具有广阔的发展前景。就现阶段有关辣木籽油的理论研究现状与进展来看,仍需要从以下几个方面进行深入研究。第一,对不同提取方法制得的辣木籽油进行安全性评价。目前关于不同提取方法制得的辣木籽油的安全性研究较少,仅有对压榨法提取的辣木籽油的安全性评价,大众普遍质疑溶剂浸提法安全性,但还没有相关研究。第二,系统研究不同提取方法对辣木籽油理化性质的影响。理化性质对鉴定油脂品质具有重要的意义,对在食品、化妆品、生物柴油等领域上的选择有针对性提取方法具有重要作用。国内外关于水酶法和超临界CO2流体萃取法提取的辣木籽油的理化性质的相关研究甚少。第三,对辣木籽油精炼方法进行研究。对提取的辣木籽油进行精炼,有助于其在食品、医疗领域更好的应用。第四,对辣木籽油中功效成分的作用机理进行研究辣木籽油在预防心血管疾病、降低癌症发病率上均有较好的效果,但是其预防机制、活性物质的化学结构仍尚不明确。
[1] LALAS S,TSAKNIS J.Characterization of Moringa oleifera seed oil variety “Periyakulam 1”[J].Journal of Food Composition and Analysis,2002,15(1):65-77.
[2] BOUKANDOUL S,CASAL S,CRUZ R,et al.Algerian Moringa oleifera whole seeds and kernels oils:Characterization,oxidative stability,and antioxidant capacity[J].European Journal of Lipid Science and Technology,2017,119(10):1600410.
[3] FATMA A M H,KE A,MONA A M A,et al.Production of healthy functional soft white cheese using Moringa oleifera oil[J].Pakistan Journal of Biological Sciences:PJBS,2018,21(8):394-400.
[4] ANWAR F,HUSSAIN A I,IQBAL S,et al.Enhancement of the oxidative stability of some vegetable oils by blending with Moringa oleifera oil[J].Food Chemistry,2007,103(4):1 181-1 191.
[5] 廖承飞,李贵华,韩学琴,等.云南辣木产业发展的SWOT分析及对策[J].中国热带农业,2016(2):13-16.
[6] ZHONG J,WANG Y,YANG R,et al.The application of ultrasound and microwave to increase oil extraction from Moringa oleifera seeds[J].Industrial Crops and Products,2018,120:1-10.
[7] DUARTE A M,AQUINO J S,QUEIROZ N,et al.A comparative study of the thermal and oxidative stability of Moringa oil with olive and canola oils[J].Journal of Thermal Analysis and Calorimetry,2018,124(3):1 943-1 952.
[8] FERNANDESAB D M,SQUISSATOA A L,LIMAAB A F,et al.Corrosive character of Moringa oleifera Lam biodiesel exposed to carbon steel under simulated storage conditions[J].Renewable Energy,2019,139:1 263-1 271.
[9] 陈德华,张孝祺,张惠娜.一种新型功能食用油-辣木籽油[J].广东农业科学,2008(5):17-18.
[10] PORTARENA S,FARINELLI D,LAUTERI M,et al.Stable isotope and fatty acid compositions of monovarietal olive oils:Implications of ripening stage and climate effects as determinants in traceability studies[J].Food Control,2015,57:129-135.
[11] 段琼芬,马李一,余建兴,等.辣木油的抗氧化稳定性研究[J].北京林业大学学报,2009,31(6):112-115.
[12] TSAKNIS J,SPILIOTIS V,LALAS S,et al.Quality changes of Moringa oleífera,variety mbololo of Kenya,seed oil during frying[J].Grasas Y Aceites,1999,50(1):37-48.
[13] OGUNSINA B S,INDIRA T N,BHATNAGAR A S,et al.Quality characteristics and stability of Moringa oleifera seed oil of Indian origin[J].Journal of Food Science and Technology,2014,51(3):503-510.
[14] ANWAR F,BHANGER M I.Analytical characterization of Moringa oleifera seed oil grown in temperate regions of Pakistan[J].Journal of Agricultural and Food Chemistry,2003,51(22):6 558-6 563.
[15] ZHAO S,ZHANG D.A parametric study of supercritical carbon dioxide extraction of oil from Moringa oleifera seeds using a response surface methodology[J].Separation and Purification Technology,2013,113:9-17.
[16] LATIF S,ANWAR F,HUSSAIN A I,et al.Aqueous enzymatic process for oil and protein extraction from Moringa oleifera seed[J].European Journal of Lipid Science and Technology,2011,113(8):1 012-1 018.
[17] ABDULKARIM S M,LONG K,LAI O M,et al.Some physico-chemical properties of Moringa oleifera seed oil extracted using solvent and aqueous enzymatic methods[J].Food Chemistry,2005,93(2):253-263.
[18] ABDULKARIM S M,LAI O M,MUHAMMAD S K S,et al.Use of enzymes to enhance oil recovery during aqueous extraction of Moringa oleifera seed oil[J].Journal of Food Lipids,2006,13(2):113-130.
[19] 吕秋冰,向泽攀,徐向波,等.不同提取方式对辣木籽油品质影响分析[J].食品科技,2018,43(3):226-231.
[20] ZHAO S,ZHANG D.An experimental investigation into the solubility of Moringa oleifera oil in supercritical carbon dioxide[J].Journal of Food Engineering,2014,138:1-10.
[21] NGUYEN H N,GASPILLO P D,MARIDABLE J B,et al.Extraction of oil from Moringa oleifera kernels using supercritical carbon dioxide with ethanol for pretreatment:Optimization of the extraction process[J].Chemical Engineering and Processing:Process Intensification,2011,50(11):1 207-1 213.
[22] RUTTARATTANAMONGKOL K,SIEBENHANDL-EHN S,SCHREINER M,et al.Pilot-scale supercritical carbon dioxide extraction,physico-chemical properties and profile characterization of Moringa oleifera seed oil in comparison with conventional extraction methods[J].Industrial Crops and Products,2014,58:68-77.
[23] 段琼芬,刘飞,罗金岳,等.辣木籽油的超临界CO2萃取及其化学成分分析[J].中国油脂,2010,35(2):76-79.
[24] ELSAYED E A,SHARAF-ELDIN M A,WADAAN M.In vitro evaluation of cytotoxic activities of essential oil from Moringa oleifera seeds on HeLa,HepG2,MCF-7,CACO-2 and L929 cell lines[J].Asian Pacific Journal of Cancer Prevention,2015,16:4 671-4 675.
[25] FOTOUO-M H,DU T E S,ROBBERTSE P J.Effect of storage conditions on Moringa oleifera Lam.seed oil:Biodiesel feedstock quality[J].Industrial Crops and Products,2016,84:80-86.
[26] AKARANTA O,ANUSIEM A C I.A bioresource solvent for extraction of castor oil[J].Industrial Crops and Products,1996,5(4):273-277.
[27] BHUTADA P R,JADHAV A J,PINJARI D V,et al.Solvent assisted extraction of oil from Moringa oleifera Lam.seeds[J].Industrial Crops and Products,2016,82:74-80.
[28] MORADI N,RAHIMI M.Effect of ultrasound- and pulsed electric field-assisted enzymatic treatment on the recovery and quality of sunflower oil[J].Separation Science and Technology,2019,54(6):1 043-1 054.
[29] HANMOUNGJAI P,PYLE D L,NIRANJAN K.Enzymatic process for extracting oil and protein from rice bran[J].Journal of the American Oil Chemists' Society,2001,78(8):817-821.
[30] MUNDER S,LATIF S,MÜLLER J.Enzyme-assisted aqueous oil extraction from high oleic sunflower seeds in a salable prototype reactor[J].Waste and Biomass Valorization,2018.
[31] GOULA A M,PAPATHEODOROU A,KARASAVVA S,et al.Ultrasound-assisted aqueous enzymatic extraction of oil from pomegranate seeds[J].Waste and Biomass Valorization,2018,9(1):1-11.
[32] MAT Y M,GORDON M H,EZEH O,et al.Aqueous enzymatic extraction of Moringa oleifera oil[J].Food Chemistry,2016,211:400-408.
[33] 孙燕,覃小丽,钟金锋,等.不同预处理对辣木籽油提取率的影响及其机理初步分析[J/OL].食品与发酵工业:DOI:10.13995/j.cnki.11-1802/ts.019592.
[34] ÖZKAL S G,YENER M E.Supercritical carbon dioxide extraction of flaxseed oil:Effect of extraction parameters and mass transfer modeling[J].The Journal of Supercritical Fluids,2016,112:76-80.
[35] SODEIFIAN G,GHORBANDOOST S,SAJADIAN S A,et al.Extraction of oil from Pistacia khinjuk using supercritical carbon dioxide:Experimental and modeling[J].The Journal of Supercritical Fluids,2016,110:265-274.
[36] DUBA K S,FIORI L.Supercritical CO2 extraction of grape seed oil:Effect of process parameters on the extraction kinetics[J].The Journal of Supercritical Fluids,2015,98:33-43.
[37] CATAL N L,ORT
N L,ORT M A,GIMÉNEZ A P,et al.Pistachio oil:A review on its chemical composition,extraction systems,and uses[J].European Journal of Lipid Science and Technology,2017,119(5):1600126.
M A,GIMÉNEZ A P,et al.Pistachio oil:A review on its chemical composition,extraction systems,and uses[J].European Journal of Lipid Science and Technology,2017,119(5):1600126.
[38] LEONE A,SPADA A,BATTEZZATI A,et al.Moringa oleifera seeds and oil:Characteristics and uses for human health[J].International Journal of Molecular Sciences,2016,17(12):2141.
[39] AL-GHAMDI F A.Fatty acids and macroelements of Moringa (M.peregrina and M.oleifera)seed oils[J].Pakistan Journal of Nutrition,2018,17(11):609-614.
[40] ABDULKARIM S M,LONG K,LAI O M,et al.Frying quality and stability of high-oleic Moringa oleifera seed oil in comparison with other vegetable oils[J].Food Chemistry,2007,105(4):1 382-1 389.
[41] TSAKNIS J,LALAS S.Stability during fying of Moringa oleifera seed oil variety “Periyakulam 1”[J].Journal of Food Composition and Analysis,2002,15(1):79-101.
[42] 段琼芬,马李一,王有琼,等.辣木籽油食用安全性毒理学评价[J].中国油脂,2014,39(2):48-52.
[43] CHUANG P,LEE C,CHOU J,et al.Anti-fungal activity of crude extracts and essential oil of Moringa oleifera Lam[J].Bioresource Technology,2007,98(1):232-236.
[44] LIN L,GU Y,CUI H.Moringa oil/chitosan nanoparticles embedded gelatin nanofibers for food packaging against Listeria monocytogenes and Staphylococcus aureus on cheese[J].Food Packaging and Shelf Life,2019,19:86-93.
[45] SALEM A S,SALAMA W M,RAGAB W A.Prolonged shelf life of sour cream by adding Moringa oleifera leaves extract (MOLE)or Moringa oleifera oil (MOO)[J].American Journal of Food Technology,2015,10:58-67.
[46] 段琼芬,李迅,陈思多,等.辣木营养价值的开发利用[J].安徽农业科学,2008(29):12 670-12 672.
[47] KLEIMAN R,ASHLEY D A,BROWN J H.Comparison of two seed oils used in cosmetics,Moringa and marula[J].Industrial Crops and Products,2008,28(3):361-364.
[48] NIJU S,ANUSHYA C,BALAJII M.Process optimization for biodiesel production from Moringa oleifera oil using conch shells as heterogeneous catalyst[J].Environmental Progress &Sustainable Energy,2018.
[49] RASHID U,ANWAR F,MOSER B R,et al.Moringa oleifera oil:A possible source of biodiesel[J].Bioresource Technology,2008,99(17):8 175-8 179.
[50] 段琼芬,杨莲,李钦,等.辣木油对小鼠抗紫外线损伤的保护作用[J].林产化学与工业,2009,29(5):69-73.