进入新世纪以来,全球经济经历了飞速发展的阶段,而环境污染和能源危机的形势却日益严峻[1-2]。随着人们生活水平日益提高,含油脂生活废水的排放也呈指数增长[3]。未经处理直接进入水体的油脂会漂浮于水体表面,影响水体的富氧及后续净化,危害水生生态系统,严重污染周围环境[4-5]。目前,含油脂废水的处理方法主要有物理法、化学法和生物法。物理法和化学法由于投资大、占地广、工艺复杂,且容易产生二次污染,实际应用较少[5]。生物法处理油脂废水,主要利用油脂废水中具有一定的油脂降解能力的微生物,将油脂作为碳源和能源,并通过微生物生长过程中产生的脂肪酶等降解酶系将油脂水解为甘油、脂肪酸,最终分解氧化为H2O和CO2等代谢产物[6]。生物处理过程投资小、成本低、效率高且无二次污染,现已成为国内外的研究热点[7-9],降解油脂微生物的筛选分离也逐渐成为了研究热点[10]。
目前,丹江口库区的产业结构调整和转型升级得到了大力发展,来自工业的三废污染和农业的面源污染已得到了良好控制[11-12]。然而,库区人们日益增长的生活废弃油脂排放,若不及时处理,一旦超过水体自净的阈值,必将成为新增的污染源。本研究以丹江口库区广泛使用的大豆油为模式底物,从丹江口库区上游支流紫气河的水体中,筛选出了能够高效降解当地生活废弃油脂的土著微生物,为实现丹江口库区废弃生活油脂的生物降解奠定了基础,对库区的污水生物处理及水生态安全的保护也具有重要的意义。
1 材料与方法
1.1 材料
1.1.1 水样
在丹江口库区的马蹬镇紫气河流域,根据生活污水的排放特点,选取了3个合适的采样点,分别用无菌的50 mL离心管采取水样,于冰盒保存备筛。
1.1.2 主要培养基
富集培养液、中性红培养基及选择培养液参照孟静[10]的方法,根据当地食用油使用的特点略作修改。富集培养液:NaCl 5 g,蛋白胨5 g,牛肉膏5 g,福临门大豆油4 mL,自然pH,用水定容至1 L,121 ℃灭菌20 min;油脂中性红培养基:NaCl 5 g,KH2PO4 0.3 g,MgSO4·7H2O 0.1 g,K2HPO4 1.5 g,(NH4)2SO4 1.0 g,琼脂20 g,Tween 80 20 mL,福临门大豆油10 mL,1.6%中性红水溶液1 mL,蒸馏水定容至1 L,自然pH,121 ℃灭菌20 min;选择培养液:蛋白胨1 g,NH4NO3 0.2 g,K2HPO4 0.5 g,KH2PO4 0.5 g,MgSO4·7H2O 0.1g,豆油1 mL,pH 7.2~7.4,蒸馏水定容至1 L,121 ℃灭菌20 min。
1.1.3 主要试剂与试剂盒
Axygen® AxyPrep Bacterial Genomic DNA Miniprep Kit,Axygen公司;Premix Prime STAR HS试剂盒,大连宝生物;其他试剂均为国产或进口分析纯。
1.2 油脂降解菌的驯化
将采集的水样样品充分混合,取5 mL加入装有45 mL无菌水和无菌玻璃组的150 mL三角瓶内,置于摇床上,200 r/min转速充分振荡10 min,然后取5 mL加入35 mL富集培养液中,并在40 ℃,200 r/min,自然pH条件下培养,每天观察,如果发现油脂降解得好就补加少量大豆油,每4 d转接10 mL培养物至30 mL新的培养基中,以促进油脂降解菌的生长,此驯化过程持续2个月。
1.3 油脂降解菌的筛选
1.3.1 初筛
将驯化后的菌液梯度稀释后涂布于油脂中性红培养基上,置于37 ℃的恒温培养箱进行平板培养,每12 h观察培养基中菌落的生长情况。在相同培养条件下生长的菌株,单菌落生长的比较大而且颜色鲜红,则证明该菌株能在此条件下良好地生长,且具有降解油脂的能力,从而初步测定出各菌株对油脂的降解情况,并以此来判断待测菌株对油脂的降解能力。
1.3.2 复筛
参照张印等[13]方法,采用紫外分光光度法测定油脂降解率,来对油脂降解菌进行复筛,获得油脂降解能力最强的菌株,并进行编号命名,以供下一步的鉴定。
1.3.3 油脂降解率的测定
将大豆油溶解于石油醚,配制成10%的标准液,然后分别用石油醚配制成体积分数为0.5%、1%、1.5%、2%、2.5%、4%和5%的工作液。然后在205 nm处测定各浓度下油脂的OD值,并绘制标准曲线,得到回归方程。通过方程式(1)计算油脂降解率。
油脂降解率![]()
(1)
式中:C0,培养基中含油量;C1,发酵液中含油量。
1.4 油脂降解菌的鉴定
1.4.1 形态和生理生化鉴定
根据《伯杰细菌鉴定手册》,将目标菌株进行形态和生理生化特征鉴定。
1.4.2 目的菌株的16 S rDNA的扩增及分析
细菌基因组DNA的提取参照试剂盒的说明书进行,并用NanoDrop 2000C超微量分光光度计测基因组的浓度。利用细菌16S rDNA扩增通用引物27F和1492R,以目的菌种基因组DNA为模板进行PCR扩增,并用1%的琼脂糖凝胶电泳检测。扩增后的PCR产物纯化后由上海生工生物工程有限公司测序,将得到的16S rDNA序列结果提交到NCBI数据库并进行BLAST比对,找到并下载典型的菌株序列与实验菌株的序列用Clustal X 2.0软件进行同源性分析,并用MEGA 6.0软件构建系统发育树。
1.5 油脂降解条件的研究
1.5.1 初始pH的影响
丹江口库区水体的pH值一般在7.8~8.2[14],为了考察不同的初始pH值对油脂降解的影响以及目标菌株对库区pH的适应性,本文首先对初始pH值做了单因素分析。以选择培养液为基础,调整油脂初始浓度到5%,菌种接种量10%,分别选定pH值为6.0、6.5、7.0、7.5、8.0、8.5和9.0作为初始值,在37 ℃、150 r/min下培养36 h,然后分别测定各pH值下的油脂降解率。
1.5.2 培养时间的影响
为了考察培养时间对油脂降解情况的影响,以选择培养液为基础,调整油脂初始浓度到5%,菌种接种量10%,pH值为7.0,在37 ℃、150 r/min下分别培养0、6、12、18、24、30和36 h,然后分别测定各培养时间线下的油脂降解率。
1.5.3 培养温度的影响
丹江口库区水体的水温常年在6~27 ℃[14],为了考察不同的培养温度对油脂降解的影响以及目标菌株对库区温度的适应性,本文也对温度做了单因素分析。以选择培养液为基础,调整油脂初始浓度到5%,菌种接种量10%,pH值为7.0,分别在5、10、15、20、25、30和35 ℃、150 r/min下培养36 h,然后分别测定各温度下的油脂降解率。
1.5.4 目标菌株对其他常见油脂的降解
丹江口库区居民的生活油脂主要包括大豆油、菜籽油和花生油,为了进一步考察目标菌株的应用潜力,本文继续考察了目标菌株对菜籽油和花生油的降解效果。以选择培养液为基础,分别调整菜籽油和花生油初始浓度到5%,菌种接种量10%,pH值为7.0,在35 ℃、150 r/min下培养36 h,每隔4 h取样测定它们的油脂降解率。
2 结果与分析
2.1 油脂降解菌的驯化与分离筛选
用大豆油对菌种进行为期2个月的驯化,然后用中性红油脂培养基进行平板分离,获得了一株油脂降解能力较强的菌株。如图1所示,1号菌株的菌落周围有明显的水解圈,且明显大于其他菌落,另外菌落中间也有红色斑点出现,表明该菌株水解油脂的潜力较大[10,15-16],命名为NY-201801。用紫外吸收测定油脂降解率的方法进行复筛,测得NY-201801菌株对5%油脂的水解率能达到50%以上,进一步证实该菌的确具有降解油脂的能力。
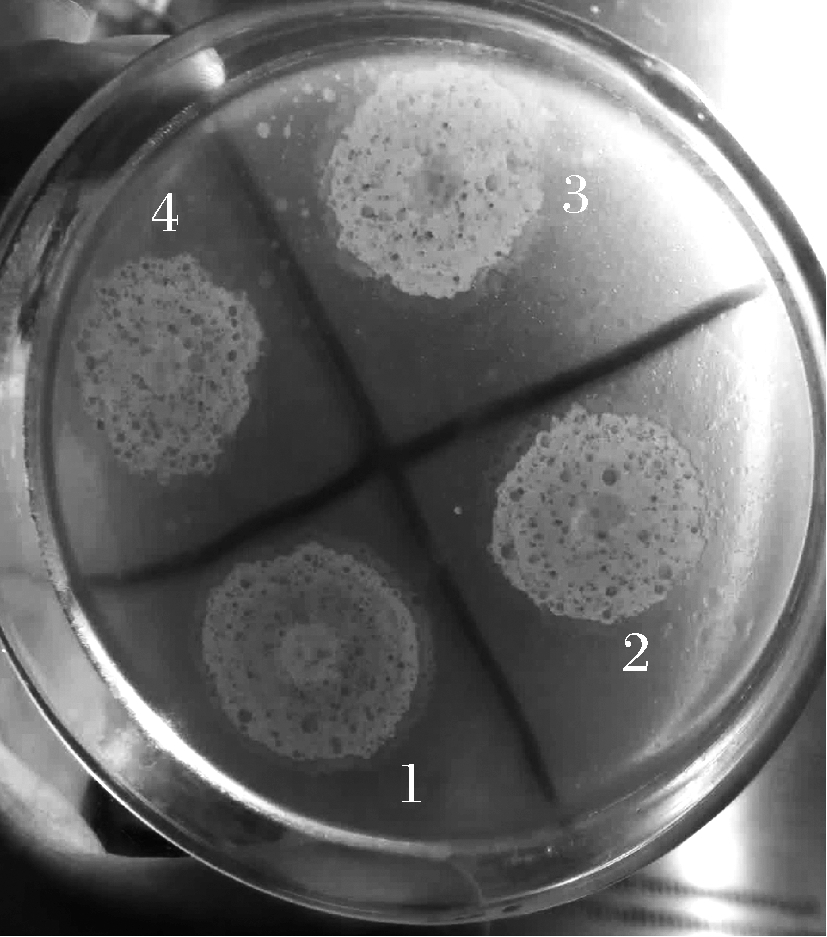
图1 生活油脂降解菌的平板分离
Fig.1 Plate isolation of degrading household lipid
2.2 菌种鉴定
2.2.1 形态特征及生理生化鉴定
NY-201801菌株为革兰氏阴性菌,杆状,菌落呈圆形,菌落表面在基础培养基上迁徙生长。生理生化试验结果如表1所示。
表1 NY-201801菌株的生理生化特性
Table 1 Physiological and biochemical characteristics of NY-201801

特征NY-201801特征NY-201801从葡萄糖产气+产硫化氢+尿素酶活性+β-半乳糖苷酶活性-硝酸盐还原+β-葡萄糖苷酶活性-苯丙氨酸脱氨+吲哚产生-氧化酶活性-明胶+
注:“+”表示具备此特征;“-”表示不具备此特征。
结果表明该菌株具有尿素酶活性,没有β-半乳糖苷酶和β-葡萄糖苷酶活性,能够分解含硫有机物生成,其生理生化特性与孟静等[10]报道的变形杆菌较为类似。利用高分辨率场发射扫描电镜对NY-201801菌株进行电镜分析,结果如图2所示。菌体长度约1 μm、直径约0.4 μm,鞭毛少且短。

图2 NY-201801菌株的场发射扫描电镜照片
Fig.2 Field emission scanning electron microscope photograph of NY-201801
2.2.2 16 S rDNA测序鉴定
NY201801菌株经过16S rDNA测序(Accession No.:MK392127),将序列在NCBI中进行BLAST分析,用ClustX 2.0和Mega 6.0软件绘制菌株NY-201801系统发育树,如图3所示。结果表明菌株NY-201801与Proteus mirabilis strain FC2969相似度达到99.9%,结合形态学和生理生化特征,可以初步鉴定为NY-201801菌株为Proteus mirabilis [10]。

图3 菌株NY-201801系统发育树
Fig.3 The phylogenetic tree of strain NY-201801
2.3 油脂含量与OD205的相关性
为了考察油脂含量与OD205的线性关系,本研究分别测定了0.5%、1%、1.5%、2%、2.5%、4%和5%大豆油在205 nm下的紫外吸收值。利用Origin 9进行线性拟合,曲线如图4所示。

图4 油脂含量与OD205的相关性
Fig.4 The correlation between oil content and OD205
结果显示,相关系数达到0.999 8,表明在油脂浓度为0.5%~5%,油脂浓度与OD205成良好的线性相关,利用紫外吸收法能够准确地测定油脂的浓度。
2.4 pH值对油脂降解率的影响
为了考察Proteus mirabilis NY-201801菌株对丹江口库区水体pH的适应能力,本研究首先研究了不同pH值对油脂降解率的影响,结果如图5所示。结果显示,该菌株在库区水体pH值范围内[14],对油脂的降解率均能达到90%以上,显著高于前人报道的水平[3,17]。同时,该菌株对库区水体pH值具有良好的适应能力,也意味着它在降解库区生活油脂方面具有更大的应用潜力。在低pH值下,Proteus mirabilis NY-201801对油脂的降解率较低,可能原因为该菌产生的脂肪酶的最适pH值偏碱性,在低pH值下不利于脂肪酶发挥水解作用。而且油脂的水解本身也是一个产酸的过程,故较高的初始pH值更利于反应的进行。

图5 pH对降解率的影响
Fig.5 The effect of pH on degradation rate
2.5 时间对油脂降解率的影响
为了考察Proteus mirabilis NY-201801对油脂的降解效率,研究了不同反应时间下的油脂降解率,结果如图6所示。前6 h处在菌体生长和脂肪酶的积累时期,油脂降解率增加的趋势较缓,随着时间的延长,油脂降解率逐渐提升,到36 h时降解率达到95%。与前人的研究相比,在相同的菌种添加量、初始油脂浓度及作用时间等条件下,Proteus mirabilis NY-201801对油脂的降解率明显占优势[9-10],也表明它具有更大的应用前景。
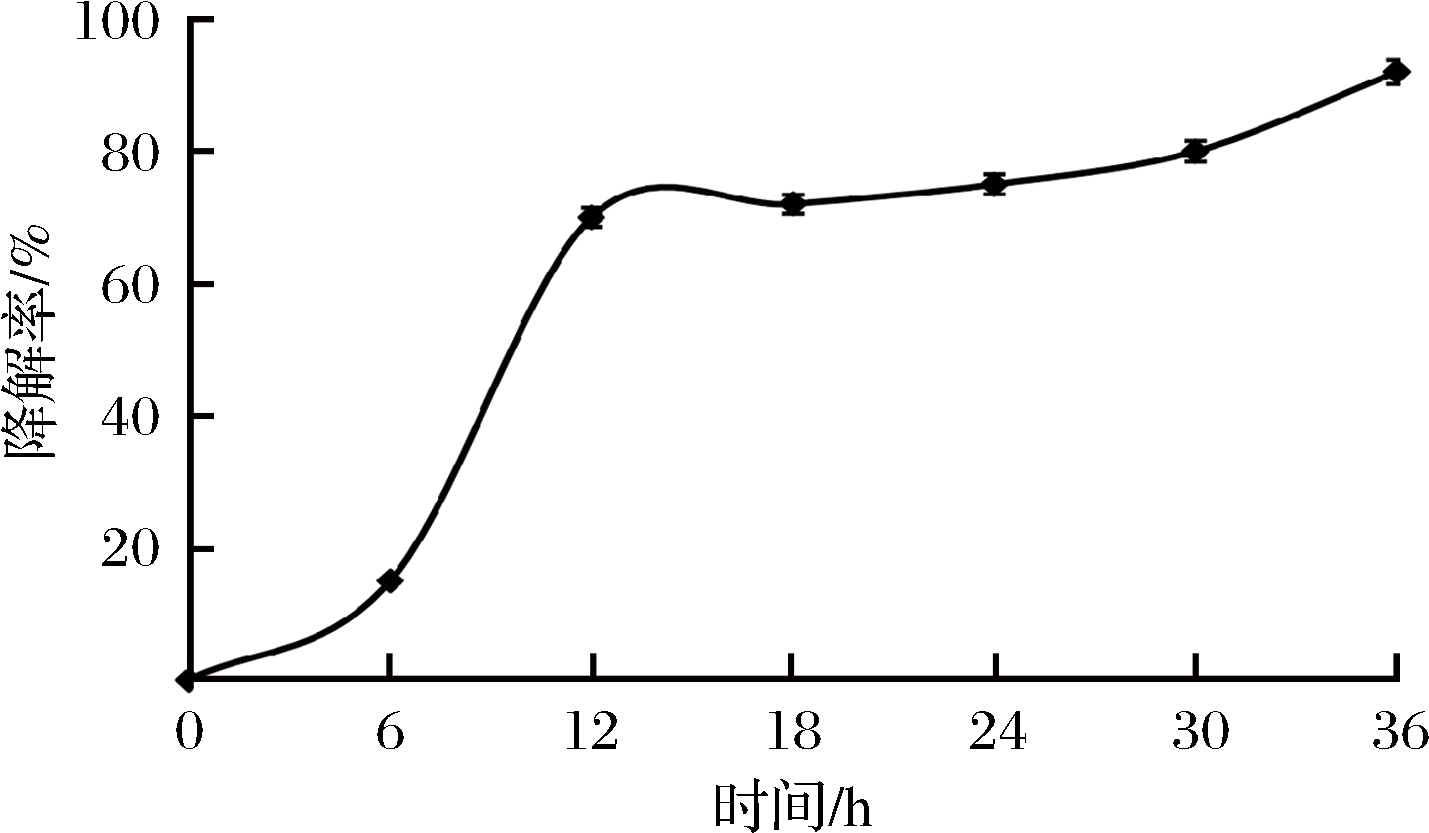
图6 时间对降解率的影响
Fig.6 The effect of time on degradation rate
2.6 温度对油脂降解率的影响
为了考察Proteus mirabilis NY-201801菌株对丹江口库区水体水温的适应能力,本研究考察了不同温度对油脂降解率的影响,结果如图7所示。在库区水体温度6~27 ℃,温度越高,油脂的降解率也越高。这归因于温度能够正调节微生物的生长速率、脂肪酶的活性,以及油脂在水中的溶解度及扩散能力。在菌体合适的生长温度(35 ℃)下,降解率可以高达92%;在夏季平均水温(25 ℃)下,Proteus mirabilis NY-201801对油脂的降解率可以达到50%以上;在10 ℃时,还有一定的降解能力;温度低于最低水温(5 ℃)时,对油脂几乎没有降解能力。进一步表明,来源于丹江口库区的土著微生物Proteus mirabilis NY-201801对库区的环境具有良好的适应能力,在处理库区生活废弃油脂时较其他微生物更具优势。
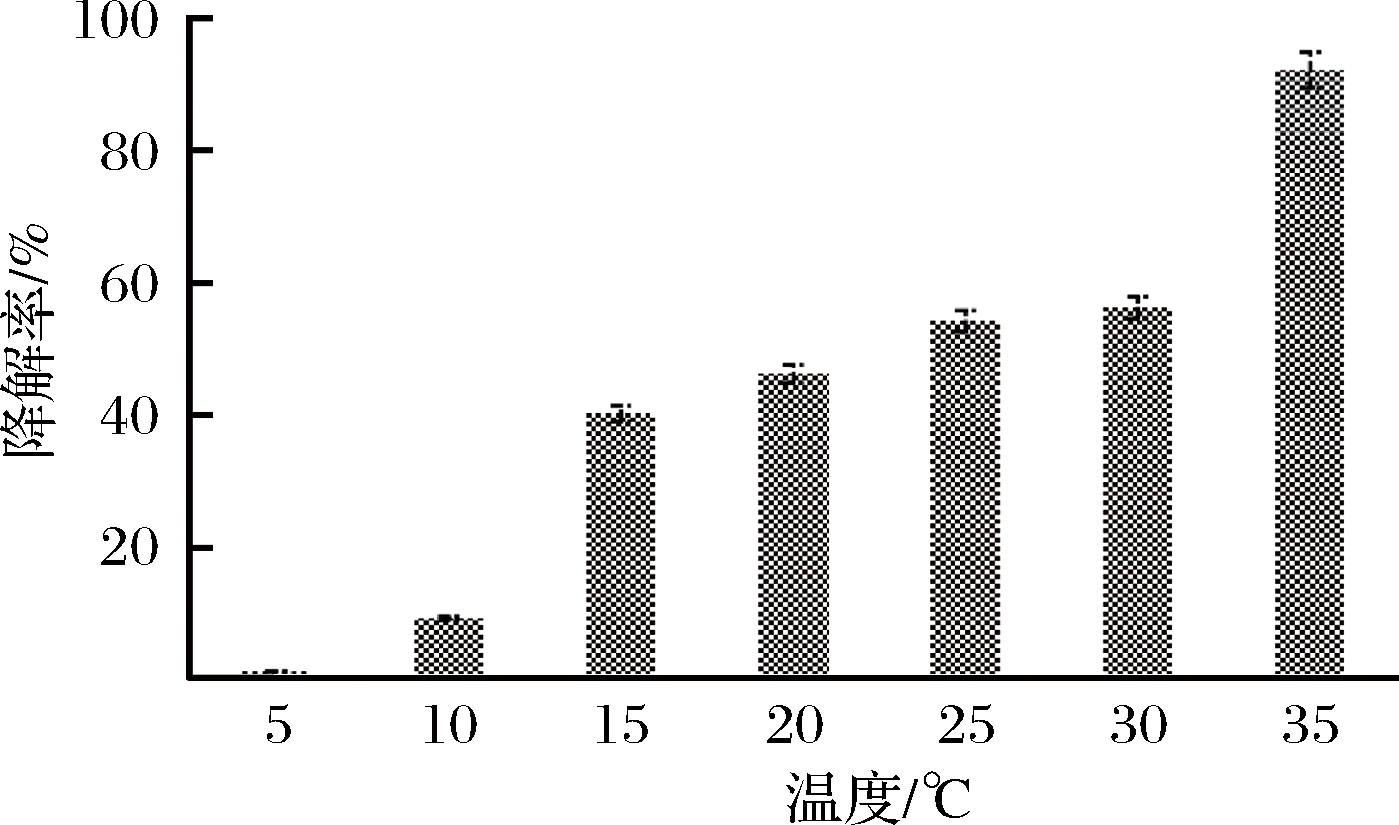
图7 温度对降解率的影响
Fig.7 The effect of temperature on degradation rate
2.7 Proteus mirabilis NY-201801对其他油脂的降解
为了进一步考察Proteus mirabilis NY-201801菌株的应用潜力,围绕丹江口库区居民日常生活油脂的使用特点,本研究继续考察了Proteus mirabilis NY-201801菌株对菜籽油和花生油的降解效果,菌种接种量10%,pH值为7.0,在35 ℃、150 r/min下培养36 h,降解率随时间的变化如图8所示。结果显示,在培养初期,Proteus mirabilis NY-201801菌株对花生油和菜籽油的降解较快,可能归因于Proteus mirabilis NY-201801菌株中水解花生油和菜籽油的脂肪酶水平较高,在初期降解花生油和菜籽油的效果较好。12 h后,Proteus mirabilis NY-201801菌株对大豆油的降解率有显著提高,可能归因于这一段时间内偏爱大豆油的脂肪酶得以大量表达,表现出了对大豆油更强的降解能力。当培养至36 h,Proteus mirabilis NY-201801菌株对3种供试油脂均有较好的降解效果,降解效果最好的大豆油的降解率可达90%以上,效果最差的花生油的降解率也接近70%,表明Proteus mirabilis NY-201801菌株具有较好的油脂种类的普适性,具有较大的应用潜力。
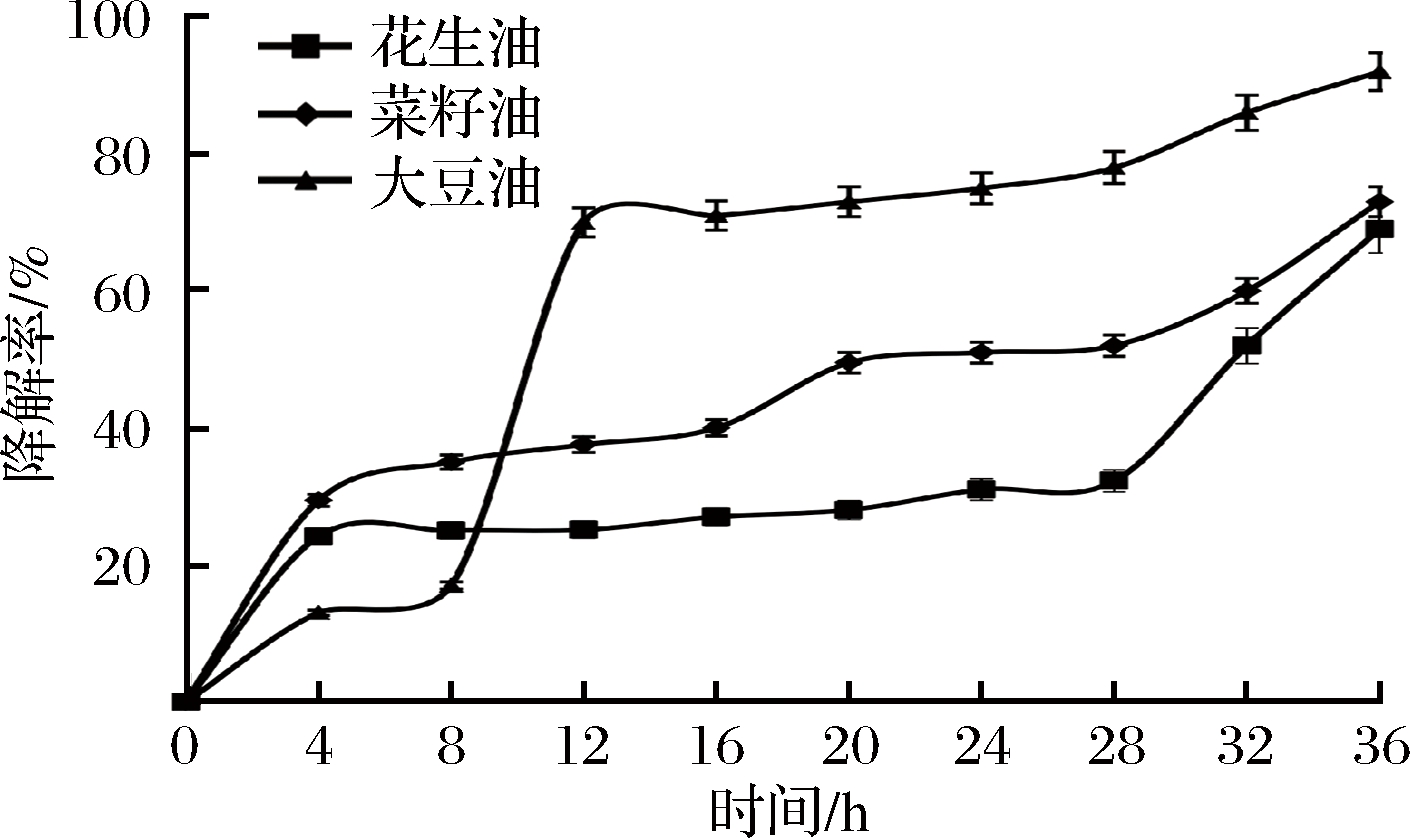
图8 Proteus mirabilis NY-201801对不同油脂的降解效率
Fig.8 The degradation efficiency of Proteus mirabilis NY-201801 for different oils
3 讨论
随着生活水平和饮食结构的改变,人们对油脂的消耗量日益增长,过多的生活废弃油脂进入水系,会降低水系的自净能力、破坏水生生态系统[5]。在南水北调中线工程干渠通水以后,进入库区参观的游客日益增多,显著增加了库区餐厨垃圾的排放,增加了水体自净的压力。生活油脂大多为长链的甘油三脂,油脂的生物降解主要依赖于微生物产生的脂肪酶来逐渐水解成短链的脂肪酸和甘油[15]。筛选高效的油脂降解菌对生活油脂进行回收和利用,已成为许多科研工作者所关注的焦点[10,18-19]。
土著微生物对当地环境具有更好的适应性,在环境治理和生态修复方面也具有更大的优势和应用潜力[20-21]。本研究利用大豆油为目标底物对库区紫气河水中的微生物进行驯化,然后利用中性红油脂平板筛选出了一株具有较强油脂降解能力的土著微生物NY-201801,油脂降解能力明显优于已报道的微生物[6,18-19]。同时该菌也具有巨大的挖掘高活性脂肪酶的潜力,有待下一步深入研究。经生理生化和分子鉴定,NY-201801与Proteus mirabilis的相似性最高[10],16S rDNA的序列同源性高达99.9%,故将其命名为Proteus mirabilis NY-201801。
此外,考察了pH值对Proteus mirabilis NY-201801降解油脂效率的影响,结果显示该菌株对库区水体pH值良好适应能力,在库区水体pH值范围内对油脂均具有较高的降解率,也意味着它在降解库区生活油脂方面具有更大的应用潜力,进一步体现了土著微生物在治理当地环境中的优势。同时,考察了温度对油脂降解率的影响,Proteus mirabilis NY-201801对环境温度的适应性较广,在15 ℃下反应36 h仍能达到40%的降解率,能够适应库区大部分时间的水温,较其他已报道的菌株更具应用优势。但该菌株在5 ℃对油脂几乎没有降解能力,也有可能是低温下菌株不能良好的生长,也有可能是产生的脂肪酶在低温下活性极低,有待下一步的验证和改造。
4 结论
本研究针对丹江口库区生活油脂的特点,对紫气河流域的油脂降解微生物进行了驯化、筛选和鉴定,并对油脂降解的条件进行了初步优化,得出了如下结论:
(1)从丹江口库区紫气河流域筛选到了一株能够高效水解大豆油的微生物,编号为NY-201801,经鉴定该菌株的生理生化特征及16S rDNA序列与奇异变形杆菌Proteus mirabilis最为接近,故将其命名为Proteus mirabilis NY-201801。
(2)Proteus mirabilis NY-201801具有较强的油脂降解能力,5%油脂初始浓度,菌种接种量10%,pH值为7.0,在35 ℃、150 r/min下培养36 h,油脂降解率可以达到92%。
(3)Proteus mirabilis NY-201801能够较好地适应丹江口库区水体的pH值和温度等条件,具有较好的环境适应性,在库区最高水温的条件下,对5%油脂的降解率可以达到50%,同时Proteus mirabilis NY-201801对菜籽油及花生油也具有较好的降解效果,具有较大的应用前景。
[1] NICKLISCH S C T,REES S D,MCGRATH A P,et al.Global marine pollutants inhibit P-glycoprotein:Environmental levels,inhibitory effects,and cocrystal structure [J].Science Advances,2016,2:e1600001.
[2] BOAMAH K B,DU J,BOAMAH A J,et al.A study on the causal effect of urban population growth and international trade on environmental pollution:evidence from China [J].Environmental Science and Pollution Research,2018,25(6):5 862-5 874.
[3] 金建云,李芳,林开春.高效油脂降解菌的筛选及其降解影响因素的初步研究[J].华中农业大学学报,2006(4):400-403.
[4] WAKELIN N G,FORSTER C F.The aerobic treatment of grease-containing fast food restaurant waste waters [J].Process Safety and Environmental Protection,1998,76(1):55-61.
[5] 游游,朱琳,张艳等.含油废水中一株高效油脂降解菌的筛选和鉴定[J].生态环境学报,2010,19(6):1 378-1 382.
[6] 刘国防.高效油脂降解菌剂构建与效果研究[D].杭州:浙江大学,2012.
[7] BECKER P,KÖSTER D,POPOV M N,et al.The biodegradation of olive oil and the treatment of lipid-rich wool scouring wastewater under aerobic thermophilic conditions [J].Water Research,1999,33(3):653-660.
[8] 薛秀园,薛月圆.油脂降解微生物的筛选及代谢能力影响因素研究[J].洛阳师范学院学报,2016,35(2):47-50.
[9] 闫红梅,王冬梅,高健等.一株高效油脂降解菌的筛选与降解性能研究[J].甘肃农业大学学报,2013,48(4):176-180.
[10] 孟静,王海燕,郭秀锐等.油脂降解菌的筛选鉴定及降解条件优化[A].中国环境科学学会2016年学术年会论文集,2016.
[11] 孙玉君,李丹华.南水北调中线工程水源区水质现状分析[J].人民长江,2016,47(14):15-18.
[12] 强艳芳.丹江口库区产业结构对环境的影响研究[D].杨凌:西北农林科技大学,2018.
[13] 张印,薛永常.油脂降解菌种的鉴定及降解条件优化[J].微生物学杂志,2015,35(2):90-94.
[14] 谭浩强,何文杰,韩宏大等.丹江口水库水质监测分析[J].供水技术,2015,9(6):1-5.
[15] 肖翰,刘标,尹红梅等.病死猪堆肥高效油脂降解菌的筛选及堆肥效果研究[J].浙江农业学报,2017,29(1):44-50.
[16] 秦华明.高效油脂降解菌的筛选及其对油脂废水的强化处理研究[D].广州:华南理工大学,2003.
[17] 徐保成,李道棠.洋葱伯克霍尔德氏菌降解高浓度油脂废水的工艺研究[A].中国生态学会2006学术年会论文集,2006.
[18] 张晓杰,白义,郑昆.高效油脂降解菌的筛选及其降解特性研究[C].//吉林省科学技术协会学会学术部.创新驱动,加快战略性新兴产业发展——吉林省第七届科学技术学术年会论文集,长春,2012:3.
[19] 陈红艳,王继华,赵霞,等.低温高效植物油脂降解菌的筛选与特性[J].环境科学研究,2009,22(12):1 466-1 471.
[20] 李晨阳.土著微生物介导的CO2咸水层封存过程的生物地球化学行为研究[D].长春:吉林大学,2017.
[21] 董姗姗.基于土著微生物的地下水TCE/NO3 N混合污染修复技术研究[D].北京:中国地质大学(北京),2018.