豇豆(Vigna sinensis)又被称为豆角,因其含有丰富的营养成分:叶绿素(160 mg/kg)、VC(190 mg/kg)、有机酸(0.2%)、蛋白质(1.5%)、可溶性固形物(10.15%),被称作“蔬菜中的肉类”[1]。但由于豇豆呼吸强度大于普通蔬菜,采收后如果不及时处理很容易萎蔫、褪色、腐烂,因此鲜豇豆采摘后需及时处理以减少损耗[2]。
泡菜是一种历史悠久、营养丰富的乳酸发酵蔬菜制品,其有机酸含量的变化既是评价发酵工艺的重要指标,也是泡菜生产过程中重要的质量管理指标[3]。食品中广泛存在的有机酸大多为低分子羧酸,除乙酸、乳酸、丁二酸、柠檬酸、酒石酸、苹果酸外,还有少量的富马酸、马来酸、甲酸、草酸等[4-5]。这些有机酸既为食品提供特殊的风味,也作为酸性物质调节溶液pH使亚硝酸盐发生降解[6]。目前有机酸的研究多集中在水果[7-9],对于蔬菜中有机酸的研究甚少;且基本也只对泡菜原料中的有机酸进行研究,而对泡菜发酵液中有机酸的报道较为罕见;鲜有的几篇也仅列出不同发酵天数有机酸的含量变化数据,并未对现象进行解释,更未对其中的原理进行探讨[10-12]。因此明确泡菜发酵过程中原料及发酵液中有机酸种类、含量变化及其对亚硝酸盐的降解作用,为泡菜研究提供新的方向。
本试验以新鲜豇豆为原料,试图探索泡豇豆发酵过程中蔬菜组织和发酵液中有机酸的种类及含量变化,并比较各有机酸降解亚硝酸盐能力大小,以期为阐明泡菜中亚硝酸盐降解机理和生产控制提供理论基础。
1 材料与方法
1.1 材料及试剂
豇豆、食盐、玻璃坛,均购于重庆市农贸市场。
有机酸(草酸、酒石酸、苹果酸、醋酸、乳酸、柠檬酸、琥珀酸、富马酸)、NH4H2PO3、H3PO4、甲醇,均为色谱纯;亚硝酸盐、NaOH、(NH4)2SO4、对氨基苯磺酸、盐酸萘乙二胺,均为分析纯,成都科龙化工试剂厂。
1.2 主要仪器及设备
PB-10酸度计,赛多利斯科学仪器(北京)有限公司;UV-1000紫外可见分光光度计,上海大美科学仪器有限公司;5810台式高速离心机,德国Eppendorf公司;FM200高速分散机,上海弗鲁克流体机械制造有限公司;LC-20A高效液相色谱仪,日本岛津公司。
1.3 方法
1.3.1 泡菜腌制方法
豇豆→清洗→切分→装坛→按1∶1加入8%食盐水→用水密封→22 ℃恒温发酵
每24 h取一坛进行分析,每个样品试验3次。
1.3.2 亚硝酸盐测定
经预实验测定,豇豆原料中硝酸盐含量为426.11 mg/kg。亚硝酸含量测定参照GB 5009.33—2016[13],采用分光光度法。吸光值y与亚硝酸盐含量x的方程为:y=0.014 3x-0.001 8,R2=0.998 8。
1.3.3 泡菜中有机酸测定
(1)标样配制
根据预试验将草酸、酒石酸、苹果酸、醋酸、乳酸、柠檬酸、琥珀酸、富马酸8种有机酸分别配制成5种不同浓度,制成混标。
(2)样品处理
豇豆按1∶1加超纯水,制备成匀浆。分别称取5.00 g匀浆,加入15 mL 80%乙醇-水溶液,75 ℃水浴0.5 h,冷却至室温,转移至25 mL容量瓶中,超纯水定容至刻度,过滤,滤液于9 000 r/min,离心30 min,上清液用氮吹仪浓缩至1.00 mL,用0.45 μm水系滤膜针头过滤器过滤浓缩液,将滤液上机检测[14]。发酵液直接取原液过0.45 μm水系滤膜,滤液上机检测。
(3)测定条件
色谱柱:C18柱(Welch Materials),250 mm×4.6 mm,5 μm。流动相:3% CH3OH,0.1mol/L KH2PO3,pH 2.8,临用前超声波脱气30 min。流速0.8 mL/min,进样量20 μL,紫外检测波长210 nm,柱温28 ℃。
(4)样品定性与定量
在上述测定条件下,对比样品测定图谱与混标测定图谱,通过保留时间进行定性分析。通过不同浓度的标准对照品所对应的峰面积制作标准曲线,用外标法进行定量分析。
(5)结果计算如公式(1)
(1)
式中:X,样品中有机酸含量,mg/(100 g);c,由标准曲线求得有机酸的浓度,μg/mL;V1,样品最后定容体积,mL;V,提取液总体积,mL;V2,样品进样体积,mL;m,样品质量,g。
1.3.4 不同有机酸降解亚硝酸能力
分别取20.00 mg草酸、酒石酸、苹果酸、乳酸、乙酸、柠檬酸、琥珀酸,加至40 mL,50μg/mL亚硝酸盐溶液中。30 ℃水浴,每12 h取1 mL于25 mL比色管中,测定亚硝酸盐含量。并按公式(2)计算亚硝酸盐降解率。
(2)
式中:Y,亚硝酸盐降解率,%;m0,未加有机酸时亚硝酸盐含量,μg;m,加入有机酸时亚硝酸盐含量,μg。
1.3.5 数据统计与分析
试验所得数据均为3次试验的平均值,采用Excel和Origin 9.0进行处理。
2 结果分析
2.1 蔬菜腌制过程中亚硝酸盐的变化
如图1所示,原料中亚硝酸盐含量为1.79 mg/kg,随着发酵的进行,蔬菜组织和发酵液中亚硝酸盐含量均呈先升高后下降的趋势,3 d后出现“亚硝峰”,亚硝酸盐含量分别为27.44 mg/kg和28.92 mg/kg,随后迅速下降,7 d后蔬菜组织和发酵液中亚硝酸盐含量降至较低水平,分别为1.50 mg/kg和1.67 mg/kg,达到绿色食品标准(<4 mg/kg)。
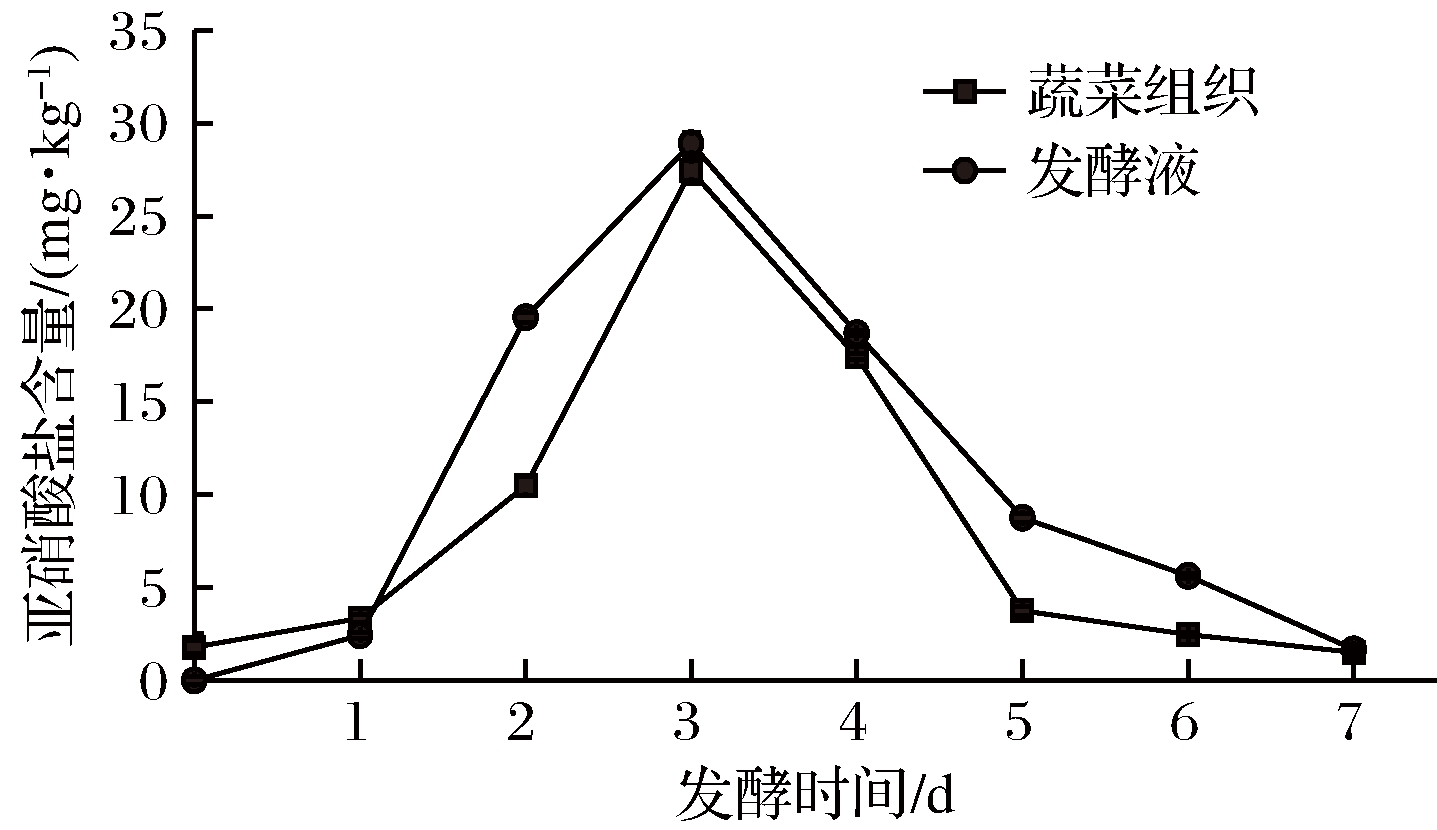
图1 蔬菜发酵过程中亚硝酸盐含量变化
Fig.1 Changes of the nitrite contents in vegetables and brine during the fermentation
2.2 有机酸标准图谱和样品图谱
由图2可以看出,采用此方法能较好地分离8种有机酸,且在15 min左右时全部有机酸被洗脱出来。
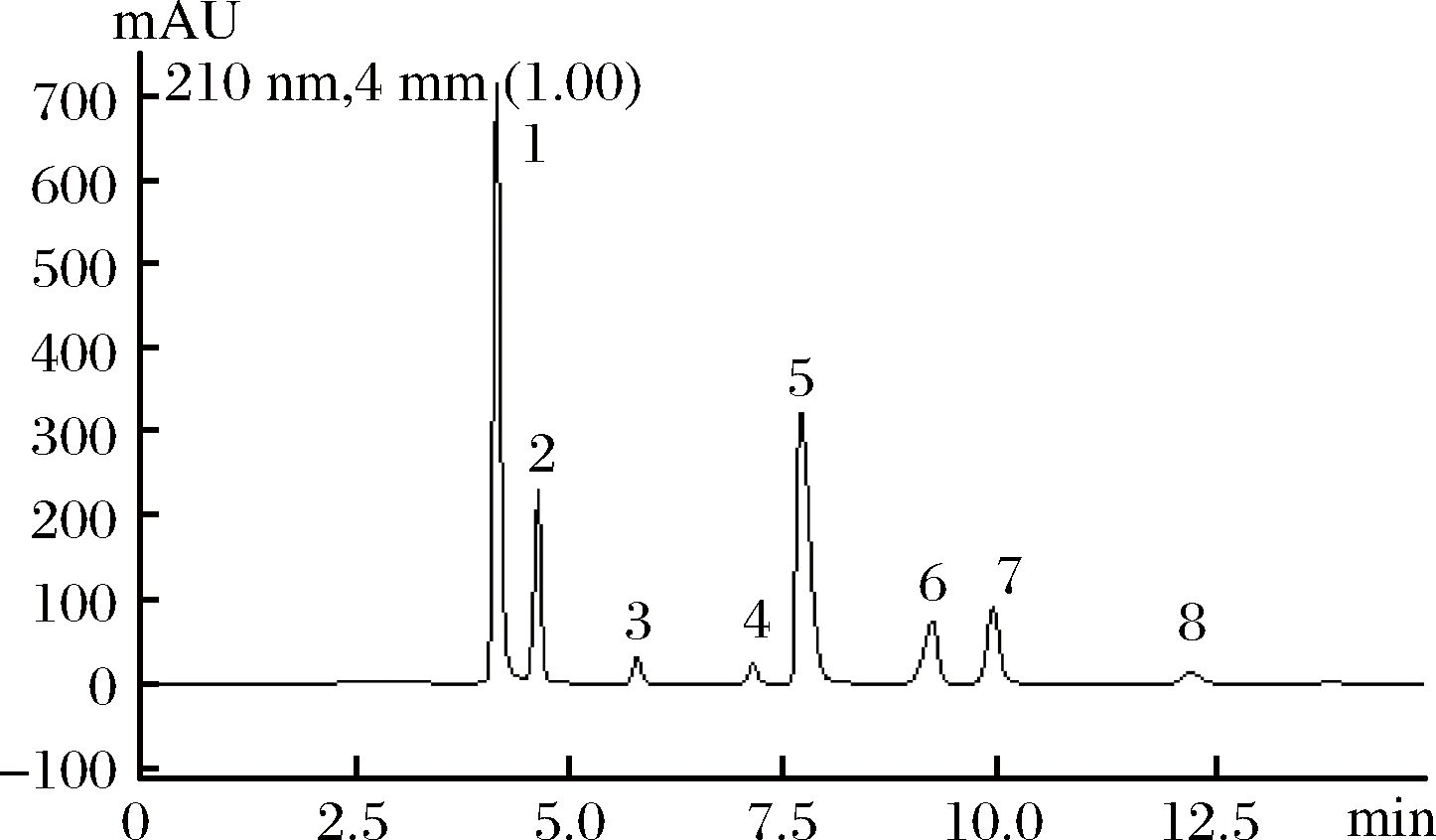
图2 有机酸标准样品色谱图
Fig.2 Chromatogram of a mixture of eight organic acids standards
注:1-草酸;2-酒石酸;3-苹果酸;4-乳酸;5-乙酸;6-柠檬酸;7-富马酸;8-琥珀酸,下同。
由图3可知发酵2 d后在蔬菜组织和发酵液中均检测出8种有机酸,分别是草酸、酒石酸、苹果酸、乳酸、乙酸、柠檬酸、富马酸、琥珀酸。发酵7 d后在蔬菜组织中检出6种有机酸,草酸和富马酸未检出;发酵液中也检出6种有机酸,富马酸和琥珀酸未检出(见图4)。可见,蔬菜组织和发酵液中有机酸种类及含量随发酵时间有明显的变化。

a-蔬菜组织组;b-发酵液组
图3 发酵2d蔬菜组织中和发酵液中有机酸色谱图
Fig.3 Chromatogram of organic acids in vegetables and brine at the 2rd day
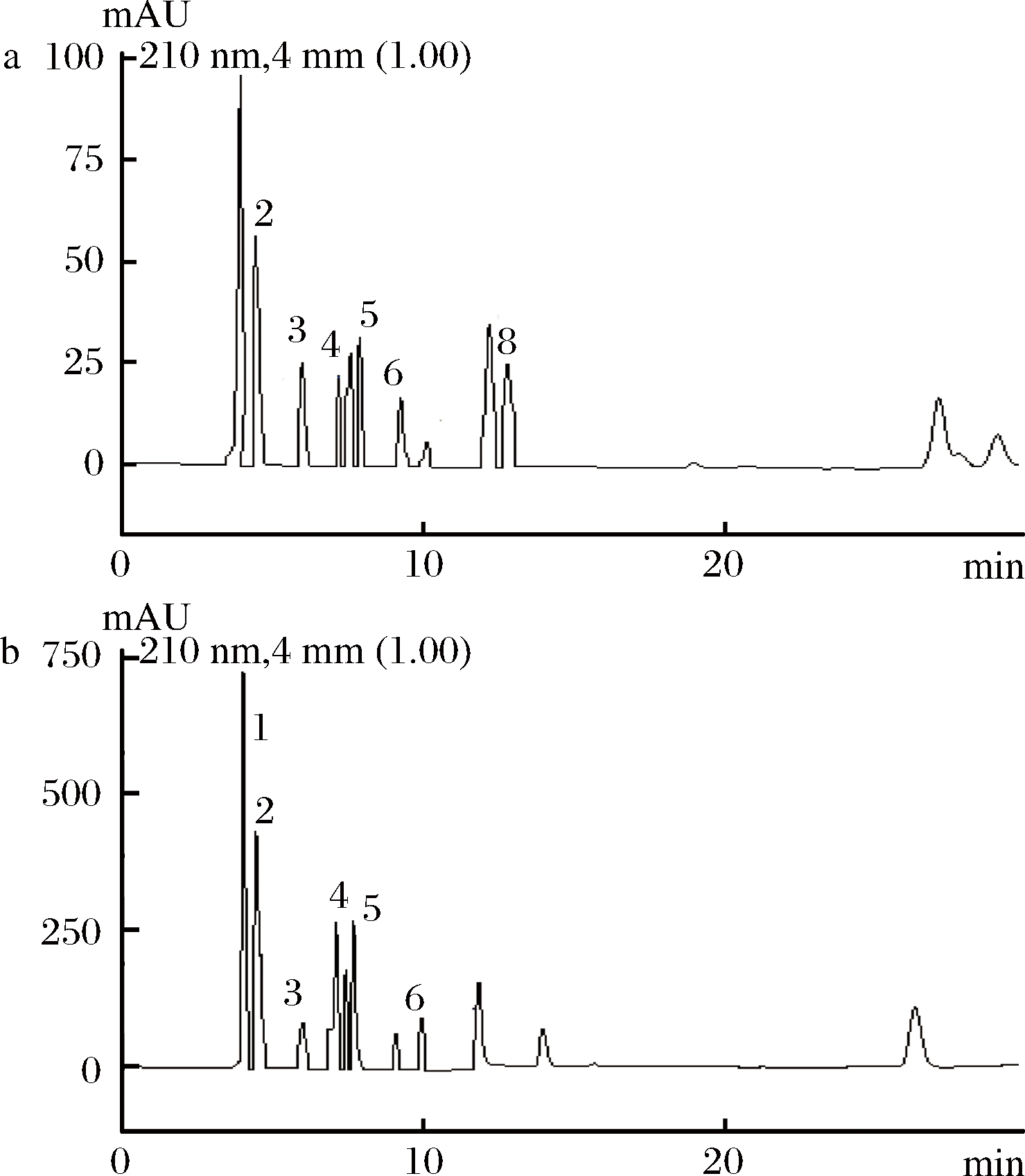
a-蔬菜组织组;b-发酵液组
图4 发酵7d蔬菜组织和发酵液中有机酸色谱图
Fig.4 Chromatogram of organic acids in vegetables and brine at the 7th day
2.3 发酵过程中有机酸含量变化
2.3.1 发酵过程中草酸含量变化
从泡菜发酵过程中草酸含量变化(图5)来看,新鲜豇豆中草酸含量为225.88 mg/(100 g),随着发酵时间的延长,蔬菜组织中草酸含量总体呈显著降低趋势(P<0.01),到发酵第5天时未被检出。原因可能是草酸与醇类物质反应生成酯类物质,或被微生物利用生成其他物质[15],以及计入发酵液中导致其含量降低。而发酵液中草酸含量随着发酵的进行先升高后降低(P<0.05),在发酵第7天,草酸含量降至29.32 mg/(100 g)。豇豆经过微生物发酵作用可显著降低草酸含量,提高其营养价值。

图5 发酵过程中草酸含量变化
Fig.5 Changes of oxalic acid in vegetables and brine during fermentation
2.3.2 发酵过程中酒石酸含量变化
原料中酒石酸含量为76.92 mg/(100 g),随着发酵过程的进行,蔬菜组织中酒石酸含量发酵1 d后显著降低(P<0.05),再升高,发酵第3天酒石酸含量最高,为97.93 mg/(100 g),而发酵7 d后降至49.69 mg/(100 g)(图6)。发酵液中酒石酸含量变化呈升高后降低的趋势(P<0.05),发酵4 d后酒石酸含量最高,为83.71 mg/kg,发酵7 d后降至45.43 mg/(100 g)。
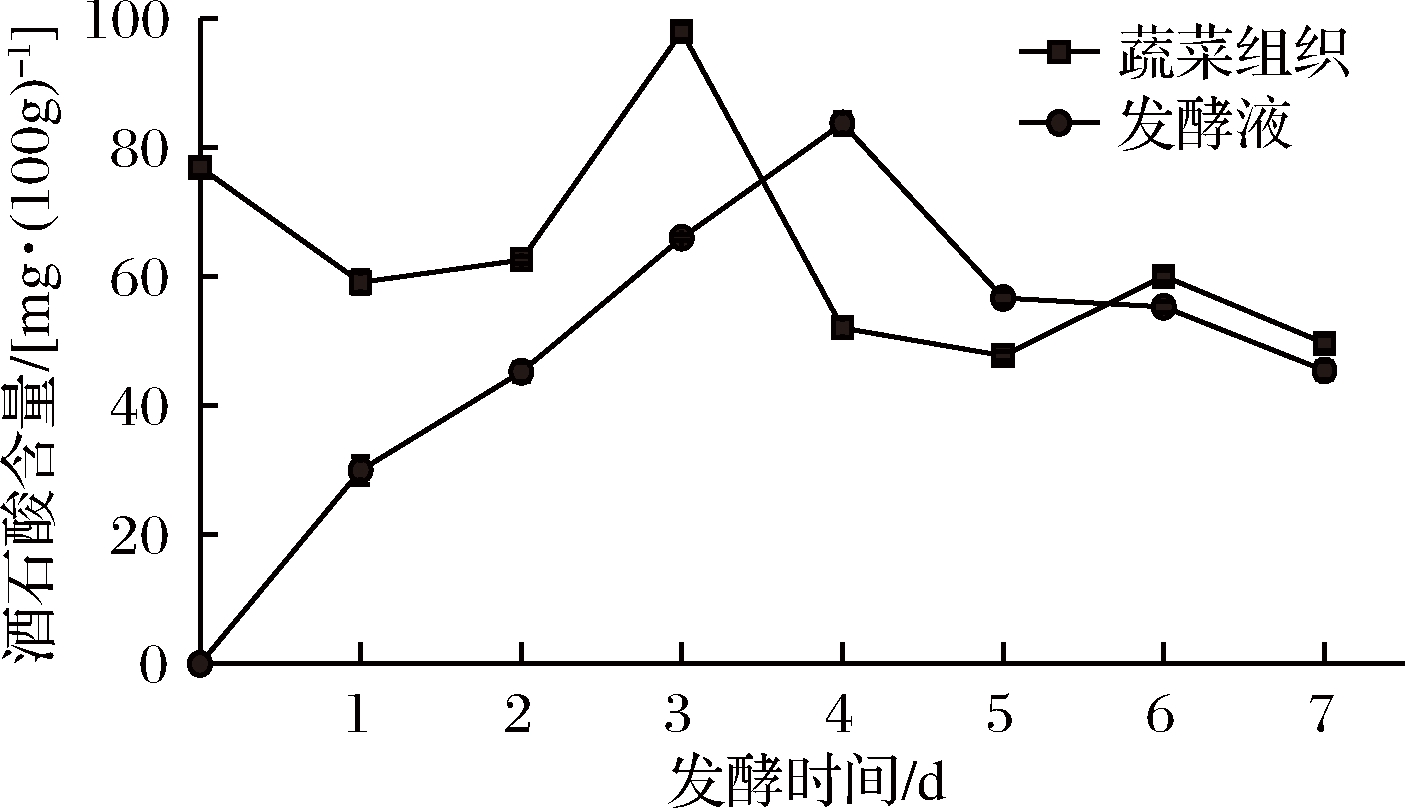
图6 发酵过程中酒石酸含量变化
Fig.6 Changes of tartaric acid in vegetables and brine during fermentation
2.3.3 发酵过程中苹果酸含量变化
在泡菜中苹果酸含量相对较高,使得泡菜的口感令人愉悦。如图7所示,在整个发酵过程中,蔬菜组织和发酵液中苹果酸含量显著升高(P<0.05),新鲜蔬菜中苹果酸含量为28.78 mg/(100 g),发酵7 d后为328.88 mg/(100 g)。发酵液中苹果酸在发酵2 d后开始被检出,然后显著升高(P<0.05),发酵5 d后,苹果酸含量变化趋势不明显,发酵7 d后,含量为195.38 mg/(100 g)。蔬菜组织中的苹果酸含量在整个发酵过程中较发酵液中高。

图7 发酵过程中苹果酸含量变化
Fig.7 Changes ofmalic acid in vegetables and brine during fermentation
2.3.4 发酵过程中乳酸含量变化
从泡菜发酵过程中蔬菜组织和发酵液中乳酸含量变化(图8)来看,原料中乳酸含量较低,为3.61 mg/(100 g),随着发酵的进行蔬菜组织中乳酸含量呈曲折上升趋势。蔬菜经发酵,乳酸含量提高8倍多。乳酸酸味柔和,有后酸味,提供泡菜柔和的风味[16]。发酵液中乳酸在发酵2 d后开始被检出,呈先升高后降低的变化趋势,发酵6 d后乳酸含量最高,为79.13 mg/(100 g),7 d后降至63.19 mg/(100 g)。原因可能是在发酵的初始阶段,主要进行异型乳酸发酵;而在发酵中期,主要是同型乳酸发酵,该阶段乳酸菌较活跃,此时可积累大量的乳酸;在发酵后熟阶段,酯化反应生成酯类芳香物质,乳酸菌活性降低,乳酸含量降低[17]。

图8 发酵过程中乳酸含量变化
Fig.8 Changes oflactic acid in vegetables and brine during the fermentation
2.3.5 发酵过程中乙酸含量变化
蔬菜发酵过程中,好气性醋酸菌将生成的乙醇在乙醇脱氢酶和氧气的作用下先氧化为乙醛,然后再氧化为醋酸。产生的醋酸具有较强的刺激感,并具有增酸增香特性,促进食欲[18]。原料中乙酸含量较低,为7.93 mg/(100 g)。随着发酵过程的进行,蔬菜组织和发酵液中乙酸含量显著升高(P<0.05,如图9)。蔬菜组织中乙酸发酵第3天增速最快,发酵6 d后,含量保持不变,为364.71 mg/(100 g)。发酵液中乙酸含量升高速率较缓,在发酵6 d后最高,为128.43 mg/(100 g),发酵第7天,乙酸含量下降至107.66 mg/(100 g)。
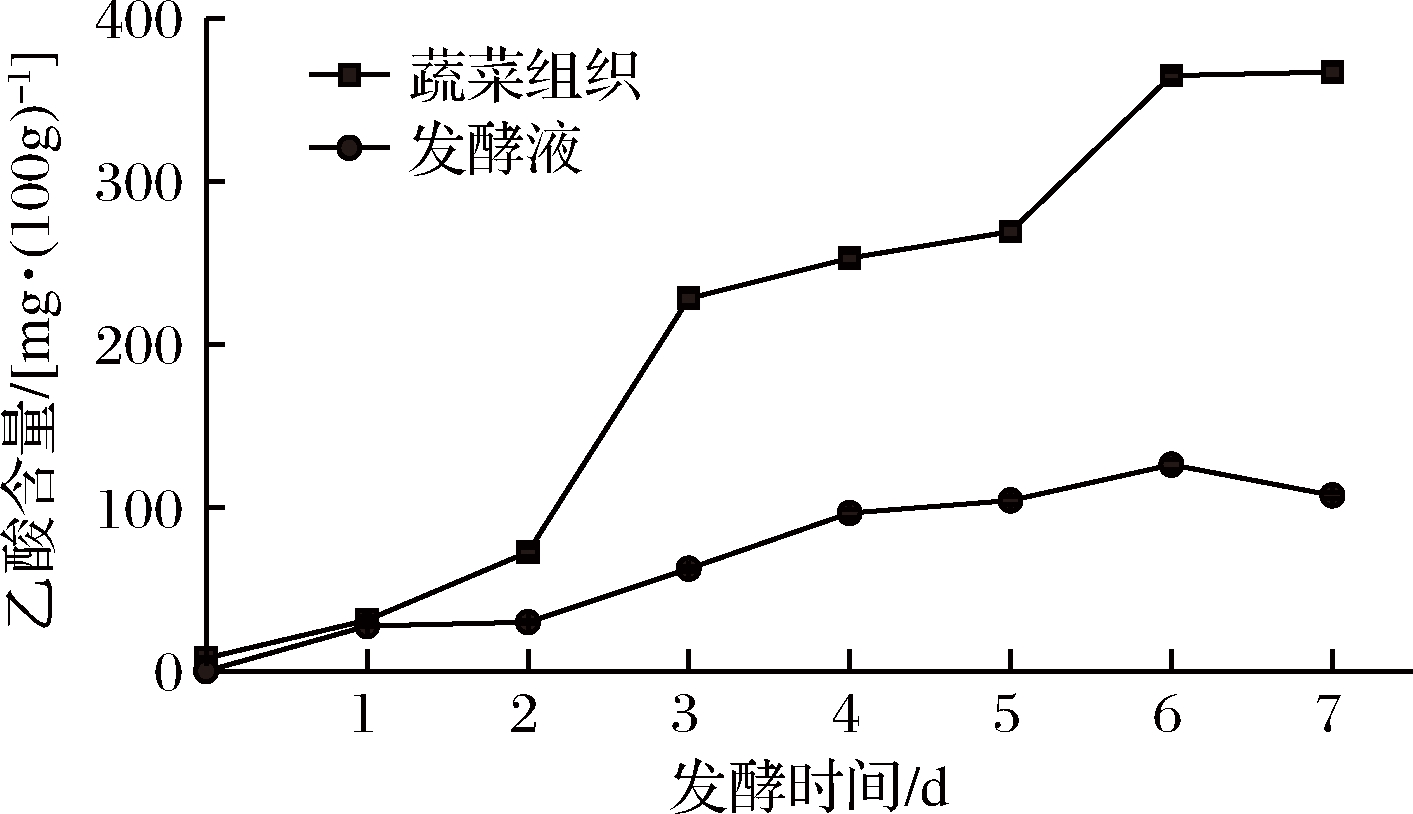
图9 发酵过程中乙酸含量变化
Fig.9 Changes of acetic acid in vegetables and brine during fermentation
2.3.6 发酵过程中柠檬酸含量变化
原料中柠檬酸含量为118.02 mg/(100 g),泡菜发酵过程中蔬菜组织中的柠檬酸含量呈先升高后降低的变化趋势(P<0.05)。在三羧酸循环阶段会积累柠檬酸,随着发酵的继续,部分柠檬酸被代谢,使其含量趋于平衡[19]。发酵4 d含量最高,为743.12 mg/(100 g),7d后降至641.59 mg/(100 g),泡菜经过发酵柠檬酸增加了4.4倍(图10)。发酵液中柠檬酸含量在发酵前4 d增速缓慢,第5天增加较高,最后基本保持不变,最终含量为174.48 mg/(100 g)。
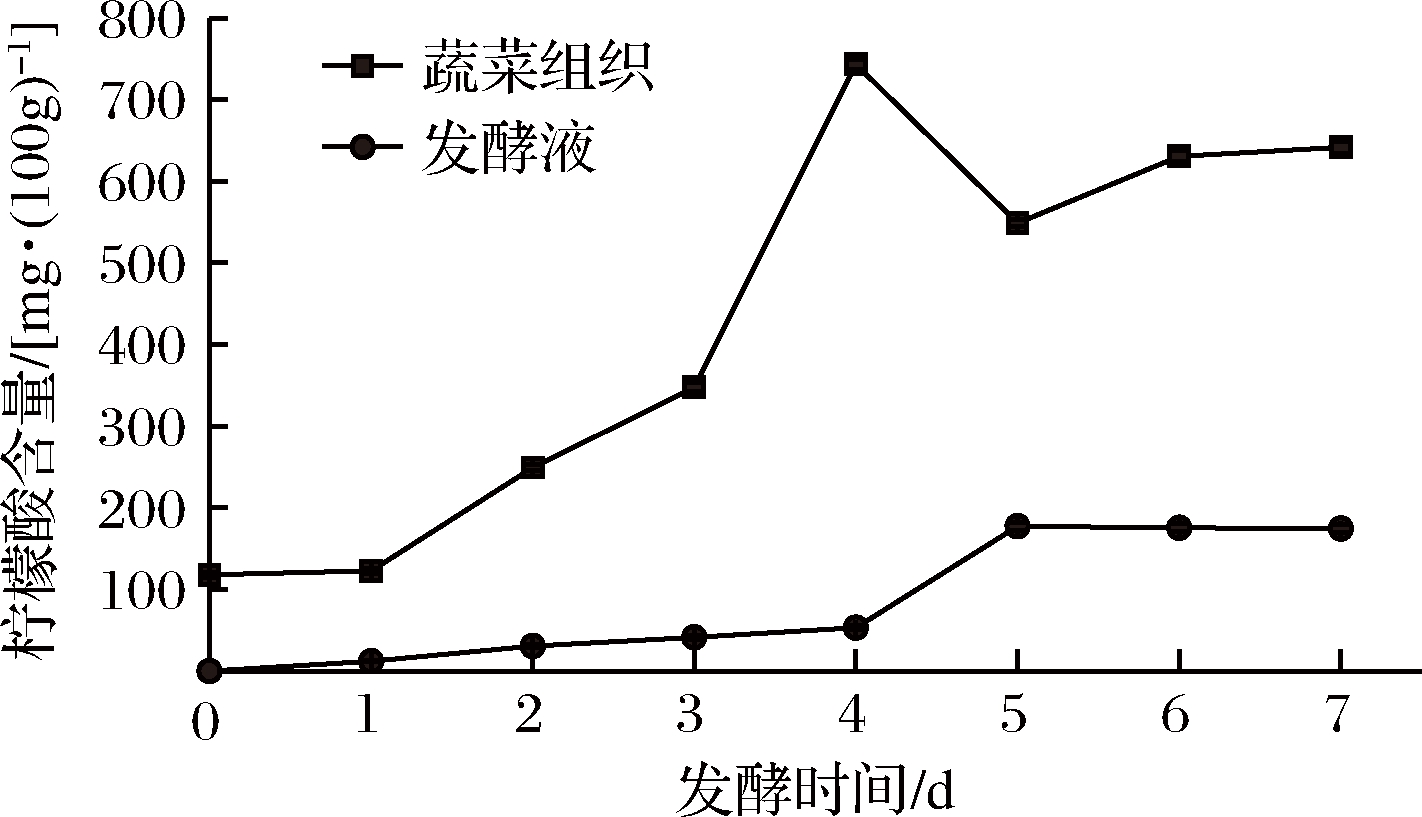
图10 发酵过程中柠檬酸含量变化
Fig.10 Changes ofcitric acidin vegetables and brine during fermentation
2.3.7 发酵过程中富马酸含量变化
蔬菜组织和发酵液中富马酸含量均呈先升高后降低的变化趋势,发酵后期均未检出(如图11),发酵3d后蔬菜组织中富马酸含量最高,为1.27 mg/(100 g)。发酵4 d后发酵液中富马酸含量最高,为1.70 mg/(100 g)。富马酸含量显著下降,可能是被醋酸菌代谢利用或者在发酵的强氧化条件下被氧化降解。

图11 泡菜发酵过程中富马酸含量变化
Fig.11 Changes of fumaric acid in vegetables and brine during the fermentation
2.3.8 发酵过程中琥珀酸含量变化
如图12所示,蔬菜组织中琥珀酸含量随着发酵的进行显著增加(P<0.05),发酵第7天含量为147.75 mg/(100 g),比新鲜蔬菜提高了9倍左右,可能是由微生物代谢引起的。发酵液中琥珀酸含量先升高,至第3天达到最大,为28.44 mg/(100 g),之后下降,发酵第4天及之后未被检出。可能是由于琥珀酸是三羧酸循环的中间产物,参与发酵过程中的微生物代谢,并与亚硝酸盐反应,以及生成微溶性盐等导致其含量下降。
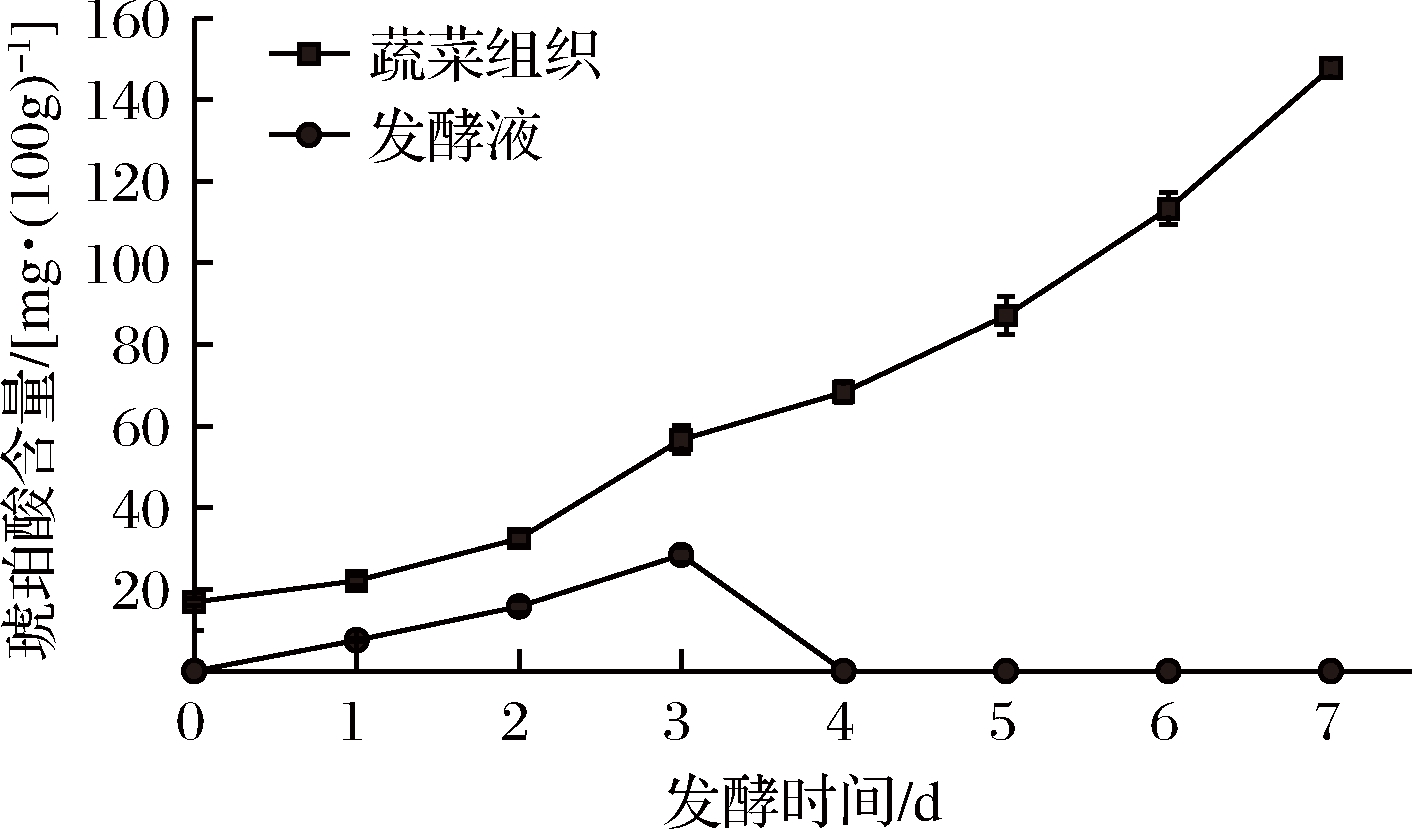
图12 发酵过程中琥珀酸含量变化
Fig.12 Changes of succinic acid in vegetables and brine during the fermentation
2.4 不同有机酸对亚硝酸盐降解能力
如图13所示,反应12 h草酸降解率为89.36%,其次是酒石酸83.33%,苹果酸和柠檬酸差异不大,分别为79.30%、78.22%,富马酸降解能力最弱,降解率为15.48%。反应72 h后,除乙酸、乳酸和富马酸外,其他5种有机酸对亚硝酸盐降解率均达95%以上。各有机酸降解亚硝酸盐能力的大小顺序依次为草酸、酒石酸、苹果酸、柠檬酸、琥珀酸、乙酸、乳酸、富马酸。
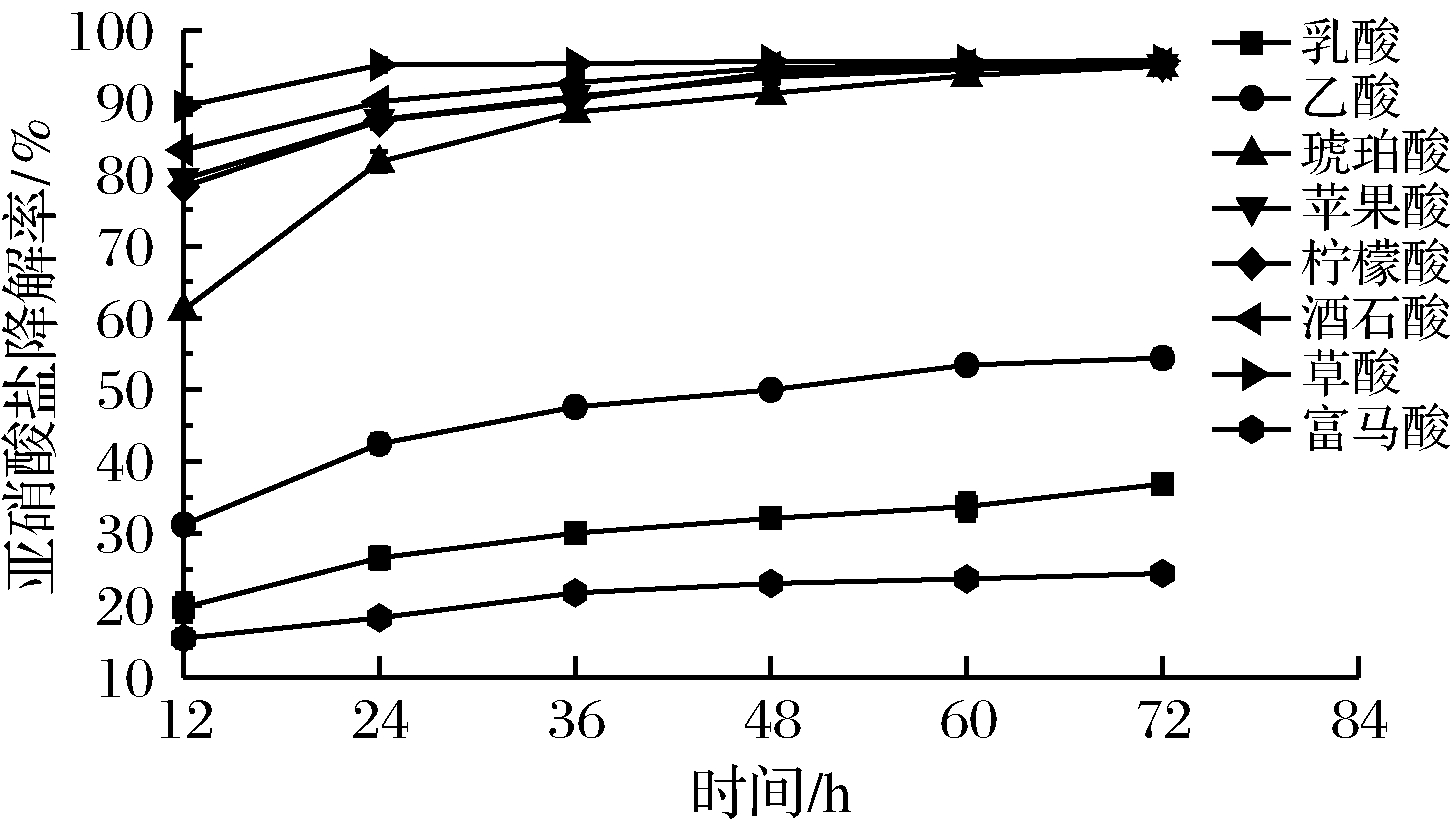
图13 不同有机酸降解亚硝酸盐能力比较
Fig.13 Effect of different organic acids onscavenging rate of nitrite
研究表明,由于亚硝根中氮处于中间价态,在化学反应中既能被氧化又能被还原[14]。在与有机酸的反应中,一方面是由于有机酸具有还原性,如抗坏血酸将亚硝酸盐还原为NO,其自身被氧化成脱氢抗坏血酸,但该反应在pH>4时不会发生[12];另一方面是有机酸可提供酸性环境,亚硝酸盐自身会发生氧化还原反应而被降解:![]() 由此可以推断,亚硝酸盐与上述有机酸反应,一方面具有还原性的有机酸中的羧羟基可能与亚硝根作用,失去电子形成羰基,亚硝根得电子生成NO;另一方面具有较强酸性的有机酸提供的酸性环境使亚硝酸盐自身发生氧化还原反应。在蔬菜发酵过程中,柠檬酸酸性较强,含量较高,而通过对亚硝酸盐降解试验可知,柠檬酸降解亚硝酸盐的能力也较强,因此推断在泡菜发酵过程中柠檬酸对亚硝酸盐的降解起主导作用。
由此可以推断,亚硝酸盐与上述有机酸反应,一方面具有还原性的有机酸中的羧羟基可能与亚硝根作用,失去电子形成羰基,亚硝根得电子生成NO;另一方面具有较强酸性的有机酸提供的酸性环境使亚硝酸盐自身发生氧化还原反应。在蔬菜发酵过程中,柠檬酸酸性较强,含量较高,而通过对亚硝酸盐降解试验可知,柠檬酸降解亚硝酸盐的能力也较强,因此推断在泡菜发酵过程中柠檬酸对亚硝酸盐的降解起主导作用。
3 结论与讨论
豇豆发酵前期在蔬菜组织和发酵液中均检测出8种有机酸,分别为草酸、酒石酸、苹果酸、乳酸、乙酸、柠檬酸、富马酸和琥珀酸;8种有机酸随发酵时间的增加变化趋势各不相同,发酵7 d后,蔬菜组织中柠檬酸含量最高,为641.59 mg/(100 g),发酵液中苹果酸含量最高,为195.39 mg/(100 g);且各有机酸降解亚硝酸盐能力大小顺序依次为草酸、酒石酸、苹果酸、柠檬酸、琥珀酸、乙酸、乳酸、富马酸。其中,柠檬酸酸性较强,含量较高,降解亚硝酸盐的能力较强,故推断其在泡菜发酵过程可能对亚硝酸盐的降解起主导作用。
本文与商景天等[10]、邹辉等[11]和刘晓英等[12]的研究存在相似之处,但试验结果却差别很大。具体原因可能有以下两点:(1)原料不同。泡菜发酵产生的有机酸种类及各有机酸含量与发酵的原料密切相关;(2)发酵时间不同。商景天等[10]的发酵时间为120 h,邹辉等[11]、刘晓英等[12]的发酵时间为12 d,故不同的发酵时间,各有机酸含量的变化趋势也会发生变化。本文虽与上述几篇文章的研究内容存在相似点,但侧重点有所不同。商景天等[10]、刘晓英等[12]重点研究不同条件(温度、酸浓度、pH等)对有机酸降解亚硝酸盐的影响,邹辉等[11]重点测定泡白菜中的有机酸种类及它们各自对亚硝酸盐的降解能力,但对各有机酸的含量变化只是简单的数据罗列,并未进行深入分析。且3篇文章都只对泡菜进行研究,都未将发酵液一起对比。因此,本文借鉴前人的研究情况,并在此基础上深入,以期为阐明泡菜中亚硝酸盐降解机理和生产控制提供理论基础。
[1] 刘楚岑,谭兴和,张春燕,等.水分添加量对豇豆发酵过程中品质变化的影响[J].食品与机械,2017,33(8):173-177.
[2] 王利斌,林晨,罗海波,等.预冷时机对四季豆和豇豆品质和生理生化特性的影响[J].食品科学,2018,39(9):232-238.
[3] ZHANG Qisheng,GONG Chen,SHEN Wenxi,et al.Microbial safety and sensory quality of instant low-salt Chinese paocai[J].Food Control,2016,59(6):575-580.
[4] SHIM S M,JI Y K,SANG M L,et al.Profiling of fermentative metabolites in kimchi:Volatile and non-volatile organic acids[J].Journal of the Korean Society for Applied Biological Chemistry,2012,55(4):463-469.
[5] FILIZ T,MINE G,TUGBA D,et al.Antioxidant activity and total phenolic,organic acid and sugar content in commercial pomegranate juices[J].Food Chemistry,2009,115(3):873-877.
[6] 马欢欢,吕欣然,白凤翎,等.传统中韩泡菜乳酸菌菌相分析与风味物质组成的比较[J].食品与发酵工业,2015,41(12):184-190.
[7] 郑惠文,张秋云,李文慧,等.新疆杏果实发育过程中可溶性糖和有机酸的变化[J].中国农业科学,2016,49(20):3 981-3 992.
[8] 王刚,王涛,潘德林,等.不同品种猕猴桃果实有机酸组分及含量分析[J].农学学报,2017,7(12):81-84.
[9] XIANG Jinle,DU Lin,LIU Zhijing,et al.Changes in biochemical parameters and organic acid content during liquid fermentation of peach vinegar[J].Modern Food Science and Technology,2015,31(5):193-198.
[10] 商景天,王修俊,王继辉.有机酸对泡菜中亚硝酸盐的降解作用[J].食品与机械,2018,34(3):78-83.
[11] 邹辉,刘晓英,陈义伦,等.泡菜(白菜)腌制过程中有机酸对亚硝酸盐含量的影响[J].食品与发酵工业,2013,39(11):29-32.
[12] 刘晓英.泡菜中有机酸对亚硝酸盐降解作用及机理的初步研究[D].泰安:山东农业大学,2013.
[13] 中华人民共和国国家质量监督检验疫总局,中国国家标准化管理委员会.GB5009.33—2016食品中亚硝酸盐与硝酸盐的测定[S].北京:中国标准出版社,2016.
[14] SCHERER R,RYBKA A C P,BALLUS C A,et al.Validationof a HPLC method for simultaneous determination of mainorganic acids in fruits and juices[J].Food Chemistry,2012,135(1):150-154.
[15] CAO Jialu,YANG Jixia,HOU Qiangchuan,et al.Assessment of bacterial profiles in aged,home-made Sichuan paocai brine with varying titratable acidity by PacBio SMRT sequencing technology[J].Food Control,2017,78(8):14-23.
[16] 林浩.乳酸菌降解亚硝酸盐机理及其在发酵萝卜中的应用[D].广州:华南理工大学,2014.
[17] 陈弦,张雁,陈于陇,等.发酵蔬菜风味形成机制及其分析技术的研究进展[J].中国食品学报,2014,14(2):217-224.
[18] OGUNTOYINBO F A,FUSCO V,CHO G S,et al.Produce from Africa’s gardens:potential for leafy vegetable and fruit fermentations[J].Frontiers in Microbiology,2016,7(3):981-994.
[19] 韩芳,吴秋燕,赵雪.有机酸在发酵过程中的变化规律[J].中国酒业,2015(1):9-12.
[20] KIM S H,KIM S H,KANG K H,et al.Kimchi probiotic bacteria contribute to reduced amounts of,N-nitrosodimethylamine in lactic acid bacteria-fortified kimchi[J].LWT-Food Science and Technology,2017,84(10):196-203.
[21] KIM S H,KANG K H,KIM S H,et al.Lactic acid bacteria directly degrade N-nitrosodimethylamine and increase the nitrite-scavenging ability in kimchi[J].Food Control,2017,71(1):101-109.