泡菜是以新鲜蔬菜为原料,在乳酸菌和酵母菌等菌群的作用下通过厌氧发酵而生成的一种发酵食品[1]。乳酸菌指发酵糖产生乳酸的一类无芽孢、革兰氏阳性细菌的总称,被称为“公认安全菌株”(generally regarded as safe,GRAS)[2]。泡菜在腌制过程中不可避免地产生亚硝酸盐,过量的亚硝酸盐能够与胃内食物中的仲胺类物质相互作用,转化为亚硝胺,而亚硝胺具有强烈的致癌作用[3]。人体长期摄入亚硝酸盐可导致胃癌[4]、肺癌[5]、甲状腺癌[6]等癌症。此外,亚硝酸盐还可使血红蛋白氧化成高铁蛋白,失去携氧能力,造成低氧血症,严重时会危害生命[7]。许多研究表明乳酸菌在泡菜发酵过程中具有很好的降低亚硝酸盐作用[8-9],这是由于乳酸菌产生的亚硝酸还原酶和代谢产物乳酸,可降解和清除亚硝酸盐[10]。丁娟芳等从扬州酱菜中筛选到一株乳酸肠球菌,培养24 h后亚硝酸盐降解率达到91.7%[11]。杜晓华等从四川泡菜中筛选的植物乳杆菌,培养24 h后亚硝酸盐降解率达到99.1%[12]。汤伟等从中国传统发酵泡菜中分离的消化乳杆菌w369培养72 h后,对亚硝酸钠的降解率为92.92%[13]。
人体摄入一定量的乳酸菌可以促进有益微生物的生长,抑制有害微生物的生长,保持肠道菌群平衡,减少肠道疾病的发生[14]。泡菜中的乳酸菌要在人体中发挥良好的保健作用,必须有足够数量活性菌经过胃到达小肠,这就要求乳酸菌对胃肠道中的酸、胆盐有较强的耐受能力,对体内环境有较强的适应性。随着对乳酸菌的研究深入,发现乳酸菌也存在潜在的危害,泡菜中的乳酸菌有很多是野生的,乳酸菌有可能携带耐药基因[15]。作为食品发酵菌株,有必要对发酵乳酸菌进行耐药性检测。
本研究主要是从泡菜中筛选降解亚硝酸盐的乳酸菌进行菌株鉴定。研究乳酸菌产酸能力、降低亚硝酸盐能力、耐酸性、耐胆盐、抑菌性和耐药性等生物学特性,为生产优质安全泡菜提供优良发酵剂。
1 材料与方法
1.1 材料与试剂
实验室自制泡菜、市售泡菜、民间收集泡菜。
MRS肉汤培养基,青岛海博公司;细菌DNA提取试剂盒,Takara公司;16S上下游引物,上海生工;药敏试纸,杭州天和公司;其余均为国产分析纯或化学纯。
大肠杆菌(Escherichia coli)CICC 10907、肠沙门氏菌(Salmonella enteric)CICC 10871、金黄色葡萄球菌(Staphylococcus aureus)CICC 10790和铜绿假单胞菌(Pseudomonas aeruginos)CICC 21636,中国微生物菌种保藏管理中心。
1.2 仪器与设备
722型紫外可见分光光度计,上海光谱仪器有限公司;AL204分析天平,上海精密仪表仪器有限公司;BBS-SDC-A超净工作台,吉林长春博科;MyCycler PCR扩增仪,美国Bio-Rad;SHP-250 型生化培养箱,江南生物仪器。
1.3 试验方法
1.3.1 乳酸菌的分离纯化
用接种环蘸取少许泡菜底部汁液,在含有CaCO3的MRS培养基平板上划线,37 ℃培养48 h,挑取有明显溶钙圈的白色单菌落接入MRS液体培养基,37 ℃培养48 h,进行革兰氏染色镜检和接触酶实验,革兰氏染色阳性、接触酶反应阴性菌株初步鉴定为乳酸菌进行下一步实验[10]。
1.3.2 降解亚硝酸盐乳酸菌的筛选
将初步鉴定为乳酸菌的菌株接种于MRS液体培养基,37 ℃培养18 h,取新鲜菌液按10%(体积分数)接种于10 mL含有质量浓度125 mg/L NaNO2的MRS液体培养基,37 ℃培养48 h,加入2 mL对氨基苯磺酸溶液,混匀,避光静置5 min,再加入1 mL盐酸萘乙二胺溶液,混匀,避光静置15 min,观察各菌株培养液的颜色变化,选出颜色较浅的菌株,进行复筛[12]。
初筛菌株活化后,按5%(体积分数)接种于含有125 mg/L NaNO2的MRS液体培养基中,37 ℃培养48 h,测定培养前后培养液中NaNO2含量,计算公式如式(1)所示,计算亚硝酸盐降解率,选取亚硝酸盐降解力较强的菌株[11]。
![]() 降解率
降解率![]() ×100
×100
(1)
亚硝酸盐含量的测定采用GB/T 5009.33—2016《食品中亚硝酸盐与硝酸盐的测定》中盐酸萘乙二胺分光光度法[16]。
1.3.3 乳酸菌的鉴定
1.3.3.1 乳酸菌形态特征观察
观察单菌落颜色、形状、边缘、表面等培养特征;革兰氏染色镜检菌体颜色、形状、排列方式等形态特点。
1.3.3.2 16S rDNA的扩增和序列分析
采用Takara细菌基因组DNA提取试剂盒提取乳酸菌基因组,以细菌16 S rDNA通用引物27f为上游引物,1492r为下游引物,基因组DNA为模板扩增16 S rDNA片段。PCR反应程序:95 ℃预变性5 min,32 个循环(95 ℃变性1 min;55 ℃退火90 s;72 ℃延伸2 min),72 ℃延伸10 min。PCR产物由上海生物工程有限公司测序,所得16 S rDNA序列提交NCBI网站进行BLAST核酸数据比对[13]。
1.3.4 乳酸菌生物学特性研究
1.3.4.1 乳酸菌发酵产酸能力测定
设置3个试验组,分别为乳酸菌JYF2接种发酵(JYF2组),乳酸菌JYF3接种发酵(JYF3组)和自然发酵(ZR组),含有5%食盐和3%白糖的溶液,121 ℃,5 min灭菌后备用。乳酸菌JYF2和JYF3,37 ℃培养48 h,按10%(体积分数)接入5%食盐和3%白糖的溶液,制得乳酸菌接种发酵泡菜汁,ZR组泡菜汁不添加任何菌。新鲜白菜洗净除去老叶,取薄厚均匀的菜叶切成约10 cm×4 cm的长条,取200 g置于500 mL广口瓶中,加入400 mL乳酸菌发酵泡菜汁和无菌泡菜汁,盖上瓶塞密封,28 ℃发酵[17]。
每天取发酵液混匀后,用pH计测pH值。总酸的测定按GB/T12456—2008《食品中总酸的测定》[18]进行,总酸含量以乳酸计。
1.3.4.2 发酵中亚硝酸盐含量测定
按照1.3.4.1发酵3组泡菜,每天取白菜叶按照GB 5009.33—2016《食品中亚硝酸盐与硝酸盐的测定》测定发酵白菜的亚硝酸盐含量[16]。
1.3.4.3 乳酸菌耐酸性测定
菌株活化后离心,弃上清液,菌体中分别加入pH值为2.0、3.0、4.0、5.0、6.0的无菌生理盐水,混匀后37 ℃保温3 h,分别再加入无菌生理盐水后0 h和3 h取培养物,稀释涂布MRS平板,37 ℃培养48 h后计数,按公式(2)计算存活率。
存活率![]()
(2)
式中:N1和N2分别为菌株接入不同pH值的无菌生理盐水培养3 h和 0 h后的活菌数。
1.3.4.4 乳酸菌耐胆盐性测定
菌株活化后分别按5%接种于含0.01、0.02、0.03、0.04和0.05 g/L猪胆盐的MRS液体培养基中,37 ℃培养18 h,稀释涂布MRS平板,37 ℃培养48 h后计数,按公式(2)计算存活率。
存活率![]()
(3)
式中:P1和P2分别为菌株接入不同浓度胆盐培养后的活菌数和不含胆盐培养后的活菌数。
1.3.4.5 乳酸菌株对常见致病菌的抑菌性研究
采用牛津杯法测定乳酸菌的抑菌性能,取大肠杆菌CICC 10907,肠沙门氏菌CICC 10871,金黄色葡萄球菌CICC 10790和铜绿假单胞菌CICC 21636新鲜菌液培养至菌液浓度为105~106 CFU/mL,并均匀涂布在牛肉膏蛋白胨培养基上,然后将牛津杯放在平板上,将乳酸菌菌液置于牛津杯孔中,37 ℃培养24 h,观察抑菌结果。
1.3.4.6 乳酸菌耐药性研究
采用细菌药敏纸片琼脂扩散法,将乳酸菌菌液培养至105~106 CFU/mL,然后均匀涂布在MRS琼脂平板上,将灭菌水纸片、青霉素G纸片、氨苄青霉素纸片、庆大霉素纸片、链霉素纸片、氟哌酸纸片、氯霉素纸片和红霉素纸片贴于MRS琼脂平板上,37 ℃培养48 h,观察并测量抑菌圈直径大小。
所有实验均进行3次平行,实验数据采用Origin 8.5进行统计分析,各组数据之间进行单因素方差分析,P<0.05表示数据间存在显著性差异。
2 结果与分析
2.1 降解亚硝酸盐乳酸菌的筛选
蘸取少许泡菜汁在含CaCO3的MRS固体培养基上划线,有34株菌有明显的溶钙圈,其中有26株菌革兰氏染色阳性,接触酶反应阴性,初步鉴定为乳酸菌,编号为S-1、S-2等。
将分离纯化的26株乳酸菌,按5%接种量接入含有125 mg/L NaNO2的MRS液体培养基中,37 ℃培养48 h,盐酸萘乙二胺的显色结果,如图1所示。

图1 部分乳酸菌盐酸萘乙二胺显色反应结果
Fig.1 Result of N-naphthylethylenediamine dihydrochloride reaction of partial lactic acid bacteria
注:从左到右试管编号:S-2、S-13、S-4、S-8、S-12、S-9、S-14、S-18、S-11、S-5。
不同乳酸菌产生不同程度的显色,显色机理是NaNO2在酸性环境下与对氨基苯磺酸生成重氮盐,重氮盐再与盐酸萘乙二胺进行偶合反应生成紫红色的偶氮化合物[13]。颜色越深,NaNO2含量越高,颜色越浅,NaNO2含量越低。MRS液体培养基中的NaNO2经乳酸菌降解,降解能力越强,NaNO2含量越低,颜色越浅。由图可见,不同乳酸菌均具有一定降解能力,但是降解NaNO2能力不同。所以,选取其中显示浅粉红色的6株菌进行复筛,重新命名为JYF1、JYF2、JYF3、JYF4、JYF5、JYF6。
初筛6株菌按5%接种量接种到含NaNO2的MRS液体培养基中,37 ℃培养48 h,每隔12 h测NaNO2降解率。如表1所示,6株乳酸菌的降解亚硝酸盐能力较强。在12 h时6株菌NaNO2降解率低于33%,可能是前12 h乳酸菌生长处于延滞期,细菌活动不旺盛,菌体数量较少,对亚硝酸盐的降解率较低[19]。从12 h开始,各菌株对亚硝酸盐的降解率逐渐加快,24 h有5株乳酸菌的降解率大于65%,36 h有5株菌的降解率大于90%,对亚硝酸盐的降解基本上已达到最高峰,可能是这段时间乳酸菌的生长处于对数期,细胞生长旺盛,菌体数量增多,分泌亚硝酸盐还原酶增多,同时乳酸菌产生较多乳酸,pH降低,促进亚硝酸盐的分解[19-20]。
表1 乳酸菌48 h内NaNO2的降解率 单位:%
Table 1 The degradation percentage of NaNO2 by lactic acid bacteria strains in 48 h
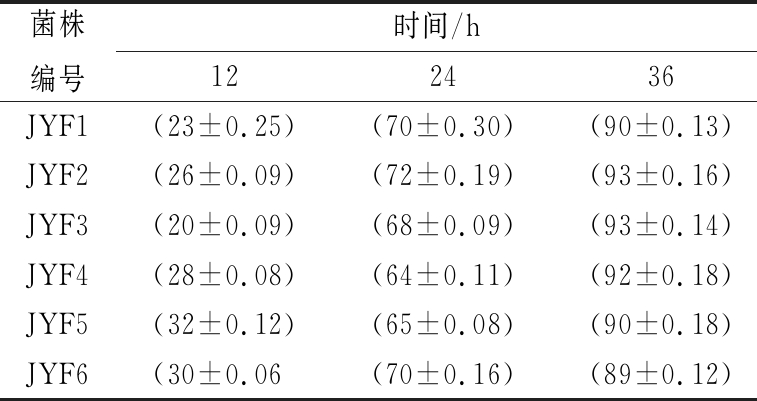
菌株编号时间/h12243648JYF1(23±0.25)(70±0.30)(90±0.13)(91±0.12)JYF2(26±0.09)(72±0.19)(93±0.16)(94±0.21)JYF3(20±0.09)(68±0.09)(93±0.14)(93±0.19)JYF4(28±0.08)(64±0.11)(92±0.18)(93±0.17)JYF5(32±0.12)(65±0.08)(90±0.18)(92±0.22)JYF6(30±0.06(70±0.16)(89±0.12)(90±0.19)
2.2 乳酸菌的鉴定
所筛6株菌在MRS固体培养基上菌落较小,圆形,凸起,表面光滑,边缘整齐,不透明,革兰氏染色后镜检阳性菌,短杆状,无芽孢,成对或短链状。
以6株乳酸菌的DNA为模板,PCR扩增得到约1.5 kb的序列片段,将各菌株的16S rDNA序列在NCBI中进行BLAST比对分析,结果发现JYF1、JYF2、JYF5和JYF6与植物乳杆菌的同源性分别为97%、98%、98%和98%;JYF3和JYF4与发酵乳杆菌的同源性为99%和98%。
根据培养特征、菌体特征和16S rDNA同源比对分析,JYF1、JYF2、JYF5和JYF6初步鉴定为植物乳杆菌(Lactobacillus plantarum);JYF3和JYF4初步鉴定为发酵乳杆菌(Lactobacillus fermentum)[21]。
结合NaNO2降解率,选取JYF2和JYF3为实验对象,进一步研究其生物学特性。
2.3 乳酸菌生物学特性研究
2.3.1 乳酸菌发酵产酸能力测定
泡菜发酵是乳酸菌的选择培养过程,乳酸菌在厌氧环境下利用糖类等底物,产生乳酸,提高总酸含量。由图2可知,前4 d pH值和总酸含量变化幅度较大,因为发酵前4 d,乳酸菌数量不断增加,产酸量不断增大。接种JYF2的泡菜在发酵第4天,pH值是3,达到最低值,总酸含量达到15%;接种JYF3的泡菜在发酵第5天,pH值最小是3,总酸含量在接种第7天达到最大值是15%,组间组内显著差异(P<0.05)。从第5天开始,发酵进入相对平稳期,pH值和总酸含量变化幅度较小。接种JYF2和JYF3泡菜的pH值比自然发酵的低,总酸量比自然发酵的高,可能是接种JYF2和JYF3的泡菜在发酵初期,在封闭的泡菜汁环境中,乳酸菌含量比自然发酵的高,促使乳酸菌优势菌群的提前形成,加快泡菜的pH值降低、总酸含量增加。
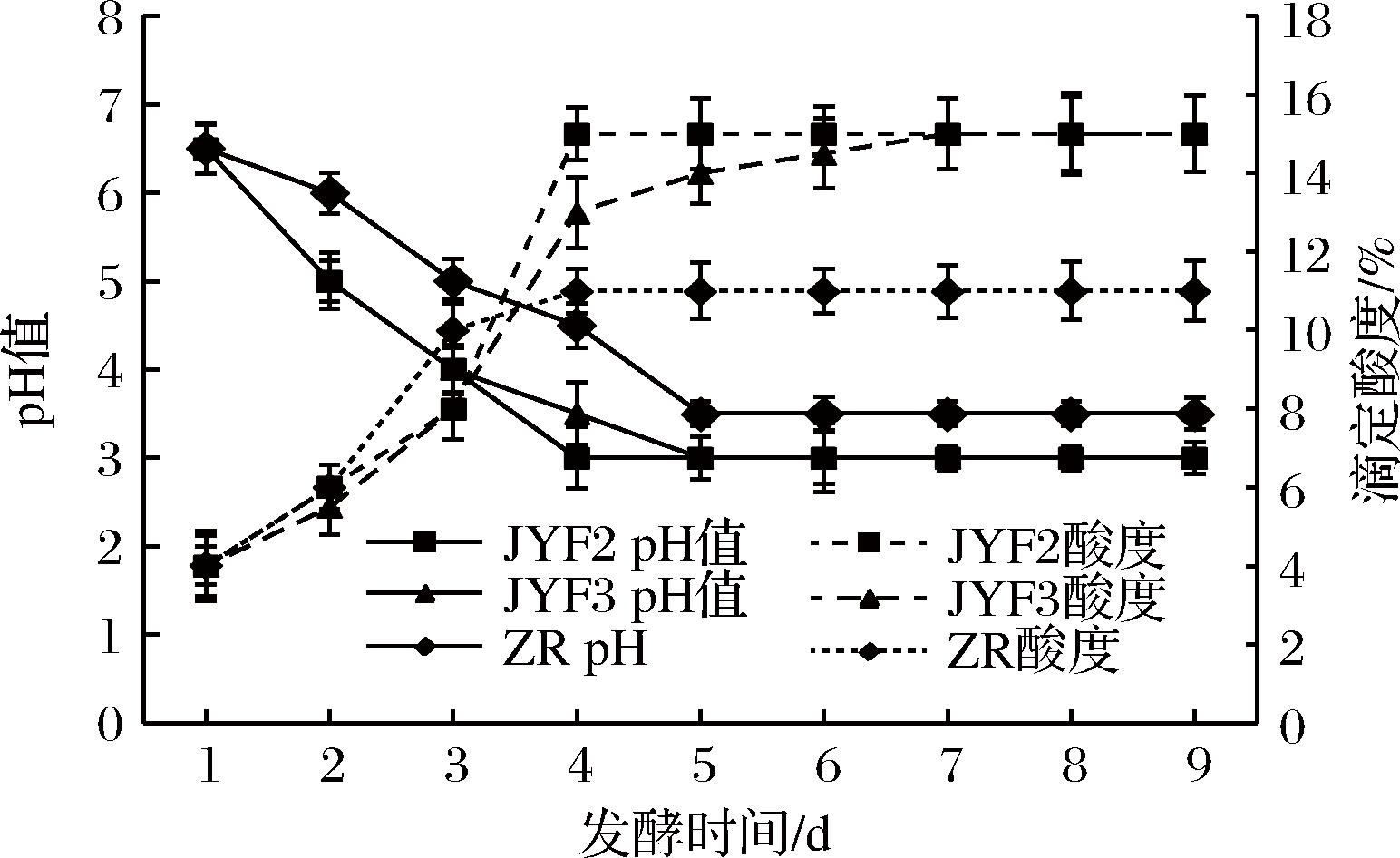
图2 泡菜发酵过程中pH值和酸度的变化
Fig.2 Changes in pH value and titratable acidity during fermentation
2.3.2 乳酸菌降低亚硝酸盐能力的测定
由图3可知,3组泡菜均出现一个“亚硝峰”,接种乳酸菌的实验组的“亚硝峰”均出现第3天,亚硝酸盐含量峰值分别为17.5和18.8 mg/kg,低于国家标准限度值20 mg/kg[22],2组亚硝酸盐含量差异不显著(P>0.05)。自然发酵泡菜的亚硝峰出现在第4天,亚硝酸盐含量峰值为30.4 mg/kg,超过国家标准[22]。3组泡菜亚硝酸盐含量在“亚硝峰”后,亚硝酸盐含量均出现下降,接种组亚硝酸含量明显低于自然发酵组,呈显著水平(P<0.05)。发酵至第8天,接种组亚硝酸盐含量分别为1.8和2 mg/kg,远低于自然发酵组6.3 mg/kg。国家标准中规定,酱腌菜制品中亚硝酸含量不得超过20 mg/kg,尽管自然发酵泡菜的含量低于国家标准,但JYF2和JYF3的接入进一步降低了泡菜中的亚硝酸盐,提高泡菜的食用安全性。
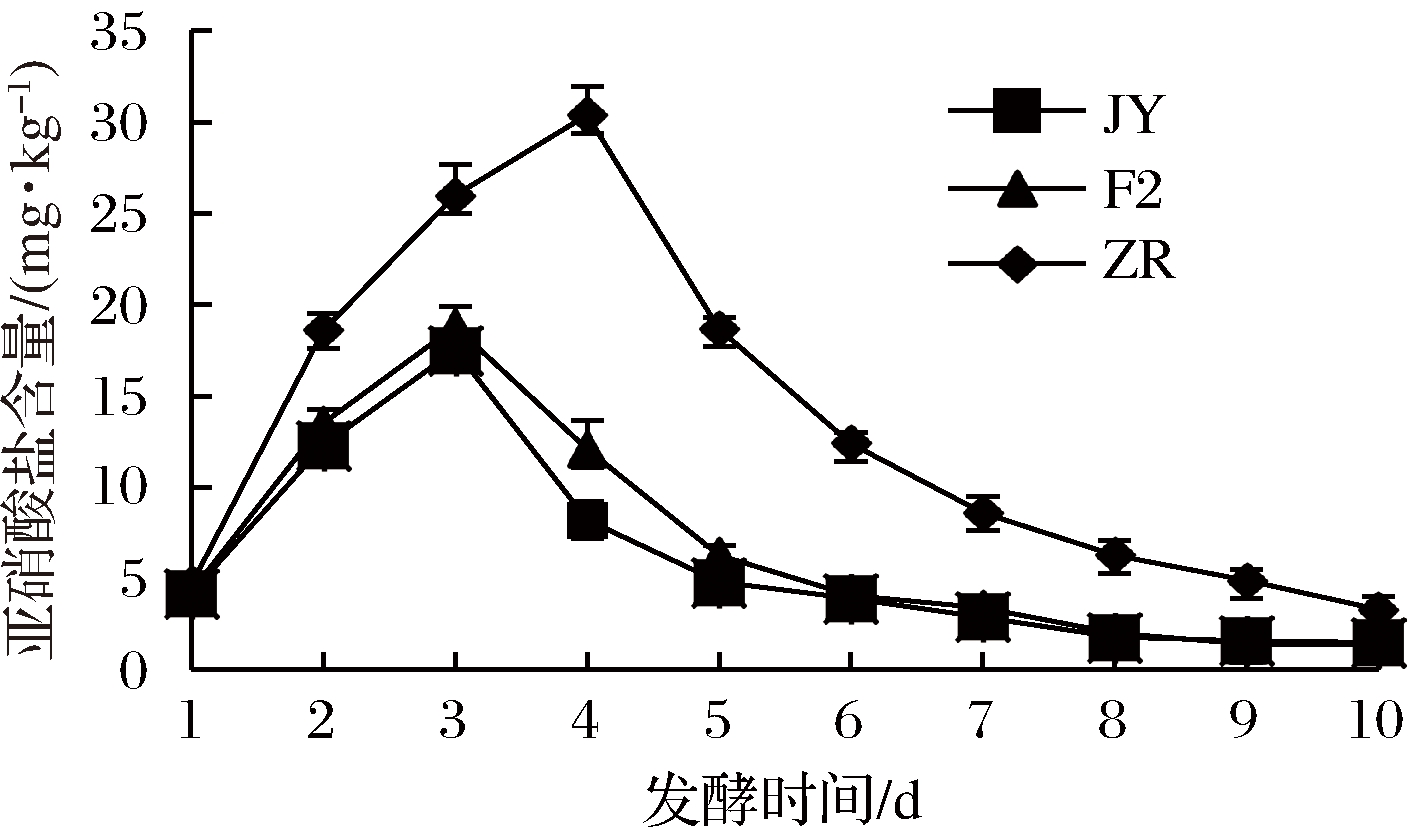
图3 泡菜发酵过程中亚硝酸盐含量的变化
Fig.3 Changes in nitrite content of pickled during fermentation
2.3.3 乳酸菌耐酸性测定
人体胃酸pH值为1.5~4.5,食物在胃中停留时间约为2~3 h[23]。如图4所示,当pH值为2时,2株菌存活率介于30%和50%之间,组间差异不显著(P>0.05);pH值为3时,2株菌的存活率大于60%,JYF2的存活率大于JYF3,且组间差异显著(P<0.05);pH值为4时,2菌株存活率均大于80%,组间差异不显著(P<0.05)。由此可知,2株菌在人体胃液环境下有一定存活性。
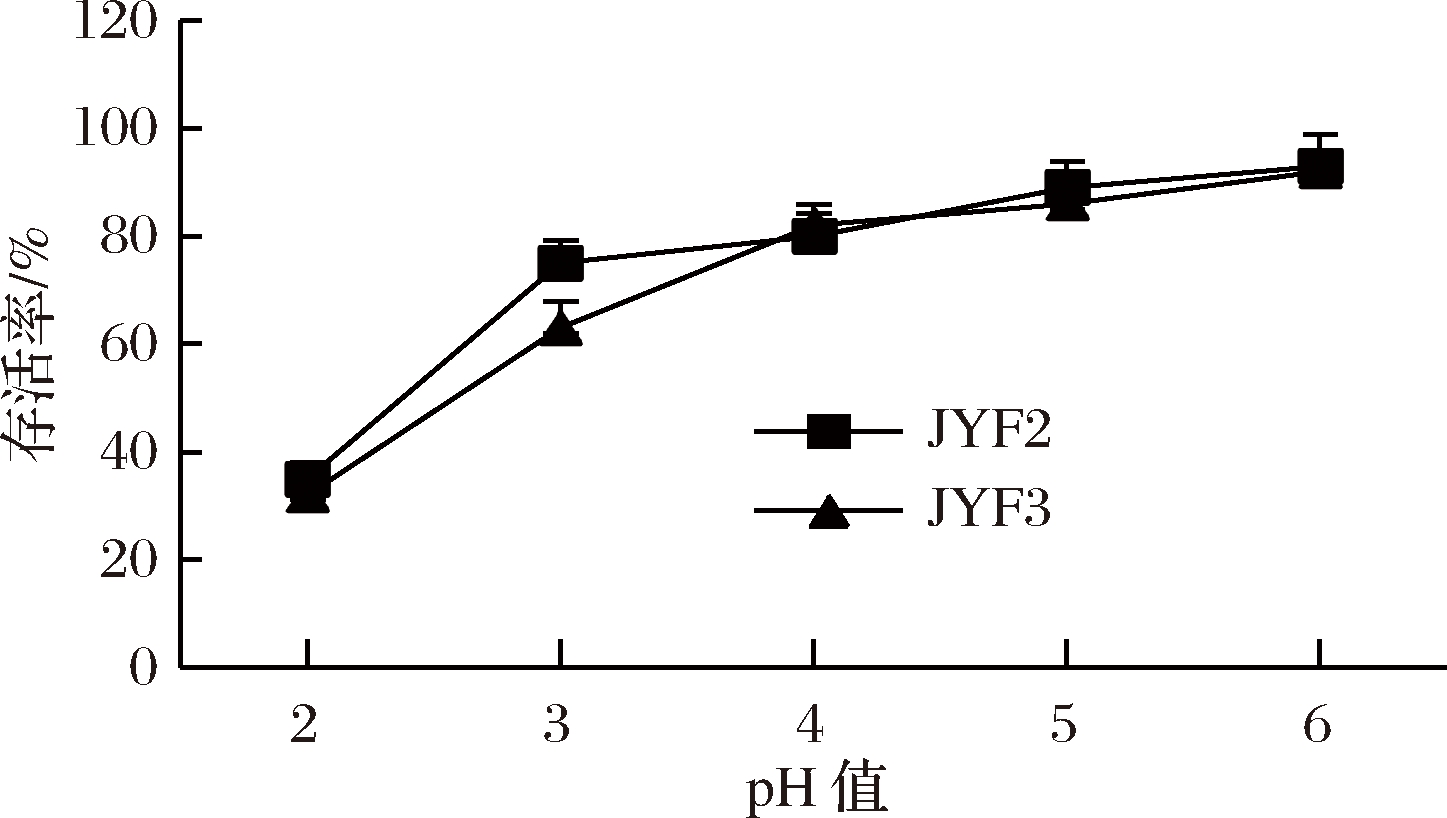
图4 乳酸菌在不同pH值下的存活率
Fig.4 The survival rate of lactic acid bacteria under different pH condition
2.3.4 乳酸菌耐胆盐性测定
乳酸菌进入人体消化道后,除了需要经受胃酸的考验外,还需要经受人体小肠胆盐环境的考验,在胃肠道保持一定数量的活菌数,乳酸菌才能发挥其益生作用。如图5所示,JYF2和JYF3两株乳酸菌在胆盐质量浓度为0.01和0.02 g/L时,存活率较高,在70%以上;胆盐质量浓度在0.03 g/L时,2株乳酸菌存活率下降到46%和48%,接近50%;胆盐质量浓度在0.04和0.05 g/L时,2株乳酸菌的存活率较低,小于30%。人体小肠中胆盐质量浓度一般在0.003~0.03 g/L[24],JYF2和JYF3在胆盐质量浓度小于0.03 g/L时,存活率在50%以上,说明这2株菌对胆盐有较好的耐受性。这2株菌在不同胆盐浓度下的存活率,组间差异不显著(P>0.05),说明2株菌对胆盐耐受性相近。
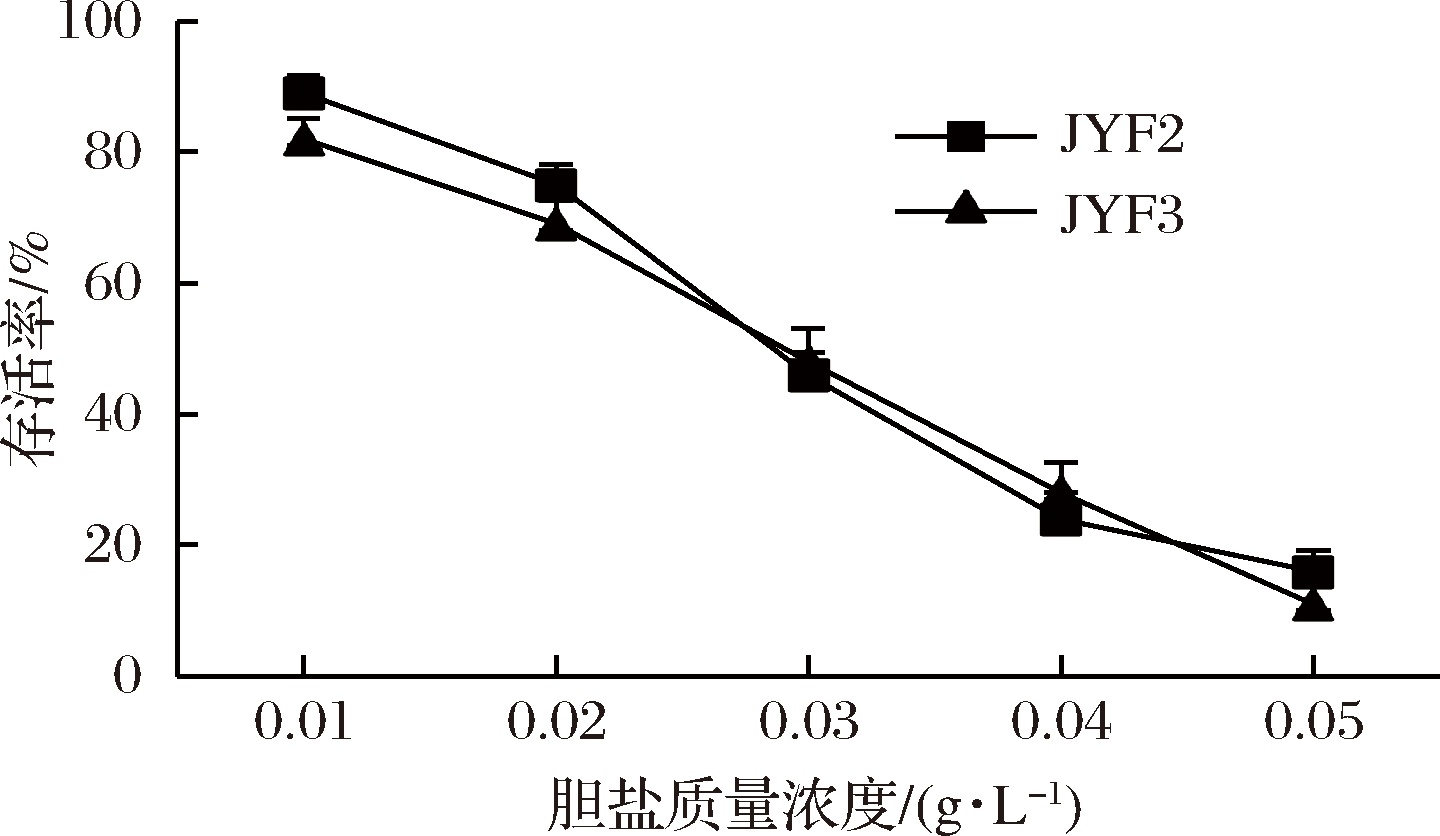
图5 乳酸菌在不同胆盐浓度下的生长
Fig.5 Growth of lactic acid bacteria under different bile salt concentration
2.3.5 乳酸菌株对常见致病菌的抑菌性研究
由图6可知,JYF2和JYF3的发酵菌液对4株致病菌均能产生抑菌圈,说明这2株菌对大肠杆菌、铜绿假单胞菌、沙门氏菌和金黄色葡萄球菌均有一定的抑菌性。由图6可知,2株菌对革兰氏阳性菌金黄色葡萄球菌的抑菌圈直径大于20 mm,组间差异不显著(P>0.05),这2株菌对革兰氏阳性菌的抑菌效果相近。对革兰氏阴性菌大肠杆菌、铜绿假单胞菌和沙门氏菌的抑菌圈直径小于20 mm,组间差异显著(P<0.05),说明2株菌对革兰氏阴性菌的抑菌性有一定差异,且JYF2>JYF3。
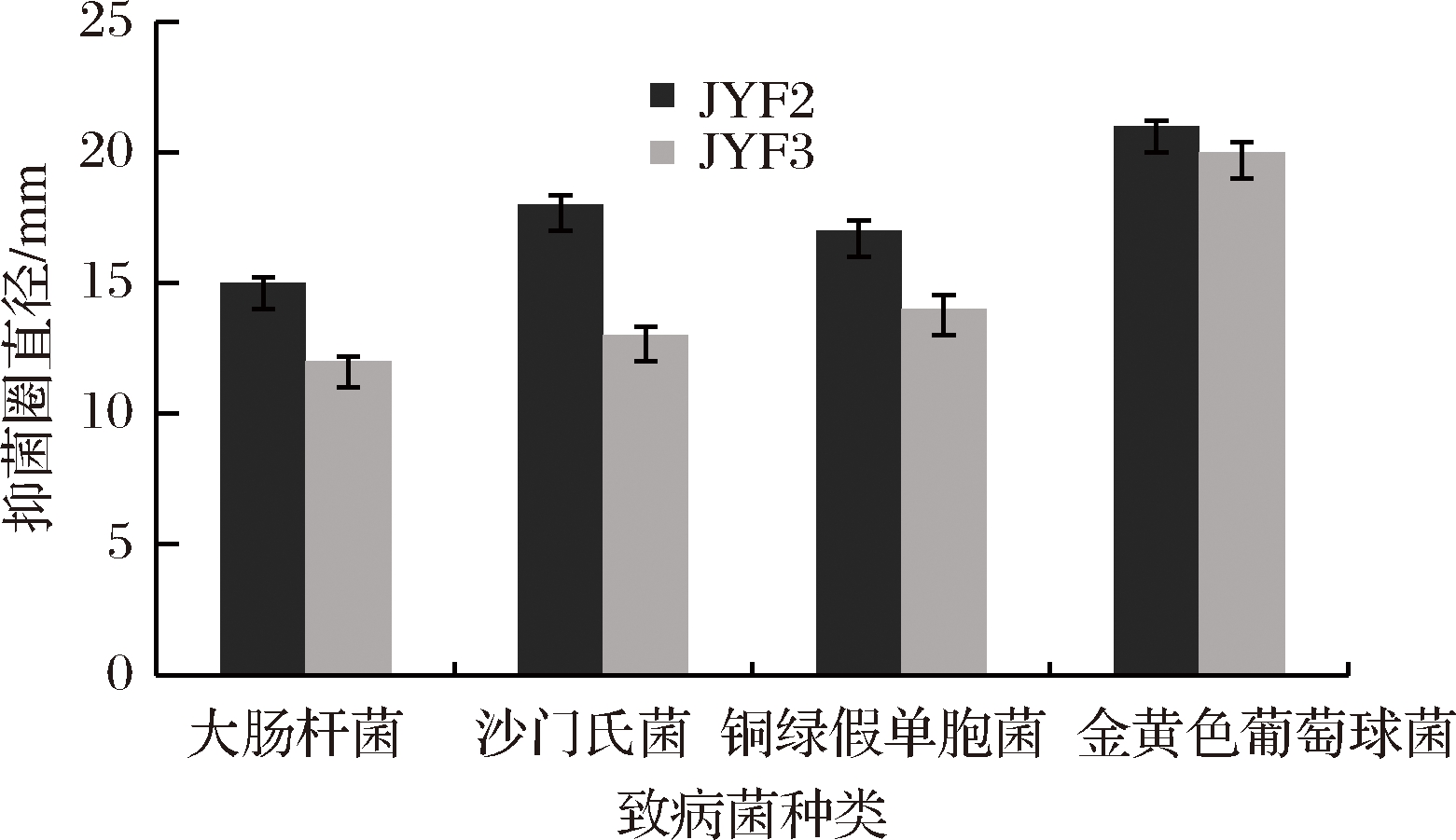
图6 乳酸菌抑菌实验结果
Fig.6 Antimicrobial activity test of lactic acid bacteria
2.3.6 乳酸菌耐药性研究
选取7种较常见的抗生素检测泡菜中分离的乳酸菌的耐药性。由图7可知,JYF2和JYF3对青霉素G、氨苄青霉素和红霉素较敏感,抑菌圈直径大于25 mm,组间差异不显著(P>0.05),说明这2株菌对青霉素G、氨苄青霉素和红霉素敏感性相近。JYF2和JYF3对庆大霉素、链霉素、氟哌酸和氯霉素中等敏感,其中对氯霉素的敏感性差异显著(P<0.05),说明这2株菌对氯霉素的敏感性存在一定的差异性。
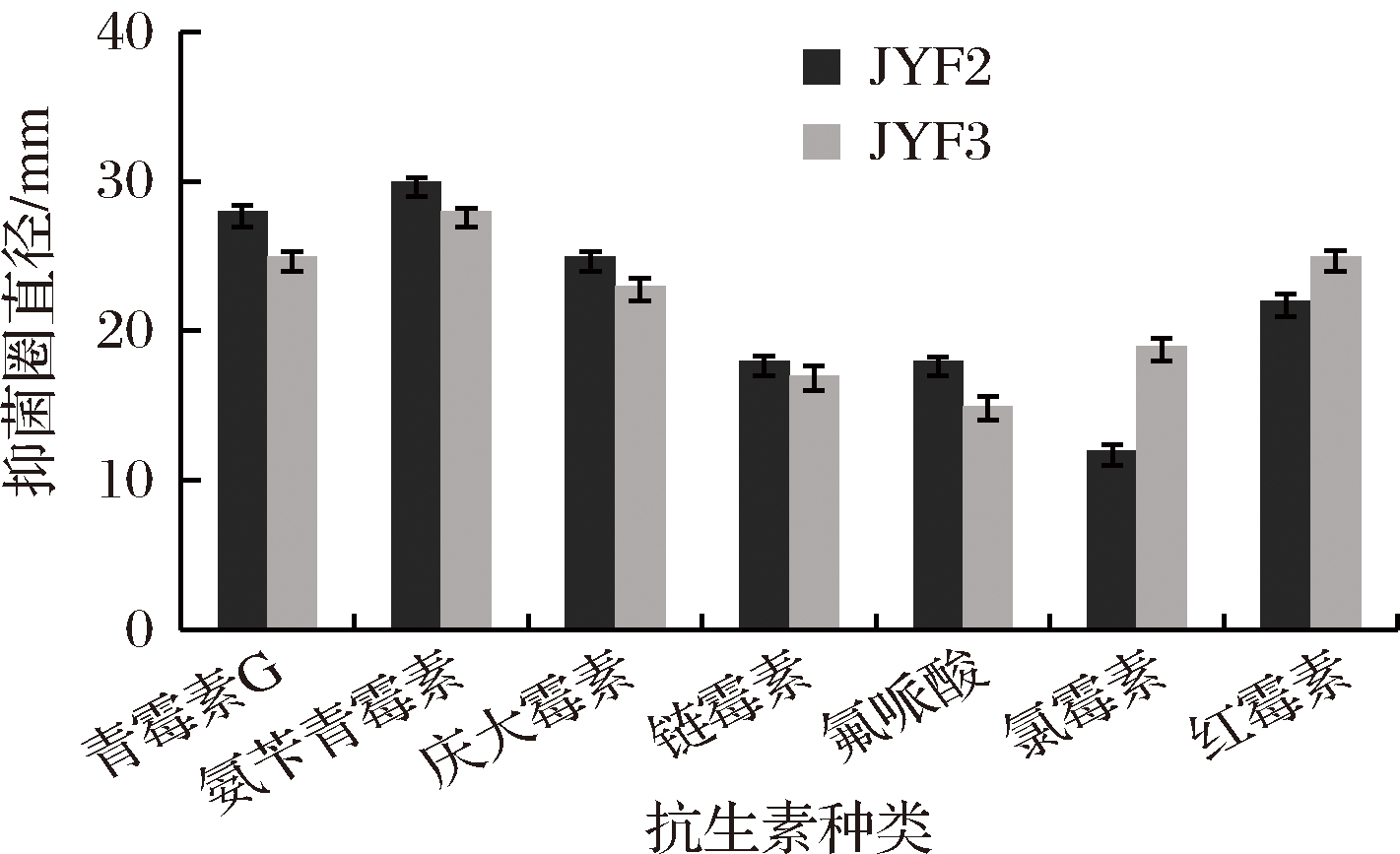
图7 分离乳酸菌的药敏试验结果
Fig.7 The result of antibiotic sensitivity tests for isolated lactic acid bacteria
3 结论与讨论
泡菜是新鲜蔬菜经微生物发酵而成的,不仅具有蔬菜的营养,而且含有大量活性乳酸菌。然而在蔬菜发酵过程中会产生亚硝酸盐,亚硝酸盐对人体健康有严重危害性。乳酸菌不仅是泡菜发酵剂,而且可以降解亚硝酸盐,降低对人体健康的危害。本研究从传统泡菜中初筛、复筛出降解亚硝酸盐的6株乳酸菌,根据菌落特征、菌体特征和16S rDNA同源比对分析,4株鉴定为植物乳杆菌(Lactobacillus plantarum);2株初步鉴定为发酵乳杆菌(Lactobacillus fermentum)。
泡菜发酵初期,泡菜汁中的氧使杂菌迅速生长繁殖,产生的硝酸还原酶将蔬菜中的硝酸盐还原为亚硝酸盐,致使亚硝酸盐含量增加[25],经亚硝酸盐诱导,乳酸菌能产生亚硝酸盐还原酶,降低亚硝酸盐。随着氧的消耗,乳酸菌逐渐成为优势菌,产生有机酸,抑制不耐酸杂菌的生长,同时pH降低,pH值<4.5时,亚硝酸盐的降解主要以酸降解为主[12]。开发优良泡菜发酵乳酸菌首先要考虑乳酸菌的产酸性,分离筛选的JYF2和JYF3用在泡菜发酵中,比自然发酵的泡菜产酸量高,pH值低。接种乳酸菌泡菜的“亚硝峰”比自然发酵泡菜的“亚硝峰”提前1 d出现,亚硝酸盐含量峰值分别为17.5和18.8 mg/kg,低于国家标准限度值20 mg/kg;自然发酵泡菜的“亚硝峰”亚硝酸盐含量为30.4 mg/kg,超过国家标准。发酵至第8天,接种组亚硝酸盐含量分别为1.8和2 mg/kg,远低于自然发酵组6.3 mg/kg,JYF2和JYF3的接入降低了泡菜中的亚硝酸盐含量,提高泡菜的食用安全性。
乳酸菌可抑制一些病原微生物的生长,调节人体胃肠道菌群平衡。JYF2和JYF3对一些常见病原微生物大肠杆菌、铜绿假单胞菌、沙门氏菌和金黄色葡萄球菌均有抑菌性,其中对革兰氏阳性菌的抑菌性大于革兰氏阴性菌。泡菜中的乳酸菌要发挥保健作用,必须要到达小肠,优良的乳酸菌对人体胃肠道环境要有耐受性。JYF2和JYF3当pH值为2时,2株菌存活率大于30%;pH值为3时,2株菌的存活率大于60%;pH值为4时,2株菌存活率均大于80%,2株菌在体外胃液环境下有一定存活性;JYF2和JYF3在胆盐浓度小于0.3%时,存活率在50%以上,说明这2株菌对胆盐有较好的耐受性。
许多传统泡菜由蔬菜表面附着的乳酸菌发酵而成,由于滥用抗生素,环境中抗生素污染日益严重,蔬菜在种植过程中易受到浇灌水、土壤等环境抗生素的污染,导致蔬菜表面微生物易产生耐药性[26]。泡菜食用时,一般不经过特殊加热处理,耐药乳酸菌会经过食物链进入人体,对人体健康造成潜在危害。选取7种较常见的抗生素检测JYF2和JYF3的耐药性,JYF2和JYF3对不同抗生素敏感性不同。
本研究从泡菜中筛选出6株降解亚硝酸盐的乳酸菌,研究其中2株乳酸菌的益生特性,为生产低亚硝酸盐泡菜提供优良乳酸菌,为开发乳酸菌功能性食品奠定基础。
[1] 徐丹萍,蒲彪,敖晓琳,等.传统泡菜中乳酸菌的研究现状[J].食品工业科技,2013,34(19):369-372.
[2] 代永刚,田志刚,南喜平.乳酸菌及其生理功能研究的进展[J].农产品加工(学刊),2009(7):24-29.
[3] 刘小宁,王文光.泡菜中亚硝酸盐的危害及预防措施[J].陕西农业科学,2010,56(4):109-110.
[4] KARIMZADEH L,KOOHDANI F,SIASSI F.Relation between nitrate and nitrite food habits with lung cancer[J].Journal of Experimental Therapeutics,2012,10(2):107-112.
[5] HERN NDEZ-RAM
NDEZ-RAM REZ R U,GALV
REZ R U,GALV N-PORTILLO M V,WARD M H.Dietary intake of polyphenols,nitrate and nitrite and gastric cancer risk in Mexico City[J].Internationgal Journal of Cancer,2009,125(6):1 424-1 430.
N-PORTILLO M V,WARD M H.Dietary intake of polyphenols,nitrate and nitrite and gastric cancer risk in Mexico City[J].Internationgal Journal of Cancer,2009,125(6):1 424-1 430.
[6] KILFOY B A,ZHANG Y,PARK Y.Dietary nitrate and nitrite and the risk of thyroid cancer in the NIH-AARP diet and health study[J].Internationgal Journal of Cancer,2011,129(1):160-172.
[7] 林琳,钱培丽,朱彩琴,等.高压氧协同药物综合治疗急性亚硝酸盐中毒9例分析[J].中华全科医学,2012,10(7):1 149-1 150.
[8] 马延岩.泡菜发酵过程中亚硝酸盐生成及降解机理研究[J].食品科技,2013,38(10):277-280.
[9] 王兰,邓放明,陈思思,等.植物乳杆菌L5降解亚硝酸盐机理的初步研究[J].食品与发酵工业,2014,40(12):120-124.
[10] ZENG X Q,PAN Q,GUO Y X,et al.Potential mechanism of nitrite degradation by Lactobacillus fermentum RC4 based on proteomic analysis[J].Journal of Proteomics,2018,194(1):70-78.
[11] 丁娟芳,杨嘉,朱淑云,等.扬州酱菜中降解亚硝酸盐乳酸菌的筛选、鉴定及性能研究[J].中国酿造,2018,37(12):87-91.
[12] 杜晓华,刘书亮,蒲彪,等.四川泡菜中降解亚硝酸盐乳酸菌的筛选鉴定及其应用[J].食品与发酵工业,2013,39(4):48-52.
[13] 汤伟,胡维,王菁蕊,等.消化乳杆菌泡菜分离株W369的鉴定及其益生功能[J].微生物学报,2016,56(6):932-942.
[14] 翟磊,凌空,宋振,等.哈萨克传统发酵食品中乳酸菌的分离鉴定及代谢特性研究[J].食品与发酵工业,2017,43(7):122-127.
[15] 宋晓敏.发酵食品中乳酸菌的耐药性现状分析[J].微生物学通报,2015,42(1):207-213.
[16] GB/T 5009.33—2016,食品中亚硝酸盐与硝酸盐的测定[S].北京:中国标准出版社,2016.
[17] 陈安特,张文娟,张羲,等.酿酒酵母对萝卜泡菜发酵过程的影响[J].食品与发酵工业,2017,43(6):129-133.
[18] GB/T 12456—2008,食品中总酸的测定[S].北京:中国标准出版社,2008.
[19] 林浩,林伟锋,陈中.2株乳酸菌对亚硝酸盐的降解作用及其降解机理的初步分析[J].食品与发酵工业,2013,39(7):65-68.
[20] 陈曦,周彤,许随根,等.贵州酸肉中具有高亚硝酸盐降解和耐受能力乳酸菌的筛选与鉴定[J].中国食品学报,2018,18(2):256-264.
[21] 凌代文,东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:117-129.
[22] GB 2714—2015,食品安全国家标准酱腌菜[S].北京:中国标准出版社,2008.
[23] 任大勇,宫圣洁,周亭亭,等.朝鲜族辣白菜中益生性乳酸菌的筛选及其功能特性[J].中国食品学报,2018,18(7):76-82.
[24] 胡爱华,敖晓琳,陈岑,等.乳酸菌耐酸耐胆盐机制的研究进展[J].食品工业科技,2015,36(8):380-383;389.
[25] 姚荷,谭兴和,张春艳,等.发酵蔬菜中乳酸菌降解亚硝酸盐的研究进展[J].中国酿造,2018,37(7):22-25.
[26] WANG Z X,SHAO Y Y.Effects of microbial diversity on nitrite concentration in pao cai,a naturally fermented cabbage product from China[J].Food Microbiology,2018,72:185-192.