脱酰基酶(decetylase,EC 3.5.1.X)是一类能够催化底物脱去酰胺的水解酶,其中脱乙酰基酶是一类能催化几丁质或蛋白质水解脱去乙酰基,形成壳聚糖或脱乙酰基蛋白质的水解酶[1-2]。脱酰基酶广泛存在于动物、植物以及微生物体内,被应用于酰基化的化合物手性拆分,以生产光学纯的医药、临床、食品等领域的产品或者中间体,工业应用前景广阔[3-5]。如壳聚糖脱乙酰基酶可以用于水解甲壳素制备壳聚寡糖[6-8]。来源于链霉菌(Streptomyces pulverzceus)的棘白霉素B(ECB)脱酰基酶[9-11]可催化ECB脱酰基获得棘白霉素B母核。然而,像绝大多数外源基因一样,脱乙酰基酶基因在大肠杆菌、酵母菌等表达系统中高效表达时,易在细胞内凝集,形成不溶的、无活性、高密度、无定形[12]、非水溶性、可溶于变性剂物质如尿素、盐酸胍的包涵体[13]。
枯草芽孢杆菌(Bacillus subtilis)因其无致病性、遗传背景清晰、分泌蛋白能力强、培养条件简单、耐高温等优点,成为异源表达和分泌外源蛋白的理想宿主[14-16]。目前利用枯草芽孢杆菌表达脱乙酰基酶的研究基本未见报道,因此,可以尝试利用枯草芽孢杆菌的组成型分泌表达系统可溶性表达脱乙酰基酶。
本实验室已筛选到一个能够立体选择性水解乙酰化氨基酸生产L-氨基酸的脱乙酰基酶NAP-Das 2.3,但在E.coli表达系统中会形成大量包涵体。为实现高效表达,本文参考相关文献[17-20],将NAP-Das 2.3编码基因克隆至枯草芽孢杆菌构建重组工程菌,优化了工程菌的培养及产酶条件,实现了异源高效可溶性表达,为脱乙酰基酶的开发和应用奠定了基础。
1 材料和方法
1.1 实验材料
1.1.1 菌株和质粒
pP43NMK质粒,南京农业大学农业部农业环境微生物工程重点开放实验室赠送;E.coli JM109和B.subtilis WB800,本实验室保藏。
1.1.2 主要工具酶、试剂和试剂盒
限制性内切酶Xho I、BamH I、Phanta Max Super-Fidelity DNA Polymerase、ClonExpress® II一步克隆试剂盒等,Vazyme公司;质粒DNA小量抽提试剂盒、PCR产物纯化试剂盒等,Axygen生物技术有限公司;DNA Marker、protein Marker、Taq DNA Polymerase、染色剂Gold View等,TaKaRa公司;卡那霉素、氨苄青霉素等,大连宝生物公司;溶菌酶,生工生物工程(上海)有限公司;其他试剂为进口或国产。
1.1.3 主要仪器和设备
Biometra PCR仪,Biometra公司;SevenMulti pH计,瑞士Mettler-Toledo;Sorvall Lynx 4 000高速冷冻离心机,Thermo Scientific公司;5 L全自动发酵罐,上海保兴生物设备工程有限公司;Mini-Protean II型电泳仪、GelDoc凝胶成像仪,Bio-Rad公司;30 kDa超滤离心管,Millipore公司;BioLogic LP蛋白纯化仪,美国Bio-Rad公司;5417R小型台式高速冷冻离心机,德国Eppendorf公司。MS-100恒温金属振荡反应器,杭州奥盛仪器有限公司;NanoDrop One/OneC微量核酸蛋白浓度测定仪,美国Thermo公司;ExpressPlusTM聚丙烯酰胺蛋白预制胶,金斯瑞生物科技有限公司;UltiMate3000高效液相色谱,美国戴安公司。
1.2 实验材料
1.2.1 脱乙酰基酶编码基因的获得及其重组表达载体的构建和鉴定
脱乙酰基酶编码基因nap-das2.3由本实验室以Arenimonas malthae的amidohydrolase(GenBank登录号WP 043803585.1)为模板合成,克隆至载体pET 28b(+)的限制性酶切位点Xho I和BamH I之间,并将重组质粒pET 28b/nap-das2.3转入E.coli BL21,获得重组菌E.coli BL21/pET 28b/nap-das2.3。将E.coli BL21/pET 28b/nap-das2.3及实验室保藏的E.coli DH5α/pP43NMK用AxyPrep质粒DNA小量抽提试剂盒提取质粒。重组质粒pET 28b/nap-das2.3用Xho I、BamH I酶切获得目的基因片段nap-das 2.3。根据载体pP43NMK上目的基因插入位点两端的序列及nap-das2.3序列设计PCR引物。插入片段扩增引物(F1/R1),上游引物F1:5′-GTAAGAGAGGAATGTACACATGATTAGATGGAGCTTTCAA-3′;下游引物R1:5′-CCTTTCGCCCGTCACTCAAGTGGTTGTTGTTAGAAGAGTA-3′。线性化克隆载体的扩增引物(F2/R2),上游引物F2:5′-CATTATAGGTAAGAGAGGAATGTACACATGATT-3′;下游引物R2:5′-CCTTTC GCCCGTCACTCAAGTGGTTGTTGTTAGAA-3′。PCR反应采用50 μL体系,PCR反应条件为:98 ℃、3 min;98 ℃、10 s;65 ℃、15 s;72 ℃、20 s,30个循环;71 ℃、10 min,随后用Dpn I消化10 min降解扩增模板后置于65 ℃加热20 min使Dpn I失活。线性化克隆载体直接用于连接,目的基因扩增片段经PCR产物纯化试剂盒清洗之后用于连接。回收后的目的基因片段和线性载体的浓度用NanoDrop One/OneC微量核酸蛋白浓度测定仪测定后,用ClonExpress® II一步克隆试剂盒连接,连接产物转化E.coli JM109,转化液涂布于含50 μg/mL氨苄青霉素的LB平板上37 ℃恒温培养10~12 h,挑取转化子用菌落PCR法鉴定并送杭州擎科梓熙生物技术有限公司测序,测序结果正确的即为阳性转化子pP43NMK/nap-das2.3。
1.2.2 重组工程菌株的构建和验证
将重组质粒pP43NMK/nap-das2.3通过化学转化法[21-22]转化B.subtilis WB800感受态细胞,转化液涂布于含有50 μg/mL卡那霉素的LB平板上,37 ℃培养20 h左右,挑取转化子,先用溶菌酶将细胞壁溶解后,再用菌落PCR法扩增重组质粒序列,PCR扩增引物及反应条件同上,产物经9 g/L琼脂糖凝胶电泳检测,条带大小正确的PCR扩增产物送杭州擎科梓熙生物技术有限公司测序,测序结果正确的即为阳性重组工程菌株B.subtilis WB800/pP43NMK/nap-das2.3。
1.2.3 B.subtilis WB800/pP43NMK/nap-das2.3的培养和NAP-Das2.3表达
挑取LB平板上的阳性转化子,分别接种于装有5 mL含50 μg/mL卡那霉素的LB液体培养基中,于37 ℃、150 r/min培养24 h,4 ℃、9 000 r/min离心10 min,收集上清液。在50 mL具塞三角反应瓶中加入100 mmol/L N-乙酰-草铵膦的磷酸钠缓冲溶液(100 mmol/L,pH 8.0)1 mL,4 mL磷酸钠缓冲溶液(100 mmol/L,pH 8.0),于35 ℃、180 r/min水浴摇床培养0.2 mL发酵上清液,每隔5 min,取1 mL至已加入10 μL 6 mol/L HCl的1.5 mL EP管中终止反应,再加6 mol/L NaOH调回反应液pH,在12 000 r/min、4 ℃的条件下离心10 min,取上清反应液,过0.22 μm滤膜,以未加入酶液的平行样为空白对照组。200 μL反应液与400 μL衍生化试剂在35 ℃反应5 min,再加入400 μL超纯水至终体积为1 mL,经过0.22 μm孔径的滤膜过滤后进行HPLC分析。35 ℃下每分钟催化生成1 μmol L-草铵膦所需要的酶量定义为1个活力单位(U)。发酵上清液加入等体积2×还原型SDS,沸水浴10 min后,用SDS-PAGE凝胶电泳分析蛋白表达情况。
生物量(细胞干重,DCW)测定:将发酵液离心去上清后,经磷酸钠缓冲溶液(100 mmol/L,pH 8.0)洗涤2次后收集菌体,置于烘箱中,80 ℃烘至恒重。
1.2.4 摇瓶培养条件的优化
保持种子活化培养基及培养条件不变(LB培养基、37 ℃、150 r/min培养10~12 h),对发酵培养基的成分及产酶条件进行考察,进行单因子摇瓶优化实验,主要包括:不同碳氮源种类及浓度、磷酸盐、金属离子、初始培养基pH、培养温度对重组脱乙酰基酶的产酶情况及菌体生长的影响。
1.2.5 5 L发酵罐中菌体生长及产酶情况
摇瓶发酵最优条件确定后,在5 L发酵罐进行扩大,种子液接种量2%(V/V),优化后的液体培养基3 L,培养温度37 ℃,搅拌转速200 r/min,通气量0.5 VVM,自然pH,连接pH电极及溶氧(DO)电极,每隔2.5 h取样测定发酵液pH、菌体浓度和酶活力等参数。
1.3 分析方法
L-草铵膦的检测:SinoPak-C18(4.6 mm×200 mm,5 μm,伊力特)色谱柱;高效液相色谱仪Dionex UltiMate 3 000;V(甲醇)∶V(0.05 mol/L乙酸铵溶液)=10∶90(pH 5.7),流速1.0 mL/min;检测波长350 nm,发射波长450 nm;柱温35 ℃,进样体积10 μL。
衍生化试剂的配制:分别准确称取0.1 g邻苯二甲醛和0.12 g N-乙酰基-L-半胱氨酸,用10 mL无水乙醇充分溶解,随后用硼酸缓冲液(pH 9.8)定容至终体积50 mL,置于冰箱中4 ℃避光保存。
2 结果与分析
2.1 脱乙酰基酶基因的获得及其重组表达载体的构建和鉴定
2.1.1 线性化扩增载体及目的基因片段的克隆
经分别带有载体末端序列的引物F1/R1及带有目的基因末端序列的引物F2/R2扩增后,得到8 000 bp线性化载体和1 299 bp目的片段。
2.1.2 重组质粒pP43NMK/nap-das2.3构建和鉴定
目的基因扩增产物经Clean up清洗试剂盒纯化后与线性化载体扩增产物经测量浓度后,计算用量,在一步克隆试剂盒反应体系中,相互连接,并转化E.coli JM109,技术路线见图2。菌落PCR呈阳性的转化子提取质粒送至杭州擎科梓熙生物技术有限公司进行DNA测序。连接产物序列正确的菌株提取质粒待用。
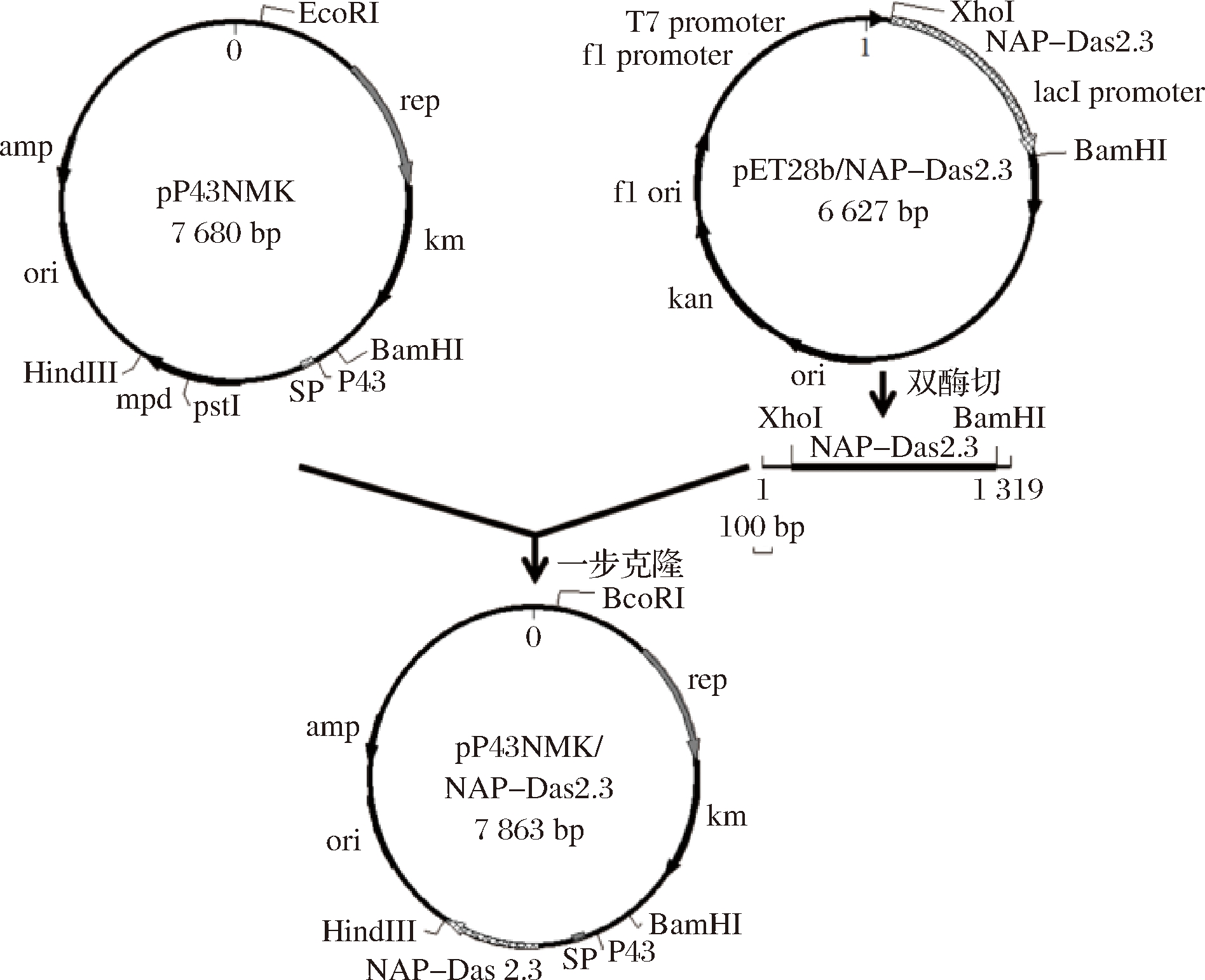
图2 重组质粒pP43NMK/nap-das2.3的构建过程
Fig.2 Construction of the recombinant plasmid pP43NMK/nap-das2.3
2.2 重组菌株的构建和菌落PCR鉴定
将重组质粒转化到B.subtilis WB800感受态中,转化液涂布于50 μg/mL卡那霉素LB平板,随机挑取单菌落提取质粒,以F2/R2为引物进行PCR验证。菌落PCR琼脂糖凝胶电泳结果显示,在8 000~12 000 bp之间有明亮的特异性条带,与预期的阳性转化子质粒大小吻合。
2.3 重组菌株的SDS-PAGE分析
挑取4个阳性转化子接种于含50 μg/mL卡那霉素的LB液体培养基,37 ℃、150 r/min培养30 h,培养液经9 000 r/min,4 ℃离心10 min,离心收集上清液。将全细胞培养液及离心上清液进行SDS-PAGE凝胶电泳检测蛋白质表达情况,结果见图3。根据氨基酸序列推算出NAP-Das2.3理论分子量是48.5 kDa。全细胞培养液和离心上清液,均出现了分子量约50 kDa的蛋白质条带,与预期的目的蛋白质大小相符,证明重组NAP-Das2.3的枯草芽孢杆菌表达系统构建成功,NAP-Das2.3成功表达。
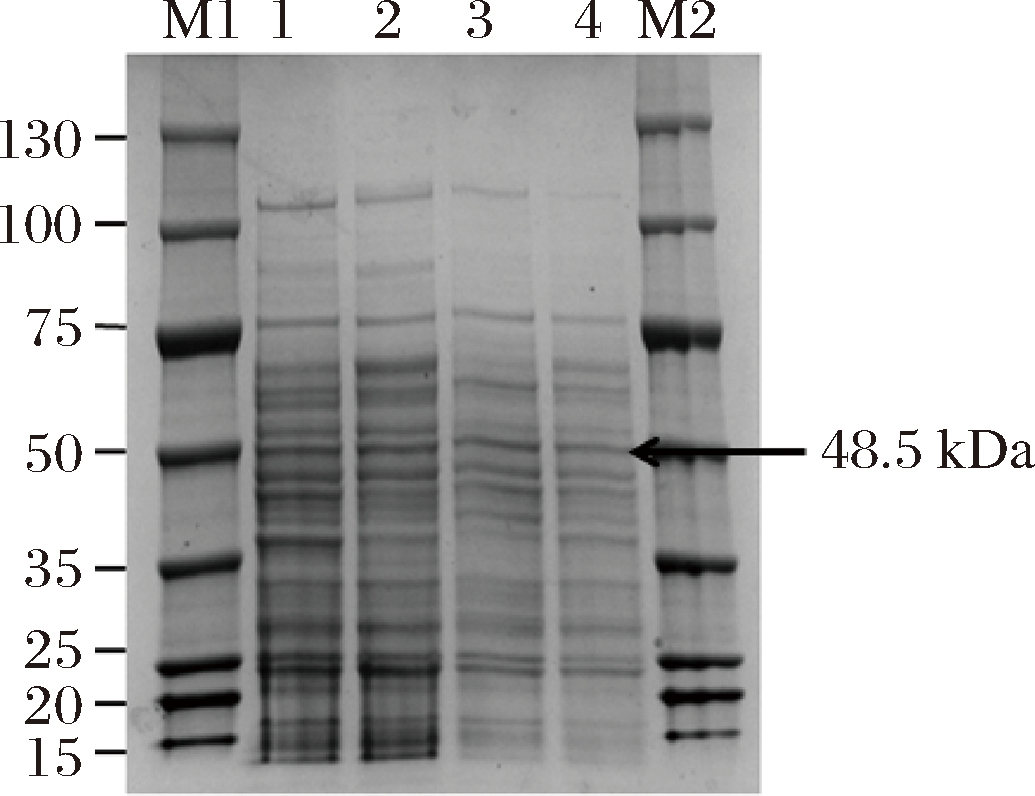
M1,M2-marker;1,2-B.subtilis WB800/pP43NMK/nap-das2.3发酵液;3,4-发酵上清液
图3 重组蛋白的SDS-PAGE分析
Fig.3 SDS-PAGE of the culture broth and supernatant of B.subtilis WB800/pP43NMK/nap-das2.3
2.4 重组菌的酶活力的测定
经检测,重组菌B.subtilis WB800/pP43NMK/nap-das2.3能够可溶性表达NAP-Das2.3,但活力较低,发酵上清液中脱乙酰基酶活力为0.25 U/L。由于NAP-Das2.3摇瓶发酵表达量及酶活较低,进一步对菌体培养及产酶条件进行优化以提高表达量。
2.5 重组菌摇瓶发酵条件的优化
2.5.1 碳源对菌体生长及产酶的影响
考察了不同有机碳源(葡萄糖、糊精、甘油、蔗糖、可溶性淀粉、麦芽糖、山梨醇、甘露醇、乳糖、D-果糖)和最优碳源质量浓度对重组菌B.subtilis WB800/pP43NMK/nap-das2.3菌体生长及产酶的影响。由图4-a可知,甘油和乳糖促进细胞产酶,发酵液中NAP-Das2.3的相对酶活分别为18.68和18.45 U/L,与对照组(不添加碳源,比酶活为15.21 U/L)相比,酶活分别提高了22.81%和21.32%,因此选择甘油作为最优碳源。这与CHOU等[23]报道的添加甘油有利于降低包涵体并提高E.coli周质青霉素G酰化酶表达量一致。
虽然D-果糖、葡萄糖、糊精对菌体生长的促进作用较大,但添加可溶性淀粉、D-果糖、山梨醇、麦芽糖、糊精和蔗糖不利于NAP-Das2.3的表达。由图4-b可知,当甘油质量浓度为6 g/L时,发酵液中的NAP-Das2.3酶活达最高,为28.53 U/L,继续增加甘油,生物量有所增大,但对NAP-Das2.3表达有抑制作用。故选择甘油的浓度为6 g/L作为菌株后续优化培养的碳源浓度。
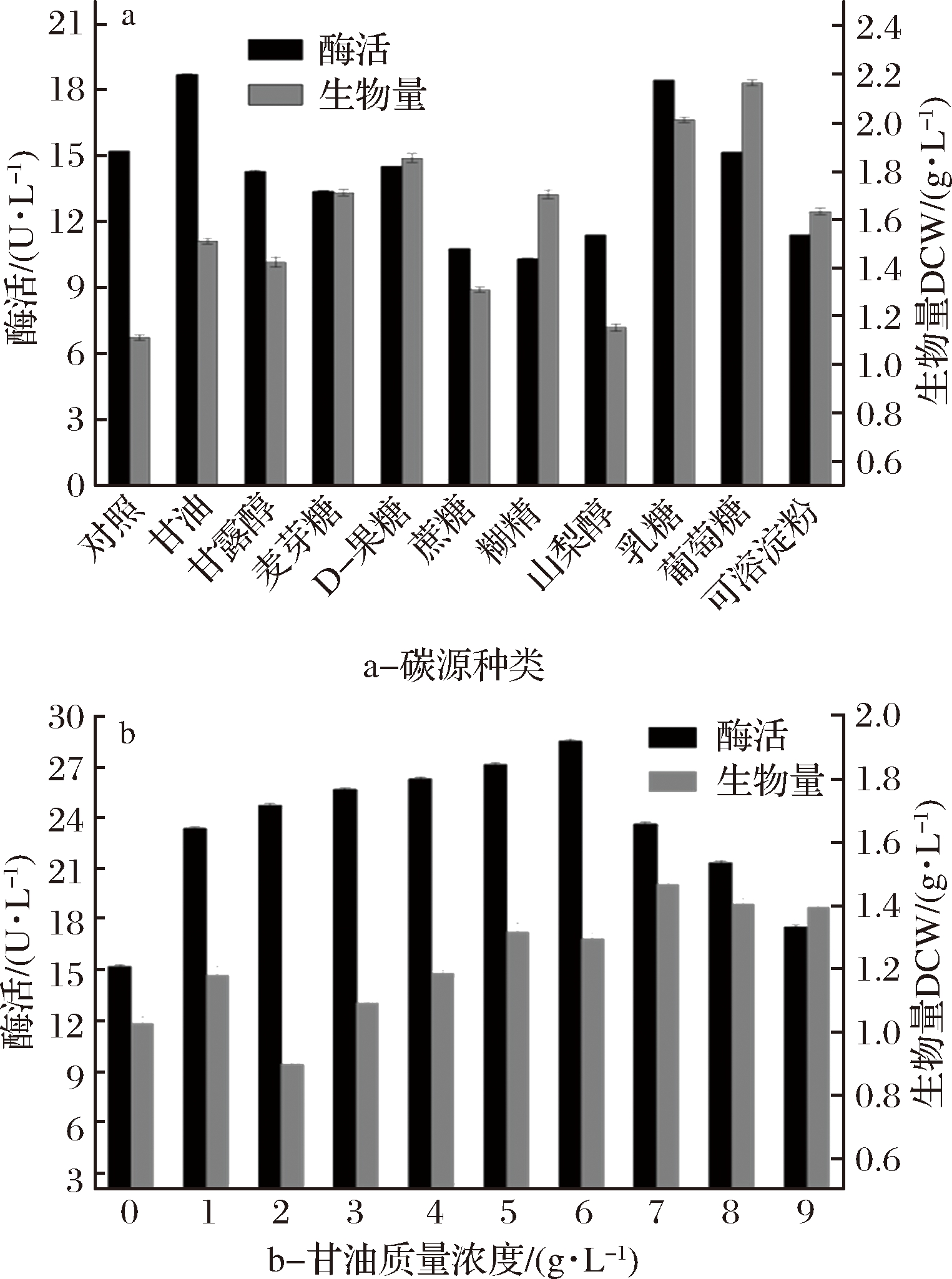
图4 碳源对B.subtilis WB800/pP43NMK/nap-das2.3生长和产酶的影响
Fig.4 Effect of carbon sources on growth and NAP-Das2.3 expression of B.subtilis WB800/pP43NMK/nap-das2.3
2.5.2 氮源对菌体生长及产酶的影响
考察了14种有机氮源及其组合(豆粕、酵母膏、玉米粉、牛肉膏、花生粉、黄豆饼粉、蛋白胨、酵母浸出汁、酵母提取物、麸皮、麦芽浸汁、牛肉膏和蛋白胨、牛肉膏和酵母粉、蛋白胨和酵母粉)和无机氮源((NH4)2SO4、NH4H2PO4、NH4Cl、CH3COONH4、HCOONH4、NaNO2、NaNO3、尿素)以及最适氮源质量浓度对重组菌生长和产酶的影响。由图5-a可知,10 g/L牛肉膏、麦芽浸汁、黄豆饼粉、玉米粉添加后,NAP-Das2.3活力均有显著提高。而且添加10 g/L牛肉膏和麦芽浸膏后,发酵液中分泌的粗酶液酶活与对照组相比分别提高了123.23%和115.07%。但组合氮源对重组菌产酶影响不显著,花生粉、豆粕、麸皮的加入反而抑制产酶。

图5 氮源对B.subtilis WB800/pP43NMK/nap-das2.3菌体生长和产酶的影响
Fig.5 Effect of nitrogen sources on growth and NAP-Das2.3 expression of B.subtilis WB800/pP43NMK/nap-das2.3
相比有机氮源,所测试的所有无机氮源都不利于菌体生长,对外源蛋白表达没有显著促进作用,并且添加(NH4)2SO4、NH4Cl、CH3COONH4、NaNO2、HCOONH4、尿素等无机氮源不利于NAP-Das2.3的表达,结果如图5-b。当牛肉膏以30 g/L(质量浓度)添加时,菌体生长及蛋白表达量均达最高值,为2.75 DCW g/L和63.22 U/L,结果如图5-c所示。
2.5.3 磷酸盐对菌体生长和产酶的影响
在上述优化后的碳源和氮源的基础上,进一步考察了NH4H2PO4、NaH2PO4、Na2HPO4、KH2PO4、K2HPO4五种磷酸盐对菌体生长和产酶的影响,磷酸盐的总添加量为10.0 g/L。由图6所示,测试的磷酸盐对产酶没有显著促进作用,而且NaH2PO4对重组菌产酶还有抑制,所以培养基中不需要额外添加磷酸盐。

图6 不同磷酸盐对B.subtilis WB800/pP43NMK/nap-das2.3生长和产酶的影响
Fig.6 Effect of phosphorus sources on growth and NAP- Das2.3 expression of B.subtilis WB800/pP43NMK/nap-das2.3
2.5.4 金属离子对菌体生长和产酶的影响
考察了13种金属离子(Co2+、Mg2+、Fe2+、Ni2+、Ba2+、Li+、Zn2+、Mn2+、Sn2+、Ca2+、Fe3+、Cu2+、Cu+)的氯化盐(2 mmol/L)和表面活性剂EDTA对菌体生长和产酶的影响。如表1所示,金属离子Fe2+、Li+、Ca2+、Cu+、Cu2+等加入均抑制菌体生长,对菌体有显著毒害,其中EDTA对菌体抑制相对较小,但所有金属离子对产酶没有显著影响(86.88%~107.10%),所以培养基中不需要添加金属离子及EDTA。
2.5.5 初始培养基pH对菌体生长和产酶的影响
如图7所示,研究了发酵培养基的初始pH(pH 5.0~9.5)对B.subtilis WB800/pP43NMK/nap-das 2.3的生长及产酶的影响。初始pH对菌体生长没有显著影响,但对菌株产酶影响较为明显。当pH<6.5时,重组酶活力较低,初始pH在6.5~8.0,NAP-Das2.3活力较高,在pH 7.5时菌株的酶活力达到最高,为68.21 U/L。pH继续增大时,酶活力下降趋势明显,因此选择pH 7.5作为培养该菌株时的培养基初始pH。
表1 不同金属离子及EDTA对B.subtilis WB800/ pP43NMK/nap-das2.3生长及产酶的影响
Table 1 Effect of different metal ions and EDTA on growth and NAP-Das2.3 expression of B.subtilis WB800/ pP43NMK/nap-das2.3
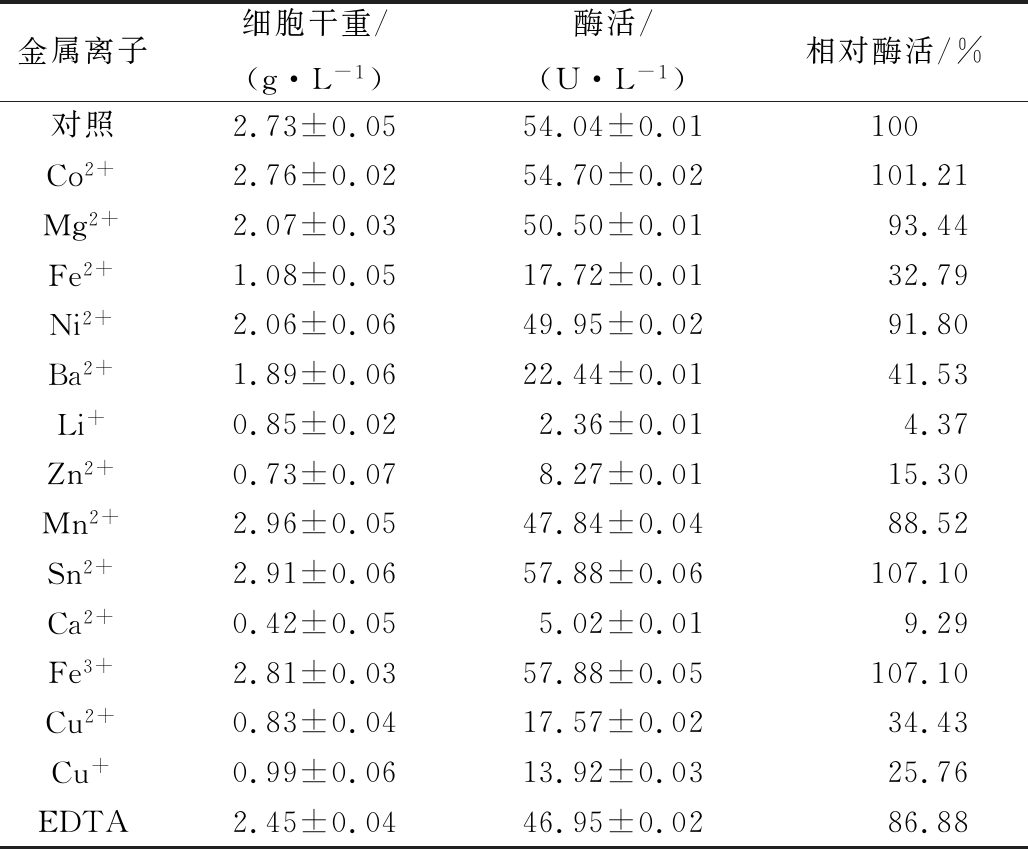
金属离子细胞干重/(g·L-1)酶活/(U·L-1)相对酶活/%对照2.73±0.0554.04±0.01100Co2+2.76±0.0254.70±0.02101.21Mg2+2.07±0.0350.50±0.0193.44Fe2+1.08±0.0517.72±0.0132.79Ni2+2.06±0.0649.95±0.0291.80Ba2+1.89±0.0622.44±0.0141.53Li+0.85±0.022.36±0.014.37Zn2+0.73±0.078.27±0.0115.30Mn2+2.96±0.0547.84±0.0488.52Sn2+2.91±0.0657.88±0.06107.10Ca2+0.42±0.055.02±0.019.29Fe3+2.81±0.0357.88±0.05107.10Cu2+0.83±0.0417.57±0.0234.43Cu+0.99±0.0613.92±0.0325.76EDTA2.45±0.0446.95±0.0286.88
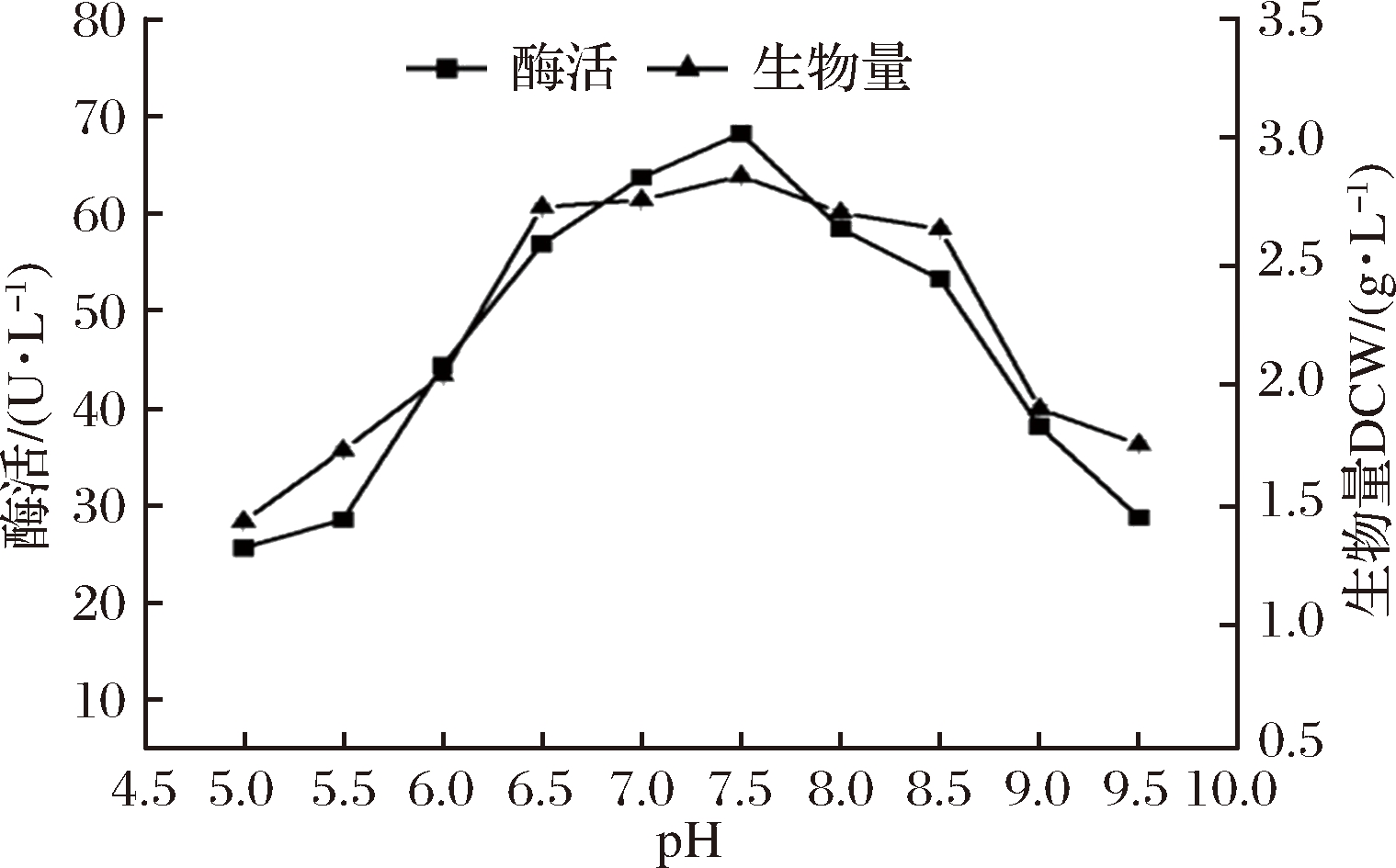
图7 初始pH对B.subtilis WB800/pP43NMK/nap-das2.3生长和产酶的影响
Fig.7 Effect of initial pH on growth and NAP-Das2.3 expression of B.subtilis WB800/pP43NMK/nap-das2.3
2.5.6 培养温度对菌体生长及产酶的影响
在最适碳氮源及其最适浓度,以及最适培养初始pH条件下,进一步研究了培养温度对菌体生长和NAP-Das2.3酶活力的影响。选择20、25、28、30、35、37、40、45 ℃进行考察,结果如图8所示,温度低于25 ℃时,不利于菌株的生长和NAP-Das2.3的表达,温度在28~37 ℃范围内,菌体生长良好且酶活力随着温度的升高而大幅度增大,菌株在37 ℃条件下生长状态最佳,且此时酶活力最高,发酵液中酶活力达106.42 U/L。温度进一步升高,酶活及菌体浓度降低,因此选择培养温度为37 ℃进行菌体培养及发酵产酶。
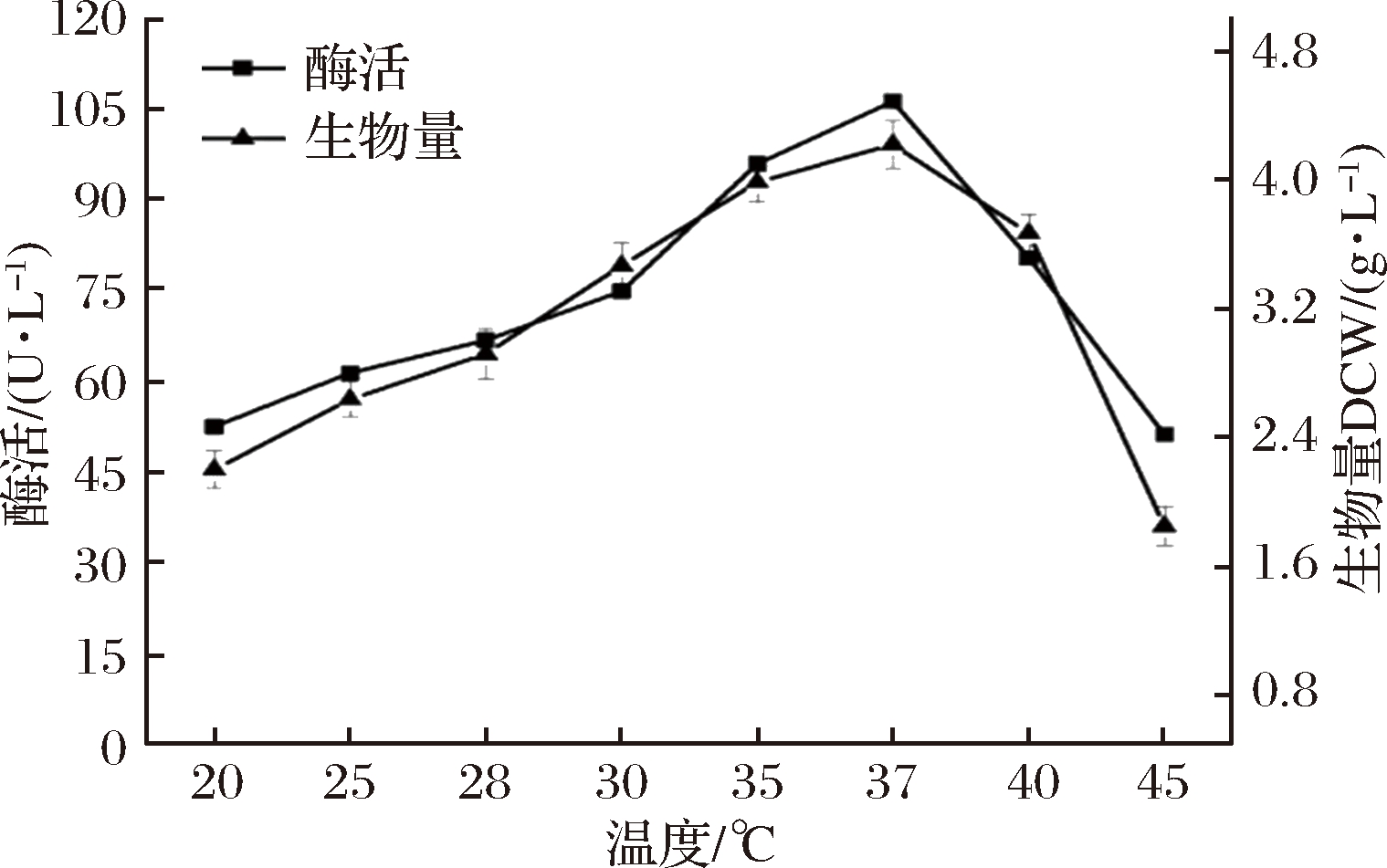
图8 培养温度对B.subtilis WB800/pP43NMK/nap-das2.3生长和产酶的影响
Fig.8 Effect of temperature on growth and NAP-Das2.3 expression of B.subtilis WB800/pP43NMK/nap-das2.3
2.6 5 L发酵罐中重组菌的生长及产酶情况
将保藏的B.subtilis WB800/pP43NMK/nap-das2.3活化后接种500 mL摇瓶,37 ℃培养12 h作为发酵种子液,以2%接种量转接至3 L优化后的液体培养基中发酵培养,37 ℃,200 r/min,通气量为0.5 VVM,自然pH,用pH电极及溶氧(DO)电极检测发酵液的pH和溶氧,定时取样测定发酵液的pH、菌体浓度并测定酶活力等参数,结果如图9所示。
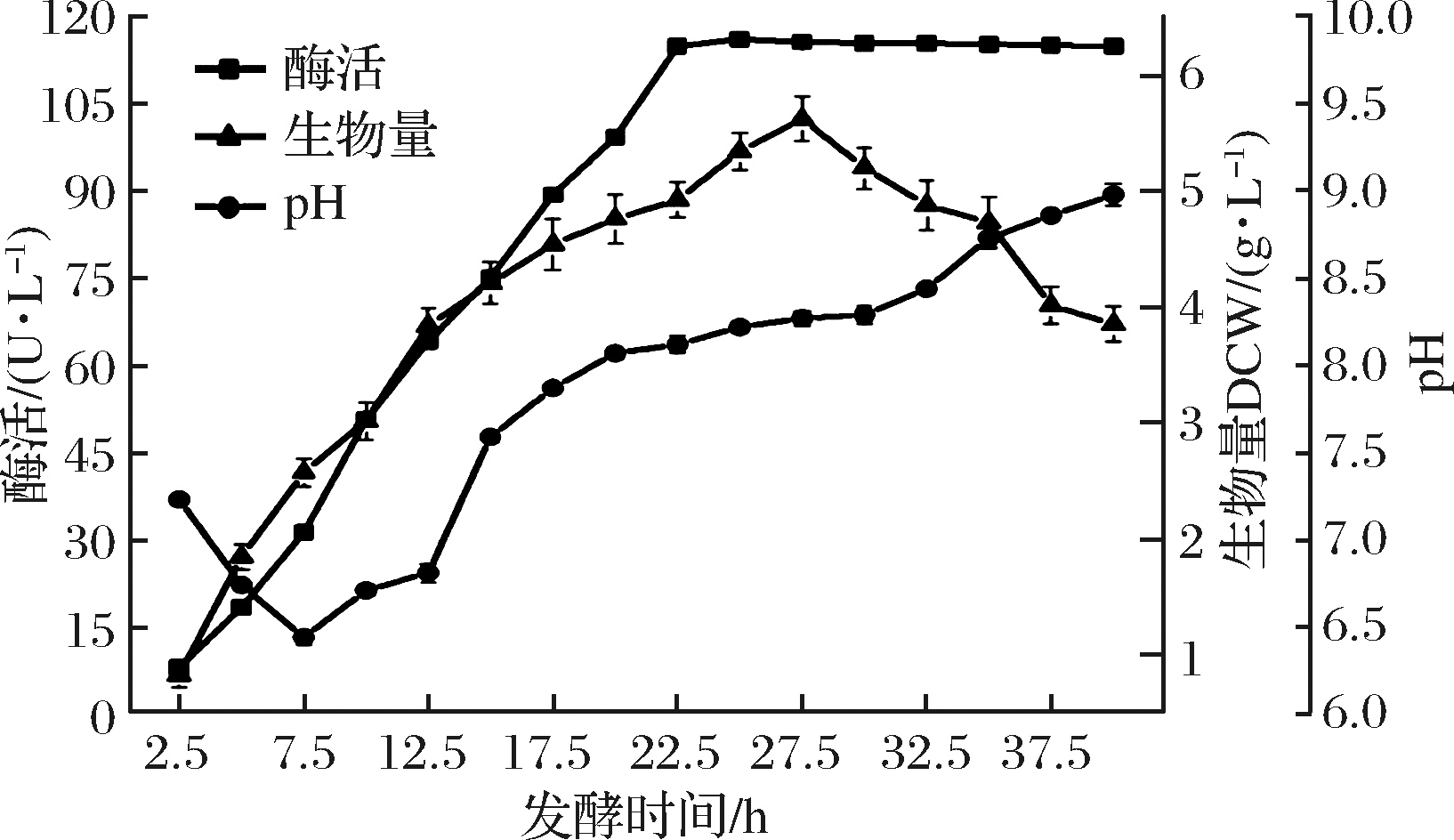
图9 5 L发酵罐中B.subtilis WB800/pP43NMK/nap-das2.3的生长和产酶曲线
Fig.9 Time course of cell growth and NAP-Das2.3 expression of B.subtilis WB800/pP43NMK/nap-das2.3 in 5 L bioreactor
在菌体培养过程中,培养体系pH随培养时间的增加先略微下降再逐渐升高,这可能因为在前期菌体生长过快,导致溶氧不足发生厌氧呼吸产生酸导致pH下降,后期随着氮源的利用,释放出氨及菌体自溶导致pH上升。发酵菌体生长在22.5 h后开始稳定产酶,此时菌体生长处在稳定中后期,说明NAP-Das2.3主要是在稳定中后期完成加工成熟。培养至25 h时,酶活力达到最大116.13 U/L并稳定不变,而生物量在培养至27.5 h时达最大5.63 g/L,之后菌株进入衰亡期开始裂解,生物量和比酶活开始下降。
目前,利用基因工程手段对脱酰基酶进行异源重组表达的报道较多。如舒群峰等[24]将黏质沙雷氏菌Serratia marcescens Y213来源的SmargE基因编码的N-乙酰鸟氨酸脱乙酰基酶在L-鸟氨酸生产菌株Corynebacterium crenatum SYPO-1中过量表达,显著提高了酶活力,重组菌在5 L发酵罐中发酵96 h,L-鸟氨酸产量较出发菌株提高了33.2%,但该酶是在细胞内表达,对脱乙酰基酶催化的脱乙酰基反应而言,胞外可溶性表达可以减少酶的分离纯化步骤,有利于酶的固定化等,使用酶蛋白进行催化也可以减少副产物的形成。WANG等[25]将来自Aspergillus nidulans的几丁质脱乙酰基酶基因异源表达于Escherichia coli BL21,经诱导后的酶活为4.17 U/mg,但是该酶以包涵体形式表达。而本研究利用枯草芽孢杆菌表达系统实现了脱乙酰基酶NAP-Das2.3的分泌型可溶性表达,这与KANG等[26]将来自Colletotrichum lindemuthianum的几丁质脱乙酰基酶基在毕赤酵母(Pichia pastoris)GS115中异源分泌表达一样,有助于脱乙酰基酶的纯化、固定化及应用。
3 结论
本文将具有立体选择性的脱乙酰基酶基因克隆至枯草芽孢杆菌受体细胞中,构建了重组菌B.subtilis WB800/pP43NMK/nap-das2.3,并成功实现胞外分泌。进一步对重组菌培养及发酵产酶条件进行了优化,在此条件下,重组蛋白的表达水平由最初的0.25 U/L提高至106.42 U/L,优化后酶活提高了424.68倍。在5 L发酵罐中用优化的培养基培养30 h后,NAP-Das2.3活力达到116.13 U/L,较初始条件,酶活提高了463.52倍。
本研究构建了能够可溶性表达草铵膦特异性脱乙酰基酶的基因工程菌B.subtilis WB800/pP43NMK/nap-das2.3,一定程度上解决了脱乙酰基酶高效异源表达形成包涵体及表达量低的问题,且能直接组成型分泌表达脱乙酰基酶于发酵液中,为重组酶的分离纯化带来便利。综上所述,本研究实现了重组脱乙酰基酶的高效可溶性表达,为其在L-草铵膦合成应用中提供了基础,也为其他脱乙酰基酶的开发提供了借鉴。
[1] COLE M.Properties of the penicillin deacylase enzyme of Escherichia coli[J].Nature,1964,203(4 944):519-520.
[2] ENDO Y.N-Acyl-L-aromatic amino acid deacylase in animal tissues[J].Biochimica Et Biophysica Acta,1978,523(1):207-214.
[3] KUCHAR L,LEDVINOVA J,LENFELD J,et al.Synthesis of specific sphingolipids isoforms using immobilized sphingolipid ceramide N-deacylase[J].Journal of Inherited Metabolic Disease,2008,31:107-107.
[4] HUANG F T,HAN Y B,FENG Y,et al.A facile method for controlling the reaction equilibrium of sphingolipid ceramide N-deacylase for lyso-glycosphingolipid production.Journal of Lipid Research,2015,56(9):1 836-1 842.
[5] LIU J,JIA Z,SHA L,et al.Identification and characterization of a chitin deacetylase from a metagenomic library of deep-sea sediments of the Arctic Ocean[J].Gene,2016,590(1):79-84.
[6] ZHAO Y,PARK R D,MUZZARELLI R A A.Chitin deacetylases:properties and applications[J].Marine Drugs,2010,8(1):24-46.
[7] GRIFOLL-ROMERO L,PASCUAL S,ARAGUNDE H,et al.Chitin deacetylases:Structures,specificities,and biotech applications[J].Polymers,2018,10(4):352.
[8] ROMANO D,GANDOLFI R,GUGLIELMETTI S,et al.Enzymatic hydrolysis of capsaicins for the production of vanillylamine using ECB deacylase from Actinoplanes utahensis[J].Food Chemistry,2011,124(3):1 096-1 098.
[9] 崔建卫,邹树平,郑裕国.棘白菌素B脱酰基酶的研究[J].生物技术通讯,2016,27(4):592-595.
[10] SHAO L,LI J,LIU A J,et al.Efficient bioconversion of Echinocandin B to its nucleus by overexpression of deacylase genes in different host strains[J].Applied and Environmental Microbiology,2013,79(4):1 126-1 133.
[11] YANG H,ZHENG G,PENG X,et al.D-amino acids and D-Tyr-tRNATyr deacylase:Stereospecificity of the translation machine revisited[J].Febs Letters,2003,552(2):95-98.
[12] SINGH S M,PANDA A K.Solubilization and refolding of bacterial inclusion body proteins[J].Journal of Bioscience &Bioengineering,2005,99(4):303-310.
[13] WALID M Q,HESTERBERG L K,SEEFELDT M B.Confronting high-throughput protein refolding using high pressure and solution screens[J].Protein Expression &Purification,2007,55(2):209-224.
[14] CINTIA R,AMIR A,TAWFIK D S.Directed evolution of proteins for heterologous expression and stability[J].Current Opinion in Structural Biology,2005,15(1):50-56.
[15] 张宇萌,童梅,陆小冬,等.提高大肠杆菌可溶性重组蛋白表达产率的研究进展[J].中国生物工程杂志,2016,36(5):118-124.
[16] 朱红裕,李强.外源蛋白在大肠杆菌中的可溶性表达策略[J].过程工程学报,2006,6(1):150-155.
[17] SINGH S M,APARMA S,UPADHYAY A K,et al.Solubilization of inclusion body proteins using n-propanol and its refolding into bioactive form[J].Protein Expression &Purification,2012,81(1):75-82.
[18] 刘晓庆,那日,郭九峰.漆酶基因异源表达及其酶活性的研究进展[J].安徽农业科学,2016,44(1):18-21.
[19] BERIAULT J N,HORSMAN G P,DEVINE M D.Phloem transport of D,L-glufosinate and acetyl-L-glufosinate in glufosinate-resistant and -susceptible Brassica napus[J].Plant Physiology,1999,121(2):619-627.
[20] ZHANG H C,YANG J,YANG G W,et al.Production of recombinant protein G through high-density fermentation of engineered bacteria as well as purification[J].Molecular Medicine Reports,2015,12(2):3 132-3 138.
[21] SPIZIZEN J.Transfomation of biochemically deficient strain of Bacilius subtilis by deoxyribonucleate[J].Proceedings of the National Academy of Science USA,1958,44(10):1 072-1 078.
[22] 李瑞芳,薛雯雯,黄亮,等.枯草芽孢杆菌感受态细胞的制备及质粒转化方法研究[J].生物技术通报,2011(5):227-230.
[23] CHOU C P,TSENG J H.Effect of carbon on inclusion body formation upon overproduction of periplasmic penicillin acylase in Escherichia coli[J].Journal of the Chinese Institute of Chemical Engineers,2000,31(3):219-224.
[24] 舒群峰,徐美娟,李静,等.钝齿棒杆菌中异源表达N-乙酰鸟氨酸脱乙酰基酶合成L-鸟氨酸的研究[J].中国生物工程杂志,2018,38(7):29-39.
[25] WANG Y,SONG J Z,YANG Q,et al.Cloning of a heatstable chitin deacetylase gene from Aspergillus nidulans and its functional expression in Escherichia coli[J].Applied Biochemistry and Biotechnology,2010,162(3):843-854.
[26] KANG L,CHEN X,ZHAI C,et al.Synthesis and high expression of chitin deacetylase from Colletotrichum lindemuthianum in Pichia pastoris GS115[J].Journal of Microbiology and Biotechnology,2012,22(9):1 202-1 207.