近年来,膳食结构改变导致糖尿病、脂肪肝、心血管疾病等慢病发病率在全球不断攀升[1]。临床研究显示,慢病的发生与氧化应激有密不可分的联系,氧化应激导致的肺纤维化造成了肺组织顺应性减退,弥散功能降低,最终导致患者出现难治性呼吸困难,严重危害人类生命健康[2-6]。因此调节氧化应激水平具有降低疾病发生风险和管理疾病的重要作用[7]。
燕窝作为一种历史悠久的保健食材,美容养颜、润肺生津[8-9]。早在唐朝,燕窝已深受宫廷贵族的青睐,现代研究表明,燕窝中丰富的生物活性成分葡萄糖胺、乳铁蛋白、唾液酸、氨基酸、脂肪酸、维生素、矿物质和抗氧化剂等具有抗炎、抗氧化及强化骨骼的作用[8,10-14]。更有研究证明,燕窝提取物可通过调节肝脏抗氧化和炎症相关基因的转录,对高脂饮食诱导的氧化应激和炎症有一定的抑制作用[15-17]。
皮肤创伤修复的基本方式是通过伤后再生的细胞和细胞间质填充、连接或代替损伤组织,因此细胞增生是创伤修复的重要过程[18]。皮肤衰老是由于表皮角质形成对细胞生长和更新速度减慢,胶原和弹性纤维合成能力下降,表皮和真皮变薄导致皮肤拉伸后弹性恢复力减弱。因此,在皮肤松弛、皮肤损伤修复、抗老化过程中,表皮角质形成细胞的生长、分化至关重要。燕窝中的活性成分具有促表皮角质形成细胞生长的能力。但是传统燕窝的加工一般采用高温炖煮的方式,往往伴随燕窝中的有效成分热损失,采用低温鲜炖加工工艺生产的“95°鲜燕窝”,可使细胞中的活性成分得到有效保留。H2O2是一种强氧化剂,易于穿透细胞膜,与胞内Fe3+反应形成自由基,导致胞内脂质、蛋白质及DNA损伤[19-21]。本研究选取H2O2诱导MRC-5细胞氧化应激损伤模型比较传统工艺制作的燕窝与“95°鲜燕窝”的抗氧化能力;并通过Hacat细胞初步探究了2种燕窝提取提取物物及燕窝肽促进皮肤角质细胞(Hacat)生长能力的差别。
1 材料与方法
1.1 材料与试剂
MRC-5细胞、Hacat细胞,购自中国医学科学院基础医学研究所;传统工艺加工燕窝,实验室制备;“95°鲜燕窝”、燕窝肽,玖拾五度鲜生物科技有限公司提供;MEM(modified eagle medium)培养基、MEM(含NEAA)培养基、平衡盐缓冲液(Hank’s balanced salt solution,HBSS),中科迈晨科技有限公司;胎牛牛血清(fetal bovine serum,FBS),美国Gibco;Cell Counting Kit-8(CCK-8)试剂盒、2,7-二氯二氢荧光素二乙酸酯(2,7-Dichlorodi-hydrofluorescein diacetate,DCFH-DA),胰蛋白酶,RIPA裂解液、BCA蛋白浓度测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒,碧云天生物技术研究所。
1.2 仪器与设备
生物安全柜,济南鑫贝西生物技术有限公司;CO2培养箱,松下公司;倒置生物显微镜(CKX41),奥林巴斯公司;分析天平,梅特勒-托利多仪器有限公司;pH计,上海雷磁仪器厂;Spectra Max酶标仪(i3),MD公司;超声波清洗仪(KQ-250DE),昆山超声仪器有限公司;高速冷冻离心机(GL-20G-Ⅱ型),上海安亭科学仪器厂;冷冻干燥机,北京松源华兴科技发展有限公司。
1.3 实验方法
1.3.1 样品提取
分别取75 g “95°鲜燕窝”和传统燕窝加入适量的水混匀后剪切10 min,于高速冷冻离心机7 500 r/min,4 ℃条件下离心10 min,取上清于50 mL离心管中,放入冷冻干燥机进行冻干,冻干后回收样品水提物进行下一步实验。
1.3.2 细胞的体外培养
1.3.2.1 MRC-5细胞的培养
MRC-5细胞培养于含有10%FBS、青霉素100 U/mL和链霉素100 U/mL的MEM培养基中,于37 ℃、含5%CO2以及90%相对湿度的培养箱中常规培养。当细胞生长至对数生长期时进行实验。
1.3.2.2 Hacat细胞的培养
Hacat细胞培养于含有10%FBS、青霉素100 U/mL和链霉素100 U/mL的MEM(NESS)培养基中。培养条件同1.3.2.1。
1.3.3 MRC-5氧化应激细胞模型的构建
1.3.3.1 H2O2的CCK-8细胞毒理学实验
取96孔培养板,每孔加100 μL细胞悬液,细胞浓度为1×105个/mL,37 ℃培养24 h后弃去培养液,用HBSS清洗一次,每孔加入50、100、150、200、250、300、400、500 μmol/L 8个不同浓度H2O2 100 μL,以无H2O2的相同培养基孵育细胞为对照,培养24 h后每孔加入10 μL CCK-8溶液于37 ℃避光孵育2 h。用酶标仪在450 nm处测定吸光度。以对照组细胞的细胞存活率为100%计算其余组别细胞存活率。
1.3.3.2 氧化应激细胞模型的构建
选取对细胞生长无显著影响的H2O2浓度诱导氧化应激细胞模型,各组细胞加样处理24 h后,小心弃去培养液,用HBSS洗1次,用RIPA裂解液裂解30 min后,按试剂盒说明书步骤测定细胞内SOD、GSH-PX水平。各组细胞加样处理24 h后,小心弃去培养液,HBSS洗1次,加入25 μmol的DCFH-DA作用30 min,吸出DCFH-DA用HBSS洗2次,每孔加入300 μL胰酶消化5 min后,用700 μL完全培养基终止消化,吹打均匀后用流式细胞仪测定荧光强度。结果以模型组ROS含量的百分比表示(%)。
1.3.4 燕窝水提物及燕窝肽对MRC-5细胞氧化应激损伤的预保护作用
1.3.4.1 燕窝水提物及燕窝肽的CCK-8细胞毒理学实验
分别选取200、400、500、600、800、1 000 μg/mL 5个不同浓度的燕窝水提物及燕窝肽测定3种样品对MRC-5细胞增殖的影响,实验方法同1.3.3.1。
1.3.4.2 实验分组
在建立的氧化应激细胞模型的基础上观察两种燕窝水提物及燕窝肽对氧化应激损伤细胞产生的预保护作用。
将细胞以3.5×106个/mL的浓度接种于96孔板,待细胞贴壁并长满时,用HBSS润洗细胞一次,加入不同的处理液。细胞分组为对照组:纯培养基、模型组:300 μmol/L H2O2组以及模型组中提前加入各燕窝水提物孵育2 h的实验组(终浓度200~400 μg/mL)。细胞上样前用HBSS缓冲液洗1次,上样后37 ℃孵育24 h,测定各组的SOD、ROS、MDA、GSH-PX,测定方法同1.3.3.2。
1.3.5 燕窝水提物及燕窝肽对Hacat细胞增殖的影响
分别选取10、25、50、100、200、300、400、500 μg/mL 8个不同浓度的燕窝水提物及燕窝肽测定3种样品对Hacat细胞增殖的影响,实验方法同1.3.3.1。
1.3.6 统计学处理
实验数据采用采用Origin 8.5统计软件进行分析,结果用![]() 表示。并对实验结果进行配对t检验,*表示显著差异(P<0.05)。
表示。并对实验结果进行配对t检验,*表示显著差异(P<0.05)。
2 结果与分析
2.1 MRC-5氧化应激细胞模型的构建
2.1.1 H2O2对MRC-5细胞增殖的影响
如图1所示,由于H2O2对细胞具有一定的损伤作用,随着H2O2浓度的增加细胞存活率显著下降。当H2O2浓度达到250 μmol/L显著抑制细胞生长(P<0.05),H2O2达到400 μmol/L时,对细胞的抑制率大于50%,严重影响细胞的生长繁殖。因此后续诱导氧化应激模型实验中选择上样浓度为100、150、200、250、300 μmol/L。

图1 不同浓度H2O2对MRC-5细胞活力的影响
Fig.1 Effects of different concentrations of H2O2 on the viability of MRC-5 cells
注:*P<0.05(相对于对照组)。下同。
2.1.2 氧化应激细胞模型的构建
ROS是氧化应激的主要标志物之一,产生氧化应激损伤的主要原因是体内生成的ROS超出了机体生理范围量。ROS持续高浓度存在,会导致肺纤维化、动脉粥样硬化等疾病的发生。由图2可知,H2O2处理24 h后,低浓度的H2O2会引起细胞内ROS含量降低,这说明当细胞内氧化应激水平较低时,能够通过自身的抗氧化能力降低ROS含量,减轻氧化应激对细胞带来的损伤,但是随着H2O2浓度不断升高导致氧化应激水平较高时,ROS含量就会超出自身调节的范围就会并对细胞造成伤害。
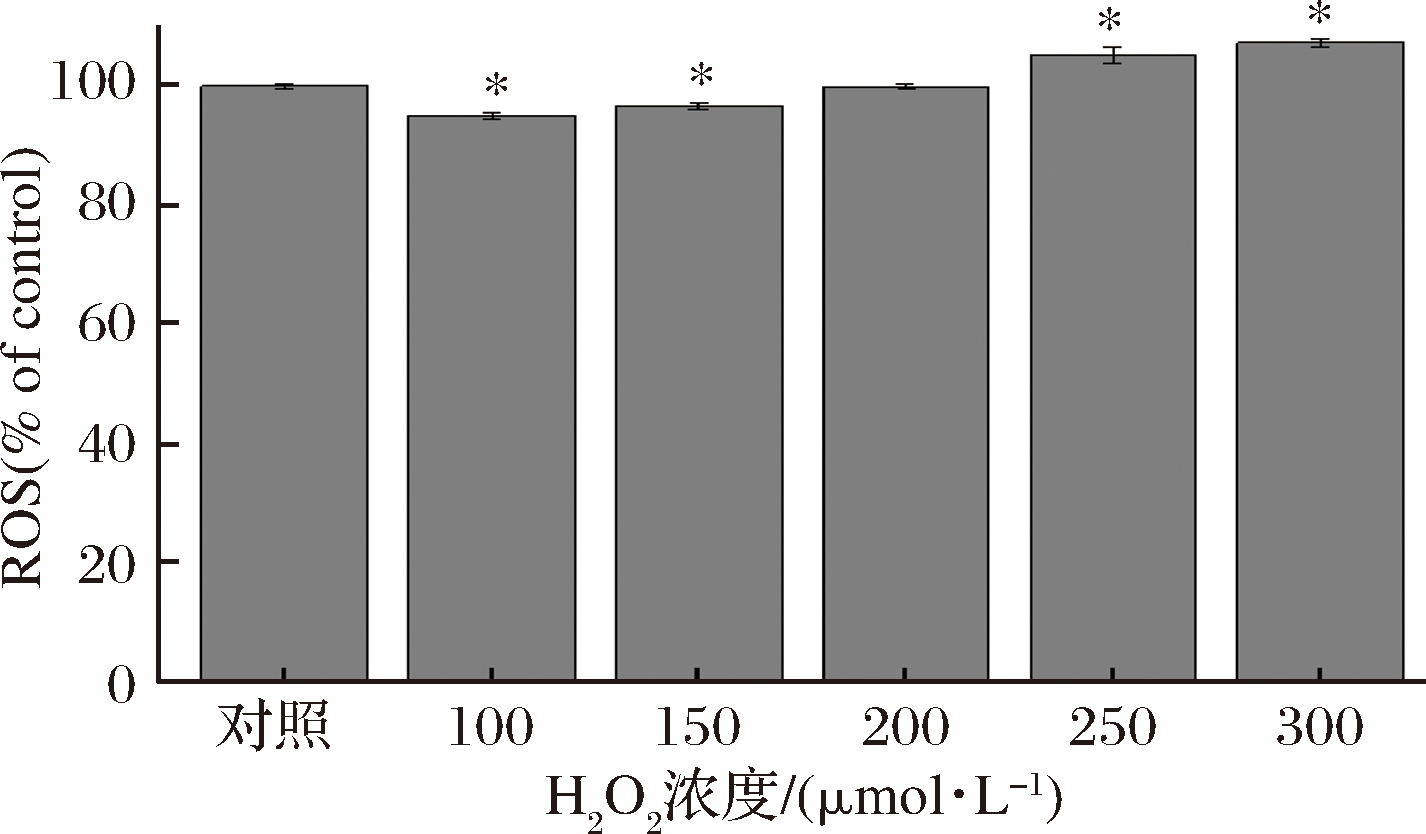
图2 H2O2处理对MRC-5细胞内ROS的影响
Fig.2 Effect of H2O2 treatment on ROS content in MRC-5 Cells
SOD是机体抗氧化的主要酶类之一,SOD活力也是判定化合物抗氧化能力的指标之一。由图3可知,H2O2处理24 h后,SOD活力呈先增加后降低的趋势,这种趋势与ROS的结果相一致,细胞出现轻度的氧化应激时,能够增加SOD的酶活力来缓解氧化应激,从而减低对细胞带来的损伤,但是当氧化应激超出自身调节的范围时就会抑制SOD的酶活力,此时不断增多的ROS对细胞造成损伤。
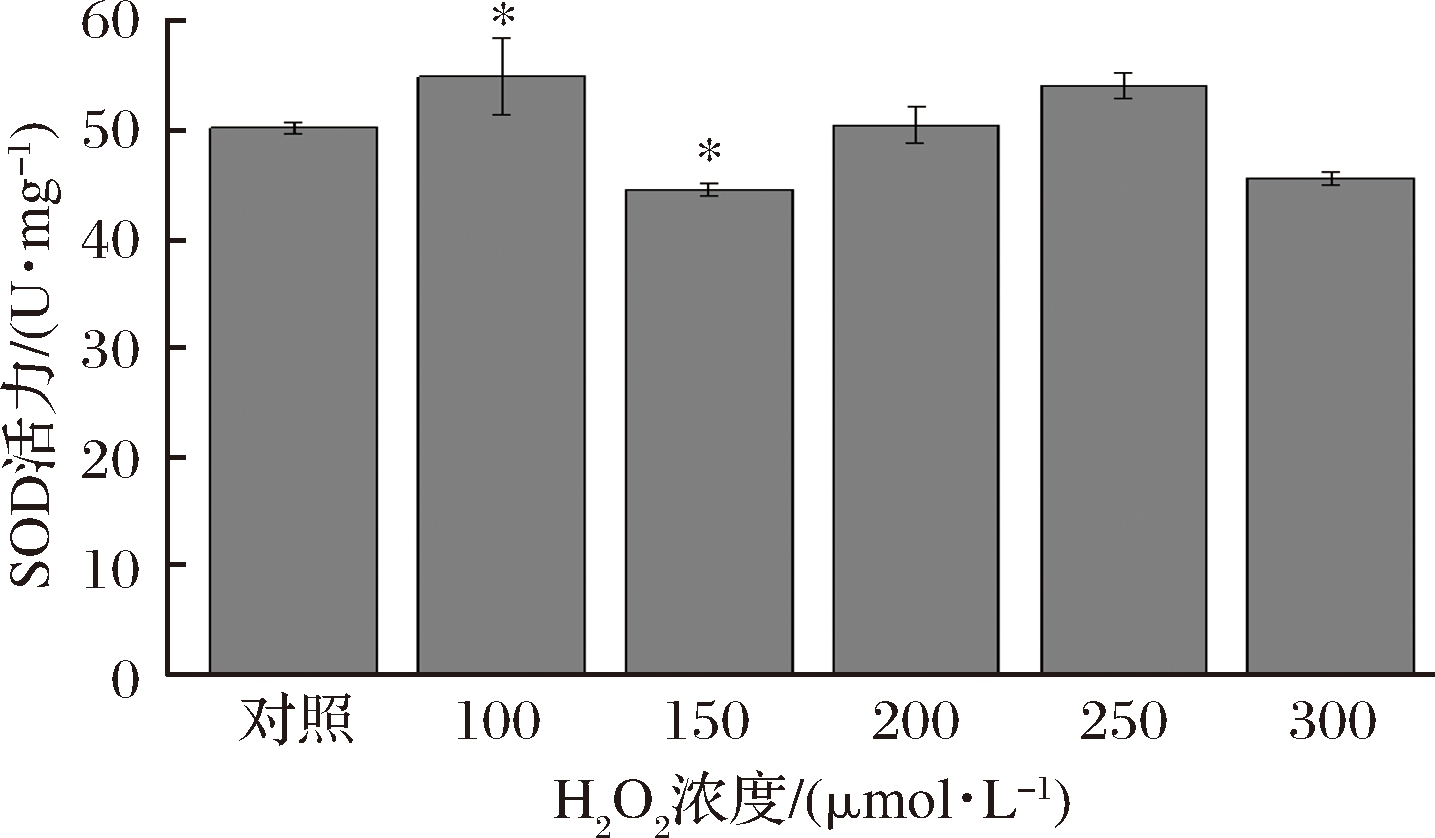
图3 H2O2处理对MRC-5细胞内SOD活力的影响
Fig.3 Effect of H2O2 treatment on SOD activity in MRC-5 Cells
综上所述,当H2O2达到300 μmol/L时,ROS含量显著增加(P<0.05),SOD含量降低证明细胞出现氧化应激损伤,因此选择300 μmol/L H2O2为最终造模浓度。
2.2 燕窝水提物及燕窝肽对MRC-5细胞氧化应激损伤的预保护作用
2.2.1 燕窝水提物及燕窝肽对MRC-5细胞增殖的影响
由图4可知,低浓度(600 μg/mL以下)的“95°鲜燕窝”水提物及燕窝肽促进细胞生长,高浓度(800 μg/mL以上)“95°鲜燕窝”水提物及传统燕窝提取物抑制细胞生长。综合上述实验结果,3种样品在200~400 μg/mL不影响MRC-5细胞生长活力,因此选择此浓度范围进行后续的预保护实验。
2.2.2 燕窝水提物及燕窝肽对MRC-5细胞氧化应激损伤的预保护作用
由图5可知,与对照组相比模型组ROS含量显著增加(P<0.05),表明MRC-5细胞出现了氧化应激损伤。与模型组相比,“95°鲜燕窝”水提物和燕窝肽在200~400 μg/mL预处理2h能显著降低ROS含量(P<0.05),且随着浓度的增加呈剂量依赖性降低胞内ROS含量。传统燕窝水提物在200 μg/mL对ROS含量无显著影响,在300、400 μg/mL时呈剂量依赖性显著降低ROS含量(P<0.05)。实验结果表明3种样品均能显著降低ROS含量,“95°鲜燕窝”水提物在低浓度时能够发挥较好的ROS清除能力。
MDA是细胞膜脂质过氧化最重要的产物之一,它的生成表明细胞出现氧化应激损伤。由图6可知,与对照组相比模型组MDA含量显著增加(P<0.05),表明模型组出现氧化应激。与模型组相比,“95°鲜燕窝”水提物在400 μmol/L预处理2 h显著降低MDA含量(P<0.05),燕窝肽在300 μmol/L预处理2 h显著降低MDA含量(P<0.05)。因此,“95°鲜燕窝”、燕窝肽能有效清除胞内MDA,减轻细胞的氧化应激损伤,传统燕窝水提物对MDA含量没有显著影响。
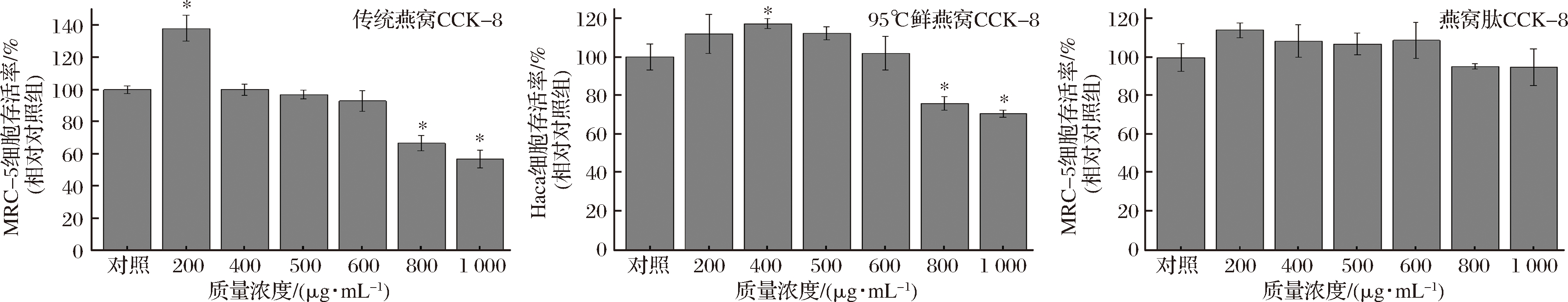
图4 不同浓度燕窝及燕窝肽对MRC-5细胞活力的影响
Fig.4 Effects of different concentrations of bird's nest extract and bird′s nest peptide on the viability of Mrc-5 cells
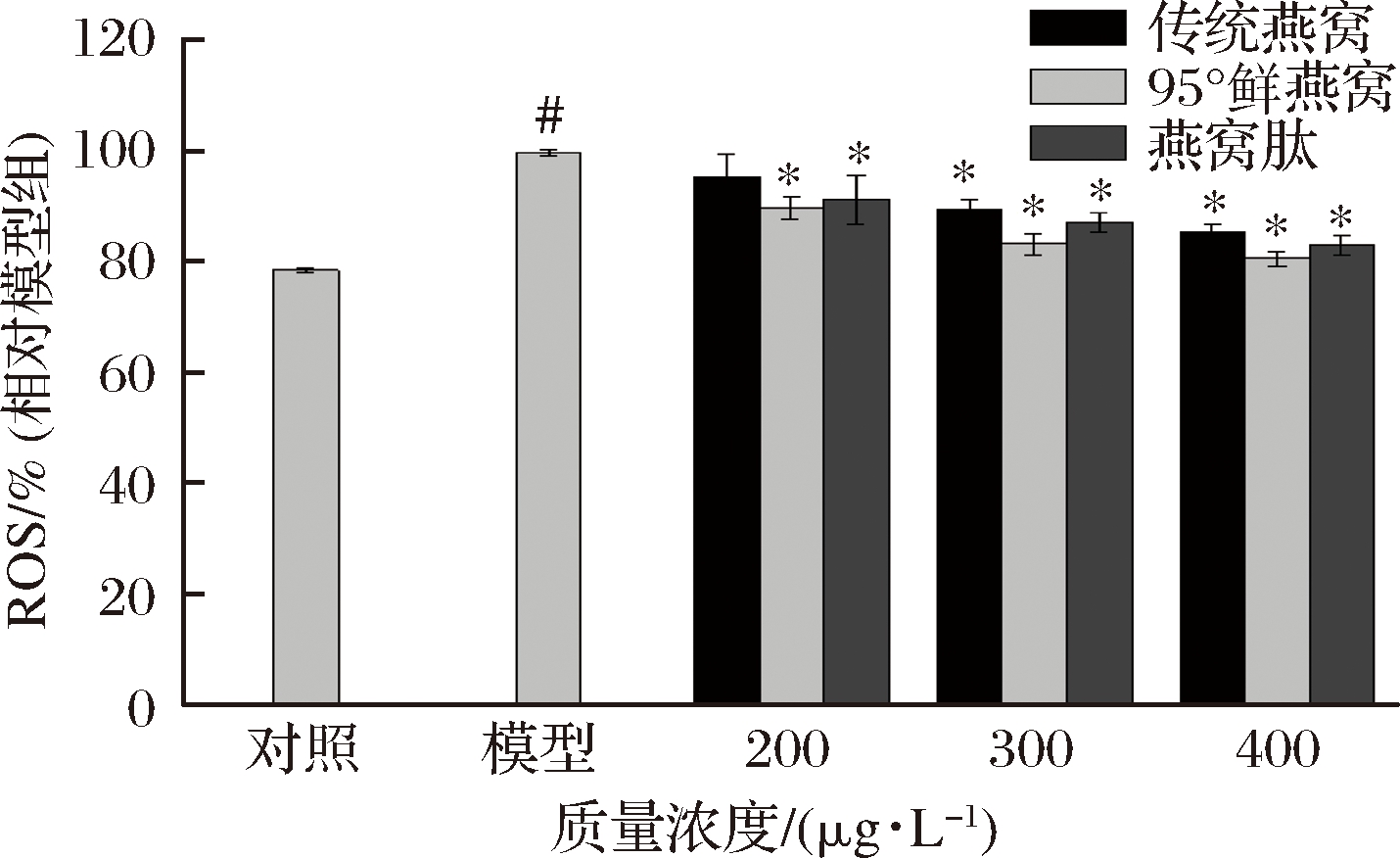
图5 燕窝水提物及燕窝肽对MRC-5细胞内ROS的影响
Fig.5 Effects of bird's nest extract and bird′s nest peptide on ROS content in MRC-5 cells
注:燕窝提取物及燕窝肽对MRC-5细胞内ROS的影响![]() #P<0.05 vs对照组,*P<0.05 vs模型组
#P<0.05 vs对照组,*P<0.05 vs模型组
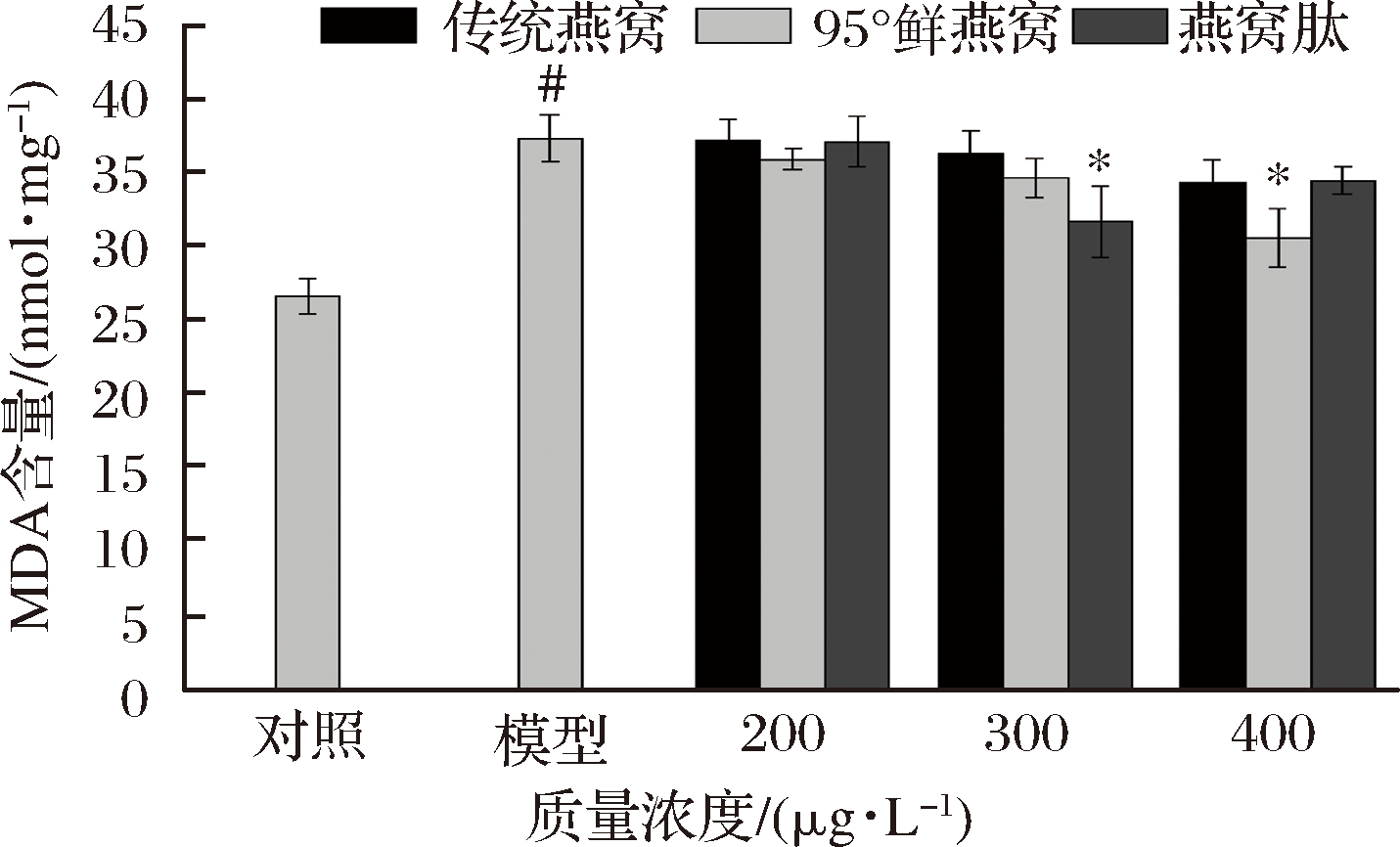
图6 燕窝水提物及燕窝肽对MRC-5细胞MDA含量的影响
Fig.6 Effects of bird′s nest extract and bird′s nest peptide on MDA content in MRC-5 cells
由图7可知,与对照组相比模型组SOD活力显著降低(P<0.05);与模型组相比,“95°鲜燕窝”水提物和燕窝肽在300、400 μmol/L预处理2 h能显著增加SOD酶活力(P<0.05),传统燕窝水提物在400 μmol/L显著增加SOD酶活力(P<0.05)。细胞内SOD酶活力增加,表明细胞清除ROS、调节氧化应激的能力增强。因此两种燕窝水提物及燕窝肽均能通过增加SOD酶活力改善氧化应激,且与传统燕窝水提物相比“95°鲜燕窝”水提物处理组增加SOD酶活力的能力更强,能更有效地改善氧化应激损伤。
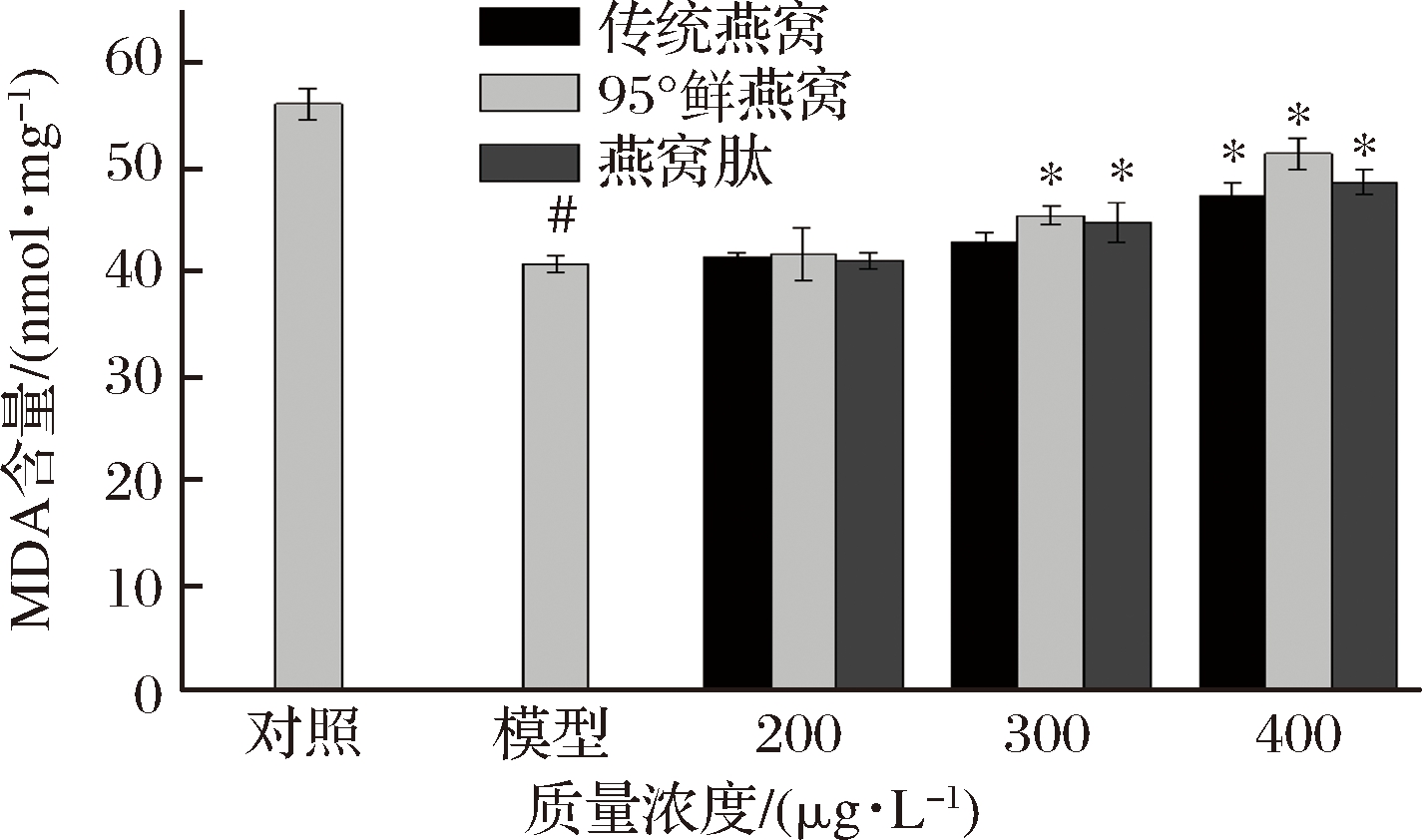
图7 燕窝水提物及燕窝肽对MRC-5细胞内SOD活力的影响
Fig.7 Effects of bird′s nest extract and bird′s nest peptide on SOD activity in MRC-5 cells
GSH-PX是除SOD以外的另一类抗氧化酶,其活力能间接反应机体的氧化应激水平同时也可以判断化合物的抗氧化能力。由图8可知,与对照组相比模型组GSH-PX活力显著降低(P<0.05),“95°鲜燕窝”水提物在400 μmol/L预处理2 h,与模型组相比能显著增加GSH-PX活力(P<0.05),因此,“95°燕窝”水提物能通过增加GSH-PX活力减轻细胞的氧化应激损伤。传统燕窝水提物与燕窝肽均能不同程度地增强GSH-PX活力但是与模型组相比无显著性。
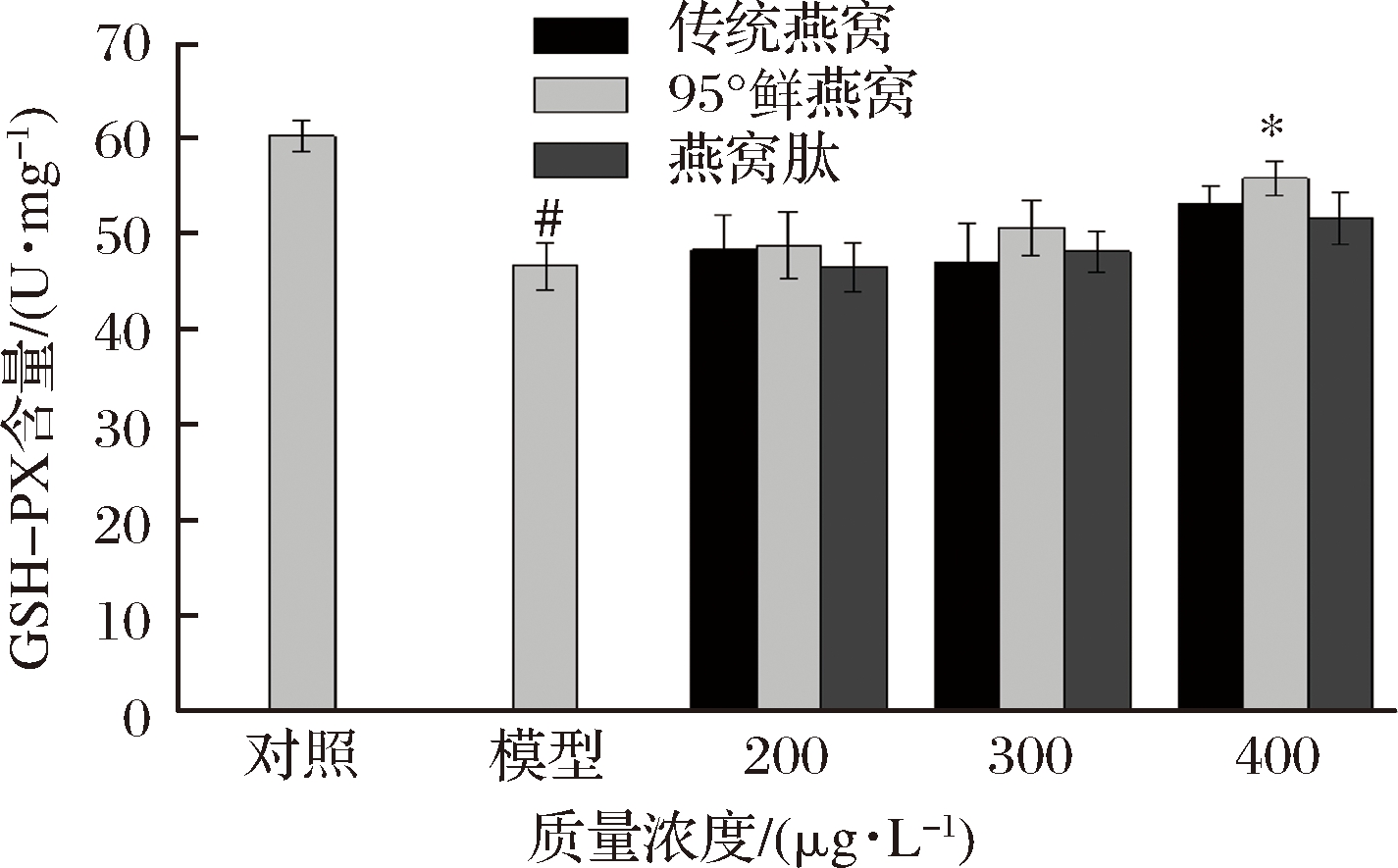
图8 燕窝水提物及燕窝肽对MRC-5细胞GSH-PX活力的影响
Fig.8 Effects of bird′s nest extract and bird′s nest peptide on the activity of GSH-PX in MRC-5 cells
肺是人体重要的呼吸器官,由于某些原因导致的肺损伤,使机体的氧化/抗氧化系统失衡,最终引发机体氧化应激反应,进而产生氧化损伤,导致细胞死亡及组织损伤,促进机体内成纤维细胞趋化[22]。通过研究肺纤维化动物模型发现氧化应激水平显著增高,相应的抗氧化物明显减少,表示氧化/抗氧化失衡可能在肺维化发病机制中发挥重要作用[2,9]。本研究通过细胞实验证明,“95°鲜燕窝”水提物通过显著增加SOD、GSH-PX酶活力(P<0.05),进而降低细胞ROS、MDA等氧化应激标志物的生成。传统燕窝水提物能够增加SOD酶活力,降低ROS含量;燕窝肽能够增加SOD酶活力,降低胞内ROS、MDA的含量。
2.3 燕窝水提物及燕窝肽对Hacat细胞增殖的影响
表皮角质形成细胞的生长、分化对皮肤损伤修复、抗老化至关重要[23]。图9所示,不同浓度燕窝水提物及燕窝肽处理细胞24 h后对细胞增殖的影响,传统燕窝水提物在100μmol/mL时显著刺激细胞生长(P<0.05),大于300 μmol/mL时显著抑制细胞生长(P<0.05)。“95°鲜燕窝”在200μmol/mL时显著刺激细胞生长(P<0.05),燕窝肽在100 μmol/mL时显著刺激细胞生长(P<0.05)。
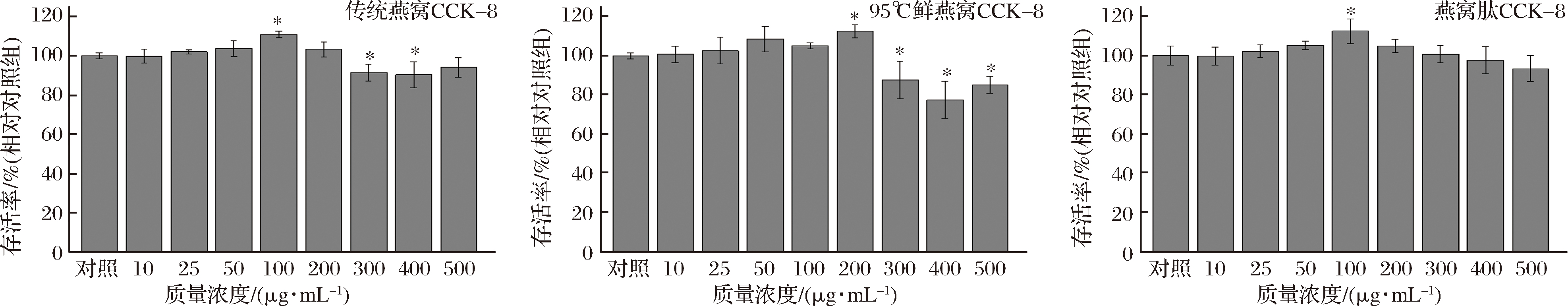
图9 不同浓度燕窝水提物及燕窝肽对Hacat细胞活力的影响
Fig.9 Effects of different concentrations of bird′s nest extract and bird′s nest peptide on the viability of Hacat cells
如图10所示,200 μmol/mL的“95°鲜燕窝”水提物显著刺激Hacat细胞增殖,培养24 h后,细胞密度大于传统燕窝水提物及燕窝肽组。因此,“95°鲜燕窝”在200 μmol/mL时显著刺激Hacat的生长分化(P<0.05),说明其在皮肤损伤及抗衰老的过程中具有一定的功效。
3 结论与展望
研究通过氧化应激细胞模型实验证实,燕窝及燕窝肽能够通过增加SOD、GSH-PX酶活力,进而降低胞内ROS、MDA水平改善细胞氧化应激状态并且这种保护作用存在剂量效应关系,尤其是“95°鲜燕窝”水提物及燕窝肽作用效果显著,由此推测燕窝的加工方式对其活性成分具有一定的影响。同时燕窝水提物均表现出促进Hacat细胞的增殖作用,表明燕窝中的有效成分在抵抗皮肤松弛、皮肤损伤修复、抗老化过程中发挥作用。本研究仅在细胞水平上对燕窝的生理功能进行了初步探索,由于细胞实验本身具有一定的局限性,因此后续还需要进一步的体内实验进行验证。近年来大量研究数据表明慢病发生常伴随氧化应激出现,因此深入探究燕窝活性成分的抗氧化机制对于慢病防治具有深远的意义。

a-对照组;b-传统燕窝水提物组;c-“95°鲜燕窝”水提物组;d-燕窝肽组
图10 燕窝水提物及燕窝肽(200 μmol/mL)对Hacat细胞活力的影响
Fig.10 Effects of bird′s nest extract and bird′s nest peptide (200 μmol/mL)on the viability of Hacat cells
[1] 陈珏晓.黄芪提取物对过氧化氢诱导的MRC-5细胞氧化损伤的保护作用[D].佳木斯:佳木斯大学,2015.
[2] 刘瑞.ROS介导的以Nrf2为核心的抗氧化防御体系对肺纤维化的调控机制研究[D].济南:第四军医大学,2008.
[3] 刘骅漫.基于Nrf2/ARE信号通路探讨海藻多糖对人胚肺成纤维细胞抗氧化作用的机制研究[D].济南:山东中医药大学,2017.
[4] 葛阳涛,胡海霞,王雪京.肺间质纤维化与肺痿[J].世界中医药,2014(8):994-997.
[5] 熊剑飞,李燕芹.肺外因素对肺纤维化形成影响[J].临床肺科杂志,2009,14(11):1 509-1 510.
[6] 肖清萍,孙坚.肺间质纤维化的发病机制研究进展[J].江西医药,2007,42(6):569-572.
[7] Zhang Yida,IMAM M U,ISMAIL M.In vitro bioaccessibility and antioxidant properties of edible bird′s nest following simulated human gastro-intestinal digestion[J].Bmc Complementary &Alternative Medicine,2014,14(1):1-7.
[8] WONG R.Edible bird′s nest:Food or medicine?[J].Chinese Journal of Integrative Medicine,2013,19(9):643-649.
[9] 刘骅漫,刘学,贾新华,等.肺纤维化氧化应激与中医肺系功能失调的相关性探讨[J].时珍国医国药,2017(3):228-230.
[10] CHUA K H,LEE T H,et al.Edible Bird′s nest extract as a chondro-protective agent for human chondrocytes isolated from osteoarthritic knee:in vitro study[J].BMC Complementary and Alternative Medicine,2013,13(1).
[11] VIMALA B,NAZAIMOON H H M W.Effects of edible bird′s nest on tumour necrosis factor-alpha secretion,nitric oxide production and cell viability of lipopolysaccharide-stimulated RAW 264.7 macrophages[J].Food and Agricultural Immunology,2012,Volume 23(4):303-341.
[12] CHUA Y G,BLOODWORTH B C,et al.Metabolite profiling of edible bird′s nest using gas chromatography mass spectrometry and liquid chromatography/mass spectrometry[J].Rapid Communications in Mass Spectrometry,2014,28(12):1 387-1 400.
[13] LIU Xiaoqing,LAI Xintian,et al.Proteomic Profile of Edible Bird's Nest Proteins[J].Journal of Agricultural and Food Chemistry,2012,60(51):12 477-12 481.
[14] YEW M,KOH R,CHYE S,et al.Edible bird′s nest ameliorates oxidative stress-induced apoptosis in SH-SY5Y human neuroblastoma cells[J].BMC Complementary and Alternative Medicine,2014,14(1):391.
[15] FERMIN I M,JAVIER C,et al.Weight Gain Induced by High-Fat Feeding Involves Increased Liver Oxidative Stress[J].Obesity,2006,14(7):1 118-1 123.
[16] MATSUZAWANAGATA N,TAKAMURA T,et al.Increased oxidative stress precedes the onset of high-fat diet-induced insulin resistance and obesity[J].Metabolism-clinical &Experimental,2008,57(8):1 071-1 077.
[17] Zhang Yida,IMAM M U,ISMAIL M,et al.Edible Bird′s Nest attenuates high fat diet-induced oxidative stress and inflammation via regulation of hepatic antioxidant and inflammatory genes[J].BMC Complementary and Alternative Medicine,2015,15(1).
[18] 陈秀明,连晓文,林坚,等.伤药软膏治疗软组织损伤的临床观察[J].中国中医药现代远程教育,2016,14(19):56-58.
[19] 丁蕾,张福利,丁滨,等.GSSG通过抑制TNF-α介导的NF-κB活化诱导非酒精性肝损伤[J].浙江中医药大学学报,2016(9):696-701.
[20] 余晶,鲍中英,徐玉敏,等.花青素抗氧化损伤及细胞凋亡的作用研究[J].中西医结合肝病杂志,2009,19(1):24-26.
[21] 杨艳,刘东波,康信聪,等.H2O2诱导胰岛RIN-m5F细胞构建氧化应激模型[J].食品与机械,2014(2):40-43.
[22] 王清华,姚旭,魏新智,等.黄芩苷对肺纤维化大鼠肺组织氧化应激的反应及炎症细胞的影响[J].中华中医药学刊,2017(6):39-41.
[23] MARCONE M F .Characterization of the edible bird’s nest the “Caviar of the East”[J].Food Research International,2005,38(10).