大鲵(Andrias davidiauns),俗称“娃娃鱼”,是世界上现存最大的两栖动物,素有“活化石”之称。大鲵全身是宝,其皮肤、皮肤分泌物、肌肉、骨骼含有多种生物活性物质[1-2]。明胶是一种从动物皮肤、骨骼组织中提取,通过胶原蛋白热变性、部分水解获得的水溶性高分子蛋白质,被广泛应用于改善食品结构、提高食品保水性和稳定性研究中。前期研究已经从大鲵皮中提取获得了中等凝冻强度明胶,但为了满足不同工业用途,有必要对其进行化学修饰来提高性能[3-4]。
茶多酚是茶叶中最重要的活性物质,其来源丰富、易于制取且无毒副作用,高纯度茶多酚已经实现了工业化生产,被广泛用于食品工业中。近年来,有关蛋白质和多酚类化合物相互作用改善复合体系理化性质、蛋白构象及生物学功能相关的研究越来越多[5-8]。夏雨等[9]报道了茶多酚对明胶的改性作用,发现不同质量浓度茶多酚可改变明胶结构和功能性质。FENG等[10]研究了0.4%茶多酚和1.2%明胶共混膜对冷藏鱼丸有保鲜作用,能抑制鱼丸微生物生长和维持鱼丸纳米结构。因此,茶多酚和明胶通过相互作用形成的复合体系,可做为潜在的复合保鲜剂和可食性膜用于食品工业中。
然而,明胶来源以及茶多酚混入比例,不仅影响复合膜液理化性质,而且对复合膜液功能特性产生较大影响。为此,本研究以大鲵皮明胶为对象,探究茶多酚质量分数对大鲵皮明胶复合膜液pH值、色差、凝胶强度、流变性、红外光谱和抗氧化活性的影响,为开发食品复合保鲜剂和可食性膜提供理论依据。
1 材料与方法
1.1 原料与试剂
试验原料:大鲵皮明胶冻干粉(蛋白质含量89%,Bloom值为216 g),陕西理工大学大鲵研究所自制。
主要试剂:茶多酚(纯度98%),天津希恩斯生化科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH),Sigma-Aldrich公司;其余试剂均为国产分析纯。
1.2 仪器与设备
3nh精密色差计,深圳三恩时科技有限公司;CT3型质构仪,美国Brookfield公司;RST-CC型流变仪,美国Brookfield公司;Avatar 360傅立叶红外光谱仪,美国尼高力仪器公司;LGJ-10B型冷冻干燥机,北京四环仪器有限公司;pHS-3C型精密pH计,上海雷磁仪器厂;HWS-12型电热恒温水浴锅,上海一恒科学仪器有限公司;Evolution 201型紫外可见分光光度计,美国Thermo公司。
1.3 试验方法
1.3.1 大鲵皮明胶-茶多酚复合膜液的制备
精确称取大鲵皮明胶,配成质量浓度为40 mg/mL的明胶溶液,置于50 ℃恒温磁力搅拌水浴锅搅拌至完全溶解。精确称量一定量茶多酚,加入少量去离子水溶解茶多酚后,将茶多酚溶液分别加入大鲵皮明胶溶液中,继续搅拌至体系混合均匀,分别获得含茶多酚质量分数为0(对照)、0.4%、0.8%和1.2%的大鲵皮明胶-茶多酚复合成膜液,50 ℃恒温磁力搅拌1 h,得到如图1所示各组复合膜液。

图1 不同质量分数茶多酚-大鲵皮明胶复合膜液
Fig.1 The gelatin blended with different contents of tea polyphenol
1.3.2 复合膜液pH的测定
不同质量分数茶多酚复合膜液的 pH值,采用经校正后的 pH 计读取,每个样品平行测量3次,取平均值。
1.3.3 复合膜液色差的测定
复合膜液色值采用3nh精密色差仪测定,以D65为光源,以仪器白板为标准![]() 测定各组复合膜液的亮度指数L*、红度值a*和黄度值b*。每个样品平行测定5次,取平均值。
测定各组复合膜液的亮度指数L*、红度值a*和黄度值b*。每个样品平行测定5次,取平均值。
1.3.4 复合膜液凝胶强度的测定
利用CT3质构仪压缩模式,测定各组复合膜液凝胶强度。分别取各组复合膜液15 mL,置于25 mL烧杯4 ℃冷藏过夜。参数设置如下:选用TA5探头,压缩距离10 mm,触发点负载1.0 g,测试前速度0.5 mm/s,测试后速度0.5 mm/s,数据频率10个/s。凝胶强度定义为探头压缩至目标距离的最大负载(g)。每组样品平行测定3次,取平均值。
1.3.5 复合膜液流变性的测定
复合膜液流变学特性采用RST-CC型流变仪测定。取适量复合膜液(约30 mL)置于同轴圆筒中,放入转子并将其与仪器连接。设置测试温度为20 ℃,剪切速率范围0~3 000 s-1,记录各组复合膜液的黏度以及剪切应力的变化值。
1.3.6 复合膜液红外光谱的测定
将各组复合膜液冷冻干燥后,称取少量样品和 100 mg KBr颗粒混合研磨、压片。采用红外光谱仪对冻干的膜液样品进行红外光谱分析,扫描范围为 4 000~400 cm-1,以波数为横坐标,以透光率为纵坐标绘图。每个样品至少扫描32次。
1.3.7 复合膜液抗氧化活性的测定
以DPPH自由基清除率和还原能力为指标,评价各组复合膜液的抗氧化活性,具体参见前期调整的测试方法[11]。
1.4 数据统计分析
试验结果均以平均值±标准差(n≥3)表示,t检验进行差异显著性分析。
2 结果与分析
2.1 茶多酚质量分数对复合膜液色差的影响
从图1可看出,随着茶多酚质量分数增加,复合膜液色泽逐渐变为红棕色,对其可食膜色泽有一定的影响。利用色差计对各组复合膜液的亮度值L*、红度值a*和黄度值b*进行测定,结果如表1所示。大鲵皮明胶溶液中引入茶多酚后,L*值显著下降(P<0.05),a*值和b*值显著增加(P<0.05)。这是因为茶多酚在水溶液呈红棕色,随着其质量分数的增加,复合膜液L*值下降,a*和b*值增加。各组复合膜液色差值变化规律,与梁迪等[12]制备的苹果果胶-多酚复合膜液的色差值随多酚质量浓度变化的规律基本一致。
表1 茶多酚质量分数对复合膜液色差的影响
Table 1 Color of composite film liquids with different levels of tea polyphenol
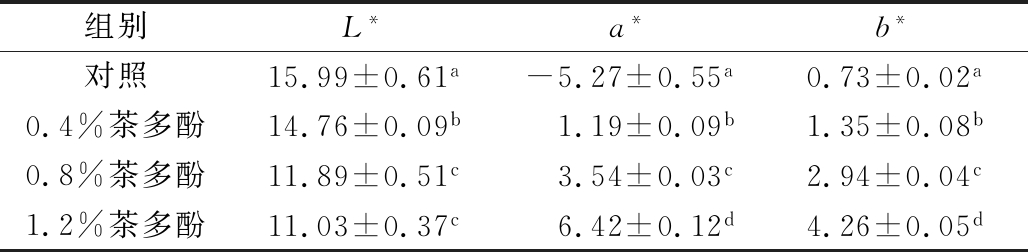
组别L*a*b*对照15.99±0.61a-5.27±0.55a0.73±0.02a0.4%茶多酚14.76±0.09b1.19±0.09b1.35±0.08b0.8%茶多酚11.89±0.51c3.54±0.03c2.94±0.04c1.2%茶多酚11.03±0.37c6.42±0.12d4.26±0.05d
注:同一列不同小写字母代表各组间存在显著差异(P<0.05)。
2.2 茶多酚质量分数对复合膜液pH的影响
向大鲵皮明胶溶液中,加入不同质量分数茶多酚后,复合膜液的pH值变化结果如图2所示。本研究配制的大鲵皮明胶水溶液(对照)pH值为5.17,加入不同质量分数茶多酚后,复合膜液的pH值逐渐下降。当茶多酚质量分数达到0.8%(pH值为4.96),与对照组和0.4%茶多酚组的pH值差异达到显著水平(P<0.05)。这是因为多酚水溶液通常呈弱酸性,当加入0.4%茶多酚,复合膜液pH值略有下降[7,13]。当茶多酚质量分数达到1.2%时,pH值降至4.55(P<0.05),并出现少许浑浊沉淀。分析原因可能是高浓度茶多酚导致酸性增加,从而造成pH值降低。另外,高浓度茶多酚与明胶易发生絮凝,造成复合膜液出现部分沉淀[14]。

图2 茶多酚质量分数对复合膜液pH值的影响
Fig.2 Effect of tea polyphenols content on pH value of composite film liquids
注:柱上方不同小写字母代表各组间存在显著差异(P<0.05)。下同。
2.3 茶多酚质量分数对复合膜液凝胶强度的影响
采用质构仪压缩模式,研究了不同质量分数茶多酚对大鲵皮明胶复合膜液凝胶性质的影响,压缩过程中各组膜液的负载-时间曲线和凝胶强度结果如图3所示。大鲵皮明胶中引入不同质量分数茶多酚对其凝胶性质影响较大。对照组凝胶强度为32.15 g,混入质量分数为0.4%茶多酚后复合膜液凝胶强度为41.70 g,较对照组提高了23.90%(P<0.05)。而茶多酚质量分数为0.8%及以上,可使复合膜液凝胶强度下降(P<0.05),其中含0.8%茶多酚的复合膜液呈弱凝胶状,含1.2%茶多酚复合膜液没有凝胶形成,凝胶强度仅为4.78 g。这种凝胶强度变化趋势,与夏雨等[9]相关研究结果基本一致。茶多酚质量分数较低时(0.4%),其酚羟基与明胶多肽链间易形成氢键,导致复合膜液凝胶网状结构增强;茶多酚质量分数较高时(0.8%及以上),多酚与明胶有絮凝沉淀现象,从而导致复合膜液浑浊,从而不利于凝胶网状结构维持[9,12]。
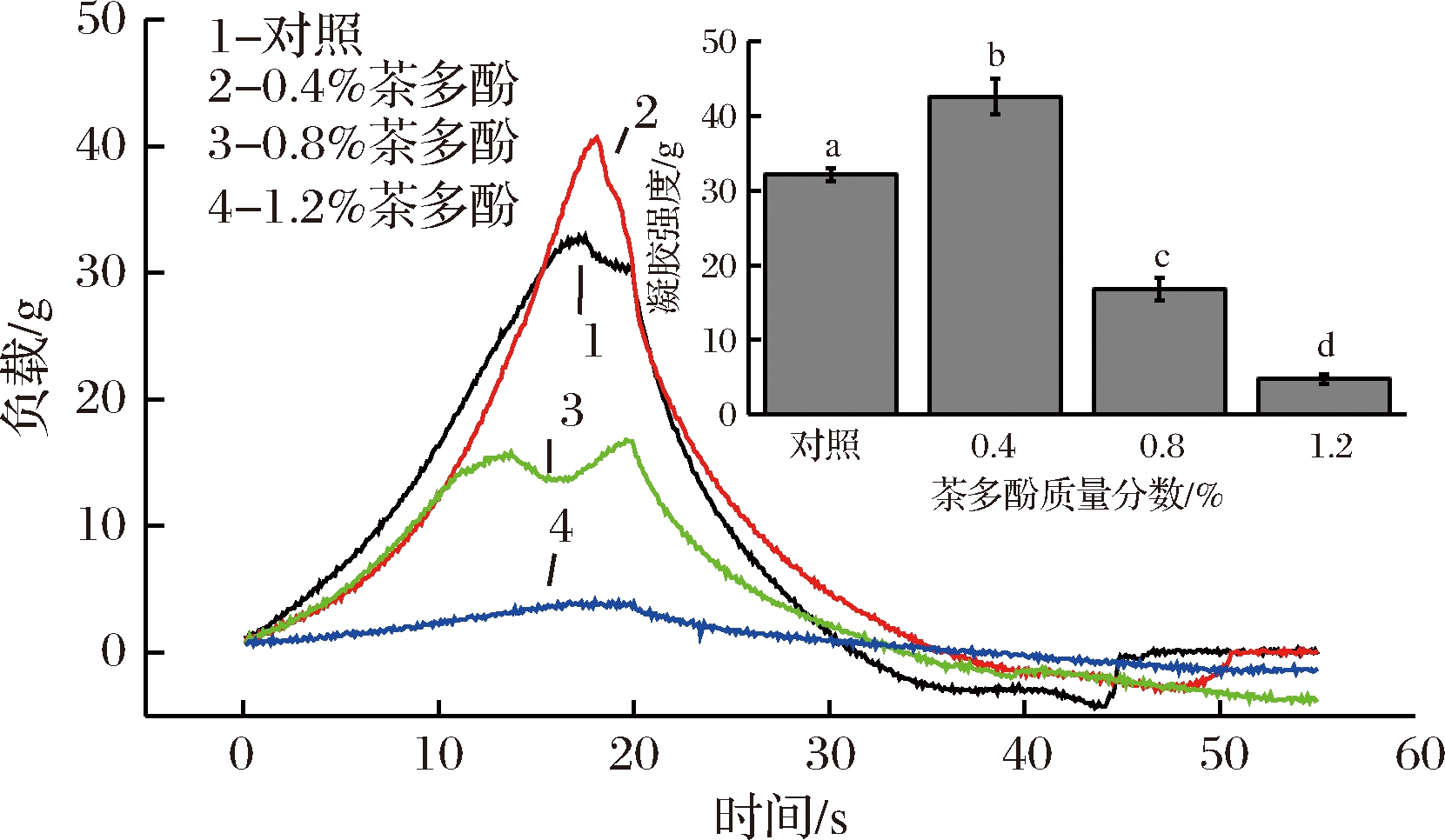
图3 茶多酚质量分数对复合膜液凝胶性质的影响
Fig.3 Effect of tea polyphenols content on gel strength of composite film liquids
2.4 茶多酚质量分数对复合膜液流变性的影响
利用流变仪,对含不同质量分数茶多酚的大鲵皮明胶复合膜液的剪切流变学性质进行分析。图4显示了不同剪切率下各组复合膜液黏度和剪切应力的变化规律,可以看出各组复合膜液黏度均随着剪切速率的增加而降低,表现出剪切稀变流体的特征,说明各组膜液均为非牛顿流体。分析其原因可能是由各组膜液体系中分子间的摩擦力随着剪切速率的增加而降低造成的[12]。
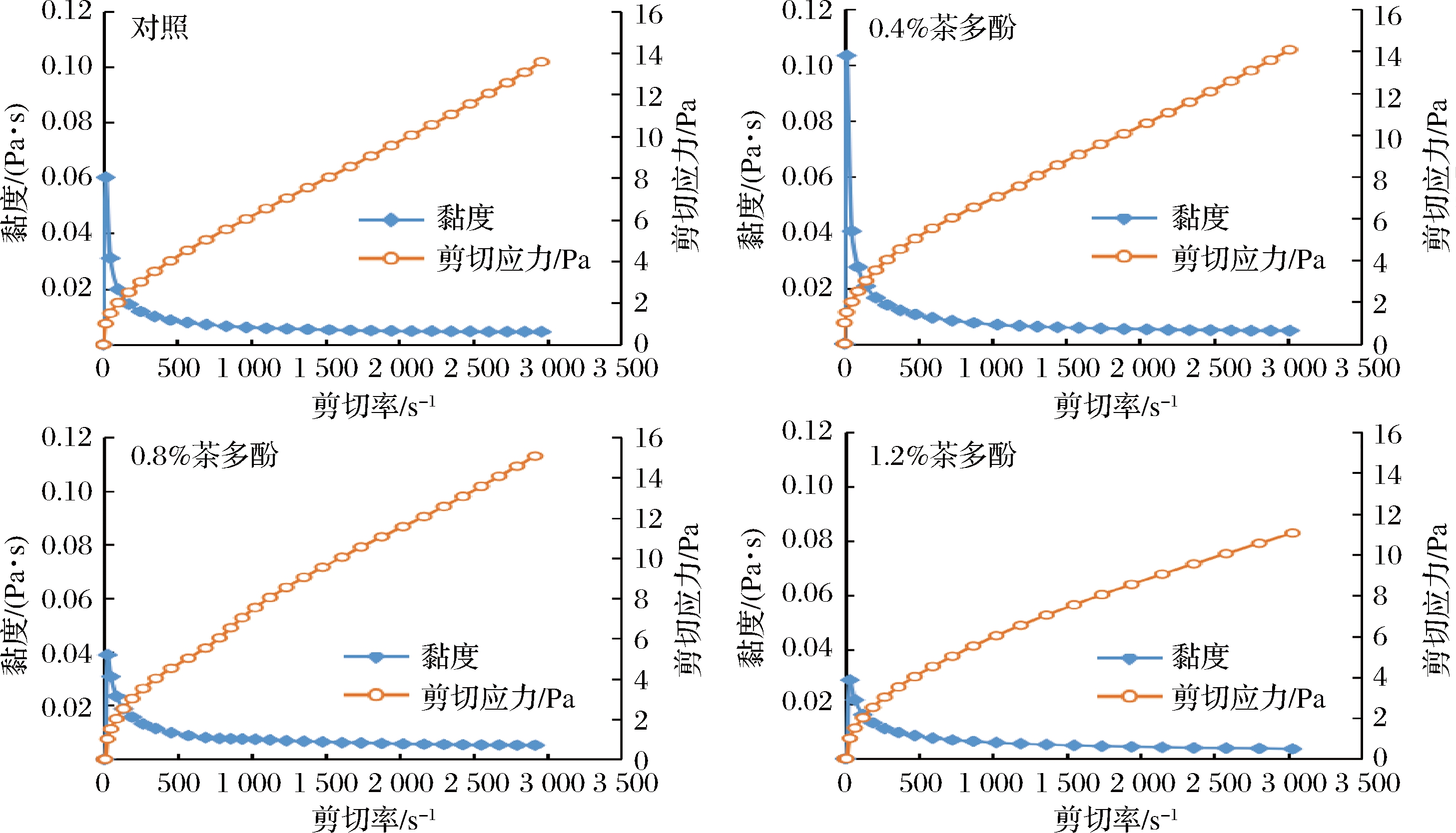
图4 茶多酚质量分数对复合膜液流变性质的影响
Fig.4 Effect of tea polyphenols content on rheological properties of composite film liquids
由图4还可知,对照组表观黏度为0.06 Pa·s,添加含0.4%、0.8%和1.2%茶多酚后,复合膜液表观黏度分别为0.1、0.04 和0.03 Pa·s。随着茶多酚质量分数增加,各组复合膜液的表观黏度呈现先增加后降低的趋势。引入低浓度茶多酚(0.4%)后,复合膜液表观黏度增加,可能是由于大鲵皮明胶分子与茶多酚形成氢键作用的缘故;而随着茶多酚质量分数继续增加,复合膜液表观黏度呈下降趋势,可能与高浓度茶多酚造成明胶溶液开始絮凝沉淀有关[9,12,15]。
此外,由图4还可知,随着剪切速率的增加,各组复合膜液剪切应力均呈现增加的趋势。当剪切速率为3 000 s-1时,对照组剪切应力为13.57 Pa,含0.4%、0.8%和1.2%茶多酚复合膜液剪切应力分别为14.07、15.08和11.06 Pa,远远小于苹果果胶-多酚复合膜液的剪切应力值(3 500 Pa以上)[12,16]。剪切应力可反映复合膜液的黏稠度,这一结果说明大鲵皮明胶与不同质量分数茶多酚相互作用会引起复合膜液稠度的变化。综合分析,各组复合膜液表观黏度和剪切应力的变化,与本研究得到凝胶强度的变化规律基本一致,均随着茶多酚质量分数增加,呈现先增加后降低的趋势。
2.5 茶多酚质量分数对复合膜液红外光谱的影响
红外光谱被广泛用于蛋白质等大分子结构特征的变化研究,本研究对含不同质量分数茶多酚的大鲵皮明胶复合膜液的红外光谱特征进行测定,结果如图5所示。由图5可看出,大鲵皮明胶引入不同质量分数茶多酚后,各组复合膜液红外吸收峰发生了一定变化,特别是对照组和含不同质量分数茶多酚的复合膜液红外吸收峰差异较为明显。通常明胶的酰胺A带吸收峰在3 300~3 500 cm-1之间,主要由O—H和N—H的伸缩振动引起,可表明氢键的作用及变化。明胶的酰胺I带、II带和III带分别反映出C![]() O的伸缩振动、N—H弯曲振动和C—H的伸缩振动,其吸收峰分别在1 600、1 500和1 200 cm-1左右[16-17]。
O的伸缩振动、N—H弯曲振动和C—H的伸缩振动,其吸收峰分别在1 600、1 500和1 200 cm-1左右[16-17]。
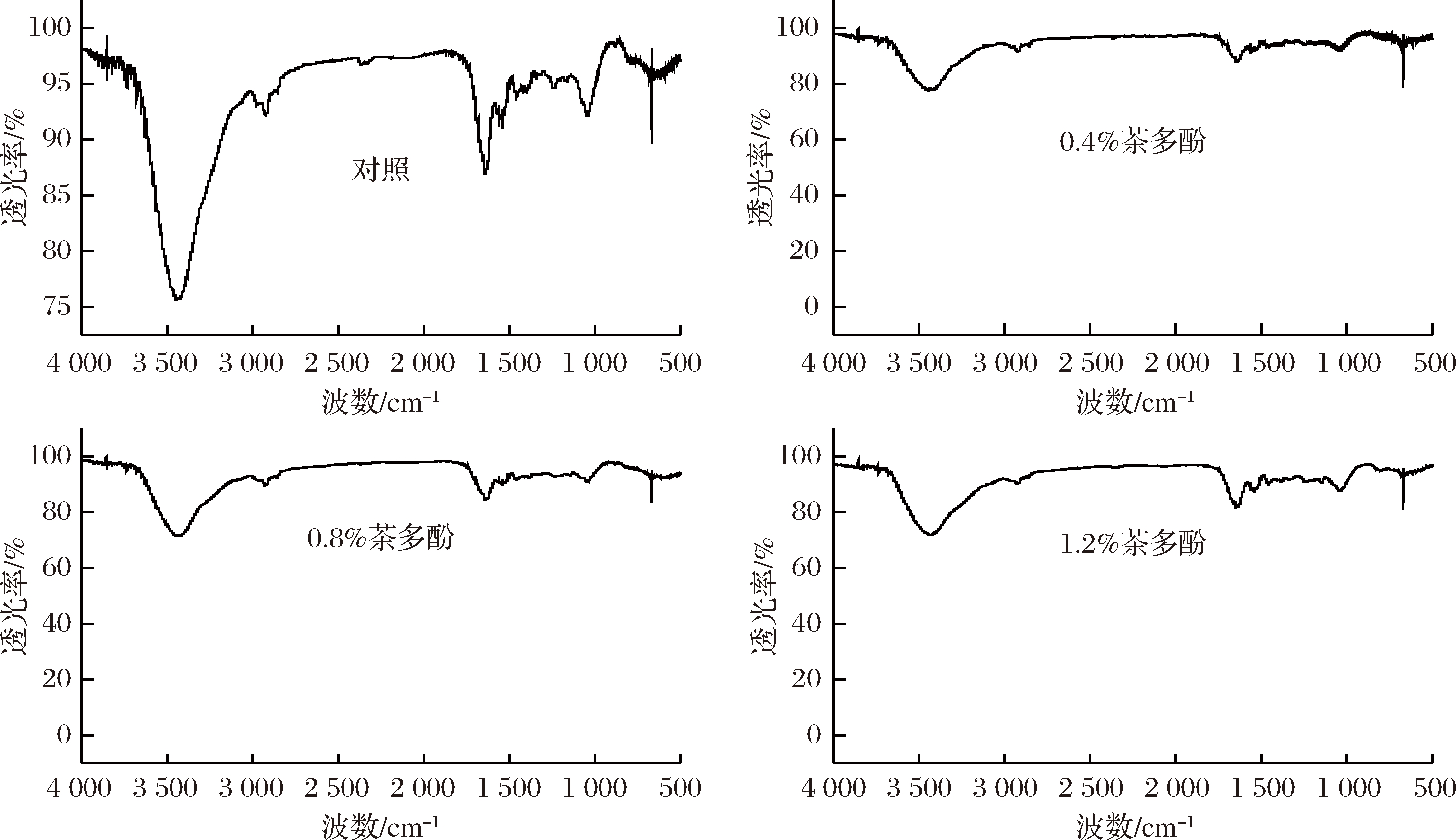
图5 茶多酚质量分数对复合膜液红外光谱的影响
Fig.5 Effect of tea polyphenols content on infrared spectra of composite film liquids
表2列出了本研究中对照组和含茶多酚的复合膜液酰胺A带、I带、II带和III带的特征吸收波数。从表2可知,对照组酰胺A带在3 447.28 cm-1处,引入0.4%、0.8%和1.2%茶多酚后复合膜液酰胺A带吸收峰分别为 3 438.06、3 440.91和3 443.01 cm-1,分别较对照组吸收峰降低了9.22、6.37和4.27个波数。酰胺A带向低波数偏移,说明复合膜液中大鲵皮明胶与茶多酚产生氢键作用,并且降低幅度越大,氢键作用越强[18-19]。随着茶多酚质量分数增加,各组复合膜液氢键作用呈现先增加后降低的趋势,其中0.4%茶多酚复合膜液氢键作用最强,这与各组膜液凝胶强度和流变性质变化结果相同。从表2中还可知,各组复合膜液酰胺III带变化不大。此外,对照组酰胺I带、II带分别在1 647.30 cm-1和1 559.07 cm-1处,引入不同质量分数茶多酚后,各组复合膜液酰胺I带、II带出现向低波数移动。可能由于酰胺I带和II带与C![]() O和N—H振动相关,一般氢键作用较强时,会促使酰胺I带和II带向低波数偏移[20-21]。这也说明茶多酚-明胶相互作用导致复合膜液内部C
O和N—H振动相关,一般氢键作用较强时,会促使酰胺I带和II带向低波数偏移[20-21]。这也说明茶多酚-明胶相互作用导致复合膜液内部C![]() O和N—H的氢键作用发生变化。夏雨等[9]在研究茶多酚对明胶改性研究中发现经不同浓度茶多酚改性的明胶红外光谱酰胺A带、I 带、II带和III带吸收特征变化与本研究结果相近。
O和N—H的氢键作用发生变化。夏雨等[9]在研究茶多酚对明胶改性研究中发现经不同浓度茶多酚改性的明胶红外光谱酰胺A带、I 带、II带和III带吸收特征变化与本研究结果相近。
表2 复合膜液红外光谱特征吸收峰位置
Table 2 Absorption peak position of the complex film liquids
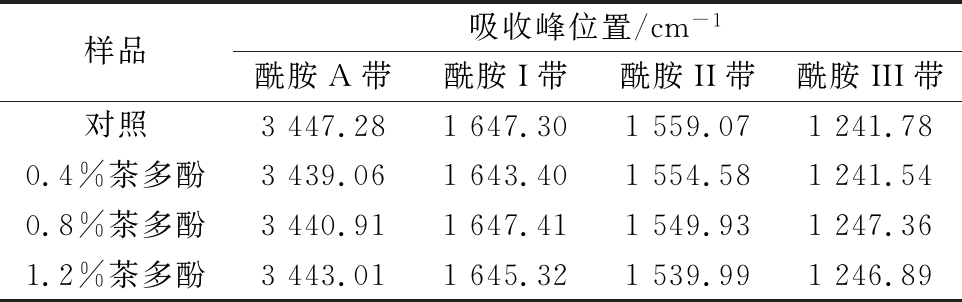
样品吸收峰位置/cm-1酰胺A带酰胺I带酰胺II带酰胺III带对照3447.281647.301559.071241.780.4%茶多酚3439.061643.401554.581241.540.8%茶多酚3440.911647.411549.931247.361.2%茶多酚3443.011645.321539.991246.89
2.6 茶多酚质量分数对复合膜液抗氧化活性的影响
以DPPH自由基清除率为指标,对各组膜液抗氧化活性进行评价,结果如图6所示。

图6 茶多酚质量分数对复合膜液抗氧化活性的影响
Fig.6 Effect of tea plolyphenol percentage on antioxidant activities of composite film liquids
可以看出,大鲵皮明胶溶液(对照组)具有一定的DPPH自由基清除能力和还原能力,其DPPH自由基清除率和还原能力(OD700 nm)分别为(46.58±1.43)%和0.27±0.04。当引入不同质量分数茶多酚时,复合膜液的DPPH自由基清除能力和还原能力显著提高(P<0.05),但是茶多酚质量分数超过0.8%以上时,复合膜液对DPPH自由基清除能力增加不明显(P>0.05)。与对照组相比,0.4%、0.8%和1.2%茶多酚复合膜液对DPPH自由基清除率分别提高了49.01%、54.12%和54.83%;对还原能力分别提高了61.87%、77.84%和79.93%。各组复合膜液具有较强的抗氧化活性,其原因是茶多酚本身具有很强的抗氧化活性,引入到大鲵明胶溶液后致使复合膜液对DPPH自由基清除能力和还原能力得到了提升。
3 结论
引入不同质量分数茶多酚,导致大鲵皮明胶复合膜液L*值(亮度)和pH值下降,a*值(红度)和b*值(黄度)增加。与对照组相比,含0.4%茶多酚复合膜液凝胶强度明显提高,但是茶多酚质量分数超过0.8%时,会造成复合膜液凝胶强度下降。剪切流变分析表明,与对照组相比,各组复合膜液表观黏度和最终剪切应力呈现先增加后降低的趋势。红外光谱分析表明,引入不同质量分数茶多酚,大鲵皮明胶复合膜液酰胺A、I、Ⅱ带吸收峰向低波数发生不同程度偏移,可能是由于明胶多肽链与茶多酚羟基之间氢键作用变化引起。此外,引入不同质量分数茶多酚后,各组复合膜液的DPPH自由基清除能力和还原能力得到显著提升。综合考虑,含0.4%茶多酚的明胶复合膜液具有较好的理化和功能性质,具有一定应用价值,今后可进行食品复合保鲜液及可食膜性能的深入研究。
[1] HE D,ZHU W,ZENG W,et al.Nutritional and medicinal characteristics of Chinese giant salamander(Andrias davidianus)for applications in healthcare industry by artificial cultivation:A review[J].Food Science and Human Wellness,2018,7(1):1-10.
[2] PEI J,JIANG L.Antimicrobial peptide from mucus of Andrias davidianus:screening and purification bymagnetic cell membrane separation technique[J].International Journal of Antimicrobial Agents,2017,50(1):41-46.
[3] 金文刚,陈德经,耿敬章,等.大鲵皮明胶提取及其性质分析[J].食品与发酵工业,2017,43(2):174-179.
[4] 康莎莎,辛颖,陈复生.添加物对明胶改性作用研究进展[J].食品与机械,2016,32(5):225-228.
[5] 李春翼,田勇,杨雅轩,等.植物多酚与蛋白质互作机制表征方法研究进展[J].食品与发酵工业,2019,45(13).
[6] CAO N,FU Y H,HE J H.Mechanical properties of gelatin films cross-linked,respectively,by ferulic acid and tannin acid[J].Food Hydrocolloids,2007,21(4):575-584.
[7] STRAUSS G,GIBSON S M.Plant phenolics as cross-linkers of gelatin gels and gelatin-based coacervates for use as food ingredients[J].Food Hydrocolloids,2004,18:81-89.
[8] OU S Y,WANG Y,TANG S Z,et al.Role of ferulic acid in preparing edible films from soy protein isolate[J].Journal of Food Engineering,2005,70(2):205-210.
[9] 夏雨,焦志华,刘海英.茶多酚对明胶的改性作用[J].食品与发酵工业,2011,37(10):36-40.
[10] FENG X,Voon Kunn N,MARTA MIKS-KRAJNIK M,et al.Effects of fish gelatin and tea polyphenol coating on the spoilage and degradation of myofibril in fish fillet during cold storage[J].Food Bioprocess and Technology,2017,10:89-102.
[11] JIN W G,DU Y N,PEN J J,et al.Characterization and antioxidant activity of Maillard reaction products from a scallop(Patinopecten yessoensis)gonad hydrolysates-sugar model system[J].Journal of Food Measurement and Characterization,2018,12:2 883-2 891.
[12] 梁迪,杨曦,侯燕杰,等.苹果果胶-多酚复合膜液制备、流变特性及抗氧化性研究[J].食品与发酵工业,2018,44(8):99-106.
[13] 贾娜,刘丹,谢振峰.植物多酚与食品蛋白质的相互作用[J].食品与发酵工业,2016,42(7):277-282.
[14] 张慧云,吴静娟,段续.添加多酚对鲤鱼肌原纤维蛋白结构及膜性能的影响[J].食品科学,2016,37(5):35-40.
[15] FRIESEN K,CHANG C,NICKERSON M.Incorporation of phenolic compounds,rutin and epicatechin,into soy protein isolate films:mechanical,barrier and cross-linking properties[J].Food Chemistry,2015,172(4):18-23.
[16] NUTHONG P,BENJAKUL S,PRODPRAN T.Effect of phenolic compounds on the properties of porcine plasma protein-based film[J].Food Hydrocolloids,2009,23:736-741.
[17] LIU Y,XIA L,JIA H,et al.Physiochemical and functional properties of chum salmon (Oncorhynchus keta)skin gelatin extracted at different temperatures[J].Journal of the Science of Food and Agriculture,2017,97:5 406-5 413.
[18] NAGARAJAN M,BENJAKUL S,PRODPRAN T,et al.Characteristics and functional properties of gelatin from splendid squid (Loligo formosana)skin as affected by extraction temperatures[J].Food Hydrocolloids,2012,29:389-397.
[19] RAFIEIAN F,KERAMAT J,SHAHEDI M.Physicochemical properties of gelatin extracted from chicken deboner residue[J].LWT-Food Science and Technology,2015,64:1 370-1 375.
[20] LIU Z,GE X,LU Y,et al.Effects of chitosan molecular weight and degree of deacetylation on the properties of gelatine-based films[J].Food Hydrocolloids,2012,26(1):311-317.
[21] BENBETTAÏEB N,KARBOWIAK T,BRACHAIS C H,et al.Coupling tyrosol,quercetin or ferulic acid and electron beam irradiation to cross-link chitosan-gelatin films:A structure-function approach[J].European Polymer Journal,2015,67:113-127.