肌原纤维蛋白(myofibrillar protein,MP)是猪肌肉总蛋白的50%~55%[1],它具有的持水性、乳化性及凝胶性等功能特性,影响着肉制品的弹性、黏合性以及质地,决定产品的最终品质。为了更好地发挥肌原纤维蛋白的功能特性,常采用物理改性、化学改性、酶改性等技术对其进行修饰。高压均质是近些年发展起来的一种高新改性技术,它利用均质过程产生的空化、剪切、湍流等作用改变蛋白的结构和功能特性[2]。
关于高压均质的研究报道已有很多[3-8],但目前国内外尚未有关于猪肉肌原纤维蛋白经高压均质处理后乳化特性改善的研究报道,同时在实际生产中,受机械设备的限制,部分均质机的均质压力一般不超过40 MPa,本研究采用均质压力(20 MPa和40 MPa)、均质次数(1次和2次)对肌原纤维蛋白进行改性,并研究其结构的变化,以期为高压均质应用于肌原纤维蛋白的实际生产提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜的猪背最长肌,黑龙江北大荒肉业有限公司;大豆色拉油,安徽中粮油脂有限公司;乙二醇双(2-氨基乙基醚)四乙酸(EGTA),北京华迈科生物技术有限责任公司;十二烷基硫酸钠(SDS)(分析纯),上海源叶生物有限公司;8-苯胺-1-萘磺酸(ANS),上海迈瑞尔化学技术有限公司;牛血清蛋白,北京索莱宝科技有限公司。
酒石酸钾钠、无水CESO4、NaOH、Na2HPO4、NaH2PO4、NaCL等均为国产分析纯。
1.2 仪器与设备
SRH60-70高压均质机,上海申鹿均质机有限公司;T18 basic型匀浆机,德国IKA公司;Mastersizer 3000型马尔文激光粒度仪,英国马尔文公司;Zetasizer Nano型马尔文电位仪,英国马尔文公司;TU-190双光束紫外-可见分光光度计,北京普析通用仪器有限责任公司;GL-21M型高速冷冻离心机,湖南湘仪实验仪器开发有限公司;F96S荧光分光光度计,上海棱光技术有限公司;AVATAR360傅立叶变换红外光谱仪,美国Nicolet公司。
1.3 实验方法
1.3.1 肌原纤维蛋白的高压均质处理
参照GUO等[9]的方法从猪背最长肌中提取肌原纤维蛋白,具体操作如下:将除去脂肪和结缔组织的肉样绞碎,用10 mmol/L磷酸盐缓冲液(含NaCl、MgCl2和EGTA,pH 7.0)低温提取3次,沉淀用0.1 mol/L NaCl洗液洗涤2次后,加入NaCl洗液,匀浆60 s,4层纱布过滤,滤液分成5份,其中1份不经均质处理作对照,剩余4份进行不同条件的高压均质处理(20 MPa 均质1次和2次;40 MPa均质处理1次和2次,后续用20-1、20-2、40-1、40-2表示),随后用0.1 mol/L HCl调节pH值至6.0,3 500 r/min冷冻(4 ℃)离心15 min,取沉淀,真空冷冻干燥备用。以牛血清蛋白为标准品,采用双缩脲法测定蛋白含量[10]。
1.3.2 溶解性测定
将不同均质处理的MP配成10 g/L的溶液,4 000 r/min离心40 min后,用双缩脲法测定上清液的吸光值,溶解度用上清液的蛋白含量与样品中的总蛋白含量的百分比来表示。
1.3.3 粒径测定
将不同均质处理的MP配成1 g/L的溶液,室温(25 ℃)环境下,以蒸馏水作为分散介质,采用激光粒度分析仪测定粒径大小和分布,测定结果以体积等效平均粒径(D4,3)表示。
1.3.4 乳化活性及乳化稳定性的测定
参照RAMIREZ-SUAREZ等[11]的方法,将8 mL 10 mg/mL的MP溶液与2 mL大豆色拉油混匀后用高速分散均质机10 000 r/min匀浆1 min,立即从底部0.5 cm处取50 μL乳化液与5 mL SDS溶液(浓度为1 mg/g)混匀,在500 nm波长下测其吸光值。同时,测定室温放置10 min后的样品。乳化活性(EAI)和乳化稳定性(ESI)按式(1)和(2)计算:
(1)
(2)
式中: ρ,乳化前的蛋白质量浓度,g/mL;φ,乳化液中油的体积比;n,稀释倍数;A0,初始乳化液在500 nm波长下的吸光度;A10,10 min后乳化液500 nm处的吸光度。
1.3.5 乳化液电位测定
将 50 μL不同均质处理的MP乳化液与5 mL磷酸盐缓冲液(pH 7.0,10 mmol/L)混匀后注入弯曲毛细管样品池中,使用马尔文激光粒度仪在常温下测定乳化液电位。
1.3.6 总巯基和活性巯基的测定
参照BEVERIDGE等[12]的方法测定。将15 mg样品用5.0 mL缓冲液(0.086 mol/L Tris, 0.09 mol/L甘氨酸, 4 mmol/L EDTA, pH 8.0)溶解,用于总巯基含量测定的缓冲液中包含8 mol/L的尿素,用于活性巯基含量测定的缓冲液中不包含尿素。然后加入50 μL 的Ellman试剂,漩涡混匀后避光反应1 h,10 000 r/min 离心15 min(4 ℃)。测上清液的蛋白含量及在412 nm处的吸光值。总巯基和活性巯基含量使用2-硝基-5-硫代苯甲酸(NTB)的摩尔消光系数13 600 mol/(L·cm) 计算,单位为μmoL/g。
1.3.7 表面疏水性的测定
根据KATO等[13]的方法,以ANS为荧光探针,利用荧光分光光度计测定不同均质处理后的蛋白质的表面疏水性。蛋白质量浓度被稀释在5~500 μg/mL,激发波长和发射波长分别设置为365 nm和484 nm。以蛋白质量浓度为横坐标,荧光强度为纵坐标,所得曲线的斜率即为表面疏水性指数。
1.3.8 红外光谱分析
真空冷冻干燥后的样品粉末与溴化钾混合研磨并压片,恒温箱里平衡5 min,红外光谱仪扫描,范围4 000~600 cm-1,分辨率4 cm-1,每个样品图谱扫描重复3次,采集红外光谱图。利用OMNIC 8.0对图谱进行处理后,使用Peak fit 4.2软件对1 600~1 700 cm-1酰胺I段的图谱进行分析,经过图谱过滤、平滑和基线校正处理后,用Gaussian函数对图谱进行去卷积、二阶求导,估计出各个叠加的子峰个数和峰位,通过二阶导数多次拟合直至残差最小,确认各子峰位归属,α-螺旋、β-折叠、β-转角和无规卷曲含量的相对含量根据各子峰的积分面积计算[14]。
1.4 数据统计分析
每个试验重复3次,结果表示为平均数±SD。差异显著性分析采用Statistix 8.1软件进行,作图采用Sigmaplot 12.5软件。
2 结果与分析
2.1 高压均质对肌原纤维蛋白功能特性的影响
2.1.1 高压均质对肌原纤维蛋白溶解性的影响
溶解性是蛋白质水化作用的重要体现,蛋白质的水化作用加强,其溶解度升高,蛋白质的高溶解性对肉制品加工至关重要。不同均质压力与次数对肌原纤维蛋白溶解性的影响见图1。
经均质压力为20 MPa和40 MPa,均质次数为1次和2次的处理组,其溶解度均显著优于未经高压均质处理的对照组(P < 0.05),其中经40 MPa均质1次的处理组其溶解度表现为最高。溶解度提高的原因可能是肌原纤维蛋白受到强烈剪切和振荡等作用,其紧密结构逐渐展开,蛋白质内部的极性基团裸露出来,表面电荷增多,结合于新暴露的极性基团的水也增多,蛋白质的水化作用加强,其溶解度上升[15]。当均质次数增加时,溶解度反而降低,可能是由于多次均质使蛋白分子过度展开,疏水作用增强,形成了难溶的聚集体,因而溶解度下降,故选择1次均质最为适宜[16]。FLOUR等[17]采用高于150 MPa的均质压力处理大豆球蛋白,结果发现其溶解性丧失,分析原因也可能是蛋白发生聚集所导致。
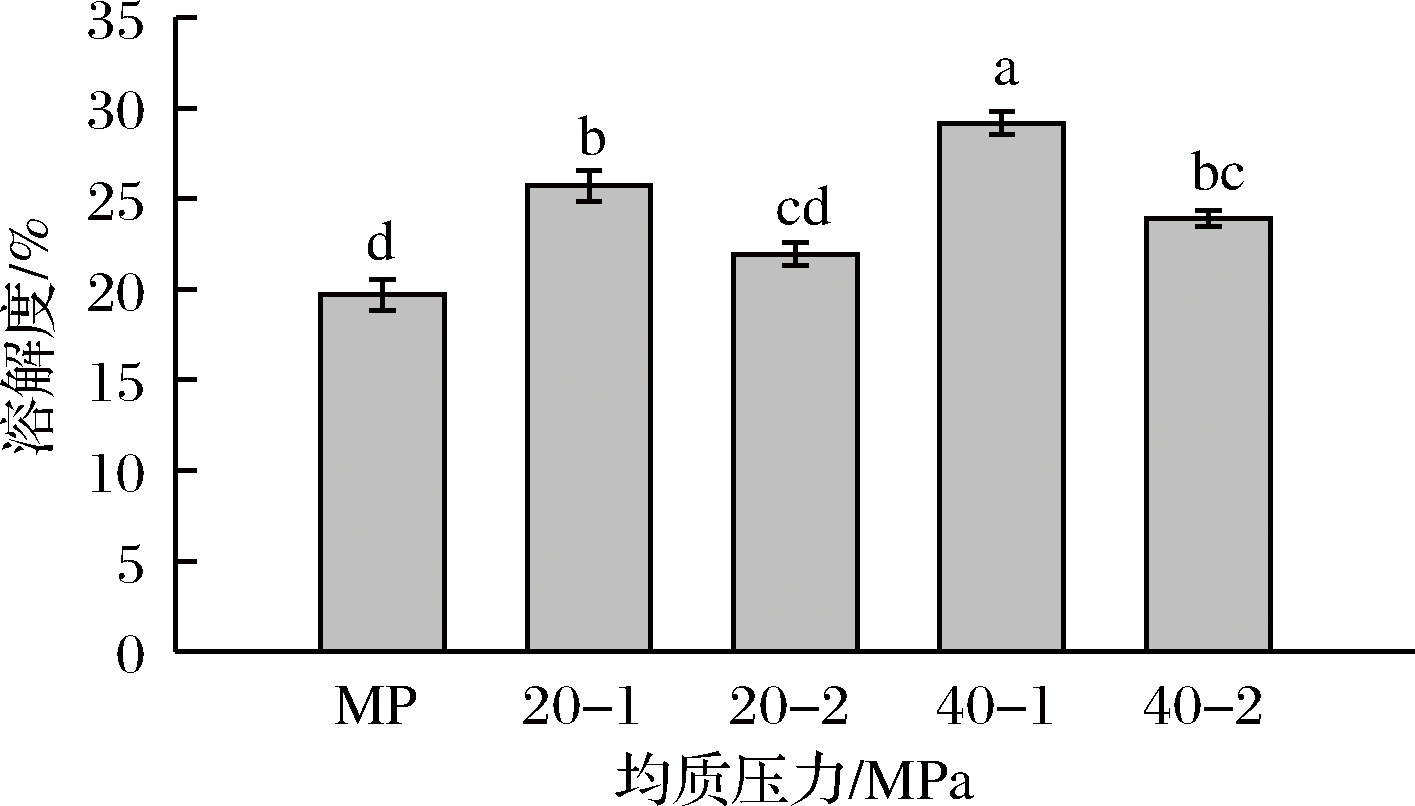
图1 高压均质对肌原纤维蛋白溶解性的影响
Fig.1 Effect of high pressure homogenization treatment on solubility of MP
注:图中不同小写字母表示差异显著,下同。
2.1.2 高压均质对肌原纤维蛋白粒径的影响
粒径分布能够反映蛋白的聚集程度。由图2可以看出,与未经高压均质处理的对照相比,均质处理的蛋白,其粒径均朝着粒径变小的方向移动,且均质压力越高,移动越明显,40 MPa均质处理1次的变化效果最显著。图3体积平均粒径D4,3也表明,随着均质压力的增加,D4,3显著降低,40 MPa均质处理1次的D4,3最小,说明高压均质能够使蛋白分子发生解聚,使其粒径变小。DUMAY等[18]也报道高压均质产生的机械力破坏了蛋白结构,使其粒径减小。
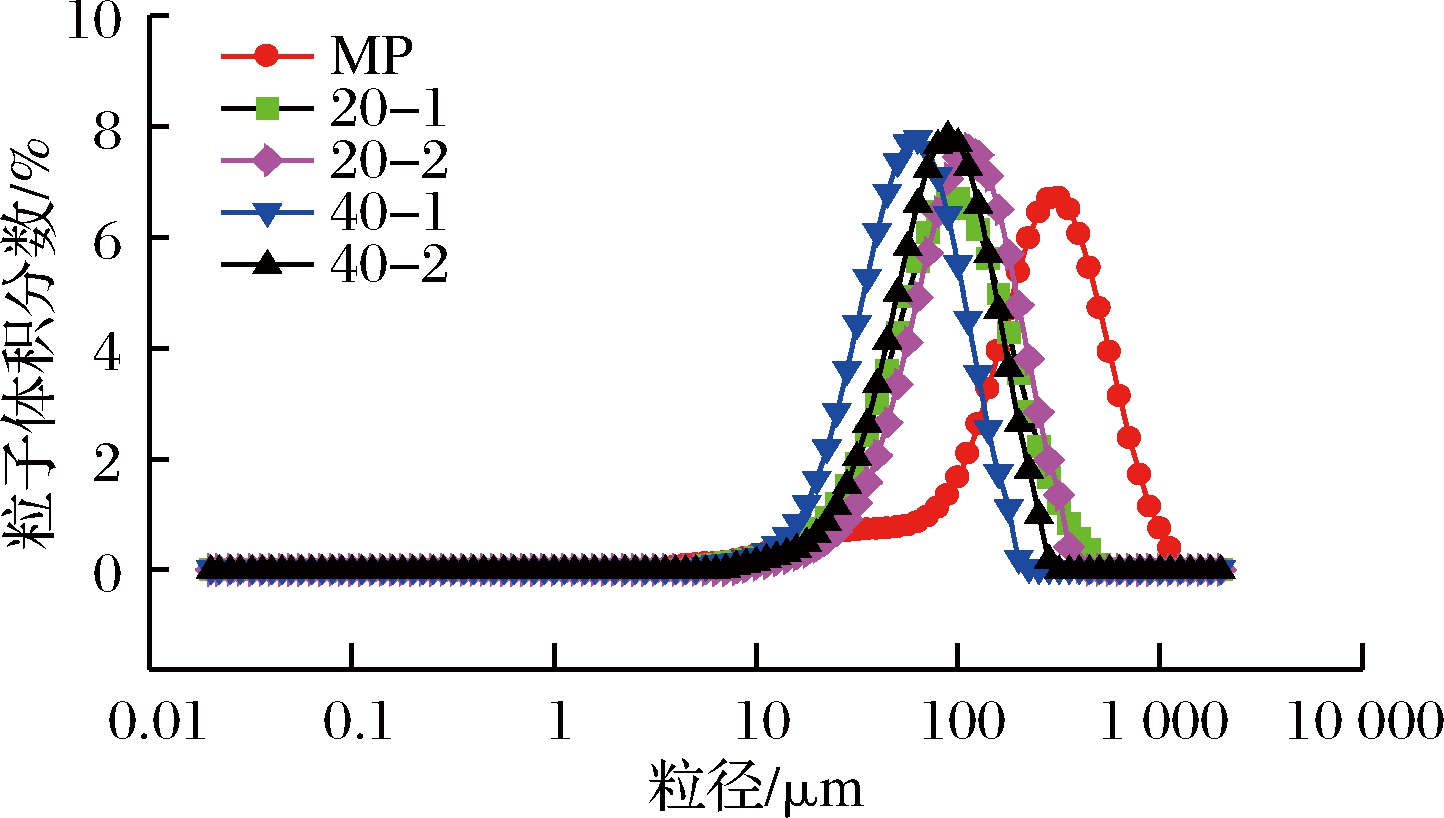
图2 高压均质对肌原纤维蛋白粒径分布的影响
Fig.2 Effect of high pressure homogenization treatment on particle size distribution of MP
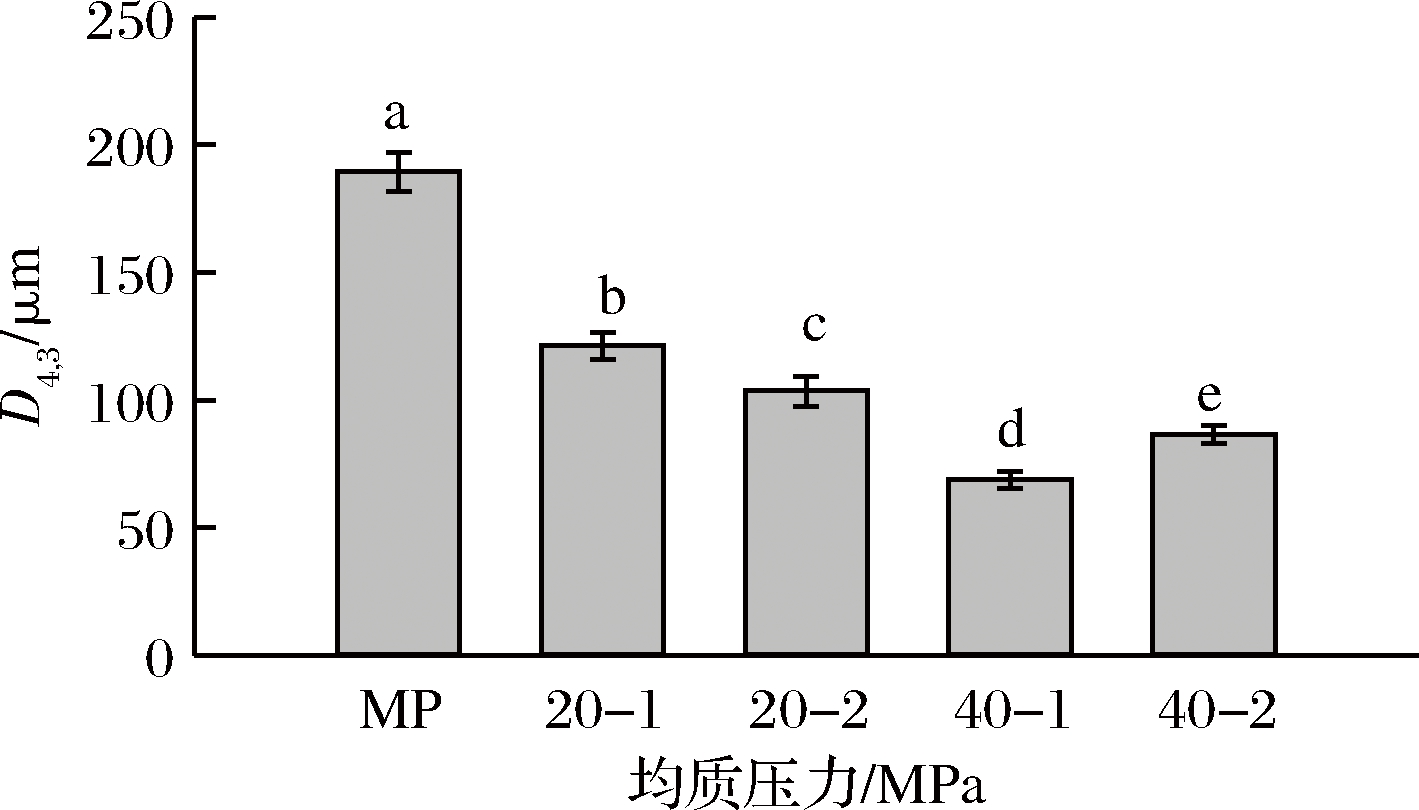
图3 高压均质对肌原纤维蛋白粒径的影响
Fig.3 Effect of high pressure homogenization treatment on particle size of MP
2.1.3 高压均质对肌原纤维蛋白乳化活性及乳化稳定性的影响
乳化能力指乳状液在相转变前每克蛋白质所能乳化油的体积。肉的乳化能力主要表现在肉中蛋白质固定脂肪的能力,乳化能力高意味着能够固定更多的脂肪,也意味着加工制成稳定的乳化肉产品时能够减少跑油的现象。高压均质对肌原纤维蛋白乳化活性和乳化稳定性的影响见图4。
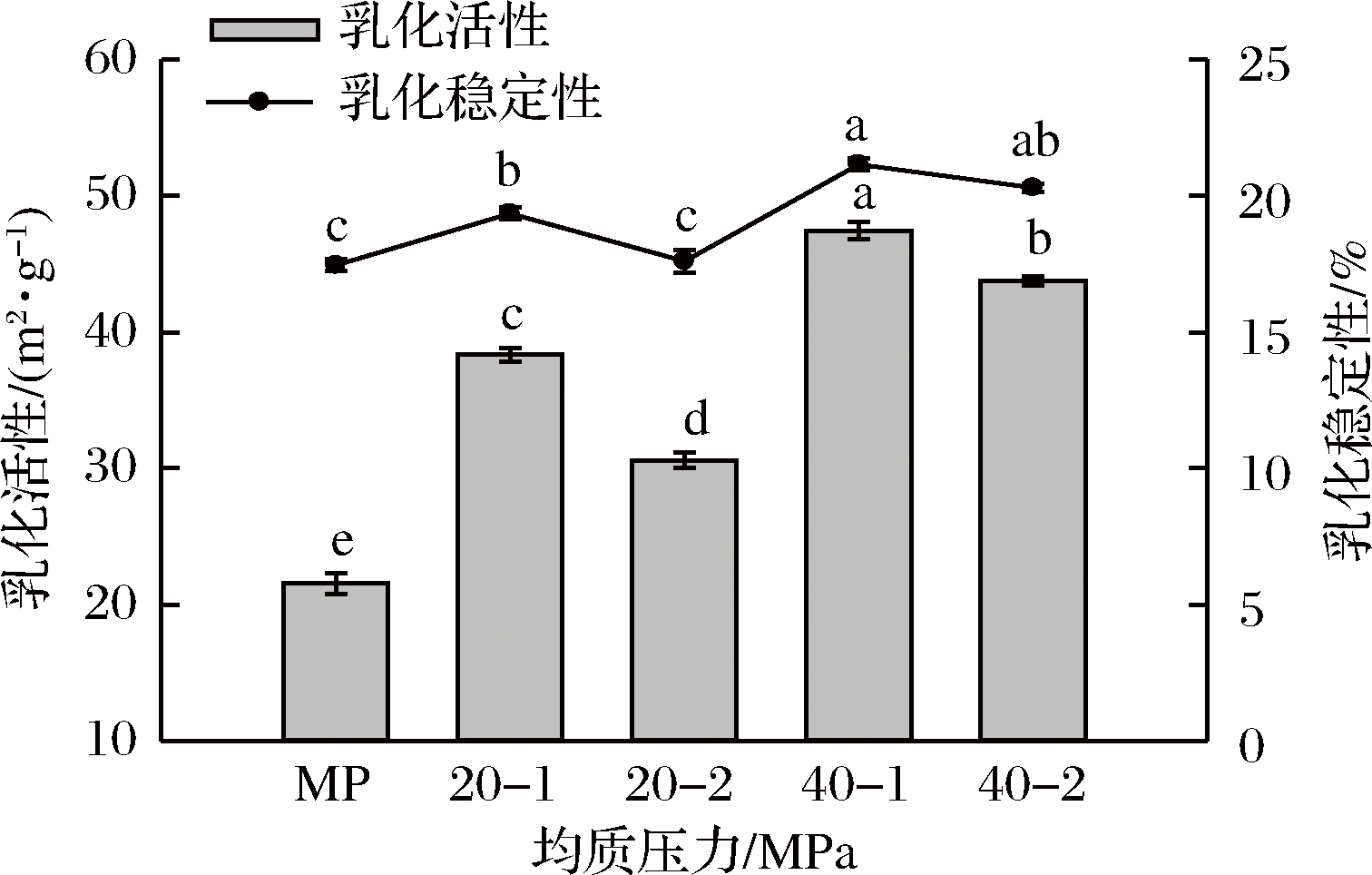
图4 高压均质对肌原纤维蛋白乳化活性和乳化稳定性的影响
Fig.4 Effect of high pressure homogenization treatment on emulsifying activity and emulsion stability of MP
由图4可以看出,经均质压力20 MPa和40 MPa,均质次数为1次和2次的处理组,其乳化活性均优于未经高压均质处理的对照组,其中经40 MPa均质1次的处理组其乳化活性表现最高,乳化值达到47.45 m2/g,这与溶解性的结果相一致。可能是由于蛋白质溶解性提高,会使更多的蛋白溶于水,进而加快了蛋白的迁移,使更多的蛋白吸附到油水界面,从而乳化活性提高。然而相同的均质压力下,均质2次的乳化活性均低于均质1次,这可能是多次均质使得疏水作用增强,进而形成不溶的聚集物,降低了蛋白迁移到油水界面的机率,乳化活性降低。乳化稳定性随着均质压力的变化趋势与乳化活性变化趋势相似。
2.1.4 高压均质对肌原纤维蛋白乳化液电位的影响
乳化液滴表面的带电性质能够反映液滴间的相互作用,进而说明乳化液的乳化能力。乳化液滴表面电荷的多少可通过电位来反映。电位的正负通常是由乳液所处的pH值决定,乳液的pH高于蛋白等电点,乳液就带负电荷,低于蛋白等电点,乳液就带正电荷[19]。

图5 高压均质对肌原纤维蛋白电位的影响
Fig.5 Effect of high pressure homogenization treatment on zeta potential of MP
图5中未经高压均质处理的MP的电位为(-13.1±0.954)mV,随着均质压力的增加,电位绝对值显著升高,说明表面带的负电荷逐渐增强,液滴间的静电斥力增强,进而阻碍了液滴间的聚集,使乳液的稳定性增强,这与乳液稳定性结果相一致。
2.2 高压均质对肌原纤维蛋白结构的影响
2.2.1 高压均质对肌原纤维蛋白总巯基和活性巯基的影响
总巯基指位于蛋白质分子表面的活性巯基和包埋于蛋白质分子内部的巯基,即蛋白质分子的所有巯基,活性巯基指暴露于蛋白质分子表面的巯基[20]。巯基含量的变化反映蛋白的结构改变,进而影响蛋白质的功能性质[21]。随着均质压力的增加,肌原纤维蛋白总巯基呈现逐渐减小的趋势,而活性巯基呈现先增加后降低的趋势,这可能是因为高压均质使蛋白分子结构变得松散,埋藏于分子内部的巯基基团逐渐暴露于表面,并随着压力的增加暴露逐渐增加,然而当均质压力为40 MPa,均质2次时,活性巯基含量开始减少,究其原因,可能是多次均质使蛋白分子结构因聚集而变得紧密,进而使活性巯基含量减少。
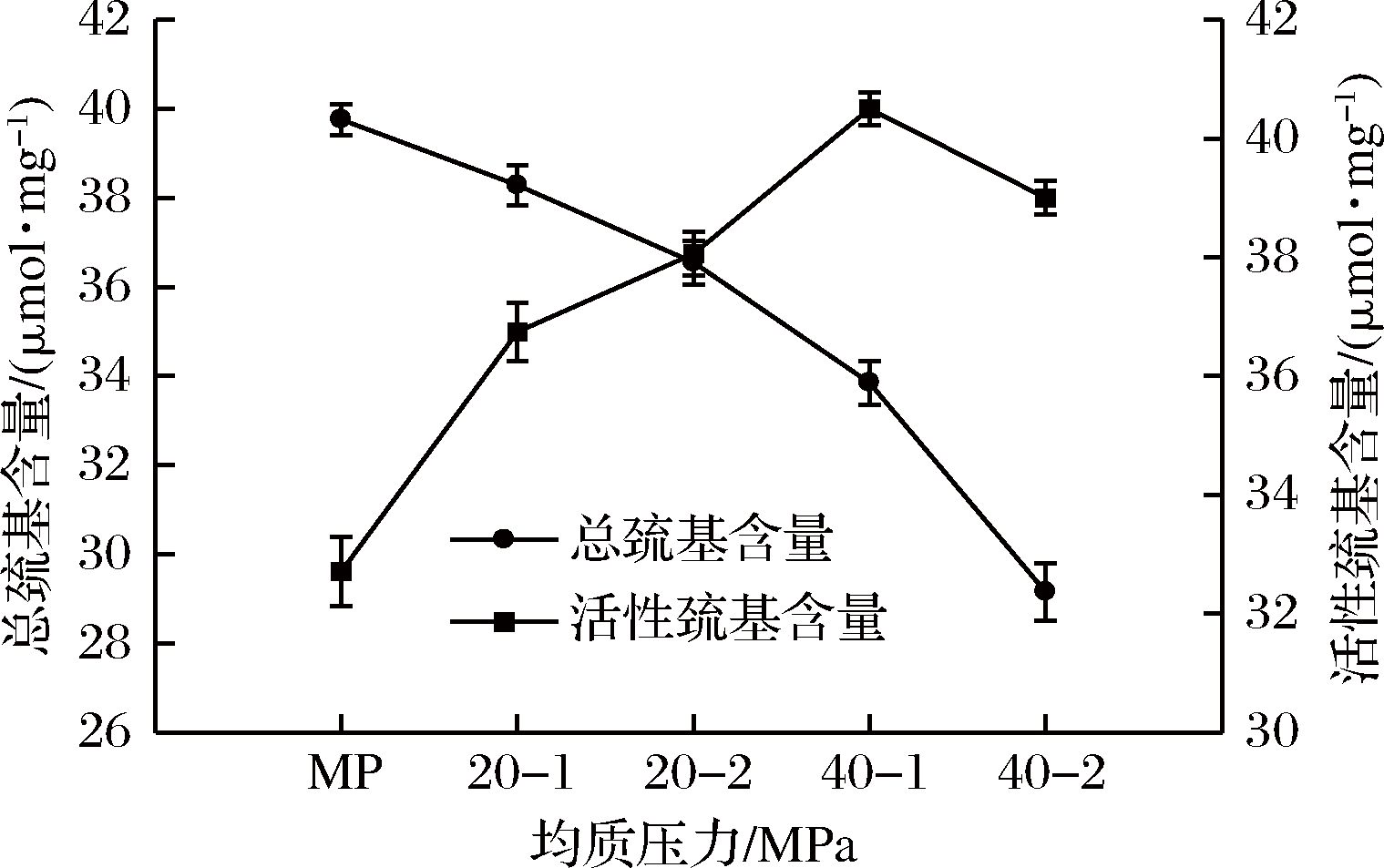
图6 高压均质对肌原纤维蛋白总巯基和活性巯基的影响
Fig.6 Effect of high pressure homogenization treatment on total sulfhydryl content and exposed sulfhydryl content of MP
另外,处理过程是在空气中进行的,暴露于表面的巯基易氧化生成二硫键,从而使总巯基含量下降。
2.2.2 高压均质对肌原纤维蛋白表面疏水性的影响
表面疏水性反映蛋白质表面疏水性氨基酸的相对含量,对维持蛋白质构象的稳定具有重要的作用,在一定程度上能够表征蛋白质结构的改变。由图7可以看出,随着均质压力及次数的增加,表面疏水性呈上升趋势,可能是高压处理破坏了蛋白质的高级结构,使其解折叠,进而蛋白内部的疏水性氨基酸如色氨酸和苯丙氨酸等残基暴露于蛋白表面,增加了蛋白的表面疏水性。KO等[22]研究发现高压处理罗非鱼肌动球蛋白后其表面疏水性增加,张自业[23]采用超高压处理鸡肉肌原纤维蛋白,也得出表面疏水性增加的结论。另外,张晶等报道80 MPa的压力处理大米蛋白,其表面疏水性增加,乳化活性得到改善。也有研究报道,表面疏水性增加,能够降低界面张力,增加蛋白质与油脂之间的相互作用,利于乳化层形成,进而使其乳化性提高[24],本研究也得到类似的结论。

图7 高压均质对肌原纤维蛋白表面疏水性的影响
Fig.7 Effect of high pressure homogenization treatment on surface hydrophobicity of MP
2.2.3 高压均质处理后肌原纤维蛋白的红外光谱分析
不同化合物由于其分子结构的不同,在红外光谱图中所显示的谱带位置、数目、强度等均不同,因此根据化合物的红外光谱图,可以定性分析该物质官能团的变化,进而分析其结构发生的变化。蛋白质二级结构变化与C![]() O、C—N和N—H的振动方式有关,这些振动方式使红外在多个波段均有吸收,其中,酰胺Ⅰ带(1 600~1 700 cm-1)的伸缩振动以C
O、C—N和N—H的振动方式有关,这些振动方式使红外在多个波段均有吸收,其中,酰胺Ⅰ带(1 600~1 700 cm-1)的伸缩振动以C![]() O为主[25],常被用来分析蛋白质二级结构的变化。有研究报道,酰胺Ⅰ带谱峰在1 610~1 640 cm-1处反映的是蛋白质二级结构中的β-折叠[26-27]。由图8可知看出,与未经均质处理的肌原纤维蛋白红外谱图比较,经高压均质处理后的红外谱图未出现新的吸收峰,但随着均质压力的增加,酰胺I峰在1 638 cm-1处发生蓝移,即向高波数方向移动,同时,峰的强度也减弱,说明蛋白质二级结构中的β折叠发生了变化。
O为主[25],常被用来分析蛋白质二级结构的变化。有研究报道,酰胺Ⅰ带谱峰在1 610~1 640 cm-1处反映的是蛋白质二级结构中的β-折叠[26-27]。由图8可知看出,与未经均质处理的肌原纤维蛋白红外谱图比较,经高压均质处理后的红外谱图未出现新的吸收峰,但随着均质压力的增加,酰胺I峰在1 638 cm-1处发生蓝移,即向高波数方向移动,同时,峰的强度也减弱,说明蛋白质二级结构中的β折叠发生了变化。

图8 高压均质处理后的肌原纤维蛋白红外光谱图
Fig.8 FT-IR spectroscopy of MP after high pressure homogenization treatment
由图9也可以看出,随着均质压力的增加,α-螺旋和β-折叠含量减少,β-转角和无规卷曲含量增加,表明高压均质使α-螺旋和β-折叠向β-转角和无规卷曲转化,蛋白分子由有序向无序结构转变。
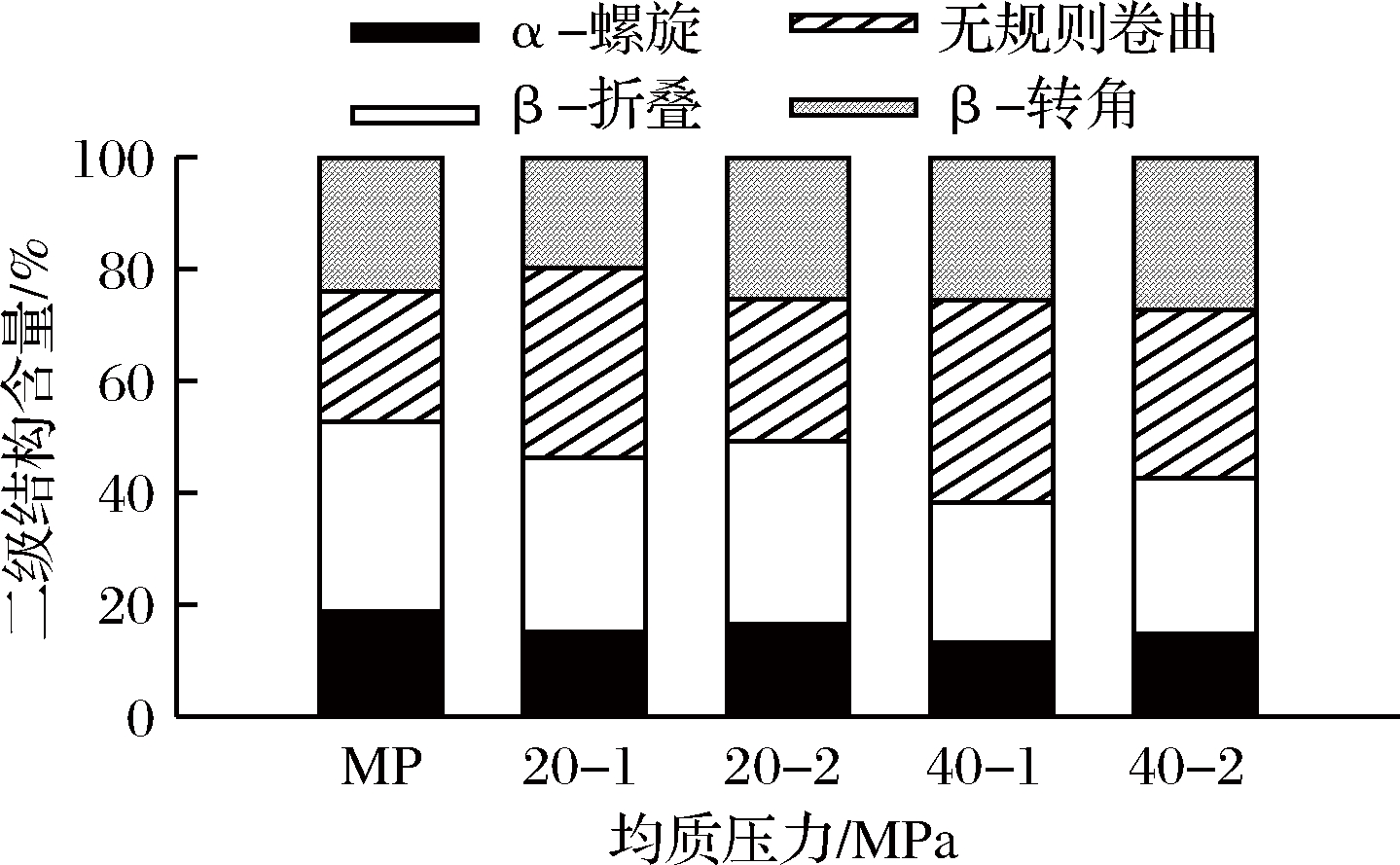
图9 高压均质处理后的肌原纤维蛋白二级结构含量的变化
Fig.9 The secondary structure contents changes of MP after high pressure homogenization treatment
这可能是随着均质压力的增大,肌原纤维蛋白分子间的氢键作用减小,分子间的相互作用减弱,蛋白质分子展开,结构变得松散,蛋白内部的非极性基团暴露,蛋白质二级结构发生了变化,表现为α-螺旋、β-折叠含量的降低以及表面疏水性的增加。王辰等[28]采用红外光谱分析大豆分离蛋白结构的变化,结果发现蛋白的表面疏水性与α-螺旋呈负相关与无规则卷曲呈正相关。WANG等[29]也研究表明大豆分离蛋白的表面疏水性与β-折叠含量的变化呈负相关。
3 结论
采用均质压力(20 MPa和40 MPa)、均质次数(1次和2次)对肌原纤维蛋白进行改性,结果发现高压均质能够改善MP的理化性和乳化性,均质压力为40 MPa,均质次数为1次的处理组表现出较低的粒径和较高的溶解性、乳化活性、乳化稳定性以及电位绝对值。通过对总巯基和活性巯基的分析得出其含量随着均质压力的变化而变化,表面疏水性随着均质压力的增加,也表现出上升趋势,红外光谱表明均质处理能够改变肌原纤维蛋白的二级结构,α-螺旋和β-折叠含量减少,β-转角和无规卷曲含量增加。然而关于均质处理过程中结构的变化机理有待进一步研究。
[1] FENG X C, CHEN L, LEI N, et al. Emulsifying properties of oxidatively stressed myofibrillar protein emulsion gels prepared with(-)-epigallocatechin-3-gallate and NaCl[J]. Journal of Agricultural and Food Chemistry, 2017, 65(13):2 816-2 826.
[2] FLOURY J, DESRUMAUX A, LARDI RES J. Effect of high-pressure homogenization on droplet size distributions and rheological properties of model oil-in-water emulsions[J]. Innovative Food Science & Emerging Technologies, 2000, 1(2):127-134.
RES J. Effect of high-pressure homogenization on droplet size distributions and rheological properties of model oil-in-water emulsions[J]. Innovative Food Science & Emerging Technologies, 2000, 1(2):127-134.
[3] DEFAYE A B, LEDWARD D A, MACDOUGALL D B, et al. Renaturation of metmyoglobin subjected to high isostatic pressure [J]. Food Chemistry, 1995, 52(1):19-22.
[4] 李杨,李明达,张毅方,等.低压均质处理对大豆分离蛋白溶解性及结构的影响[J].农业机械学报,2019,50(3):345-351.
[5] 翟爱华,杨盛楠.高压均质对大豆蛋白7S和11S组分功能性质的影响[J].食品科技,2015(6):208-211.
[6] 龙小涛,赵谋明,罗东辉,等.高压均质对大豆分离蛋白功能特性的影响[J].食品与发酵工业,2009,35(3):49-52.
[7] 源博恩,赵强忠,赵谋明.酸性条件下高压均质对大豆蛋白结构与功能特性的影响[J].食品工业科技,2012,33(8):117-120.
[8] YU C P, WU F, YUE C, et al. Effects of high-pressure homogenization on functional properties and structure of mussel (Mytilus edulis) myofibrillar proteins[J]. International Journal of Biological Macromolecules, 2018, 118:741-746.
[9] GUO A Q, XIONG Y L. Glucose oxidase promotes gallic acid-myofibrillar protein interaction and thermal gelation [J]. Food Chemistry, 2019, 293:529-536.
[10] GORNALL A G, BARDAWILL C J, DAVID M M. Determination of serum proteins by means of the biuret reaction[J]. Journal of Biological Chemistry, 1949, 177(2): 751-766.
[11] RAMIREZ-SUAREZ J C, XIONG Y L. Rheological properties of mixed muscle/nonmuscle protein emulsions treated with transglutaminase at two ionic strengths [J]. International Journal of Food Science & Technology, 2010, 38(7):777-785.
[12] BEVERIDG T, TOMA S J, NAKAI S. Determination of SH and SS-groups in some food proteins using Ellman's reagent [J]. Journal of Food Science, 1974, 39(1):49-51.
[13] KATO A, NAKAI S. Hydrophobicity determined by a fluorescence probe methods and its correlation with surface properties of proteins [J]. Biochim Biophys Acta, 1980, 624(1):13-20.
[14] BYLER D M, SUSI H. Examination of the secondary structure of proteins by deconvolved FTIR spectra [J]. Biopolymers, 1986, 25: 469-487.
[15] 张晶,丁芳,邹晴晴,等.压均质对大米蛋白功能特性及物化特性的影响[J].食品与机械,2016,32(6):9-12;33.
[16] 杨盛楠,翟爱华.高压均质对大豆分离蛋白功能性质的影响[J].中国酿造,2014,33(12):89-93.
[17] FLOURY J, DESRUMAUX A, LEGRAND J. Effect of ultra-high-pressure homogenization on structure and on rheological properties of soy protein-stabilized emulsions[J]. Journal of Food Science, 2006, 67(9):3 388-3 395.
[18] DUMAY E, CHEVALIER-LUCIA D, LAETITIA P P, et al. Technological aspects and potential applications of (ultra) high-pressure homogenization[J]. Trends in Food Science & Technology, 2013, 31(1):13-26.
[19] 刘宁,李骋,金昱辰,等.不同蛋白对水包油型乳状液稳定性影响[J].食品科技, 2017,42 (12): 69-73.
[20] 邓思杨,王博,李海静,等.冻融次数对镜鲤鱼肌原纤维蛋白功能和结构特性变化的影响[J/OL].食品科学:1-10[2019-04-12].http://kns.cnki.net/kcms/detail/11.2206.TS.20180918. 1151.004. html.
[21] CHAPLEAN N, MANGAVEL C, COMPOINT J P, et al. Effect of high- pressure processing on myofibrillar protein structure[J]. Journal of the Science of Food & Agriculture, 2010, 84(1):66-74.
[22] KO W C, JAO C L, HSU K C. Effect of hydrostatic pressure on molecular conformation of tilapia (Orechromis niloticus) myosin [J]. Journal of Food Science, 2003, 68(4):4.1 192-1 195.
[23] 张自业. 盐和超高压处理对肌原纤维蛋白凝胶特性与作用力的影响及调控机理研究[D].南京:南京财经大学,2016.
[24] YIN S W, TANG C H, CAO J S, et al. Effects of limited enzymatic hydrolysis with trypsin on the functional properties of hemp (Cannabis sativa L.) protein isolate[J]. Food Chemistry, 2008, 106(3):1 004-1 013.
[25] 魏苏萌,游远,杨玉玲,等.氧化对肌原纤维蛋白流变学特性及结构的影响[J].食品工业科技,2019,40(8):29-33.
[26] 戈志成,张燕萍.对改性小麦面筋蛋白二级结构的红外光谱研究[J].中国粮油学报,2006,21(3):36-38.
[27] 闫洁,马晓军.不同干燥方式对大豆蛋白二级结构的影响[J].食品工业科技,2008,29(5): 131-132;136.
[28] 王辰,江连洲,魏冬旭,等.不同品种大豆分离蛋白结构与表面疏水性的关系[J].食品科学,2012,33(9):54-57.
[29] WANG Z J, LI Y, JIANG L Z, et al. Relationship between secondary structure and surface hydrophobicity of soybean protein isolate subjected to heat treatment [J]. Journal of Chemistry, 2014,2014:1-10.