食用菌采后含水量高,呼吸与蒸腾作用强烈,生理代谢旺盛,且表面无保护结构,微生物易滋生,常温贮藏2~3 d即出现开伞、褐变、软化等现象,影响商品质量[1-2]。加强食用菌采后保鲜,延长其贮藏期,对食用菌产业持续健康发展具有重要意义。
生物保鲜剂包括天然提取物、微生物菌体及代谢产物等,将其配制成溶液,通过浸泡、喷淋等方式应用于食用菌,能够隔离食用菌与空气接触,减缓呼吸速率,延缓氧化作用,抑制腐败微生物[3-4]。复合生物保鲜剂将不同来源的生物保鲜剂综合利用,发挥协同作用,能够长期保持食用菌风味和营养价值[5]。近年来,我国对食用菌复合生物保鲜剂进行了较多研究,在金针菇[6]、茶新菇[7]、鸡腿菇[8]、香菇[9-11]、双孢菇[12]、海鲜菇[13]等保鲜中均有体现。
我国杏鲍菇产量因栽培技术推广而大幅提升,其采后保鲜已成为亟待解决的问题[14]。刘开华等[15]研究发现,茶多酚和大豆分离蛋白复合处理明显抑制褐变度和呼吸强度增加、降低失重率、减少可溶性固形物损失。赵春燕等[16]研究发现,壳聚糖复合液(壳聚糖2 g/L、乙酸1.5%、乳酸链球菌素0.4 g/kg)涂膜处理能够延迟褐变、减缓水分蒸发、抑制腐败,延长货架期7 d。赵梅等[17]研究发现,纳米壳聚糖复合液涂膜处理能够降低失重率,抑制呼吸强度和多酚氧化酶活性,延缓可溶性固形物和Vc降解。
近年来,添加抗菌剂、抗氧化剂等活性物质制备涂膜剂已成为保鲜领域的研究热点。目前,抗氧化肽主要用于肉制品保鲜[18-22],通过减少挥发性盐基氮,降低硫代巴比妥酸值和过氧化物值,抑制脂质氧化,延长贮藏期,在果蔬保鲜上应用较少。研究表明,谷胱甘肽处理能够降低荔枝多酚氧化酶(polyphenol oxidase, PPO)活性和相对电导率,提高超氧化物岐化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)活性,降低丙二醛(malondialdehyde, MDA)含量,维持VC含量[23]。金针菇蛋白酶解肽处理冬枣可以降低腐烂率,抑制SOD和CAT活性,减少VC损失[24]。胶原多肽复合涂膜剂可以减缓苹果贮藏期间硬度、总酸和可溶性固形物含量下降,降低失重率[25]。
本课题组前期采用酶法水解滑菇蛋白制备抗氧化肽[26-27],研究发现滑菇肽能够维持杏鲍菇贮藏期间SOD和CAT活性,抑制PPO活性。为开发新型杏鲍菇复合生物保鲜剂,本试验通过研究羧甲基壳聚糖与滑菇肽复合涂膜对杏鲍菇贮藏期间理化品质的影响,揭示其对杏鲍菇保鲜效果,为延长杏鲍菇贮藏期提供参考。
1 材料与方法
1.1 材料与试剂
杏鲍菇,采自天津市食用菌技术工程中心,菇体完整、无病虫害、未开伞、七八分熟,采后运至天津市林业果树研究所。PPO、SOD、CAT测试盒,购自南京建成生物工程研究所。羧甲基壳聚糖(脱乙酰度≥85%、分子质量20~50 kDa),购自北京索莱宝科技有限公司,其他试剂均为国产分析纯。
1.2 仪器与设备
ColorFlex EZ型色差仪,美国HunterLab公司;TMS-Pro型质构仪,美国FTC公司;FA2004C型分析天平,上海越平科学仪器有限公司;GXH-3010E型便携式红外线CO2分析仪,北京华云分析仪器有限公司;LHS-250HC-Ⅱ型恒温恒湿箱,上海一恒科学仪器有限公司;PHS-3C型pH计,上海精密科学仪器有限公司;TU-1810型紫外可见分光光度计,北京普析通用仪器有限责任公司;GL-20C型高速冷冻离心机,上海安亭科学仪器厂;HJ-6型磁力加热搅拌器,常州国华电器有限公司。
1.3 实验方法
1.3.1 滑菇肽制备
根据文献[26-27]从滑菇子实体干品中提取粗蛋白。配制底物浓度30 g/L的粗蛋白溶液,置于超声波细胞粉碎机中,在功率300 W、温度40 ℃下处理20 min;置于55 ℃水解反应器中,调节pH值至9.0,加入3 500 U/g碱性蛋白酶,水解3.5 h;水解结束后80 ℃处理20 min, 灭酶,冷却,6 000 r/min离心20 min,取上清;置于55 ℃水解反应器中,调节pH值至7.0,加入3 000 U/g风味蛋白酶,水解1.5 h;水解结束后80 ℃处理20 min, 冷却,6 000 r/min离心20 min,取上清,浓缩,冷冻干燥,即滑菇肽。
1.3.2 保鲜剂制备
称取10 g羧甲基壳聚糖,蒸馏水溶解,移至1 L容量瓶,定容,即得10 g/L羧甲基壳聚糖保鲜剂。在上述保鲜剂中加入1 g滑菇肽,混匀,即得10 g/L羧甲基壳聚糖-0.1 g/L滑菇肽复合保鲜剂。
1.3.3 杏鲍菇保鲜
挑选大小均一、无机械损伤、表面光洁的杏鲍菇,洗净后晾干,分为对照组(CK)、羧甲基壳聚糖处理组(TC)、羧甲基壳聚糖-滑菇肽处理组(TCP),每组50个杏鲍菇。各处理组以杏鲍菇∶保鲜剂=1∶5(g∶mL)分别将杏鲍菇放入相应的保鲜剂中,20 ℃浸泡2 min,以蒸馏水浸泡处理为对照。取出后30目筛盘沥干水分,装入保鲜盒,每盒5个杏鲍菇,密封,在温度(4±0.5)℃、相对湿度(85±5)%条件下贮藏30 d。每个处理10个重复。每3 d取样1次,测定指标。
1.3.4 指标测定
1.3.4.1 白度
采用色差仪测定。根据CIELAB表色系统,测定菇柄中部黑白度L*值,仪器用标准白板(L*=94.11)校正,重复3次,求平均值。以L*值反映颜色变化,L*值越大表示褐变程度越轻。
1.3.4.2 硬度
采用质构仪测定。将杏鲍菇置于载物台,分别对菇盖、菇柄中部径向穿刺测定硬度,每个部位取3个点,重复3次,求平均值。测定模式为质地多面分析,探头类型为直径5 mm圆柱形探头,测定温度为20 ℃,测定参数为下压距离5 mm、下压速率1 mm/s。
1.3.4.3 失重率
采用称量法[28]。每个处理随机取5个杏鲍菇,称重,重复3次,求平均值。计算公式(1)如下:
失重率![]()
(1)
式中:m1为贮藏前杏鲍菇质量,g;m2为贮藏后杏鲍菇质量,g。
1.3.4.4 呼吸强度
采用静置法测定[29]。每个处理分别称取50 g样品,置于1 L锥形瓶中,封口膜密封,20 ℃贮藏1 h,CO2分析仪测定呼吸强度,重复3次,求平均值。以每千克样品每小时释放的CO2质量表示,即mg/(kg·h)。
1.3.4.5 MDA含量
采用硫代巴比妥酸法[30-31]。称取1 g样品,加入5 mL 10%三氯乙酸溶液,匀浆,5 000 r/min离心10 min,取上清2 mL,移至10 mL试管,加入2 mL 0.6% 硫代巴比妥酸溶液,混匀,以蒸馏水为空白,沸水浴10 min,冷却,5 000 r/min离心10 min,取上清,测定450、532、600 nm吸光值。
1.3.4.6 SOD、CAT、PPO活性
酶提取液制备参考程曦等[31]方法并稍作修改。称取2 g样品,置于研钵中,加入8 mL、0.1 mol/L pH值7.0磷酸钠缓冲液,匀浆,移至10 mL离心管,10 000 r/min 离心10 min,取上清,移至10 mL容量瓶,定容。根据测试盒说明书测定SOD、CAT、PPO活性,重复3次,取平均值。
1.3.4.7 Vc含量
采用紫外快速测定法[32]。称取1 g样品,加入5 mL 1%盐酸,匀浆,移至25 mL容量瓶,定容。5 000 r/min离心10 min,取上清0.2 mL,移至10 mL容量瓶,加入0.2 mL 10%盐酸,定容,以蒸馏水为空白,243 nm测定吸光值。
1.3.4.8 可溶性糖含量
采用苯酚-硫酸法[32]。称取1 g样品,液氮研磨匀浆,移至10 mL试管,加入5 mL蒸馏水,沸水浴30 min, 过滤,滤液移至100 mL容量瓶,定容。取1 mL 稀释液,移至10 mL试管,加入1 mL蒸馏水、1 mL、0.09 g/mL苯酚溶液,混匀,加入5 mL浓H2SO4,20 ℃反应30 min,490 nm测定吸光值。
1.4 数据处理
各指标重复测定3次,结果以x±s表示,采用Excel软件作图,SPSS 17.0软件分析,采用邓肯氏多重比较法进行差异显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 保鲜剂处理对白度的影响
杏鲍菇采后发生失水、褐变、软化等品质劣变现象,分析原因是由本身含有的酶类以及环境的理化因素造成。因此,色泽、硬度等是评价感官品质的重要指标。由图1可知,随着贮藏时间延长L*值逐渐下降,但各处理组L*值下降缓慢,且始终高于对照组。贮藏30 d后TCP组和TC组L*值分别为70.33和61.11,显著高于对照组(P<0.05),且TCP组和TC组存在显著差异(P<0.05)。本试验中对照组和TC组杏鲍菇分别贮藏12 d和21 d后已不能被消费者所接受,而TCP组杏鲍菇贮藏30 d后仍被消费者所接受。
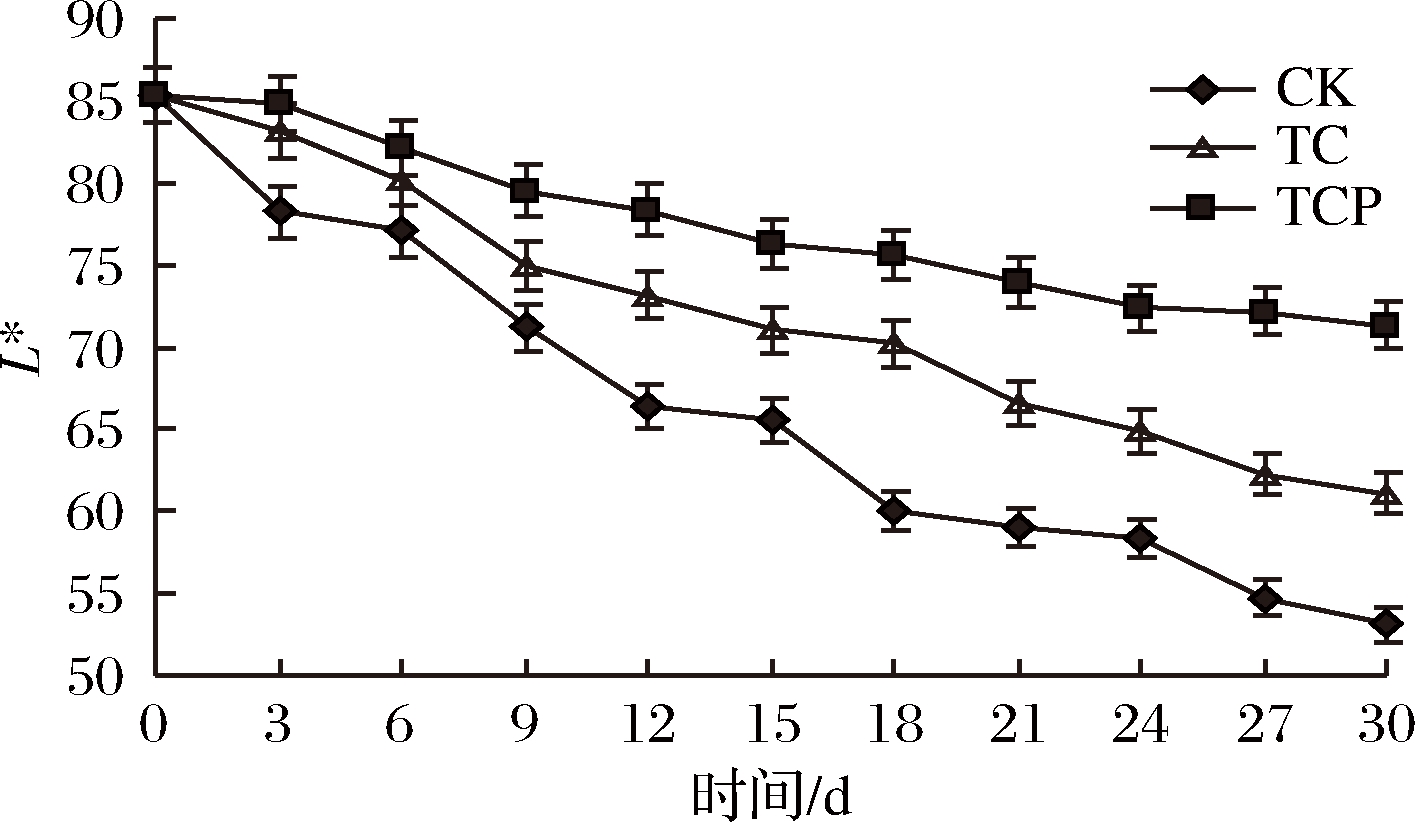
图1 保鲜剂处理对L*值的影响
Fig.1 Effect of biological preservative treatment on L*value
因此,保鲜剂处理可以较好地保持色泽,减轻褐变程度,且复合保鲜剂效果更佳。
2.2 保鲜剂处理对硬度的影响
由图2可知,贮藏前期(0~9 d)硬度下降较快,贮藏9 d后对照组硬度降至110 g,TCP组和TC组分别降至180 g和150 g,与对照组存在显著差异(P<0.05)。之后硬度下降趋于平缓,贮藏30 d后TCP组和TC组硬度分别为150 g和110 g,显著高于对照组(P<0.05)。因此,保鲜剂处理可以抑制硬度下降,延缓老化过程。
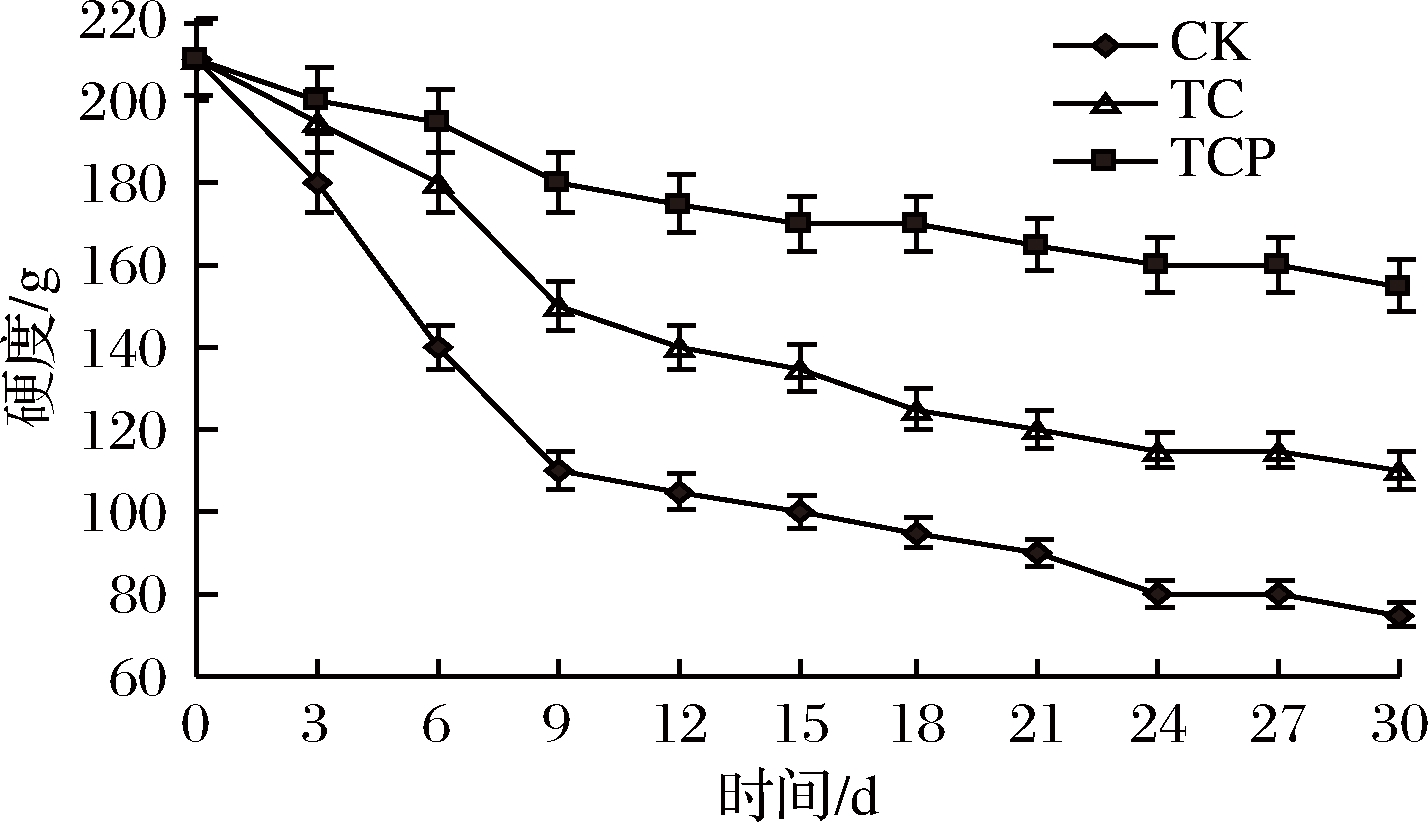
图2 保鲜剂处理对硬度的影响
Fig.2 Effect of biological preservative treatment on hardness
2.3 保鲜剂处理对失重率的影响
杏鲍菇采后质量损失主要因水分蒸发散失及新陈代谢消耗有机物引起[33]。由图3可知,随着贮藏时间延长失重率逐渐增大。贮藏30 d后对照组失重率为28.03%,TCP组和TC组分别为9.59%和17.36%,显著小于对照组(P<0.05)。本试验中涂膜组失重率始终小于对照组,可能是因为保鲜剂处理在杏鲍菇表面形成了微环境气调,降低了杏鲍菇代谢水平,从而抑制了水分蒸发,减少了失重率[43]。因此,保鲜剂处理具有较好的保湿作用,可以防止水分散失。
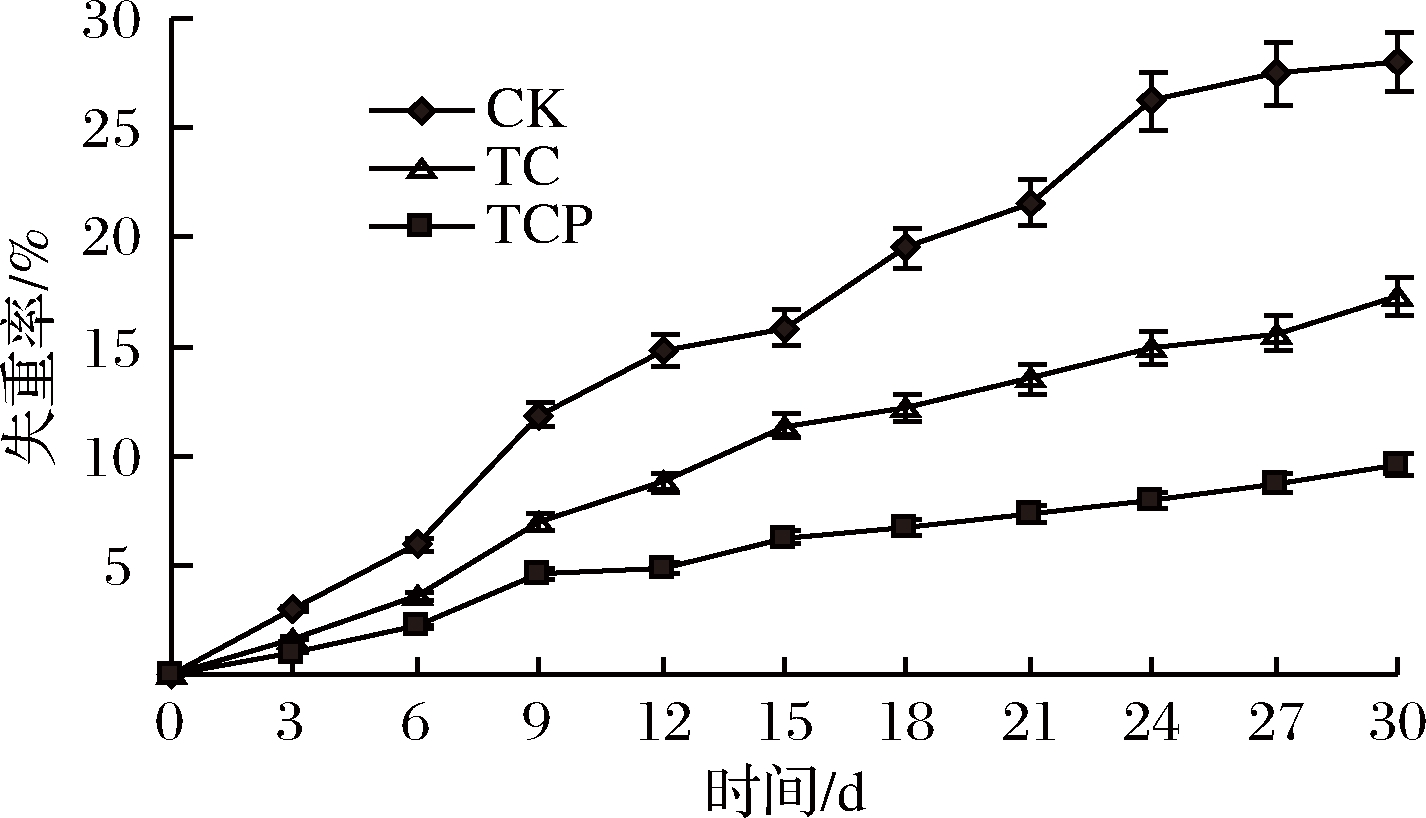
图3 保鲜剂处理对失重率的影响
Fig.3 Effect of biological preservative treatment on weight loss
2.4 保鲜剂处理对呼吸强度的影响
杏鲍菇采后通过呼吸作用消耗自身养分获得能量维持生命活动,呼吸强度越高,耐贮性越差[35]。由图4可知,贮藏前期(0~3 d)呼吸强度略微下降。随着贮藏时间延长,菇体逐渐成熟,呼吸强度逐渐上升,对照组和TC组在第12天达到呼吸高峰,分别为438.04 和355.63 mg/(kg·h),而TCP组在第15天达到呼吸高峰,为299.09 mg/(kg·h),与其他组存在显著差异(P<0.05)。随着菇体衰老,呼吸强度逐渐下降。本试验中处理组呼吸强度始终低于对照组,分析原因是保鲜剂处理在杏鲍菇表面形成了一层半透膜,抑制了呼吸强度[32],且复合保鲜剂处理效果更明显,不仅降低了呼吸峰值,还推迟了呼吸高峰到来。
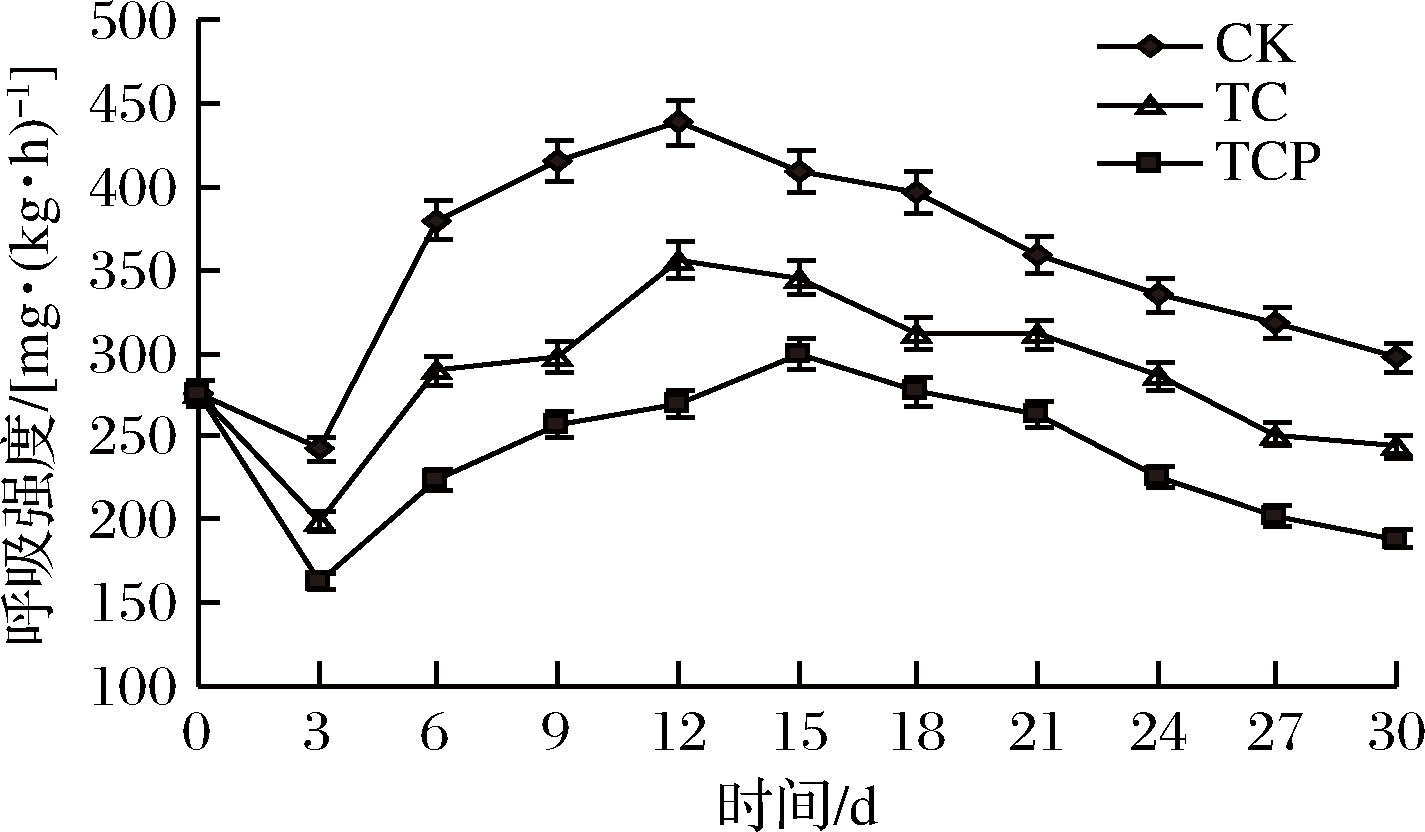
图4 保鲜剂处理对呼吸强度的影响
Fig.4 Effect of biological preservative treatment on respiratory intensity
2.5 保鲜剂处理对PPO活性的影响
杏鲍菇褐变以PPO催化酚类底物氧化和聚合生成黑色素的酶促褐变为主。正常情况下PPO和酚类底物通过脂膜系统实现区域化分布,酚和醌的氧化-还原反应处于动态平衡,当脂膜系统遭到破坏,酚类底物和PPO接触,氧化-还原反应平衡被破坏,引起褐变[36]。由图5可知,随着贮藏时间延长,PPO活性呈上升趋势。贮藏30 d后TCP组和TC组PPO活性分别为28.52和35.16 U/g,显著低于对照组(P<0.05)。 本试验中保鲜剂处理可以有效抑制PPO活性,避免PPO与酚类底物过多接触,减少氧化产物积累,有利于延缓酶促褐变进程。
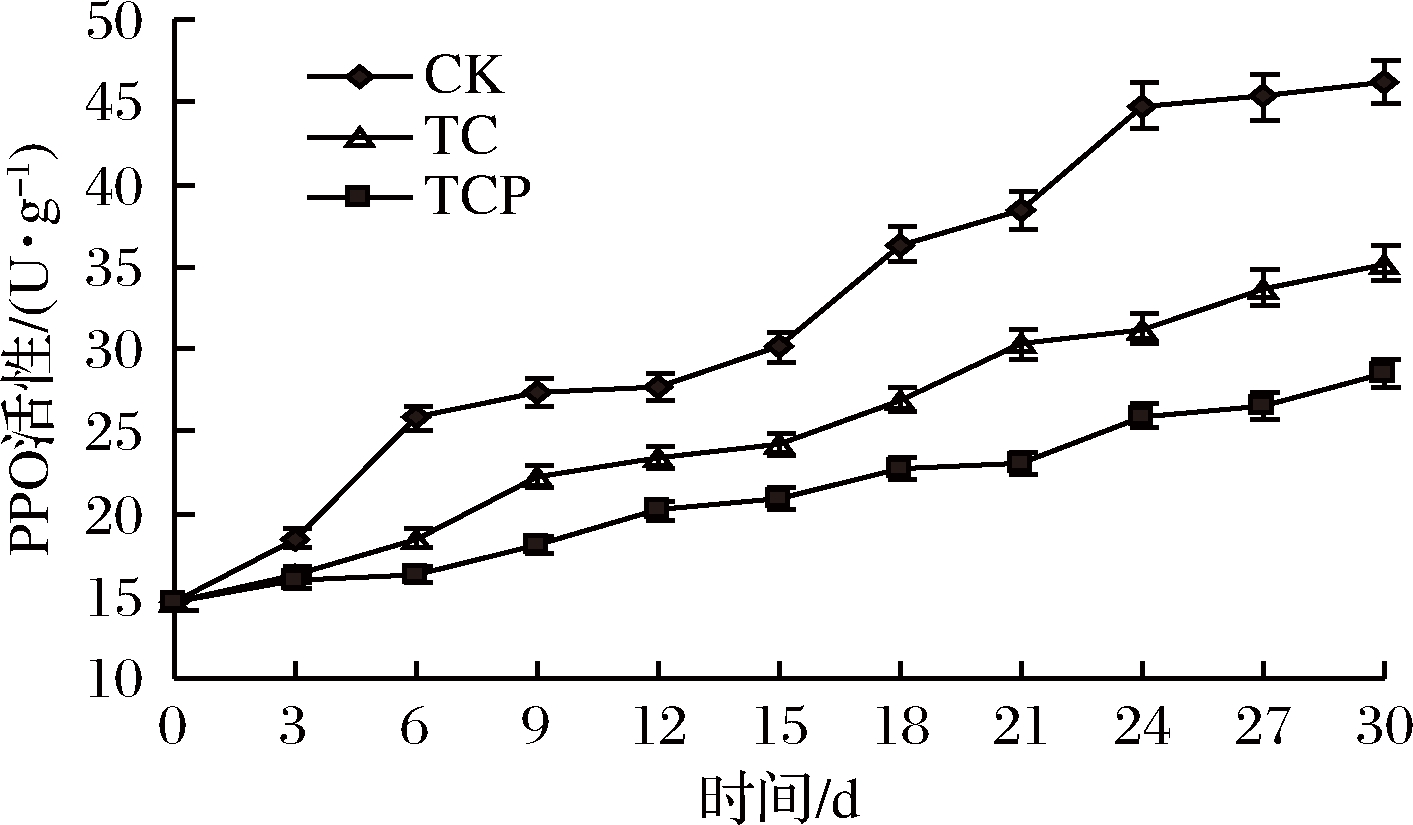
图5 保鲜剂处理对PPO活性的影响
Fig.5 Effect of biological preservative treatment on PPO activity
2.6 保鲜剂处理对MDA含量的影响
在杏鲍菇老化过程中,细胞产生的自由基诱导不饱和脂肪酸发生过氧化作用产生脂质自由基,进而诱发膜脂过氧化作用[37-38]。MDA使生物膜蛋白发生聚合,降低膜脂不饱和度而引起膜流动性降低,造成细胞膜系统损害,加速衰老[39]。由图6可知,各组MDA含量变化趋势基本一致,随着贮藏时间延长逐渐上升,但处理组MDA含量始终低于对照组。贮藏30 d后对照组MDA含量为1.45 nmol/g,TCP组和TC组分别为0.95和1.15 nmol/g,与对照组存在显著差异(P<0.05)。因此,保鲜剂处理可以降低MDA上升速率,抑制膜脂过氧化进程。
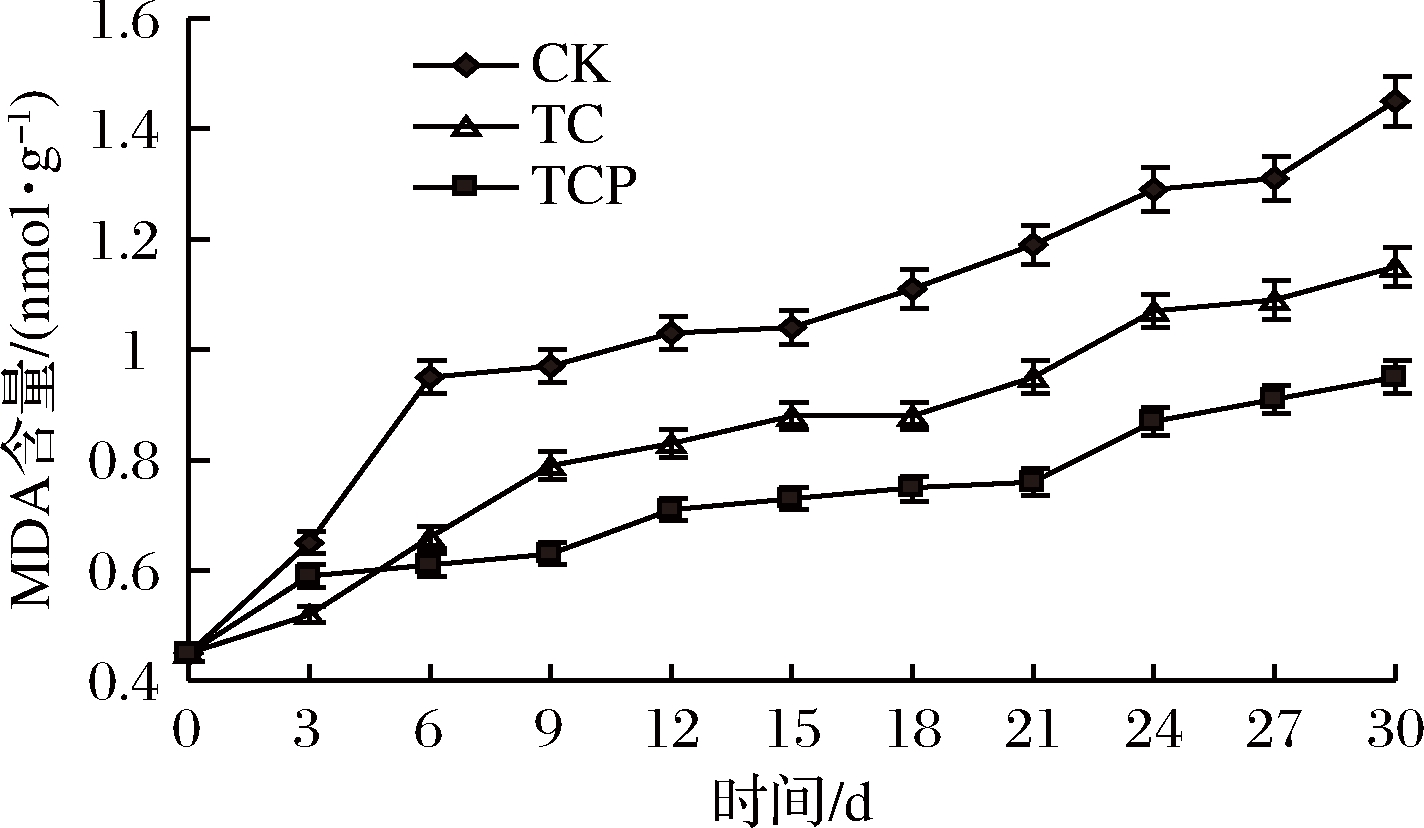
图6 保鲜剂处理对MDA含量的影响
Fig.6 Effect of biological preservative treatment on MDA content
2.7 保鲜剂处理对抗氧化酶活性的影响
SOD是酶促防御系统中的关键酶,维持活性氧代谢平衡,防止氧自由基对细胞膜系统伤害[40]。CAT与SOD协同作用清除活性氧,减少H2O2造成的氧化伤害[40]。由表1可知,贮藏前期(0~12 d)SOD活性逐渐增大,第12天均达到最大值。贮藏后期(12~30 d)处理组SOD活性下降较对照组缓慢,第30 天TCP组和TC组SOD活性分别为35.27和29.19 U/g, 显著高于对照组(P<0.05)。随着贮藏时间延长,CAT活性先升后降,第9天均达到最大值,TCP组和TC组CAT活性分别为23.61和21.06 U/g,显著高于对照组(P<0.05)。之后处理组CAT活性下降较慢,与对照组存在显著差异(P<0.05)。
2.8 保鲜剂处理对Vc和可溶性糖含量的影响
Vc可以消除活性氧,减轻细胞损伤,但Vc不稳定,易被氧化分解,是食用菌非酶促褐变的原因之一[41]。由表2可知,贮藏前期(0~15 d)Vc含量快速下降,贮藏15 d后TCP组和TC组Vc含量分别为155.51和126.94 μg/g,显著高于对照组(P<0.05)。贮藏后期(15~30 d)处理组Vc含量下降趋于平缓,与对照组存在显著差异(P<0.05)。
表1 保鲜剂处理对SOD和CAT活性的影响 单位:U/g
Table 1 Effect of biological preservative treatment on activities of SOD and CAT

时间/dCKTCPTCSOD活性033.19±1.99a33.19±1.99a33.19±1.99a334.79±2.09a35.75±2.32a37.16±2.52a635.15±2.28a40.87±2.93b38.15±2.48a936.35±2.36a43.51±3.05b41.25±2.89b1238.36±2.49a46.35±3.45b42.53±2.98b1534.28±2.06a43.12±3.02b41.08±2.88b1833.41±2.01a41.71±2.92b38.86±2.53b2130.91±1.85a39.77±2.59b38.21±2.48b2427.11±1.49a39.23±2.55c34.97±2.11b2724.05±1.19a36.79±2.39c31.09±1.87b3023.08±1.15a35.27±2.29c29.19±1.61bCAT活性0 5.21±0.34a 5.21±0.34a 5.21±0.34a38.71±0.57a15.24±1.14c10.73±0.75b613.24±0.93a22.33±1.79c18.02±1.35b915.91±1.19a23.61±1.89c21.06±1.68b1212.61±0.88a20.84±1.67c17.51±1.31b1511.94±0.84a19.59±1.47c16.21±1.22b189.88±0.64a18.95±1.42c14.89±1.04b218.14±0.53a16.38±1.23c12.21±0.85b245.12±0.33a14.14±0.99c11.06±0.77b274.35±0.26a13.51±0.95c8.15±0.53b302.07±0.12a10.67±0.75c7.36±0.48b
注:不同字母表示差异显著,P<0.05。下同。
糖是呼吸作用的重要底物,食用菌采后生命活动所需能量和中间物质主要来源于糖类物质的氧化分解。由表2可知,随着贮藏时间延长,可溶性糖含量逐渐下降,但处理组可溶性糖含量的下降幅度和速度始终低于对照组。贮藏30 d后TCP组和TC组可溶性糖含量分别为118.46和91.22 mg/g,显著高于对照组(P<0.05)。本试验中保鲜剂处理有效抑制了杏鲍菇采后贮藏期间的呼吸强度,降低了作为呼吸基质的可溶性固形物消耗,减少了营养价值损失。
3 讨论
杏鲍菇是呼吸跃变型果实,呼吸作用是采后最主要的生命活动,呼吸强烈引起水分损失迅速,造成代谢无法正常进行,出现疲软、皱缩等现象,导致外观品质下降;同时杏鲍菇为获得能量维持采后生命活动,需要降解自身营养物质,导致营养品质下降[42]。羧甲基壳聚糖是一种天然多糖涂膜保鲜剂,极易溶于水,可在杏鲍菇表面形成一层透明薄膜,具有良好的保湿性,能够减少贮藏期间水分损失[43]。此外,羧甲基壳聚糖膜具有良好的气体选择透过性,能够调节贮藏环境内外气体交换,在内部形成低O2、高CO2浓度的微环境,抑制呼吸作用和其他生理代谢活动[34,43]。本试验复合保鲜剂处理能够抑制杏鲍菇贮藏期间呼吸强度,降低水分损失和营养物质消耗,保鲜效果优于羧甲基壳聚糖单独处理。
表2 保鲜剂处理对Vc和可溶性糖含量的影响
Table 2 Effect of biological preservative treatment on Vc and soluble sugar content

时间/dCTCPTCVc/(μg·g-1)0185.53±14.84a185.53±14.84a185.53±14.84a3174.59±13.97a183.61±14.69a178.35±14.27a6169.03±13.52a181.37±14.51a174.23±13.94a9144.81±10.86a176.35±14.11c154.16±12.33b12118.04±8.85a169.11±13.53c148.44±11.13b1599.12±6.94a155.51±12.44c126.94±9.52b1896.38±6.75a154.79±12.38c123.35±9.25b2189.33±6.25a152.96±12.24c121.39±9.09b2479.12±5.54a145.24±10.89c113.05±8.48b2778.01±5.46a142.09±10.66c109.53±8.21b3068.38±4.79a138.69±10.41c105.83±7.94b可溶性糖/(mg·g-1)0155.03±11.63a155.03±11.63a155.03±11.63a3144.24±10.09a150.65±11.29a146.36±10.25a6128.67±9.01a143.35±10.03b137.22±9.89a9112.12±7.29a138.28±9.68b133.56±9.35b12108.49±7.05a138.49±9.69c121.38±8.51b15104.82±6.81a133.41±9.34c118.37±7.69b1891.29±5.93a131.29±9.19c111.39±7.21b2187.45±5.25a125.52±8.79c109.17±7.11b2477.03±4.62a127.27±8.91c101.38±6.59b2773.14±4.39a121.24±8.49c98.84±6.42b3061.22±3.67a118.46±7.71c91.22±5.93b
杏鲍菇在后熟衰老过程中产生活性氧自由基,通过膜脂过氧化作用造成细胞膜损伤,而SOD和CAT能够维持活性氧代谢平衡,清除![]() 和H2O2,防止膜脂过氧化[2]。本试验复合保鲜剂处理促使SOD和CAT被激活以抵御外界产生的不良影响,贮藏前期SOD和CAT活性快速上升并保持较高活性,贮藏后期延缓SOD和CAT活性下降,从而有效降低MDA上升速率,抑制膜脂过氧化进程,这与谢丽源等[32]的报道基本一致。
和H2O2,防止膜脂过氧化[2]。本试验复合保鲜剂处理促使SOD和CAT被激活以抵御外界产生的不良影响,贮藏前期SOD和CAT活性快速上升并保持较高活性,贮藏后期延缓SOD和CAT活性下降,从而有效降低MDA上升速率,抑制膜脂过氧化进程,这与谢丽源等[32]的报道基本一致。
杏鲍菇采后极易发生褐变,导致外观品质下降,其中酶促褐变起主要作用,而褐变程度与PPO活性密切相关。本试验复合保鲜剂处理能够抑制PPO活性,从而延缓酶促褐变进程。分析原因是:一方面,羧甲基壳聚糖在杏鲍菇表面形成一层透明薄膜,有利于维持细胞膜结构完整性,减少PPO与酚类底物接触;另一方面,滑菇肽具有清除自由基能力,减少自由基对细胞膜损伤,抑制MDA积累,减缓膜脂过氧化程度。因此,复合保鲜剂从两方面发挥作用,达到延缓杏鲍菇衰老的目的,其保鲜效果亦优于羧甲基壳聚糖单独处理。
本试验羧甲基壳聚糖和滑菇肽复合处理对杏鲍菇具有良好的保鲜效果,这可能主要与羧甲基壳聚糖的成膜性、滑菇肽的抗氧化性密切相关,前者在形成微环境气调方面起主要作用,后者在改善氧化应激水平上起主要作用,但两者之间是否存在协同效应有待进一步研究。
目前杏鲍菇采后保鲜主要采用低温冷藏、气调贮藏、涂膜处理等技术。谢丽源等[44]证实杏鲍菇4 ℃可贮藏15 d。胡花丽等[45]和石建春等[46]研究表明,采用保鲜袋密封包装杏鲍菇,分别延长20~25 ℃货架期至8 d和12 d。孔芳等[47]研究发现杏鲍菇经壳聚糖处理22 ℃可贮藏10 d。
综合考虑影响杏鲍菇保鲜效果的各种因素,必须根据其自身特点和生理活动规律,制定相应的物理、化学或生物等综合方法。谢丽源等[32]和寇莉萍等[48]研究表明,采用保鲜袋密封包装杏鲍菇,分别延长低温贮藏货架期至15 d和18 d。杏鲍菇经1-MCP[49]、壳聚糖[17]、乙醇[50]或茶多酚[15]处理后,装入聚乙烯保鲜袋,低温条件下可贮藏10~19 d。周拥军等[51]和李志刚等[52]研究表明,杏鲍菇经减压包装后低温贮藏可达30 d。陆健东等[53]采用短波紫外线辐照杏鲍菇,装入低密度聚乙烯保鲜袋,延长2 ℃贮藏货架期至35 d。本试验采用羧甲基壳聚糖和滑菇肽涂膜处理杏鲍菇,保鲜盒密封包装,4 ℃可贮藏30 d。
杏鲍菇贮藏货架期因保鲜方法不同而异,但低温冷藏仍是最基本的保鲜方式,与气调包装技术相结合已成为目前常用的保鲜手段,而安全有效的生物保鲜剂的发展,大大提高了保鲜效果。因此,需要进行多种技术相结合的集成性研究,用高效的集成保鲜技术支撑产业链的发展和延伸[4]。
4 结论
羧甲基壳聚糖与滑菇肽处理可以较好地保持杏鲍菇低温贮藏期间的色泽和硬度,降低失重率,达到抑制感官品质劣变的效果;可以抑制MDA含量增加和PPO活性,维持较高的SOD和CAT活性,减缓酶促褐变进程;通过降低呼吸强度,减缓可溶性糖消耗和Vc含量下降,延缓后熟老化进程,维持商品质量。因此,羧甲基壳聚糖和滑菇肽复合处理对杏鲍菇具有较好的保鲜效果。
[1] SINGH P,LANGOWSKI H C,WANI A A,et al.Recent advances in extending the shelf life of fresh Agaricus mushrooms: A review[J].Journal of the Science of Food and Agriculture,2010,90(9):1 393-1 402.
[2] GAO M,FENG L,JIANG T.Browning inhibition and quality preservation of button mushroom (Agaricus bisporus) by essential oils fumigation treatment[J].Food Chemistry,2014,149:107-113.
[3] 张茜,李洋,王磊明,等.生物保鲜剂在果蔬保鲜中的应用研究进展[J].食品工业科技,2018,39(6):308-316.
[4] 史君彦,高丽朴,王清,等.食用菌保鲜技术的研究进展[J].食品工业,2017,38(6):278-282.
[5] 蔡路昀,吕艳芳,李学鹏,等.复合生物保鲜技术及其在生鲜食品中的应用研究进展[J].食品工业科技,2014,35(10):380-385.
[6] 邓靖,谭兴和,周晓媛.肉桂油的抑菌性能及其在金针菇保鲜中的应用研究[J].中国调味品,2009,34(5):54-58.
[7] 徐吉祥,王飞生,陈景勇,等.可食性涂膜保藏茶新菇的研究[J].广东农业科学,2010,37(5):121-123.
[8] 谯康全.壳聚糖复合保鲜剂对鸡腿菇保鲜效果的研究[J].食品工业,2012,33(4):14-16.
[9] 刘开华,邢淑婕.壳聚糖中添加茶多酚对香菇贮藏品质的影响[J].食用菌学报,2012,19(3):54-58.
[10] JIANG T,FENG L,ZHENG X.Effect of chitosan coating enriched with thyme oil on postharvest quality and shelf life ofshiitake mushroom (Lentinus edodes)[J].Journal of Agricultural and Food Chemistry,2012,60(1):188-196.
[11] JIANG T,FENG L,ZHENG X,et al.Physicochemical responses and microbial characteristics of shiitake mushroom (Lentinus edodes) to gum arabic coating enriched with natamycin during storage[J].Food Chemistry,2013,138(2-3):1 992-1 997.
[12] 张强,王松华,祝嫦巍,等.两种复配保鲜剂对双孢菇保鲜作用的研究[J].现代食品科技,2013,29(10):2 431-2 436.
[13] 赵梅,慕鸿雁,李文香.壳聚糖复合保鲜剂对海鲜菇保鲜效果的影响[J].食品工业,2016,37(7):98-100.
[14] 田平平,王杰,秦晓艺,等.采后处理对杏鲍菇贮藏品质及抗氧化酶系统的影响[J].中国农业科学,2015,48(5):941-951.
[15] 刘开华,邢淑婕.大豆分离蛋白联合茶多酚对刺芹侧耳保鲜效果的影响[J].食用菌学报,2013,20(1):52-55.
[16] 赵春燕,叶春苗,李成莹,等.壳聚糖复合涂膜处理对采后杏鲍菇贮藏品质影响[J].食品研究与开发,2017,38(3):212-217.
[17] 赵梅,王琦,孙悦,等.纳米壳聚糖复合涂膜对杏鲍菇保鲜效果的影响[J].食品研究与开发,2018,39(9):174-177.
[18] 彭新颜,孟婉静,周夕冉,等.蓝点马鲛鱼皮抗氧化肽段对熟肉糜脂肪和蛋白氧化抑制作用的研究[J].水产学报,2015,39(11):1 730-1 741.
[19] 郭利平,荣婧,杨宁,等.罗非鱼酶解肽抑制冷藏鱼糜中油脂和蛋白质氧化能力[J].食品科学, 2016,37(5):89-93.
[20] 韩诗蕾,但姝.还原型谷胱甘肽复配保鲜剂对刀额新对虾品质的影响[J].现代食品科技, 2016,32(8):246-252.
[21] 阮仕艳,彭新颜,张淑荣,等.乳清抗氧化肽对冷藏猪肉糜肌原纤维蛋白功能性及品质的影响[J].食品科学,2017,38(21):272-278.
[22] 王晓杰,曲悦,丛万锁.玉米肽的抗氧化活性及其对熟猪肉糜脂质氧化抑制作用的研究[J].食品科技,2018,43(4):251-257.
[23] 莫亿伟,郑吉祥,李伟才,等.外源抗坏血酸和谷胱甘肽对荔枝保鲜效果的影响[J].农业工程学报,2010,26(3):363-368.
[24] 朱晶,李星辰,郭嘉川,等.金针菇酶解肽对冬枣保鲜效果的研究[J].陕西农业科学,2013,59(4):6-8.
[25] 许先猛,董文宾,孙皎皎.猪皮胶原多肽用于苹果涂膜保鲜的作用研究[J].食品科技, 2015(6):32-37.
[26] 钱磊,张志军,周永斌,等.酶法水解滑菇蛋白制备抗氧化肽的工艺优化[J].食品工业科技,2017,38(20):72-76.
[27] 钱磊,张业尼,张志军,等.超声预处理双酶分步水解制备滑菇抗氧化肽[J].食品工业,2018,39(2):98-102.
[28] ANTMANN G,ARES G,LEMA P,et al.Influence of modified atmosphere packaging on sensory quality of shiitake mushrooms[J].Postharvest Biology and Technology,2008,49(1):164-170.
[29] 张洪翠,李云云,靳苗苗,等.乙醇熏蒸对双孢蘑菇保鲜品质的影响[J].食品与发酵工业,2018,44(6):187-194.
[30] HU Y H,CHEN C M,XU L,et al.Postharvest application of 4-methoxy cinnamic acid for extending the shelf life of mushroom (Agaricus bisporus)[J].Postharvest Biology and Technology,2015,104(1):33-41.
[31] 程曦,赵春霞,李云云,等.高氧气调包装对双孢蘑菇抗氧化活性及褐变的影响[J].食品与发酵工业,2016,42(10):68-74.
[32] 谢丽源,郑林用,彭卫红,等.不同包装膜对杏鲍菇冷藏品质和贮藏效果的影响[J].食品科学,2015,36(22):197-202.
[33] JIANG T.Effect of alginate coating on physicochemical and sensory qualities of button mushrooms (Agaricus bisporus) under a high oxygen modified atmosphere[J].Postharvest Biology and Technology,2013,76(1):91-97.
[34] 梁志宏,刘刚,王俊宇,等.羧甲基壳聚糖涂膜对大久保桃保鲜及货架品质的影响[J].食品工业科技,2015,36(3):353-356.
[35] 孟德梅,宋天姿,申琳,等.采收期对香菇耐贮特性及抗氧化酶系统的影响[J].食品科学,2011,32(2):275-279.
[36] ALTUNKAYA A,GÖKMEN V.Effect of various inhibitors on enzymatic browning,antioxidant activity and total phenol content of fresh lettuce (Lactuca sativa)[J].Food Chemistry,2008,107(3):1 173-1 179.
[37] 温小礼,张伟,周巧丽,等.肉桂醛熏蒸处理对香菇采后生理和品质的影响[J].中国食品学报,2014,14(8):190-196.
[38] 周巧丽,陈丹妮,叶笑,等.海藻酸钠/纳米TiO2复合涂膜对香菇采后品质的影响[J].中国食品学报,2014,14(1):198-203.
[39] 吴宁,金城,黄菊,等.葡萄籽提取物对香菇保鲜效果的影响[J].食品科学,2013,34(8):299-302.
[40] 王成涛,王昌涛,赵磊,等.不同氧分压条件下金针菇贮藏保鲜相关酶活性的研究[J].食品科学,2011,32(8):300-304.
[41] 李云云,赵春霞,程曦,等.高氧气调包装对双孢蘑菇微生物及其品质的影响[J].食品科学,2016,37(2):261-265.
[42] 张艳珍,李建龙,李卉,等.UV-C结合生物保鲜剂处理对水蜜桃常温保鲜与贮藏效果研究[J].华北农学报,2016,31(6):144-150.
[43] 张胜文,冯伟,程思,等.羧甲基壳聚糖在草莓保鲜中的应用效果研究[J].中国酿造,2014,33(5):142-145.
[44] 谢丽源,郑林用,甘炳成,等.贮藏温度对采后杏鲍菇生理特性的影响[J].西南农业学报,2016,29(1):153-158.
[45] 胡花丽,李鹏霞,王毓宁.不同薄膜包装对杏鲍菇采后衰老生理的影响[J].食品与发酵工业,2012, 38(7):196-200.
[46] 石建春,冯翠萍,常明昌,等.不同包装材料对杏鲍菇货架期保鲜效果的影响[J].山西农业科学,2016,44(11):1 704-1 707.
[47] 孔芳,薛正莲,杨超英.壳聚糖复合涂膜对杏鲍菇保鲜效果的研究[J].中国农学通报, 2013,29(18):215-220.
[48] 寇莉萍,王敏,侯豪豪.贮藏温度对鲜切杏鲍菇呼吸强度和贮藏品质的影响[J].食品工业科技,2012,33(5):340-343.
[49] 赵春燕,马芳菲,冯叙桥,等.不同浓度1-MCP处理对杏鲍菇采后贮藏品质的影响[J].食品与发酵工业,2012,38(8):231-234.
[50] 张莉,许欣,刘林德,等.乙醇熏蒸对杏鲍菇贮藏品质的影响[J].食品科技,2018,43(11):55-59.
[51] 周拥军,郜海燕,陈杭君,等.减压贮藏对杏鲍菇采后活性氧代谢的影响[J].核农学报,2014, 29(6):1 108-1 113.
[52] 李志刚,宋婷,冯翠萍,等.不同温度对杏鲍菇减压贮藏品质的影响[J].农业工程学报,2015,31(3):332-338.
[53] 陆健东,王丹凤,钱炳俊,等.短波紫外线辐照对杏鲍菇保鲜效果的研究[J].浙江农业科学,2014, 1(3):348-351.