蛋白酶是水解蛋白质肽链的一类酶的总称,它在消化吸收[1-2]、抗氧化[3-4]、降低过敏反应[5]、洗涤剂添加剂[6]、生物活性肽[7-9]等方面发挥着重要作用。目前,蛋白酶的种类主要分为动物蛋白酶[10-11]、植物蛋白酶[12]和微生物蛋白酶[13]。微生物菌群复杂多样,分布较广,繁殖速度较快,具有参与体内新陈代谢,调节内分泌,免疫调节等多种作用[14-15]。海洋微生物酶是一种获得新型酶制剂方式[16],在工业过程和产品制作得到广泛应用[17-18]。王凤舞等[19]对来自裙带菜的1株产低温碱性蛋白酶内生菌株QD-1,经鉴定该菌株为芽孢杆菌属,该菌产生的蛋白酶的最适作用温度为20 ℃,最适作用pH 9.0,Mn2+对该酶有较强的激活作用,Zn2+,金属蛋白酶抑制剂(ethylenediaminetetra aceticacid,EDTA)和丝氨酸蛋白酶抑制剂(phenylethanesulfonyl fluoried,PMSF)对该酶有抑制作。李倩倩等[20]以单环刺螠内脏为原料,分离出1种单环刺螠内脏蛋白酶LPN2,分子质量约59 ku,其最适温度为50 ℃,最适pH 6~8,PMSF、EDTA、Ca2+、Zn2+和Ba2+抑制蛋白酶LNP2的酶活,Fe2+在低浓度下对该酶有激活作用。BANERJEE等[21]从鱼肠中分离的细菌菌株棒状杆菌ATH3产生的胞外蛋白酶和淀粉酶,纯化的蛋白酶和淀粉酶的分子质量分别为17和28 kDa,酶的最适pH 7.5~8.0,最适温度35~45 ℃。目前,人们已经从海参体壁[22]、肠[23]和消化道[24]提取出蛋白酶粗酶,而对从海参肠中分离出蛋白酶菌株的研究较少。
本研究拟从海参肠道中分离筛选出1株产蛋白酶活性较高的菌株,对该菌株进行鉴定,以酶活力为指标,对其产酶发酵条件进行优化;利用该菌发酵海参肠产多肽,优化了发酵工艺条件,并对海参肠发酵产物多肽的抗氧化活性进行测定。
鲜活刺参(Apostichopus japonicas):由青岛佳日隆海洋食品有限公司提供;海参肠(经水煮,去杂质,脱盐,初步脱脂后沥干而成):由青岛佳日隆海洋食品有限公司提供,于-20 ℃保存;干红枣:福建古田县大丰工贸有限公司;苹果醋:鹤山市东古调味食品有限公司售;蜂蜜:山东华康蜂业有限公司售。
固体培养基:LB营养琼脂3.3 g,海水100 mL,121 ℃灭菌15 min。酪蛋白培养基:干酪素1 g,酵母膏0.1 g,琼脂1.5 g,海水100 mL,pH 7.2-7.4,121 ℃灭菌15 min。液体培养基:蛋白胨0.5 g,酵母膏0.1 g,磷酸高铁0.01 g,海水100 mL,pH 7.8~8.0,121 ℃灭菌15 min。
酪蛋白(casein):上海索莱宝生物科技有限公司;偶氮酪蛋白(azocasein):美国Sigma公司;三羟甲基氨基甲烷(Tris):美国Sigma公司;其余试剂均为分析纯。
DU-800型紫外分光光度计,美国贝克曼公司;TGL-16M型高速台式冷冻离心机,湖南湘仪实验室仪器开发有限公司;DHP-9032电热恒温培养箱,中国龙口市先科仪器有限公司;IS-RDV3立式恒温振荡器,美国精骐有限公司;SHA-B水浴恒温振荡器,常州国华电器有限公司。
1.3.1 菌株的分离与鉴定
(1)菌株的分离纯化
取活体刺身内脏,剪碎,按100 g/L加入无菌海水制成菌液原液,梯度稀释后分别涂布于固体培养基, 25 ℃,静置培养3 d。挑取单菌落点接种于酪蛋白培养基,25 ℃,培养24 h,观察透明圈大小。选取菌落周围有透明圈的菌株进行分离纯化。挑取适量的菌株,接种于液体培养基上,25 ℃,180 r/min,3 d,选择产蛋白酶活性较高的菌株为目的菌株。挑取少量菌株接种于固体培养基上,置于25 ℃静置培养3 d,观察目标菌株的菌落形态,并进行革兰氏染色,观察菌株的个体形态,芽孢等。
(2)蛋白酶活性的测定
蛋白酶活性的测定采用参照RANILSON的偶氮酪蛋白法[25]。
(3)形态学及生理生化鉴定
参照《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》进行形态学及生理生化鉴定。
(4)16S rDNA序列分析
采用CTAB[26]法提取基因组DNA,PCR产物的纯化和测序由上海生工生物工程技术服务有限公司完成。序列提交GeneBank数据库,用Blast软件在GeneBank网站上进行相似性搜索,获取相近典型菌株的16S rDNA基因序列,通过Clustal进行多重序列比对,利用MEGA 5.0软件绘制出系统发育树。
1.3.2 QDHF-1菌株产酶发酵条件工艺优化
参照朱玫瑛[27]的前期单因素试验研究结果,采用L9(33)正交试验,以pH值、温度、发酵时间3个因素为影响因素,以蛋白酶活力为指标,对产酶发酵工艺进行正交优化,因素水平见表1。
1.3.3 QDHF-1菌株发酵海参肠工艺优化及抗氧化活性测定
(1)BSA标准曲线的绘制
将BSA标准品(5 g/L)用生理盐水配置成质量浓度为0.025、0.05、0.1、0.2、0.3、0.4、0.5 g/L的溶液,置于离心管中。将BCA试剂盒中的A试剂和B试剂按照50∶1的体积比充分混匀,得到BCA工作液。用移液枪从各浓度的BSA管中吸取20 μL溶液,并与200 μL的BCA工作液充分混匀,置于37 ℃水浴中振摇1 h,用蒸馏水做空白。在562 nm下测定吸光值,绘制BSA标准曲线。
表1 L9(33)正交试验因素及水平
Table 1 Factors and levels in L9(33) orthogonalexperiment design
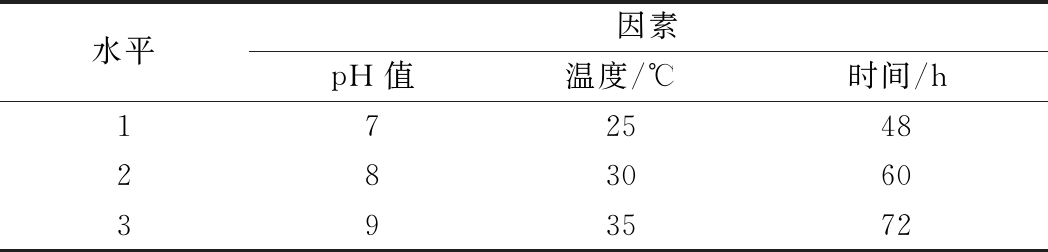
水平因素pH值温度/℃时间/h172548283060393572
(2)多肽含量的测定
采用BCA法[28]测定样品中的多肽含量。向试管中加入已稀释好的相应倍数的样品溶液20 μL,同时加入已经配好的BCA溶液200 μL,迅速混匀,于水浴37 ℃放置60 min。波长562 nm下测定吸光度值,试验重复3次,根据标准曲线计算样品中多肽的百分含量。
(3)QDHF-1种子液的制备
将Thalassobacillus sp. QDHF-1菌株接种到液体培养基上,30 ℃,180 r/min,培养24 h,制备液体种子液培养基。
(4)接种量对QDHF-1发酵海参肠发酵液中多肽含量的影响
取洗净沥干的海参肠用组织捣碎机捣碎,称取5 g,料水比为1∶10,接种量分别为2%、4%、6%、8%、10%,发酵时间为60 h,温度30 ℃,转速180 r/min,培养结束后离心,分别测定上清液的多肽含量。
(5)发酵时间对QDHF-1发酵海参肠发酵液中多肽含量的影响
取洗净沥干的海参肠用组织捣碎机捣碎,称取5 g,料水比(g ∶mL)为1∶10,接种量为6%,发酵时间分别为12、24、36、48、60 h,温度30 ℃,转速为180 r/min,培养结束后离心,分别测定上清液的多肽含量。
(6)料水比对QDHF-1发酵海参肠发酵液中多肽含量的影响
取洗净沥干的海参肠用组织捣碎机捣碎,称取5 g,料水比(g∶mL)分别为1∶1、1∶5、1∶10、1∶15、1∶20,接种量为6%,发酵时间为36 h,温度30 ℃,转速180 r/min,培养结束后离心,分别测定上清液的多肽含量。
1.3.4 海参肠发酵物抗氧化活性测定
利用QDHF-1菌株发酵海参肠的的最佳工艺条件为接种量6%,料水比1:5,发酵时间36 h,可得到多肽质量浓度达13.21 g/L。海参肠发酵液经离心去除菌体及杂质,再经浓缩、冷冻干燥,获得海参肠发酵物多肽,并对其进行抗氧化测定。
(1)羟自由基(·OH)清除能力的测定采用邻二氮菲-Fe2+氧化法[29]。
(2)二苯代苦味酰基自由基(DPPH·)清除能力的测定采用ALI等的测定方法[30]。
(3)超氧阴离子自由基(O2-·)清除能力的测定采用邻苯三酚自氧化法[31]。
1.3.5 统计分析方法
试验数据以平均值±标准差(M±S.D.)表示,采用SPSS 19.0软件进行统计学分析。分析方法为单因素方差分析和邓肯(Duncan)多重比较,显著性水平选择0.05。
海参肠道产蛋白酶菌株的初筛结果如图1和表2所示。经分离得到的5株菌株,菌落直径差异不显著(P>0.05),但QDHF-1菌株所产的透明圈直径与菌落直径比值显著高于其他菌株(P<0.05)。酪蛋白培养基上水解透明圈直径与菌落直径的比值(D/d值)越大说明产酶能力越强,所以QDHF-1菌株具有较高产蛋白酶的能力。不同菌株发酵液产蛋白酶活力的测定结果如图2所示。其中QDHF-1菌株产的蛋白酶活性较高,产蛋白酶活力为582 U/mL,显著高于其他菌株(P<0.05)。综合水解透明圈和酶活力两个因素,选择QDHF-1菌株为出发菌株。
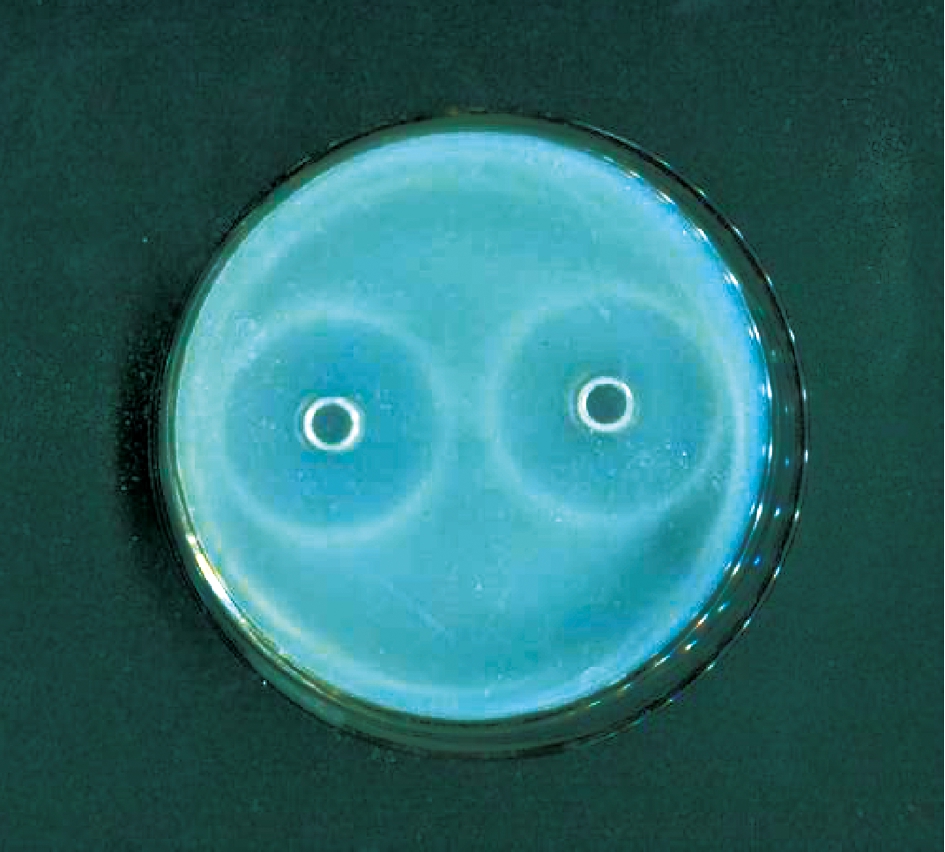
图1 QDHF-1菌株透明圈实验结果
Fig.1 Results of transparent circle test of QDHF-1 strain
表2 海参肠道产蛋白酶菌株初筛结果
Table 2 Screening results of protease-producingstrains from tract of sea cucumber
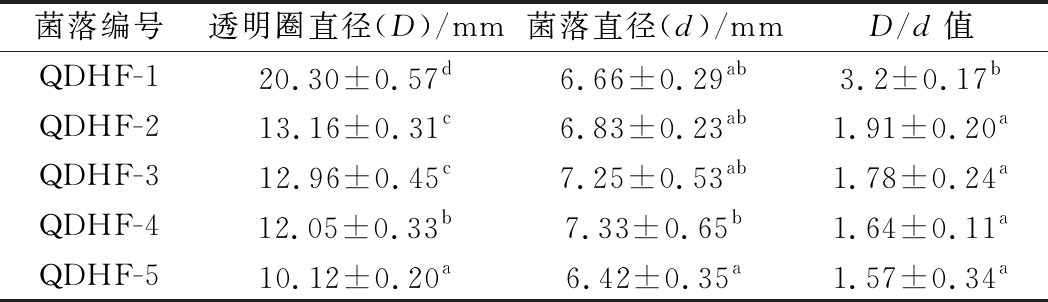
菌落编号透明圈直径(D)/mm菌落直径(d)/mmD/d值QDHF-120.30±0.57d6.66±0.29ab3.2±0.17bQDHF-213.16±0.31c6.83±0.23ab1.91±0.20aQDHF-312.96±0.45c7.25±0.53ab1.78±0.24aQDHF-412.05±0.33b7.33±0.65b1.64±0.11aQDHF-510.12±0.20a6.42±0.35a1.57±0.34a
注:同一列不同字母上标代表数值间差异显著(P<0.05)。下同。
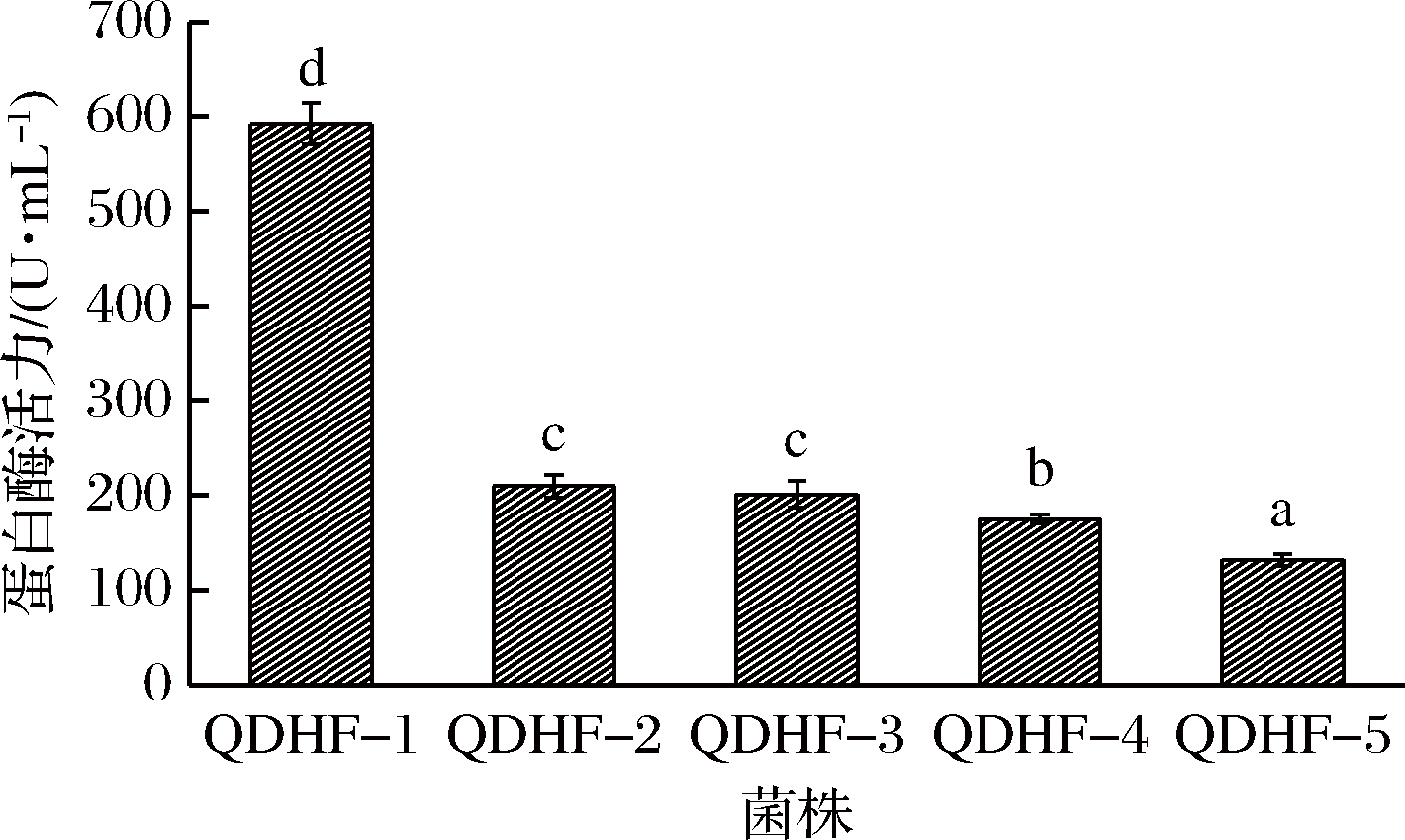
图2 不同菌株发酵液产蛋白酶活力的测定
Fig.2 Determination of protease activity in fermentation broth of different strains
注:图中不同小写字母代表差异显著(P<0.05)。下同。
如表3所示,3个单因素中,对QDHF-1产酶发酵的影响顺序为时间>pH值>温度,因此最佳产酶发酵条件为pH 8,温度为30 ℃,发酵时间72 h。
表3 正交试验结果表
Table 3 Results of the orthogonal experiment

试验号pH值温度/℃时间/h酶活力/(U·mL-1)11(7)1(25)1(48)515212(30)2(60)582313(35)3(72)58642(8)126555223756623153573(9)1360583215409332577K1561592530K2649627605K3574566649极差R8860119
2.3.1 形态特征及生理生化鉴定
QDHF-1的菌落形态是乳白色、圆形、凸起、边缘整齐、湿润的光滑小菌落。对QDHF-1菌株进行革兰氏染色和芽孢染色,结果如图3所示,QDHF-1为革兰氏阳性、产芽孢的两端钝圆的杆状细菌。对QDHF-1菌株进行部分生理生化鉴定试验,结果如表4所示。查阅《伯杰细菌鉴定手册》和《细菌系统鉴定手册》,并未发现有对应生理特征的种属分类。因此,对QDHF-1菌株采用16S rRNA基因序列分析进行鉴定。
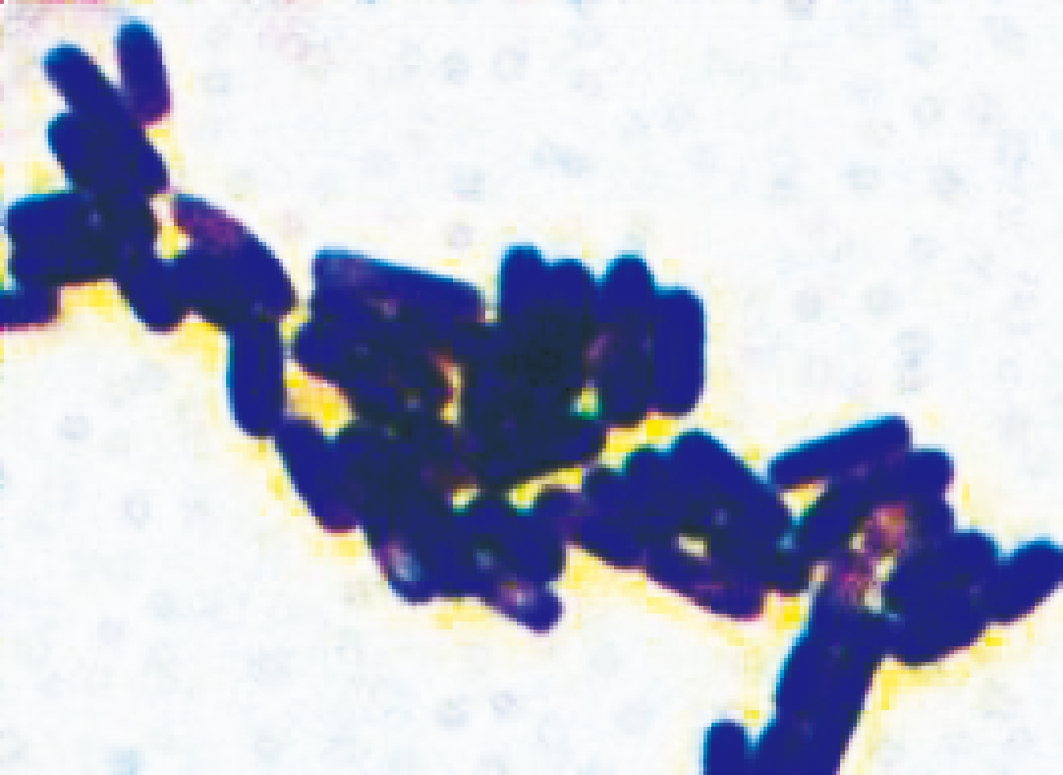
图3 菌株QDHF-1的革兰氏染色观察
Fig.3 The image of QDHF-1 after gram stain
表4 生理生化鉴定
Table 4 Physiological and biochemical experiments
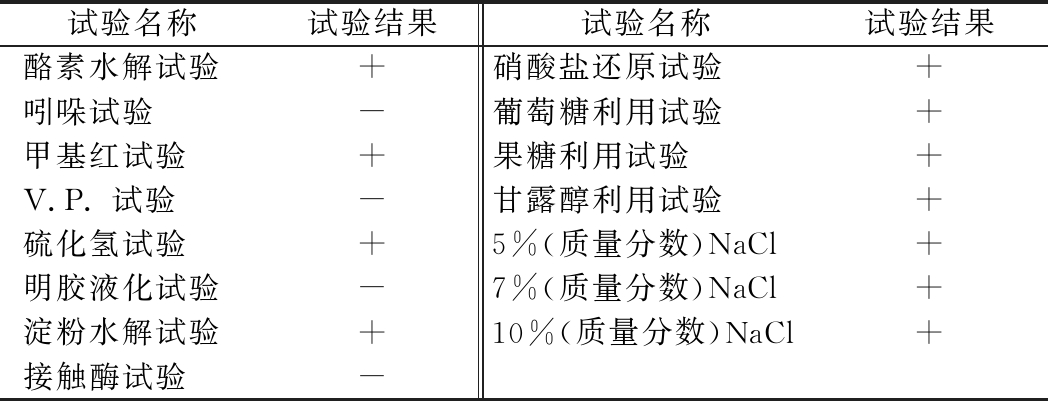
试验名称试验结果试验名称试验结果酪素水解试验+硝酸盐还原试验+吲哚试验-葡萄糖利用试验+甲基红试验+果糖利用试验+V.P. 试验-甘露醇利用试验+硫化氢试验+5%(质量分数)NaCl+明胶液化试验-7%(质量分数)NaCl+淀粉水解试验+10%(质量分数)NaCl+接触酶试验-
注:表中“+”表示阳性反应,“-”表示阴性反应。
2.3.2 16S rDNA全序列分析
2.3.2.1 PCR扩增结果
经PCR扩增获得菌株16S rRNA基因片段的长度为1 500 bp左右,如图4所示,条带清晰,可用于菌株16S rRNA序列的测定。
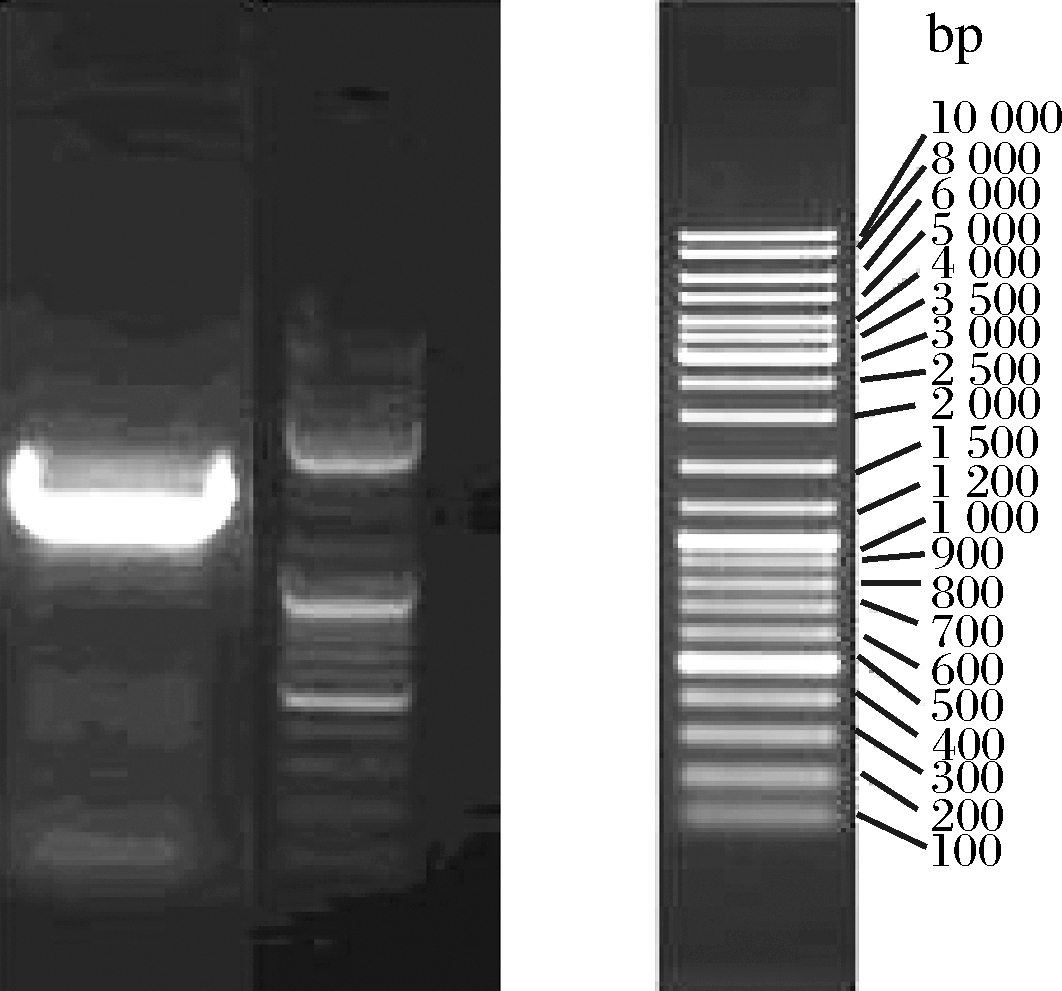
图4 16S rRNA基因PCR扩增产物
Fig.4 PCR amplification product of 16S rRNA gene
2.3.2.2 系统发育树分析
登陆www.NCBI.com网站,在GeneBank中通过Blast得到与QDHF-1菌株序列相似度较大的菌株,通过Clustul软件同GeneBank中的相似序列进行比对,可知QDHF-1与Thalassobacillus sp. LY18同源性为99.3%。利用MEGA 5.0软件绘制出系统发育树,可以确定QDHF-1为Thalassobacillus属。将QDHF-1序列提交GeneBank获得登录号为KF357910(图5)。QDHF-1菌株属于Bacteria(细菌),Firmicutes(厚壁菌门),Bacilli(杆菌),Bacillales(芽孢杆菌目),Bacillaceae(芽孢杆菌科),Thalassobacillus属,命名为Thalassobacillus sp.QDHF-1。
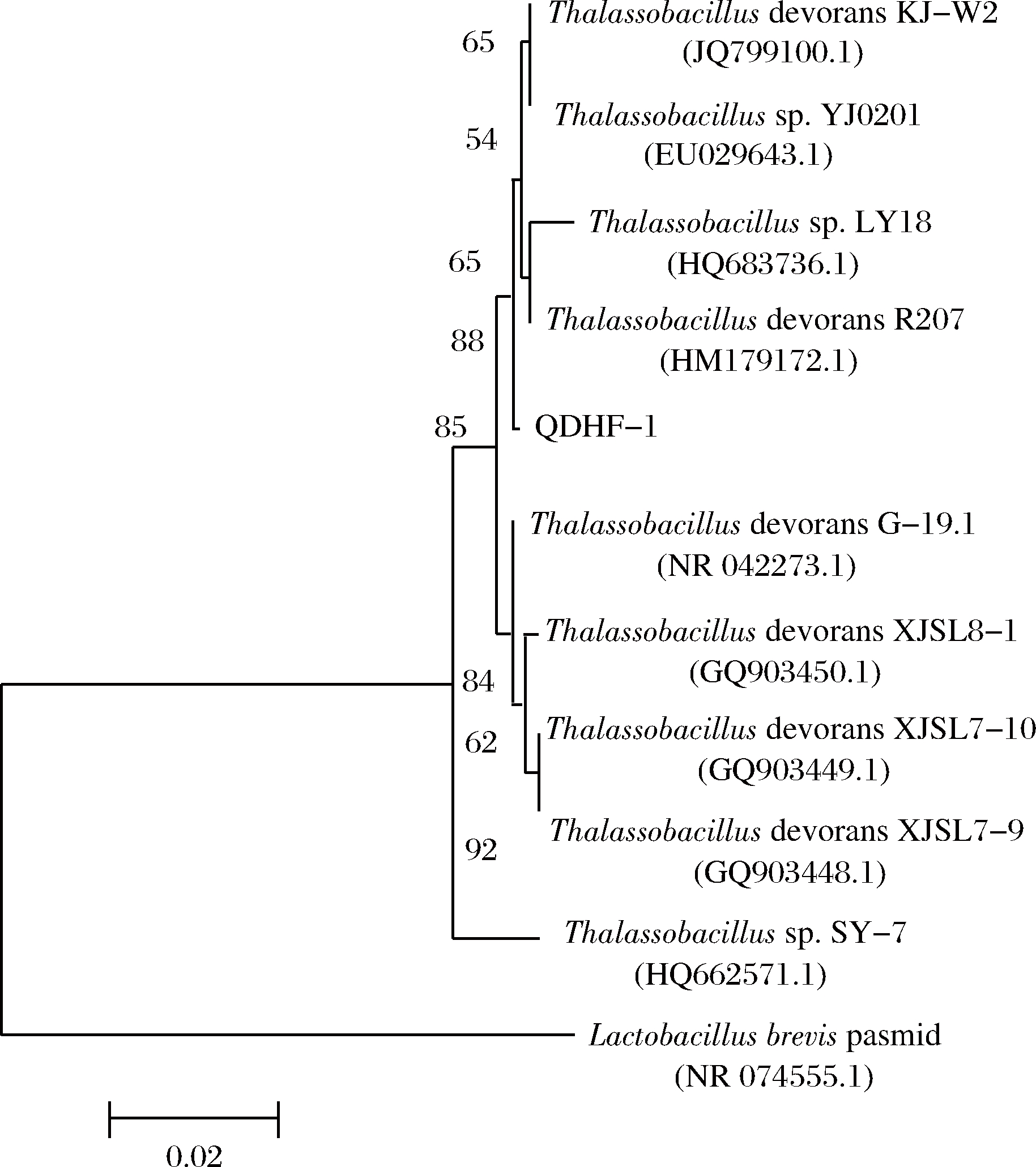
图5 QDHF-1菌株16S rRNA同源性构建的系统发育树
Fig.5 Phylogenetic tree of strain QDHF-1 on 16S rRNA gene sequence
2.4.1 接种量对发酵产多肽含量的影响
接种量对QDHF-1发酵海参肠发酵液中多肽含量的影响结果如图6所示。随着接种量不断增加,发酵液中多肽含量呈先上升后下降的趋势。当接种量在2%~8%时,发酵液中多肽含量呈上升趋势,当接种量为6%和8%时,发酵液的多肽含量没有显著性差异(P<0.05)。因此选择接种量为6%较为合适,此时发酵液中多肽质量浓度为5.02 g/L。当接种量为10%时,多肽含量开始下降,可能是由于菌体数量过多,开始分解发酵液中的多肽所致。
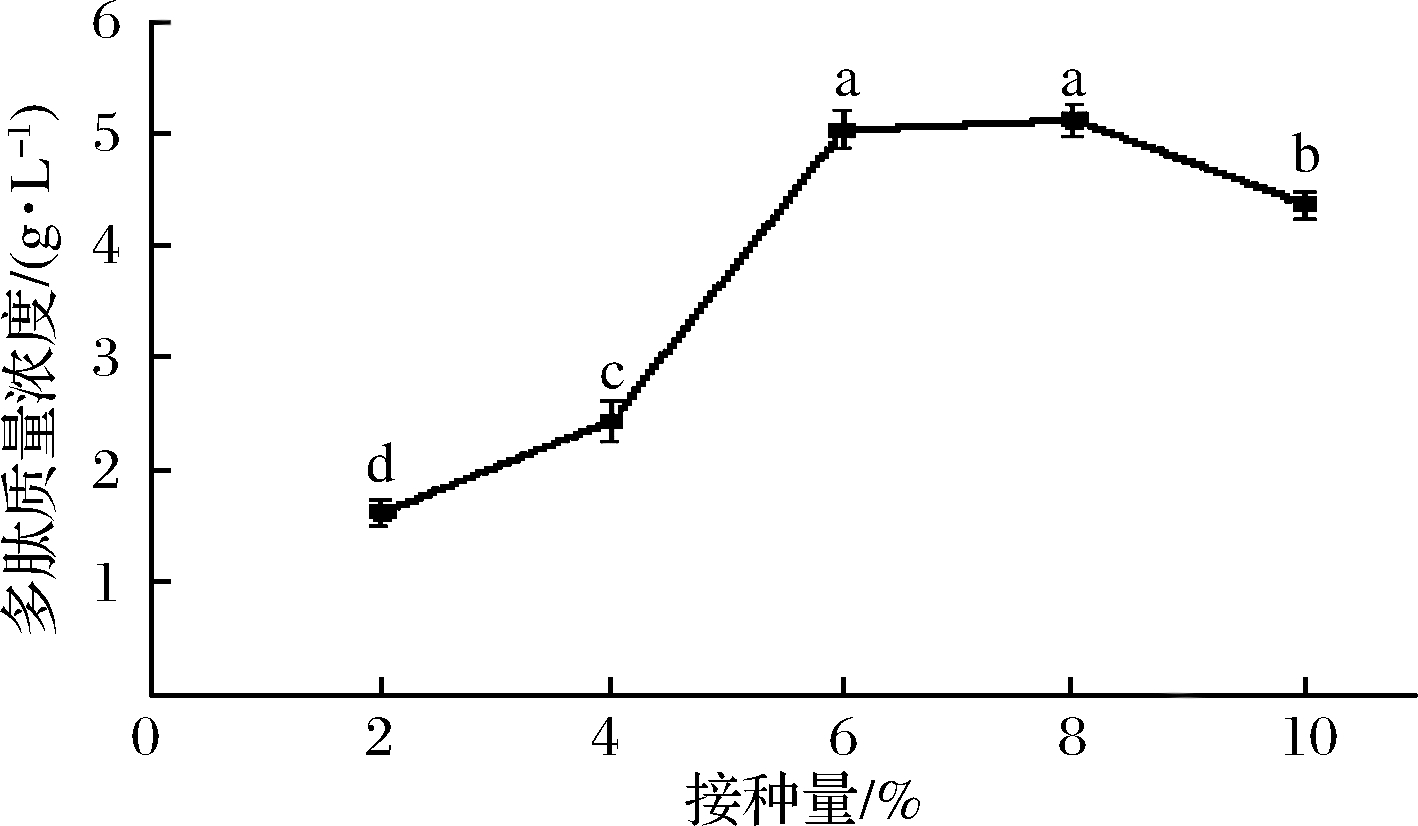
图6 接种量对发酵液产多肽含量的影响
Fig.6 Effect of inoculum size on the content of polypeptide in fermentation
2.4.2 发酵时间对发酵产多肽含量的影响
发酵时间对QDHF-1发酵海参肠发酵液中多肽含量的影响结果如图7所示。随着发酵时间的增加,发酵液中多肽含量呈先上升后下降的趋势。当发酵时间为36 h,多肽含量达到最大值为7.66 g/L,显著高于其他组(P<0.05)。随着发酵时间的延长,发酵液中多肽含量开始逐渐下降,可能是菌体开始消耗多肽所致。因此选择发酵时间为36 h较为合适。
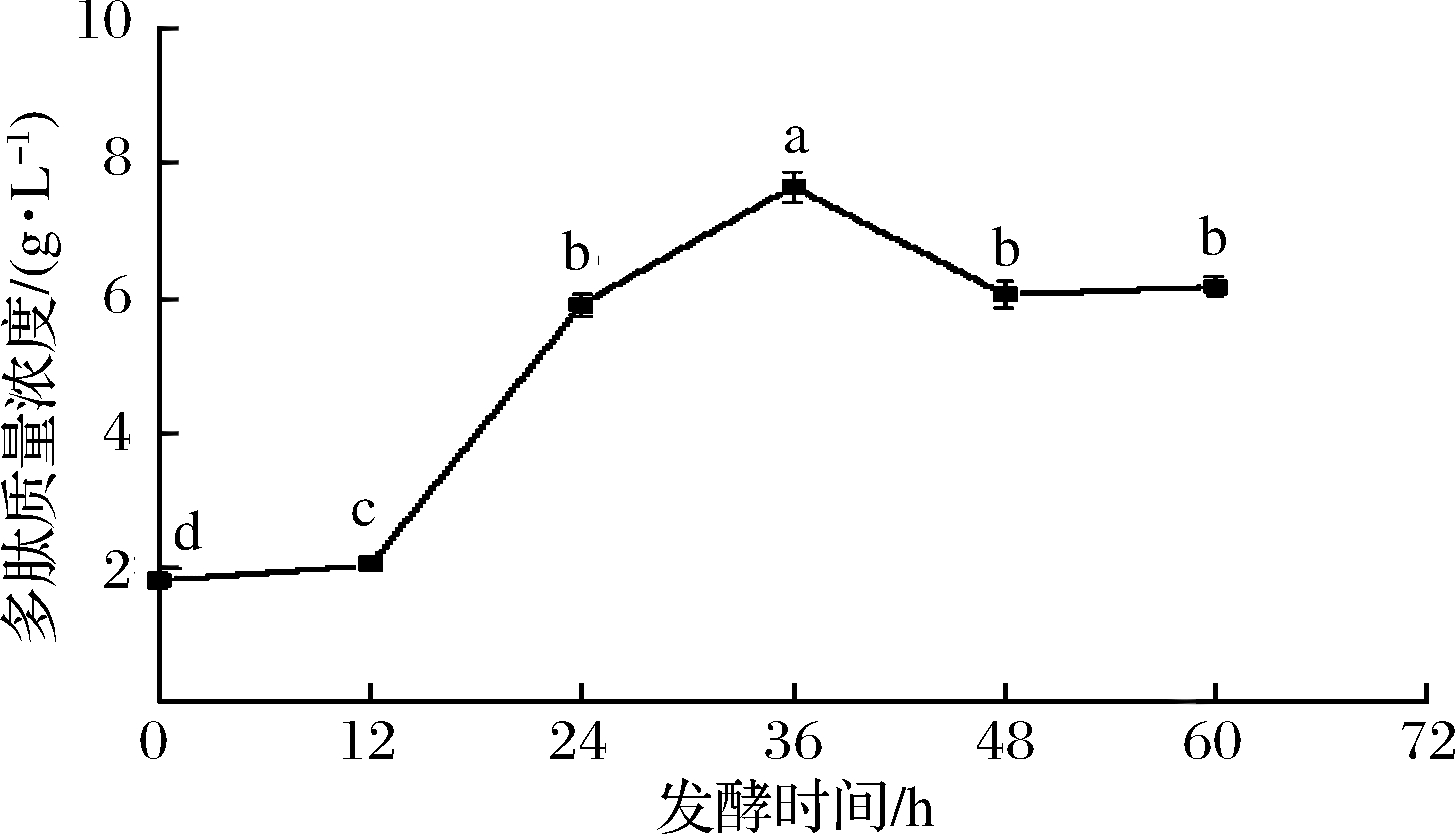
图7 发酵时间对发酵液产多肽含量的影响
Fig.7 Effect of fermentation time on polypeptide content in fermentation
2.4.3 料水比对发酵产多肽含量的影响
料水比对QDHF-1发酵海参肠发酵液中多肽含量的影响结果如图8所示。随着料水比的不断增加,肽含量呈先增加后下降的趋势。当料水比为1∶5(g∶mL)时,多肽质量浓度为13.21 g/L,显著高于其他组(P<0.05)。随着料水比的继续增加,肽含量不断减小,原因可能是料水比的增加造成了肽含量的稀释。因此选择料水比为1∶5(g∶mL)较为合适。

图8 料水比对发酵液产多肽含量的影响
Fig.8 Effect of solid-liquid ratio on polypeptide content in fermentation
2.5.1 不同浓度海参肠发酵物多肽对羟自由基(·OH)的清除能力
不同浓度的海参肠发酵物多肽对羟自由基的清除作用结果,如图9所示。随着海参肠发酵物多肽质量浓度的增大,对羟自由基的清除率逐渐增大,质量浓度为50 g/L时,清除率为93.94%。因此,海参肠发酵物多肽对羟自由基具有良好的清除能力。
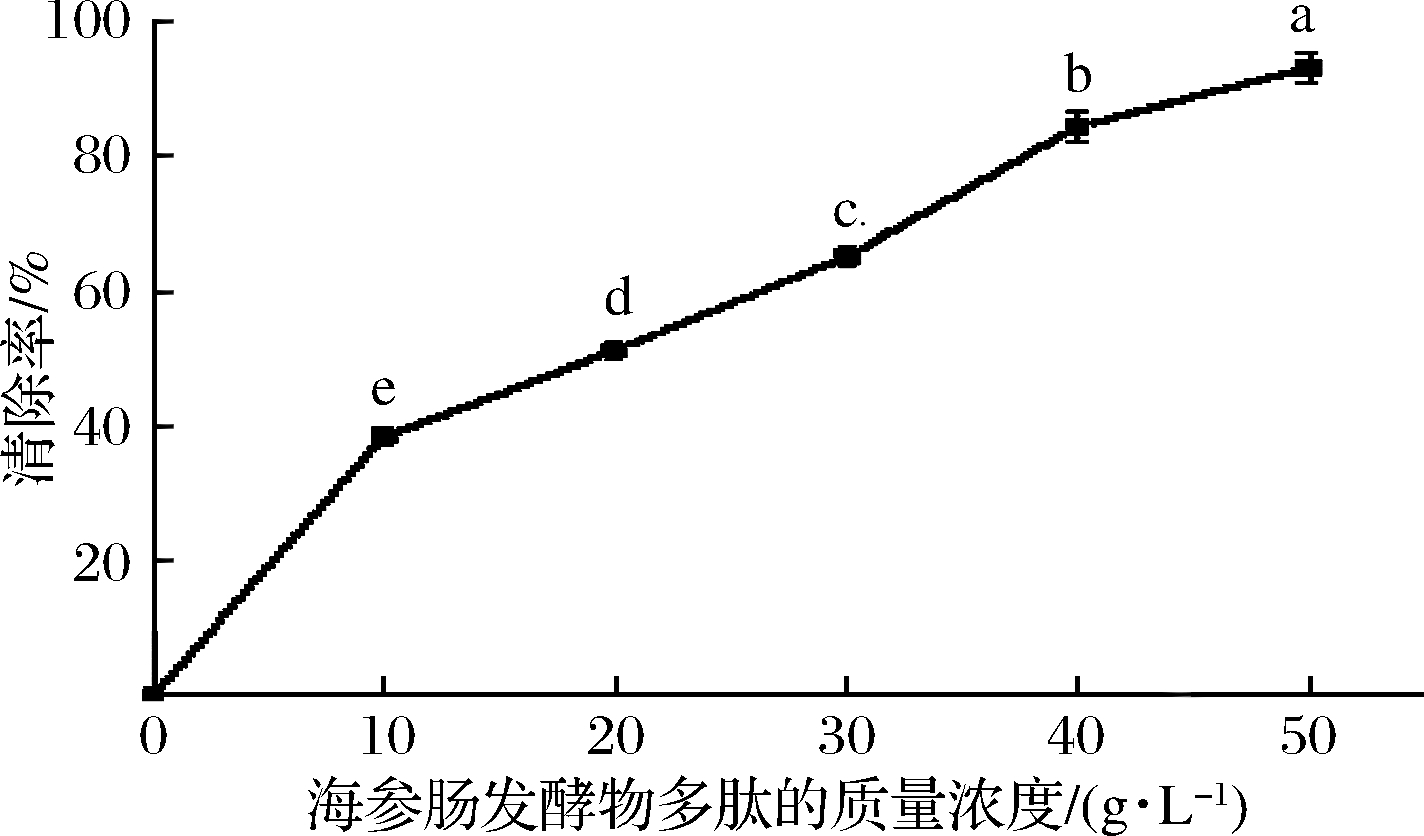
图9 海参肠发酵物多肽对·OH的清除作用
Fig.9 ·OH scavenging effects of fermentation product polypeptide of sea cucumber
2.5.2 不同浓度海参肠发酵物多肽对二苯代苦味酰基自由基(DPPH·)的清除能力
不同浓度的海参肠发酵物多肽对DPPH·的清除作用结果,如图10所示。随海参肠发酵物多肽质量浓度的增大,DPPH·自由基清除率呈不断增大的趋势。当海参肠发酵物多肽质量浓度为50 g/L时,清除率为32.38%。随着浓度继续增加,对DPPH·自由基清除率维持在一定水平。
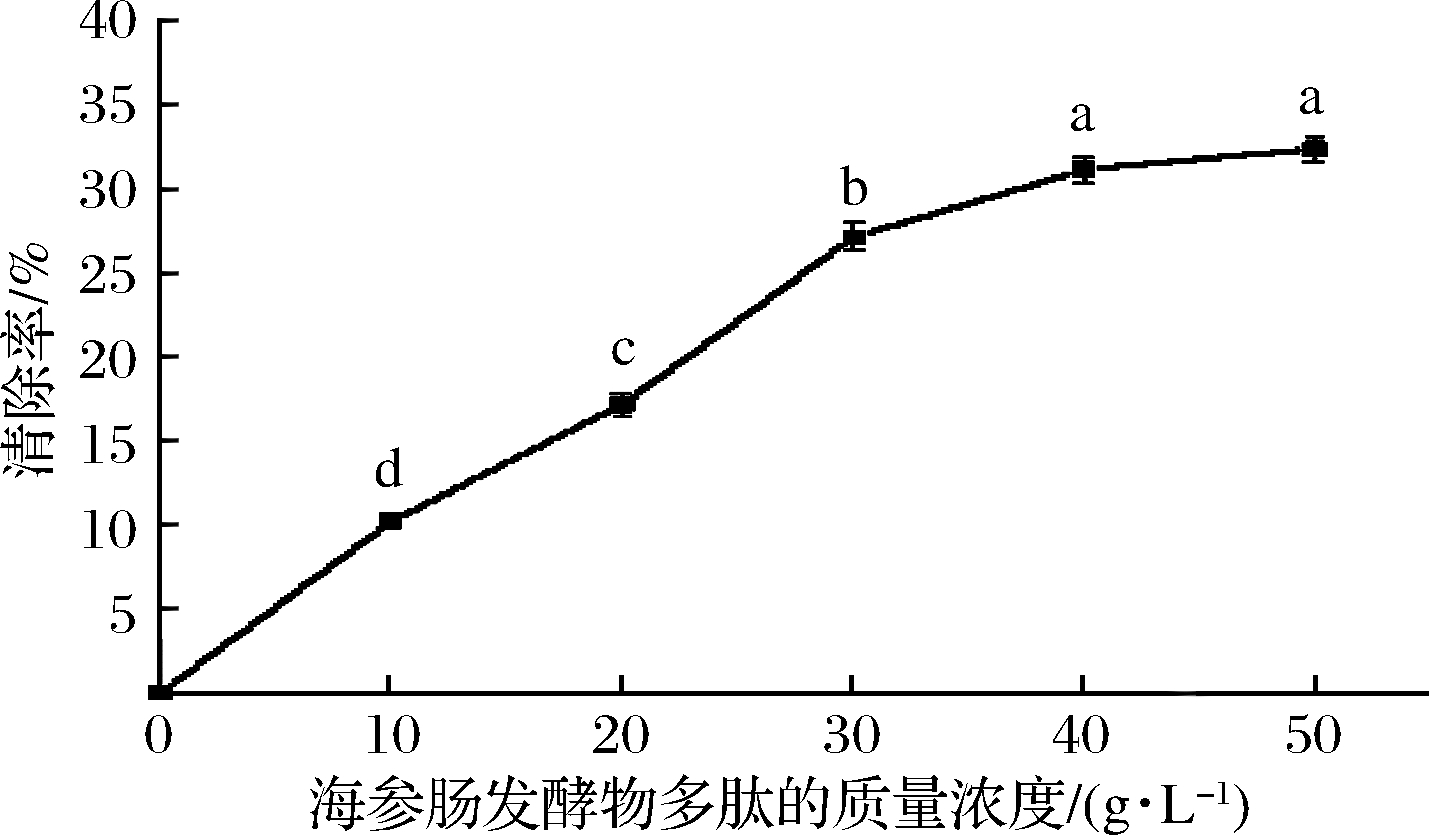
图10 海参肠发酵物多肽对DPPH·的清除作用
Fig.10 DPPH· scavenging effects of fermentation product polypeptide of sea cucumber
2.5.3 不同浓度海参肠发酵物多肽对超氧阴离子自由基![]() 的清除能力
的清除能力
不同浓度的海参肠发酵物多肽对![]() 的清除作用结果,如图11所示。随海参肠发酵物多肽质量浓度的增大,
的清除作用结果,如图11所示。随海参肠发酵物多肽质量浓度的增大,![]() 的清除率逐渐增大。海参肠发酵物多肽质量浓度为90 g/L时,清除率为14.47%,与质量浓度为80 g/L时的清除率没有显著性差异(P>0.05)。
的清除率逐渐增大。海参肠发酵物多肽质量浓度为90 g/L时,清除率为14.47%,与质量浓度为80 g/L时的清除率没有显著性差异(P>0.05)。
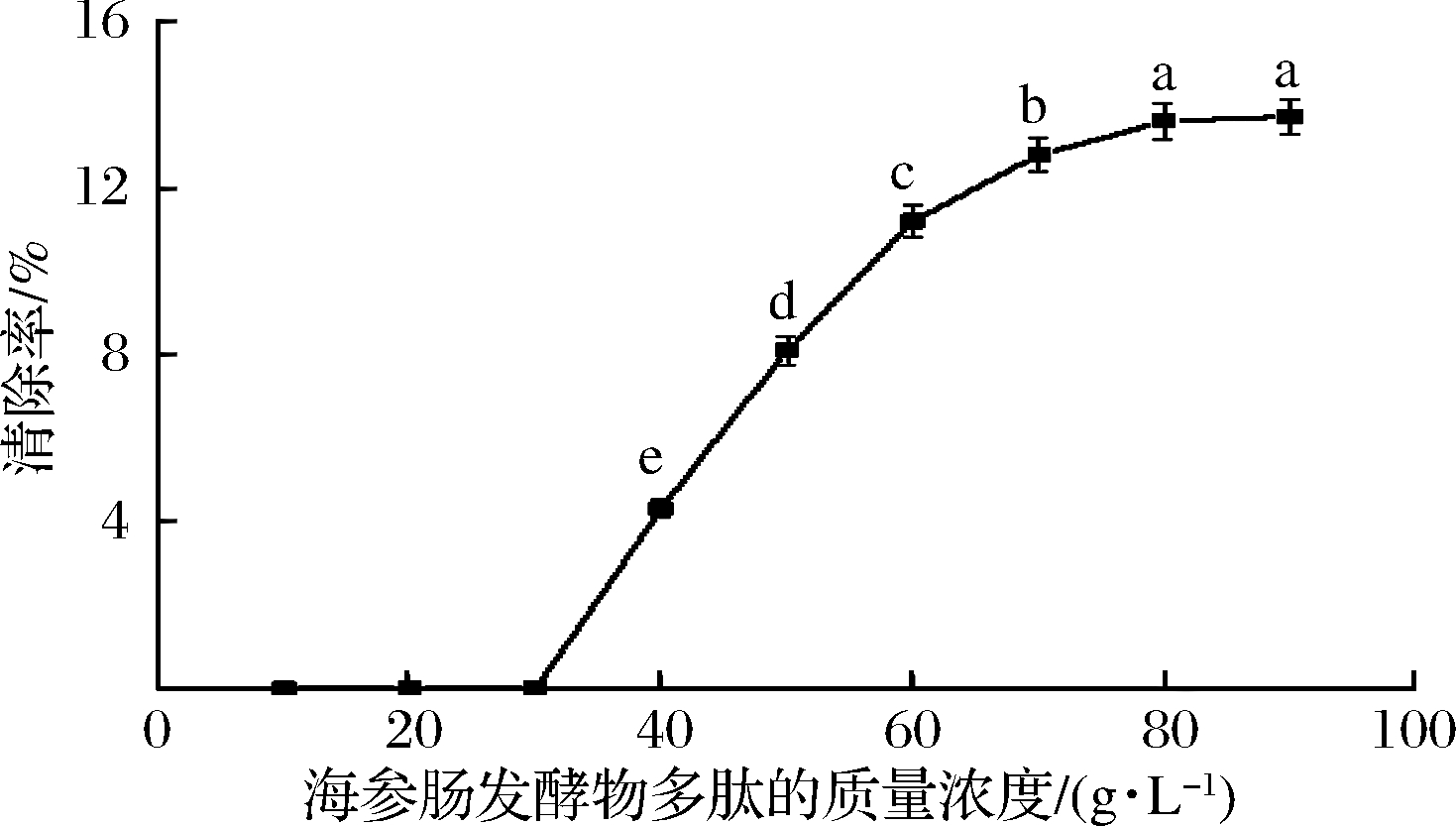
图11 海参肠发酵物多肽对![]() 的清除作用
的清除作用![]() scavenging effects of fermentation
scavenging effects of fermentation
product polypeptide of sea cucumber
本研究中,海参肠发酵物对不同自由基的清除效果依次为:![]() 由此可以说明,经由发酵产生的多肽对·OH具有较高的清除活性,这些多肽中富含多种游离的还原性基团,如巯基、羟基、氨基等,因此可有效保护细胞中极易受·OH攻击的核酸和细胞膜。然而,多肽对DPPH·和
由此可以说明,经由发酵产生的多肽对·OH具有较高的清除活性,这些多肽中富含多种游离的还原性基团,如巯基、羟基、氨基等,因此可有效保护细胞中极易受·OH攻击的核酸和细胞膜。然而,多肽对DPPH·和![]() 具有较低的清除活性,可能的原因是:一方面,具有清除自由基功能的多肽浓度太低,而总多肽浓度较高;另一方面,这些自由基与多肽作用后产生新的自由基,而这些新的自由基具有较高的活性。
具有较低的清除活性,可能的原因是:一方面,具有清除自由基功能的多肽浓度太低,而总多肽浓度较高;另一方面,这些自由基与多肽作用后产生新的自由基,而这些新的自由基具有较高的活性。
本实验通过初筛和复筛从海参肠道中分离筛选获得1株产蛋白酶的菌株QDHF-1,确定菌株QDHF-1是芽孢杆菌目,命名为Thalassobacillus sp.QDHF-1,其最佳产酶发酵条件为pH 8,温度30 ℃,发酵时间72 h。将菌株Thalassobacillus sp.QDHF-1应用于发酵海参肠,其最佳工艺条件为接种量6%,料水比1∶5(g∶mL),发酵时间36 h;海参肠发酵物多肽具有良好的抗氧化活性,其中对羟自由基的具有较强的清除能力,当海参多肽质量浓度为50 g/L时,对羟自由基清除率可达93.94%。本研究为开发具有抗氧化活性的海参肠解多肽产品提供实验依据。
[1] HORIMOTO Y,LIM L T.Effects of different proteases on iron absorption property of egg white hydrolysates[J].Food Research International,2017,95:108-116.
[2] 喻世哲,刘晶晶,吴佳伦,等.外源蛋白酶对腐乳后发酵理化和感官特性的影响[J].食品科学,2018, 39(8):64-68.
[3] HATANAKA T,URAJI M,FUJITA A,et al.Anti-oxidation activities of rice-derived peptides and their inhibitory effects on dipeptidylpeptidase-IV[J].International Journal of Peptide Research & Therapeutics,2015,21(4):479-485.
[4] 于亚莉,宋雪梅,王莹,等.玉米胚芽粕清蛋白酶解产物的制备及其抗氧化活性和护肝作用[J].中国食品学报,2018,18(6):93-103.
[5] OSBORN D A,SINN J K,JONES L J.Infant Formulas Containing Hydrolysed Protein for Prevention of Allergic Disease and Food Allergy[M].The Cochrane Library.John Wiley & Sons,Ltd,2017:CD003664.
[6] 刘唤明,张芷欣,洪鹏志,等.耐高温代表酶产生菌的筛选及酶学特性的初步研究[J].食品工业科技,2017,38(3):133-136;142.
[7] HERN NDEZ-LEDESMA B,DEL M C M,RECIO I.Antihypertensive peptides:Production,bioavailability and incorporation into foods[J].Advances in Colloid & Interface Science,2011,165(1):23-35.
NDEZ-LEDESMA B,DEL M C M,RECIO I.Antihypertensive peptides:Production,bioavailability and incorporation into foods[J].Advances in Colloid & Interface Science,2011,165(1):23-35.
[8] YARNPAKDEE S,BENJAKUL S,KRISTINSSON H G,et al.Antioxidant and sensory properties of protein hydrolysate derived from Nile tilapia (Oreochromis niloticus) by one-and two-step hydrolysis[J].Journal of Food Science & Technology,2015,52(6):3 336-3 349.
[9] GUO Z,LIN D,GUO J,et al.In vitro antioxidant activity and in vivo anti-fatigue effect of sea horse (Hippocampus) peptides[J].Molecules,2017,22(3):482.
[10] 张海祥,魏兆军,周乐春,等.响应曲面法优化动物蛋白酶水解脱脂蚕蛹蛋白的工艺[J].食品科学,2009,30(24):188-192.
[11] 陈艳辉,李超柱,黎丹戎,等.动物蛋白酶酶解制备广西产牡蛎肉抗肿瘤活性肽的实验研究[J].食品工业科技,2010,31(8):167-169.
[12] VOJCIC L,PITZLER C,KÖRFER G,et al.Advances in protease engineering for laundry detergents.[J].New Biotechnology,2015,32(6):629-634.
[13] BANERJEE G,RAY A K.Impact of microbial proteases on biotechnological industries[J].Biotechnology & Genetic Engineering Reviews,2017,33(2):119-143.
[14] BHATNAGAR I,KIM S K. Immense essence of excellence: marine microbial bioactive compounds.[J].Marine Drugs,2010,8(10):2 673-2 701.
[15] SATPUTE S K,BANAT I M,DHAKEPHALKAR P K,et al.Biosurfactants,bioemulsifiers and exopolysaccharides from marine microorganisms[J].Biotechnology Advances,2010,28(4):436-450.
[16] ZHANG C,KIM S K.Research and application of marine microbial enzymes:Status and prospects[J].Marine Drugs,2010,8(6):1 920-1 934.
[17] CONTESINI F J,MELO R R,SATO H H.An overview of Bacillus proteases:From production to application[J].Critical Reviews in Biotechnology,2018,38(3):321-334.
[18] DOS SANTOS AGUILAR J G,SATOH H. Microbial proteases:Production and application in obtaining protein hydrolysates[J].Food Research International,2018,103:253-262.
[19] 王凤舞,段书娟,仝令君,等.产低温碱性蛋白酶菌株QD-1的鉴定及产酶条件和酶学性质[J].中国食品学报,2017,17(2):85-91.
[20] 李倩倩,刘双双,陈海华,等.单环刺螠内脏蛋白酶的分离纯化与酶学性质研究[J].中国食品学报,2016,16(6):88-95.
[21] BANERJEE G,MUKHERJEE S,BHATTACHARYA S,et al.Purification and characterization of extracellular protease and amylase produced by the bacterial strain,Corynebacterium alkanolyticum,ATH3 isolated from fish gut[J].Arabian Journal for Science & Engineering,2015,41(1):9-16.
[22] 吴海龙.海参体壁中胶原蛋白酶的研究[D].厦门:集美大学,2013.
[23] 郭晓坤,李傲婷,韩佳润,等.海参肠组织蛋白酶D的提取及酶学特性研究[J].食品工业科技,2017,38(18):135-139;144.
[24] FU X Y,XUE C H,MIAO B C,et al.Characterization of proteases from the digestive tract of sea cucumber (Stichopus japonicus):High alkaline protease activity[J].Aquaculture,2005,246(1-4):321-329.
[25] BEZERRA R S,LINS E J F,ALENCAR R B,et al.Alkaline proteinase from intestine of Nile tilapia (Oreochromis niloticus)[J].Process Biochemistry,2005,40(5):1 829-1 834.
[26] WILSON K.Preparation of genomic DNA from bacteria[J].Methods in Enzymology,2013,529(4):143-151.
[27] 朱玫瑛.海参肠道产蛋白酶菌的分离鉴定及其在海参下脚料中的应用[D].山东:青岛农业大学,2014.
[28] 张云楚,纪宇.双辛可宁酸法测定胎盘多肽注射液中低浓度多肽的含量[J].中国生化药物杂志,2010,31(6):402-404.
[29] 文镜,贺素华,杨育颖,等.保健食品清除自由基作用的体外测定方法和原理[J].食品科学,2004,25(1):190-195.
[30] ALI B,MOHAMED H,RAFIK B,et al. Antioxidant and free radical-scavenging activities of smooth hound (Mustelus mustelus) muscle protein hydrolysates obtained by gastrointestinal proteases[J].Food Chemistry,2009,114(4):1 198-1 205.
[31] 杨明琰,张晓琦,沈俭,等.超氧化物歧化酶两种邻苯三酚自氧化测定活力方法的比较[J].微生物学杂志,2006,26(3):40-42.