赖氨酸芽孢杆菌(Lysinibacillus fusiformis)广泛存在于海洋、土壤、植物体内及动物体内,该菌的发酵产物在各个领域中均有应用潜力。有报道表明,赖氨酸芽孢杆菌可对食物和农产品的黄曲霉毒素B1进行降解[1];刘贵友等[2]从土壤样品中分离得到1株耐有机溶剂的赖氨酸芽孢杆菌CGMCC 4913,该菌能将葛根素转化成葛根素-7-O-果糖苷;AHMAD等[3-4]从果蔬中分离得到赖氨酸芽孢杆菌JX416855、JX416856,2株菌具有抗食源性细菌的潜力;SEO等[5]从赖氨酸芽孢杆菌中分离得到一种可转化蓖麻油酸的化合物10,12-dihydroxystearic acid,通过乳化活性实验表明该化合物可用作生物表面活性剂。
芽孢杆菌在发酵过程中能产生脂肽类、聚酮类、有机酸类、细菌素等[6-9]抗菌物质,在食品保鲜、环境治理、植物病害防治和医药治疗上具有极大的应用价值。目前对赖氨酸芽孢杆菌发酵液抗真菌活性的研究较少,有文献报道赖氨酸芽孢杆菌B-CM18对植物病原真菌的生长有抑制作用[10],还没有抗动物病原真菌方面的报道。
本研究对赖氨酸芽孢杆菌(Lysinibacillus fusiformis)He14发酵液的抗真菌谱进行初步研究,对发酵液中活性成分进行了稳定性考察及抑菌活性物质富集方式的优化,初步纯化富集得到的活性粗产物,研究结果为赖氨酸芽孢杆菌的开发利用提供参考依据。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
赖氨酸芽孢杆菌(Lysinibacillus fusiformis)He14、水稻纹枯病菌(Thanatephorus cucumeris)、水稻稻瘟病菌(Magnaporthe grisea)、烟草黑胫病菌(Phytophthora nicotianae)、辣椒灰霉病菌(Botrytis cinerea)、马铃薯早疫病菌(Alternaria solani)、马铃薯晚疫病菌(Phytophthora infestans)、须毛癣菌(Trichophyton mentagrophytes)、红色毛癣菌(Trichophyton mbmm):均由贵州大学贵州省生化工程中心分离保藏。
1.1.2 培养基
NB固体培养基(g/L):蛋白胨10,牛肉膏3,NaCl 5,琼脂20,121 ℃灭菌30 min。
NB液体培养基(g/L):蛋白胨10,牛肉膏3,NaCl 5,121 ℃灭菌30 min。
PDA培养基(g/L):马铃薯200,葡萄糖20,琼脂20,121 ℃灭菌30 min。
1.1.3 仪器与设备
SFAT-8000C液体发酵自动控制系统,江苏大学镇江市江大科技有限公司;SA-1480-2水平层流洁净工作台,上海上净净化设备有限公司;PQX多段可编程人工气候箱,宁波东南仪器有限公司;SORVALL Legend MICRO 21微量离心机,赛默飞世尔科技有限公司;R-100旋转蒸发仪,瑞士BUCHI公司;PHS-25 pH测试仪,上海雷磁仪器有限公司。
1.2 试验方法
1.2.1 病原真菌的活化
将6株植物病原真菌和2株动物病原真菌接种于9 cm的PDA培养皿中,28 ℃培养,待菌丝体长满培养皿后,4 ℃保存备用。
1.2.2 菌株He14发酵液的制备
将菌株He14接种于NB固体培养基中,28 ℃活化培养24 h。制备NB液体培养基,于121 ℃灭菌30 min后接种活化好的菌株,作为种子液于28 ℃、120 r/min摇床培养24 h。将He14种子液以1%的接种量接种于装有NB液体培养基的10 L发酵罐中,作为发酵液于28 ℃、120 r/min培养3 d。
1.2.3 菌株He14发酵液对不同病原真菌的抑制作用
取少量菌株He14的发酵液,经4 200 r/min离心10 min后,上清液用细菌过滤器过滤,滤液采用生长速率法[11]进行活性测定。即将发酵滤液和PDA培养基混合倒入培养皿中,制成含药培养基,发酵液的质量浓度为3 g/L,等量无菌水为空白对照。用5 mm打孔器对培养好的病原真菌自菌落边缘切取菌饼,将菌饼放置于培养皿中央,菌丝面朝上,于培养箱中培养至各病原真菌的空白对照菌丝长满培养皿。通过十字交叉法测定菌落直径,按公式(1)计算发酵滤液对各病原真菌菌丝生长的抑制率。
抑制率![]()
(1)
1.2.4 发酵液抗真菌成分的稳定性
在不同温度(0、20、40、60、80、100 ℃)处理发酵液 1 h 后测定抑真菌活性效果;用10%(体积分数)HCl和100 g/L NaOH调节发酵液pH值(1、3、5、7、9、11、13) 2 h后再调回到初始pH值7.85,测定抑真菌活性效果;将发
酵液置于30 W紫外灯下照射30、60、90、120、150、180 min,以未经紫外照射的发酵液做为对照测定抑真菌活性效果。指示病原真菌为辣椒灰霉病菌。
1.2.5 不同方法富集发酵液的抑菌活性成分
将发酵液分别用石油醚、乙酸乙酯、正丁醇按1∶1(体积比)萃取2次,合并相同的有机层及水层,浓缩至干测定抑真菌活性;使用明矾、AlCl3、FeSO4、Al2(SO4)3处理发酵液后取上清液及沉淀物测定抑真菌活性;选用非极性大孔吸附树脂D101、LX-60,中等极性大孔吸附树脂LSA-12、XDA-6,极性大孔吸附树脂LX-17、XDA-8G对发酵液进行吸附,用乙醇进行洗脱,将流出液与洗脱液分别浓缩至干,得粗产物,测定其抑真菌活性。指示病原真菌为辣椒灰霉病菌。
1.2.6 活性粗产物的纯化与活性筛选
将经过富集处理的活性粗产物用硅胶柱层析,通过琼脂扩散法[12]对初步分离得到的产物进行抑真菌实验,供试病原真菌为水稻纹枯病菌、马铃薯晚疫病菌、辣椒灰霉病菌、马铃薯早疫病菌和须毛癣菌。
1.2.7 数据处理
数据均为3次独立试验平均值,采用Microsoft Excel 2007对原始试验数据进行整理,用SPSS 17.0进行统计分析,所得实验数据采用方差分析(ANOVA),并用Duncan法对各测定数据进行显著性检验,结果以均数±标准差表示。
2 结果与分析
2.1 菌株He14发酵液对不同病原真菌的抑菌能力
试验结果表明,菌株He14的发酵液对6株植物病原真菌和2株动物病原真菌的生长均有抑制作用(表1,图1)。在植物病原真菌中,发酵液对马铃薯晚疫病菌的拮抗作用最强,抑制率为100%;对辣椒疫霉菌的拮抗作用相对较弱,抑制率为81%;对水稻纹枯病菌、水稻稻瘟病菌、烟草黑胫病菌和马铃薯早疫病菌的抑制率在50%~75%。对动物病原真菌须毛癣菌和红色毛癣菌的拮抗强度相同,抑制率均为75%。综合抑制率与病原真菌的生长速度考虑,选择辣椒灰霉病菌作为菌株He14抗真菌活性实验的指示菌用于后续实验。
表1 菌株He14对病原真菌的抑制作用
Table 1 Inhibitory effects of strain He14 on pathogenic fungi

处理ABCDEFGH对照组直径/mm85.0±0.185.0±0.165.0±0.185.3±0.285.0±0.270.6±0.185.0±0.770.0±0.2实验组直径/mm45.0±0.732.1±0.823.0±0.525.0±0.525.0±0.321.1±0.220.3±0.25.0±0.0抑制率/%50.1±0.265.9±0.770.0±0.475.1±0.475.0±0.875.4±0.381.0±0.4100.0±0.0
注:A-水稻稻瘟病菌;B-烟草黑胫病菌;C-马铃薯早疫病菌;D-须毛癣菌;E-水稻纹枯病菌;F-红色毛癣菌;G-辣椒灰霉病菌;H-马铃薯晚疫病菌。下同。
2.2 菌株He14发酵产物抑真菌活性物质的稳定性
实验表明,菌株He14的发酵液在低温及中高温环境抑制率为76%~79%,在120 ℃下处理1 h后抑制率为71%,说明发酵液中活性成分具有一定的热稳定性;发酵液在pH 3~11环境下处理2 h后对供试病原真菌的抑制率可维持在70%~81%,在pH 1和pH 13时抑制率下降,为53%~59%;发酵液在紫外环境下处理30 ~180 min后抑制率维持在78%左右,与未经紫外照射的对照组相比抑制率基本不变,说明菌株He14发酵液中的抑菌活性物质具有紫外稳定性(图1~图3)。
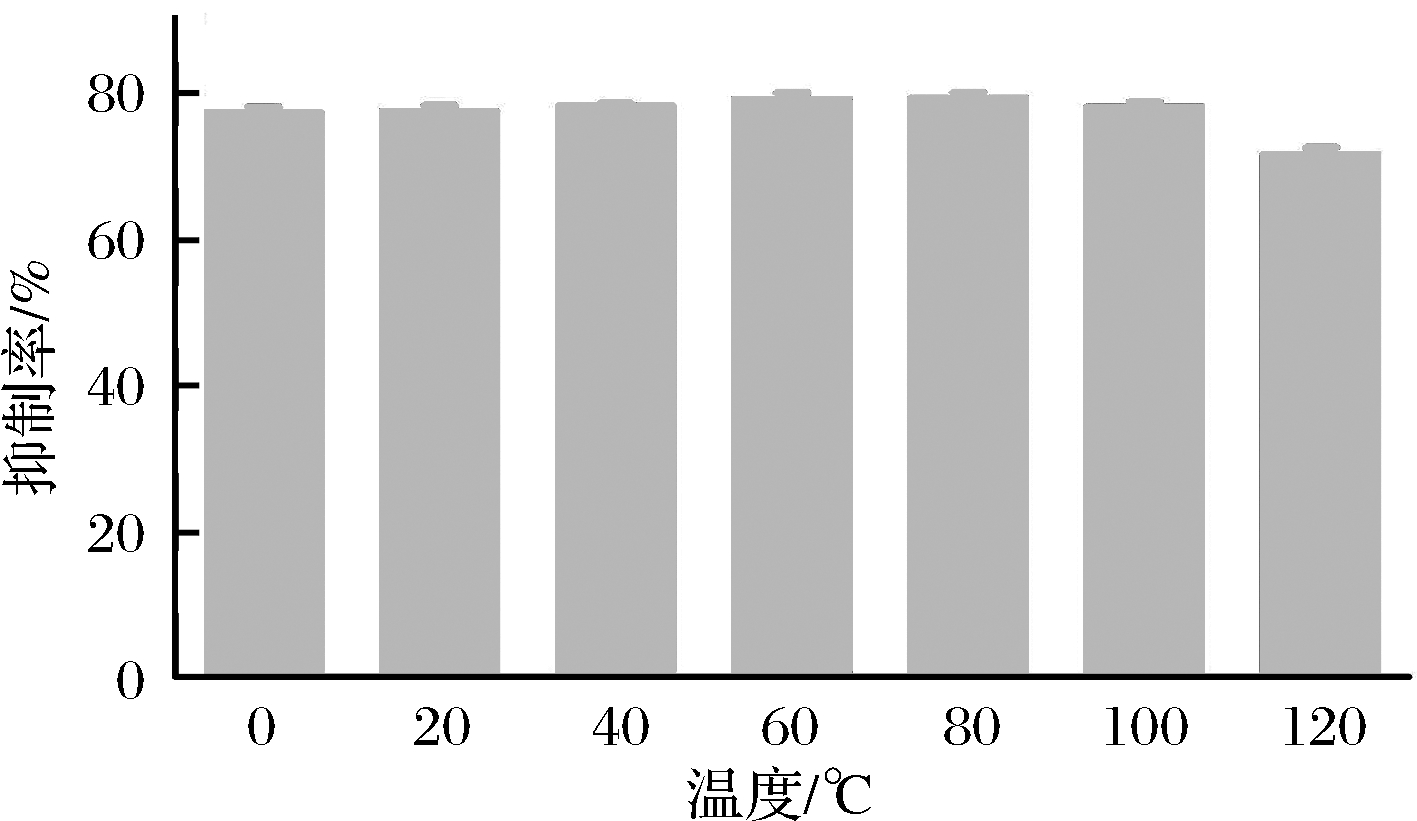
图1 温度对菌株He14发酵液抑菌活性的影响
Fig.1 Effect of temperature on antibacterial activity of strain He14 fermentation broth
2.3 不同富集方法对发酵液抑真菌活性成分的影响
试验结果表明,发酵液经萃取处理后,各有机层粗提物与各水层粗提物均有不同程度的抑真菌效果,同等浓度下各有机层与各水层的抑真菌效果均小于原液,且活性规律不明显;AlCl3、FeSO4、Al2(SO4)3
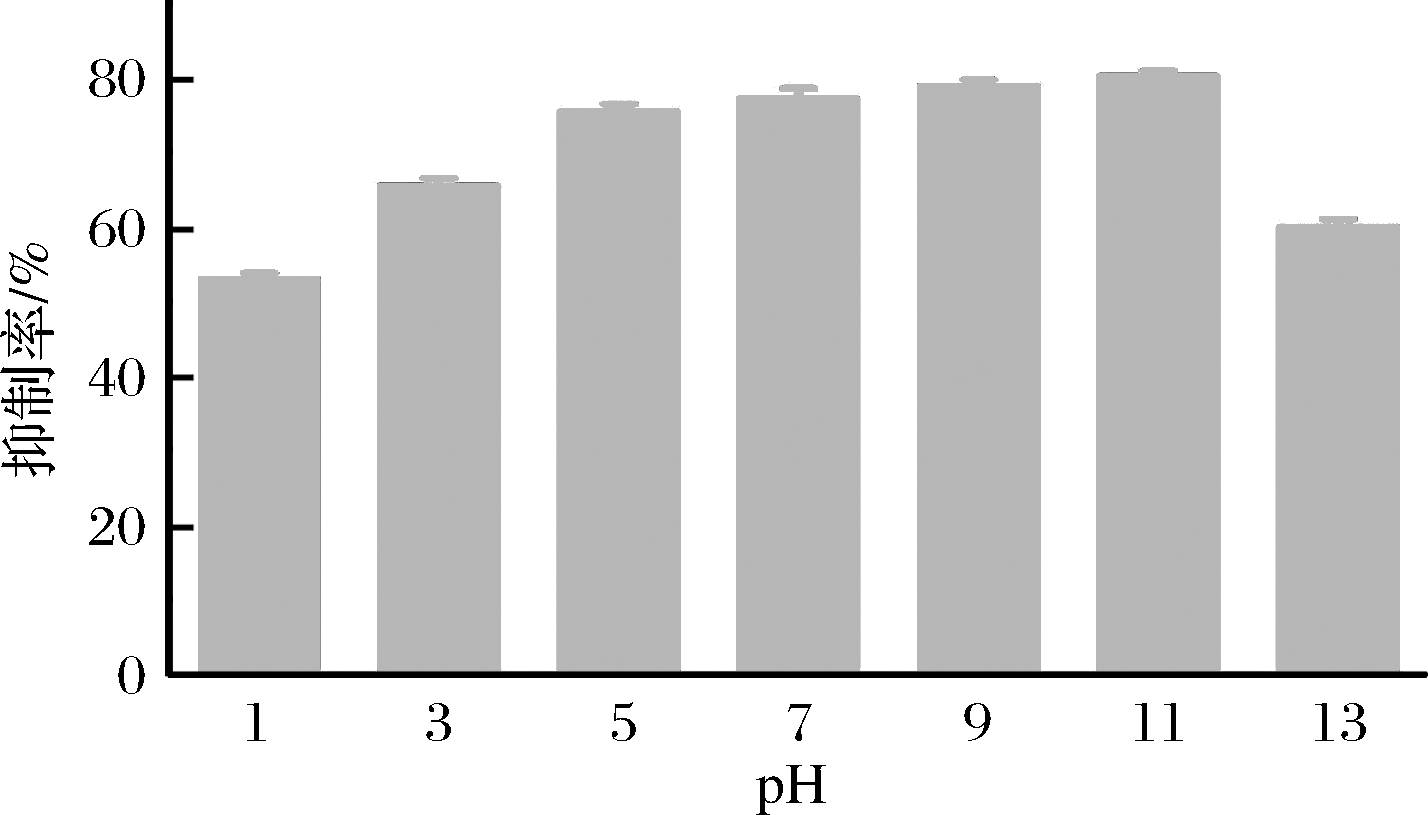
图2 pH值对菌株He14发酵液抑菌活性的影响
Fig.2 Effect of pH on antibacterial activity of strain He14 fermentation broth
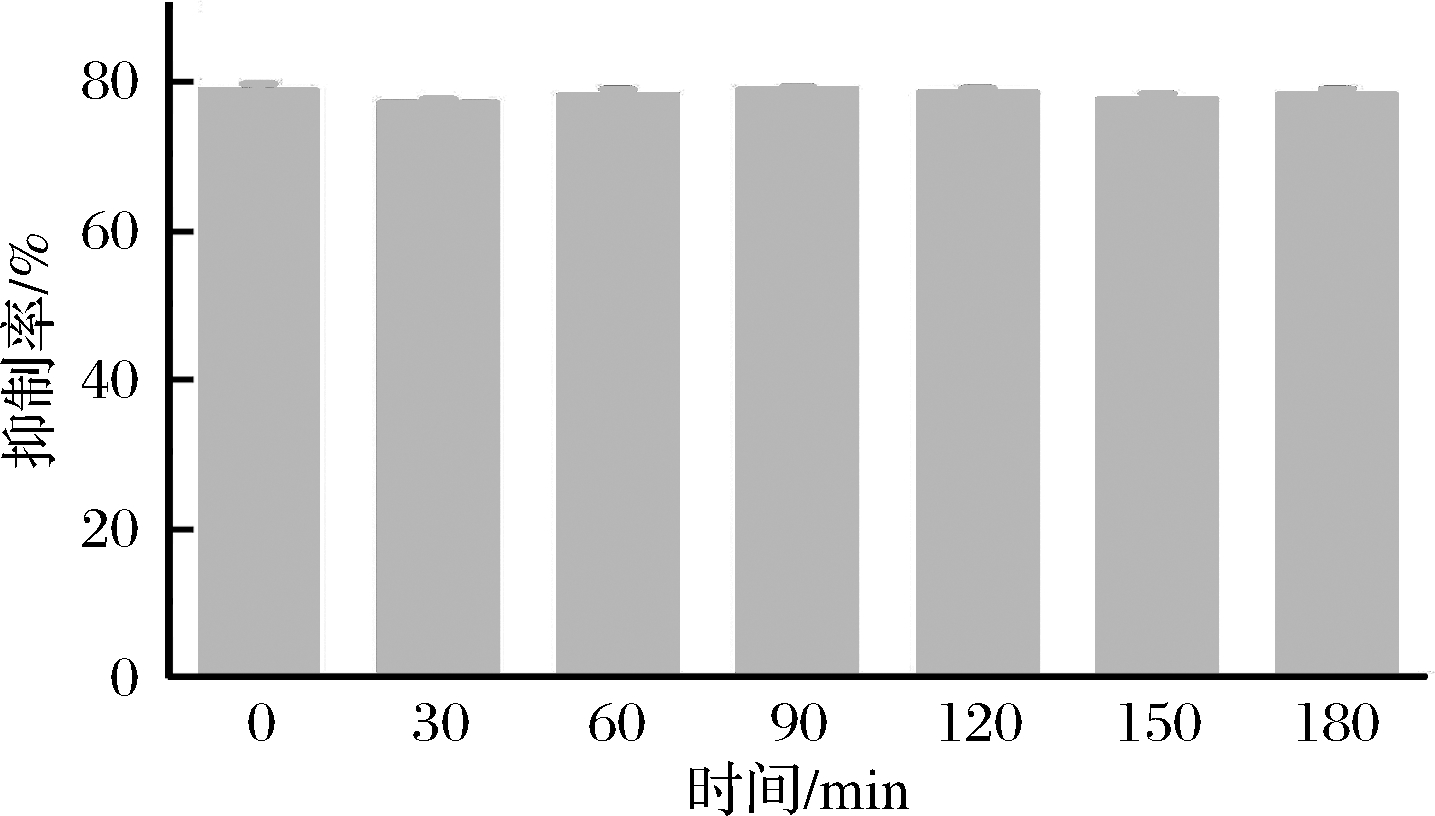
图3 紫外对菌株He14发酵液抑菌活性的影响
Fig.3 Effect of UV on antibacterial activity of strain He14 fermentation broth
均不能使发酵液变澄清,发酵液经明矾处理后液体虽然可以澄清,但活性较原液大大降低,且沉淀物没有抑真菌活性;大孔吸附树脂可有效富集发酵液中的活性成分,其中LX-60型大孔吸附树脂效果最好(表2~表5)。
表2 萃取实验结果
Table 2 Results of extraction

指标空白原液石油醚乙酸乙酯正丁醇有机层水层有机层水层有机层水层菌落直径/mm90.0±0.330.0±0.368.0±0.442.0±0.562.0±0.240.0±0.438.0±0.580.0±0.3抑制率/%-70.7±0.826.1±0.756.4±0.433.3±0.459.1±0.461.0±0.211.7±0.1
注:“-”表示未检出。下同。
表3 发酵液加入絮凝剂后活性变化结果
Table 3 Results on treatment by flocculant
指标空白原液明矾上清液明矾沉淀菌落直径/mm90.0±0.231.0±0.680.0±0.783.0±0.3抑制率/%-70.0±0.512.1±0.48.2±0.4
表4 大孔吸附树脂流出液抑真菌活性
Table 4 Antifungal activities of effluent of resins

指标空白对照原液D101LX-60LSA-12XDA-6LX-17XDA-8G菌落直径/mm90.0±0.130.0±0.366.0±0.688.0±0.212.0±0.351.0±0.240.0±0.370.0±0.1抑菌率/%-70.6±0.328.2±0.72.3±0.491.8±0.445.9±0.258.8±0.623.5±0.2
表5 大孔吸附树脂洗脱液抑真菌活性
Table 5 Antifungal activities of eluent of resins

指标空白对照原液D101LX-60LSA-12XDA-6LX-17XDA-8G菌落直径/mm90.0±0.130.0±0.325.0±0.225.0±0.425.0±0.425.0±0.228.0±0.128.0±0.3抑菌率/%-70.6±0.376.5±0.576.5±0.776.6±0.776.5±0.572.9±0.372.9±0.5
2.4 抑真菌活性产物的筛选
活性粗产物经硅胶柱层析后得到不同的混合组分。抑真菌活性实验结果表明混合组分Ⅰ、Ⅱ、Ⅲ显示出了抑真菌活性(表6)。其中组分Ⅱ对供试病原真菌的生长均有抑制效果,组分Ⅰ对水稻纹枯病菌、马铃薯晚疫病菌、辣椒灰霉病菌有抑制作用,组分Ⅲ对马铃薯晚疫病菌、辣椒灰霉病菌和须毛癣菌有抑制作用。
另外,病原真菌给药处理持续培养时发现,组分Ⅱ不仅对马铃薯晚疫病菌的生长有较强的抑制作用,还可令已生长的马铃薯晚疫病菌菌丝死亡(图4)。
表6 混合组分Ⅰ, Ⅱ和Ⅲ对病原真菌的抗菌谱
Table 6 Antifungal spectrum of compoundⅠ,Ⅱ and Ⅲ against pathogenic fungi

编号病原真菌IHGCD组分Ⅰ+++--组分Ⅱ++++++++++组分Ⅲ-++++-++
注:-表示无抑菌活性;+表示弱抑菌活性;++表示中等抑菌活性;+++表示强抑菌活性;I-水稻纹枯病菌。
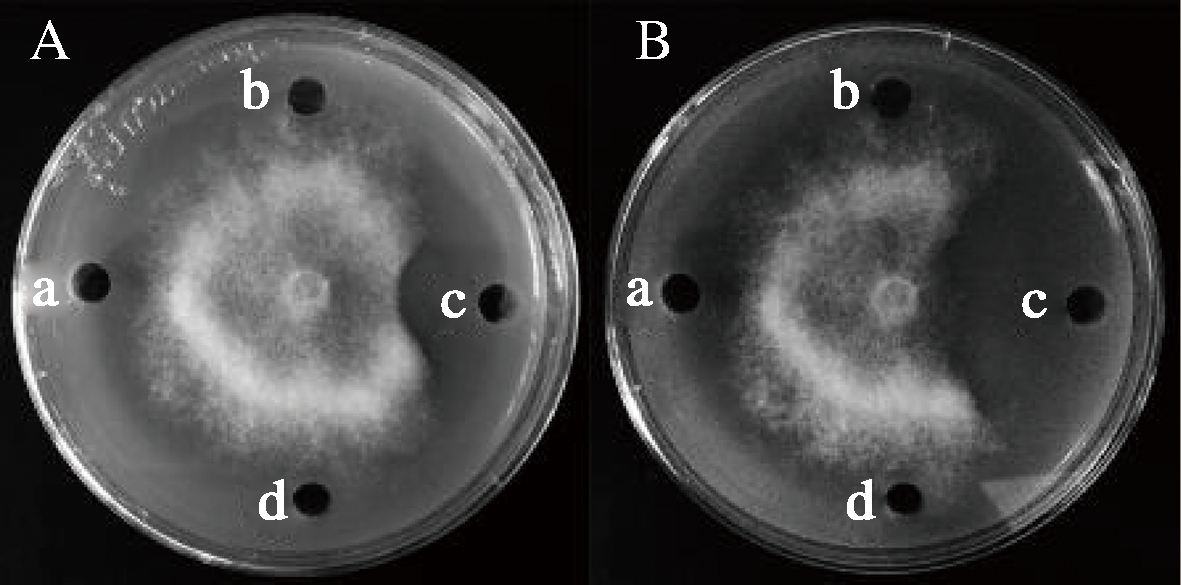
A-培养7 d;B-培养10 d
图4 混合组分对马铃薯晚疫病菌抑制效果
Fig.4 Inhibitory effect of components onPhytophthora infestans
注:a为组分Ⅰ; c为组分Ⅱ; b与d为空白对照组。
3 讨论
目前对赖氨酸芽孢杆菌的研究表明,其产生的活性物质主要有蛋白酶类[13]、多糖类[14]、表面活性剂[15-16]等。曾承露等[17]运用响应面法对赖氨酸芽孢杆菌P-3产胞外多糖的发酵工艺参数进行了优化,使该菌产生胞外多糖的平均产量提高到2.92 g/L。王伟高等[18-20]从小鼠体内分离得到1株可产氨基甲酸乙酯水解酶的赖氨酸芽孢杆SC02,经发酵培养条件优化后,该菌株最高酶活水平可达到7 066 U/L。PARK等[16]从赖氨酸芽孢杆菌KMC003中分离出螺环戊烯酮、螺菌毒素,但未进行活性测定。SINGH等[10]对赖氨酸芽孢杆菌B-CM18进行广谱抗菌测定,发现该菌株对多种植物病原真菌有拮抗性并分离到了抗菌活性物质——几丁质酶,但并未加入动物病原真菌。
本研究不仅测定了常见的植物病原真菌,还测定了对人类有感染性的动物病原真菌,丰富了赖氨酸芽孢杆菌的抗真菌谱。研究发现该菌株的活性物质具有良好的稳定性,为后期分离纯化工作奠定了基础。以抑真菌活性结果为指导,相比较于萃取和沉淀处理发酵液,使用大孔吸附树脂能有效富集He14发酵液的抗真菌活性物质。对活性粗产物进行初步分离,得到有抑真菌活性的混合组分Ⅰ、Ⅱ、Ⅲ,其中组分Ⅱ抑真菌效果最强,且可令已生长的马铃薯晚疫病菌菌丝死亡,说明该组分可深入研究其抑真菌机制,以期发挥其在生物防治方面的潜力。
[1] ADEBO O A, NJOBEH P B, MAVUMENGWANA V. Degradation and detoxification of AFB1, by Staphylocococcus warneri, Sporosarcina sp. and Lysinibacillus fusiformis[J]. Food Control, 2016,68: 92-96.
[2] 刘贵友, 王思渊, 袁生. 碳和氮源以及pH对耐有机溶剂葛根素糖基化菌株Lysinibacillus fusiformis CGMCC4913生长及转化活性的影响[J]. 南京师范大学学报(自然科学版), 2016, 39(2): 61-65.
[3] AHMAD V, KHAN M S. Therapeutic intervention and molecular characterizations of bacteriocin producing Lysinibacillus sp. nov. isolated from food sample [J]. Pakistan Journal of Pharmaceutical Sciences, 2015, 28(4): 1 337.
[4] AHMAD V, LGBALAN M Z, HASEEB M, et al. Antimicrobial potential of bacteriocin producing Lysinibacillus jx416856 against foodborne bacterial and fungal pathogens, isolated from fruits and vegetable waste[J]. Anaerobe, 2014, 27: 87-95.
[5] SEO M H, KIM K R, OH D K. Production of a novel compound, 10,12-dihydr-oxystearic acid from ricinoleic acid by an oleate hydratase from Lysinibacillus fusiformis[J]. Applied Microbiology and Biotechnology, 2013, 97(20): 8 987-8 995.
[6] 张学雯, 张学彬,李红亚,等. 黄曲霉拮抗菌Bacillus amyloliquefaciens B10-6-1产生的脂肽类抗生素的分离和鉴别[J]. 中国生物防治学报, 2019, 38(3): 1-9.
[7] 陈娜. 芽孢杆菌AH-E-1抗真菌肽的分离纯化、性质及产生条件研究[D]. 天津:天津大学, 2012.
[8] 张爱民. 解磷解钾特异菌株CX-7的筛选及其应用试验研究[D]. 保定:河北农业大学, 2014.
[9] 桑建伟, 陈奕鹏,蔡吉苗,等. 拮抗内生细菌BEB17对4个香蕉品种组培杯苗的定殖、促生分析和抗病性评价[J]. 热带作物学报, 2018, 39(7): 1 383-1 389.
[10] SINGH R K, KUMAR D P, SOLANKI M K, et al. Optimization of media components for chitinase production by chickpea rhizosphere associated Lysinibacillus fusiformis B-CM18[J]. Journal of Basic Microbiology, 2013, 53(5): 451-460.
[11] 盖智星, 王日葵, 贺明阳, 等. 肉桂酸钾对柑橘采后主要病原真菌的抑制作用[J]. 食品与发酵工业, 2016, 42(3): 109-113.
[12] 胡显鹤, 杨紫嫣,黄娟,等. 有抑菌能力乳杆菌的筛选及其抑菌物质的初步探究[J]. 中国微生态学杂志, 2019, 31(3): 285-290.
[13] MECHRI S, KRIAA M, MOUNA B E B, et al. Optimized production and characterization of a detergent-stable protease from Lysinibacillus fusiformis C250R[J]. International Journal of Biological Macromolecules, 2017, 101: 383-397.
[14] 刘旸, 陈敏, 庞昕, 等. 一株产胞外多糖的山药内生细菌Lysinibacillus fusiformis S-1的分离和鉴定[J]. 应用与环境生物学报, 2014, 20(3): 382-388.
[15] PRADHAN A K, PRADHAN N, SUKLA L B, et al. Inhibition of pathogenic bacterial biofilm by biosurfactant produced by Lysinibacillus fusiformis S9[J]. Bioprocess and Biosystems Engineering, 2014, 37(2): 139-149.
[16] PARK H B, KIM Y J, LEE J K, et al. Spirobacillenes A and B, unusual spiro-cyclopentenones from Lysinibacillus fusifornius KMC003[J]. Organic Letters, 2012, 14(19): 5 002-5 005.
[17] 曾承露, 李锋, 黄德娜. 纺锤形赖氨酸芽孢杆菌P-3产胞外多糖发酵工艺参数优化[J]. 中国酿造, 2017, 36(6): 111-115.
[18] 王伟高, 陈坚, 周景文. 赖氨酸芽孢杆菌产氨基甲酸乙酯水解酶的发酵条件优化[J]. 食品与生物技术学报, 2017,36(3): 259-265.
[19] 谌小立, 陈文莹,夏吉跃,等. 红酸汤烹调过程中全反式番茄红素含量变化规律研究[J]. 中国调味品, 2018, 43(2): 68-71.
[20] 段斌, 葛永红, 李灿婴, 等. 香菜精油的稳定性及其抑菌和抗氧化作用[J]. 食品与发酵工业, 2019,45(1): 145-151.