酵母絮凝是指酵母细胞间相互作用,从悬浮的培养基中快速沉降的现象[1]。这也是细胞抵御外界恶劣环境的一种表现形式[2-4]。絮凝表型分为Flo型和New Flo型[5]。Flo型絮凝表现在发酵的各个时期,会造成发酵时间延长,而New Flo型絮凝只有糖质量浓度<3 g/L时才能开始表达[6]。在啤酒发酵过程中,通常希望在发酵结束时,发酵液中分散的酵母细胞能相互聚集而沉淀,New Flo型酵母正是发酵工业所需要的,这对酵母细胞分离、回收再利用具有重要的作用[7-9]。
New Flo型基因表达的Lg-Flo1絮凝蛋白和Flo1絮凝蛋白相似,都是由N端、C端和中间重复序列3个结构域组成的细胞壁蛋白,这些蛋白的C端以共价键连接到细胞壁上,利用暴露的N端与相邻酵母细胞壁的甘露糖残基特异性结合导致絮凝[10-11]。除了甘露糖可以可逆地抑制这种表型外,Lg-Flo1蛋白还受多种糖的抑制,如葡糖糖、麦芽糖、麦芽三糖等[12]。GOOSSENS等[13]将Flo1絮凝蛋白的N端在毕赤酵母中的表达、纯化,产量是在酿酒酵母中表达的4倍,并且具有与甘露糖结合的活性。GROES等[14]将纯化出的Lg-Flo1蛋白结晶,进一步通过X-ray衍射分析确定了其糖结合区域。然而,国内尚未有关絮凝蛋白Lg-Flo1的克隆、表达及纯化的相关报道。
本研究将巴氏酵母的New Flo型基因Lg-FLO1的N端序列克隆到pET-28a(+)载体上,选择不同的诱导条件在大肠杆菌BL21(DE3)中异源表达,经纯化、复性后的Lg-Flo1蛋白表现出类似的甘露糖结合活性。为大规模制备絮凝蛋白并进一步探索其与不同低聚糖或糖蛋白的结合位点及空间结构,从而以此蛋白为配基制备功能性糖的特异性亲和吸附剂奠定了基础。
1 材料与方法
1.1 菌株和质粒
大肠杆菌BL21(DE3),本实验室保存;pETLF1重组表达质粒,由金唯智生物科技有限公司合成,连接pET-28a(+)质粒载体,转化至大肠杆菌JM109中保存。
1.2 培养基及主要试剂
LB培养基、TB培养基、质粒提取试剂盒、胶回收试剂盒、限制性内切酶BamH Ⅰ和Hind Ⅲ:TaKaRa公司;Ni-NTA Agarose:QIAGEN公司;过硫酸铵:阿拉丁;蛋白质Marker:BBI生命科学有限公司;丙烯酰胺/甲叉双丙烯酰胺30%溶液、尿素、乳糖、IPTG、卡那霉素、牛血清蛋白、考马斯亮蓝和咪唑:生工生物工程(上海)股份有限公司。
1.3 重组表达质粒的鉴定
质粒的提取参照试剂盒说明书进行,重组表达质粒用BamH Ⅰ和Hind Ⅲ酶切后,核酸电泳检测目的条带。
1.4 重组表达质粒的转化及阳性转化子筛选
将重组表达质粒pETLF1转化到大肠杆菌BL21(DE3)中,涂布含有Amp的LB平板,培养12 h,挑取单菌落。从目的基因上任意位置选择长度为252 bp的序列,用Primer Premier 5软件设计引物,菌落PCR筛选阳性转化子。大肠杆菌感受态细胞的制备及转化方法参考《分子生物学实验》执行[15]。
1.5 N-Lg-Flo1蛋白在大肠杆菌中的表达及SDS-PAGE分析
将BL21(DE3)(pETLF1)菌液在含有50 μg/mL卡那霉素的LB固体培养基上划线培养24 h,挑取单菌落接种于3 mL含有相同浓度卡那霉素的LB液体培养基中,37 ℃、200 r/min培养12 h,以1%的接种量接种于30 mL含有卡那霉素的LB培养基中, 37 ℃、200 r/min培养至对数生长期(OD600值0.6),在培养基中添加乳糖(终质量浓度为0.2 g/L),37 ℃、200 r/min 诱导8 h,取5 mL菌液,离心收集菌体,用3 mL、50 mmol/L Tris-HCl(pH 8.0)重悬菌体,超声波破碎菌体(350 W工作20 min,2 s/2 s)。将菌体破碎液进行SDS-PAGE分析,方法参照《生物化学实验》执行[16]。
1.6 诱导条件对N-Lg-Flo1蛋白表达的影响
1.6.1 诱导剂对N-Lg-Flo1蛋白表达的影响
将菌液以相同的接种量接种于30 mL含有卡那霉素的LB培养基中,分别采用终质量浓度为0.2 g/L的乳糖和0.2 mmol/L的IPTG作为诱导剂,37 ℃、200 r/min诱导8 h,以下方法均按照1.5所述方法获得菌体破碎液,进行SDS-PAGE分析。以乳糖诱导的BL21(DE3) (pET-28a(+))破碎液作为对照。
1.6.2 培养基对N-Lg-Flo1蛋白表达的影响
将菌液以相同的接种量分别接种于30 mL含有卡那霉素的LB和TB培养基中,乳糖为诱导剂,37 ℃、200 r/min诱导8 h,菌体超声破碎后进行SDS-PAGE分析。
1.6.3 诱导温度对N-Lg-Flo1蛋白表达的影响
将菌液以相同的接种量接种于30 mL含有卡那霉素的LB培养基中,乳糖为诱导剂,分别在25、28和37 ℃、200 r/min诱导8 h,菌体超声破碎后进行SDS-PAGE分析。
1.6.4 诱导时间对N-Lg-Flo1蛋白表达的影响
将菌液以相同的接种量接种于30 mL含有卡那霉素的LB培养基中,乳糖为诱导剂,37 ℃、200 r/min分别诱导2、4、6、8、10 h,菌体超声破碎后进行SDS-PAGE分析。
1.6.5 诱导剂用量对N-Lg-Flo1蛋白表达的影响
将菌液以相同的接种量接种于30 mL含有卡那霉素的LB培养基中,加入乳糖诱导,使乳糖终质量浓度分别为0.2、0.4、0.6、0.8和1 g/L,37 ℃、200 r/min诱导8 h,菌体超声破碎后进行SDS-PAGE分析。
1.7 包涵体N-Lg-Flo1蛋白的变性溶解、纯化及复性
将BL21(DE3)(pETLF1)在优化后的诱导条件下诱导表达,离心收集菌体,用50 mmol/L Tris-HCl(pH 8.0)洗涤菌体后重悬,超声波破碎,离心收集沉淀,得到重组蛋白包涵体。用洗涤缓冲液洗涤沉淀2次,再加入变性缓冲液,4 ℃搅拌5 h后,离心去除沉淀,上清为N-Lg-Flo1包涵体变性液。使用Ni-NTA琼脂糖凝胶亲和层析带有His-tag的N-Lg-Flo1蛋白,用咪唑浓度梯度洗脱目的蛋白,纯化步骤及溶液配制参照Ni-NTA琼脂糖凝胶产品说明书中包涵体蛋白的纯化。纯化的蛋白进行SDS-PAGE分析。蛋白的复性参照文献的方法执行[17-18]。
1.8 蛋白含量的测定
采用Q5000超微量核酸蛋白测定仪测定蛋白的紫外吸收值及质量浓度。
1.9 荧光光谱分析
通过荧光光谱测定N-Lg-Flo1蛋白与D-(+)-甘露糖的结合作用。设定激发波长为277 nm,在300~420 nm扫描发射波长,扫描速度为100 nm/min,激发和发射狭缝宽度均为5 nm[1],确定最大发射波长。初始样品为500 μL絮凝缓冲液(50 mmol/L醋酸钠,pH 6,100 mmol/L NaCl,7 mmol/L CaCl2)中含有2 μmol/L的N-Lg-Flo1蛋白,测定荧光信号强度。之后加入D-(+)-甘露糖,使终浓度为100 mmol/L,再次测定荧光信号强度。荧光强度变化如公式(1):
荧光强度变化%=
(1)
数据采用SPSS 17.0分析,重复3次实验取平均值,在图中以平均值±标准偏差表示,并进行单因素方差分析数据差异的显著性(P < 0.05)。
2 结果与分析
2.1 重组表达载体pETFL1的鉴定
将N-Lg-FLO1基因克隆到pET-28a(+)质粒载体上,构建了重组表达载体pETFL1,N-Lg-FLO1基因长度为642 bp,位于BamH Ⅰ (198) / Hind Ⅲ (173) 位点,pETFL1载体结构如图1所示。从菌株JM109(pETFL1) 提取质粒pETFL1,经BamH Ⅰ /Hind Ⅲ酶切鉴定,证实了重组质粒含有N-Lg-FLO1基因片段(图2)。
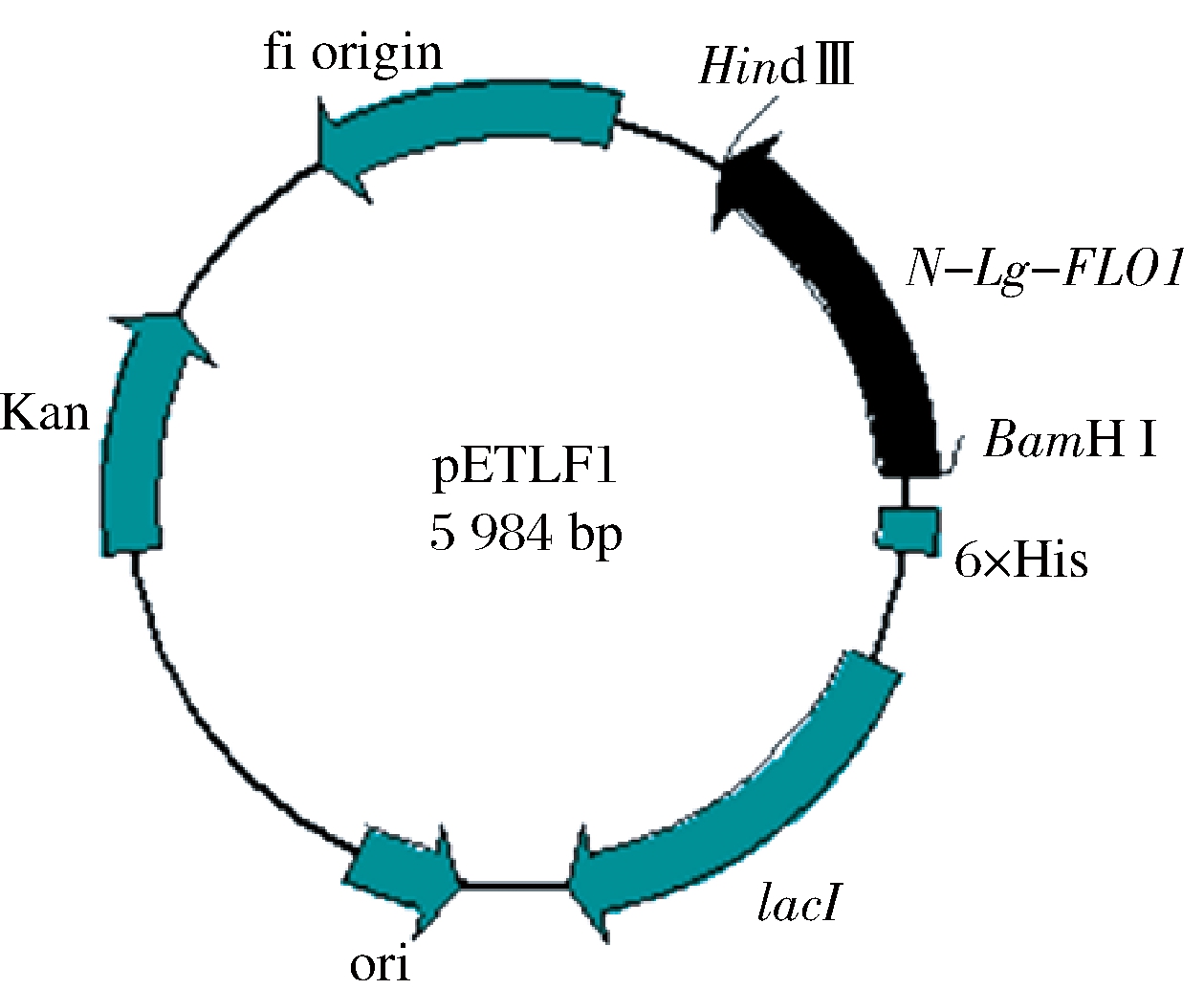
图1 pETLF1表达载体结构
Fig.1 The expression vector structure of pETLF1
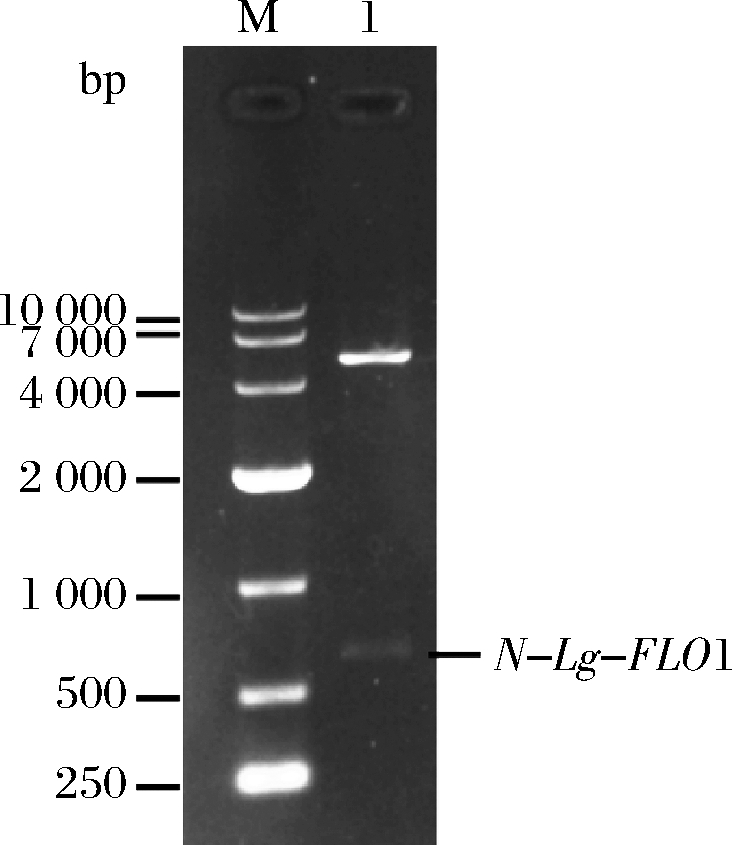
图2 pETLF1表达载体酶切鉴定
Fig.2 The identification of the expression vector pETLF1 by restriction endonucleases digestion
注:M-DNA marker;1-BamH Ⅰ/Hind Ⅲ酶切。
2.2 重组表达质粒的转化及阳性转化子检测
重组表达质粒pETLF1转化大肠杆菌BL21(DE3),涂布Amp平板,挑取单菌落,进行PCR检测,获得阳性转化子。PCR检测结果见图3,从电泳图中可以看到,从Amp平板上挑取的8个转化子均扩增出设计的含有252 bp的目的条带,均为阳性克隆。将其接种于含有Amp的LB液体培养基中,甘油保藏,用于目的蛋白的表达。
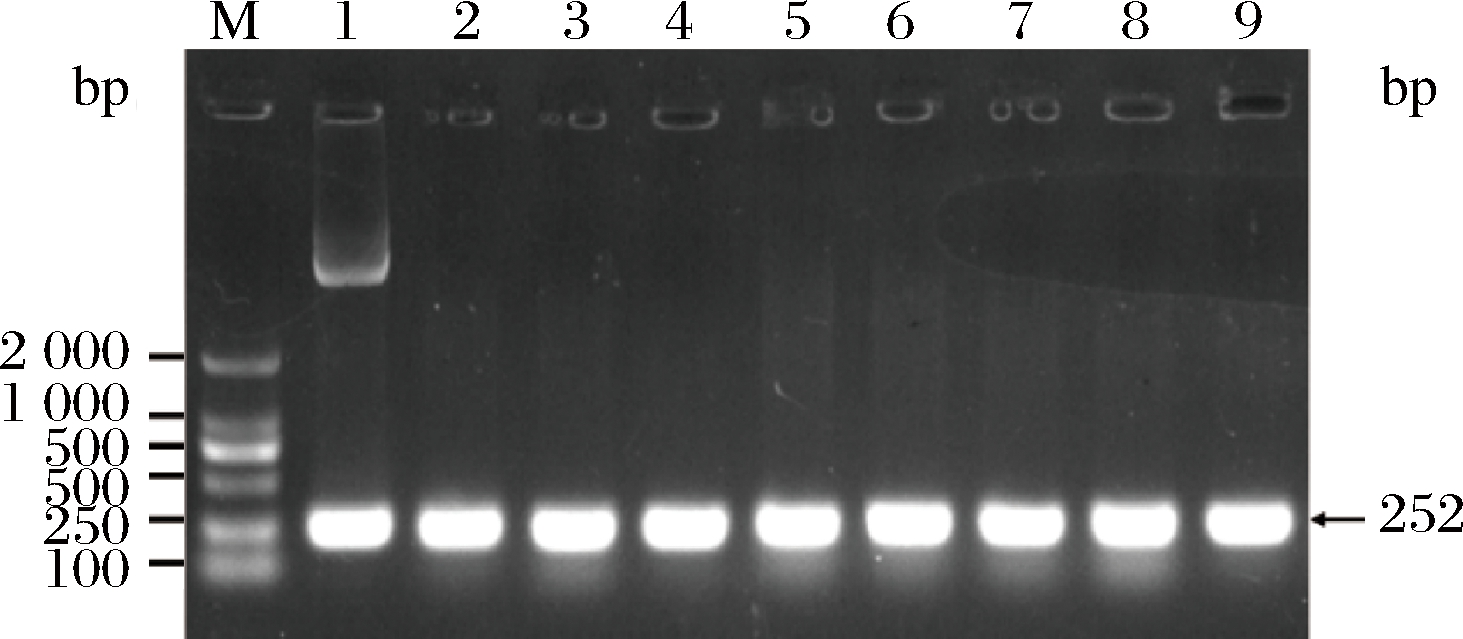
图3 阳性转化子检测电泳图
Fig.3 Electrophoresis of validation of positive transformant
注:M-DNA marker;1-阳性对照;2~9-转化子PCR检测条带。
2.3 诱导剂和培养基对N-Lg-Flo1蛋白表达的影响
分别使用IPTG和乳糖做诱导剂诱导重组大肠杆菌表达目的蛋白(图4-A),用Bio-Rad凝胶成像仪的Image Lab软件MW分析工具对目的蛋白分子质量分析,约为2.8 kDa,比实际预测的分子质量高出约0.4 kDa,因为表达了载体上的一些标签。通过Image Lab软件检测泳道和条带,在定量工具中选择每个泳道的目的蛋白条带为参考条带,分析得到目的蛋白条带百分比含量。结果表明,表达目的蛋白分别占总蛋白的30.7%和29.5%,表明使用IPTG和乳糖为诱导剂时表达的目的蛋白相对含量接近。IPTG不能被菌体利用,也不会产生复杂的代谢过程,被用作常规诱导剂广泛使用,但价格较高,且对菌体有毒害作用,因此限制了在大规模生产中的应用。而乳糖作为诱导剂参与代谢,需要乳糖透过酶的协助进入菌体内部,乳糖被转运至胞内后还需要经过β-半乳糖苷酶作用转化为异乳糖才能诱导Lac启动子,所以与IPTG相比,乳糖诱导过程更为复杂,但其经济、无毒,特别是在大肠杆菌基因工程菌大规模发酵中具备较大潜在价值[19]。
在LB和TB培养基中表达的结果如图4-B所示,TB培养基营养丰富,虽然表达后菌体浓度较大,总蛋白量高,但杂蛋白所占的比例较大,Image Lab软件分析结果表明目的蛋白只有19.3%,而在LB培养基中目的蛋白占30.3%,表达量较高。
2.4 诱导温度对N-Lg-Flo1蛋白表达的影响
分别在25、28 和37 ℃对目的蛋白进行诱导表达(图5),通过Image Lab软件分析得出,在37 ℃表达的目的蛋白占总蛋白的31.9%,而在25和28 ℃表达的目的蛋白仅占12.5%和16%。可见温度对目的蛋白的表达量影响较大,与许崇利[19]用pET-28c(+)载体在大肠杆菌BL21(DE3)中表达β2毒素的结果一致,推测pET-28系列载体的适合诱导表达温度为37 ℃。
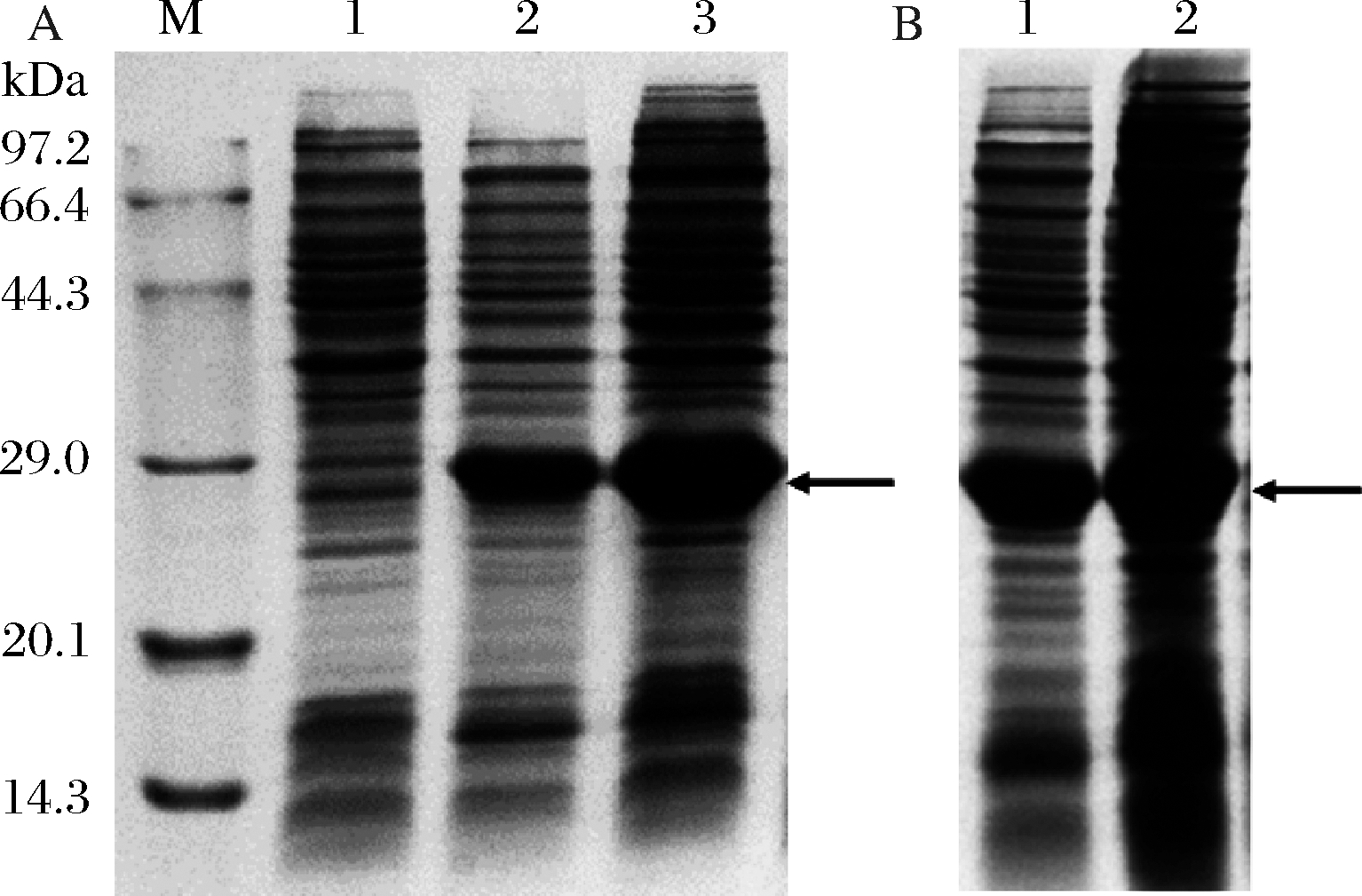
A-诱导剂对蛋白表达的影响;B-培养基对蛋白表达的影响
图4 不同诱导剂和培养基对N-Lg-Flo1蛋白表达的影响
Fig.4 Effects of different inducer and medium on expression of N-Lg-Flo1 protein
注:黑色箭头所指条带为目的蛋白;M-蛋白质Marker。下同。
图A中,1- BL21(DE3)(pET-28a(+))菌体裂解液;2~3- IPTG和
乳糖诱导的BL21(DE3)(pETLF1)菌体裂解液;图B中:1~2- BL21
(DE3)(pETLF1)在LB和TB培养基中的菌体裂解液。

图5 不同诱导温度对N-Lg-Flo1蛋白表达的影响
Fig.5 Effects of different induction temperature on
expression of N-Lg-Flo1 protein
注:1- 37 ℃培养BL21(DE3)(pET-28a(+))菌体裂解液;
2~4- 25、28和37 ℃诱导的BL21(DE3)(pETLF1)菌体裂解液。
2.5 诱导时间对N-Lg-Flo1蛋白表达的影响
诱导2 h,菌体浓度较低,目的蛋白还没有表达,随着诱导时间的增加,目的蛋白开始大量表达(图6),Image Lab软件分析表明,诱导6 h后,目的蛋白占总蛋白的比例相差不明显,在30%~33%。为了便于细胞破碎且节省成本,可以选择诱导时间为6 h。
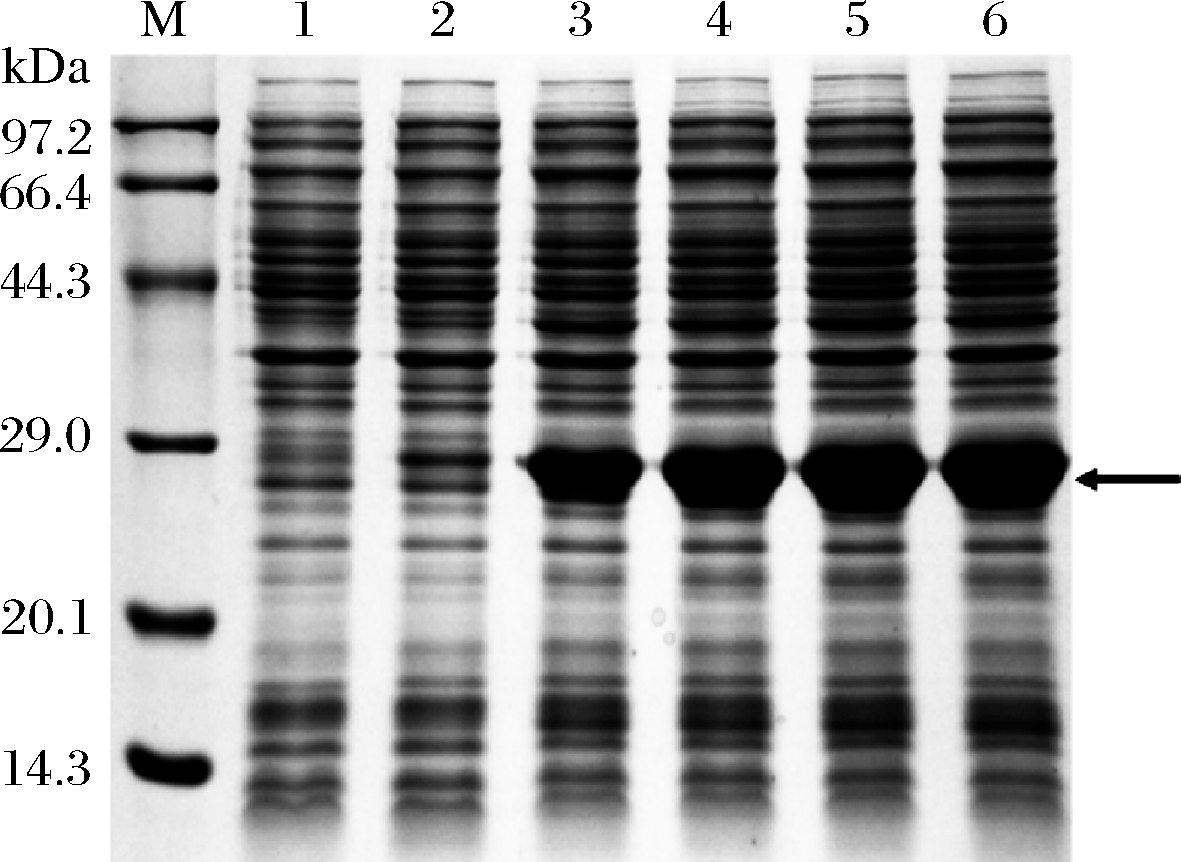
图6 不同诱导时间对N-Lg-Flo1蛋白表达的影响
Fig.6 Effects of different induction time on expression of N-Lg-Flo1 protein
注:1-BL21(DE3)(pET-28a(+))诱导8h的菌体裂解液;
2~6-BL21(DE3)(pETLF1)诱导2、4、6、8和
10 h的菌体裂解液。
2.6 乳糖加入量对N-Lg-Flo1蛋白表达的影响
诱导剂的加入量对菌体总蛋白量和目的蛋白的表达量影响不大(图7),Image Lab软件分析表明,目的蛋白所占的相对比例在30%~32%,相差很小,因此选择加入0.2 g/L的乳糖进行诱导,可以降低成本。
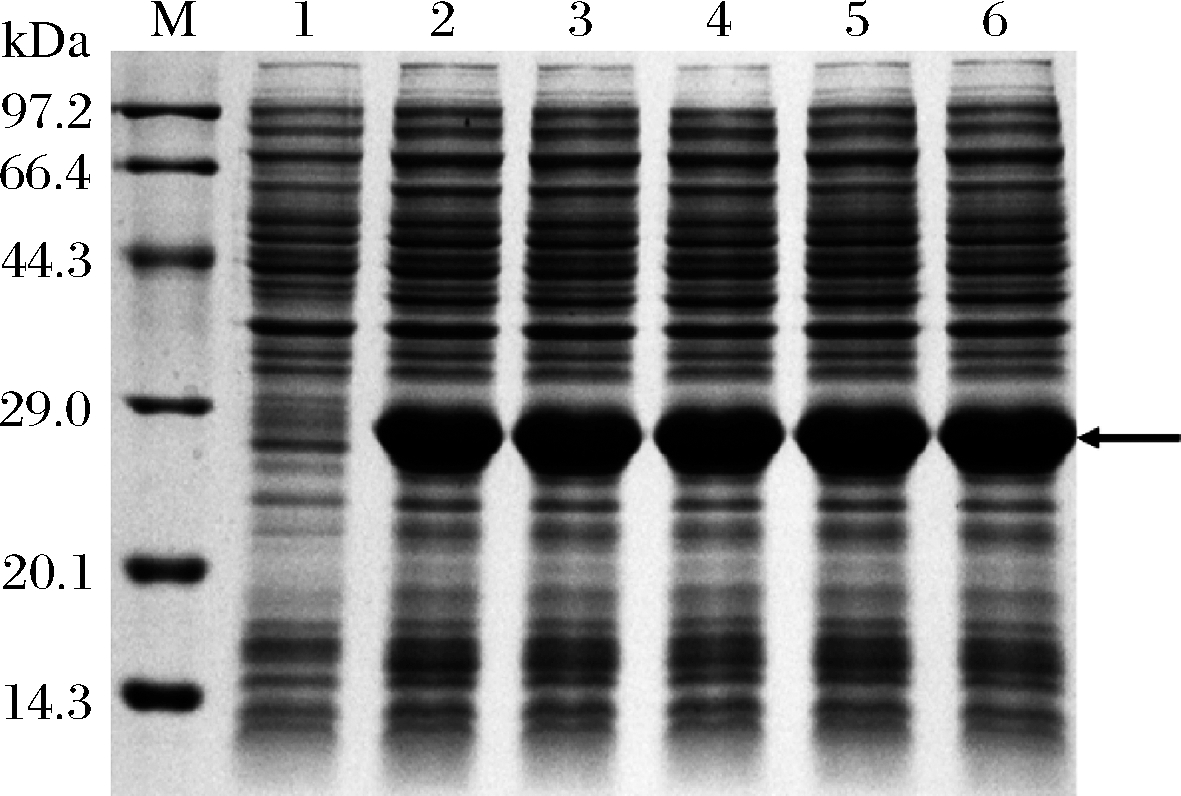
图7 乳糖加入量对N-Lg-Flo1蛋白表达的影响
Fig.7 Effects of different lactose concentrations
on expression of N-Lg-Flo1 protein
注:1-0.2 g/L乳糖诱导的BL21(DE3)(pET-28a(+))菌体裂解液;
2~6- 0.2、0.4、0.6、0.8和1 g/L乳糖诱导的BL21(DE3)(pETLF1)
菌体裂解液。
2.7 N-Lg-Flo1蛋白的纯化
利用pET-28a(+)表达载体上的His-tag的亲和性,用Ni-NTA琼脂糖凝胶亲和柱对表达的N-Lg-Flo1包涵体蛋白变性液进行分离纯化,洗脱曲线如图8所示,第1个洗脱峰为没有和亲和柱结合的杂蛋白峰,第2个洗脱峰为目的蛋白的洗脱峰,较为单一,150 mmol/L的咪唑可以将目的蛋白洗脱下来。将洗脱峰对应的洗脱液进行SDS-PAGE分析(图9),杂蛋白被大量除去,目的蛋白的纯度可以达到90%以上。通过Image Lab软件分析及超微量核酸蛋白测定仪测得的蛋白浓度,计算得到目的蛋白的回收率约为88%。
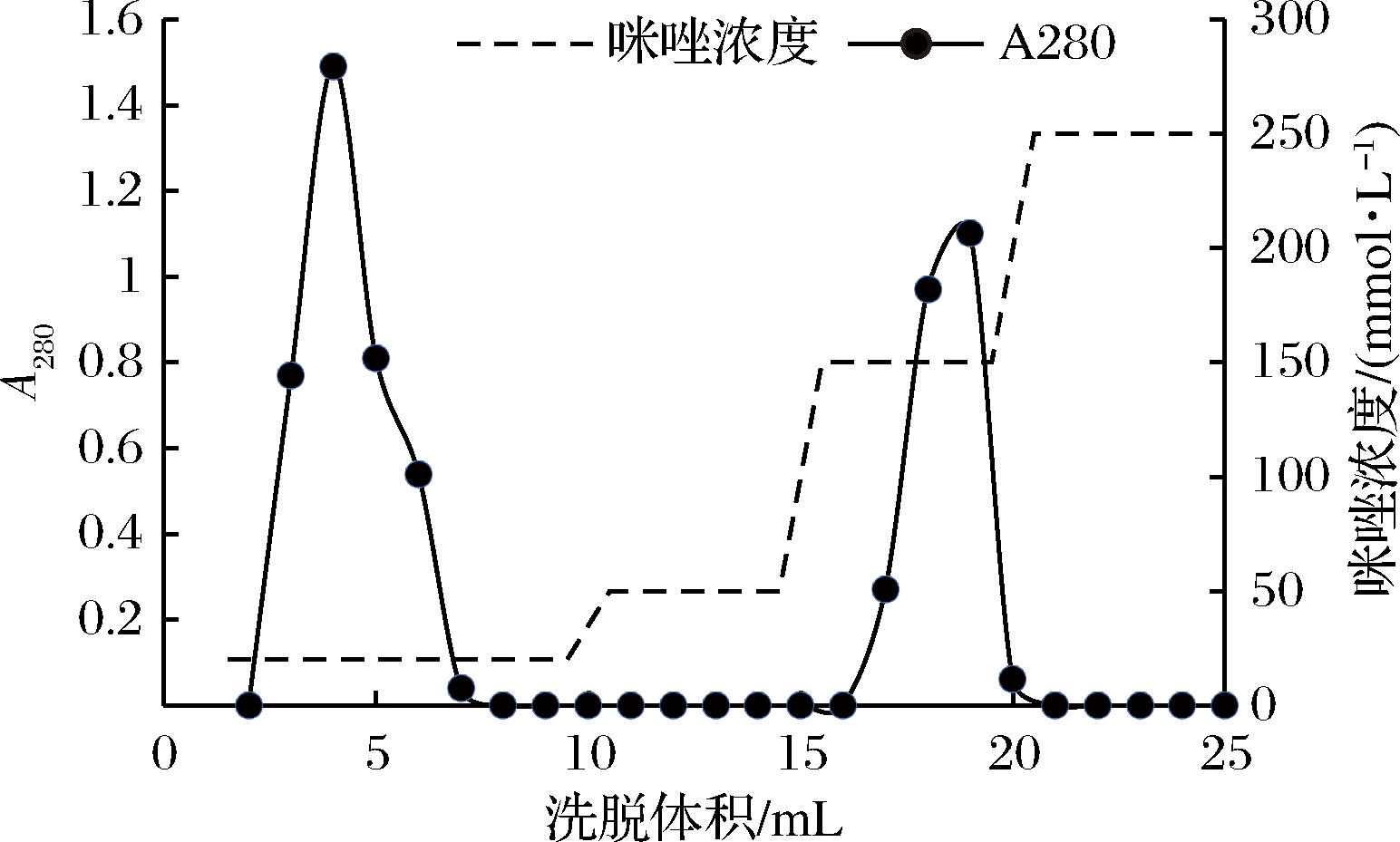
图8 N-Lg-Flo1蛋白亲和层析洗脱曲线
Fig.8 Affinity chromatography elution curve of N-Lg-Flo1 protein

图9 Ni-NTA亲和柱纯化后SDS-PAGE
Fig.9 SDS-PAGE of proteins purified by Ni-NTA affinity column
注:1- 包涵体蛋白变性溶解液;2~5- 杂蛋白;6~8- 目的蛋白
2.8 N-Lg-Flo1蛋白的甘露糖结合活性
通过荧光光谱测定N-Lg-Flo1蛋白与甘露糖的结合活性,通过对目的蛋白溶液的波长扫描,确定最大激发波长和最大发射波长分别为275 nm和336 nm,在此波长下,进行荧光强度的测定。如图10所示,添加100 mmol/L甘露糖的蛋白溶液和没有添加甘露糖的蛋白溶液相比,荧光淬灭,信号强度减弱了25%,表明N-Lg-Flo1蛋白存在与甘露糖的结合位点,结合部位的氨基酸可能为Trp、Phe或Tyr。KOBAYASHI等[20]的研究推测Flo1蛋白的第228位Trp是甘露糖的一个结合位点,而Lg-Flo1蛋白的228位被Leu取代,推测甘露糖结合位点可能为196位的Trp。
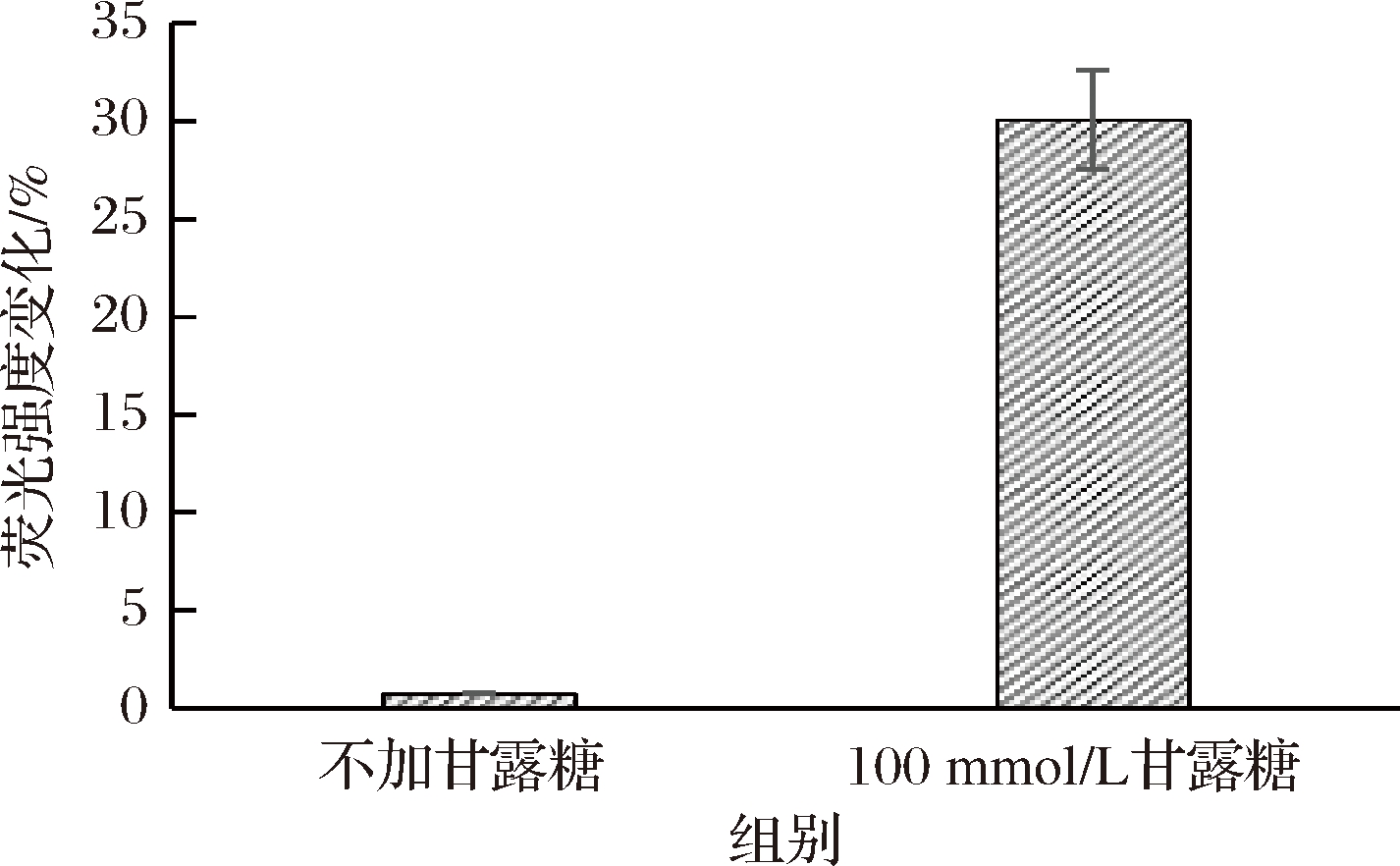
图10 N-Lg-Flo1蛋白与甘露糖结合荧光强度变化
Fig.10 Change in fluorescence intensity by the binding of D-(+)-mannose to N-Lg-Flo1 protein
3 结论
将巴氏酵母絮凝蛋白基因Lg-FLO1的N端序列克隆到pET-28a(+)载体上,构建了重组表达载体pETLF1,在大肠杆菌BL21(DE3)中表达。通过对菌体破碎液进行SDS-PAGE和Image Lab软件分析,确定了较优的诱导表达条件:在LB培养基中表达,乳糖作为诱导剂,乳糖终质量浓度0.2 g/L,诱导温度37 ℃,诱导时间6 h,目的蛋白的表达量均高于30%。该结果与其他使用乳糖作为诱导剂的科研人员的研究结果相似,采用乳糖诱导时,目标蛋白在总蛋白中所占比例与IPTG诱导相当,甚至酶的活性更高[19,21-22]。对包涵体目的蛋白变性溶解后,经Ni-NTA琼脂糖凝胶亲和柱分离纯化,目的蛋白的纯度可以达到90%以上,回收率约为88%。荧光光谱分析表明,复性后的目的蛋白与100 mmol/L的甘露糖作用,荧光信号强度减弱了25%,表明N-Lg-Flo1蛋白具有与甘露糖的结合活性。
[1] GOOSSENS K V Y, DE GREVE H, WILLAERT R G. Cloning, expression, and purification of the n-terminal domain of the flo1 flocculation protein from saccharomyces cerevisiae in pichia pastoris[J]. Protein Expression and Purification, 2013, 88(1), 114-119.
[2] IELAS I F S, GOYAL P, SLEUTEL M, et al. The mannose-specific lectin domains of Flo1p from Saccharomyces cerevisiae and Lg-Flo1p from S. pastorianus: Crystallization and preliminary X-ray diffraction analysis of the adhesin-carbohydrate complexes[J]. Acta Crystallographica Section F:Structural Biology and Crystallization Communications, 2013, 69(7):779-782.
[3] KEMP B, ALEXANDRE H, ROBILLARD B, et al. Effect of production phase on bottle-fermented sparkling wine quality[J]. Journal of Agricultural and Food Chemistry, 2015, 63(1):19-38.
[4] BORRULL A, POBLET M, ROZ S N. New insights into the capacity of commercial wine yeasts to grow on sparkling wine media. Factor screening for improving wine yeast selection[J]. Food Microbiology, 2015, 48:41-48.
S N. New insights into the capacity of commercial wine yeasts to grow on sparkling wine media. Factor screening for improving wine yeast selection[J]. Food Microbiology, 2015, 48:41-48.
[5] 刘楠, 王冬立,何秀萍,等. 酵母新絮凝特性的研究进展及应用展望[J]. 食品与发酵工业, 2007, 33(1):89-91.
[6] GOOSSENS K V, WILLAERT R G. Flocculation protein structure and cell-cell adhesion mechanism in Saccharomyces cerevisiae[J]. Biotechnol Lett, 2010, 32: 1 571-1 585.
[7] RADHAKRISHNAN A N P, MARQUES M P C, DAVIES M J, et al. Flocculation on a chip: A novel screening approach to determine floc growth rates and select flocculating agents[J]. Lab on a Chip, 2018, 18(4): 585-594.
[8] DIGIANVITO P, TESNI RE C, SUZZI G, et al. FLO5 gene controls flocculation phenotype and adhesive properties in a Saccharomyces cerevisiae sparkling wine strain[J]. Scientific Reports, 2017, 7(1): 10 786.
RE C, SUZZI G, et al. FLO5 gene controls flocculation phenotype and adhesive properties in a Saccharomyces cerevisiae sparkling wine strain[J]. Scientific Reports, 2017, 7(1): 10 786.
[9] 郭立芸, 谢鑫,梁云. 应用絮凝基因表达量分析技术评价酵母菌株的絮凝性[J]. 食品与发酵工业, 2018, 44(5): 70-75.
[10] STRATFORD M, ASSINDER S. Yeast flocculation: Flo1 and NewFlo phenotypes and receptor structure[J]. Yeast, 1991, 7(6):559-574.
[11] VEELDERS M, ![]() S, OTT D, et al. Structural basis of flocculin-mediated social behavior in yeast[J]. Proceedings of the national Academy of Scieuces,2010, 107(52): 22 511-22 516.
S, OTT D, et al. Structural basis of flocculin-mediated social behavior in yeast[J]. Proceedings of the national Academy of Scieuces,2010, 107(52): 22 511-22 516.
[12] SATO M, MAEBA H, WATARI J, et al. Analysis of an inactivated Lg-FLO1 gene present in bottom-fermenting yeast[J]. Journal of Bioscience and Bioengineering, 2002, 93(4): 395-398.
[13] GOOSSENS K V Y, WILLAERT R G. The n-terminal domain of the Flo11 protein from Saccharomyces cerevisiae is an adhesin without mannose-binding activity[J]. FEMS Yeast Research, 2011, 12(1): 78-87.
[14] GROES M, TEILUM K, OLESEN K, et al. Purification, crystallization and preliminary X-ray diffraction analysis of the carbohydrate-binding domain of flocculin, a cell-adhesion molecule from Saccharomyces carlsbergensis[J]. Acta Crystallographica, 2002, 58(12): 2 135-2 137.
[15] 汪天虹. 分子生物学实验[M]. 北京:北京大学出版社, 2016.
[16] 陈钧辉. 生物化学实验[M]. 北京:科学出版社, 2015.
[17] 王俊雄, 关怡新,姚善泾. 重组瑞替普酶包涵体制备及其体外复性[J]. 化工学报, 2015, 66(2):709-716.
[18] 郭帅, 陈梦仟,朱新术,等. 大肠杆菌表达的重组琼胶酶包涵体的纯化与复性条件研究[J]. 基因组学与应用生物学, 2018, 37(3):1 197-1 202.
[19] 许崇利. 乳糖诱导剂及培养条件对C型产气荚膜梭菌β2毒素基因表达影响[J]. 基因组学与应用生物学, 2015, 34(1):112-116.
[20] KOBAYASHI O, HAYASHI N, KUROKI R, et al. Region of Flo1 proteins responsible for sugar recognition[J]. Journal of Bacteriology, 1998, 180(24): 6 503-6 510.
[21] 朱运平, 江正强,李里特. 乳糖诱导极耐高温木聚糖酶基因B在大肠杆菌中的表达[J]. 食品与发酵工业, 2005, 31(4): 37-41.
[22] 汪明明, 杨瑞金,华霄,等. 乳糖诱导纤维二糖差向异构酶的表达及热处理纯化[J]. 食品与发酵工业, 2015, 41(3): 1-7.