抗菌肽是一种新型的生物防腐剂,易被人体消化水解[1],且具有无毒副作用、无污染、无残留、热稳定性强等优点[2]。目前研发的溶菌酶、乳酸链球菌素[3]等对革兰氏阳性菌具有明显抗菌性,已广泛应用于陆生动物食品中。但对革兰氏阴性致病菌占优势的海洋食品来说,相关报道较少[4]。
我国渔业资源丰富,近年来以海洋中上层鱼类为原料生产鱼罐头的产业不断壮大,在加工过程中产生大量的暗色肉,其富含丰富的蛋白质及碱性氨基酸[5],适合开发成抗菌肽。本文以鲣鱼暗色肉为原料,对其进行酶解优化[6],并对酶解产物粗肽进行分离纯化和抑菌活性测定,以期获得一种具有产业化前景、抑制海洋食品中革兰氏阴性致病菌的抗菌肽,为海洋中上层鱼类暗色肉的精深加工利用提供理论依据。
1 材料与方法
1.1 材料与仪器
鲜冻鲣鱼(Katsuwonus pelamis),市售;金黄色葡萄球菌(Staphylococcus aureus)ATCC25923、大肠杆菌(Escherichia coli)ATCC25922、枯草芽孢杆菌(Bacillus subtilis)、希瓦氏菌(Shewanella),南京茂捷微生物科技有限公司;碱性蛋白酶(地衣芽胞杆菌产)、胰蛋白酶、中性蛋白酶(枯草芽孢杆菌产)、木瓜蛋白酶、酸性蛋白酶(黑曲霉产)、胃蛋白酶,广西南宁庞博生物工程有限公司;MH肉汤培养基、LB培养基,杭州微生物科技有限公司;牛血清白蛋白,生工生物工程股份有限公司;干酪素,上海麦克林生化科技有限公司;酪氨酸,中国食品药品检定研究院;福林酚,上海国药试剂集团;NaCl(分析纯)、磷酸盐缓冲液(PBS)、NaOH(分析纯)、HCl(分析纯);HiPrep 16/60 Sephacryl S-100 High Resolution,通用电气GE医疗集团生命科学部。
UV-1800PC型紫外可见分光光度计,上海翱艺仪器有限公司;超滤离心管,上海雷布斯科技有限公司;麦氏比浊管,上海艾研生物科技有限公司;THZ-100型恒温摇床、DHP-9012B型电热恒温培养箱、SW-CJ-2F型超净工作台、XR1台式高速冷冻离心机,上海一恒科学仪器有限公司;雷磁PHS-3G pH计,梅特勒-托利多仪器(上海)有限公司;L-8900高效氨基酸自动分析仪,上海天齐生物科技有限公司;MK3型酶标仪,上海实维实验仪器有限公司;AKTA avent 150 蛋白质分离纯化系统,通用电气GE医疗集团生命科学部。
1.2 实验方法
1.2.1 原料预处理
取鲜冻鲣鱼,置于20 ℃条件下自然解冻,解冻完成后去除其内脏、头后蒸熟,挑选鱼背部颜色较深的肉即为暗色肉,将暗色肉置于-40 ℃的超低温冰箱中冻藏。
1.2.2 酶解方法
取100 g解冻后的蒸熟的鲣鱼暗色肉于烧杯中,加入蒸馏水,调pH值,置于恒温水浴锅中保温,加酶水解6 h。不同种类蛋白酶统一加酶量4 000 U/g,暗色肉和蒸馏水的料液比1∶5(g∶mL),酶解温度、pH条件如表1所示。酶解结束后,在沸水浴中灭酶10 min,冷却,10 000 r/min低温离心10 min,取上清液于4 ℃冰箱冷藏备用,用于测定水解度和抑菌率。
表1 各类酶的酶解条件
Table 1 Enzymolysis conditions for various enzymes
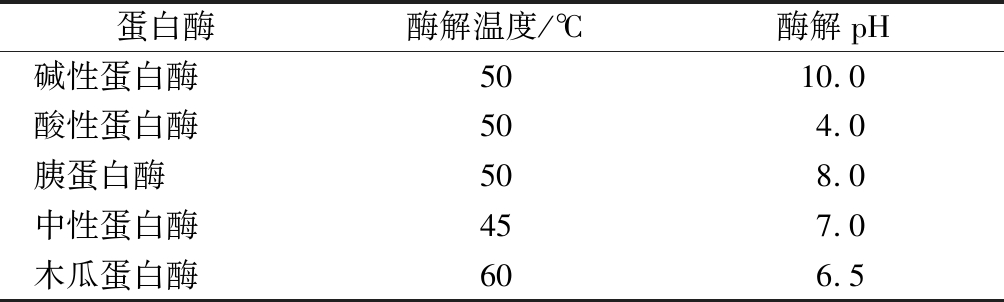
蛋白酶酶解温度/℃酶解pH碱性蛋白酶5010.0酸性蛋白酶504.0胰蛋白酶508.0中性蛋白酶457.0木瓜蛋白酶606.5
1.2.3 单因素试验
按照1.2.2方法制备鲣鱼暗色肉抗菌肽。以肽浓度和对大肠杆菌和金黄色葡萄球菌的抑菌率为指标,选择抑菌对象,从碱性蛋白酶、酸性蛋白酶、胰蛋白酶、中性蛋白酶、木瓜蛋白酶中选择合适的蛋白酶及抑菌对象。以抑菌率为指标,考察料液比(1∶4、1∶5、1∶6、1∶7、1∶8、1∶9,g∶mL),酸性蛋白酶酶解pH(2.5、3.0、3.5、4.0、4.5、5.0)、酶解温度(35、40、45、50、55、60 ℃)、加酶量(2 000、3 000、4 000、5 000、6 000、7 000 U/g)以及酶解时间(1、2、3、4、5、6 h)对酶解产物对大肠杆菌抑菌率的影响,确定各个酶解条件的最适值。
1.2.4 Box-Behnken实验设计
进行4因素3水平的Box-Behnken中心组合设计试验。选取对大肠杆菌的抑菌率作为响应值,优化酶解条件。响应面因素编码及水平见表2。
表2 响应面试验因素与水平
Table 2 Response surface experiment factors and levels

水平因素pH(A)加酶量(B)u/g时间(C)/h温度(D)/℃-14.002 00024504.503 00035015.004 000455
1.2.5 可溶性肽的测定
采用三氯乙酸沉淀结合Folin-酚法测定可溶性肽[7]。取5 mL酶解液于离心管中,加入5 mL 100 g/L三氯乙酸(trichloroacetic acid solution, TCA)溶液,静置20 min,10 000 r/min离心10 min,取1 mL稀释一定倍数的上清液(定量范围为5~100 μg蛋白质),加入5 mL碱性铜溶液,摇匀,常温下静置10 min,加入0.5 mL Folin试剂并迅速混匀,显色反应,在30 ℃水浴锅中放置30 min,测定650 nm处吸光值。以牛血清白蛋白为标准品,制作标准曲线,从标准曲线求出肽得率。
可溶性肽得率![]()
(1)
Folin-酚试剂A:碱性铜溶液;甲液:取2 g Na2CO3,溶于100 mL 0.1 mol/L NaOH溶液中;乙液:取0.5 g CuSO4·5H2O晶体,溶于100 mL 1%酒石酸钾中。临用时按V(甲液)∶V(乙液)=50∶1混合使用。
1.2.6 抑菌活性的测定
将制备好的酶解液进行过滤除菌(0.22 μm水相微孔滤膜)后[8-9],取100 μL酶解液至96孔酶标板中,加入100 μL无菌生理盐水,作为空白组;100 μL酶解产物液加入96孔酶标板中,再加入100 μL用LB培养基稀释为1.0×105 CFU/mL的大肠杆菌菌悬液[12],作为试验组;在96孔酶板上加入100 μL无菌生理盐水,加入用LB培养基稀释为1.0×105 CFU/mL的100 μL菌悬液,作为对照组。分别将空白组、试验组、对照组置于37 ℃恒温培养箱中培养12 h,用酶标法测定620 nm下的吸收率。水解液的抑菌率按公式(2)计算[10]:
抑菌率/%=
(2)
1.2.7 超滤
根据响应面优化得到的粗肽冻干样品,配制成质量浓度为5 mg/mL的样液。采用截留分子量分别为5、10 kDa的超滤膜对样液进行超滤离心初步分离。超滤条件为[11]:温度25 ℃、转速4 000 r/min、离心时间30 min。收集滤液,冷冻干燥,备用。
1.2.8 凝胶色谱层析-Sephacryl S-100 HR分离纯化
称取冻干的样品200 mg,于10 mL 0.05 mol/L Na3PO4、0.15 mol/L NaCl、pH 7.0的缓冲液中溶解,配制溶液质量浓度为10 mg/mL,通过0.22 μm过滤器过滤。其余的工作液也需通过0.22 μm过滤器过滤。先用0.15 mol/L NaCl、pH 7.0、0.05 mol/L Na3PO4的缓冲液对Sephacryl S-100 HR凝胶柱进行平衡,设压力最大值为0.15 MPa,紫外值归0,流速设为0.5 mL/min,平衡2个柱体积直至紫外吸收值趋于平稳,待平衡后上样。进样条件为:上样量1mL,流速0.5 mL/min,压力最大值0.15 MPa,紫外波长280 nm。将有吸收峰的馏分进行收集,冷冻干燥,备用。
1.2.9 最小抑菌浓度的测定(minimum ihibitory concentration,MIC)
采用微量二倍稀释法[12-13]测定暗色肉抗菌肽对革兰氏阳性菌枯草芽孢杆菌、金黄色葡萄球菌和革兰氏阴性菌大肠杆菌、希瓦氏菌的最小抑菌浓度。通过麦氏比浊法取处于对数生长期的致病菌,用MH肉汤培养基将菌液稀释至105 CFU/mL。将灭好菌的酶标板的每个孔中加入100 μL MH肉汤培养基,在第1孔中加入质量浓度为320 μg/mL抗菌肽溶液100 μL,然后对抗菌肽溶液进行二倍稀释。即,第一孔中加入抗菌肽液后用移液枪反复吹打4次使之与肉汤充分混匀,然后吸取100 μL至第二孔中再充分吹打混匀,重复至最后一孔,从第8列吸出100 μL弃掉。使抗菌肽溶液质量浓度依次调节为:320、160、80、40、20、10、5、2.5 μg/mL,共做3次平行。接着在一排孔中再加入100 μL MH肉汤培养基,作为阴性对照。在另一排孔中加入100 μL菌液作为阳性对照。将希瓦氏菌的酶标板放入28 ℃的恒温箱,其余放入37 ℃的恒温箱中培养放置12 h后,观察结果。若有菌生长,孔板底部会出现白色沉淀。MIC值的判定:96孔板横排中未有沉淀的最后一孔所对应的浓度为该抗菌肽液的MIC值。
1.3 数据分析
利用SAS数据处理软件进行差异性分析,其中P<0.05 差异显著,P<0.01 差异极显著;用Excel 2003软件进行数据处理及绘图,每次试验设计3~5个平行,结果用平均值±标准差来表示。采用Design-expert 8. 0软件进行响应面试验设计与分析。
2 结果与分析
2.1 酶的筛选
2.1.1 不同蛋白酶酶解液抑菌率分析
如图1、2所示,随着酶解时间的进行,酸性蛋白酶对大肠杆菌和金黄色葡萄球菌的最大抑菌率分别达到(66.18±1.44)%和(52.33±1.13)%,经单因素差异性分析,酸性蛋白酶酶解液对大肠杆菌抑菌率显著大于其他蛋白酶(P<0.05)。胰蛋白酶和木瓜蛋白酶的抑菌效果最差,木瓜蛋白酶的酶解产物在初期阶段几乎没有抑菌活性。施永清等[14]通过酶解制备鱼鳞抗菌肽时,酸性蛋白酶和碱性蛋白酶的酶解产物对大肠杆菌的抑菌效果较好。吴林泽等[15]用碱性蛋白酶酶解罗非鱼下脚料,以金黄色葡萄球菌为指示菌,获得的粗肽具有很好抑菌性。各个蛋白酶在不同酶解时间段得到的酶解产物对大肠杆菌和金黄色葡萄球菌的抑菌效果均有所不同[11],可能与蛋白酶的特异性有关[16-17],中性蛋白酶[18]、酸性蛋白酶[19]以及碱性蛋白酶[20]的酶切作用范围广,主要作用于C-端的某些疏水性氨基酸残基,导致疏水性基团暴露,蛋白质结构松散,易被水解,暴露出具有抑菌活性的氨基酸序列,获得更多活性多肽,而木瓜蛋白酶[21]和胰蛋白酶[22]主要作用于蛋白质N-端的亲水性氨基酸(Arg-、Lys-)残基,蛋白质结构紧密,水解不完全,无法获得较多的活性肽[23]。因此本实验选取酸性蛋白酶制备抗菌肽。
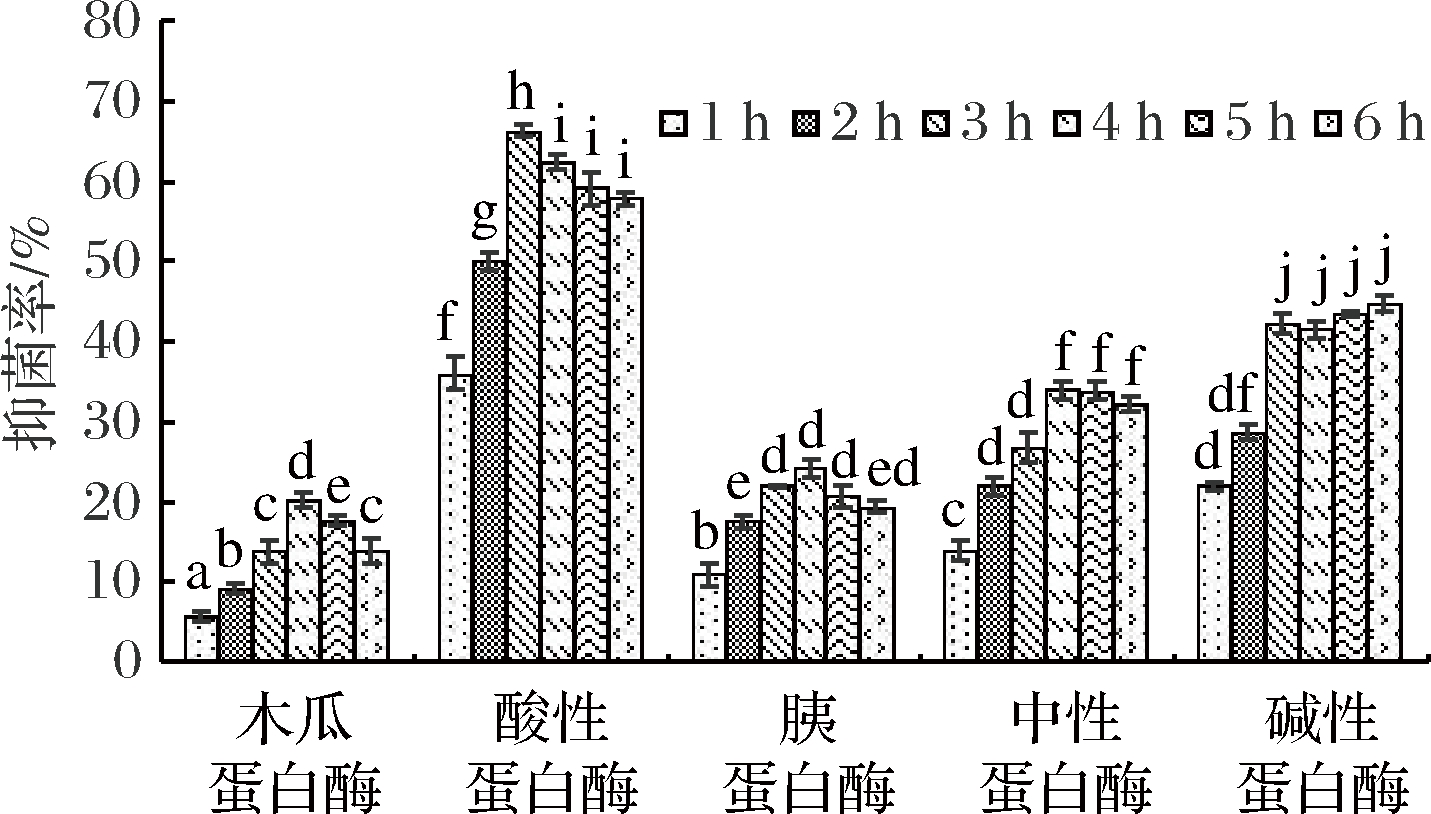
图1 各类蛋白酶酶解液对大肠杆菌的抑菌率
Fig.1 Antibacterial rate of various protease hydrolysates on Escherichia coli
注:不同小写字母表示差异显著(P<0.05),下同。

图2 各类蛋白酶酶解液对金黄色葡萄球菌的抑菌率
Fig.2 Antibacterial rate of various protease hydrolysates on Staphylococcus aureus
2.1.2 不同蛋白酶酶解液肽得率分析
肽得率反映底物经蛋白酶水解得到的可溶性多肽占总蛋白的比例。得率越高表明获得的可溶性多肽越多,经济效益也就越高。由图3可知,5种蛋白酶水解液中肽得率总体上均随反应时间的延长先上升后趋于平缓,原因可能是酶解反应初期,蛋白酶作用的蛋白质酶切位点比较多,随后快速水解,短时间内暗色肉蛋白质上的肽键被大量切断[24],释放出较多的可溶性肽及少数的游离氨基酸到溶液中,随后待水解的底物减少,使肽得率趋于稳定[25]。在整个水解过程中,多肽的产率由大到小依次为中性蛋白酶、碱性蛋白酶、酸性蛋白酶、胰蛋白酶和木瓜蛋白酶。通过单因素差异性比较分析,肽得率较高的中性蛋白酶显著高于其他种类蛋白酶(P<0.05)。
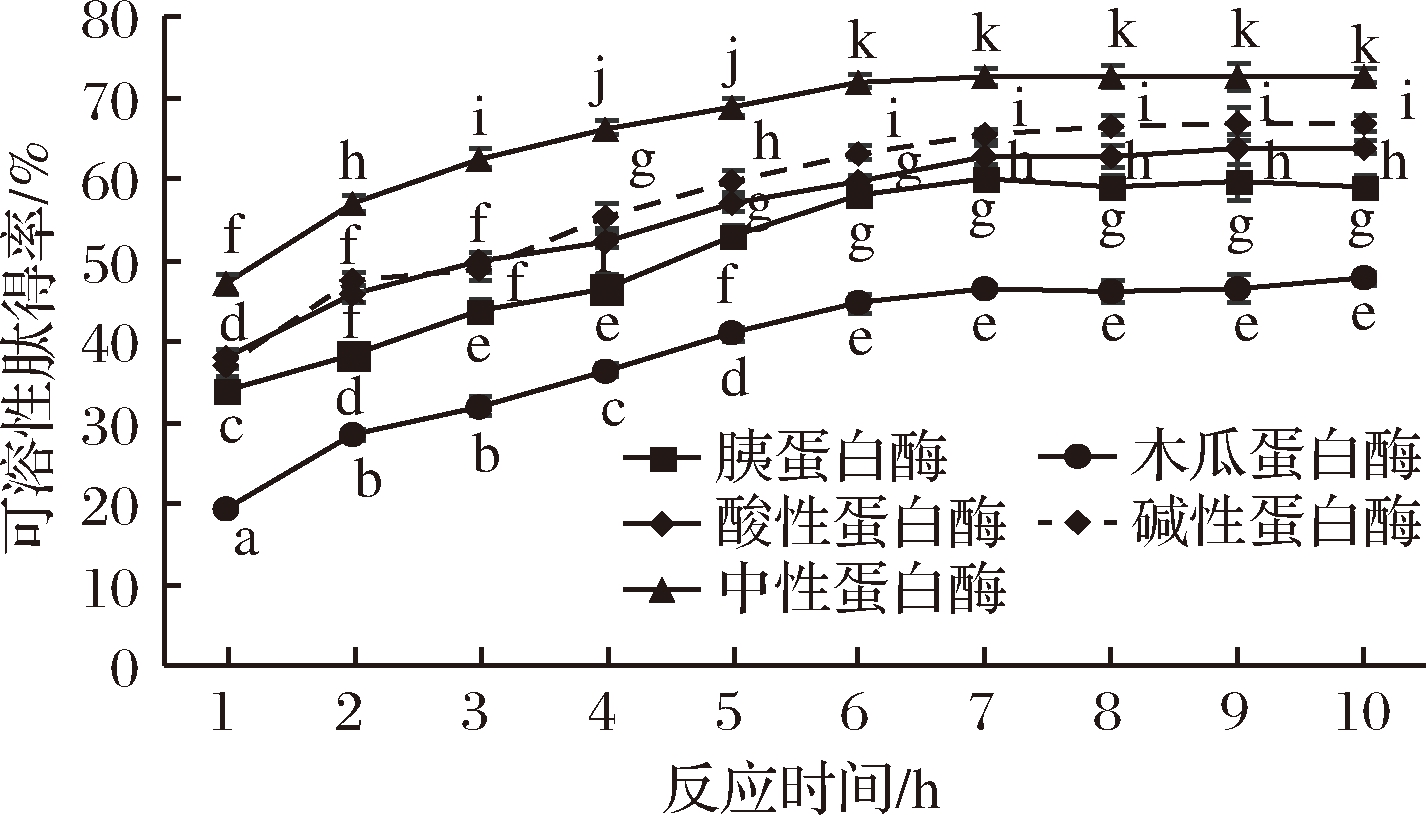
图3 各类蛋白酶酶解鲣鱼暗色肉过程中可溶性肽得率
Fig.3 The yield of soluble peptide in the process of enzymatic hydrolysis of squid dark meat by various proteases
从可溶性肽得率和抑菌率综合考虑,选取酸性蛋白酶制备抗菌肽并以大肠杆菌为指示菌进行下一步的响应面优化试验。
2.2 鲣鱼暗色肉酸性蛋白酶水解单因素试验
2.2.1 料液比对抑菌活性的影响
在酸性蛋白酶酶解时间3 h、加酶量4 000 U/g、酶解温度50 ℃、酶解pH 4.0的条件下,料液比对抑菌活性的影响如图4所示。
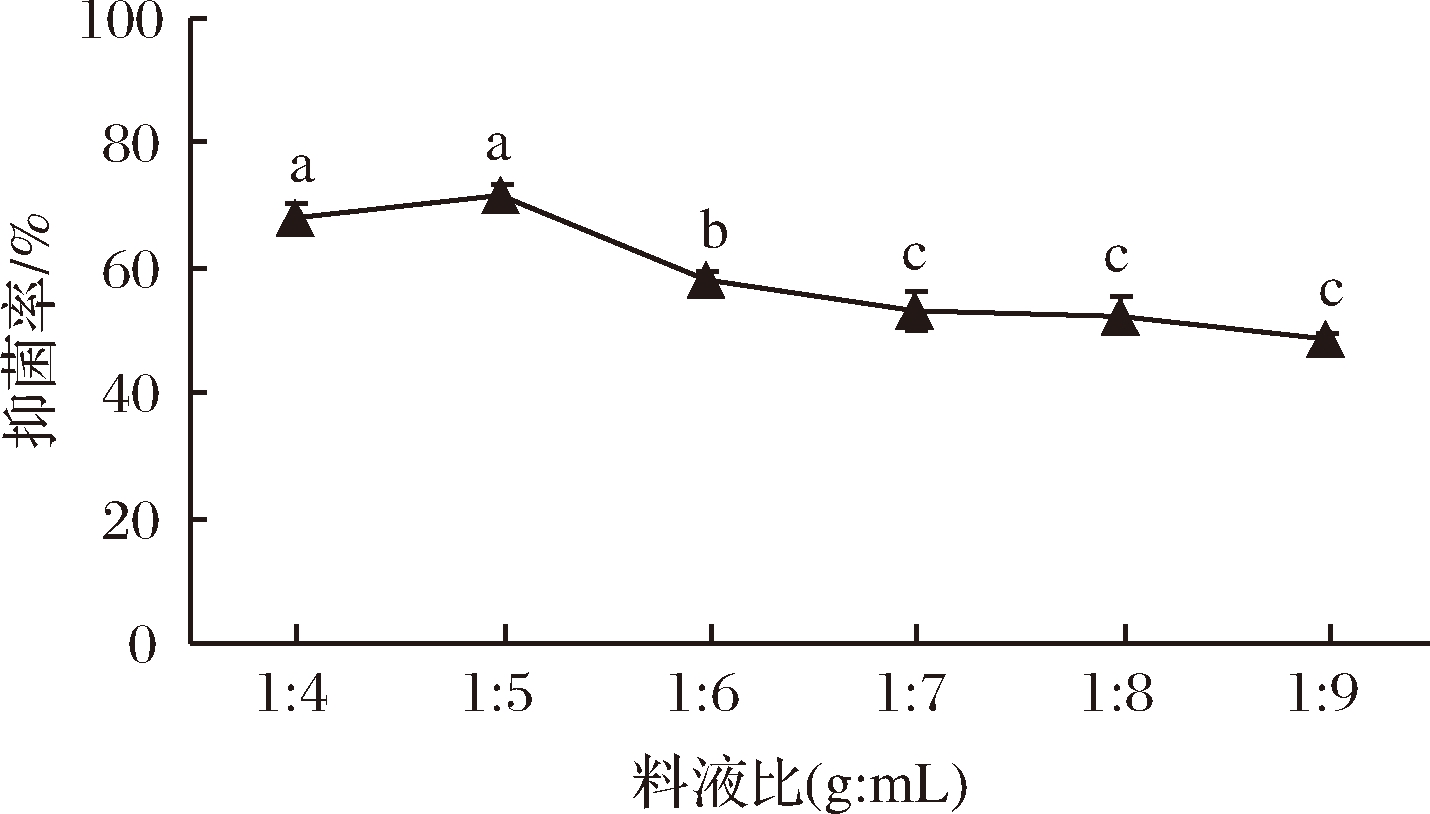
图4 料液比对抑菌效果的影响
Fig.4 Effect of liquid-liquid ratio on antibacterial effect
料液比在1∶4~1∶9(g∶mL)区间,随着蒸馏水体积的增加,酶解液中暗色肉比例降低,酶解产物的抑菌活性整体呈下降趋势,在1∶5~1∶4(g∶mL)区间,酶解产物的抑菌活性有所增加,但差异性不显著(P>0.05)。可能是暗色肉比例越高,酶解效果越好,得到有抑菌活性的多肽数量越多。但随着暗色肉比例继续增加,与暗色肉结合的酶添加量一定,导致酶解效率达到极限,造成抑菌效果上升不显著(P>0.05),且暗色肉比例增多反而会影响蛋白酶与其的结合[26],因此试验确定最适暗色肉比蒸馏水的料液比为1∶5(g∶mL)。
2.2.2 pH值对抑菌活性的影响
在酸性蛋白酶酶解时间3 h、加酶量4 000 U/g、酶解温度50 ℃、料液比为1∶5(g∶mL)的条件下,pH对抑菌活性的影响如图5所示,随着pH值的增加,对致病菌的抑菌效果呈先上升后下降的趋势,在pH值为4.5时抑菌率达到最大值。可能是酶解pH低于酸性蛋白酶的最适pH值时,随着pH值的升高,酶活性也逐渐升高,得到的抗菌肽片段随之增加[27],从而抑菌率升高,但高于最适pH时,酶的活性降低,进而影响酶解液的抑菌效果。根据单因素差异性分析,确定酸性蛋白酶酶解pH 4、4.5、5作为响应面试验水平。
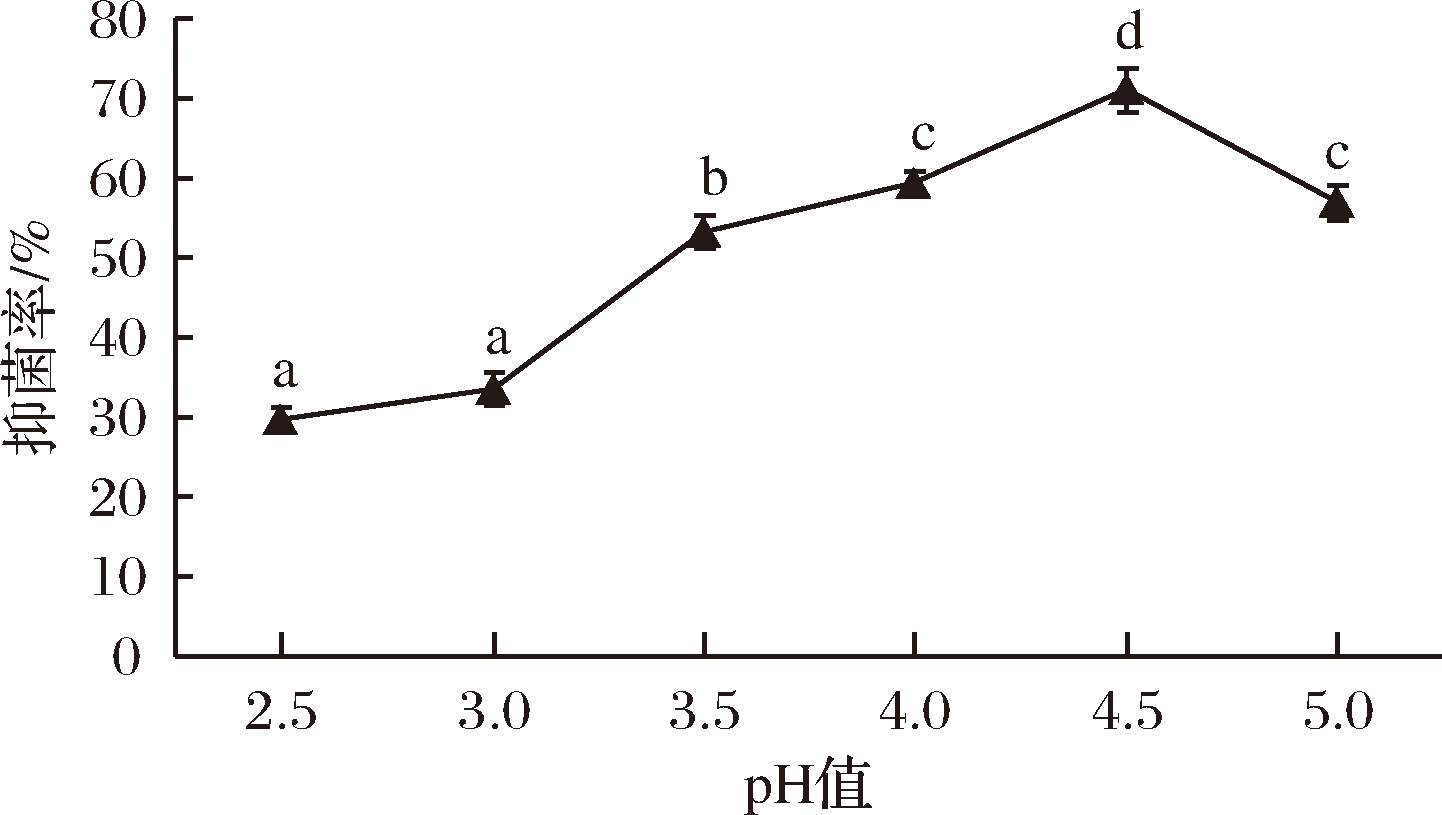
图5 pH对抑菌效果的影响
Fig.5 Effect of pH on bacteriostatic effect
2.2.3 加酶量对抑菌活性的影响
在酸性蛋白酶酶解时间3 h、酶解pH 4.0、酶解温度50 ℃、料液比为1∶5(g∶mL)的条件下,加酶量对抑菌活性的影响由图6所示。
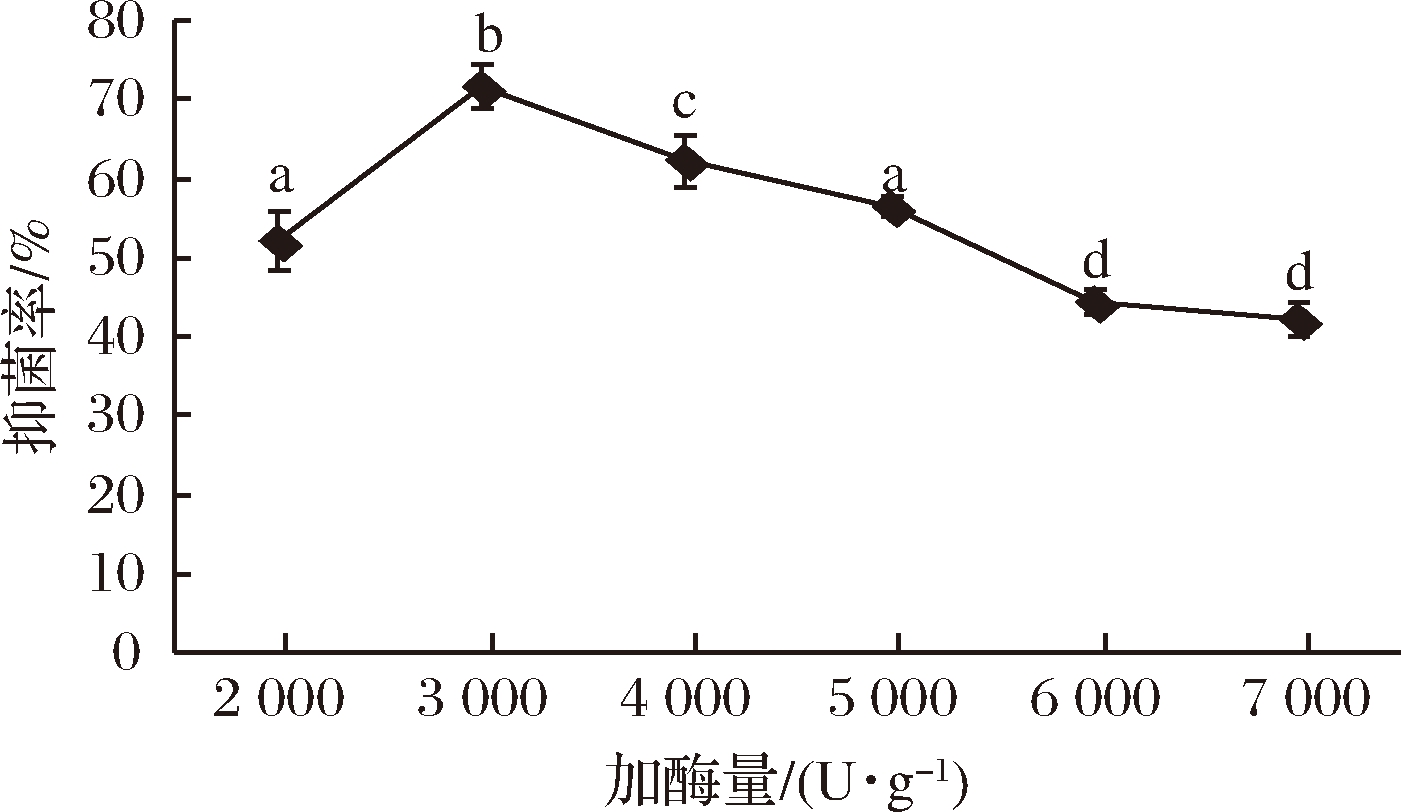
图6 加酶量对抑菌效果的影响
Fig.6 Effect of enzyme dosage on antibacterial effect
随着加酶量的增多,对大肠杆菌的抑菌效果呈先上升后下降的趋势,加酶量在3 000 U/g时抑菌活性最大。原因可能是加酶量在2 000~3 000 U/g时,随着酶数量的增加,酶解效果越好,得到的能够有效抑菌的酶解产物越多。当加酶量达到一定值时,过多的酶将具有抑菌作用的肽片段进一步水解成没有抑菌活性的更小片段,进而使酶解液抑菌率降低。根据单因素差异性分析,确定最适加酶量2 000、3 000、4 000 U/g作为响应面试验水平。
2.2.4 酶解时间对抑菌活性的影响
在酸性蛋白酶酶解pH 4.0、加酶量4 000 U/g、酶解温度50 ℃、料液比为1∶5(g∶mL)的条件下,酶解时间对抑菌活性的影响如图7所示,随着酶解时间的进行,对大肠杆菌的抑菌率呈先上升后逐渐下降,然后趋于稳定的趋势。可能在酶解前期,酸性蛋白酶能够快速水解底物得到大量具有抗菌性的酶解产物,所以酶解液的抑菌率不断上升,但随着酶解的继续进行,具有抑菌活性的肽片段被蛋白酶进一步水解,成为无抑菌活性或更小抑菌活性的肽片段,所以在酶解后期,酶解液抑菌率逐渐降低。为选择最适的酶解时间,选择酶解时间2、3、4 h作为响应面试验水平。
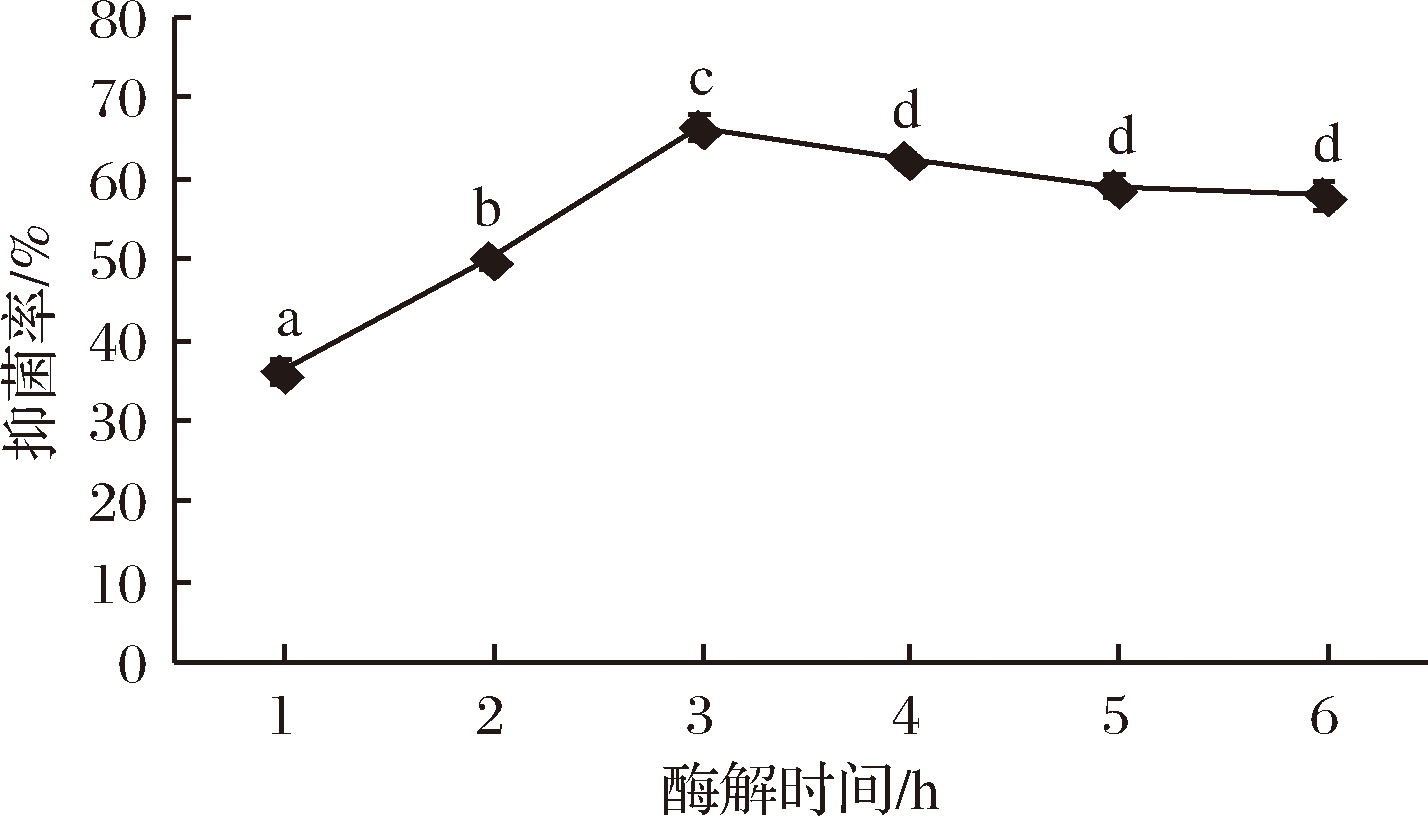
图7 酶解时间对抑菌效果的影响
Fig.7 Effect of enzymatic hydrolysis time on bacteriostatic effect
2.2.5 酶解温度对抑菌活性的影响
在酸性蛋白酶酶解pH 4.0、加酶量4 000 U/g、酶解3 h、料液比为1∶5(g∶mL)的条件下,酶解温度对抑菌活性的影响如图8所示。

图8 酶解温度对抑菌效果的影响
Fig.8 Effect of enzymatic hydrolysis temperature on antibacterial effect
随着酶解温度的升高,对大肠杆菌的抑菌效果先上升后下降,温度为50 ℃时,抑菌率最高,可能是蛋白酶的最适温度为50 ℃,当酶解温度低于50 ℃时,随着温度的升高,酶活性随之升高,酶解效率升高,酶解产物增多,酶解液抑菌率增加,但当酶解温度高于最适温度50 ℃时,蛋白酶的活性受到抑制,随着温度的继续增加,蛋白酶甚至变性失活,导致酶解效率低,酶解液抗菌活性也随之降低。因此选择酶解温度45、50、55 ℃作为响应面试验水平。
2.2.6 响应面优化酶解条件
为研究酶解条件和抑菌率之间的关系,优化获得最佳酶解条件,根据Box-Benhnken模型的中心组合试验设计原理,在单因素的试验基础上,进行4因素的响应面试验,响应面试验结果见表3。
表3 Box-Benhnken试验设计方案及响应值
Table 3 Box-Benhnken test design and response
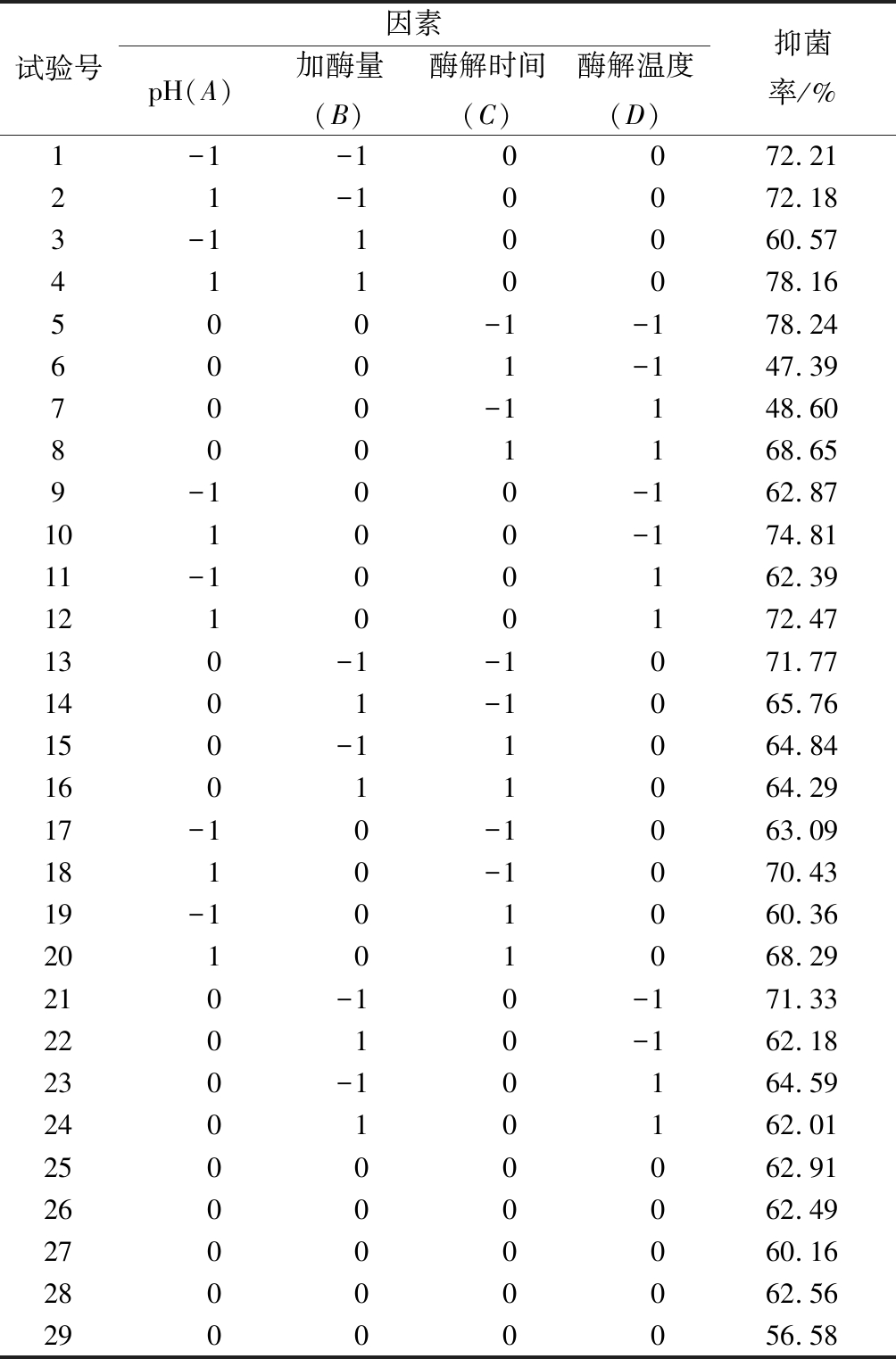
试验号因素pH(A)加酶量(B)酶解时间(C)酶解温度(D)抑菌率/%1-1-10072.2121-10072.183-110060.574110078.16500-1-178.246001-147.39700-1148.608001168.659-100-162.8710100-174.8111-100162.3912100172.47130-1-1071.771401-1065.76150-11064.8416011064.2917-10-1063.091810-1070.4319-101060.3620101068.29210-10-171.3322010-162.18230-10164.5924010162.0125000062.9126000062.4927000060.1628000062.5629000056.58
利用方差分析可以得到各个数据之间的显著差异。运用Design-Expert 8.0软件对各个试验点的响应值进行最小二乘法拟合回归,得到的二次多元回归模型方程为:Y=+60.95+4.62A-2.05B-2.00C-1.51D+4.20AB+0.15AC-0.43AD+1.38BC+1.63BD+12.73CD+5.68A2+4.69B2-0.18C2+0.29D2。经响应面分析,模型计算得到最佳酶解理论条件为:酶解pH为4.0、加酶量为2 015.54 U/g,酶解时间为2.45 h,温度为45.18 ℃,对大肠杆菌的抑菌率理论值为83.97%。结合实际条件,最终选择料液比1∶5(g∶mL)、pH 4.0、加酶量2 000.0 U/g,时间2.50 h,温度45 ℃为最优条件,该条件下,实际测得抑菌率值为(79.56±1.56)%,与理论值相比,相对误差为(4.41±1.56)%。
2.3 鲣鱼暗色肉抗菌粗肽分离纯化
2.3.1 超滤结果分析
一般情况下,抗菌肽是一类分子量相对较小的物质,需对其进行多步分离。首先通过高速离心、沉淀法或超滤法对粗肽进行初步分离,目的是去除样品中分子量较大的脂肪以及其他大颗粒物,再通过离子交换层析、蛋白凝胶层析、电泳凝胶及高效液相对其进行深一度的分离纯化。如樊陈等[28]对地衣芽孢杆菌产抗菌肽进行纯化时,首先将地衣芽孢杆菌发酵液进行初步离心超滤浓缩后,接着进行阴离子交换层析,冷冻干燥后,再进行凝胶层析,最后经反相高效液相分离纯化获得抗菌肽。
超滤离心法主要以分子量的大小、密度、形状进行分离[29-30]。经截留分子量分别为5、10 kDa的超滤膜对样液进行超滤离心初步分离后,分别得到大于10 kDa、5~10 kDa、小于5 kDa三种组分。对得到的3种组分分别进行抑菌试验,结果如图9所示。
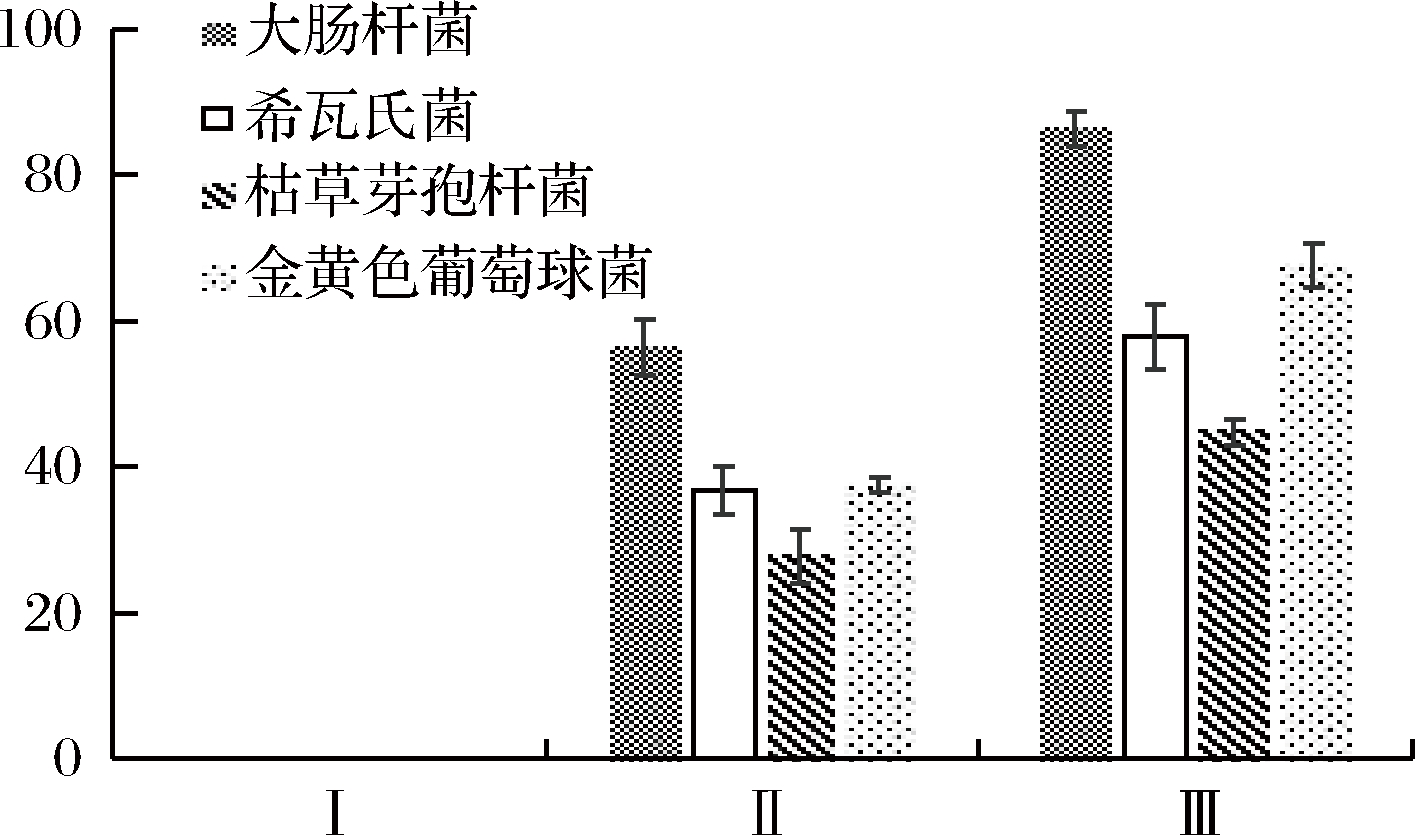
图9 酸性蛋白酶水解物超滤离心后3种组分的抑菌作用比较
Fig.9 Comparison of antibacterial activity of three components after ultrafiltration of acid protease hydrolysate
注:Ⅰ代表大于10 kDa的组分;Ⅱ代表5~10 kDa的组分;Ⅲ代表小于5 kDa的组分
Ⅰ组分中对试验菌均没有抑菌性,Ⅱ组分中对大肠杆菌、希瓦氏菌、枯草芽孢杆菌、金黄色葡萄球菌的抑菌率分别为(56.44±3.80)%、(36.75±3.31)%、(27.67±3.73)%、(37.45±0.97)%。Ⅲ组分中对大肠杆菌、希瓦氏菌、枯草芽孢杆菌、金黄色葡萄球菌的抑菌率分别为(86.36±2.29)%、(57.89±4.39)%、(44.89±1.84)%、(67.66±2.85)%。经比较Ⅱ、Ⅲ组分均有抑菌效果,Ⅲ组分的抑菌效果最好。可能是由于抗菌肽的分子量一般较小,通常只有12~50个氨基酸[31-32]。将Ⅱ、Ⅲ组分合并收集,进行下一步的Sephacryl S-100 HR凝胶层析分离。
2.3.2 凝胶色谱结果分析
凝胶层析是按照蛋白质的分子量大小进行的分离技术。不同类型的凝胶筛孔大小不同,大的蛋白质直接通过凝胶珠之间的缝隙先被洗脱下来,但小分子受其运动路程长和来自凝胶珠内部的阻力的影响,从柱子上洗脱下来所花费的时间较长。通过Sephacryl S-100 HR分离纯化的蛋白质和多肽分子量范围为1~100 kDa。如图10所示,超滤后的暗色肉抗菌肽经凝胶Sephacryl S-100层析纯化后,共有4个峰,分别为S-1、S-2、S-3和S-4。

图10 超滤后酶水解物的凝胶层析
Fig.10 Gel chromatography of enzymatic hydrolyzate after ultrafiltration
将冷冻干燥后的各个组分配制成质量浓度为0.5 mg/mL的样液,进行抑菌试验,效果如图11所示。
S-1、S-2组分对试验菌均没有抑菌性,S-3组分对大肠杆菌、希瓦氏菌、枯草芽孢杆菌、金黄色葡萄球菌的抑菌率分别为(96.71±3.0)%、(77.89±2.09)%、(64.89±1.24)%、(88.66±5.39)%。S-4组分中对大肠杆菌、希瓦氏菌、枯草芽孢杆菌、金黄色葡萄球菌的抑菌率分别为(36.44±4.21)%、(14.54±3.01)%、(7.67±3.64)%、(14.56±3.10)%。S-1、S-2组分无抑菌性可能是由于凝胶层析初期,首先被洗脱下来的大分子物质无抑菌性。S-4较S-3组分抑菌效果要弱的多,可能是由于酸性蛋白酶水解后期,使得具有抑菌活性的氨基酸序列的多肽进一步水解。S-3组分的抑菌性要高于超滤后的组分Ⅲ,由此可以粗略得出凝胶层析可以进一步对抗菌肽进行分离纯化。

图11 酶水解物凝胶层析后各组分抑菌率的比较
Fig.11 Comparison of antibacterial rate of each component after ultrafiltration of enzymatic hydrolyzate gel chromatography
2.3 S-3抗菌肽对测试菌种的MIC值
抗菌肽对不同菌种的最小抑菌浓度有一定差异。从表4可以得出,暗色肉抗菌肽S-3对大肠杆菌的MIC值为40 μg/mL,对金黄色葡萄球菌和希瓦氏菌的MIC值为80 μg/mL,对枯草芽孢杆菌的MIC值为160 μg/mL。
表4 S-3抗菌肽对测试菌种的MIC值
Table 4 MIC value of antibacterial peptide against test strain

测试菌种S-3抗菌肽质量浓度/(μg·mL-1)3201608040201052.5大肠杆菌---+++++希瓦氏菌--++++++金黄色葡萄球菌--++++++枯草芽孢杆菌-+++++++
注:“+”表示与阴性、阳性对照组对照后酶标板孔底部有白色沉淀;“-”表示与阴性、阳性对照组对照后酶标板孔底部无白色沉淀。
有些因素可能会影响致病菌的MIC值,已有研究表明致病菌可以通过改变细胞壁和膜表面电荷[33-34]来隔离和排斥抗菌肽[35-36],导致MIC值增大。此外,孙宜君[37]对螺旋藻抗菌肽的纯化鉴定及其抑菌机理的研究表明,K+、Ca2+等离子存在也会影响微生物的MIC值。
3 小结
以鲣鱼暗色肉为原料,选择酸性蛋白酶,以料液比为1∶5(g∶mL)、酶解pH为4.0、加酶量为2 000.0 U/g,酶解2.5 h,酶解温度为45 ℃,得到的多肽对大肠杆菌具有较好的抑菌效果,实际抑菌率为(79.56±1.56)%。通过对鲣鱼暗色肉的优化产物抗菌粗肽进行超滤分离、凝胶层析分离纯化,获得一组分离峰S-3,对其进行最小抑菌浓度的测定,其中对大肠杆菌的MIC值为40 μg/mL,对金黄色葡萄球菌和希瓦氏菌的MIC值为80 μg/mL,对枯草芽孢杆菌的MIC值为160 μg/mL。希望该研究对制备用于革兰氏阴性细菌或广谱抗菌性的海洋鱼类抗菌肽提供指导,同时也为海洋经济鱼类高值化研究提供新的思路。
[1] DA C J, COVE M, FERREIRA R, et al. Antimicrobial peptides: an alternative for innovative medicines[J]. Appl Microbiol Biotechnol, 2015, 99(5): 2 023-2 040.
[2] 单安山, 马得莹,冯兴军,等. 抗菌肽的功能、研发与应用[J]. 中国农业科学, 2012, 45(11): 2 249-2 259.
[3] N DIA C, SARNEBTI B, PINTADO M. The importance of antimicrobial peptides and their potential for therapeutic use in ophthalmology[J]. International Journal of Antimicrobial Agents, 2013, 41(1): 5-10.
DIA C, SARNEBTI B, PINTADO M. The importance of antimicrobial peptides and their potential for therapeutic use in ophthalmology[J]. International Journal of Antimicrobial Agents, 2013, 41(1): 5-10.
[4] SPERSTAD S V, HAUG T, BLENCKE H M, et al. Antimicrobial peptides from marine invertebrates: Challenges and perspectives in marine antimicrobial peptide discovery [J]. Biotechnology Advances, 2011, 29(5): 519-530.
[5] 苏阳, 章超桦,曹文红,等. 南海产3种金枪鱼普通肉、暗色肉营养成分分析与评价[J]. 广东海洋大学学报, 2015, 35(3): 87-93.
[6] 袁永俊, 胡婷,朱家骅. 酪蛋白抗菌肽的酶法制备[J]. 食品与机械, 2010, 26(2): 1-4.
[7] 金文刚, 吴海涛,朱蓓薇,等. 虾夷扇贝生殖腺多肽的制备及分离[J]. 大连工业大学学报, 2011, 30(6): 391-395.
[8] REN L, HEMAR Y, PERERA C O, et al. Antibacterial and antioxidant activities of aqueous extracts of eight edible mushrooms [J]. Bioactive Carbohydrates & Dietary Fibre, 2014, 3(2): 41-51.
[9] TANG W T, ZHANG H, WANG L, et al. Antimicrobial peptide isolated from ovalbumin hydrolysate by immobilized;liposome-binding extraction [J]. European Food Research & Technology, 2013, 237(4): 591-600.
[10] 马秀玲, 陈蕊君,王飞,等. 吸光度法快速确定菌悬液浓度及其适用范围[J]. 微生物学杂志, 2014(4): 90-92.
[11] 唐田园, 陈旋,宋风霞,等. 固态发酵苦荞制备多肽菌种的筛选[J]. 微生物学通报, 2017(3):655-663.
[12] 李哲. 贻贝抗菌肽的分离纯化[J]. 安徽农业科学, 2012,371(10):5 768-5 770.
[13] 王巧巧. 鲫鱼鱼鳞抗菌肽的制备、抑菌机理及应用研究[D]. 杭州:浙江工商大学, 2017.
[14] 杜昕, 李诚,肖岚. 酶解牦牛血发酵液制备抗氧化肽工艺优化[J]. 核农学报, 2017, 31(2): 325-333.
[15] 施永清, 王巧巧,吴丹丽,等. 响应面试验优化双酶酶解法制备鱼鳞抗菌肽工艺及其抑菌性能分析[J]. 食品科学, 2018, 39(6): 155-161.
[16] 吴林泽, 李从发. 罗非鱼下脚料酶解产物中抗菌肽的初步研究[J]. 科技信息:科学·教研, 2007, 17: 289-434.
[17] ZHANG J, PENG S, CHENG X, et al. Functional analysis of hybrid peptide CAMA-Syn: expression in mammalian cells and antimicrobial potential[J]. Protein & Peptide Letters, 2012, 19(10):198-201.
[18] YOUNT N Y, BAYER A S, XIONG Y Q, et al. Advances in antimicrobial peptide immunobiology[J]. Peptide Science, 2010, 84(5):435-458.
[19] 赵红倩, 宋风霞,江祥师,等. Plackett-Burman和Box-Behnken试验优化苦荞蛋白酶解制备抗菌肽的工艺[J]. 食品科学, 2017, 38(16): 158-164.
[20] 姜太玲, 吴红洋,申光辉,等. 酸性蛋白酶制备花椒籽蛋白抗菌肽的研究[J]. 食品科学, 2015, 36(13): 148-53.
[21] OSMAN A, GODAH A, ABDEL-HAMID M, et al. Antibacterial peptides generated by Alcalase hydrolysis of goat whey [J]. LWT - Food Science and Technology, 2016, 65: 480-486.
[22] 张秋萍. 豌豆分离蛋白酶解产生物活性肽的研究[D]. 无锡:江南大学, 2013.
[23] DEMERS-MATHUEU, VERONIQUE, ROBITAILLE, et al. Antibacterial activity of peptides extracted from tryptic hydrolyzate of;whey protein by nanofiltration [J]. International Dairy Journal, 2013, 28(2): 94-101.
[24] 徐叔云, 卞如濂,陈修. 药理实验方法学(第3版). [M]. 北京:人民卫生出版社, 2002: 1 612.
[25] LI G H, LE G W, SHI Y H, et al. Angiotensin I-converting enzyme inhibitory peptides derived from food proteins and their physiological and pharmacological effects [J]. Nutrition Research, 2004, 24(7): 469-486.
[26] MINE Y, FUPENG MA A, LAURIAU S. Antimicrobial peptides released by enzymatic hydrolysis of hen egg white lysozyme [J]. Journal of Agricultural & Food Chemistry, 2004, 52(5): 1 088-1 094.
[27] 郭鑫杰, 袁凯松,简敬一,等. 抗菌肽分离纯化分析研究进展[J]. 国外医药抗生素分册, 2017(6): 9-12.
[28] 樊陈, 高兆建,张桂英,等. 地衣芽孢杆菌抗菌肽的纯化及抗菌特性分析[J]. 中国农学通报, 2013, 29(33):313-318.
[29] 苗建银, 柯畅,郭浩贤,等. 抗菌肽的提取分离及抑菌机理研究进展[J]. 现代食品科技, 2014, 30(1): 233-240.
[30] ZHANG J, PENG S, CHENG X, et al. Functional analysis of hybrid peptide CAMA-Syn: expression in mammalian cells and antimicrobial potential[J]. Protein & Peptide Letters, 2012, 19(10):1 076-1 081.
[31] GLUKHOV E, STARK M, BURROWS L L, et al. Basis for selectivity of cationic antimicrobial peptides for bacterial versus mammalian membranes[J]. Journal of Biological Chemistry, 2005, 280(40):33 960-33 967.
[32] YOUNT N Y, BAYER A S, XIONG Y Q, et al. Advances in antimicrobial peptide immunobiology[J]. Peptide Science, 2010, 84(5):435-458.
[33] SCHITTEK B, HIPFEL R, SAUER B, et al. Dermcidin: a novel human antibiotic peptide secreted by sweat glands[J]. Nature Immunology, 2001, 2(12):1 133-1 137.
[34] LAI R, LIU H, LEE W H, et al. An anionic antimicrobial peptide from toad Bombina maxima[J]. Biochemical and Biophysical Research Communications, 2002, 295(4):799.
[35] BROGDEN K A, DE LUCCA A J, BLAND J, et al. Isolation of an ovine pulmonary surfactant-associated anionic peptide bactericidal for Pasteurella haemolytica[J]. Proceedings of the National Academy of Sciences, 1996, 93(1):412-416.
[36] JOO H S, OTTO M. Mechanisms of resistance to antimicrobial peptides in staphylococci[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2015:S0005 273615000498.
[37] 孙宜君. 螺旋藻抗菌肽的纯化鉴定及其抑菌机理的研究[D]. 北京:北京林业大学, 2016.