白梨属蔷薇科梨属植物,是我国西北地区梨的主栽品种,具有成熟期早、外形美观、品质优良等特性,且因其皮薄而深受消费者青睐[1]。据国家统计局统计,截止2017年,甘肃省梨产量已经达到2.104×105 t,其中苹果梨、早酥梨和皇冠梨是甘肃省大面积栽培的白梨系统的主要品种[2]。酚类物质普遍存在于植物的根、茎、叶和果实等部位,在果实中的含量比较丰富,但有研究表明与果肉相比,果皮的酚类物质含量更高[3-4]。果蔬中酚类化合物不仅赋予其特殊色泽和风味,而且具有抗菌、清除自由基、抗毒素及抵御生物和非生物胁迫等作用[5]。同时,总酚和类黄酮属于多酚类物质,具有较强收敛性的多酚往往具有较强的自由基清除能力,相应地也具有较强的药理活性[6]。因此增加果蔬摄入量可以降低许多不同类型疾病的风险,包括癌症、心血管疾病、糖尿病和阿尔茨海默症等[7]。
梨果皮化学组分及生物学功能的系统研究,可为梨果综合利用及天然、无毒无害的抗氧化资源开发提供依据[8]。白梨果皮中酚类物质含量丰富,有研究表明果皮酚类物质与果实抗氧化能力具有相关性[9],且其对病原物侵染及潜伏具有调控作用[10]。但酚类化合物由于结构不稳定,在不适宜的光照、pH、氧气、贮藏温度等环境条件下,容易发生降解,且酚类物质种类和含量因品种、部位、发育贮藏期和环境条件而异[11]。因此系统研究不同品种梨在低温贮藏过程中果皮中酚类物质含量及抗氧化能力的变化具有十分重要的意义。尽管目前有关梨果酚类物质含量及其特性的研究报道较多[12-15],但对甘肃省主栽的3种梨果低温贮藏期间果皮主要酚类物质变化及其抗氧化特性的研究仍缺乏系统报道。因此本研究以甘肃省的3种白梨苹果梨、早酥梨和皇冠梨为试材,全面检测分析3种梨果品种在低温贮藏期间果皮总酚、总黄酮、8种主要酚类物质含量及变化规律,并测定酚提取物的抗氧化能力及其与各酚类含量的相关性,以期为更好地利用梨果皮的酚类物质及其抗氧化特性提供理论依据。
1 材料与方法
1.1 材料
供试梨果采自甘肃省景泰县条山农场,主要包括苹果梨、早酥梨和皇冠梨3个品种,每品种梨选定3棵树,每棵树随机采摘大小基本一致的10个果,贮藏期均为采后贮藏的前5个月,贮存于0 ℃冷库中。
酚类标准样:绿原酸(chlorogenic acid)、咖啡酸(caffeic acid)、对香豆酸(p-coumanic acid)、阿魏酸(ferulic acid)、儿茶素((+)-catechin)、表儿茶素((+)-epicatechin)、芦丁(rutin hydrate)、熊果苷(arbutin)以及其他试剂,均购自sigma公司。
1.2 仪器与设备
Agilent 1100高效液相色谱仪,美国安捷伦公司;UV-2450日本岛津紫外可见分光光度计,上海旦鼎国际贸易有限公司;Eclipsc Plus C18色谱柱(150 mm×4.6 mm,5 μm),美国安捷伦公司;AWL-1002-M艾科普超纯水仪,重庆颐洋企业发展有限公司。
1.3 方法
1.3.1 梨果皮酚类物质的提取
参考李磊等[16]旳方法。取梨果皮40 g,加入30 mL 70%(体积分数)丙酮匀浆后,超声波提取25 min后抽滤,40 ℃下用氮吹干仪去除丙酮。水相用1 mol/L的NaOH和HCl调pH,加20 mL乙酸乙酯萃取,分离出酯相后合并,在30 ℃下用氮吹干仪去除乙酸乙酯,用甲醇(色谱纯)定容到3 mL,0.45 μm有机滤膜过滤后备用。
1.3.2 总酚与总黄酮测定
总酚含量测定参考SINGLETON等[17-18]的方法。取0.125 mL酚提取液并加入0.5 mL蒸溜水和0.125 mL福林肖卡试剂,旋涡混合后静置反应6 min,加入1.25 mL 7% Na2CO3溶液和1 mL蒸馏水,室温避光静置反应90 min后在760 nm波长下测其吸光度,同时以0.125 mL甲醇代替提取液作为空白对照。用不同浓度梯度的没食子酸标准品溶液,测定吸光度并绘制标准曲线。总酚含量以每千克鲜样所含的没食子酸当量(GAE)表示,单位为g GAE/kg。
总黄酮含量测定参考JIA等[18-19]的方法。取0.3 mL酚提取液,加入1.5 mL蒸溜水和0.09 mL 5% NaNO2溶液,旋涡混合后静置反应5 min,加入0.18 mL 10% AlCl3·6H2O混合后静置6 min,之后再加入0.6 mL 1 mol/L NaOH溶液和0.33 mL蒸馏水,在510 nm处测吸光度,同时以0.3 mL甲醇代替提取液作为空白对照。用不同浓度梯度的儿茶素标准品溶液,测定吸光度并绘制标准曲线。总黄酮含量计算以每千克鲜样所含的儿茶素当量(CE)表示,单位g CE/kg。
1.3.3 HPLC测定8种酚类物质含量
通过全波长紫外扫描到流动相以及所测各单酚在紫外光区的最大吸收波长。HPLC测定条件如下:酚酸类测定波长为323 nm,黄酮类测定波长为297 nm,芦丁为358 nm。以乙腈和1%(体积分数)乙酸为流动相。将8种单酚分别配成甲醇溶液,并在已确定的色谱条件下测定,确定标准物质的保留时间,用保留时间结合增高法定性,根据色谱中峰面积与样品中标准物质的含量关系进行线性回归,通过计算相关系数,得出样品中的酚类物质的含量。
1.3.4 抗氧化能力测定
DPPH自由基清除能力的测定参考LOCATELLI等[20]方法。取0.2 mL稀释后的酚提取液加入2.8 mL 70 mmol/L的DPPH甲醇溶液,混匀后室温环境避光反应30 min后,于515.5 nm波长下测吸光度。ABTS+·清除能力测定参考RE等[21]的方法。将配制的7 mmol/L的ABTS+·水溶液和2.45 mmol/L的过硫酸钾水溶液混合定容至25 mL后,室温避光条件下静置反应12 h,之后稀释混合液至其在734 nm波长下的吸光度为0.700±0.020。取0.15 mL稀释后的酚提取液,加入3 mL ABTS+·溶液反应30 min,于734 nm波长下测其吸光度。FRAP抗氧化能力的测定参考BENZIE等[22]的方法。取0.2 mL酚提取液,加入2.8 mL的FARP溶液,室温下避光静置反应30 min,在593 nm下测其吸光度。以甲醇代替提取液作为空白对照,以Trolox为标样做标准曲线,抗氧化能力以每千克鲜样所含的Trolox当量(TE)表示,单位为mg TE/kg。
1.4 数据统计
每个试验重复3次,本实验采用Microsoft Excel 2007和SPSS 19.0统计分析软件进行统计处理并作图。
2 结果与分析
2.1 贮藏期梨果皮总酚、总黄酮含量
贮藏过程中3种梨果皮总酚含量总体呈降低的趋势,且品种之间差异并不显著(图1-A)。梨果皮总酚含量变化范围为0.346 ~ 0.646 g GAE/kg,其中在贮藏前期总酚含量相对较高,且在贮藏第一个月迅速下降,在贮藏30 d时苹果梨、早酥梨、皇冠梨果皮总酚含量较贮藏初期分别下降了37.9%、37.1%和35.9%(图1-A)。
由图1-B可见,与总酚类似,3种梨果皮总黄酮含量均随贮藏期延长而降低,但不同品种之间存在差异,其中早酥梨果皮中总黄酮含量较高,平均含量分别为苹果梨和皇冠梨的1.32和1.20倍。同样其含量在贮藏前期下降较快,其中苹果梨在贮藏60 d时果皮总黄酮含量降至0.362 g CE/kg,仅为贮藏初期的32.7%(图1-B)。
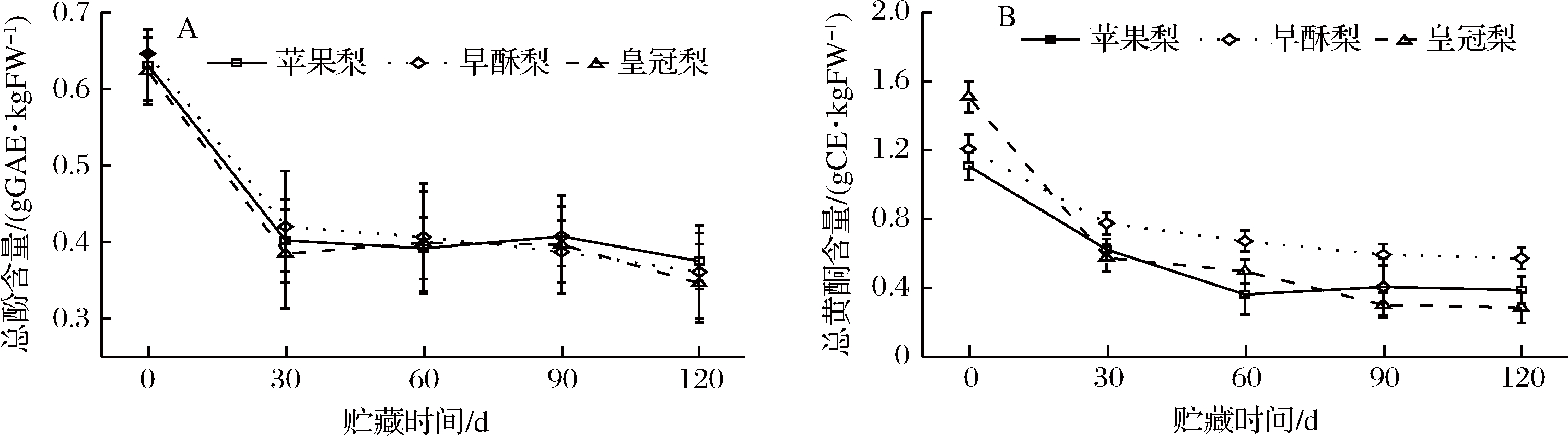
图1 低温贮藏期间3种梨果皮总酚(A)和总黄酮(B)含量变化
Fig.1 Changes in total phenolic content (A) and total flavonoids content (B) of three kinds of pear peel during cold storage
注:竖线表示标准误(±SE),下同。
2.2 贮藏期梨果皮主要酚类物质含量的比较
2.2.1 梨果皮酚酸类物质含量的变化
贮藏期间3种梨果皮绿原酸和咖啡酸含量的变化规律存在一定差异(图2-A,图2-B)。梨果皮绿原酸的含量依次为苹果梨>皇冠梨>早酥梨,其中在贮藏前期绿原酸的含量相对较高,苹果梨在贮藏第60天时果皮的绿原酸含量为初期的1.35倍(图2-A)。由图2-B可知,早酥梨和皇冠梨在贮藏前期果皮咖啡酸含量均呈先上升的趋势,其中早酥梨果皮在贮藏第30天含量达到最高,含量是初期的1.48倍,而皇冠梨的含量则在第60天达到峰值,苹果梨的咖啡酸含量在整个贮藏期间变化不大(图2-B)。
3种梨果皮对香豆酸和阿魏酸含量在梨果贮藏期间的变化存在较大差异,除早酥梨果皮对香豆酸和阿魏酸含量在贮藏末期略有升高外,早酥梨和皇冠梨果皮的对香豆酸和阿魏酸含量在贮藏期均维持在较低水平且呈缓慢降低趋势,而苹果梨果皮阿魏酸含量在整个贮藏过程持续降低,对香豆酸含量在贮藏前期呈上升趋势,后期迅速下降,在第60天时含量达到初期的3.82倍(图2-C,图2-D)。
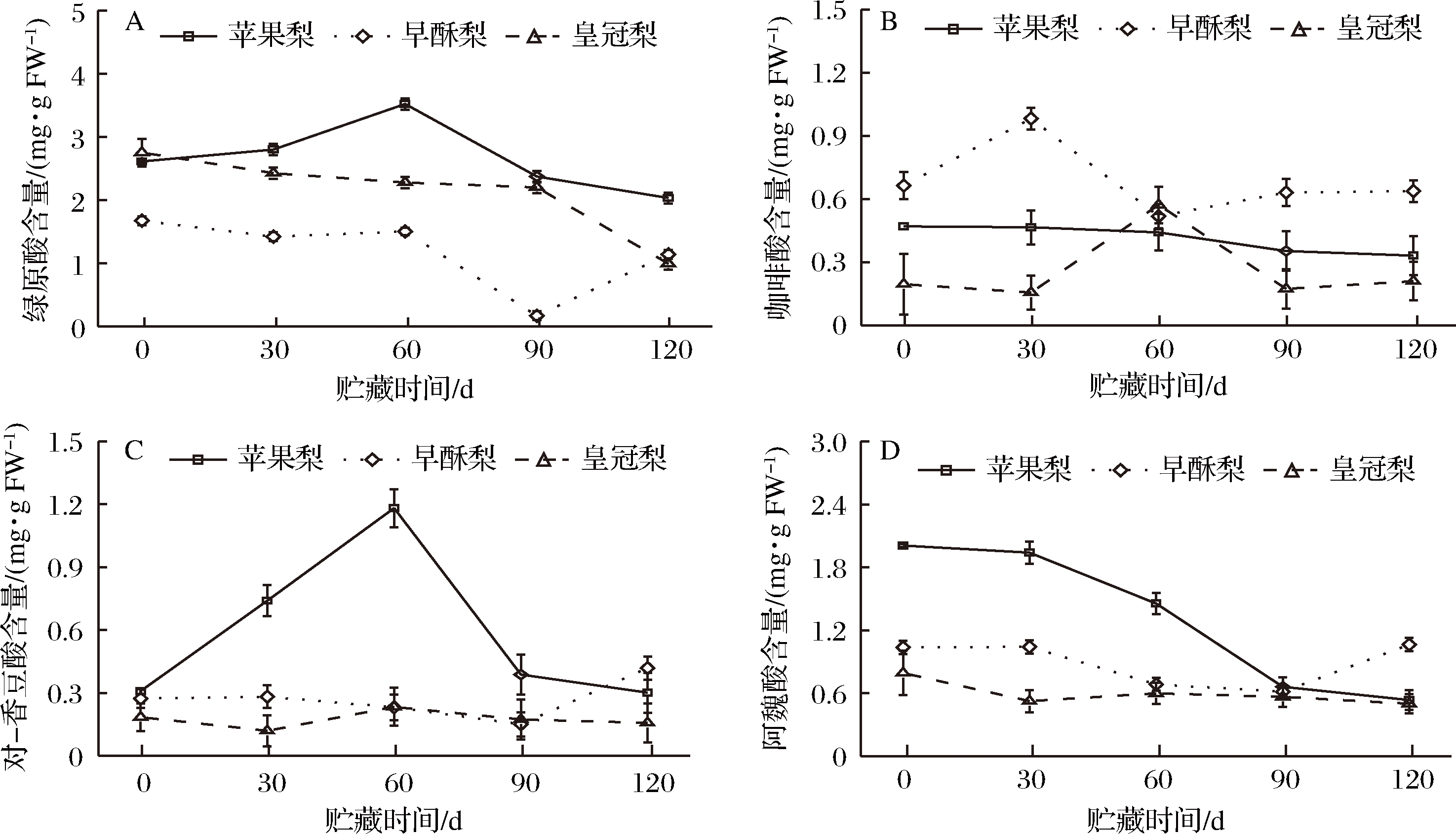
图2 低温贮藏期3种梨果皮绿原酸(A)、咖啡酸(B)、对香豆酸(C)和阿魏酸(D)含量变化
Fig.2 Changes in chlorogenic acid (A), caffeic acid (B), p-coumanic acid (C) and ferulic acid (D) contents of three kinds of pear peel during cold storage
2.2.2 梨果皮黄酮类物质含量的变化
3种梨果在贮藏过程中,除早酥梨果皮的儿茶素含量持续上升外,果皮儿茶素和表儿茶素总体上呈先上升后下降的趋势,其中苹果梨果皮的表儿茶素含量显著高于其他两个品种,其平均含量分别是早酥梨和皇冠梨的1.42和1.94倍(图3-A,图3-B)。苹果梨和皇冠梨果皮的芦丁含量在贮藏前期变化趋势不明显,但在贮藏最后1个月显著升高,在贮藏120 d达到了整个贮藏期的最高值,分别是贮藏初期的1.45和2.08倍,早酥梨果皮的含量在第30天达到峰值,之后变化趋势不明显(图3-C)。
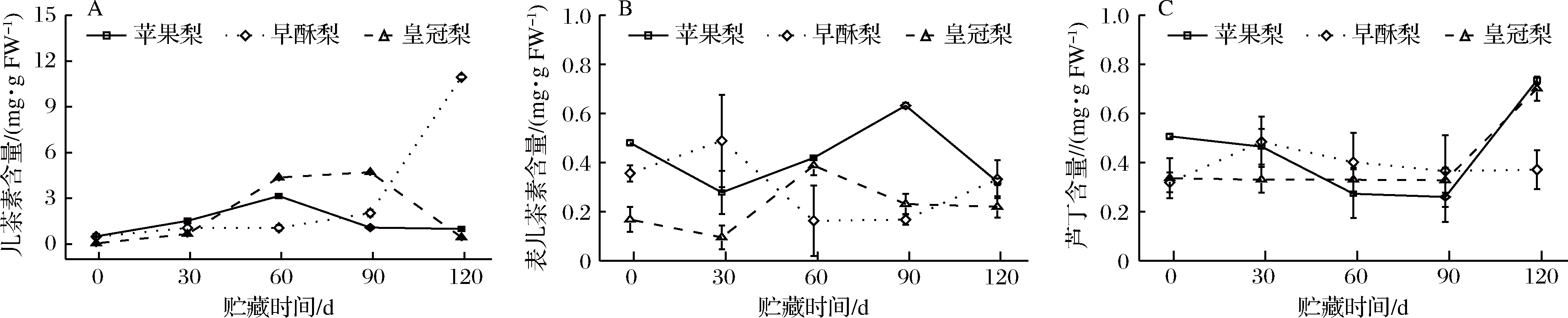
图3 低温贮藏期3种梨果皮儿茶素(A)、表儿茶素(B)、芦丁(C)含量变化
Fig.3 Changes in (+) -catechin (A), (+) -epicatehin (B) and rutin hydrate (C) contents of three kinds of pear peel during cold storage
2.2.3 梨果皮熊果苷含量的变化
贮藏期3种梨果熊果苷含量总体呈先上升后下降的趋势,早酥梨和皇冠梨果皮的熊果苷含量是略高于苹果梨的,其中苹果梨和皇冠梨在贮藏第1个月迅速升高,在贮藏第30天含量较初期分别增加了20.1和23.6 mg/g FW,而早酥梨在第60天含量达到最高值(图4)。
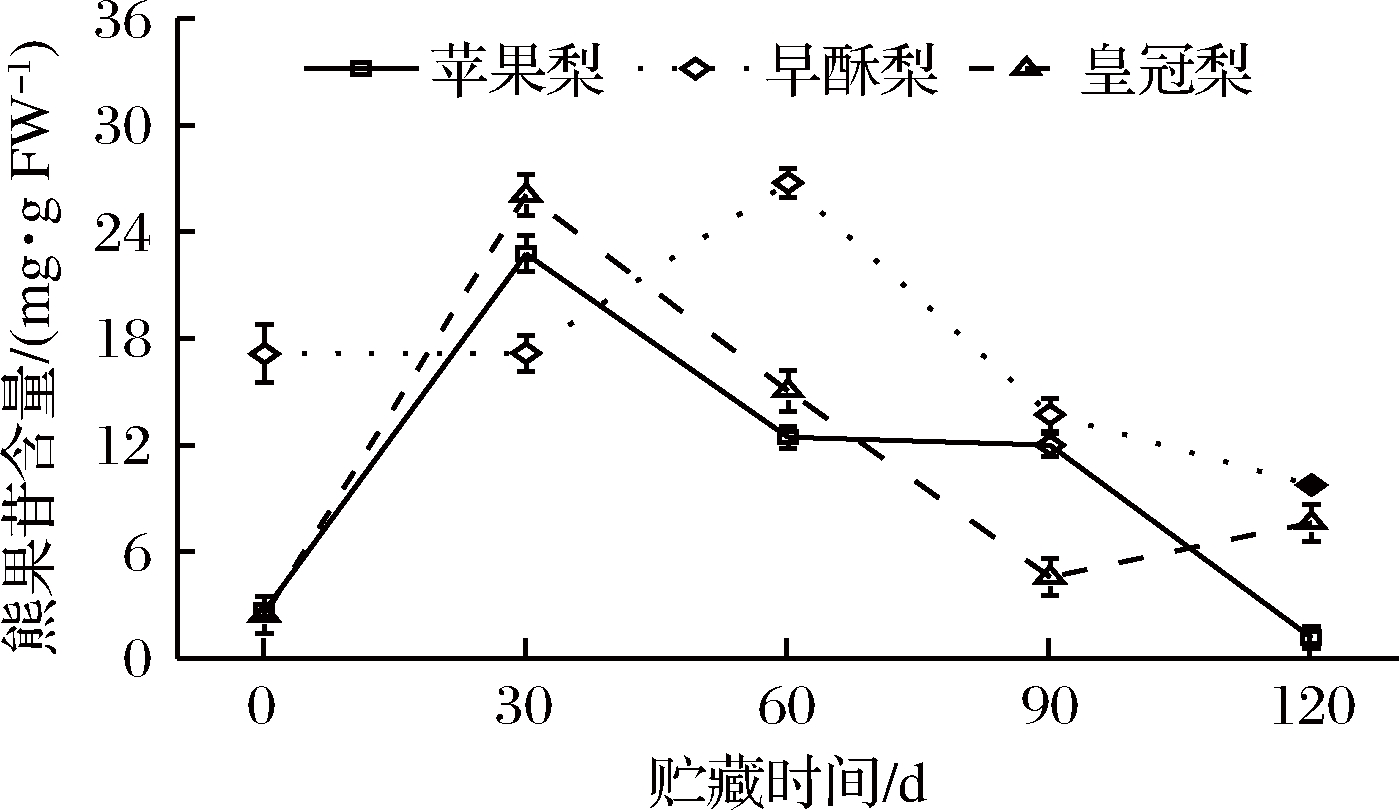
图4 低温贮藏期3种梨果皮类熊果苷物质含量变化
Fig.4 Changes in arbutin content during cold storage of three kinds of pear peel
2.3 梨果皮的抗氧化特性及其与果皮酚类物质的相关性
2.3.1 贮藏期梨果皮抗氧化特性变化分析
2.3.1.1 DPPH自由基清除能力
3种梨果皮在贮藏期DPPH自由基清除能力均呈下降趋势,清除速率变化范围约在43.70~64.35 mg TE/kg,以皇冠梨的DPPH自由基清除能力相对较高。其中在贮藏前期清除速率相对较高,且在贮藏第1个月迅速下降,在贮藏第30天时苹果梨、早酥梨和皇冠梨DPPH自由基清除能力较贮藏初期分别下降了26.4%、28.5%和24.5%(图5)。
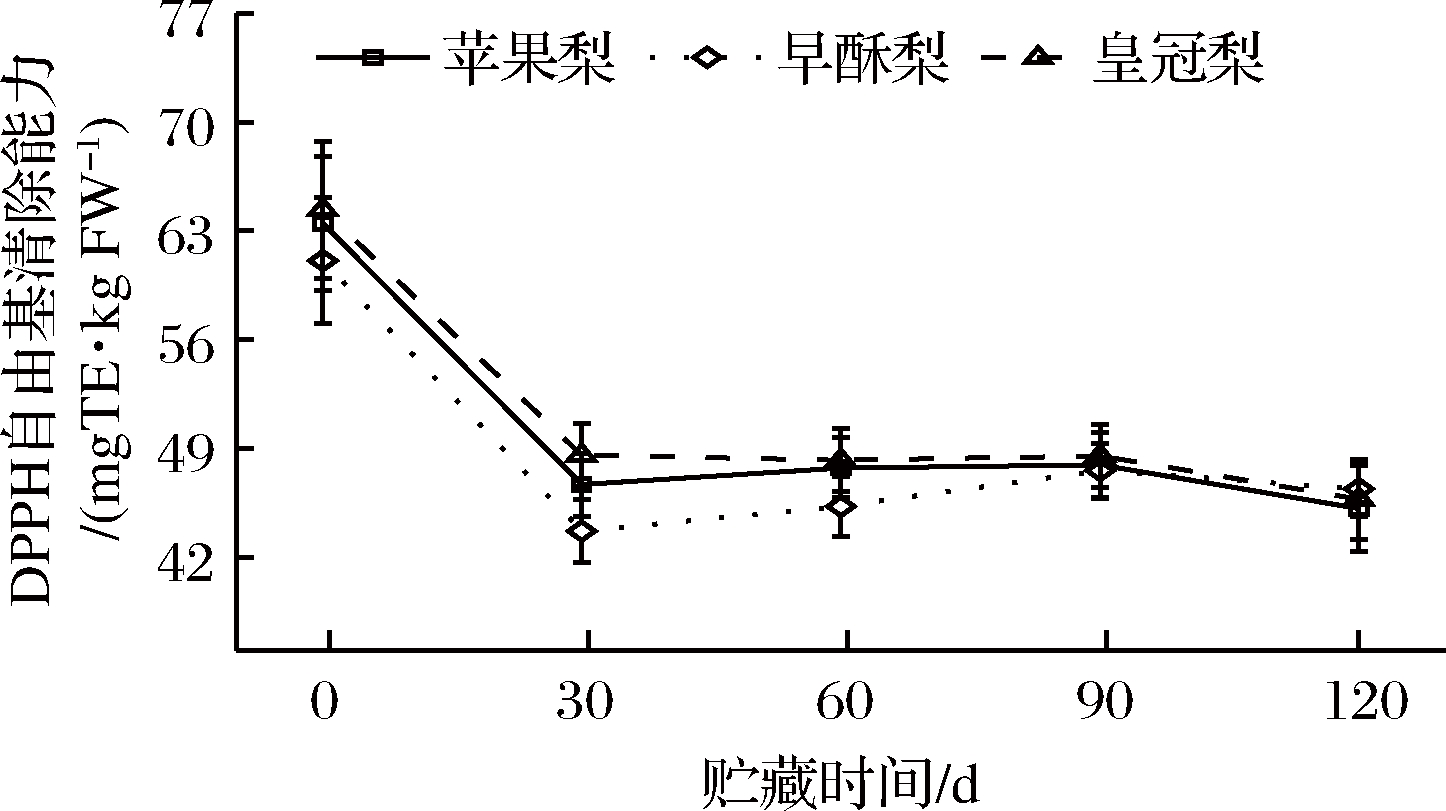
图5 低温贮藏期梨果皮DPPH自由基清除能力的测定
Fig.5 Changes in the capacity of DPPH radical scavenging during cold storage of three kinds of pear peel
2.3.1.2 ABTS+·清除能力
与DPPH自由基清除能力基本一致,3种梨果皮ABTS+·清除能力均随贮藏期延长而降低,且三者之间差异不显著。其中以苹果梨的ABTS+·清除能力相对较高,同样其清除能力在贮藏前期下降较快,在贮藏第30天时苹果梨、早酥梨和皇冠梨ABTS+·清除能力较贮藏初期分别下降了21.4%、25.0%和25.2%(图6)。
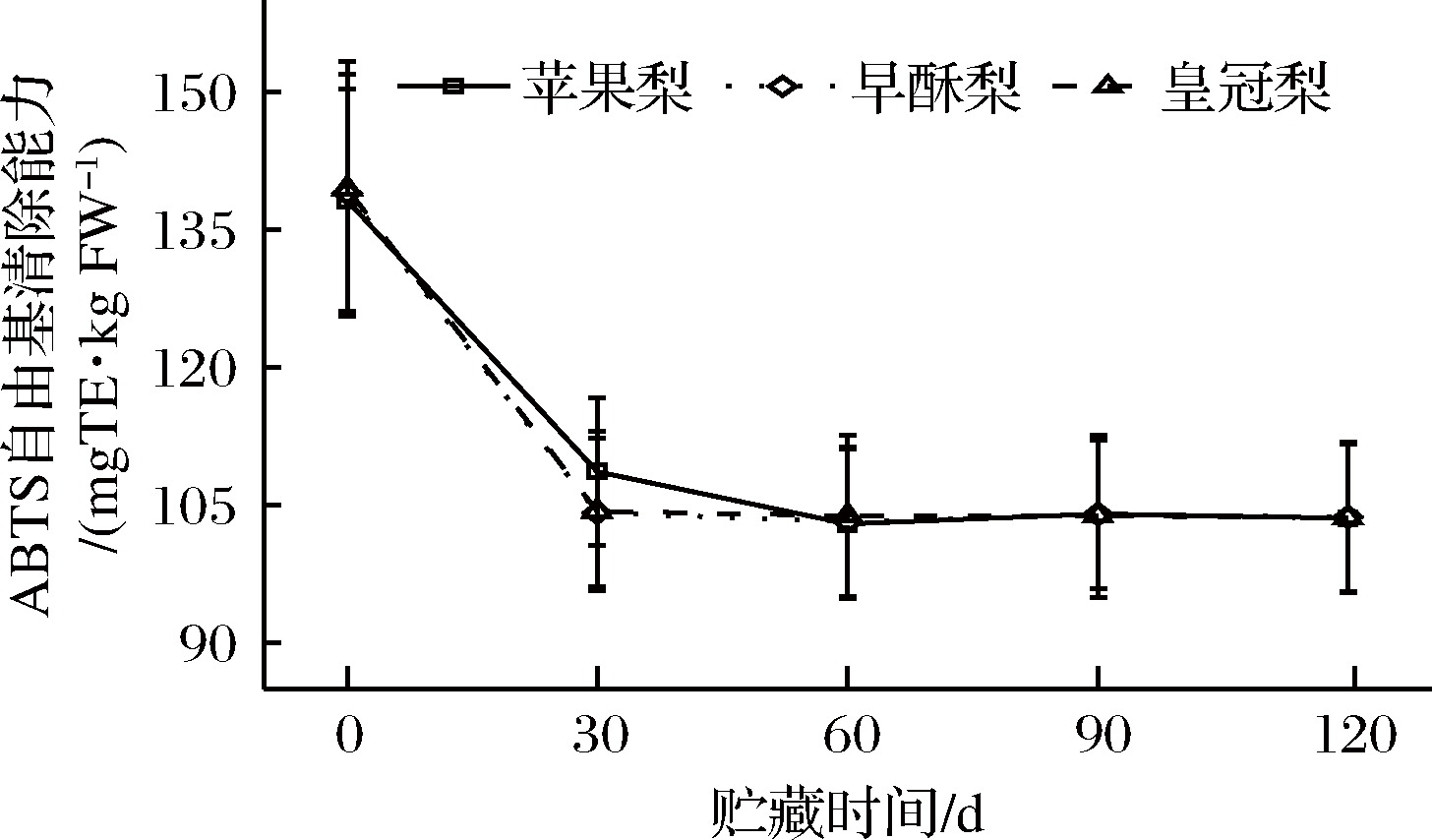
图6 低温贮藏期梨果皮ABTS+·清除能力的测定
Fig.6 Changes in the capacity of ABTS+· radical scavenging during cold storage of three kinds of pear peel
2.3.1.3 FRAP抗氧化能力
贮藏期3种梨果皮的FRAP抗氧化能力均呈下降趋势,其中苹果梨、早酥梨和皇冠梨果皮的平均FRAP抗氧化能力分别为184.50、192.51和160.62 mg TE/kg,同样其抗氧化能力均在第一个月降幅较大,在贮藏末期时苹果梨、早酥梨和皇冠梨的FRAP抗氧化能力较初期分别降低了40.8%、39.1%和61.2%(图7)。
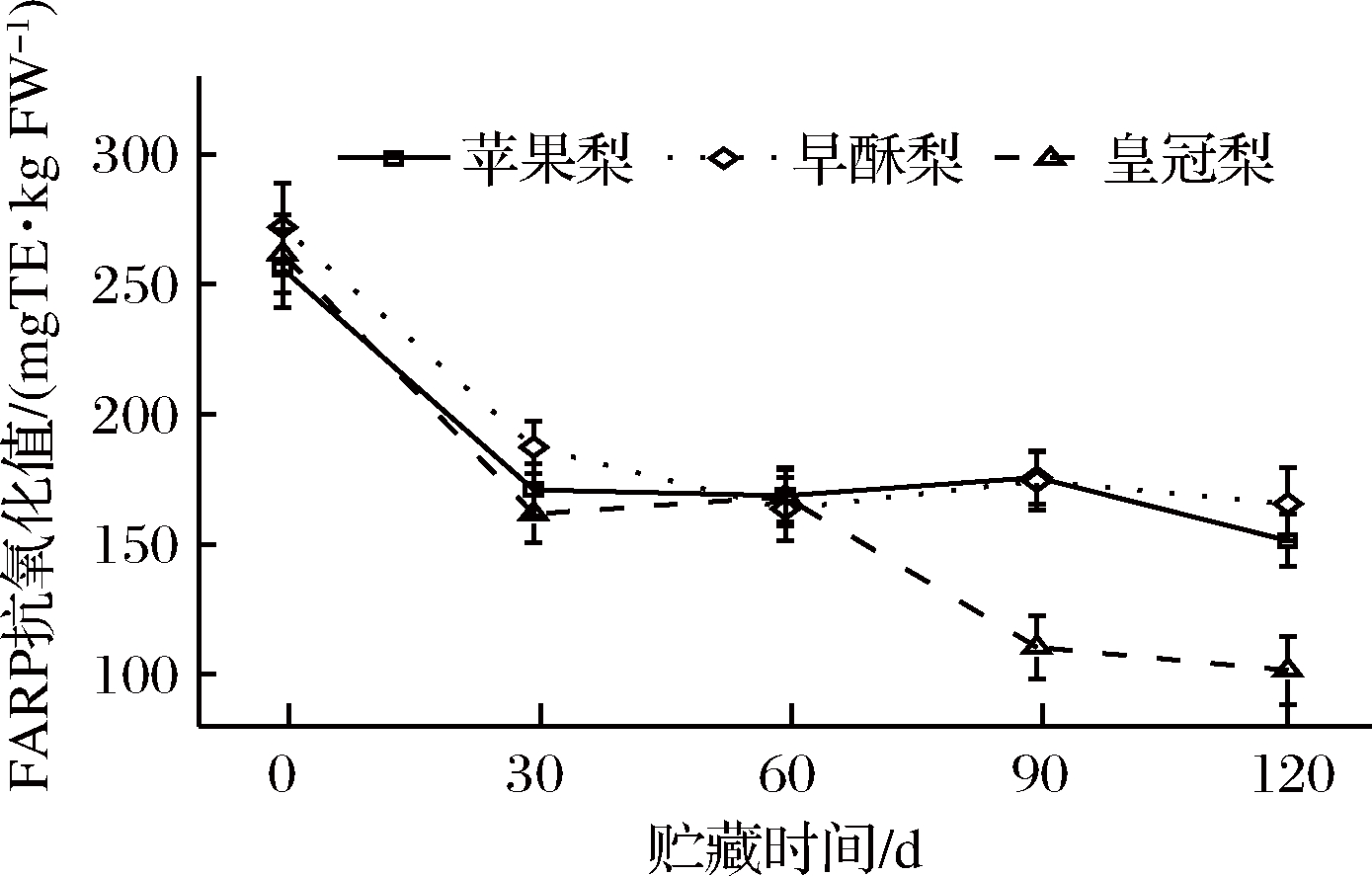
图7 低温贮藏期梨果皮FRAP抗氧化能力的测定
Fig.7 Changes in the value of FRAP during cold storage of three kinds of pear peel
2.3.2 抗氧化能力与酚类物质含量的相关性分析
由表1可知,3种梨果皮抗氧化能力均与酚类物质存在一定的相关关系,其中DPPH、ABTS+·清除速率、FRAP均与总酚含量呈极显著正相关(P<0.01),苹果梨抗氧化能力也与总黄酮含量极显著正相关(P<0.01),与芦丁含量显著正相关(P<0.05)。而皇冠梨抗氧化能力与阿魏酸含量极显著正相关(P<0.01),FRAP抗氧化能力与总黄酮含量极显著正相关(P<0.01),早酥梨DPPH自由基清除能力与总黄酮含量显著正相关(P<0.05),表明总酚、总黄酮、阿魏酸、芦丁是梨果皮抗氧化性的主要贡献者(表1)。
表1 低温贮藏期酚类物质含量与抗氧化活性的相关性
Table 1 Relationship between the phenolic contents and antioxidant capacity during cold storage
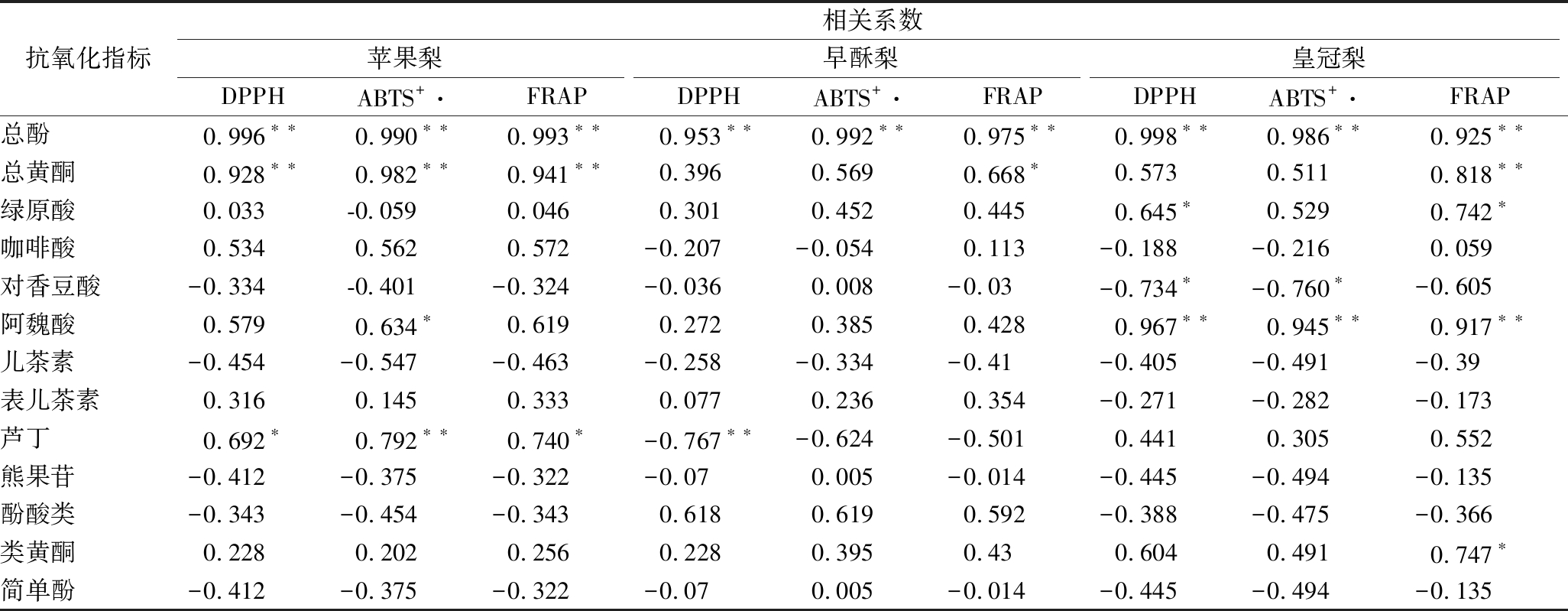
抗氧化指标相关系数苹果梨早酥梨皇冠梨DPPHABTS+·FRAPDPPHABTS+·FRAPDPPHABTS+·FRAP总酚0.996∗∗ 0.990∗∗ 0.993∗∗ 0.953∗∗ 0.992∗∗ 0.975∗∗ 0.998∗∗ 0.986∗∗ 0.925∗∗总黄酮0.928∗∗ 0.982∗∗ 0.941∗∗0.396 0.5690.668∗0.5730.511 0.818∗∗绿原酸0.033 -0.0590.0460.301 0.4520.445 0.645∗0.529 0.742∗咖啡酸0.534 0.5620.572-0.207-0.0540.113-0.188-0.216 0.059对香豆酸-0.334 -0.401-0.324-0.036 0.008-0.03-0.734∗-0.760∗-0.605阿魏酸0.579 0.634∗0.6190.272 0.3850.428 0.967∗∗ 0.945∗∗ 0.917∗∗儿茶素-0.454-0.547-0.463-0.258-0.334-0.41-0.405-0.491-0.39表儿茶素0.3160.1450.3330.077 0.2360.354-0.271-0.282-0.173芦丁0.692∗ 0.792∗∗ 0.740∗-0.767∗∗-0.624-0.5010.441 0.305 0.552熊果苷-0.412-0.375-0.322-0.07 0.005-0.014-0.445-0.494-0.135酚酸类-0.343-0.454-0.3430.618 0.6190.592-0.388-0.475-0.366类黄酮0.2280.202 0.2560.228 0.3950.430.604 0.4910.747∗简单酚-0.412-0.375-0.322-0.07 0.005-0.014-0.445-0.494-0.135
注:**表示为0.01的极显著水平;*表示为0.05的显著水平。
3 讨论
果实中的酚类物质含量会随贮藏期的延长而变化,且其变化规律因果实品种和贮藏环境而异[23-24]。本实验对8种主要酚类物质含量测定结果表明,3种梨果皮酚类物质中熊果苷含量均呈现最高,绿原酸次之,苹果梨、早酥梨和皇冠梨在贮藏期间果皮的熊果苷平均含量分别达到10.22、16.92和11.17 mg/g FW(图4),这与张小双等[25]的报道基本一致,他们发现在早酥梨和南果梨中,除果肉和果心外,其他部位含量最高的多酚均为熊果苷。3种梨果在低温贮藏期间果皮总酚均呈下降趋势(图1-A),该结果与毕阳等[26]对苹果梨、鸭梨和冬果梨中的研究一致,这可能是低温条件下,果实的生化反应程度减弱导致的。LI等[27]研究也发现黄冠梨的总酚含量在0和10 ℃冷藏10 d之后,呈下降趋势,而10 ℃贮藏的果实中总酚含量在第一个月保持较高的水平。在低温贮藏过程中早酥梨果皮的儿茶素和苹果梨、皇冠梨中的芦丁含量在贮藏期间呈升高趋势,其他主要酚类物质含量均随贮藏时间延长而下降(图2~图4),这一现象应该是梨果贮藏过程中果皮酚类物质之间的相互转化的结果。同时发现3个品种白梨皮中酚酸类物质绿原酸、咖啡酸、对香豆酸和阿魏酸含量在低温贮藏期间变化规律不同,这可能是由于不同品种梨果后熟过程中对果皮酚类物质代谢的调控机制存在差异或不同品种梨果响应低温进而介导果皮酚类物质转化的途径不同,但具体机理尚需进一步研究揭示(图2)。目前也有研究表明采后处理会影响梨果冷藏过程中酚类物质的变化[28]。KOU等[29]发现2% CaCl2浸泡和1%普鲁兰多糖涂层能有效延缓0 ℃冷藏的皇冠梨酚类化合物质的损失。也有研究报道外源二氢茉莉酸丙脂(PDJ)处理可以有效提升南果梨酚类代谢水平,对果皮中黄酮醇含量及果肉中黄烷醇、熊果苷含量有显著促进作用,从而提高果实的保健功能性[30]。
酚类物质具有较强的自由基清除能力[31-32]。大量研究表明,植物的抗氧化能力在很大程度上取决于其酚类物质的种类和含量[33-35]。为了更全面揭示酚类物质的抗氧化效果,可采用多种方法来评价样品的抗氧化能力[36]。KOLNIAK-OSTEK[14]使用DPPH和FRAP方法测定梨果皮的潜在抗氧化能力,“Radana”和“Bonkreta”表现出较高的活性化合物浓度和抗氧化能力,“Uta”品种的抗氧化能力最低。同样有研究评估了10个梨品种间抗氧化能力的差异性,在FRAP测定方法中,金秋梨果皮提取物抗氧化能力最强,而在DPPH方法中,鸭广梨、红啤梨和青啤梨的提取物抗氧化能力最高[37],表明不同的测定方法评价样品的抗氧化能力得到的结果存在差异性。本研究采用了ABTS+·、DPPH和FRAP 3种方法系统评价了梨果皮酚类提取物对自由基的清除能力,发现3种梨果皮均具有一定的抗氧化能力,但其抗氧化能力均在第一个月迅速下降(图5~图7),可见3种梨果皮均可作为天然抗氧化物质的主要来源,且鲜食能够更好地利用其抗氧化特性。已有大量研究表明,果蔬的抗氧化能力受总酚和总黄酮含量的影响较大,特别是总酚含量与其抗氧化能力具有非常显著的相关关系[27,38-39]。与本研究相关性分析结果类似,在低温贮藏期间3种梨果皮抗氧化能力均与总酚呈极显著相关,部分抗氧化指标与总黄酮、阿魏酸和芦丁含量也呈显著正相关性(表1)。而梨果皮酚类物质含量测定结果表明,熊果苷和绿原酸的含量较高,但这两种物质均与抗氧化能力没有明显的正相关,说明这两种物质对于梨果抗氧化能力没有明显的贡献,而是影响梨果的其他品质特性。
4 结论
低温贮藏期间3种梨果皮总酚和总黄酮均呈降低趋势,且在贮藏第一个月迅速下降,其中早酥梨果皮总黄酮含量在贮藏期保持在较高水平。贮藏期间8种主要酚类物质含量存在较大差异,除了早酥梨中儿茶素和苹果梨、皇冠梨中芦丁含量在贮藏期间呈升高趋势外,其他主要酚类物质含量均随贮藏时间延长而下降。3种梨果皮均表现出较高的抗氧化能力,但不同的抗氧化评价方法得到的结果存在一定差异,且抗氧化能力均在第一个月迅速下降;相关性分析表明,3种梨果皮抗氧化活性与总酚、总黄酮和阿魏酸含量存在显著正相关关系(P<0.05)。可见,梨果皮酚类物质含量因品种、贮藏条件和时间而不同,因此系统掌握了梨果皮酚类物质的变化规律及调控机制,可为梨果皮功能成分开发及综合利用提供理论依据。
[1] 吴小华, 颉敏华,陈柏,等. GA_3处理对黄冠梨采后常温贮藏品质变化及病害发生的影响[J]. 甘肃农业科技, 2019(3): 11-17.
[2] 孙琰, 马捷,张静荣,等. 三个主栽白梨品种鲜切后品质及微生物变化的比较[J]. 食品与发酵科技, 2018, 54(2): 41-47;86.
[3] JIMÉNEZ-AGUILAR D, ![]() H, WELTI-CHANES J. Phytochemical characterization of prickly pear (Opuntia spp) and of its nutritional and functional properties: a review[J]. Current Nutrition & Food Science, 2014, 10(1): 57-69.
H, WELTI-CHANES J. Phytochemical characterization of prickly pear (Opuntia spp) and of its nutritional and functional properties: a review[J]. Current Nutrition & Food Science, 2014, 10(1): 57-69.
[4] KOLNIAK-OSTEK J, OSZMIANSKI J. Characterization of phenolic compounds in different anatomical pear (Pyrus communis L) parts by ultra-performance liquid chromatography photodiode detector-quadrupole/time of flight-mass spectrometry (UPLC-PDA-Q/TOF-MS)[J]. International Journal of Mass Spectrometry, 2015, 392: 154-163.
[5] SOTO-VACA A, GUTIERREZ A, LOSSO J N, et al. Evolution of phenolic compounds from color and flavor problems to health benefits[J]. Journal of Agricultural and Food Chemistry, 2012, 60(27): 6 658-6 677.
[6] 夏乐晗, 陈玉玲,冯义彬,等. 不同品种杏果实发育过程中类黄酮、总酚和三萜酸含量及抗氧化性研究[J]. 果树学报, 2016, 33(4): 425-435.
[7] JARAMILLO S, LOPEZ S, VARELA L M, et al. The flavonol isorhamnetin exhibits cytotoxic effects on human colon cancer cells[J]. Journal of Agricultural and Food Chemistry, 2010, 58(20): 10 869-10 875.
[8] 郭海丽. 梨皮化学成分的LC-MS和NMR研究[D]. 武汉:华中师范大学, 2014.
[9] 李丽梅, 赵哲,何近刚,等. 不同品种梨果实酚类物质和抗氧化性能分析[J]. 食品科学, 2014, 35(17): 83-88.
[10] 李磊, 寇晓虹. 黄冠梨储藏期间果皮酚类物质代谢与鸡爪病发生的关系[J]. 河南工业大学学报(自然科学版), 2011, 32(4): 74-79.
[11] RIVERO R M, RUIZ J M, GARC A P C, et al. Resistance to cold and heat stress: accumulation of phenolic compounds in tomato and in watermelon plants[J]. Plant Science, 2001, 160(2): 315-321.
A P C, et al. Resistance to cold and heat stress: accumulation of phenolic compounds in tomato and in watermelon plants[J]. Plant Science, 2001, 160(2): 315-321.
[12] 周广志, 鲁敏,安华明. 刺梨果实发育过程中主要活性物质含量及其抗氧化性分析[J]. 食品科学, 2018, 39(22): 20-25.
[13] GUAN J F, HE J G, SHEN C G, et al. Chapter 17-how cultivars influence fruit composition: total phenols, flavonoids contents, and antioxidant activity in the pulp of selected Asian pears[M]. Processing and Impact on Active Components in Food, 2015:139-145.
[14] KOLNIAK-OSTEK J. Content of bioactive compounds and antioxidant capacity in skin tissues of pear[J]. Journal of Functional Foods, 2016, 23: 40-51.
[15] 翟锐, 房晨,范二婷,等. ‘早酥’梨及其红皮芽变‘红早酥’梨类黄酮组分变化与合成模式研究[J]. 果树学报, 2016, 33(S1): 75-82.
[16] 李磊, 谢冰,寇晓虹. 高效液相色谱-串联质谱测定黄冠梨果皮中主要酚类物质[J]. 食品工业, 2012, 33(5): 132-135.
[17] SINGLETON V L, ORTHOFER R, LAMUELA-RAVENTóS R M. Analysis of total phenols and other oxidation substrates and antioxidants by means of folin-ciocalteu reagent[J]. Methods in Enzymology, 1999, 299: 152-178.
[18] DEWANTO V, WU X, ADOM K K, et al. Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity[J]. Journal of Agricultural and Food Chemistry, 2002, 50(10): 3 010-3 014.
[19] JIA Z S, TANG M C, WU J M. The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals[J]. Food Chemistry, 1999, 64(4): 555-559.
[20] LOCATELLI M, GINDRO R, TRAVAGLIA F, et al. Study of the DPPH-scavenging activity: development of a free software for the correct interpretation of data[J]. Food Chemistry, 2009, 114(3): 889-897.
[21] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine, 1999, 26(9-10): 1 231-1 237.
[22] BENZIE I F, STRAIN J J. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: the FRAP assay[J]. Analytical Biochemistry, 1996, 239(1): 70-76.
[23] CHENG Y, LIU L, ZHAO G, et al. The effects of modified atmosphere packaging on core browning and the expression patterns of PPO and PAL genes in “Yali” pears during cold storage[J]. LWT-Food Science and Technology, 2015, 60(2): 1 243-1 248.
[24] OCHOA-VELASCO C E, GUERRERO-BELTRAN J A. The effects of modified atmospheres on prickly pear (Opuntia albicarpa) stored at different temperatures[J]. Postharvest Biology and Technology, 2016, 111: 314-321.
[25] 张小双, 郑迎春,曹玉芬,等. ‘早酥’和‘南果梨’16个部位多酚物质组成及含量分析[J]. 中国农业科学, 2017, 50(3): 545-555.
[26] 毕阳, 郭玉蓉,李永才,等. 冷藏期间三种梨果皮中酚类物质含量及多酚氧化酶活性变化与褐变度的关系[J]. 制冷学报, 2002(4): 52-54.
[27] LI D, CHENG Y, DONG Y, et al. Effects of low temperature conditioning on fruit quality and peel browning spot in “Huangguan” pears during cold storage[J]. Postharvest Biology and Technology, 2017, 131: 68-73.
[28] CHENG Y D, LIU L Q, FENG Y X, et al. Effects of 1-MCP on fruit quality and core browning in “Yali” pear during cold storage [J]. Scientia Horticulturae, 2019, 243: 350-356.
[29] KOU X, WU M, LI L, et al. Effects of CaCl2 dipping and pullulan coating on the development of brown spot on “Huangguan” pears during cold storage[J]. Postharvest Biology and Technology, 2015, 99: 63-72.
[30] 商叶, 汪晓谦,刘洋,等. 采后PDJ处理对‘南果梨’果实酚类物质含量变化的影响[J]. 中国果树, 2017, (S1): 66-69;86.
[31] DAI J, MUMPER R J. Plant phenolics: extraction, analysis and their antioxidant and anticancer properties[J]. Molecules, 2010, 15(10): 7 313-7 352.
[32] SCALBERT A, MANACH C, MORAND C, et al. Dietary polyphenols and the prevention of diseases[J]. Critical Reviews in Food Science and Nutrition, 2005, 45(4): 287-306.
[33] SILVA F G D, O’CALLAGAHAN Y, O’BRIEN N M, et al. Antioxidant capacity of flaxseed products: the effect of in vitro digestion[J]. Plant Foods for Human Nutrition, 2012, 68(1): 24-30.
[34] MANGANARIS G A, GOULAS V, VICENTE A R, et al. Berry antioxidants: small fruits providing large benefits[J]. Journal of the Science of Food and Agriculture, 2014, 94(5): 825-833.
[35] DEBHI F, HASIB A, BOUAZIZ M, et al. Effects of phenolic compounds and betalain pigments on the antioxidant capacity of Moroccan prickly pear juices[J]. Nature & Technology, 2013, 9: 2-7.
[36] AWIKA J M, ROONEY L W, WU X, et al. Screening methods to measure antioxidant activity of sorghum (Sorghum bicolor) and sorghum products[J]. Journal of Agricultural and Food Chemistry, 2003, 51(23): 6 657-6 662.
[37] LI X, WANG T, ZHOU B, et al. Chemical composition and antioxidant and anti-inflammatory potential of peels and flesh from 10 different pear varieties (Pyrus spp)[J]. Food Chemistry, 2014, 152: 531-538.
[38] CHU Y H, CHANG C L, HSU H F. Flavonoid content of several vegetables and their antioxidant activity[J]. Journal of the Science of Food & Agriculture, 2000, 80(5): 561-566.
[39] DU G, LI M, MA F, et al. Antioxidant capacity and the relationship with polyphenol and vitamin C in Actinidia fruits[J]. Food Chemistry, 2009, 113(2): 557-562.