2016年我国水产品的总产量为4 920万t,居世界首位[1]。但由于虾体内富含水分及蛋白质,在加工贮藏过程中极易腐败变质,尤其是发生黑变[2]。黑变是由于虾体内富含的多酚氧化酶(polyphenoloxidase,PPO)使表面酪氨酸等色原物质发生氧化,经过一系列生化反应生成了黑色素[3]。
水产品添加剂的使用直接关系到产品的质量安全。长期以来,我国普遍依赖亚硫酸盐来抑制虾类黑变的发生[4]。但是,亚硫酸盐的使用容易引发食品安全问题[5-6]。欧盟、日本等都严格规定了虾肉中SO2残留不得超过0.1 mg/g[7]。另外,发达国家已率先研发出相对安全的4-己基间苯二酚(4-Hexylresorcinol,4-HR)来抑制虾类黑变的发生[8]。这可能会成为影响我国海水虾类出口的重大技术壁垒。因此,引进国外海水虾酚酶抑制剂,研发不同食品添加剂的协同防黑变新技术,对于解决产品质量安全,提升我国水产品国际市场竞争力,增加渔民收入和渔业增效具有十分重要的意义。
本文针对包括前期研究的4种主要的酚酶抑制剂成分:4-HR、柠檬酸、抗坏血酸以及乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA-2Na),分析影响多酚氧化酶活力的主因子及双因子效应,用降维法得出偏回归解析子模型,对酶活抑制效果寻优;研究了2种抑制因子对海水虾酶促褐变的抑制效果以及抑制类型,通过分子动力学模型探究复合抑制剂的抑制机理。
1 材料与方法
1.1 材料与试剂
4-己基间苯二酚(4-Hexylresorcinol,4-HR)、L-抗坏血酸(食品级)、左旋多巴(Levodopa,L-DOPA)(分析纯),美国Sigma-Aldrich公司;丙酮、KH2PO4、K2HPO4、无水(NH4)2SO4等(分析纯)、Tris-HCl缓冲液,上海国药集团化学试剂有限公司。
1.2 海水虾多酚氧化酶的制备
选择东海区海捕虾主要品种中华管鞭虾为研究对象,其多酚氧化酶的制备采用XIANG[9]的方法。
1.3 方法
1.3.1 不同抑制因子组合的交互作用试验设计
采用丁希泉[10]的方法稍作修改。以4-HR、柠檬酸、抗坏血酸与EDTA-2Na作为抑制因子,目标函数为多酚氧化酶活力,结合酚酶抑制特性研究的相关文献,设计如表1所示的因素水平表。每个水平的抑制因子先配制成一定浓度的50 mL处理液备用。
1.3.2 PPO酶活力测定方法
参照NIRMAL[11]的方法并略有改进。以L-DOPA为特异性底物,将相应浓度的处理液1 mL与0.5 mL的L-DOPA混合均匀,再加入0.5 mL PPO以及1 mL Tris-HCL缓冲液,45 ℃保温10 min,再加入预冷的纯水3 mL,混匀后在490 nm波长处测定吸光度变化,测定6 min,每1 min吸光值增加0.001定义为1个酶活力单位。
表1 效应分析中参试抑制因子水平编码表 单位:mmol/L
Table 1 Level coding table of the inhibition factor in effect analysis
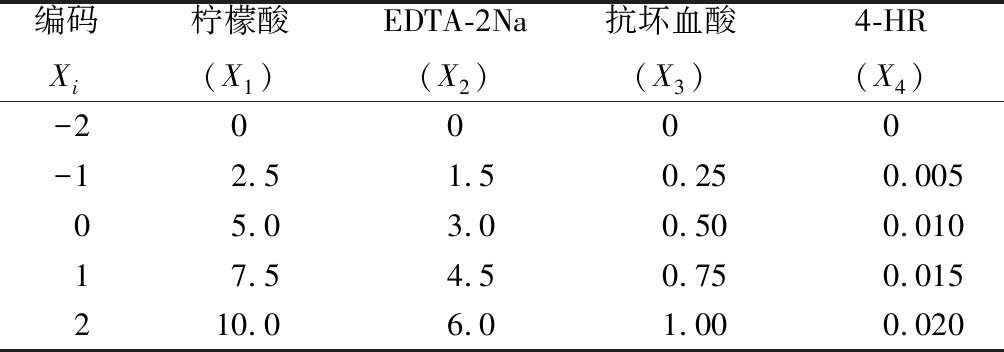
编码Xi柠檬酸(X1)EDTA-2Na(X2)抗坏血酸(X3)4-HR(X4)-20000-12.51.50.250.00505.03.00.500.01017.54.50.750.015210.06.01.000.020
1.4 多酚氧化酶活力抑制因子的抑制机理
1.4.1 抑制因子对多酚氧化酶活力的抑制作用
将新提取的酶液与不同浓度的抑制因子混合,然后在冰箱中4 ℃静置0.5 h,2种抑制因子在反应体系中的终浓度如下:EDTA-2Na为0、0.6、1.0、1.4、1.8 g/L,柠檬酸为0、1、3、5、7 g/L,再加入0.01 mol/L的L-DOPA为底物。酶活测定方法同1.3.2,空白对照组以1 mL超纯水代替抑制因子。酶被抑制因子处理前后酶活性变化以剩余酶活百分比表示。酶促反应体系达到稳定态后,吸光度随时间延长的线性段直线外推得到的横截距为迟滞时间。
1.4.2 抑制因子对多酚氧化酶活性的抑制类型
以L-DOPA为底物,在不同底物浓度下,测定不同浓度的EDTA-2Na与柠檬酸对PPO酶活的抑制效果。以Lineweaver-Burk双倒数作图,判断不同抑制剂的抑制类型。其中L-DOPA底物的浓度均为0.001、0.003、0.005、0.008、0.010 mol/L,酶活测定方法同1.3.2。
1.5 抑制因子的分子结构化学动力学研究
采用ChemBioOffice Ultra软件,利用分子动力学模型MM2力场,基于量子化学的分子动力学计算方法对酶抑制反应路径进行多次模拟优化,利用密度泛函理论计算各反应路径中稳态和过渡态的结构和能量,并对分子模拟结果进行验证[12-15]。依此预测各抑制动力学流程及产物结构变化特征,探讨2种抑制因子的抑制机理。
1.6 统计分析
试验数据采用SPSS 19.0软件进行显著性分析,正交试验结果采用Design Expert 8.0.6统计分析软件进行数据处理,采用Excel 2007软件绘图。采用ChemBioOffice Ultra软件进行分子动力学模拟计算,并绘制反应流程图及结构变化示意图。
2 结果与分析
2.1 不同抑制因子组合对甲壳类多酚氧化酶活力的影响
按表1中参试抑制因子水平进行多酚氧化酶酶活抑制试验,试验和分析结果见表2和表3。
表2 各参试因子试验结构矩阵及测试结果
Table 2 Structure matrix and results of each test
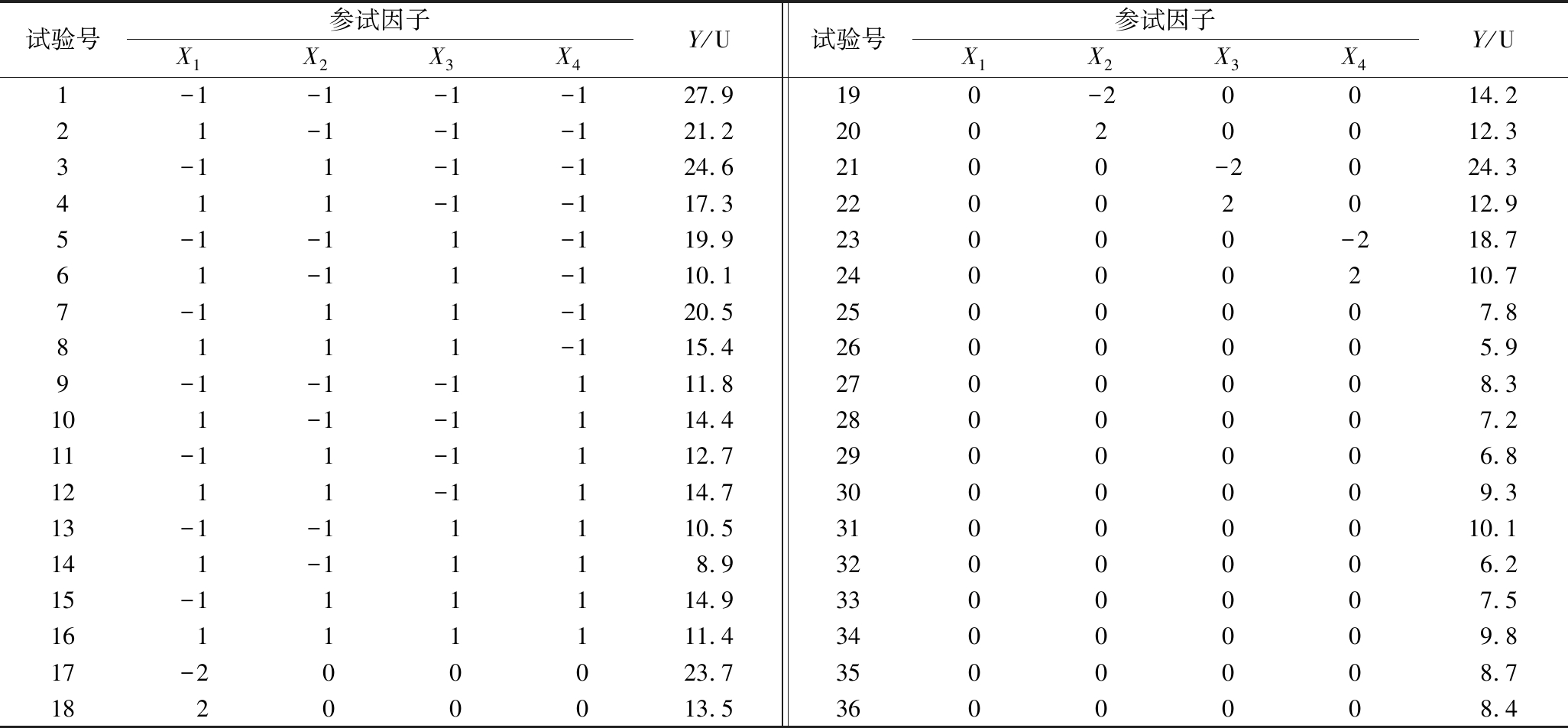
试验号参试因子X1X2X3X4Y/U试验号参试因子X1X2X3X4Y/U1-1-1-1-127.9190-20014.221-1-1-121.220020012.33-11-1-124.62100-2024.3411-1-117.322002012.95-1-11-119.923000-218.761-11-110.124000210.77-111-120.52500007.88111-115.42600005.99-1-1-1111.82700008.3101-1-1114.42800007.211-11-1112.72900006.81211-1114.73000009.313-1-11110.531000010.1141-1118.93200006.215-111114.93300007.516111111.43400009.817-200023.73500008.718200013.53600008.4
表3 回归分析结果
Table 3 Results of regression analysis

来源平方和自由度均方F值P值来源平方和自由度均方F值P值X1-2.075 010.342 736.656 5<0.000 1X3X41.075 010.419 76.559 00.018 2X20.125 010.342 70.133 00.719 0X212.604 210.296 876.982 4<0.000 1X3-2.325 010.342 746.021 5<0.000 1X221.266 710.296 818.212 90.000 3X4-3.066 710.342 780.066 0<0.000 1X232.604 210.296 876.982 4<0.000 1X1X20.100 010.419 70.056 80.814 0X241.629 210.296 830.129 0<0.000 1X1X3-0.662 510.419 72.491 10.129 4残差59.20212.82X1X41.775 010.419 717.882 20.000 4失拟项39.10103.912.140.1140X2X31.175 010.419 77.836 10.010 7纯误差20.10111.83X2X40.587 510.419 71.959 00.176 2总离差1 192.3535
表2中的响应值经回归拟合后,得回归方程:![]() 其中失拟不显著说明该模型能很好地拟合多酚氧化酶活力与参试因子之间的关系。X1、X3、X4在0.001水平上有显著性差异,说明柠檬酸、抗坏血酸、4-HR对多酚氧化酶的活力有极显著的抑制作用;X1X4在0.001水平上有显著性差异,X3X4、X2X3在0.01水平上有显著性差异,说明柠檬酸与4-HR、抗坏血酸与4-HR、EDTA-2Na与抗坏血酸间存在显著的交互作用。
其中失拟不显著说明该模型能很好地拟合多酚氧化酶活力与参试因子之间的关系。X1、X3、X4在0.001水平上有显著性差异,说明柠檬酸、抗坏血酸、4-HR对多酚氧化酶的活力有极显著的抑制作用;X1X4在0.001水平上有显著性差异,X3X4、X2X3在0.01水平上有显著性差异,说明柠檬酸与4-HR、抗坏血酸与4-HR、EDTA-2Na与抗坏血酸间存在显著的交互作用。
2.2 影响多酚氧化酶活力的主因子效应分析
用降维法可得出各参试组分对甲壳类多酚氧化酶活力影响的偏回归解析子模型如下:![]() 从线性项看,4种抑制剂中,对多酚氧化酶活力的影响作用从大到小依次为4-HR、抗坏血酸、柠檬酸和EDTA-2Na;从二次项看,4种抑制剂中,对多酚氧化酶活力的抑制作用从大到小依次为抗坏血酸、柠檬酸、4-HR和EDTA-2Na。当柠檬酸、EDTA-2Na、抗坏血酸、4-HR分别在编码值为0.398,-0.051,0.446,0.942时,酶活性取得最小值,此时它们的质量浓度分别为6.00,1.58,0.61,0.015 mg/mL(表4)。
从线性项看,4种抑制剂中,对多酚氧化酶活力的影响作用从大到小依次为4-HR、抗坏血酸、柠檬酸和EDTA-2Na;从二次项看,4种抑制剂中,对多酚氧化酶活力的抑制作用从大到小依次为抗坏血酸、柠檬酸、4-HR和EDTA-2Na。当柠檬酸、EDTA-2Na、抗坏血酸、4-HR分别在编码值为0.398,-0.051,0.446,0.942时,酶活性取得最小值,此时它们的质量浓度分别为6.00,1.58,0.61,0.015 mg/mL(表4)。
表4 主因子效应值
Table 4 Principal factor effect value
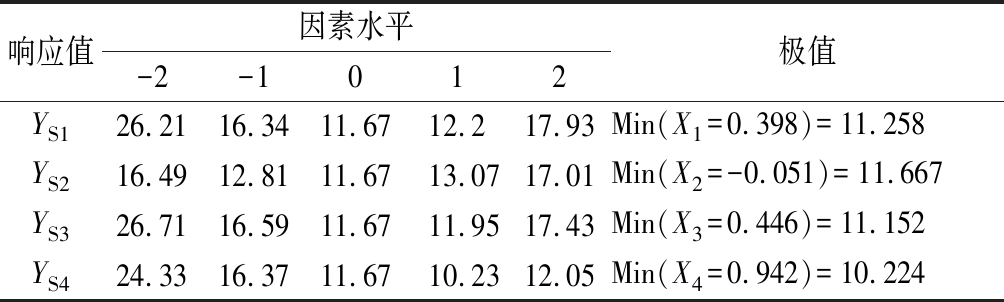
响应值因素水平-2-1012极值YS126.2116.3411.6712.217.93Min(X1=0.398)=11.258YS216.4912.8111.6713.0717.01Min(X2=-0.051)=11.667YS326.7116.5911.6711.9517.43Min(X3=0.446)=11.152YS424.3316.3711.6710.2312.05Min(X4=0.942)=10.224
2.3 响应面曲面分析
通过响应曲面分析得到X1X4、X3X4、X2X3的偏回归解析子模型为:
YS1-4=![]()
YS3-4=![]()
YS2-3=![]()
图1是模型的响应曲面,从中可以直观地看出,当柠檬酸和抗坏血酸的用量处于低编码值水平时,随着4-HR用量的增加,酶活力下降;当柠檬酸和抗坏血酸处于较高编码水平时,4-HR浓度的提高却最终导致酶活力有增加趋势,说明高浓度的柠檬酸将显著削弱4-HR的作用效果。当EDTA-2Na处于较低编码值水平时,随着抗坏血酸用量的增加,酶活力下降;但当EDTA-2Na处于较高编码水平时,抗坏血酸导致酶活性的下降趋势缓慢,说明高浓度的EDTA-2Na对抗坏血酸的抑制效果有削弱作用。
2.4 酶活抑制效果的模拟寻优
采用数学模拟对响应面进行分析的结果表明,当4-HR、抗坏血酸、柠檬酸、EDTA-2Na的质量浓度分别为0.46~0.68、0.01~0.018、4.85~7.20、1.58~2.90 mg/mL时,多酚氧化酶的酶活可抑制在14以下,抑制率达60%以上。
2.5 多酚氧化酶的抑制机理
2.5.1 抑制剂对多酚氧化酶酶促反应的影响
从图2可以看出,随着柠檬酸和EDTA-2Na质量浓度的增加,多酚氧化酶的催化活性均逐渐降低。在反应中没有抑制剂时,反应的迟滞时间分别为126.34、135.23 s;当体系中柠檬酸和EDTA-2Na质量浓度分别达到1.8 g/L时,酶的活力均降至45.8%,迟滞时间分别达到1094.65 s和1186.65 s。吕敏等也发现,在多种抑制剂中,柠檬酸和EDTA对中华管鞭虾PPO活性抑制作用较强[16]。
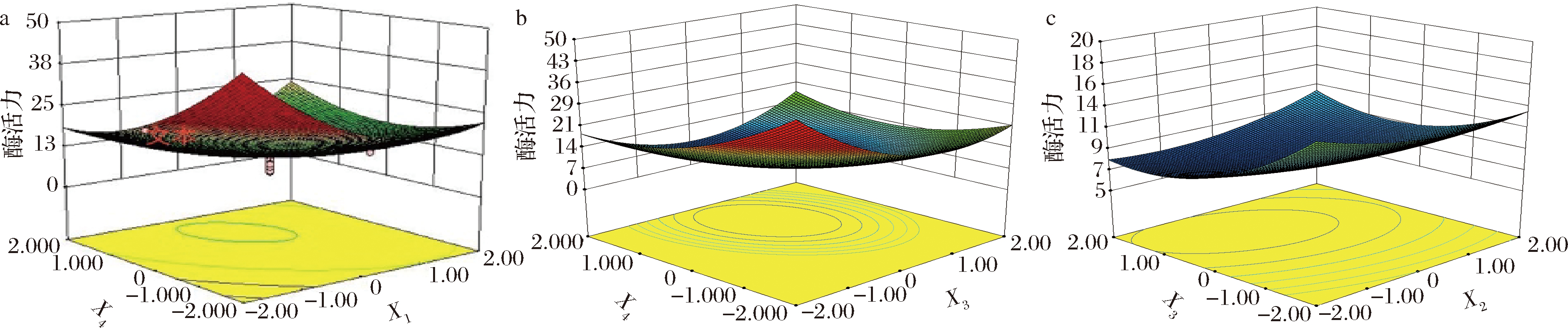
a-柠檬酸(X1)与4-HR(X4)的双因子效应分析;b-抗坏血酸(X3)与4-HR(X4)的双因子效应分析; c-EDTA-2Na(X2)与抗坏血酸(X3)的双因子效应分析
图1 各因素交互作用等高线和响应面
Fig.1 Response surfaces of the pairwise interactive effects of four extraction

图2 抑制因子对多酚氧化酶的酶活力和迟滞时间的影响
Fig.2 Effects of inhibiting factor on the enzyme activity and hysteresis time of phenol oxidase
2.5.2 抑制剂对多酚氧化酶的抑制类型
从图3可以看出,柠檬酸与EDTA-2Na抑制PPO催化底物的反应中,反应的最大速率不变,但是米氏常数随抑制剂浓度的增大而增大,说明2种因子同底物竞争性地与酶结合。
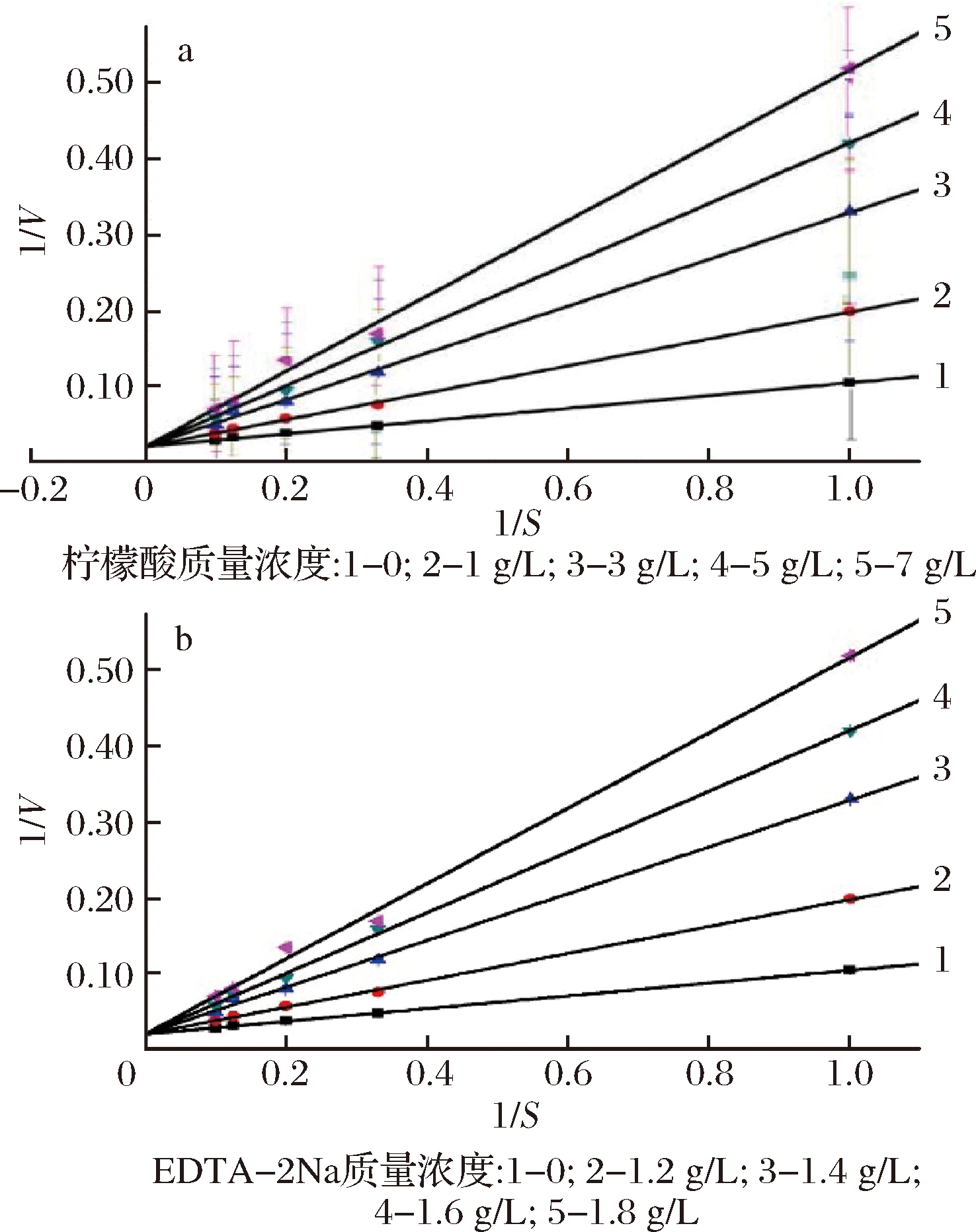
a-柠檬酸对多酚氧化酶的抑制类型Lineweaver-Burk作图;b-EDTA-2Na对多酚氧化酶的抑制类型Lineweaver-Burk作图
图3 柠檬酸以及EDTA-2Na对多酚氧化酶的抑制类型
Fig.3 Effect of citric acid on phenol oxidase
2.6 两种抑制因子抑制机理探讨
多酚氧化酶是多亚基的含铜金属酶,每个亚基含2个金属铜离子,它们分别与蛋白质分子中2个平展的组氨酸和1个弱的直立组氨酸配体结合,另有1个内源桥基将2个铜离子联系在一起,构成多酚氧化酶催化氧化反应活性中心[17]。根据分子轨道理论,柠檬酸和EDTA-2Na与多酚氧化酶结合的稳态最小能量为458、450 kcal/mol,而这一能量数值与底物邻苯二酚(463 kcal/mol)相近,表明柠檬酸和EDTA-2Na与邻苯二酚可能构成直接竞争关系。
柠檬酸羧基活性高,可与多酚氧化酶结合。同时,该类络合物既能发生分子内络合,也可与另一个柠檬酸分子实现分子间络合。这两类反应都具有很低的络合能量(122~139 kcal/mol),生成的化合物较为稳定。因此,柠檬酸与多酚氧化酶活性体生成的高稳定性单体会降低多酚氧化酶与底物的接触浓度,从而发挥抑制作用。由于柠檬酸抑制体系是分子力学上动态的可逆反应,体系的反应程度有限,所以柠檬酸只能发挥有限的抑制作用,并不能彻底防止黑变的发生。当EDTA-2Na分子上一个羧基与多酚氧化酶络合后,该分子上的另一个羧基更倾向于与多酚氧化酶络合,因为这种络合态能量更低(分子内络合能量值为167 kcal/mol,而分子间络合能量值为197 kcal/mol)。由于EDTA-2Na易解离和接受氢离子,氢离子浓度对EDTA-2Na的络合影响很大,通过调节氢离子的浓度可以实现EDTA-2Na的可逆络合反应。EDTA-2Na与柠檬酸的作用机理类似,体系的反应程度有限,仅能够有限地抑制黑变的发生。
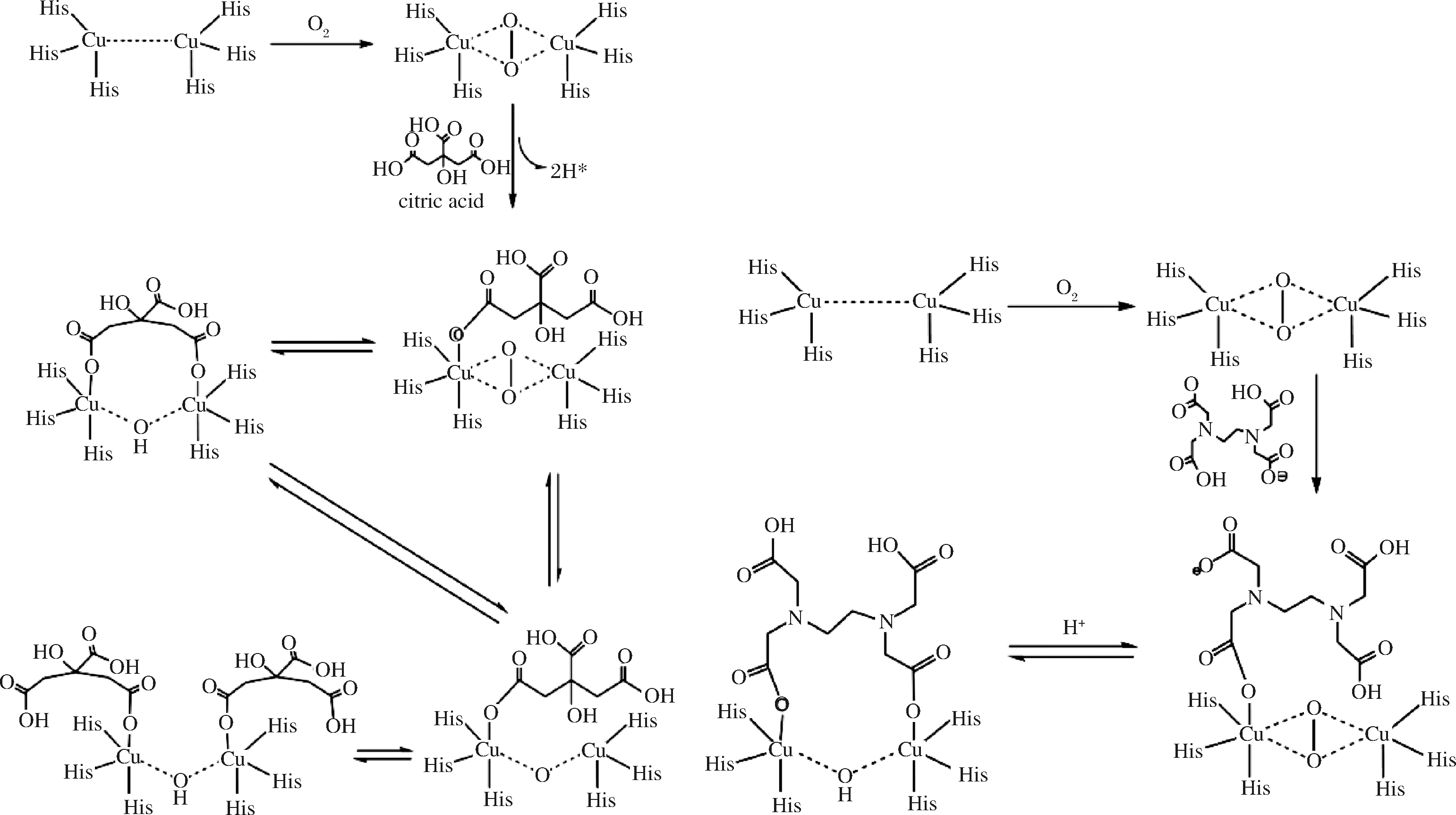
图4 柠檬酸与EDTA-2Na抑制多酚氧化酶化学原理图
Fig.4 Chemical schematic diagram of citric acid and EDTA-2Na inhibiting phenol oxidase
2.7 复合抑制剂对多酚氧化酶抑制机理分析
2.7.1 4-HR与抗坏血酸的抑制机理[18-20]
4-HR、抗坏血酸均能抑制海水虾多酚氧化酶活性。它们与PPO双铜活性中心的初始结合能量较低,通过竞争性结合活性中心发挥抑制效果。在反应过程中,4-HR与PPO会生成一种高稳定络合物,持续有效地消耗PPO,降低酶与底物的接触浓度,在较大程度上抑制黑变。抗坏血酸则存在2种作用机制,一方面能通过与多酚氧化酶活性中心络合,直接对PPO酶产生抑制作用;另一方面能通过还原中间产物醛类,抑制黑色素的生成。
2.7.2 抑制因子交互作用机理分析
复合抑制剂主要作用组分之间存在交互效应,其中低浓度的柠檬酸、抗坏血酸与4-HR存在一定的正交作用;而高浓度的柠檬酸、抗坏血酸会削弱4-HR的抑制效果。柠檬酸与抗坏血酸酸性较强,容易解离出氢离子,可作为较强的亲核试剂进攻多酚氧化酶活性中心。同时,它们的结构变型性好、空间位阻小,更容易与多酚氧化酶结合,这一点可以从分子力场轨道模型的最小稳态能量得到体现(柠檬酸、抗坏血酸、4-HR与酶结合的最小能量分别是458、461和463 kcal/mol)。同时,柠檬酸和抗坏血酸的结合是可逆的,所以在高浓度条件下,它们会降低4-HR与多酚氧化酶的接触浓度从而削弱4-HR的抑制效果。至于高浓度EDTA-2Na对抗坏血酸的抑制作用也有削弱效果,可能由于高浓度的EDTA-2Na与抗坏血酸较强的氢键络合作用降低了抗坏血酸与多酚氧化酶的接触浓度。
2.7.3 复合抑制剂抑制机理探讨
4种抑制因子与多酚氧化酶双铜活性中心的初始结合能量大小接近,均易与多酚氧化酶活性中心结合,起到抑制效果。其中4-HR几乎不可逆地与多酚氧化酶结合,持续有效地消耗多酚氧化酶,较大程度上抑制黑变。而抗坏血酸、柠檬酸和EDTA-2Na与多酚氧化酶则形成动力学上的可逆平衡,因此只能在一定程度上抑制黑变。
在复配体系中,4-HR的溶解是一个动态平衡过程,其他组分的存在,有利于提高4-HR的离子化水平,保障其有效作用浓度。同时抗坏血酸、柠檬酸与EDTA-2Na均呈酸性,可解离出一定浓度的氢离子,适量氢离子的存在,能增强4-HR与其他组分的氢键配位络合效应,进而提高4-HR的水溶性。
综上所述,复合抑制剂中4-HR通过与多酚氧化酶形成高稳定的络合物来主导抑制效果,适量柠檬酸、抗坏血酸、EDTA-2Na的存在,既可通过铜络合发挥抑制作用,也可提高4-HR的氢键配位络合能,从而实现复合抑制剂的高抑制效果。
3 结论
(1)4种抑制剂的抑制能力从大到小依次为4-HR、抗坏血酸、柠檬酸和EDTA-2Na。高浓度的柠檬酸、抗坏血酸将显著削弱4-HR的作用效果,高浓度EDTA-2Na也会削弱抗坏血酸的抑制效果。当4-HR、抗坏血酸、柠檬酸、EDTA-2Na的质量浓度分别为0.01~0.018、0.46~0.68、4.85~7.20、1.58~2.90 mg/mL时,复合抑制剂的抑制率达60%以上。
(2)4种因子均同底物竞争性地与酶结合。复合抑制剂中4-HR通过与多酚氧化酶形成高稳定的络合物来主导抑制效果,适量柠檬酸、抗坏血酸、EDTA-2Na的存在,既可通过铜络合发挥抑制作用,也可提高4-HR的氢键配位络合能,从而实现复合抑制剂的高抑制效果。但在高浓度条件下,柠檬酸和抗坏血酸会降低4-HR与多酚氧化酶的接触程度,从而对4-HR抑制作用起到了削弱效果。
[1] FAO. Fishery and aquaculture statistics[M]. Rome,Italy: 2018.
[2] 凌萍华, 谢晶. 冰温技术结合保鲜剂对南美白对虾品质的影响[J]. 食品科学, 2010,31(14):280-284.
[3] NIRMAL N P, BENJAKUL S, AHMAD M, et al. Undesirable enzymatic browning in crustaceans: Causative effects and its inhibition by phenolic compounds[J]. Critical Reviews in Food Science and Nutrition, 2015,55(14):1 992-2 003.
[4] 励建荣, 李学鹏,周凯,等. 我国虾类产品中亚硫酸盐的安全性评价[J]. 食品安全质量检测学报, 2014(8):2 295-2 301.
[5] 吕艳芳,魏春娇,王娇,等,南美白对虾酚氧化酶的提取及生化特性[J]. 食品科学, 2014(7):113-117.
[6] 孟紫强. 二氧化硫毒理学和生理学研究进展[C]//中国毒理学会第六届全国毒理学大会.广东广州,2013:369.
[7] WARNER C R, DIACHENKO G W, BAILEY C J. Sulfites: an important food safety issue[J]. Food Testing and Analysis, 2000,6(4):8-10.
[8] REIST M, JENNER P, HALLIWELL B. Sulphite enhances peroxynitrite-dependent alpha1-antiproteinase inactivation. A mechanism of lung injury by sulphur dioxide[J]. FEBS Lett, 1998,423(2):231-234.
[9] 凌关庭. 4-己基间苯二酚(4HR)-一种能抑制褐变的新型抗氧护色剂[J]. 食品工业, 1997(3):19-20.
[10] XIANG X W, ZHOU Y F, HAO Y B, et al. Purification and characterization of the polyphenoloxidase (PPO) isolated from Solenocera crassicornis (H. Milne Edwards, 1837)[J]. Crustaceana, 2015,88(3):259-272.
[11] 李秀霞,盛云婷,王桃桃,等,超高压处理对南美白对虾多酚氧化酶活性和品质的影响[J]. 食品工业, 2019(2):110-114.
[12] NIRMAL N P, BENJAKUL S. Inhibition kinetics of catechin and ferulic acid on polyphenoloxidase from cephalothorax of Pacific white shrimp (Litopenaeus vannamei)[J]. Food Chemistry, 2012,131(2):569-573.
[13] 赵铮.酶反应机理的多理论层次量子力学/分子力学研究[D]. 合肥:中国科学技术大学, 2008.
[14] 熊鹰.四嗪类高氮化合物热分解机理的理论研究[D]. 绵阳:中国工程物理研究院, 2007.
[15] 程林.肽酰转移酶催化肽键形成机理的理论研究[D]. 武汉:华中师范大学, 2006.
[16] 汪敬, 顾健德,田安民. 5-硝基-1-氢-四唑衍生物热分解机理的从头算分子动力学模拟及密度泛函理论研究[J]. 四川大学学报(自然科学版), 2002(2):315-320.
[17] 吕敏, 黄光华,杨慧赞,等. 中华管鞭虾多酚氧化酶(PPO)的纯化及特性研究[J]. 现代食品科技,2018(11):138-144.
[18] ROLFF M, SCHOTTENHEIM J, DECKER H, et al. Copper-O-2 reactivity of tyrosinase models towards external monophenolic substrates: molecular mechanism and comparison with the enzyme[J]. Chemical Society Reviews, 2011,40(7):4 077-4 098.
[19] 周宇芳, 胡建坤,郝云彬,等. 4-HR与抗坏血酸对中华管鞭虾多酚氧化酶的抑制机理研究[J]. 食品科学, 2019,40(4):69-74.
[20] 吕敏,黄光华,杨慧赞,等,东海中华管鞭虾多酚氧化酶(PPO)的纯化及特性研究[J]. 现代食品科技, 2018(11):138-144.