Ⅱ型糖尿病,又称非胰岛素依赖型糖尿病(non-insulin-dependent diabetes mellitus,简称NIDDM),由胰岛素抵抗和胰岛素分泌缺陷造成,患者体内的胰岛素水平表现为正常或高于正常人水平,由于NIDDM无症状或症状少,因此往往会被忽视而在病人体内进一步呈隐匿性发展,正因为如此,NIDDM的发病率显著高于其他糖尿病(Ⅰ型糖尿病、妊娠糖尿病和其他特殊类型糖尿病)[1],占糖尿病总数的85%以上。在临床上,可通过胰岛素增敏剂、促胰岛素分泌剂、α-葡萄糖苷酶抑制剂等药物手段缓解或治疗NIDDM[2]。
在目前的NIDDM治疗药物品类中,α-葡萄糖苷酶抑制剂(α-glucosidase inhibitor,简称AGI)因其疗效佳、副作用小而被病患视为首选的口服降糖药物。尽管自然界中AGI来源广泛,植物(如大豆[3]、中草药[4]等)、动物(如海洋无脊椎动物[5]等)和微生物[6]中均有过报道。与前两者相比,增殖生长更迅速的微生物有AGI积累快、得率高的特点,因而微生物来源的AGI成为目前市售主要糖尿病药物,如阿卡波糖(Acarbose)、伏格列波糖(Voglibose)以及米格列醇(Miglitol),都是真菌类微生物的代谢产物或次级代谢产物[7]。但到目前为止,受到可参考分离手段相对有限等不利因素的影响,安全性更有优势的细菌类微生物(如乳酸菌等)AGI依然未得到有效的开发与应用。
前期研究发现,脱脂乳经BD3526发酵(培养时间36 h,培养温度30℃,脱脂乳浓度为10%、三角瓶装量为50 mL/250 mL)后对α-葡萄糖苷酶的抑制活性较强(半数抑制浓度IC50为22.4 mg/mL),为了进一步提高目标抑制物的产量,以利于后续的分离提取工作顺利开展,本文以半数抑制浓度为响应值IC50,先后采用单因素法和响应面法确定培养时间、培养温度、脱脂乳浓度和三角瓶装量的优选值,接着验证响应面预测模型的可靠性,并与优化前IC50进行了比较。
1 材料与方法
1.1 菌种与实验材料
Paenibacillus bovis BD3526,由光明乳业股份有限公司提供。
M17琼脂培养基、M17液体培养基、乳糖,英国OXOID LTD.;脱脂乳粉,光明乳业股份有限公司;NaOH、Na2CO3、乳酸,国药集团化学试剂有限公司;α-葡萄糖苷酶(EC 3.2.1.20)、pNPG(4-硝基酚-α-D-吡喃葡萄糖苷),美国Sigma公司,MRS培养基,德国merck公司;TPY培养基,海博生物科技有限公司。
1.2 培养基的制备
脱脂乳培养基的制备:将质量分数2.0%~10.0%脱脂乳粉与蒸馏水混匀,充分溶解后,120 ℃灭菌20 min,即得所需浓度的无菌脱脂乳培养基。
1.3 仪器与设备
HVE-50型高压灭菌锅,日本HIRAYAMA公司;SG-402TX型超净工作台,美国THE BAKER COMPANY公司;AVANTI J30I型高速冷冻离心机,美国BECKMAN COULTER公司;HZQ-F160型摇床,苏州培英实验设备有限公司;GNP-9270型隔水式恒温培养箱,上海精宏实验设备有限公司;PHS-25型pH计,美国奥立龙公司;XW-80A型漩涡混合仪,上海青浦沪西仪器厂;Spectra Max M5多功能酶标仪,美国Molecular Devices公司;FreeZone 12型真空冷冻干燥机,美国LABCONCO公司。
1.4 实验方法
1.4.1 发酵种子的制备
将牛类芽孢杆菌BD3526的冻干粉以少量无菌蒸馏水溶解,用接种环挑取一环划线于M17蔗糖琼脂培养基(以50 g/L蔗糖取代M17培养基中5 g/L的乳糖,在120 ℃下灭菌20 min)上,28 ℃好氧培养24 h后取出,用接种环挑取单菌落接入1 mL M17蔗糖液体培养基中,采用涡旋混合仪将细胞均匀分散后,28 ℃、180 r/min摇床培养48 h取出,再以体积分数2%接种量接种于50 mL上述M17蔗糖液体培养基中,再次于28 ℃、180 r/min摇床培养48 h,将培养物以15 000 r/min离心10 min,弃去上清,沉淀部分以无菌蒸馏水洗涤2次后,用原培养体积的无菌蒸馏水悬浮,得到发酵用的种子。
1.4.2 待测样品的制备
将发酵乳置于沸水浴中灭活10 min,取出冷却至室温,以10 000 r/min离心2 min后取上清,以1 mol/L NaOH回调pH至6.80,再次10 000 r/min离心2 min后取上清,将冷冻干燥后所得粉末溶解于PBS(0.1 mol/L,pH 6.80)的缓冲液中,即得不同质量浓度(80、40、20、10和5 mg/mL)的待测样品。
1.4.3 α-葡萄糖苷酶抑制活性及IC50的测定
在体外测定模型PNPG法[8]的基础上加以改良:向1.5 mL EP管内分别加入100 μL待测样品与50 μL α-葡萄糖苷酶(100 mU/mL),混合均匀后于37 ℃水浴15 min,再加入80 μL PNPG(2 mmol/L),混匀后再次37 ℃水浴15 min,最后加入80 μL Na2CO3(0.2 mol/L)终止反应。将上述反应体系于4 ℃、10 000 r/min离心2 min后,取200 μL上清液于96孔微孔板中,利用酶标仪在405 nm下测定吸光度。取3次平行实验OD405的平均值,代入公式(1)计算α-葡萄糖苷酶抑制活性:
α-葡萄糖苷酶抑制率![]()
式中:阴性对照组为PBS替代待测样品组中的待测样品;阴性空白组为PBS替代阴性对照组中的α-葡萄糖苷酶;样品空白组为PBS替代待测样品组中的α-葡萄糖苷酶。
IC50的测定:以样品浓度为横坐标,糖苷酶抑制率为纵坐标作图,通过回归方程拟合并计算可得该样品抑制α-葡萄糖苷酶半数活性所需的浓度,即IC50。
1.4.4 单因素实验
1.4.4.1 培养时间对BD3526产AGI的影响
将BD3526种子液按体积分数2%接种量接入装有50 mL 10%(质量分数)脱脂乳培养基的250 mL三角瓶中,30 ℃、180 r/min摇床培养,并于不同的培养时间(12、24、36、48、60 h)取出发酵乳(n=3),按1.4.2所述方法制备成待测样品,再按1.4.3所述方法测得各样品的IC50。
1.4.4.2 培养温度对BD3526产AGI的影响
将BD3526种子液按2%(体积分数)接种量接入装有50 mL、10%(质量分数)脱脂乳培养基的250 mL三角瓶中,分别置于20、25、30、35和40 ℃条件下,180 r/min摇床培养48 h,取出发酵乳(n=3),按1.4.2所述方法制备成待测样品,再按1.4.3所述方法测得各样品的IC50。
1.4.4.3 脱脂乳浓度对BD3526产AGI的影响
将BD3526种子液按2%(体积分数)接种量接入装有50 mL,浓度分别为2%、4%、6%、8%和10%(质量分数)脱脂乳培养基的250 mL三角瓶中,30 ℃、180 r/min摇床培养48 h,取出发酵乳(n=3),按1.4.2所述方法制备成待测样品,再按1.4.3所述方法测得各样品的IC50。
1.4.4.4 三角瓶装量对BD3526产AGI的影响
将BD3526种子液按2%(体积分数)接种量分别接入装有25、50、75、100和125 mL,10%(质量分数)脱脂乳培养基的250 mL三角瓶中,30 ℃、180 r/min摇床培养48 h,取出发酵乳(n=3),按1.4.2所述方法制备成待测样品,再按1.4.3所述方法测得各样品的IC50。
1.4.5 响应面实验
为了确定BD3526产AGI的最佳条件,在上述单因素实验的基础上,进一步以培养时间(A)、培养温度(B)、脱脂乳浓度(C)、三角瓶装量(D)4个因素为自变量,IC50为响应值,采用Box-Behnken响应面法(response surface methodology,RSM)设计中心组合实验,因素与水平见表1。
表1 响应面因素与水平表
Table 1 Factors and levels of RSM
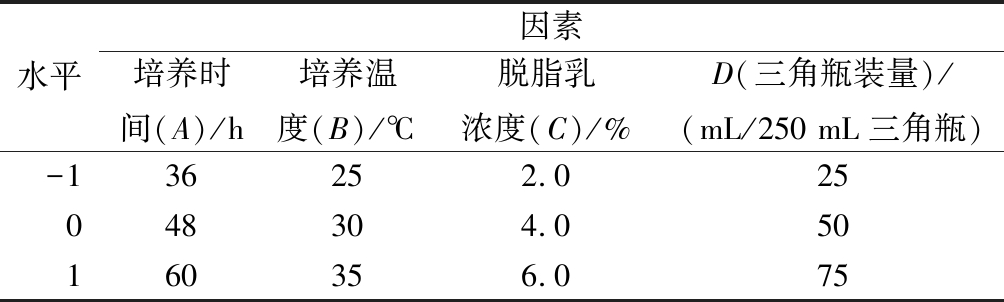
水平因素培养时间(A)/h培养温度(B)/℃脱脂乳浓度(C)/%D(三角瓶装量)/(mL/250 mL三角瓶)-136252.025048304.050160356.075
1.4.6 验证与比较实验
根据RSM法获得的优选条件以及优化前的方法制备发酵乳并测定IC50,对响应面预测值进行验证,同时比较条件优化前后的BD3526产AGI的效果差异。
1.4.7 数据统计分析
采用Design Expert 8.0.6 软件进行响应面设计、数据分析及回归模型建立,运用Origin Pro 2016、Excel 2013 进行作图。
2 结果与分析
2.1 单因素实验
2.1.1 培养时间对BD3526产AGI的影响
将BD3526种子液按2%(体积分数)接种量接入装有50 mL 10%(质量分数)脱脂乳培养基的250 mL三角瓶中,30 ℃、180 r/min摇床培养,培养不同时间(12、24、36、48、60 h)后获得的发酵乳IC50如图1所示。

图1 培养时间对BD3526产AGI的影响
Fig.1 Effect of fermentation time on AGI-production of Paenibacillus bovis BD3526
在BD3525接种后的12~60 h内,发酵乳IC50呈现先下降后上升的变化趋势,在发酵前期(12~48 h),随着培养时间的延长,IC50缓慢下降,各时间点的IC50分别为:35(12 h)、26.8(24 h)、22.4(36 h)、20.3 mg/mL(48 h),表明BD3526代谢产生的AGI正随着发酵程度的加深而逐步积累,当培养时间延长至60 h时,IC50并未进一步降低,反而显著升高(42.4 mg/mL),说明前期积累的AGI被迅速消耗,可能的原因是:(1)发酵后期(48~60 h)的体系中营养物质已趋于贫乏,前期积累的代谢产物被视为营养来源而被菌株加以利用;(2)菌株为了维持必要的生境而分解过度积累的代谢产物。类似的AGI合成特点在其他同类研究中也常被提及,例如范文娅等[9]发现,接种LC2W培养96 h后获得的发酵乳对糖苷酶抑制效果最佳,但随着发酵时间的进一步延长,其体外降糖效果会逐步降低,因此,推测发酵时间的延长导致发酵前期代谢产生的抑制剂被利用或被菌体裂解产生的胞内酶破坏。鉴于48 h发酵乳的IC50最低,因此,后续实验均采用48 h作为最适培养时间。
2.1.2 培养温度对BD3526产AGI的影响
将BD3526种子液以2%(体积分数)接种量接入50 mL 10%(质量分数)脱脂乳培养基的250 mL三角瓶中,分别置于20、25、30、35和40 ℃条件下,180 r/min摇床培养48 h后获得的发酵乳IC50如图2所示。
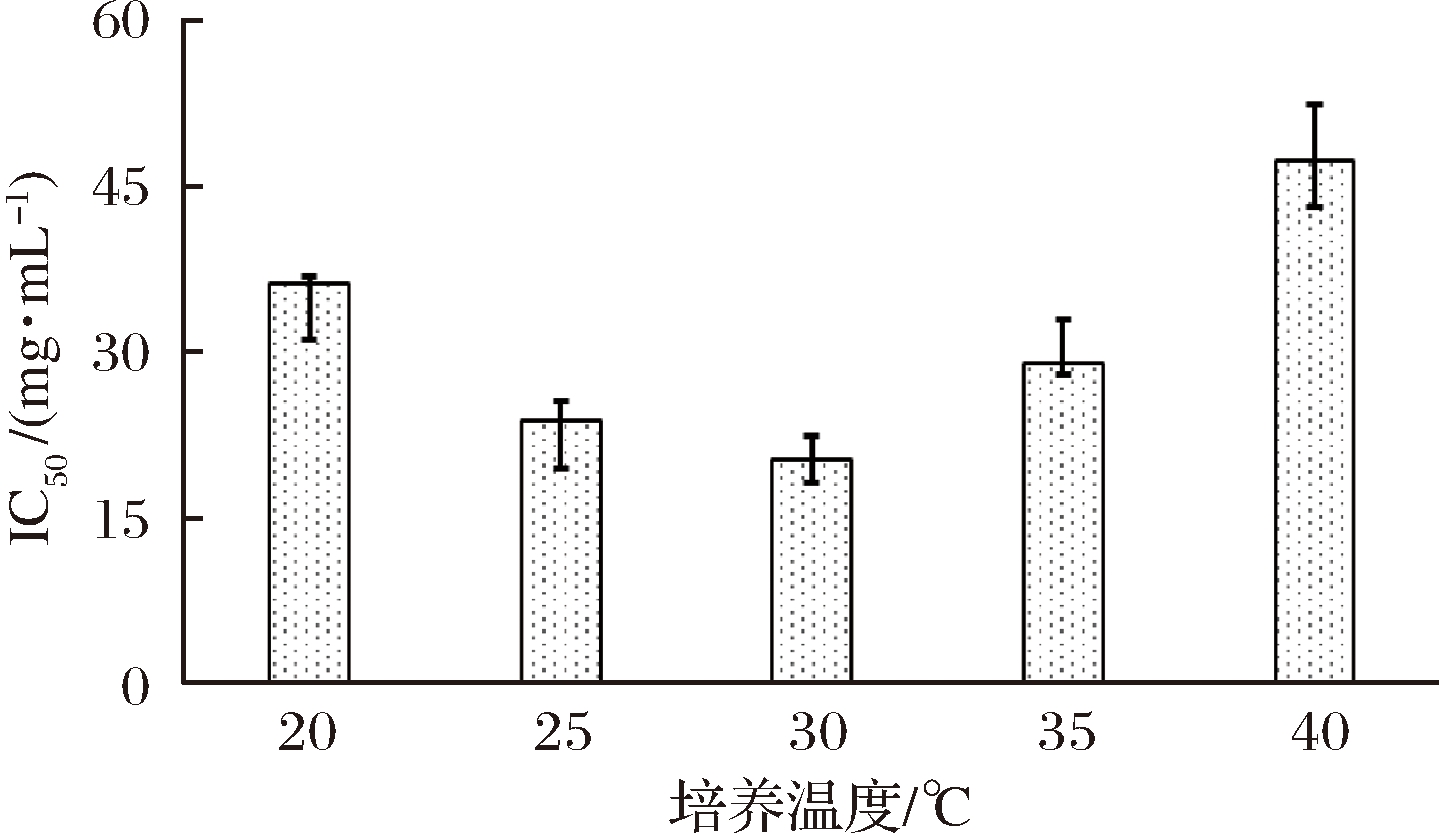
图2 培养温度对BD3526产AGI的影响
Fig.2 Effect of fermentation temperature on AGI-production of Paenibacillus bovis BD3526
培养温度对BD3526产AGI能力的影响较大,不同样品组的IC50差异较大。其中,40 ℃发酵乳的糖苷酶的IC50最高(47.2 mg/mL),20 ℃发酵乳的IC50次之(36.1 mg/mL),说明过低(20 ℃)或过高(40 ℃)的培养温度均不利于AGI大量合成或积累,而在30 ℃条件下制备的BD3526发酵乳的IC50最低(20.3 mg/mL),表明30 ℃为BD3526代谢脱脂乳产AGI的优选培养温度;此外,该条件与类芽孢杆菌家族其他菌株(如多粘类芽孢杆菌[10]等)的最适生长条件基本吻合[11],所以,由糖苷酶抑制活性与菌体生长的正相关性推测可得,AGI极有可能是该菌株生长过程中的代谢产物之一。
2.1.3 脱脂乳浓度对BD3526产AGI的影响
将BD3526种子液按2%(体积分数)接种量接入装有50 mL,质量分数分别为2%、4%、6%、8%和10%脱脂乳培养基中, 30 ℃、180 r/min摇床培养48 h后获得的发酵乳IC50如图3所示。
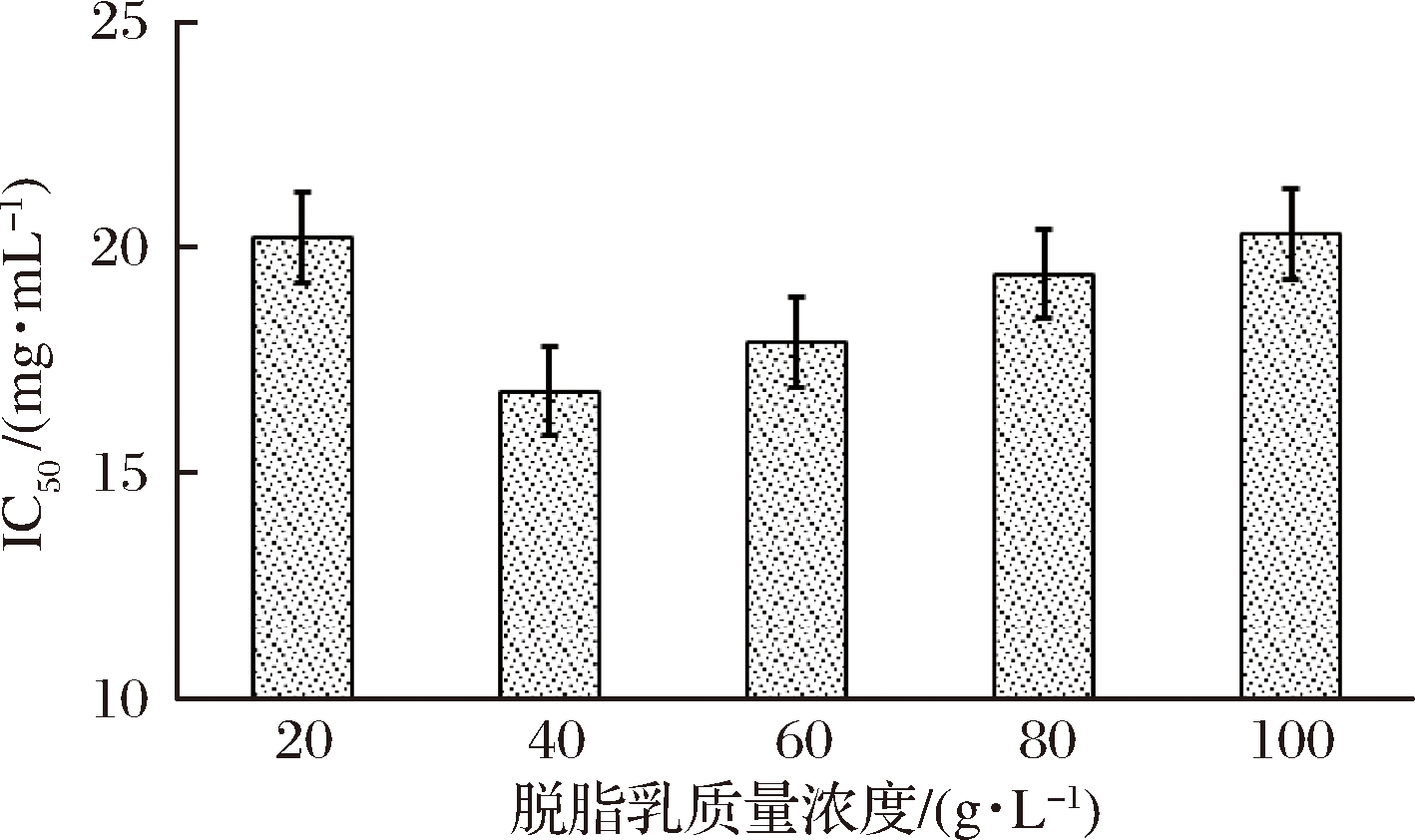
图3 脱脂乳浓度对BD3526产AGI的影响
Fig.3 Effect of skimmed milk concentration on AGI-production of Paenibacillus bovis BD3526
当脱脂乳浓度较低(质量分数2%)时,BD3526发酵乳的IC50较高(20.2 mg/mL),说明合成的AGI较少,这可能是发酵体系中的营养成分相对不足造成的。将脱脂乳质量浓度增加至40 g/L时发酵乳IC50达到最低(16.8 mg/mL),表明此时BD3526合成与积累AGI的效果最佳。然而,继续增加脱脂乳浓度并未对AGI的产量有进一步促进作用,6%、8%以及10%(质量分数)的脱脂乳培养基制备而得的发酵乳所对应的糖苷酶IC50分别为:17.9、19.4和20.3 mg/mL,导致这种现象的原因:(1)增加的营养成分(脱脂乳)促进了菌体的大量增殖,迅速富集的有害代谢产物影响了AGI的生物合成;(2)脱脂乳浓度的增加提高了发酵体系的渗透压,高渗环境对菌体的正常代谢有一定影响。考虑到脱脂乳浓度4%(质量分数)的发酵乳IC50最低,故选用4%为最适脱脂乳浓度。
2.1.4 三角瓶装量对BD3526产AGI的影响
将BD3526种子液按2%(体积分数)接种量分别接入分别装有25、50、75、100和125 mL,4%(质量分数)脱脂乳培养基的250 mL三角瓶中,30 ℃、180 r/min摇床培养48 h后获得的发酵乳IC50如图4所示。
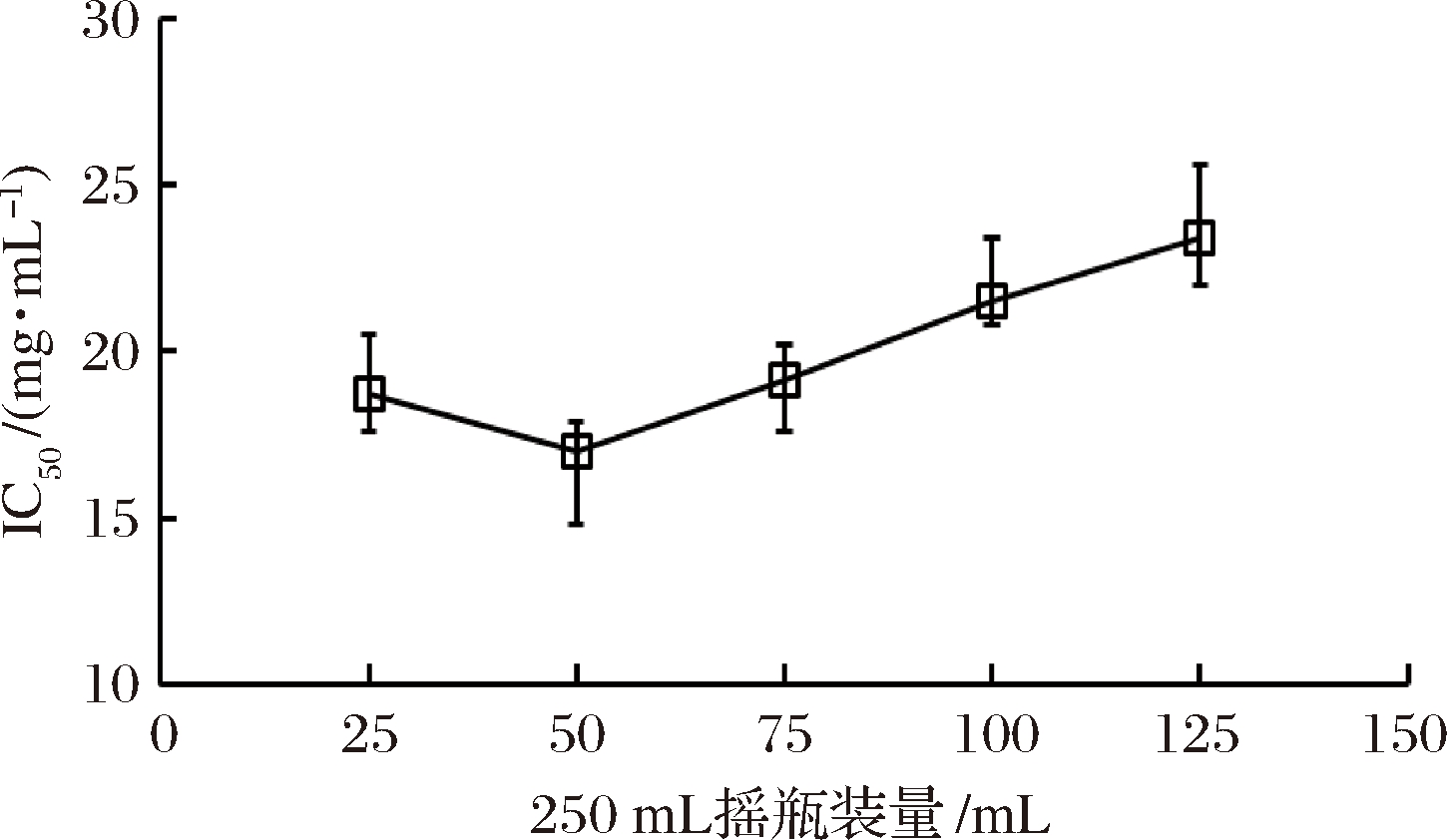
图4 三角瓶装量对BD3526产AGI的影响
Fig.4 Effect of amount of medium per flask on AGI-production of Paenibacillus bovis BD3526
BD3526是最近发现的一株类芽孢杆菌新种[12],为典型的好氧菌,因此,发酵体系的通气状况直接影响BD3526的生长状态与目标代谢物的产量。若三角瓶装量过多,则发酵体系通气不足,AGI的产量会因菌株生长不充分而降低,相反地,若装量过少,又会因菌体过度生长使原本用于合成AGI的营养物质被快速消耗殆尽。由图4分析可知,装量为25、75、100和125 mL/250 mL时制备的发酵乳IC50相对较高,分别为18.7、19.1、21.5和23.4 mg/mL,前者属于装量过少的情况,后三者是装量过多所致,装量50 mL/250 mL时所制备发酵乳的IC50最低(17 mg/mL),因此为本实验的优选装量。
2.2 响应面实验
2.2.1 Box-Behnken响应面实验及回归分析
利用Box-Behnken响应面法对多变量发酵体系中的研究因素(培养时间、培养温度、脱脂乳浓度、三角瓶装量)和评价因素(IC50)的相关性和及其相互影响进行分析,通过软件(Design Expert 8.0.6)推算建立二次回归数学模型,进而获得优选的发酵因素组合。
根据Box-Benhnken中心组合实验的原理,设计N=29的4因素3水平的响应面分析实验,其中析因点24个,区域中心零点的重复实验5个。具体实验的设计与结果如表2所示。
表2 响应面设计与结果
Table 2 Design and results of RSM
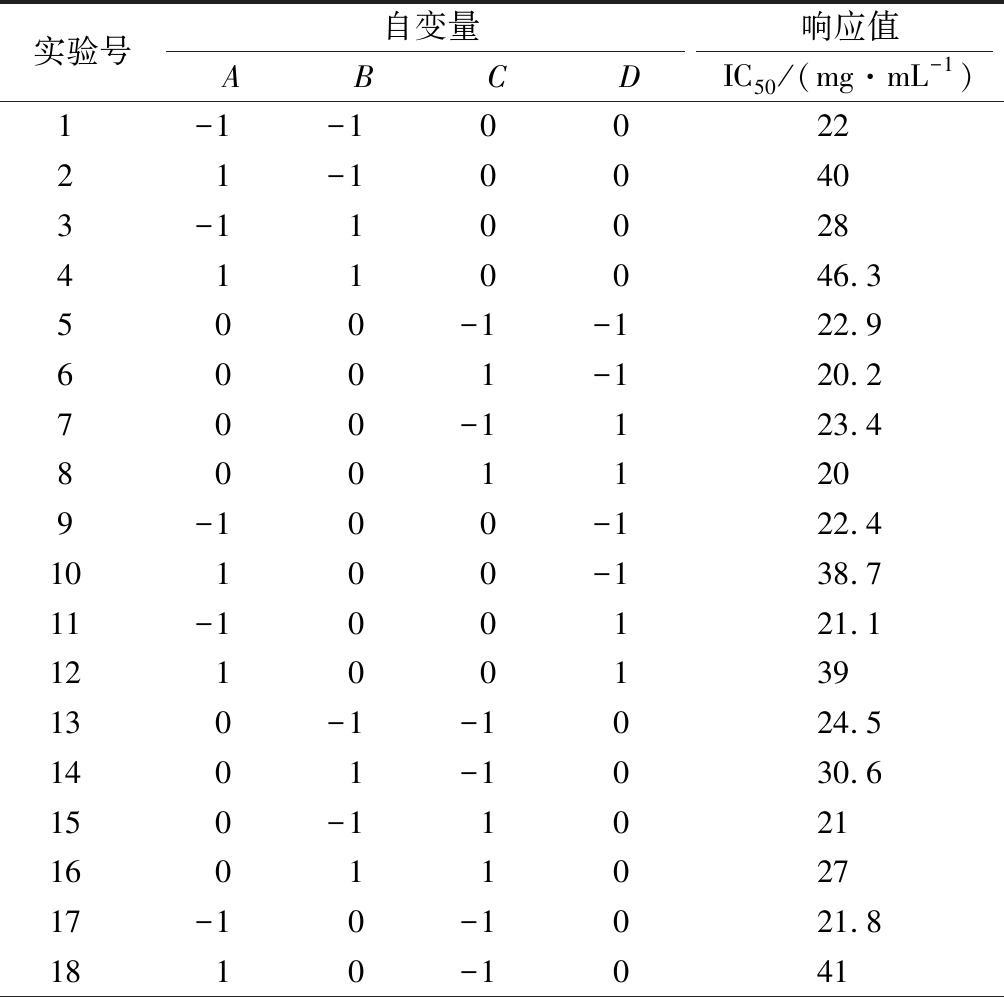
实验号自变量响应值ABCDIC50/(mg·mL-1)1-1-1002221-100403-1100284110046.3500-1-122.96001-120.2700-1123.480011209-100-122.410100-138.711-100121.112100139130-1-1024.51401-1030.6150-110211601102717-10-1021.81810-1041
续表2
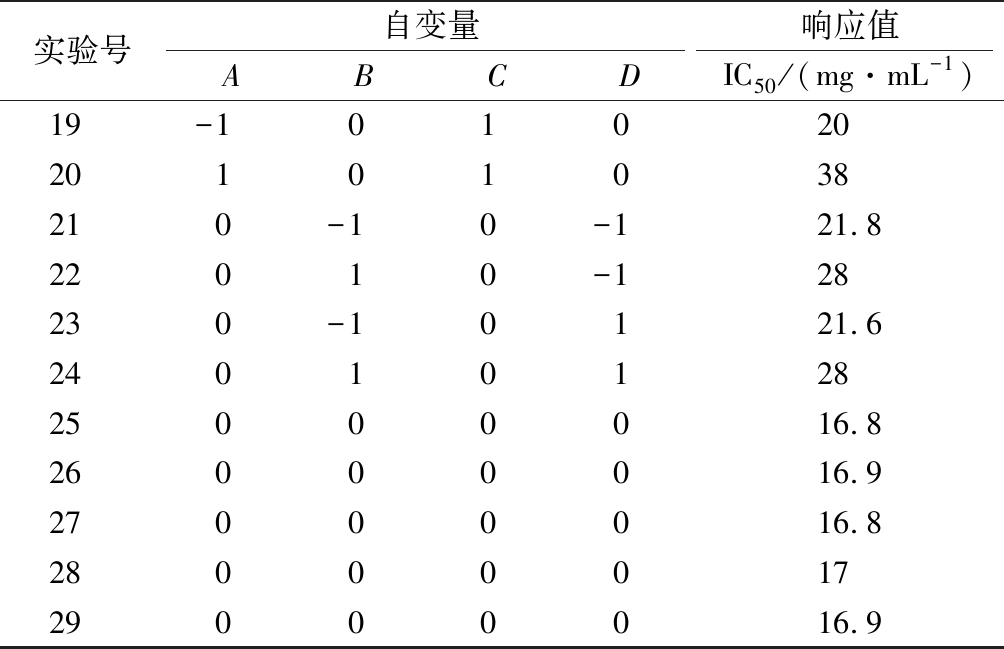
实验号自变量响应值ABCDIC50/(mg·mL-1)19-10102020101038210-10-121.822010-128230-10121.62401012825000016.826000016.927000016.82800001729000016.9
进一步利用Design Expert 8.0.6对表2数据进行回归分析,得到多元二次响应面回归模型:IC50 (mg/mL)=16.88+8.98A+3.08B-1.50C-0.075D+0.075AB-0.30AC+0.40AD-0.025BC+0.05BD-0.18CD+11.04A2+ 6.11B2+ 2.56C2+ 2.14D2。该模型的R2=0.998 4,调整R2=0.996 8,说明回归方程与数据的拟合度较高,可解释99.68%实验所得结果。二次响应面回归模型的方差分析结果见表3。
表3 二次响应面回归模型的方差分析结果
Table 3 Variance analysis results of the quadratic response surface regression model

方差来源平方和自由度均方F值P值显著性模型2 010.9314143.64628.32<0.000 1∗∗A966.611966.614 228.25<0.000 1∗∗B114.081114.08499.04<0.000 1∗∗C27.00127.00118.11<0.000 1∗∗D0.06810.0680.300.595 4AB0.02310.0230.0980.758 4AC0.3610.361.570.230 1AD0.6410.642.800.116 5BC0.002 510.002 50.0110.918 2BD0.0110.010.0440.837 3CD0.1210.120.540.476 2A2791.061791.063 460.35<0.000 1∗∗B2241.821241.821 057.81<0.000 1∗∗C242.37142.37185.35<0.000 1∗∗D229.80129.80130.35<0.000 1∗∗失拟项3.17100.3245.320.178 6
注:*表示显著,P<0.05;**表示极显著,P<0.01
该模型显著(模型P值<0.0001),且无失拟因素存在(失拟项P值为0.178 6>0.05)。各因素的交互作用对IC50的影响顺序为:AD(0.116 5)>AC(0.230 1)>CD(0.476 2)>AB(0.758 4)>BD(0.837 3)>BC(0.918 2),其中,部分因素的交互作用(A和B、C和D)对IC50的影响如图5所示。

A-培养温度和培养时间的交互作用;B-脱脂乳浓度和三角瓶装量的交互作用
图5 培养温度和培养时间、脱脂乳浓度和三角瓶装量的交互作用对IC50的影响
Fig.5 The effect of the interactions of cultivation temperature and cultivation time, skimmed milk concentration and amount of medium per flask on IC50
由图5可知,各因素在所选范围均存在响应最高点,这与表3中模型的显著性结果一致。根据二次回归模型的预测,当培养时间为43.04 h、培养温度为29.39 ℃、脱脂乳浓度为4.85%、三角瓶装量为52.43 mL/250 mL时,菌株BD3526发酵乳的最低IC50可达14.6 mg/mL。综合考虑了后续验证实验的可操作性,对上述优化条件进行修正:培养时间为43 h,培养温度为29 ℃,脱脂乳浓度为5%、三角瓶装量为50 mL/250 mL。
2.2.2 验证与比较
为验证优化实验预测结果的可靠性,在上述优选条件下制备BD3526发酵乳(n=3),并测定糖苷酶的IC50,同时与优化前的条件(培养时间为36 h,培养温度为30 ℃,脱脂乳浓度为10%、三角瓶装量为50 mL/250mL)所制备的发酵乳进行比较,结果如图6所示。
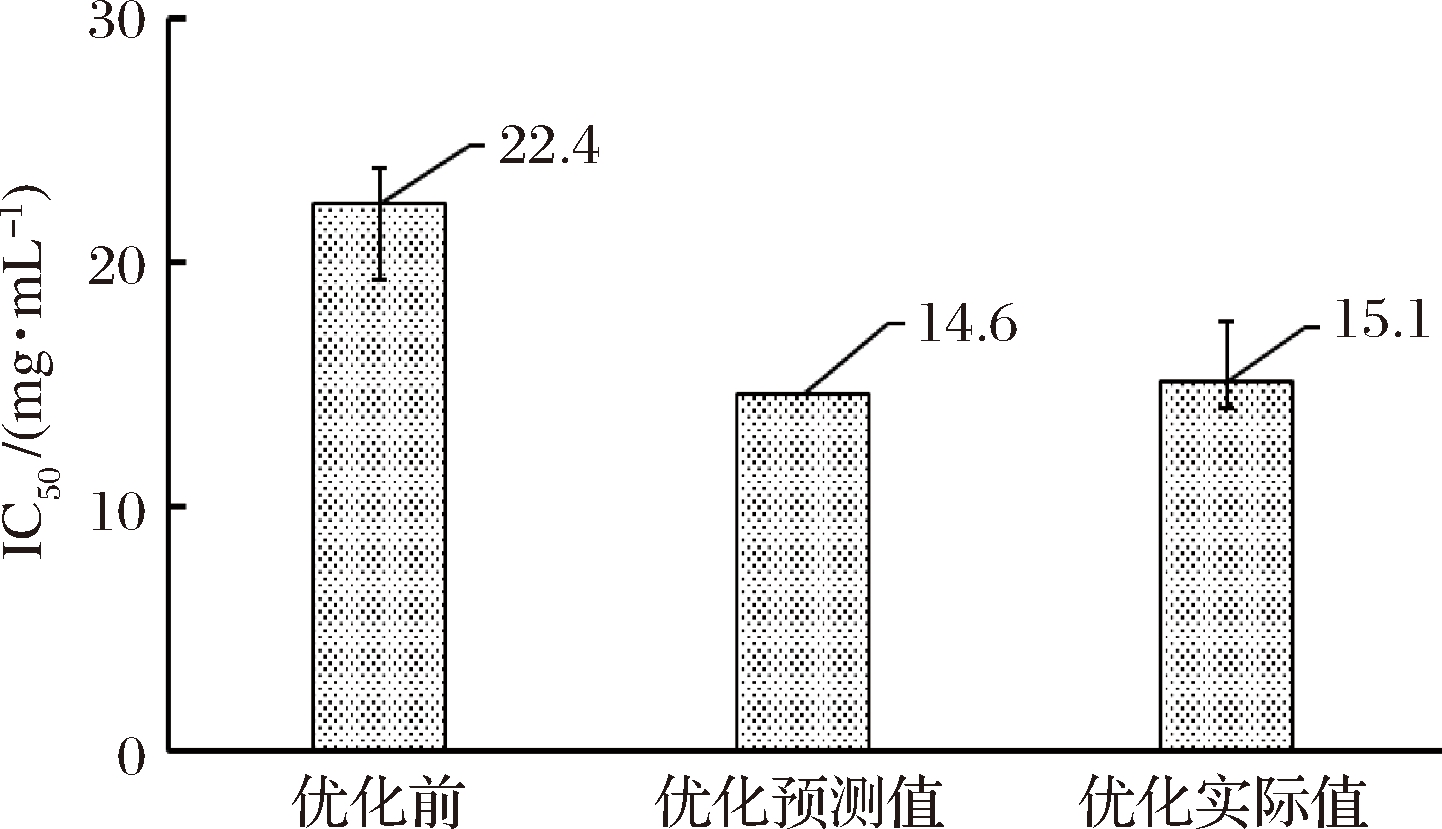
图6 验证与比较实验结果
Fig.6 Results of the validation and comparison experiments
验证后发现:(1)优化条件下实测的BD3526发酵乳IC50均值为15.1 mg/mL,基本与模型预测值(14.6 mg/mL)保持同一水平;(2)优化后的实测IC50值比优化前(22.4 mg/mL)降低了33%,上述结果表明响应面法对BD3526发酵乳制备工艺的条件优化是有效的。
3 结论与讨论
BD3526是1株从西藏生牦牛乳中分离得到的类芽孢杆菌,经生理生化、16S rDNA等分类数据的比较后发现,该菌株为1株类芽孢杆菌新种,命名为Paenibacillus bovis(牛类芽孢杆菌),为该种的模式菌株[12]。随后,围绕BD3526的各类研究相继展开。杭锋等发现,BD3526可代谢小麦麸皮产生一种高活性的凝乳酶[13-14],并进一步研究了该金属蛋白酶的分离纯化过程[15]、结构预测[16]及其对乳蛋白的水解位点的影响[17]。BD3526能利用多种培养基(麸皮[18]、无氮培养基[19]、半合成培养基[20])合成具有特定生物活性(增强免疫)的胞外多糖(Levan等),兼具抑菌[21-22]、促生长[23]等积极的益生功能。近期研究发现,脱脂乳经BD3526发酵(培养时间为36 h,培养温度为30 ℃,脱脂乳浓度为10%、三角瓶装量为50 mL/250 mL)后对α-葡萄糖苷酶的半数抑制浓度IC50为22.4 mg/mL,为进一步提高目标抑制物的产量以利于后续的分离提取工作顺利开展,本文对培养条件进行了优化。
本文首先采用单因素实验确定了培养时间、培养温度、脱脂乳浓度和三角瓶装量的优选值,分别为48 h、30 ℃、4%和50 mL/250 mL,在此基础上,再利用响应面法考察了各因素的相互作用对α-葡萄糖苷酶IC50的影响,结果发现,当培养时间为43 h,培养温度为29 ℃,脱脂乳浓度为5%、三角瓶装量为50 mL/250 mL时,BD3526发酵乳的IC50为15.1 mg/mL,进一步地验证与比较实验显示,实际值与理论值(14.6 mg/mL)基本一致,比优化前(22.4 mg/mL)降低了33%。
[1] FOWLER, 徐赫男. 糖尿病分类:并非所有高血糖都一样[J]. 糖尿病天地(临床), 2008, 2(3): 103-105.
[2] 于彩丽. Ⅱ型糖尿病的药物治疗进展[J]. 中国医药指南, 2012, 10(29): 66-67.
[3] ADEMILUYI A O, OBOH G. Soybean phenolic-rich extracts inhibit key-enzymes linked to type 2 diabetes (alpha-amylase and alpha-glucosidase) and hypertension (angiotensin I converting enzyme) in vitro[J]. Experimental and Toxicologic Pathology, 2013, 65(3): 305-309.
[4] 季芳, 肖国春,董莉, 等. 药用植物来源的α-葡萄糖苷酶抑制剂研究进展[J]. 中国中药杂志, 2010, 35(12): 1 633-1 640.
[5] 卜同, 陈雷,林秀坤. 天然来源的α-葡萄糖苷酶抑制剂的研究进展[J]. 海洋科学, 2010, 34(2): 92-95.
[6] 韩瑨, 季红,周方方, 等. 产α-葡萄糖苷酶抑制剂乳酸菌的筛选及发酵条件优化[J]. 天然产物研究与开发, 2013, 25(3): 302-306.
[7] 张欢欢, 韩瑨,游春苹, 等. 植物乳杆菌来源的α-葡萄糖苷酶抑制剂的分离纯化[J]. 应用化工, 2015, 44(8): 1 417-1 420.
[8] CHAPDELAINE P, TREMBLAY R R, DUBE J. P-Nitrophenol-alpha-D-glucopyranoside as substrate for measurement of maltase activity in human semen[J]. Clinical Chemistry, 1978, 24(24): 208-211.
[9] 范文娅, 吴正钧,郭本恒. 响应面法优化干酪乳杆菌LC2W代谢产α-葡萄糖苷酶抑制剂的发酵条件[J]. 江苏农业科学, 2012, 40(10): 228-231.
[10] 苍桂璐, 张付云,杨阳, 等. 多粘类芽孢杆菌的研究进展[J]. 安徽农业科学, 2013, 399(2): 487-489.
[11] GRADY E N, MACDONALD J, LIU L, et al. Current knowledge and perspectives of Paenibacillus: a review[J]. Microbial Cell Factories, 2016, 15(1): 203-220.
[12] GAO C, HAN J, LIU Z, et al. Paenibacillus bovis sp. nov., isolated from raw yak (Bos grunniens) milk[J]. International Journal of Systematic & Evolutionary Microbiology, 2016, 66(3): 1 413-1 418.
[13] 杭锋, 洪青,陶源, 等. Paenibacillus spp.BD3526发酵小麦麸皮生产凝乳酶[J]. 食品与发酵工业, 2016, 42(2): 35-40.
[14] HANG F, LIU P, WANG Q, et al. High milk-clotting activity expressed by the newly isolated Paenibacillus spp. Strain BD3526[J]. Molecules, 2016, 21(1): 73-86.
[15] HANG F, WANG Q, HONG Q, et al. Purification and characterization of a novel milk-clotting metalloproteinase from Paenibacillus spp. BD3526[J]. International Journal of Biological Macromolecules, 2016, 85: 547-554.
[16] HANG F, WANG Q, HONG Q, et al. Structural insight into a novel neutral metalloproteinase from Paenibacillus spp. BD3526: Implications for mechanisms of rapid inactivation and calcium-dependent stability[J]. International Journal of Biological Macromolecules, 2017, 95: 1 082-1 090.
[17] 杭锋, 洪青,王钦博. Paenibacillus spp. BD3526金属蛋白酶对乳蛋白水解位点分析[J]. 乳业科学与技术, 2016, 39(5): 1-6.
[18] 崔燕丽, 韩瑨,吴正钧. Paenibacillus bovis BD3526产胞外多糖的培养条件优化[J]. 食品与发酵工业, 2016, 42 (5): 108-113.
[19] 徐晓芬. 类芽孢杆菌BD3526在无氮固体培养基上产胞外多糖的研究[J]. 食品工业科技, 2017, 38(16): 95-100.
[20] XU X, GAO C, LIU Z, et al. Characterization of the levan produced by Paenibacillus bovis sp. nov BD3526 and its immunological activity[J]. Carbohydr Polym, 2016, 144: 178-186.
[21] 刘玉娟, 韩瑨,吴江, 等. 类芽孢杆菌BD3526抑菌活性物质的初步分离及性质测定[J]. 天然产物研究与开发, 2015, 27(7): 1 176-1 180.
[22] 花榜清, 张秋香,刘振民,等. 牛类芽孢杆菌BD3526产抗菌物质培养条件的优化[J]. 食品与机械, 2017, 33(3): 31-36.
[23] 洪青, 杭锋,吴正钧. 类芽孢杆菌BD3526发酵上清对植物乳杆菌ST-Ⅲ的促生长研究[J]. 乳业科学与技术, 2016, 39(6): 1-5.