活性氧(reactive oxygen species, ROS)是机体内正常代谢产物,如超氧阴离子、过氧化氢、羟基自由基和氧原子等均为人体细胞内ROS[1-4],在参与细胞信号转导、维持体内氧化还原状态的平衡中起着重要作用。当机体受到某些外界刺激时,活性氧的产生和清除失去平衡,使细胞发生氧化应激,进而活性氧攻击蛋白质、脂质和DNA等生物大分子,导致细胞衰老并诱发一系列疾病,如心血管疾病、糖尿病、癌症、动脉硬化、类风湿性关节炎和神经退行性疾病[5-7]。具有抗氧化活性的物质可以清除细胞内产生的过量自由基,对氧化应激的细胞起到保护作用[8]。近年来,具有抗氧化活性的天然活性肽受到较多关注,如从玉米[9-13]、鸡蛋[14]、大豆[15-17]中通过蛋白酶酶解制备的抗氧化活性肽,这些活性肽较人工合成的抗氧化剂更安全可靠,不仅可以提供人体所需的营养还可调节机体氧化还原平衡状态。
玉米蛋白粉是湿法生产淀粉的主要蛋白副产物,蛋白质含量约为60%,富含亮氨酸、脯氨酸、丙氨酸等疏水性氨基酸,缺乏色氨酸和赖氨酸等人体必需氨基酸;大豆蛋白的蛋白质含量在90%以上,富含人体必需氨基酸色氨酸和赖氨酸。将玉米蛋白和大豆蛋白按一定比例复配后,复配物的氨基酸组成更加符合人体氨基酸需求。利用蛋白酶水解蛋白提高其功能性存在一个普遍问题:随着蛋白酶解反应进行,一些疏水性氨基酸基团暴露在肽链的一端,蛋白水解物呈现一定苦味。米曲霉种曲在发酵过程中能产生复合蛋白酶、淀粉酶、糖化酶、纤维素酶等,在食品发酵工业中有着广泛的应用,用含多种蛋白酶的米曲霉种曲水解蛋白质会降低水解物的苦味,在提高总体反应转化率、使反应产物的生理功能性得到更多释放与提高的同时,使蛋白水解物的苦味值保持在可接受范围内。
本研究用米曲霉种曲和碱性蛋白酶(alcalase)协同水解玉米大豆蛋白复配物,分析蛋白水解物的抗氧化活性,将蛋白水解物作用于人结肠癌细胞(Caco-2细胞),研究其在细胞内的抗氧化活性和氧化应激条件下对细胞内活性氧(ROS)的清除能力。
1 材料与方法
1.1 材料与试剂
玉米蛋白粉,黑龙江省龙凤玉米开发有限公司;Caco-2细胞,南京凯基生物技术有限公司;米曲霉种曲,黑龙酿造有限公司;碱性蛋白酶(alcalase),丹麦诺维信公司;DMEM (高糖) 培养基和胰蛋白酶,美国Gibico公司;胎牛血清(FBS),德国PAN公司;噻唑兰(MTT),上海生工生物技术有限公司;2,2′-偶氮二异丁基脒二盐酸盐(AAPH)、2′,7′-二氯荧光黄双乙酸盐(DCFH-DA),美国Sigma公司;磷酸盐缓冲溶液(PBS)、二甲基亚砜(DMSO) 和高效RIPA裂解液,北京索莱宝科技有限公司;活性氧(ROS)试剂盒,南京建成生物技术有限公司;其他试剂均为国产分析纯试剂。
1.2 主要的仪器与设备
NV4750E二氧化碳培养箱,NUAIRE(美国)公司;SW-CJ-2FD超净工作台,安泰空气技术(苏州)有限公司;LX73荧光倒置显微镜,Olympus(日本东京)公司;EnSpire多功能酶标仪,珀金埃尔默(美国)公司产品;SX-500高温蒸汽灭菌锅,TOMY(日本)公司产品;PC/PLC-LD-53冷冻干燥机,MILLROCK(美国)公司;96孔板、6孔板、细胞培养瓶和移液管,Corning(美国)公司。
1.3 研究方法
1.3.1 米曲霉种曲和alcalase协同水解玉米大豆蛋白复配物
将m(玉米蛋白)∶m(大豆蛋白)=7∶3的比例进行混合,配成质量浓度为100 g/L的蛋白悬液,用米曲霉种曲和alcalase协同水解玉米大豆蛋白复配物。米曲霉种曲的最适水解条件:55 ℃, pH 8.5,水解时间为22 h;alcalase的最适水解条件:60 ℃,pH 8.5,水解时间为2 h。在反应过程中用1 mol/L NaOH维持pH稳定,并记录NaOH消耗量,计算水解过程中的水解度。反应结束后,将反应体系置于沸水浴中灭酶15 min,冷却后4 000 r/min离心15 min,测定上清液的Fe2+螯合能力和DPPH自由基清除率,剩余上清液冻干备用。
1.3.2 蛋白水解物的抗氧化活性测定
1.3.2.1 DPPH自由基清除率的测定
在10 mL离心管中加入2 mL CSPH溶液和2 mL 0.1 mmol/L DPPH无水乙醇溶液,振荡摇匀后室温下避光反应30 min,立即倒入石英比色皿中,在517 nm波长下用紫外可见分光光度计测得吸光值,重复测定3次。按公式(1)计算:
DPPH·清除率![]()
(1)
1.3.2.2 金属离子(Fe2+)螯合能力的测定
在10 mL离心管中加入1 mL CSPH溶液、2 mL 6 mmol/L FeSO4溶液和2 mL 0.5 mmo/L菲咯嗪溶液,振荡摇匀后室温下静置10 min,立即倒入石英比色皿中,在562 nm波长下用紫外可见分光光度计测得吸光值,重复测定3次。按公式(2)计算:
Fe2+螯合率![]()
(2)
1.3.3 细胞培养
Caco-2细胞培养于37 ℃ 5%(体积分数)CO2的培养箱中,用DMEM (高糖)培养基,并向DMEM中添加体积分数10%胎牛血清(FBS)和体积分数1%的双抗作为Caco-2细胞的生长培养基。待细胞生长融合度达到80%~90%时,进行传代培养。实验选用20~30代细胞。
1.3.4 蛋白水解物对细胞存活率的测定
将对数期Caco-2细胞以浓度为1×105 cells/mL接种至96孔板,每孔加入100 μL细胞悬液培养24 h,然后,每孔加入100 μL终浓度为0.05、0.1、0.25、0.5、1、2 mg/mL CSPH4培养液,培养细胞24 h后每孔加入终浓度为0.5 mg/mL的MTT溶液培养4 h,弃上清,每孔加入150 μL DMSO,在37 ℃ 500 r/min微孔板振荡仪振荡10 min,在570 nm波长下用酶标仪检测OD值。计算细胞存活率:
细胞存活率![]()
(3)
1.3.5 氧化应激模型构建及实验分组
将Caco-2细胞以1×105 cells/mL接种至96孔板,每孔加入100 μL细胞悬液。实验分为对照组(0 mmol/L H2O2);氧化应激组(1 mmol/L H2O2);实验组(0.05、0.1、0.25、0.5、1、2 mg/mL CSPH4+1 mmol/L H2O2),细胞存活率测定方法同1.3.4。
1.3.6 蛋白水解物对Caco-2细胞内ROS的清除能力测定
将Caco-2细胞以1×105 cells/mL接种至96孔板,加CSPH4培养细胞2 h后,用1 mmol/L H2O2进行氧化应激处理,PBS清洗细胞2次后,加入终浓度为10 μmol/L的DCFH-DA,在CO2培养箱中孵育30 min,细胞用PBS清洗后,在激发波长为485 nm,发射波长为500 nm的条件下用酶标仪测定荧光强度。
ROS水平![]()
(4)
1.3.7 蛋白水解物对细胞内抗氧化能力的测定
CAA(cellular antioxidant activity)测定参考WOLF和LIU的方法[18],将Caco-2细胞以1×105 cells/mL接种于96孔板中,每孔100 μL细胞悬液,细胞培养24 h后去除培养液,PBS清洗细胞1次,实验组每孔加入不同浓度CSPH4的DMEM培养液,其中含25 μmol/L DCFH-DA的DMEM,作用Caco-2细胞2 h后,用100 μL PBS清洗细胞一遍,每孔加入100 μL 600 μmol/L的AAPH溶液,将96孔板放入酶标仪中,在激发波长485 nm,发射波长530 nm条件下,每5 min检测一次,连续测定1 h。设定空白组和对照组,空白组仅采用DCFH-DA处理,但不加入AAPH;对照组采用DCFH-DA和AAPH自由基处理,但不加入样品。实验中用Trolox作为阳性对照。
(5)
式中:![]() 实验组荧光值相对于时间曲线下的完整面积;
实验组荧光值相对于时间曲线下的完整面积;![]() 对照组荧光值曲线下的完整面积。最终,CAA的值以每100 g CSPH4中相当于水溶性Trolox的微摩尔当量来表示(μmol TE/100g)。
对照组荧光值曲线下的完整面积。最终,CAA的值以每100 g CSPH4中相当于水溶性Trolox的微摩尔当量来表示(μmol TE/100g)。
1.3.8 数据处理
实验中的数据均以平均值±标准偏差表示。用SPSS Statistics 19.0进行统计学分析,数据间的显著性差异采用单因素方差分析(LSD检验),P<0.05为差异性显著水平。用GraphPad Prism 5绘制图表。
2 结果与讨论
2.1 玉米大豆蛋白复配物的水解
蛋白质被蛋白酶水解时,不同的蛋白酶均有其特定的酶切位点,随着反应的进行,蛋白质的酶切位点不断减少。用alcalase和米曲霉种曲协同水解玉米大豆蛋白复配物,可以很好地增强蛋白质水解效果,将原料充分利用起来,提高利用率。
在玉米大豆蛋白复配物质量浓度为100 g/L的条件下,考察了alcalase和米曲霉种曲在不同加酶顺序和不同加酶量的条件下,协同水解玉米大豆蛋白复配物的效果,水解物的DH、可溶性蛋白含量、DPPH·清除率和亚铁离子螯合能力的结果如表1所示。
表1 酶底比与加酶顺序对碱性蛋白酶和米曲霉种曲协同水解玉米大豆蛋白复配物的影响
Table 1 Hydroltsis effect of E∶S ratio and proteases adding sequence on corn soybean protein mixture by alcalase and Aspergillus oryzae
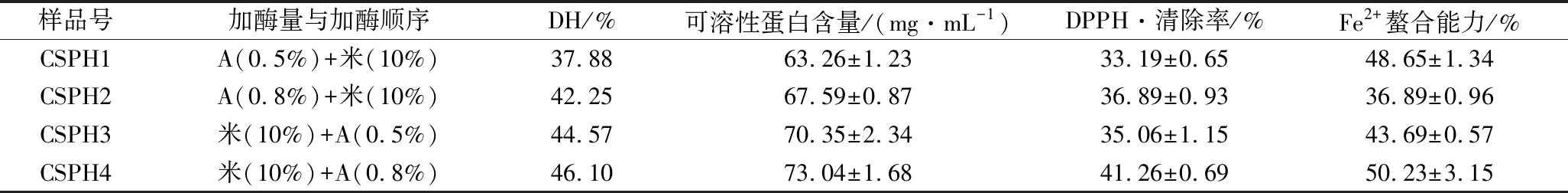
样品号加酶量与加酶顺序DH/%可溶性蛋白含量/(mg·mL-1)DPPH·清除率/%Fe2+螯合能力/%CSPH1A(0.5%)+米(10%)37.8863.26±1.2333.19±0.6548.65±1.34CSPH2A(0.8%)+米(10%)42.2567.59±0.8736.89±0.9336.89±0.96CSPH3米(10%)+A(0.5%)44.5770.35±2.3435.06±1.1543.69±0.57CSPH4米(10%)+A(0.8%)46.1073.04±1.6841.26±0.6950.23±3.15
从表1可以看出,alcalase和米曲霉种曲的加入顺序对水解物DH和可溶性蛋白含量影响较大。在双酶协同顺序水解过程中,从DH和可溶性蛋白含量上来看,先用米曲霉的水解效果比先用alcalase的好。将米曲霉种曲的加酶量固定为10%(质量分数),改变alcalase的加酶量,结果发现alcalase为0.8%(质量分数)时,无论其为第1种酶或第2种酶,DH和可溶性蛋白含量均大于加酶量为0.5%(质量分数)组;米曲霉+alcalase组合的水解效果要优于alcalase和米曲霉组合,其可能原因是,米曲霉种曲蛋白酶系复杂,且活力不高,先加入米曲霉可以将破坏大分子蛋白质的空间结构破坏,使alcalase的切割位点大量暴露出来,增加了alcalase的水解效率;而先加入alcalase,其自身就可以将大分子蛋白质水解成大量分子量小于1 000 Da的肽段[19],再加入米曲霉后,反应体系中以小分子肽段为主,米曲霉自主产生的蛋白酶活力不高,导致这些蛋白酶没有作用位点,水解效果没有alcalase和米曲霉种曲组合好。双酶协同水解复配物产物的抗氧化活性与DH和可溶性蛋白含量没有正比关系,DH和可溶性蛋白含量高的时候,抗氧化活性不一定强。综合实际生产过程中的原料利用率情况和蛋白酶成本,将CSPH4作为接下来细胞实验的原料,此条件下DH、可溶性蛋白含量、DPPH自由基清除率和Fe2+螯合能力分别为46.10%、(73.04±1.68) mg/mL、(41.26±0.69)%和(50.23±3.15)%。
2.2 CSPH4对Caco-2细胞存活率的影响
不同浓度的CSPH4对Caco-2细胞存活率存在显著性(P<0.05)差异,与对照组相比,CSPH4在0.05~2.00 mg/mL浓度范围内,细胞存活率均≥对照组细胞存活率,即CSPH4对Caco-2细胞无毒性。

图1 玉米大豆蛋白水解物对Caco-2细胞存活率的影响
Fig.1 Effect of corn soybean protein hydrolysate on Caco-2 cell viability
注:肩标不同字母表示差异显著(P<0.05);相同字母表示差异不显著(P>0.05)。下同。
2.3 CSPH4对氧化应激的Caco-2细胞的保护作用
不同浓度的CSPH4培养Caco-2细胞后用1 mmol/L H2O2进行氧化应激,测得细胞存活率如图2所示。

图2 玉米大豆蛋白水解物对H2O2诱导氧化应激Caco-2细胞的保护作用
Fig.2 Cytoprotective effects of mixture of corn soybean protein hydrolysate on H2O2 induced oxidized Caco-2 cells
细胞经1 mmol/L H2O2作用后,细胞存活率显著(P<0.05)降低,表明氧化应激模型构建成功。CSPH4在实验浓度范围内,预培养Caco-2细胞后再进行氧化应激,与氧化应激组相比,细胞存活率均显著(P<0.05)提高,其中CSPH4浓度在0.05 mg/mL时保护细胞效果最好,此时细胞存活率可达到 92.82%,与H2O2氧化损伤组相比,细胞存活率提高了40%左右。WANG等[20]发现2种玉米肽组分浓度在0.05~2.5 mg/mL范围内可以显著提高氧化应激条件下HepG2细胞的存活率,对已发生氧化损伤的HepG2细胞有保护作用,浓度为2.5 mg/mL时,相比氧化损伤组细胞存活率来看,经玉米肽预处理2 h后可使细胞存活率提高50%左右。YI等[21]研究了一种来源于鸡蛋卵铁蛋白的ACE抑制肽(Ile-Arg-Trp)对Caco-2细胞的保护作用,结果发现经50 μmol/L IRW预处理细胞0.5 h后,可以保护细胞免受H2O2氧化损伤,此时细胞存活率提高了15.7%。
2.4 CSPH4对细胞内ROS的清除能力
CSPH4可使细胞存活率提高可能与其降低细胞内ROS水平有关。因此,用H2O2构建氧化应激模型,测得细胞内ROS水平如图3所示。
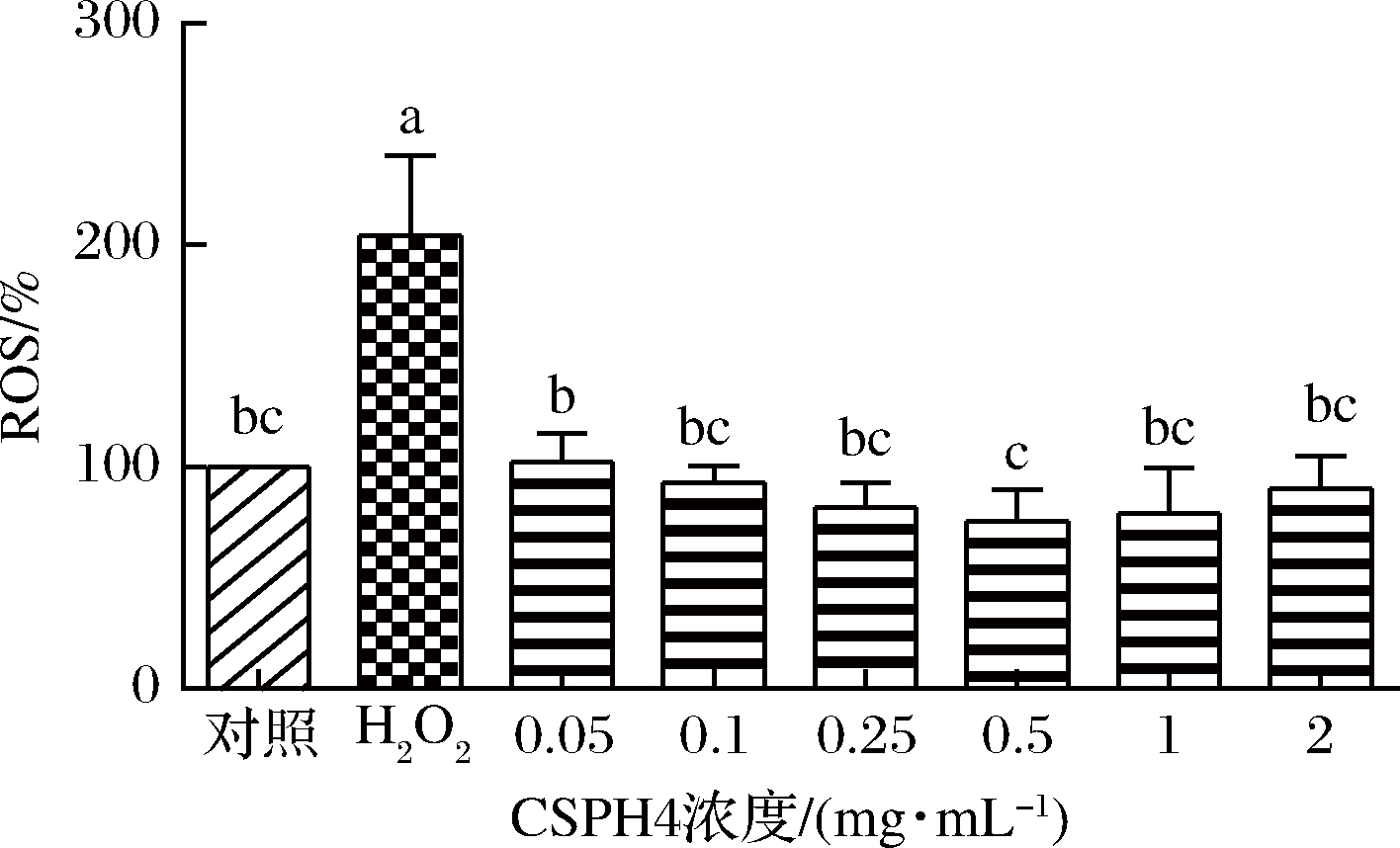
图3 氧化应激条件下玉米大豆蛋白水解物对细胞内ROS清除能力的影响
Fig.3 Intracellular ROS scavenging capacities of corn soybean protein hydrolysate under conditions of oxidative stress in cells induced by H2O2
从图3中可看出,与对照组相比,氧化应激组细胞内ROS水平显著(P<0.05)升高。与氧化应激组相比,经不同浓度(0.05~2.00 mg/mL) CSPH4处理后细胞内ROS水平显著降低(P<0.05),与对照组相比,经CSPH4处理后细胞内ROS水平与对照组无显著(P>0.05)差异。因此,CSPH4能有效降低H2O2诱导的氧化应激细胞内ROS水平。
2.5 CSPH4对细胞内抗氧化活性的影响
采用荧光探针(DCFH-DA) 法测定细胞内抗氧化活性,DCFH-DA可被细胞膜上的酯酶脱乙酰基水解成DCFH,DCFH可进入细胞内,AAPH自由基经激发后可使细胞内DCFH氧化成具有绿色荧光的DCF。若有抗氧化物质存在,其可通过减少过氧化自由基的产生从而降低荧光强度。CSPH4对细胞内荧光强度的影响如图4所示。
从图4可以看出,无论是Trolox还是CSPH4都可以抑制DCF荧光的增加,且呈现剂量依赖关系。根据公式算出CAA活性值,以浓度为横坐标,CAA活性值为纵坐标,绘制剂量效应曲线如图5所示。根据图5计算出Trolox和CSPH4的EC50值分别为0.733和8.968 mg/mL,此时,CSPH4的CAA值为(48.08±2.05) μmol TE/100 g。在CAA实验中,Caco-2可以吸收CSPH4来清除有AAPH产生的过氧自由基,减少DCF的形成,降低细胞内荧光产生。实验中测得的Trolox的EC50值与文献中的值接近[20]。CSPH4的CAA活性值要比蓝莓、蔓越莓、苹果和红葡萄等在HepG2细胞中CAA活性值高,但略低于绿葡萄CAA活性值[18]。存在的这些差异可能是由于这些抗氧化剂的主要成分与本实验中肽的主要成分不同导致的,而且不同的细胞之间也会有不一样的CAA活性值[22]。

图4 Trolox(A)和CSPH4(B)对荧光强度的影响
Fig.4 Effect of Trolox(A) and CSPH4(B) on cellular fluorescence intensity
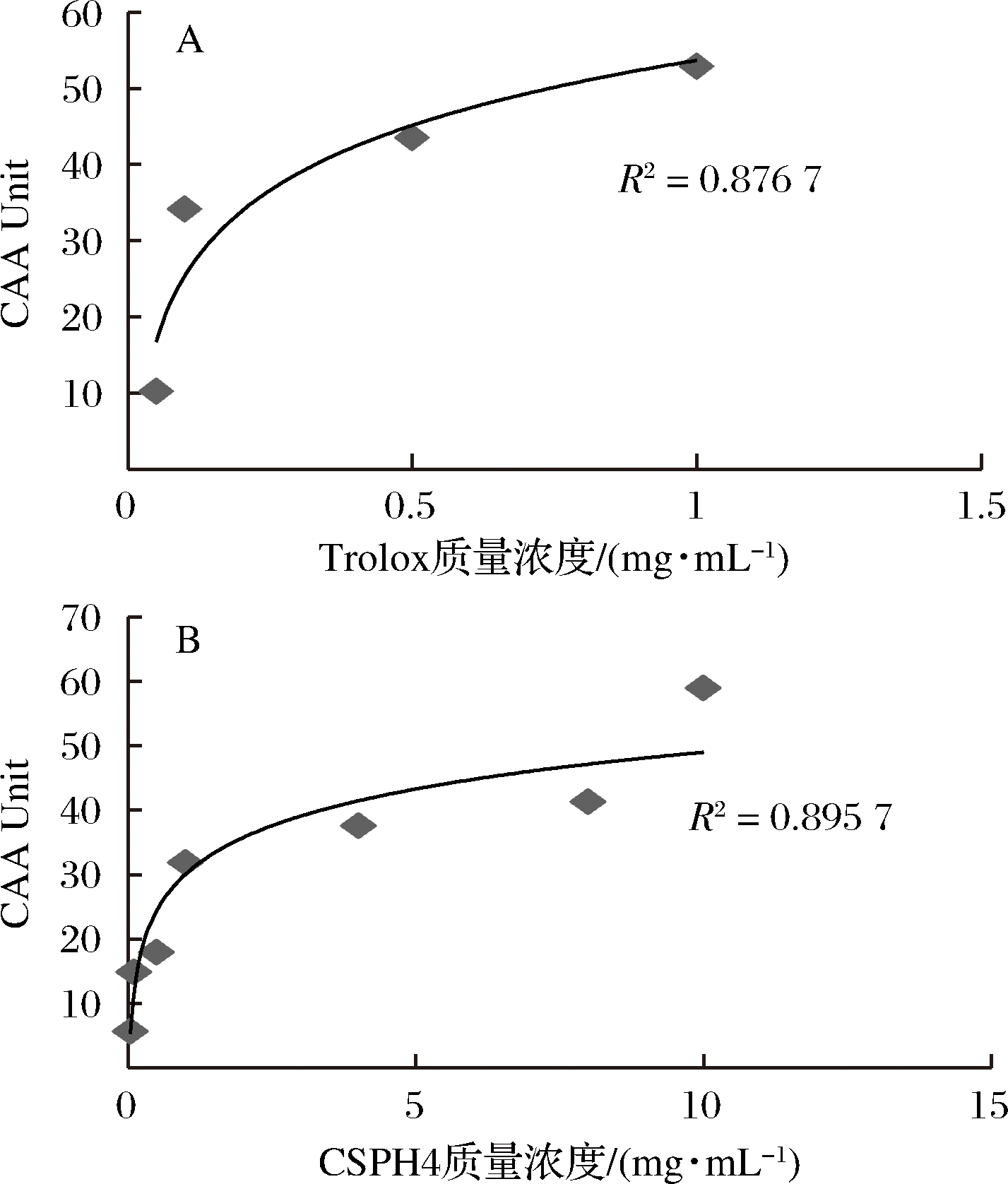
图5 Trolox(A)和CSPH4(B)的CAA活性值
Fig. 5 The CAA value of Trolox(A) and CSPH4(B)
3 结论
本文研究了米曲霉种曲和碱性蛋白酶顺序协同水解玉米大豆蛋白复配物的条件、玉米大豆蛋白水解物的抗氧化能力及氧化应激条件下对Caco-2细胞内ROS的清除能力。玉米大豆蛋白水解物具有良好的抗氧化活性,降低氧化应激条件下Caco-2细胞内ROS含量,在食品工业中具有成为良好抗氧化剂的潜力。
[1] 吴其夏,余应年,卢建.病理生理学[M].北京:中国协和医科大学出版社,2003:247-270.
[2] HALLIWELL B. How to characterize a biological antioxidant[J]. Free Radical Research Communications, 2009, 9(1):1-32.
[3] HALLIWELL B, AESCHBACH R, LÖLIGER J, et al. The characterization of antioxidants[J]. Food and Chemical Toxicology, 1995, 33(7):601-617.
[4] HALLIWELL B. Free radicals, antioxidants, and human disease: curiosity, cause, or consequence?[J]. Lancet, 1994, 344(8924):721-724.
[5] FINKEL T, HOLBROOK N J. Oxidants, oxidative stress and the biology of ageing[J]. Nature, 2000, 408(6 809):239-247.
[6] VALKO M, LEIBFRITZ D, MONCOL J. Free radicals and antioxidants in normal physiological functions and human disease[J].International Journal of Biochemistry and Cell Biology,2007, 39(1):44-84.
[7] ZHOU K,SUN S,CANNING C. Production and functional characterisation of antioxidative hydrolysates from corn protein via enzymatic hydrolysis and ultrafiltration[J]. Food Chemistry, 2012,135(3):1 192-1 197.
[8] 李亚会,吉薇,吉宏武,等.远东拟沙丁鱼抗氧化肽对Caco-2细胞氧化应激损伤的影响[J].广东海洋大学学报,2016,36(6):94-99.
[9] WANG X J,ZHENG X Q, KOPPARAPU N,et al. Purification and evaluation of a novel antioxidant peptide from corn protein hydrolysate[J].Process Biochemistry, 2014, 49(9):1 562-1 569.
[10] LIU X L,ZHENG X Q,SONG Z L,et al.Preparation of enzymatic pretreated corn gluten meal hydrolysate and in vivo evaluation of its antioxidant activity[J].Journal of Functional Foods,2015,18(Part B):1 147-1 157.
[11] ZHENG X Q,LI L L,LIU X L,et al. Production of hydrolysate with antioxidative activity by enzymatic hydrolysis of extruded corn gluten[J]. Applied Microbiology and Biotechnology,2006,73:763-770.
[12] JIN D X,LIU X L,ZHENG X Q,et al. Preparation of antioxidative corn protein hydrolysates, purification and evaluation of three novel corn antioxidant peptides[J]. Food Chemistry,2016, 204:427-436.
[13] CHEN C, CHI Y J, ZHAO M Y. Purification and identification of antioxidant peptides from egg white protein hydrolysate[J]. Amino Acids, 2012, 43: 457-466.
[14] 陈美珍, 余杰,郭慧敏.大豆分离蛋白酶解物清除羟基自由基作用的研究[J].食品科学,2002,23(1): 43-47.
[15] CHEN H M. et al. Structural analysis of antioxidative peptides from soybean β-conglyon[J]. Journal of Agricultural and Food Chemistry,1995,43: 574-578.
[16] YOKOMIZO A, TAKENAKA Y, TAKENAKA T. Antioxidative activity of peptides prepared from Okara protein[J]. Food Science and Technology Research, 2002, 8(4): 357-359.
[17] LEESEON KIM,YUNYOUNG KIM,ORAN KWON,et al. Antioxidant activities of ethanolic and acidic ethanolic extracts of astringent persimmon in H2O2-stimulated Caco-2 human colonic epithelial cells[J]. Food Science and Biotechnology, 2017,26(4):1 085-1 091.
[18] WOLFE KELLY L,LIU Ruihai.Cellular antioxidant activity (CAA) assay for assessing antioxidants,foods,and dietary supplements[J].Journal of Agricultural and Food Chemistry,2007,55(22):8 896-8 907.
[19] 郑喜群.玉米黄粉的酶解工艺与抗氧化活性肽的制备[D].北京:中国农业大学,2006.
[20] WANG L Y, LONG D, YU Z P, et al.Intracellular ROS scavenging and antioxidant enzyme regulating capacities of corn gluten meal-derived antioxidant peptides in HepG2 cells[J].Food Research International,2016,90:33-41.
[21] YI J E,ZHAO J,WU J P. Egg ovotransferrin derived IRW exerts protective effect against H2O2-induced oxidative stress in Caco-2 cells[J]. Journal of Functional Foods, 2017, 39:160-167.
[22] KELLETT M E, GREENSPAN P, PEGG R B. Modification of the cellular antioxidant activity (CAA) assay to study phenolic antioxidants in a Caco-2 cell line[J].Food Chemistry,2018,244:359-363.