木聚糖是由D-木糖通过β-1,4-糖苷键相连成的主链和少量L-阿拉伯糖和葡萄糖醛酸等构成的侧链所组成的结构复杂的不均一聚糖[1]。由于木聚糖资源以复杂的结构存在,而无法被人类直接利用,从而迫使人们积极寻找可利用木聚糖资源的途径[2]。木聚糖酶(xylanase)是指一类能专一降解木聚糖的多功能酶的总称[3-5]。绝大多数微生物都能利用木聚糖,目前所知,细菌、真菌、放线菌、酵母菌、藻类以及动物瘤胃中的细菌等大多数微生物都能产木聚糖酶[6-8]。木聚糖酶(EC3.2.1.8)作为木聚糖的主要降解酶,广泛应用于工业领域,不同的应用领域需要对应不同特性的木聚糖酶[9-11]。
合成生物学是运用工程化设计理念,对所选生物体进行目的性设计、改造乃至重新合成[12-13],创建赋予非自然功能的"人造生命",在生物技术颠覆式创新方面展现了无限的潜力。分子酶学工程是21世纪生命科学以及生物技术的重要领域。分子酶学工程研究是采用计算设计以及实验验证2种学科交叉的方法,获得具有特定性质和功能的生物大分子[14-15]。本研究采用合成生物学思路,以黑曲霉XZ-3S木聚糖酶XynZF-2基因序列为基础,将N端48个氨基酸替换成EvXyn11 N端的34个氨基酸;引入芳香族氨基酸和疏水性氨基酸;在C端引入二硫键,设计杂合酶基因,对杂合酶基因序列分析,基因全合成,在毕赤酵母中表达杂合酶基因,测定酶学性质,探讨酶构效关系。选育高产菌株,并对其发酵工艺进行初步研究,有望为木聚糖酶分子改造研究提供新的思路。
1 材料和方法
1.1 材料与试剂
菌株及质粒:黑曲霉(Aspergillus niger)XZ-3S、Escherichia coli DH5α由作者所在实验室保存;Pichia pastoris GS115、表达载体pPIC9K,Invitrogen公司。
主要试剂及工具酶:DNA质粒提取试剂盒、DNA片段回收试剂盒,Sangon公司;限制性内切酶、DNA Marker及T4DNA Ligase等,TaKaRa公司。
主要培养基:质量分数5%土豆浸汁(豆芽浸汁、麸皮浸汁)、质量分数0.5%蛋白胨、质量分数0.5%硫酸铵、质量分数1% 100 μmol/L pH 6.0磷酸盐缓冲液。
1.2 仪器与设备
C1000梯度PCR扩增仪,美国Bio-Rad公司;DYY-2稳压稳流电泳仪,北京市六一仪器厂;DC-0506fE温恒槽,上海比朗仪器有限公司;HZQ-F160A恒温振荡器,上海一恒科学仪器有限公司;Neofuge 23R高速冷冻离心机,上海力申科学仪器有限公司。
1.3 引物
根据Xyn-ZL基因序列结合pPIC9K多克隆位点,设计引物ZL-JF:CCGGAATTCATGGCTCAGACCTGTTTGAC(EcoR I),ZL-JR:ATAAGAATGCGGCCGCTTACTGAACACAGATGGAC(Not I)。
1.4 验证方法
1.4.1 木聚糖酶基因生物信息学分析
GenBank中通过BLAST查询相似序列,序列的同源性比较及核苷酸序列分析利用DNAMAN 5.0软件处理,并将翻译后氨基酸序列进行Chou-Fasman二级结构预测与swissmodel三维结构的同源建模。利用DiANNA预测分子内二硫键,确定突变位点,以及利用http://www.uniprot.org/uniprot/P82973预测木聚糖酶活性中心。N-糖基化分析用NetNGlyc 1.0(http://www.cbs.dtu.dk/services/NetNGlyc/),O-糖基化分析用NetOGlyc 3.1(http://www.cbs.dtu.dk/services/NetOGlyc/)。
1.4.2 杂合酶基因序列设计及合成
将黑曲霉XZ-3S木聚糖酶XynZF-2的N端48个氨基酸替换成EvXyn11 N端的34个氨基酸;引入芳香族氨基酸P9Y和H14F;在C端引入二硫键Cys38-Cys191;α-螺旋及cord区域分别引入疏水性氨基酸K164M、G166A、N160I、V111A以及G109A。将该杂合酶序列送于公司进行全序列合成。
1.4.3 杂合酶基因工程菌构建
用引物ZL-JF、ZL-JR PCR扩增杂合酶基因,PCR扩增条件为:94 ℃预变性2 min;94 ℃变性30 s,67 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。将扩增产物和酵母表达载体pPIC9K经EcoR I、Not I双酶切,酶切产物回收后经T4 DNA连接酶连接,转化E. coli DH5α,在含有抗性平板上筛选阳性重组克隆子pPIC9K-ZL,提取质粒,进行双酶切验证。将重组质粒线性化,电转化P. pastoris GS115,筛选得到His+克隆,保存转化子,经G418(工作浓度为4.0 mg/mL)浓度筛选,获得目的基因的高拷贝转化子GS115-Xyn-ZL。
1.4.4 重组菌摇瓶发酵工艺研究
采用单因素实验设计研究发酵培养基、培养温度、种龄、诱导时间、诱导起始pH、甲醇诱导浓度等对重组菌GS115-Xyn-ZL产酶的影响。
1.4.5 木聚糖酶活力的测定
采用DNS法测酶活力[16]。酶活力单位的定义:在40 ℃和pH 5.0条件下,以0.5%桦木木聚糖作为底物,以每分钟产生1 μmol木糖所需的酶量为1个酶活力单位。以木糖作为标样的标准曲线为y=1.896 3x-0.025 6,R2=0.999 9。相对酶活力定义:以同组最高酶活力为100%计算各因素的相对酶活力。
1.4.6 蛋白质电泳(SDS-PAGE)分析
发酵液经离心、透析袋(14.0 kDa孔径)透析、浓缩处理,取上清进行5%浓缩胶,12%分离胶的SDS-PAGE电泳。
1.4.7 重组酶酶学性质测定
1.4.7.1 最适作用温度及温度稳定性
在pH 5.0,温度分别为35、40、45、50、55和60 ℃条件下反应15 min,按照木聚糖酶活力测定方法测定GS115-Xyn-ZL酶活力,以此来确定木聚糖酶的最适反应温度。将GS115-Xyn-ZL酶液在45、50和55 ℃条件下分别保温处理1 h,每隔5 min取样1次,按常规方法进行残余酶活力测定,以未保温(4 ℃冰箱)的酶样活力为100%,以此来确定酶的稳定性。
1.4.7.2 最适pH及pH稳定性
于最适反应温度下,测定GS115-Xyn-ZL发酵液分别在pH 3.0、4.0、5.0、6.0、7.0、8.0、9.0的条件下的酶活力,以最高酶活力为100%,以此来确定酶的最适反应pH。在40 ℃条件下,将酶液在不同pH下保温1 h,再分别测定残留酶活力与未处理酶的活力比,计算百分比,由此确定酶的pH稳定性。
1.4.8 数据的统计学分析
每个实验重复3次,取其均值,经Excel办公软件和SPSS11.0软件处理最终实验数据结果,绘制相应曲线。
2 结果与分析
2.1 木聚糖酶基因生物信息学分析
杂合木聚糖酶XynZL同源建模(图1)发现,突变酶与原酶结构相似,都属于GH11家族,由1个简单的α-螺旋以及2个反向的β-折叠片层组成,呈右手半握状结构。预测活性中心为Glu89、Glu180。此外杂合酶XynZL相较原酶XynZF-2基因改变的氨基酸位点均在图1中标识。
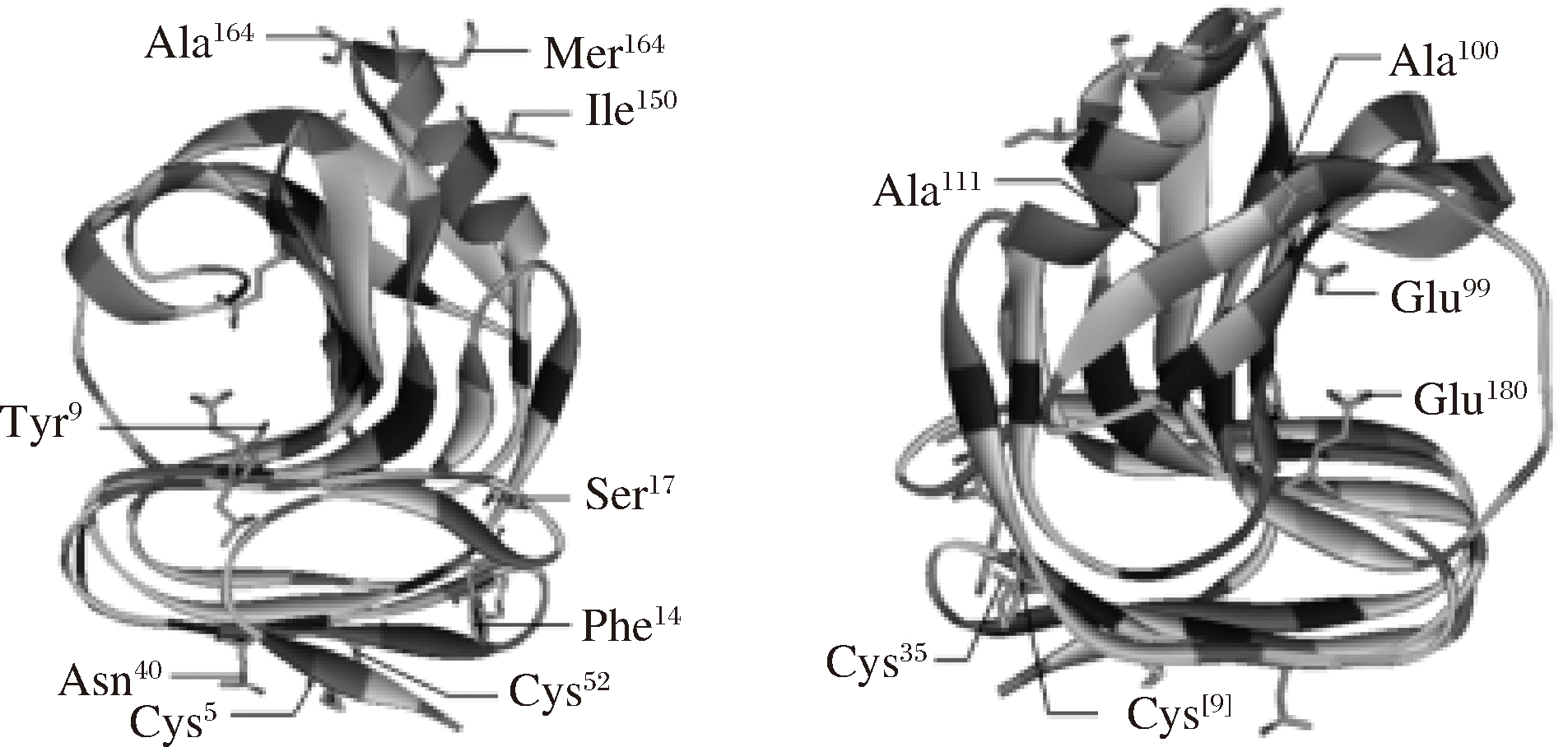
图1 杂合木聚糖酶XynZL三维结构预测图谱
Fig.1 Three-dimensional structure of heterozygous xylanase XynZL
2.2 杂合酶基因序列设计及合成
杂合酶序列送于公司进行全序列合成,得到杂合酶基因及杂合酶序列图谱(图2),GenBank登录号为MK484115。

图2 人工酶序列图谱
Fig.2 Sequence of artificial enzyme
注:单下划线为替换成EvXyn11 N端的34个氨基酸,阴影为引入的芳香族氨基酸P9Y和H14F,斜体为C端引入的二硫键Cys38-Cys191;双下划线表示α-螺旋及cord区域分布引入的疏水性氨基酸K164M、G166A、N160I、V111A以及G109A。
2.3 杂合酶基因工程菌构建
PCR扩增目的基因,琼脂糖凝胶电泳如图3所示。

M-DL1000 DNA Marker;1-PCR产物
图3 目的基因PCR扩增
Fig.3 PCR amplification of xylanase gene
筛选阳性重组克隆子,提取质粒,双酶切琼脂糖凝胶电泳显示目的基因与载体成功连接(图4)。重组质粒线性化,电转化P. pastoris GS115,筛选得到His+克隆,保存转化子,经G418浓度筛选,获得目的基因的高拷贝转化子。
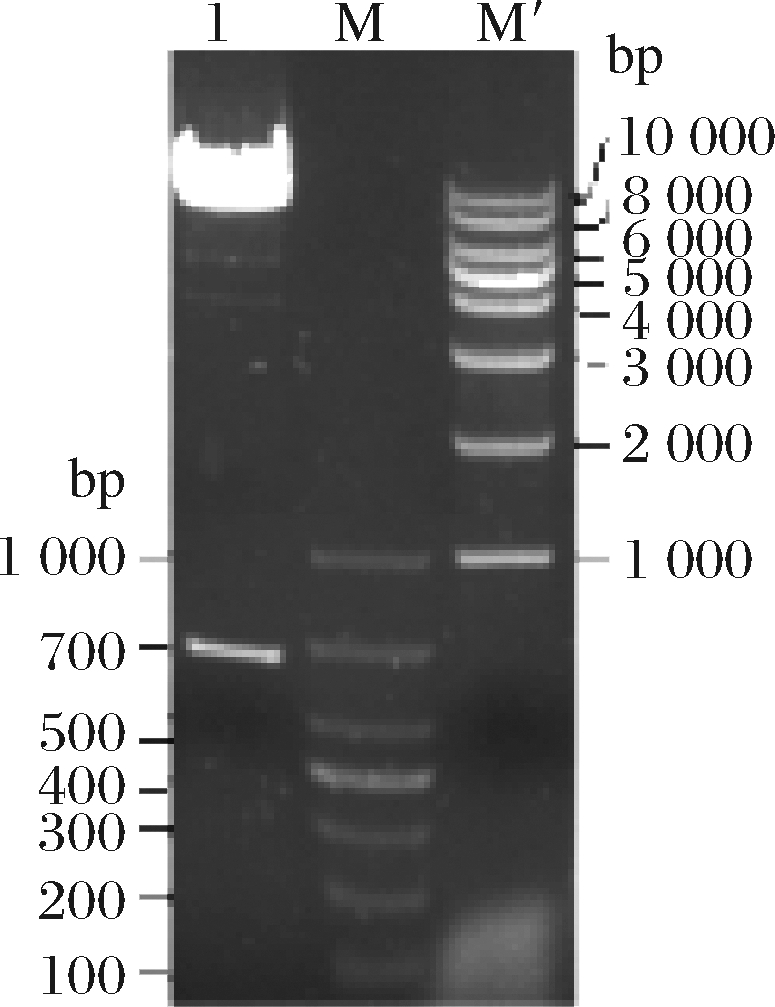
1-重组质粒双酶切;M-DL1000 DNA Marker;M’-1Kb DNA Marker
图4 重组质粒双酶切验证
Fig.4 Enzyme digestion of recombinant plasmid
2.4 重组菌摇瓶发酵工艺研究
对重组菌GS115-Xyn-ZL进行摇瓶表达,采用单因素手段确定摇瓶发酵的最适条件。最佳发酵培养基:土豆培养基(图5-a);最佳诱导温度:28 ℃(图5-b);最佳种龄(OD600为13.182):20 h(图5-c);最佳诱导时间:168 h(图5-d);最佳诱导起始pH:pH 6.5(图5-e);甲醇诱导最佳浓度:体积分数1.5%(15 mL/L)(图5-f)。
2.5 蛋白质电泳(SDS-PAGE)分析
由图6可见,目的菌株GS115-XynZL在泳道中有明显条带,分子量约为24.60 kDa,对照组在对应位置没有条带,证明重组菌成功表达了目的蛋白。

图5 单因素优化发酵最适条件
Fig.5 Optimum fermentation conditions by single factor
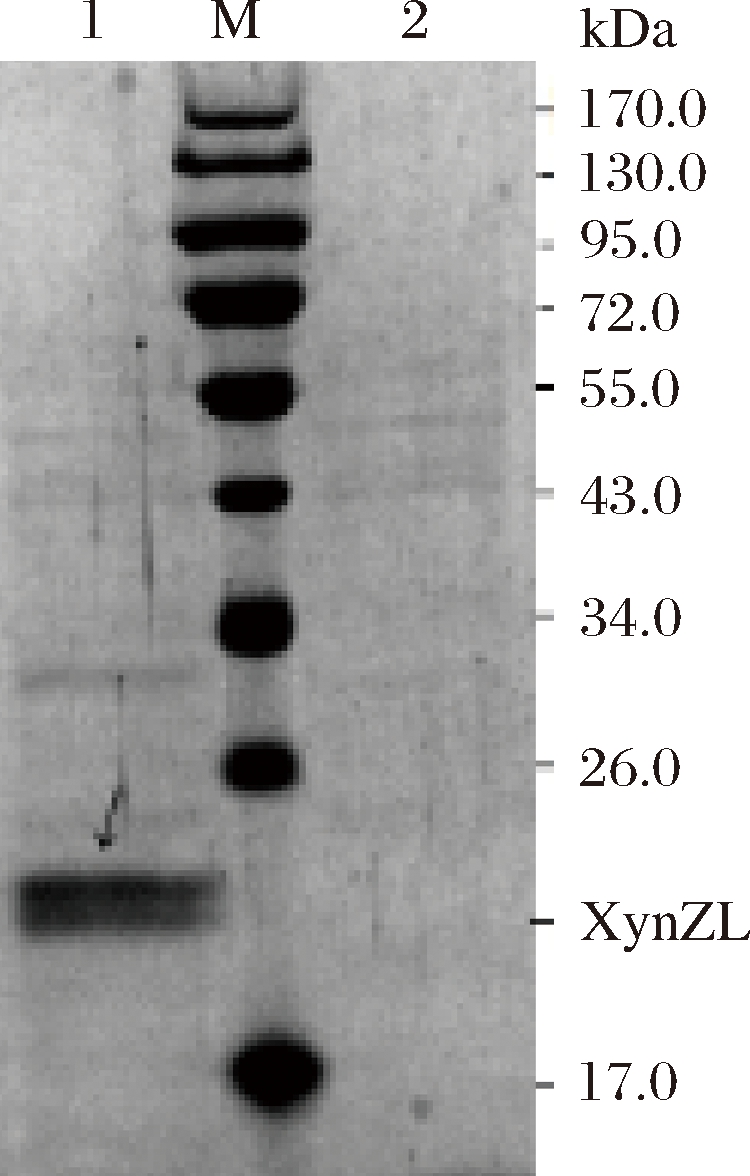
1-GS115-XynZL蛋白条带;2-GS115/pPIC9K蛋白条带
图6 重组木聚糖酶SDS-PAGE电泳分析
Fig.6 SDS-PAGE electrophoretic analysis of recombinant xylanase
2.6 重组酶酶学性质测定
从图7-a可见,该重组酶最佳反应温度为50 ℃,比XynZF-2最适反应温度[17]提高10 ℃。在50 ℃保温30 min,相对残余酶活力为58.2%(图7-b),比XynZF-2(9.2%)[17]有显著提升。最适pH为pH 5.0(图7-c),与XynZF-2[17]基本一致。从图7-d可见,该重组酶在pH 5.0~9.0保持较高的活力,相比XynZF-2,pH稳定范围有所拓宽。
3 结论与讨论
目前,改良木聚糖酶分子主要通过理性设计、非理性设计及介于两者之间的半理性设计来实现,以获得酶学特性优良的木聚糖酶[18-19]。大量研究使得人们对木聚糖酶分子结构和酶学性质的相关性有了一定程度的了解。侯洁等[20-21]通过在N端引入部分氨基酸以及构建二硫键,可以将变性温度显著提升且仍保持较高的酶活力,由此可知,N端改造可以对GH11 家族木聚糖酶的热稳定性起到良好的改善作用。李婧逸等[22-23]通过定点突变T205C和A52C在C端引入二硫键,发现突变酶XynZF T205C-A52C的最适温度比原酶XynZF-2提高10 ℃以及其在50 ℃的热稳定性进一步提高,引入二硫键能提高黑曲霉木聚糖酶热稳定性。以大量研究为基础,本实验将多个影响酶热稳定性的因素融合,以期为木聚糖酶分子改造提供新的思路。

图7 重组酶酶学性质
Fig.7 Enzymatic properties of recombinant xylanase
选择合适的表达系统是蛋白质体外成功表达的关键,毕赤酵母表达系统是目前最为成功的外源蛋白表达系统之一,属于酵母表达系统的一种。酵母是一种单细胞低等真核生物,培养条件普通,生长繁殖迅速,能够耐受较高的流体静压,用于表达基因工程产品时,可以大规模生产,有效降低了生产成本。酵母表达系统由于兼具原核以及真核表达系统的优点,应用此系统可高水平表达蛋白,且具有翻译后修饰功能,外源蛋白基因遗传稳定,所以酵母表达系统被认为是一种表达大规模蛋白的强有力的工具。
[1] WALIA A, GULERIA S, MEHTA P, et a1. Microbial xylanases and their industrial application in pulp and paper biobleaching: a review[J]. Biotech, 2017, 7(1):1-12.
[2] PENG Z, JIN Y, DU J. Enzymatic properties of endo-1,4-β-xylanase from wheat malt[J]. Protein Pept Lett, 2019, 26(5):332-338.
[3] 宋立立,顿宝庆,张亚楠,等.木聚糖酶基因的克隆与表达[J].江苏农业科学,2018,46(10):43-46.
[4] 陈洪洋,蔡俊,林建国,等.木聚糖酶的研究进展[J].中国酿造,2016.35(11):1-6.
[5] LI Q, WU T, DUAN Y. et al. Improving the thermostability and pH stability of Aspergillus niger xylanase by site-directed mutagenesis[J]. Appl Biochem Microbiol, 2019, 55(2): 136-144.
[6] SANJIVKUMAR M, SILAMBARASAN T, PALAVESAM A, et a1. Biosynthesis, purification and characterization of β-1,4-xylanase from a novel mangrove associated actinobacterium Streptomyces olivaceus (MSU3) and its applications[J]. Protein Expres Purif, 2017, 130:1-12.
[7] ZHAO Y Y, MENG K, LUO H Y, et a1. Molecular and biochemical characterization of a new alkaline active multidomain xylanase from alkaline wastewater sludge[J]. World J Microbiol Biotechnol, 2013, 29(2):327-334.
[8] BASOTRA N, JOSHI S, SATYANARAYANA T, et a1. Expression of catalytically efficient xylanases from thermophilic fungus Malbranchea cinnamomea for synergistically enhancing hydrolysis of lignocellulosics[J]. Int J Biol Macromol, 2018, 108:185-192.
[9] 韩世强,李莎怡静,徐彩红.饲用木聚糖酶的应用现状及作用机理[J].粮食与饲料工业,2018(4):51-54.
[10] 张燕青,张超群,王浩猛.木聚糖酶的分子改造方法及其工业应用研究现状[J].中国酿造,2018(1):25-29.
[11] 王晓宇,刘伟娜,谢响明,等.青霉L1来源具有生产木寡糖应用潜力的高比活GH11木聚糖酶[J].生物工程学报,2018,34(1):68-77.
[12] 匡雪君,邹丽秋,孙超,等.天然产物合成生物学体系的优化策略[J].生物技术通报,2017,33(1):48-57.
[13] 李检秀,陈先锐,陈小玲,等.应用合成生物学策略构建全细胞生物催化剂合成(S)-乙偶姻[J].中国生物工程杂志,2019,39(4):60-68.
[14] 冯雁.酶功能进化新策略及应用[J].工业微生物,2017,47(1):66-67.
[15] 王志新.中国酶学基础研究四十年回顾[J].生物化学与生物物理进展,2014,41(10):990-996.
[16] TAN Z B, TANG C D, WU M C, et al. Exploration of disulfide bridge and N-glycosylation contributing to high thermostability of a hybrid xylanase[J]. Protein Pept Lett, 2014, 21(9):657-662.
[17] 王丹丹,周晨妍,李同彪,等.黑曲霉XZ 3S 木聚糖酶基因xynZF-2在毕赤酵母中的高效表达[J].食品工业科技,2015,36(7):200-203;280.
[18] 张燕青,张超群,王浩猛.木聚糖酶的分子改造方法及其工业应用研究现状[J].中国酿造,2018,37(1):25-29.
[19] HEGAZY UM, El-KHONEZY MI, SHOKEER A, et al. Revealing of a novel xylose-binding site of Geobacillus stearothermophilus xylanase by directed evolution[J]. J Biochem, 2019,165(2):177-184.
[20] 侯洁,蒋玥凤,熊科,等. N末端改造提高GH11家族木聚糖酶热稳定性的研究进展[J].食品科学,2019,40(3):293-299.
[21] 郭超.牛肠激酶轻链在毕赤酵母中的表达及热稳定性改造[D].天津:天津大学,2016.
[22] 李婧逸,任冰洁,蔡刘滕子,等. C-端引入二硫键对黑曲霉木聚糖酶XynZF-2热稳定性的影响[J]. 基因组学与应用生物学,2017,36(12):5 122-5 127.
[23] 刘晓彤,邬敏辰,殷欣,等.二硫键对提高木聚糖酶AoXyn11A热稳定性的作用[J].食品与生物技术学报,2014,33(10):1 038-1 043.