β-丙氨酸(3-氨基丙酸)广泛应用于医药、食品、化工等领域,目前主要是以丙烯腈或β-氨基丙腈为底物通过化学合成[1-2]。随着环境问题日益引起人们的关注,传统的化学方法将逐渐被生物方法所取代,如酶转化法、全细胞催化法和发酵法[3-4]。
L-天冬氨酸-α-脱羧酶(EC4.1.1.11 ADC)是催化L-天冬氨酸产生β-丙氨酸的关键酶,近几十年来受到广泛的关注。细菌来源的ADC研究较多,包括来源于大肠杆菌、谷氨酸棒杆菌和枯草芽孢杆菌的ADC等[5-8]。1979年,WILLIAMSON和BROWN首次从大肠杆菌中分离出ADC[9],随后RAMJEE等[10]对该酶进行酶学性质表征,其Km和kcat分别被确定为0.151 mm和0.57 s-1。谷氨酸棒杆菌来源的ADC比酶活为2.7 μmol/(min·mg) [11]。结核分枝杆菌来源的ADC经过量表达、纯化后,测得动力学参数Km和kcal分别为0.219 mm和0.65 s-1。,比酶活为2.1 μmol/(min·mg)[12]。
谷氨酸棒杆菌来源的ADC稳定性好、酶活较高,具有工业应用潜力。用谷氨酸棒杆菌来源的ADC纯酶合成β-丙氨酸,产量可达到12.85 g/L [13];过表达谷氨酸棒杆菌来源的ADC并设计代谢途径,β-丙氨酸合成量达到32.3 g/L [14];去年,LI等[15]构建了过量表达谷氨酸棒杆菌ADC的大肠杆菌重组菌,实施全细胞催化生产β-丙氨酸,产量达到24.8 g/L。
众多的研究表明,微生物来源ADC的酶活力很低,使得β-丙氨酸的生物合成法受到限制。有研究表明,昆虫来源ADC的酶活力远高于细菌来源ADC[16-18]。在前期研究中,将红粉甲虫(又名赤拟谷盗,Tribolium castaneum)来源的ADC在大肠杆菌中重组表达,重组酶的比酶活是细菌来源的2倍左右[19]。对其进行分子改造,初筛结果显示突变体K49R稳定性与酶活力较野生型有一定的优势[20]。本研究旨在实现β-丙氨酸“绿色生产”,筛选催化能力优良的突变体、并进行酶学性质表征,建立全细胞催化策略,优化重组菌株合成β-丙氨酸的催化工艺。
1 材料与方法
1.1 材料
重组表达载体pEt-28a(+)-TcADC、pEt-28a(+)-TcADC/K49R为本实验室早期构建,宿主菌E. coli BL21(DE3)为实验室保藏。种子培养基为LB培养基,诱导培养基为2YT培养基。L-天冬氨酸钠、β-丙氨酸、IPTG、卡那霉素购于上海生工生物工程有限公司;酵母提取物、蛋白胨购于Oxford公司;异硫氰酸苯酯(phenyl isothiocyanate,PITC)购于Sigma公司。
1.2 主要仪器设备
蛋白纯化仪和纯化柱,GE Healthcare UK Ltd。
2 实验方法
2.1 酶的过量表达与纯化
将重组大肠杆菌BL21/pET28a-TcADC、BL21/pET28a-TcADC/K49R的单克隆接种于5 mL LB培养基(含有50 μg/mL卡那霉素)中,置于37 ℃、200 r/min的摇床中,过夜振荡培养,进行菌种活化。按2%(体积分数)接种量接种于含有50 μg/mL卡那霉素的 2YT培养基中,37 ℃、200 r/min,振荡培养至OD600为0.6~0.8。加入终浓度为0.2 mmol/L的IPTG,在20℃条件下诱导表达20 h左右。
利用Purifier AKTA蛋白纯化仪和His Trap HP纯化柱对目的蛋白进行分离纯化。收集细胞培养液,12 000 r/min离心2 min,弃去上清液,收集沉淀。用Binding缓冲液(20 mmol/L Na2HPO4、20 mmol/L NaH2PO4、500 mmol/L NaCl、20 mmol/L咪唑)悬浮细胞,置于冰上进行超声波破碎。溶液澄清之后,于4 ℃、12 000 r/min离心45 min,收集细胞破碎上清液。用Binding缓冲液,将0.45 μm滤膜过滤后的粗酶液上样,用Binding缓冲液洗去非结合蛋白。用15个柱体积的Elution缓冲液(20 mmol/L Na2HPO4、20 mmol/L NaH2PO4、500 mmol/L NaCl、500 mmol/L咪唑)进行线性洗脱,收集洗脱峰。放入50 mmol/L Tris-HCl(pH 7.0)缓冲液中,4 ℃,过夜透析除去咪唑。利用12%(质量浓度)的SDS-PAGE对分离纯化样品进行电泳检测,利用Brandford法测定目的蛋白浓度。
2.2 L-天冬氨酸和β-丙氨酸检测
L-天冬氨酸和β-丙氨酸采用异硫氰酸苯酯(PITC)衍生法检测[19-20]。氨基酸的衍生产物采用HPLC测定,色谱柱为La Chrom C18(5 μm,4.6 mm×250 mm);流动相A溶液80%(体积分数)乙腈水溶液,B溶液97∶3(体积分数,pH 6.5)的0.1 mol/L乙酸钠-乙腈溶液;梯度洗脱:0~20 min,B溶液由95%下降至65%;20~30 min,B溶液由65%上升至95%;30~43 min,B溶液梯度保持不变,检测波长为254 nm,柱温为40 ℃。
2.3 酶学性质测定
最适温度测定。将pH 6.5的反应液(含200 μg/mL纯酶液,100 mmol/L L-天冬氨酸钠,1 mmol/L PLP)置于不同温度的水浴(30、37、40、42、50、55 ℃)中反应10 min,测定酶活。将最高酶活定义为100%,分析酶的最适反应温度。
温度稳定性测定。将500 μg/mL纯酶液置于不同温度(30、37、40、42、50、55 ℃)孵育30 min后,于冰上冷却5 min。加入终浓度100 mmol/L L-天冬氨酸钠和1 mmol/L PLP,于37 ℃,pH 6.5条件下反应10 min测定残余酶活。将初始酶活定义为100%,分析温度稳定性情况。
最适pH测定。配置不同pH 4.0、5.0、6.0、6.5、7.0、8.0、9.0的反应液(含200 μg/mL纯酶液,100 mmol/L L-天冬氨酸钠,1mmol/L PLP),于37 ℃反应10 min测定酶活性。将最高酶活定义为100%,分析酶的最适反应pH。
pH稳定性测定。将500 μg/mL纯酶液置于不同pH缓冲液(pH 4.0、5.0、6.0、6.5、7.0、8.0、9.0)中,于冰上过夜孵育。加入终浓度100 mmol/L L-天冬氨酸钠和1 mmol/L PLP,于37 ℃,pH 6.5条件下反应10 min测定残余酶活。将初始酶活定义为100%,分析pH稳定性情况。
动力学常数测定。在终浓度50 μg/mL纯酶液中,分别加入终浓度5~100 mmol/L L-天冬氨酸钠、终浓度1 mmol/L PLP,于37 ℃,pH 6.5条件下,反应10 min检测β-丙氨酸产量,测定初始反应速率。采用GraphPad Prism软件拟合曲线,测定动力学常数Km,kcat。
将在37 ℃,pH 6.5的条件下,每小时转化L-天冬氨酸钠生成1 mmol β-丙氨酸所需酶量定义为一个酶活力单位U。
2.4 全细胞催化合成β-丙氨酸的体系优化
以提高重组菌株的蛋白表达量及生物量为目的,在培养基中添加10和20 g/L葡萄糖,重组菌株经0.2 mmol/L IPTG,20 ℃诱导20 h后,冰浴破碎,利用质量浓度为12%的SDS-PAGE对重组酶的表达情况进行电泳检测。
重组菌细胞经培养诱导后,离心收集,浓缩到OD600=200。在10 mL反应液(pH 6.5)中,加入L-天冬氨酸钠固体粉末至终浓度1 mol/L,1 mmol/L PLP,反应温度为37 ℃,持续搅拌。每隔2 h取样测定L-天冬氨酸剩余量和β-丙氨酸的生成量。同时将不添加PLP的实验样品作为对照组。
3 结果
3.1 L-天冬氨酸-α-脱羧酶的表达与纯化
酶活与热稳定性初步筛选结果显示,红粉甲虫来源L-天冬氨酸-α-脱羧酶(TcADC)突变体K49R催化性能优良。本研究将其过量表达并分离纯化。分离纯化结果如图1所示,重组菌成功表达了野生型与突变体L-天冬氨酸-β-脱羧酶,且获得了电泳纯目的蛋白,分子量约为61 kDa。
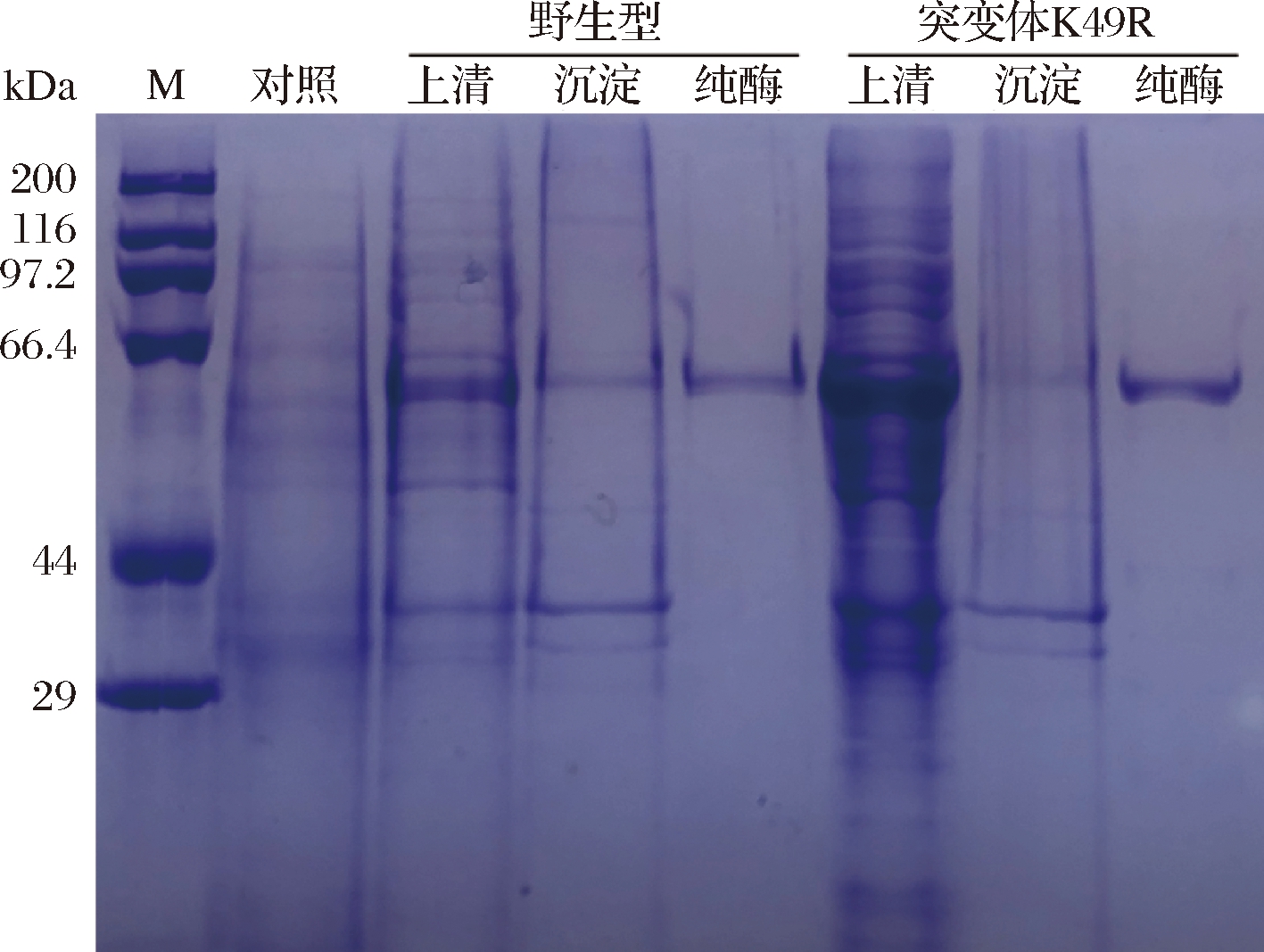
图1 重组酶过量表达与纯化
Fig.1 Overexpression and purification of recombinant enzymes
3.2 突变体K49R的酶学性质表征
由图2-a可知,野生型的最适温度为37 ℃,突变体K49R的最适温度为42 ℃。在不同温度下处理酶30 min后测量其热稳定性,发现随着温度升高,野生型的酶活性降低,特别是在高于40 ℃时(图2-b)。在40 ℃处理后,野生型的活性保持在70%,而在50 ℃处理情况下,野生型仅剩余22%的酶活;而突变体K49R稳定性有所提高,50 ℃处理后仍剩余34%的酶活(图2-b)。
野生型与突变体K49R的最适pH均为6.5(图2-c)。在冰上在各种pH条件下孵育8 h后检测其pH稳定性,突变体K49R与野生型几乎无差异:在pH 6.0~7.0之间保持稳定,在pH低于5.5或高于7.5时,TcADC的剩余酶活低于75%(图2-d)。

a-最适温度;b-温度稳定性;c-最适pH;d-pH稳定性
图2 温度与pH对酶活力的影响
Fig.2 Effects of temperature and pH on enzymatic activity
测定突变体K49R的比活性和动力学参数(表1)并与野生型进行比较。野生型的比活性为290±9.5 U/g,Km为5.63±0.36 mmol/L,kcat为16.9±0.6 s-1。突变体K49R的Km值有大幅下降,表明其底物亲和力优于野生型;虽然kcat值略有下降,但是催化效率还是有显著提升,是野生型的1.8倍。
表1 动力学参数与比酶活
Table 1 Kinetic parameters and specific activities

酶Km/(mmol·L-1)kcat/(s-1)kcat/Km/(L·mmol-1·s-1)电活性/(U·g-1)TcADC5.63±0.3616.9±0.63.00290±9.5K49R2.66±0.2014.2±1.15.34269±5.0
3.3 全细胞催化合成β-丙氨酸
3.3.1 重组ADC表达条件的优化
以提高重组菌株的蛋白表达量及生物量为目的,在培养基中添加葡萄糖。培养、诱导表达后,蛋白表达情况如图3所示。添加10 g/L葡萄糖后,蛋白表达量有所增加,可溶性与沉淀中的蛋白量都随之增加。与添加20 g/L葡萄糖和未添加葡萄糖相比,添加量为10 g/L时,相同生物量的菌体内可溶性蛋白含量较高。另外,添加葡萄糖后,其生物量也从OD600 5.8提高到8.8。

图3 葡萄糖对重组ADC的影响
Fig.3 Effect of glucose on the expression of TcADC
3.3.2 PLP对全细胞催化反应的影响
TcADC为PLP依赖型酶,通过一次性加入高浓度底物的方法研究PLP对全细胞催化反应的影响。在含有重组大肠杆菌细胞(OD600=200)的反应液中,添加1 mol/L的L-天冬氨酸进行全细胞催化反应,定时取样监测的底物与产物的含量。结果如图3所示,添加1 mmol/L PLP的反应体系较快地完成了催化(图4-b),而未添加PLP的反应体系也能完成催化,但是生产效率较低(图4-a)。重组菌细胞内的PLP作为辅酶参与全细胞催化,而额外添加PLP可以大幅提高β-丙氨酸生产效率。添加2 mmol/L的PLP或每隔10 h添加1 mmol/L的PLP,催化效率几乎与添加1 mmol/L的PLP相同(数据未显示),表明在本全细胞催化体系中,一次性添加1 mmol/L的PLP可以满足辅酶的供应需求。
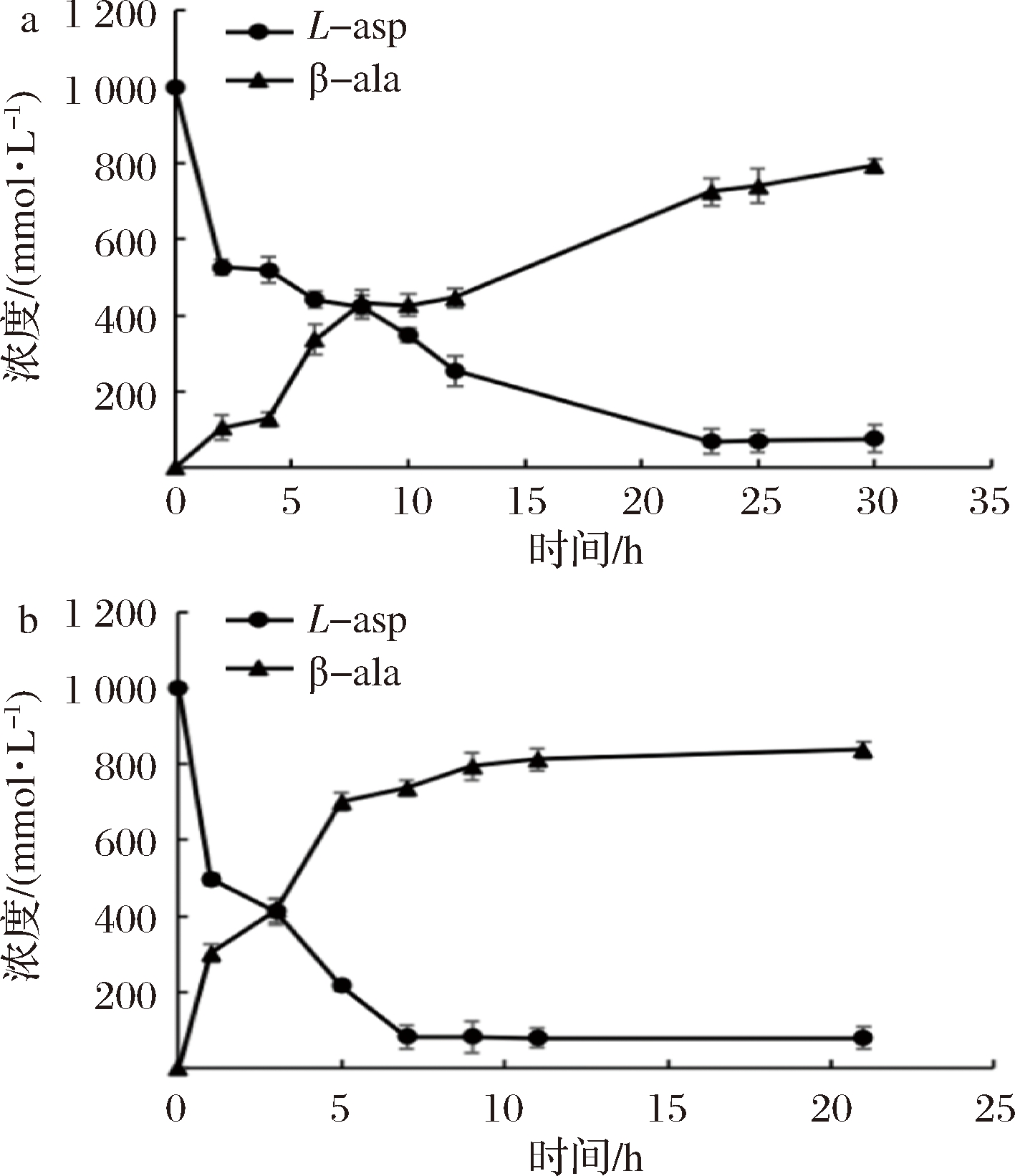
a-未添加PLP;b-添加1 mmol/L PLP
图4 PLP对全细胞催化合成β-丙氨酸的影响
Fig.4 Effect of PLP on β-alanine synthesis using whole-cell catalysis
4 结论
目前,由于ADC的催化能力有限,限制了工业上生物合成法生产β-丙氨酸。本研究对红粉甲虫L-天冬氨酸-β-脱羧酶的突变体K49R进行了酶学性质解析,发现其热稳定性较野生型有所提高,最适pH和pH稳定性与野生型相差无几。酶动力学测定结果显示其催化效率是野生型的1.8倍,推测是得益于其大幅提高底物亲和力。突变体K49R具有更优良的催化性能以及很大的工业应用潜力。全细胞催化合成β-丙氨酸体系优化结果显示,添加10 g/L葡萄糖可以将重组菌生物量提高0.5倍,重组酶的表达量也相应提升;添加适量PLP可以大幅缩短催化时间,提高β-丙氨酸的合成效率。
[1] CARLSON GH, HOTCHKISS CN. Preparation of beta-alanine. US, 2336067[P]. 1943.
[2] FORD J H. The alkaline hydrolysis of β-aminopropionitrile[J]. J Am Chem Soc, 1945, 67(5):876-877.
[3] DE CARVALHO C. Enzymatic and whole cell catalysis: finding new strategies for old processes[J]. Biotechnol Adv, 2011, 29(1):75-83.
[4] SCHMID A, DORDICK JS, HAUER B, et al. Industrial biocatalysis today and tomorrow[J]. Nature, 2001, 409(6 817):258-268.
[5] SALDANHA SA, BIRCH LM, WEBB ME, et al. Identification of Tyr58 as the proton donor in the aspartate-α-decarboxylase reaction[J]. Chem Commun, 2001, 18:1 760-1 761.
[6] SCHMITZBERGER F, KILKENNY M L, LOBLEY C M C, et al. Structural constraints on protein self-processing in L-aspartate-α-decarboxylase[J]. EMBO J, 2003, 22(23):6 193-6 204.
[7] LEE B I, SUH S W. Crystal structure of the schiff base intermediate prior to decarboxylation in the catalytic cycle of aspartate α-decarboxylase[J]. J Mol Biol, 2004, 340(1):1-7.
[8] KÖNST P M, FRANSSEN M C R, SCOTT E L, et al. A study on the applicability of L-aspartate α-decarboxylase in the biobased production of nitrogen containing chemicals[J]. Green Chem, 2009, 11:1 646-1 652.
[9] WILLIAMSON JM and BROWN GM. Purification and properties of L-Aspartate-alpha-decarboxylase, an enzyme that catalyzes the formation of beta-alanine in Escherichia coli[J]. J Biol Chem, 1979, 254(16):8 074-8 082.
[10] RAMJEE MK, GENSCHEL U, ABELL C, et al. Escherichia coli L-aspartate-alpha-decarboxylase: preprotein processing and observation of reaction intermediates by electrospray mass spectrometry[J]. Biochem J, 1997, 323(Pt 3):661-669.
[11] QIAN Y, LIU J, SONG W, et al. Production of β-Alanine from fumaric acid using a dual-enzyme cascade[J]. ChemCatChem, 2018, 10:4 984-4 991.
[12] CHOPRA S, PAI H, RANGANATHAN A, et al. Expression, purification, and biochemical characterization of Mycobacterium tuberculosis aspartate decarboxylase, PanD[J]. Protein Expres Purif, 2002, 25(3):533-540.
[13] SHEN Y, ZHAO L, LI Y, et al. Synthesis of β-alanine from L-aspartate using L-aspartate-α-decarboxylase from Corynebacterium glutamicum[J]. Biotechnol Lett, 2014, 36(8):1 681-1 686.
[14] SONG C, LEE J, KO Y, et al. Metabolic engineering of Escherichia coli for the production of 3-aminopropionic acid[J]. Metab Eng, 2015, 30:121-129.
[15] LI H, LU X, CHEN K, et al. β-alanine production using whole-cell biocatalysts in recombinant Escherichia coli[J]. Mol Catal, 2018, 449:93-98.
[16] DAI F, LIANG Q, CAO C, et al. Aspartate decarboxylase is required for a normal pupa pigmentation pattern in the silkworm Bombyx mori[J]. Sci Rep, 2015, 5:10 885.
[17] RICHARDSON G, DING H, ROCHELEAU T, et al. An examination of aspartate decarboxylase and glutamate decarboxylase activity in mosquitoes[J]. Mol Biol Rep, 2010, 37(7).
[18] BORODINA I, KILDEGAARD KR, JENSEN NB, et al. Establishing a synthetic pathway for high-level production of 3-hydroxypropionic acid in Saccharomyces cerevisiae via β-alanine[J]. Metabolic Eng, 2015, 27:57-64.
[19] 高宇. 一釜双酶法转化富马酸制备β-丙氨酸催化体系的构建及工艺优化[D]. 无锡:江南大学, 2017.
[20] 王超,叶文琪,薛岚,等. 赤拟谷盗来源天冬氨酸α-脱羧酶分子改造及催化合成β-丙氨酸工艺的建立[J].食品与发酵工业,2019, DOI: 10.13995/j.cnki.11-1802/ts.019670.