甲硫氨酸(methionine, Met, (S)-2-Amino-4-(methylthio)butanoic acid)[1-2]是必需氨基酸中唯一含硫元素的氨基酸,分为L型和D型2种同分异构体,在自然界中主要以L型为主。在畜牧养殖业中甲硫氨酸被视为是家禽[1]的第一限制性氨基酸。
微生物法合成L-甲硫氨酸的代谢途径虽然复杂[3],但生物合成条件温和、对环境友好,具有很大的发展潜力[4]。半胱氨酸的合成效率是利用重组菌E. coli 生产L-甲硫氨酸的限制因素之一[5-6]。相对于硫酸盐同化途径,硫代硫酸盐同化途径仅消耗1个NADPH分子即可从硫代硫酸盐分子合成2个L-半胱氨酸分子[7]。在该途径中,硫代硫酸盐依靠O-乙酰-L-丝氨酸硫氢化酶B(cysM编码)和硫代硫酸盐硫转移酶(glpE编码)进入半胱氨酸代谢通路[8]。在硫代硫酸盐的cysM依赖转化途径中,O-乙酰-L-丝氨酸硫氢化酶B催化O-乙酰-高丝氨酸和硫代硫酸盐转化为S-硫代半胱氨酸(SSC)[9]。SSC随后通过类谷氧还蛋白[7](nrdH编码)和还原性谷氧还酶1[10](grx1编码)代谢生成半胱氨酸,并且同时释放的亚硫酸盐![]() 也通过硫酸盐途径被同化为另一个半胱氨酸。在非cysM依赖转化途径[11]中硫代硫酸盐硫转移酶催化硫代硫酸盐生成亚硫酸盐进入硫酸盐途径,通过半胱氨酸合酶[12](cysK编码)和亚硫酸盐还原酶[13](cysIJ编码)的作用代谢半胱氨酸,从而为甲硫氨酸的积累提供前体。
也通过硫酸盐途径被同化为另一个半胱氨酸。在非cysM依赖转化途径[11]中硫代硫酸盐硫转移酶催化硫代硫酸盐生成亚硫酸盐进入硫酸盐途径,通过半胱氨酸合酶[12](cysK编码)和亚硫酸盐还原酶[13](cysIJ编码)的作用代谢半胱氨酸,从而为甲硫氨酸的积累提供前体。
生物合成途径中细胞代谢通量的平衡依赖于关键代谢物、酶和调节因子的协调[14-15]。目标产物的合成总是由多种酶协同催化完成,代谢工程的发展需要通过理性设计代谢途径进一步完善目标产物形成[16-18]。启动子工程提供了具有不同强度和功能的各种启动子,并且已被公认为精确控制代谢工程中基因表达的有效工具[18]。
已有研究报道通过在发酵培养基中添加Na2S2O3,显著提高了L-甲硫氨酸的产量[19],这为通过硫模块优化提高L-甲硫氨酸的生物合成提供了重要的思路。本文以实验室前期工作中构建的重组菌E. coli W3110 JAHFEBL/pA*H为出发菌株,通过基因表达,确定了硫代谢模块中的关键酶;在此基础上,研究了强启动子介入和关键基因共表达对L-甲硫氨酸产量的影响;并进一步优化了培养基主要组分的浓度,为提高L-甲硫氨酸的生物合成提供了良好的理论基础。
1 材料与方法
1.1 实验材料
1.1.1 菌株和质粒
本文中所使用的菌株及相关基因型见表1,质粒说明见表2。
表1 主要菌株与说明
Table 1 Main strains and relevant instructions

菌株名称相关说明E. coli W3110 JAHFEBL/pA∗H [6]W3110衍生型,敲除metI、metJ、lysA,在基因组上用trc启动子替换metH、metF、cysE和metBL的启动子,携带质粒pA∗HE. coli W3110JAHFEBL/pA∗H-trc-cysM菌株E. coli W3110JAHFEBL携带质粒pA∗H-trc-cysME. coli W3110JAHFEBL/pA∗H-trc-grx1菌株E. coli W3110JAHFEBL携带质粒pA∗H-trc-grx1E. coli W3110JAHFEBL/pA∗H-trc-glpE菌株E. coli W3110JAHFEBL携带质粒pA∗H-trc-glpEE. coli W3110JAHFEBL/pA∗H-trc-nrdH菌株E. coli W3110JAHFEBL携带质粒pA∗H-trc-nrdHE. coli W3110JAHFEBL/pA∗H-trc-cysK菌株E. coli W3110JAHFEBL携带质粒pA∗H-trc-cysKE. coli W3110JAHFEBLtrc-cysK/pA∗H菌株E. coli W3110JAHFEBL/pA∗H基因组上的cysK启动子被trc启动子替代E. coli W3110JAHFEBLtrc-cysK/pA∗H-trc-glpE菌株E. coli W3110JAHFEBL trc-cysK携带质粒pA∗H-trc-glpEE. coli W3110JAHFEBLtrc-cysK/pA∗H-trc-nrdH菌株E. coli W3110JAHFEBL trc-cysK携带质粒pA∗H-trc-nrdHE. coli W3110JAHFEBLtrc-cysK/pA∗H-trc-nrdH-glpE菌株E. coli W3110JAHFEBL trc-cysK携带质粒pA∗H-trc-nrdH -glpEE. coli W3110 JAHFEBL p32-glpE/pA∗H菌株E. coli W3110JAHFEBL/pA∗H基因组上的glpE启动子被p32启动子替代E. coli W3110 JAHFEBL/pA∗H-p32-glpEE. coli W3110 JAHFEBL携带质粒pA∗H -p32-glpEE. coli W3110 JAHFEBL p32-cysK/pA∗H菌株E. coli W3110JAHFEBL/pA∗H基因组上的cysK启动子被p32启动子替代E. coli W3110 JAHFEBL trc-cysK/pA∗H-trc-nrdH-glpE菌株E. coli W3110 JAHFEBL trc-cysK携带质粒pA∗H-trc-nrdH -glpE
表2 主要质粒与说明
Table 2 Main plasmids and relevant instructions

质粒相关说明pA∗H[19]pTrcA∗H的缩写,在质粒pTrc99A 的多克隆酶切位点中插入基因yjeH和抗反馈抑制突变的基因metApTrc-glpE在质粒pTrc99A的多克隆酶切位点中插入基因glpEpTrc-cysK在质粒pTrc99A的多克隆酶切位点中插入基因cysKpTrc-cysM在质粒pTrc99A的多克隆酶切位点中插入基因cysMpTrc-nrdH在质粒pTrc99A的多克隆酶切位点中插入基因nrdHpTrc-grx1在质粒pTrc99A的多克隆酶切位点中插入基因grx1pA∗H-trc-nrdH在质粒pA∗H的trc启动子上游插入trc启动子驱动的基因nrdHpA∗H-trc-glpE在质粒pA∗H的trc启动子上游插入trc启动子驱动的基因glpEpA∗H-trc-grx1在质粒pA∗H的trc启动子上游插入trc启动子驱动的基因grx1pA∗H-trc-cysM在质粒pA∗H的trc启动子上游插入trc启动子驱动的基因cysMpA∗H-trc-nrdH -glpE在质粒pA∗H的trc启动子上游插入trc启动子驱动的基因nrdH和基因glpE的串联pA∗H-p32-glpE在质粒pA∗H的trc启动子上游插入p32启动子驱动的基因glpEpA∗H-p32-nrdH -glpE在质粒pA∗H的trc启动子上游插入p32启动子驱动的基因nrdH和基因glpE的串联
1.1.2 主要工具酶、试剂和试剂盒
限制性内切酶EcoR I FastDigest、Nco I FastDigest、BamH I FastDigest、Xba I FastDigest、Kpn I FastDigest、Sal I FastDigest、Pst I FastDigest和Bcu I FastDigest,以及RNA提取试剂盒PureLinkTM RNA Mini Kit,Thermo Fisher Scientific公司;PCR扩增酶Pfu酶、Taq酶,博彩生物公司;ClonExpressTMOneStep Cloning Kit连接试剂盒、HiScript II Q RT SuperMix for qPCR (+gDNA wiper)试剂盒,诺维赞公司;基因组提取试剂盒FastDNA® Spin Kit for Soil,MPbio;质粒DNA小量抽提试剂盒、PCR产物纯化试剂盒,Axygen生物技术有限公司。
1.1.3 主要仪器和设备
Biometra PCR仪,Biometra公司;Sorvall Lynx 4000高速冷冻离心机,Thermo Scinentific公司;Mini-Protean Ⅱ型电泳仪、GelDoc凝胶成像仪,Bio-Rad公司;5417R小型台式高速冷冻离心机、荧光定量PCR仪22331 Hamburg,德国Eppendorf公司;MS-100恒温金属振荡反应器,杭州奥盛仪器有限公司;NanoDrop One/OneC微量核酸蛋白浓度测定仪,美国Thermo公司;UltiMate3000高效液相色谱,美国戴安公司;电穿孔仪MicroPulserTM,上海伯乐生命医学产品有限公司等。
1.2 实验方法
1.2.1 构建含有甲硫氨酸硫代谢通路中关键基因glpE、grx1、cysK、cysM或nrdH的双表达质粒
用FastDNA® Spin Kit for Soil试剂盒提取E. coli W3110菌株的基因组DNA,以该基因组为模版,通过PCR获得目的基因序列。然后通过对表达载体pTrc99A使用限制性内切酶双酶切以线性化,胶回收纯化回收目的片段。采用诺维赞ClonExpressTM OneStep Cloning Kit试剂盒连接线性化载体和目的基因片段。涂布至LB平板(100 μg/mL Amp)上筛选,挑选单菌落进行菌落PCR,通过琼脂糖凝胶电泳验证,测序验证阳性克隆,获得以pTrc99A质粒为载体的重组质粒pTrc-grx1、pTrc-glpE、pTrc-cysM、pTrc-cysK和pTrc-nrdH。
提取上述质粒作为模板,通过PCR克隆得到序列trc至与其对应的终止子序列。提取E. coli W3110 JAHFEBL/pA*H的质粒pA*H,同时通过PCR线性化pA*H质粒的trc启动子上游。借助诺维赞ClonExpressTM One Step Cloning Kit试剂盒将trc启动子表达的目的基因插入到质粒pA*H上游,得到pA*H-trc-grx1、pA*H-trc-glpE、pA*H-trc-cysK和pA*H-trc-nrdH 4个重组质粒,进行菌落PCR验证后送公司测序。
共表达质粒的构建通过在以上构建的pTrc-target gene上采用酶切连接的方法继续插入基因,得到pTrc-nrdH-glpE的共表达质粒,克隆目标序列片段,重复上述方法可以构建得到pA*H-trc-nrdH-glpE质粒。
1.2.2 CRISPR-Cas9基因组改造[20]获得E. coli W3110 JAHFEBL/trc-cysK
以E. coli W3110 JAHFEBL/trc-cysK的构建为例。使用基因组提取试剂盒提取E. coli W3110基因组。以提取到的基因组为模版扩增获得donor DNA上游同源臂片段和下游同源臂片段,通过融合PCR获得donor DNA。将donor DNA片段连接至T载体,获得T-donor DNA质粒,以之为模板,使用同源臂PCR体系扩增donor DNA片段,通过Clean Up试剂盒将质量浓度浓缩至900 ng/L以上。
PCR突变pTarget质粒并用Bcu I FastDigest和Dpn I酶切,T4连接酶16 ℃过夜自连,转入E. coli DH5α感受态细胞中,提取质粒并送测序。
将donor DNA片段和pTarget - cysK质粒各0.5 μL通过电击转化到含有pCas质粒的E. coli W3110 JAHFEBL电转感受态中,涂布SD(50 μg/mL)和kan(50 μg/mL)双抗性平板30 ℃培养筛选,PCR验证阳性克隆并测序验证。消除pCas和pTarget质粒,获得E. coli W3110 JAHFEBL trc-cysK菌株。
1.2.3 启动子文库构建
以pLVX-AcGFP1-N1载体为模板,PCR扩增绿色荧光蛋白目的基因AcGFP1。通过限制性内切酶Thermo ScientificTM FastDigest EcoR I和Hind III对质粒pTrc99A进行酶切。将目的基因PCR产物和酶切产物使用AXYGEN AxyPrepTM PCR Cleanup Kit试剂盒纯化后,再利用诺维赞ClonExpressTM OneStep Cloning Kit试剂盒连接两者,成功构建重组质粒pTrc99A-AcGFP1。经DNA测序鉴定得到正确的阳性克隆转化子。
以重组质粒pTrc99A-AcGFP1为模板,分2次PCR突变质粒中trc启动子的-35到-1区域,扩增得到含有PG3启动子重组质粒pPG3-AcGFP1。经DNA测序鉴定得到正确的阳性克隆转化子。
设计重组质粒pPG3-AcGFP1的单点突变引物对质粒pPG3-AcGFP1上的PG3启动子的-35 box到+1 box逐个碱基进行单点突变,每个位点分别突变为N(A/T/C/G),依序将每4个PCR产物纯化并浓缩至同一个PCR管中,转化到E.coli W3110感受态菌株中,涂布到含有100 μg/L Amp的LB平板中,37 ℃培养后,获得转化单菌落。将单菌落接种96孔板(每个孔800 μL含有0.1 μg/mL Amp的LB培养基)中,37 ℃、180 r/min培养12 h后,将200 μL菌液转接到另一个96孔板(每个孔中800 μL含有0.1 μg/mL Amp和0.024 μg/mL IPTG的LB培养基)中,30 ℃、180 r/min培养12 h。
结束培养后于4 000×g,4 ℃离心10 min,去掉上清液,用pH 7.0的PBS磷酸缓冲溶液洗涤菌体2次后,加入1 mL PBS磷酸缓冲液(50 mmol/L)重悬菌体。取菌体溶液200 μL分别在波长为600 nm的条件下测量吸光度。然后取重悬的菌体溶液200 μL用荧光分光光度计在激发波长为488 nm,发射波长为520 nm条件下测量其相对荧光值,即RFU值。如果测量的RFU值和OD600超出仪器检测线性范围,则用RBS溶液稀释一定倍数后再次测量。最后根据RFU/OD600的比值来衡量启动子的强弱。
1.2.4 p32启动子替换质粒构建
以pA*H-p32-nrdH-glpE质粒的构建为例。提取pTrc-nrdH-glpE质粒,PCR对启动子区域进行突变,获得质粒p32-nrdH-glpE,转入到E. coli DH5α感受态细胞中扩增质粒,菌落PCR检测并测序。然后利用1.2.1的质粒构建方法获得质粒pA*H-p32-nrdH-glpE。
1.2.5 菌株培养方法
用接种环从LB固体平皿培养基(2%琼脂,100 μg/mL Amp)中挑选单菌落转接至含LB培养基(100 μg/mL Amp)的试管中,37 ℃,180 r/min培养12 h。将上述培养好的种子液,以5%(体积分数)的接种量转接到发酵培养基中,于37 ℃,180 r/min条件下摇瓶培养2 h。加入4 μL IPTG母液(0.12 g/mL)后28 ℃,180 r/min继续培养48 h。
发酵培养基:葡萄糖20 g/L,(NH4)2SO4 16 g/L,KH2PO4 1 g/L,Na2S2O3 1 g/L,酵母提取物2 g/L,金属离子1 mL/L。500 mL摇瓶培养基装液量为20 mL。其中金属离子为MgSO4·H2O 500 mg/L,FeSO4·7H2O 5 mg/L,MnSO4·8H2O 5 mg/L,ZnSO4 5 mg/L溶于超纯水。115 ℃高温蒸汽灭菌30 min。在接种时加入VB12母液(20 μg/mL)、赖氨酸(10 mg/L)、Amp(100 μg/mL),以及分装灭菌的CaCO3固体0.20 g。
1.2.6 培养基优化
利用单因素实验,分别考察了不同葡萄糖添加量(20~60 g/L),硫代硫酸钠添加量(0.5~5.0 g/L)、氮源添加量(1.0~3.5 g/L)、(NH4)2SO4浓度(8~28 g/L)和KH2PO4添加量(0.5~3.0 g/L)对L-甲硫氨酸产量的影响。
1.2.7 分析方法
1.2.7.1 L-甲硫氨酸的HPLC检测
取1 mL发酵液于1.5 mL EP中,12 000×g离心2 min,保存上清;将100 μL上清液稀释至1.5 mL EP管中,加入100 μL 0.5 mol/L的NaHCO3溶液和100 μL体积分数1%的2,4-二硝基氟苯乙腈溶液,60 ℃避光反应60 min;再用0.22 μm有机膜进行过滤,用以高效液相色谱检测。
L-甲硫氨酸检测条件:分析柱为C18柱(250 mm×4.6 mm,5 μm),流动相为V(甲醇)∶V(水)=1∶1:其中,水相由1.5 mL乙酸和2.05 g乙酸钠溶于1 L超纯水,调pH值至3.5;柱温40 ℃,流速1.0 mL/min,进样量10 μL,紫外波长365 nm,时间16 min。
标准品的制备:采用外标法定量,分别配制质量浓度0.5~2.5 g/L的L-甲硫氨酸标准溶液,依次对不同浓度的标准溶液进行HPLC分析检测,以标准溶液的峰面积X为横坐标,以标准溶液的浓度Y(g/L)为纵坐标,绘制标准曲线,并得回归方程。
1.2.7.2 荧光定量PCR检测
在发酵培养12 h时取样,取1mL发酵液于1.5 mL EP中,12 000×g离心2 min,分离上清液。在1.5 mL离心管沉淀中加入1 mL蒸馏水洗涤后,再加入1 mL体积分数20%乙酸溶液混匀,充分中和沉淀中的CaCO3。使用PureLinkTM RNA Mini Kit试剂盒提取并纯化RNA。提取的总RNA按照500 ng使用HiScript II Q RT SuperMix for qPCR (+gDNA wiper)试剂盒反转录获得cDNA。以E. coli k-12 MG1655的16S rRNA作为对照基因。每组设置3个平行,将cDNA样品作为模板上机检测。
2 结果与分析
2.1 trc启动子替换菌株构建
2.1.1 trc启动子提高grx1、glpE、cysK、nrdH和cysM表达对L-甲硫氨酸产量的影响
从基因组上克隆得到目的基因grx1、glpE、cysK、nrdH和cysM,通过在质粒pA*H上插入包括trc启动子的转录元件,过表达grx1、glpE、cysK、nrdH和cysM基因,获得E. coli W3110 JAHFEBL/pA*H-trc-grx1、E. coli W3110 JAHFEBL/pA*H-trc-glpE、E.coli W3110 JAHFEBL/pA*H-trc-cysK、E. coli W3110 JAHFEBL/pA*H-trc-nrdH和E. coli W3110 JAHFEBL/pA*H-trc-cysM菌株(如图1),检测这些重组菌株的甲硫氨酸产量以探究关键基因。如图2所示,作为非cysM依赖通路,glpE能转化硫代硫酸盐生成亚硫酸盐[8],过表达glpE使L-甲硫氨酸产量提高了约15.3%。过表达cysK能使L-甲硫氨酸产量提高约12.6%。由于nrdH在细胞内的过表达可以将S-磺酸半胱氨酸(SSC)转化为L-半胱氨酸和亚硫酸盐,表达携带nrdH的质粒可以提高L-半胱氨酸的代谢水平[7],过表达nrdH也能使L-甲硫氨酸产量有近8%的提升。
通过分析重组菌生长结果发现质粒上表达单一基因对菌体的生长状况影响并不显著(图3)。可见,cysM、cysK、glpE、nrdH和grx1并非通过增加菌体量提升L-甲硫氨酸的合成水平。
2.1.2 共表达基因glpE、nrdH和cysK对L-甲硫氨酸产量的影响
根据上述结果将glpE、nrdH在E. coli W3110 JAHFEBL trc-cysK菌株中共表达。使用CRISPR-Cas9技术在基因组上用trc启动子替换cysK的启动子获得E.coli W3110 JAHFEBL trc-cysK菌株,L-甲硫氨酸的产量提升约11.3%;在此基础上过表达glpE基因获得E. coli W3110 JAHFEBL trc-cysK/pA*H-trc-glpE菌株,其产量相较对照组提升了约23.4%;而E. coli W3110 JAHFEBL trc-cysK/pA*H-trc-nrdH菌株的L-甲硫氨酸产量相较对照组提升了16.8%。同时在质粒pA*H上共表达glpE和nrdH基因,E. coli W3110 JAHFEBL trc-cysK/pA*H-trc-nrdH-glpE菌株的L-甲硫氨酸产量相较对照组提升了28.2%(图4)。L-甲硫氨酸的产量提升并非由菌体量增加引起(图5)。
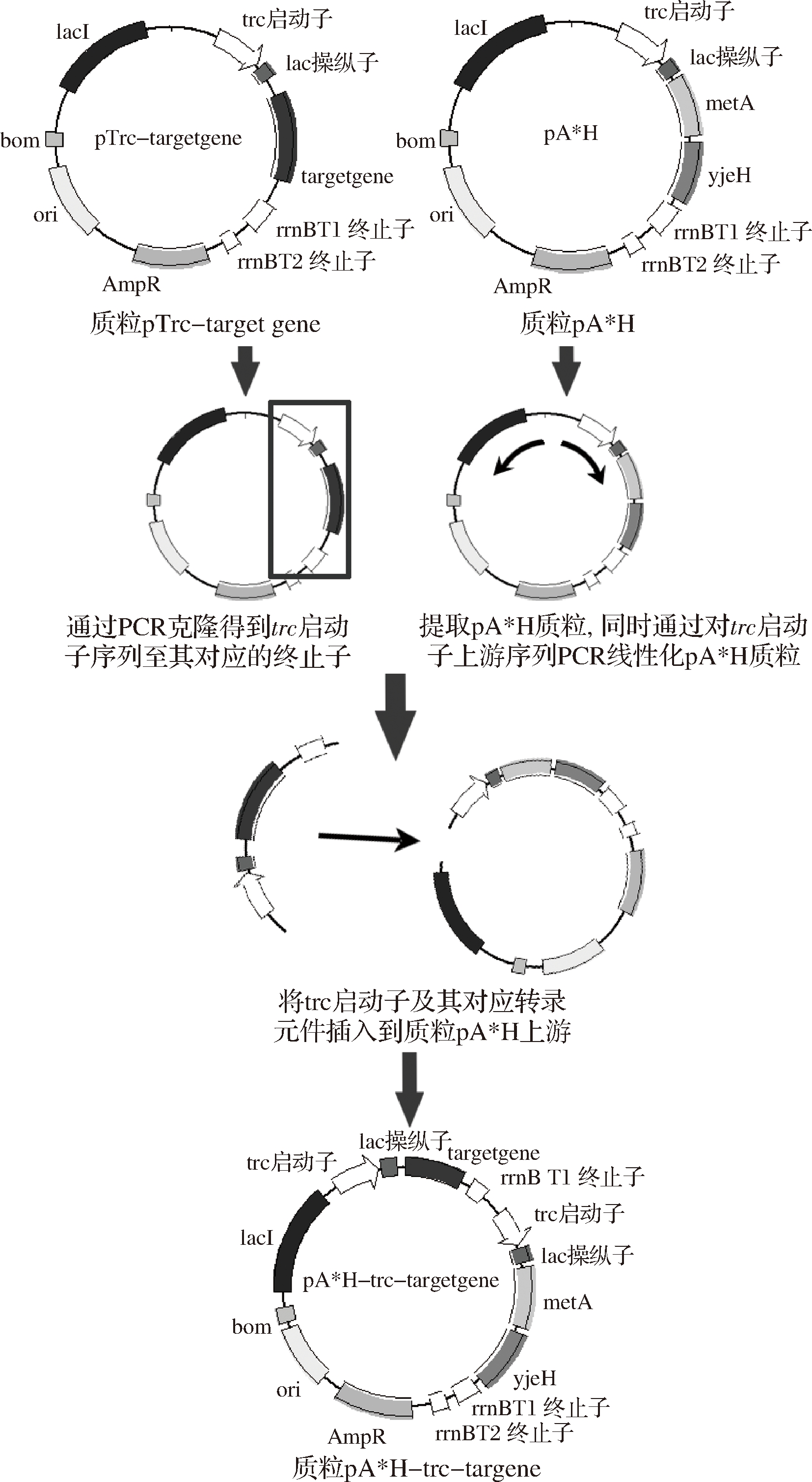
图1 双表达载体质粒的构建
Fig.1 Construction of the double expression recombinant plasmids
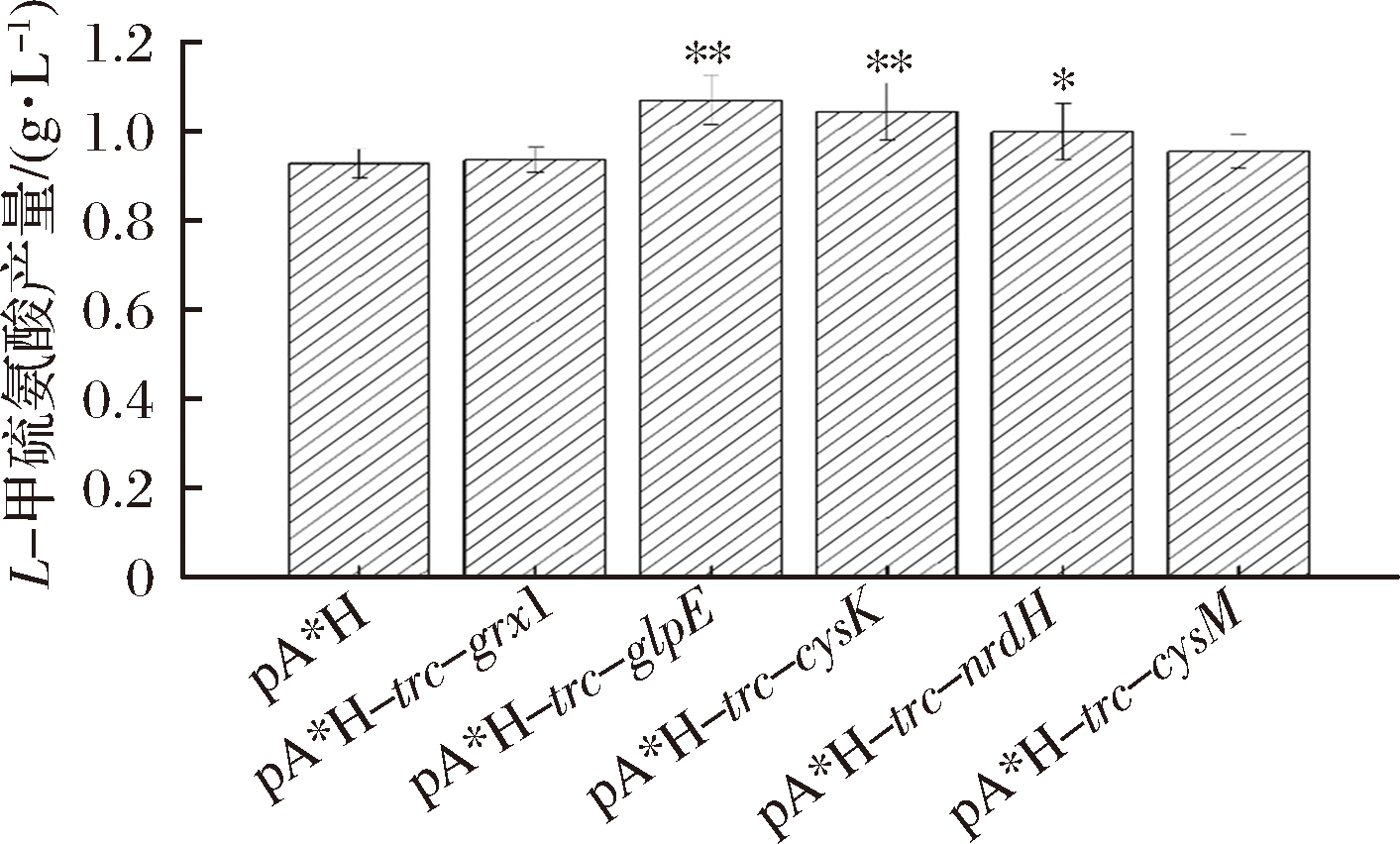
图2 质粒上分别过表达基因grx1, glpE, cysK,nrdH和cysM对L-甲硫氨酸产量的影响
Fig.2 Influence of grx1, glpE, cysK, nrdH and cysM overexpressions in plasmids to the titer of L-methionine
注:相比对照组,P值<0.01表示实验组差异非常显著
(***),P值处于0.01~0.05之间表示实验组差异显著(**),P值处于0.05~0.16之间表示实验组差异轻微显著(*)。下同。

图3 质粒上分别过表达基因grx1, glpE, cysK,nrdH和cysM对菌体生长的影响
Fig.3 Influence of grx1, glpE, cysK, nrdH and cysM overexpressions in plasmids to the growth of the strains
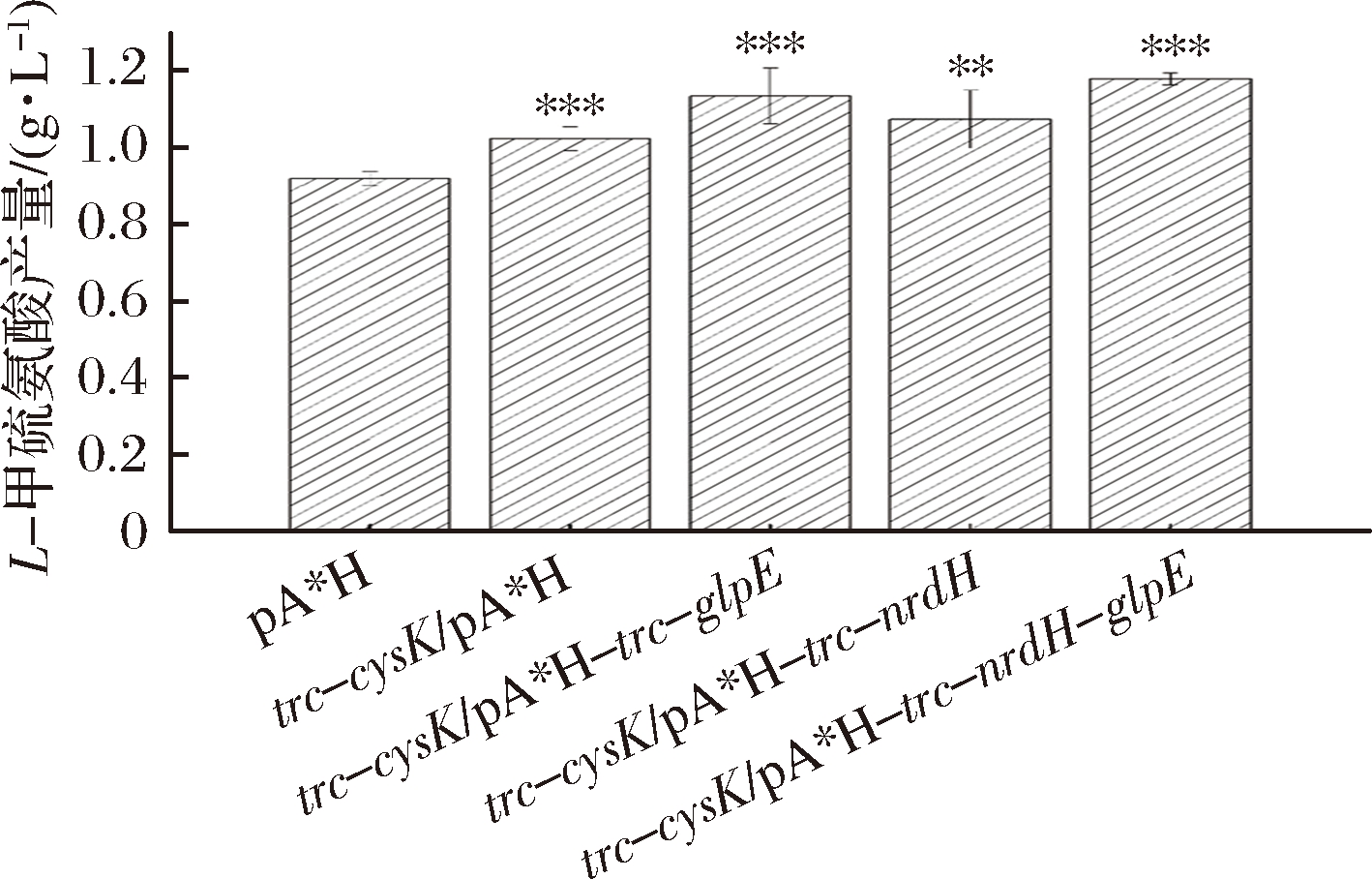
图4 多基因共表达对L-甲硫氨酸的影响
Fig.4 Influence of multigene coexpression to the titer of L-methionine
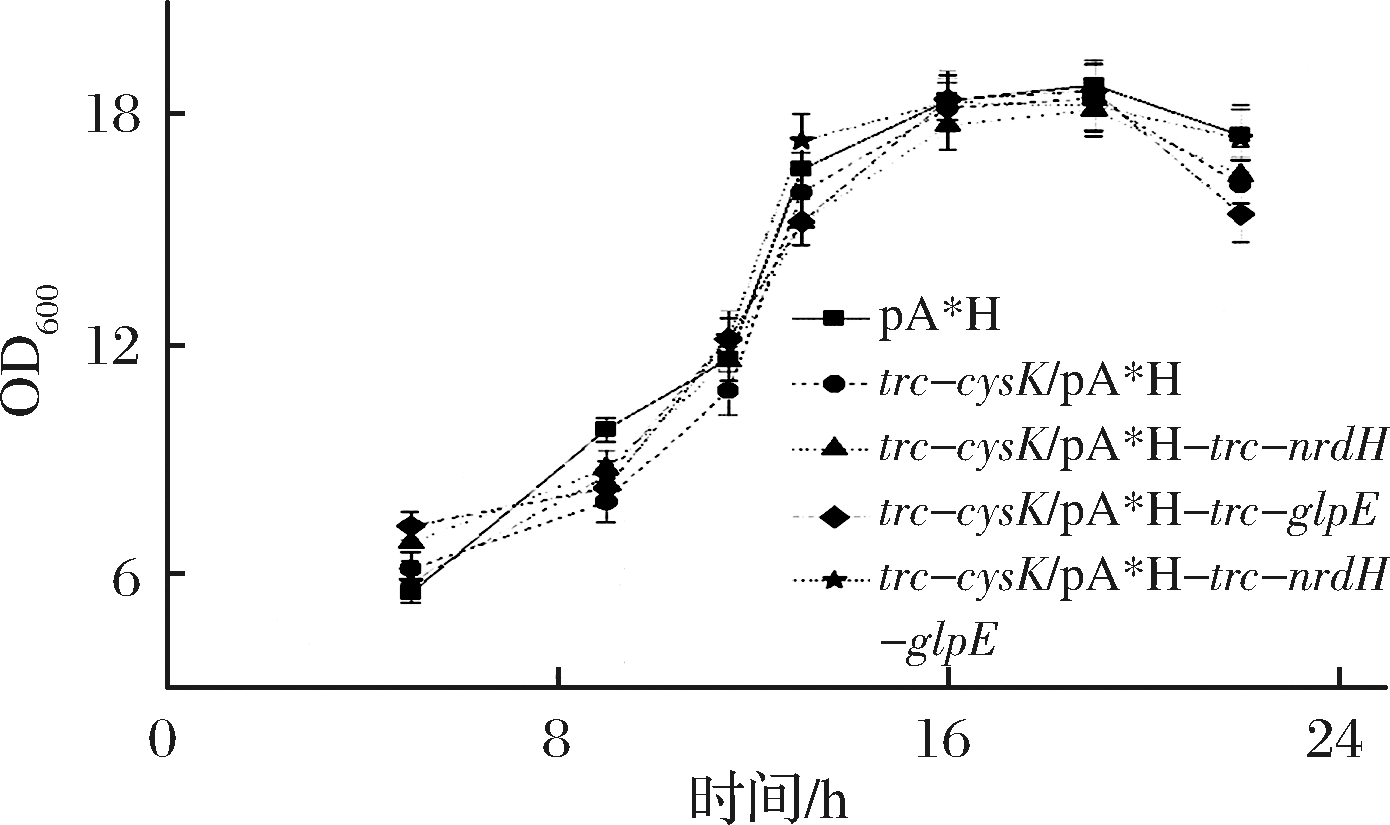
图5 多个目的基因共表达对菌体生长的影响
Fig.5 Influence of the multigene co-expression to the growth of strains
2.2 高强度PG3突变启动子的获得
2.2.1 启动子文库构建
为了获得更高强度的启动子以优化2.1中关键基因的表达水平,选择PG3[21]为模板构建启动子文库,序列为TTGACATTGGAAGGGAGATTCTTTATAATAAGAATT,该启动子由原始启动子杂合而成,具有良好的转录活性和较高的突变潜力。通过分析单点突变对启动子影响,组合突变位点,最终获得包含32个样本的突变启动子文库。如图6所示,其RFU/OD600比值跨度从最低的256.3到最高的8 351.2,跨度适中,满足了下游基因对不同强度调控的需求。其与PG3启动子相比,强度变化范围为11.8%~385.3%。
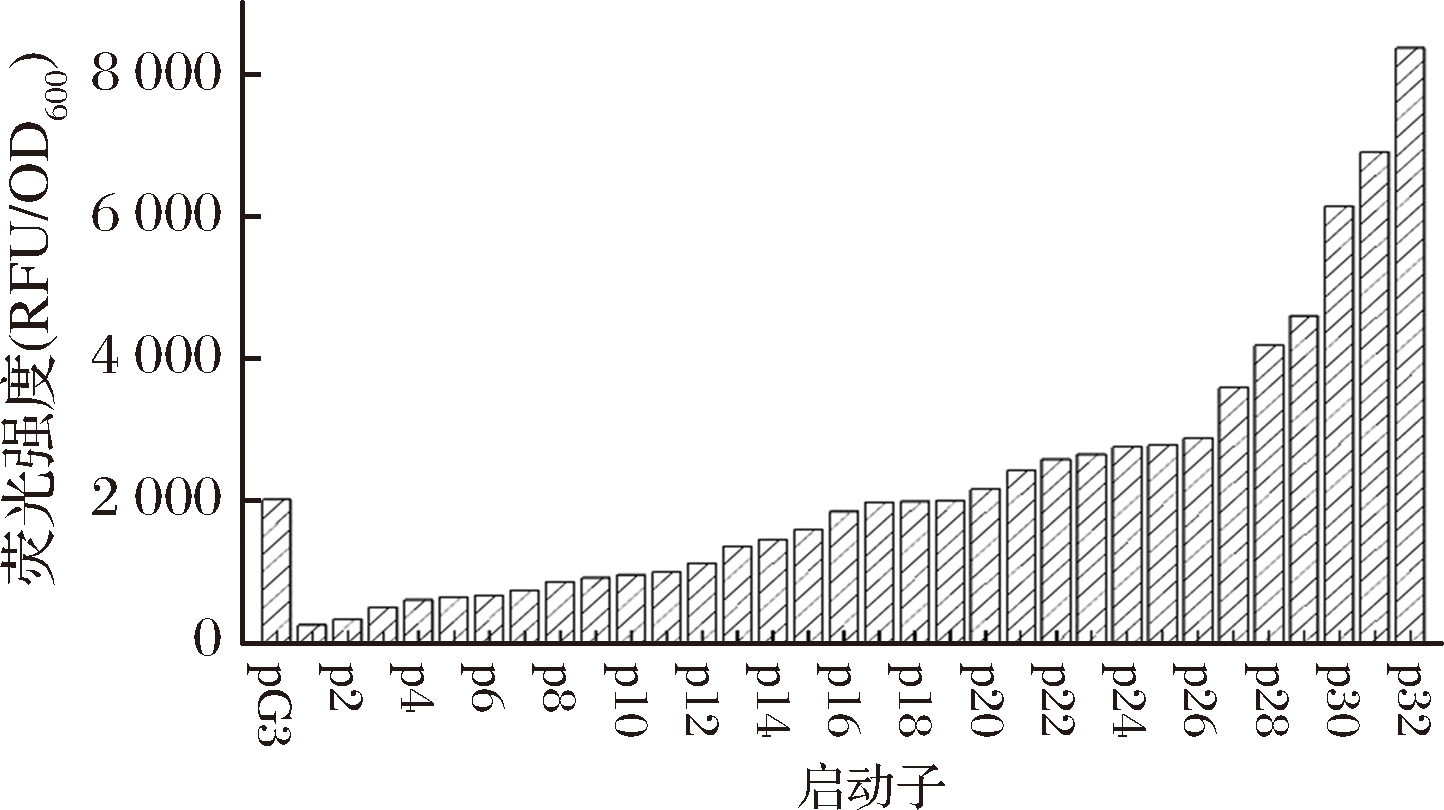
图6 PG3突变启动子文库
Fig.6 PG3 mutation prompter library
注:从左到右按pG3,p1,p2…p31,p32排列。
2.2.2 荧光定量PCR比较trc和p32启动子强度
分别采用发酵培养基模拟发酵条件,培养携带p32-AcGFP和pTrc-AcGFP质粒的E. coli k-12 W3110菌株。取发酵12 h的菌液使用荧光定量PCR检测突变启动子p32相对trc启动子的转录水平。p32启动子核心区域序列为TTGACAGAGGCAGGG CGACATTTTATAATAAGACTT。
本文比较了AcGFP在p32和trc启动子驱动下的转录水平差异(表3),相比于trc启动子,突变文库中荧光强度最高的突变启动子p32的转录水平提高了约150%,这可以进一步上调E. coli W3110 JAHFEBL trc-cysK/pA*H-trc-nrdH-glpE菌株硫同化模块关键酶的表达,在目标宿主菌株中具有较好的应用价值。
表3 启动子p32和trc对AcGFP转录水平的影响
Table 3 Effect of promoter p32 and trc on the transcription levels of AcGFP

启动子AcGFP16S rRNAΔCtΔΔCt2 -(ΔΔCt)trc15.901 010.222 75.678 301p3214.845 210.509 64.335 61.342 62.536 2
2.3 p32启动子替换
2.3.1 基因glpE和cysK不同启动子对L-甲硫氨酸产量的影响
由于提高glpE和cysK的表达能有效提高菌体L-甲硫氨酸的产量,考虑通过提高基因组上glpE的表达量以减少质粒上串联表达的基因数。通过分别优化cysK和glpE基因的表达效果,比较两者差异,选择较优菌株。
如图7所示,在基因组水平用p32启动子替换glpE原始启动子能使L-甲硫氨酸产量提高15.4%,而在质粒上用p32启动子过表达glpE的菌株的L-甲硫氨酸产量则提高了21.2%,因此选择在质粒上使用p32过表达glpE。用p32启动子替换cysK原始启动子能使L-甲硫氨酸产量提高15.2%,而用trc启动子替换cysK原始启动子则使L-甲硫氨酸产量提高了24.2%,因此在基因组上使用p32替换cysK启动子提高其表达量。
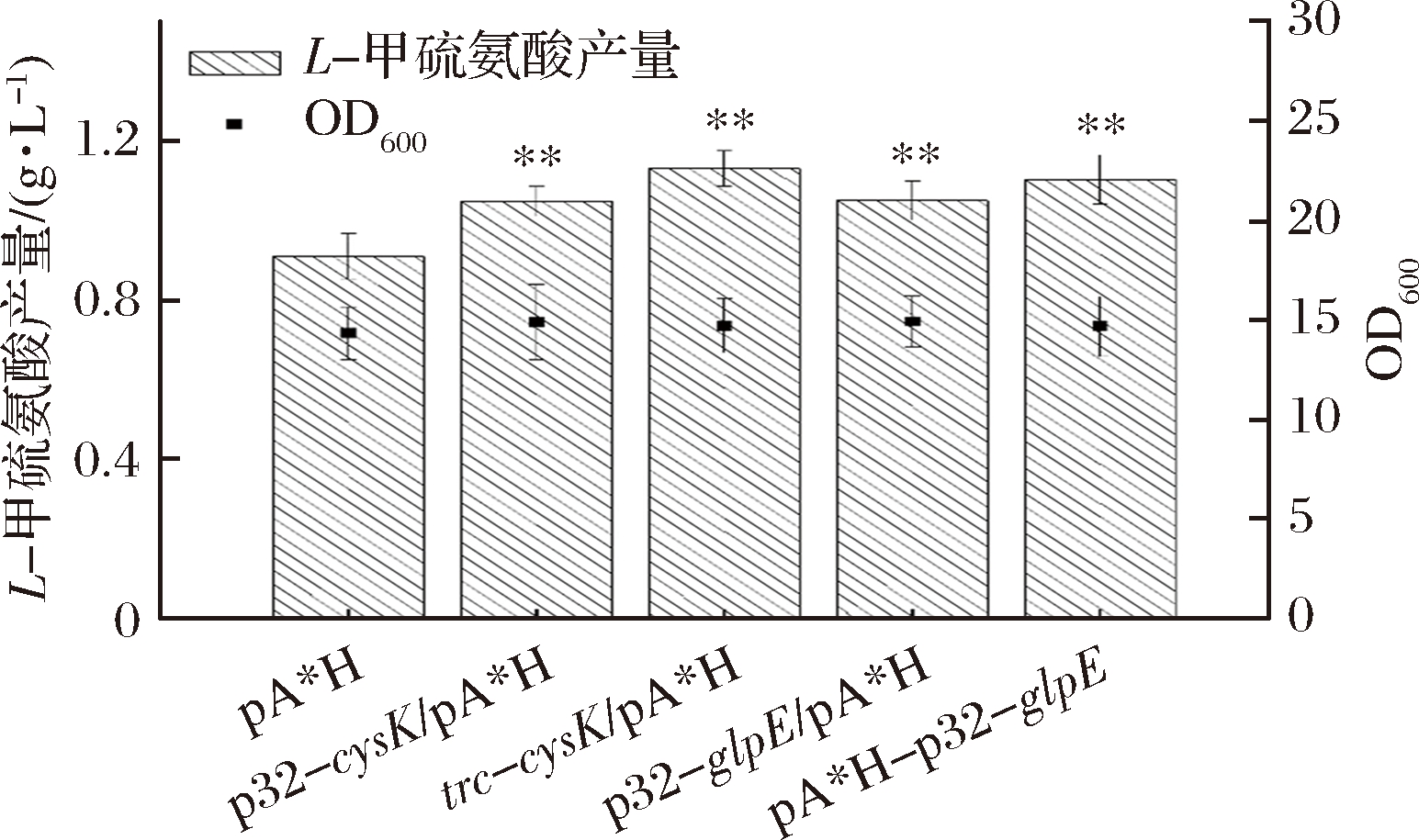
图7 基因glpE和cysK对L-甲硫氨酸产量最优表达
Fig.7 Optimization of glpE and cysK expressions to L-methionine
2.3.2 p32在菌株中的应用
使用p32启动子替换pA*H-trc-nrdH-glpE和pA*H-trc-nrdH-grx1-glpE质粒中trc启动子,获得pA*H-p32-nrdH-glpE和pA*H-p32-nrdH-grx1-glpE质粒,转入到E. coli W3110 JAHFEBL trc-cysK菌株中比较L-甲硫氨酸的产量。实验结果如图8所示,E. coli W3110 JAHFEBL trc-cysK/pA*H-p32-nrdH-glpE菌株的L-甲硫氨酸产量达到1.3 g/L,相较原始菌株提高了41.5%,相较E. coli W3110 JAHFEBL trc-cysK/pA*H-trc-nrdH-glpE菌株提高了12.0%。

图8 p32启动子应用对L-甲硫氨酸产量的影响
Fig.8 Influence of applying p32 promoter to the titer of L-methionine
2.4 培养基组分优化
培养基组分优化结果如图9所示。结果表明,40 g/L的葡萄糖添加量可以使L-甲硫氨酸产量提高13.8%,但继续提高葡萄糖的添加量,实验结果L-甲硫氨酸产量,反而出现下降的趋势。进一步研究发现葡萄糖添加量在30 g/L和40 g/L之间时,L-甲硫氨酸产量存在上升空间。通过细化葡萄糖添加量的浓度梯度,可知,在添加34 g/L葡萄糖时L-甲硫氨酸产量达到最高,提升约18.6%(如图9-B)。
考虑到重组菌株的改造集中在硫代硫酸盐利用途径中,提高硫代硫酸盐的供给对L-甲硫氨酸产量的提升应该有较为重要的意义[19]。因此,在碳源优化的基础上考察了硫代硫酸钠的添加量对菌株发酵的影响。实验结果如图9-C所示,硫代硫酸钠的添加量增加至3 g/L时,L-甲硫氨酸产量提高了41.3%,而继续提高硫代硫酸钠的供给并不能使L-甲硫氨酸产量进一步提升。降低硫代硫酸钠的浓度(0.5 g/L)使L-甲硫氨酸产量急剧下降,为对照组的48.8%。硫代硫酸钠的添加对菌体生物量没有造成影响,整体相差并不明显。
进一步考察了氮源添加量对菌体发酵的影响。如图9-D所示,当酵母提取物添加量为2.0 g/L时,菌体生物量和L-甲硫氨酸产量最优。如图9-E所示,培养基中提高硫酸铵的浓度对L-甲硫氨酸产量和菌体生物量并没有明显促进作用,相反,过高的铵盐浓度会对细胞生长产生抑制[22]。
如图9-F所示,当KH2PO4添加量提高至2.0 g/L时,重组菌株的L-甲硫氨酸产量提高了约9.7%;在此基础上继续提高KH2PO4浓度对L-甲硫氨酸产量并没有显著的影响。

A-葡萄糖添加浓度(20~60 g/L)对L-甲硫氨酸产量的影响;B-葡萄糖添加浓度(32~40 g/L)对L-甲硫氨酸产量的影响;C-硫代硫酸钠添加浓度对L-甲硫氨酸产量的影响;D-酵母提取物添加浓度对L-甲硫氨酸产量的影响;E-(NH4)2SO4添加浓度对L-甲硫氨酸产量的影响;F-KH2PO4添加浓度对L-甲硫氨酸产量的影响
图9 培养基优化
Fig.9 Optimzation of fermentation media
利用优化后的培养基配方进一步发酵验证表明,E. coli W3110 JAHFEBL trc-cysK/pA*H-p32-nrdH-glpE菌株的产量可达到2.3 g/L,相比优化前的发酵结果(1.3 g/L)提升了约77.0%。
3 结论
本文以pA*H质粒为基础构建了trc启动子双表达质粒,发现提高cysK、glpE和nrdH的表达水平能改善L-甲硫氨酸的产量。以E.coli W3110 JAHFEBL/pA*H为基础,在基因组上用trc启动子替换了cysK的本地启动子,在质粒pA*H上插入glpE和nrdH基因共表达,构建了E. coli W3110 JAHFEBL trc-cysK/pA*H-trc-nrdH-glpE,发酵48 h的L-甲硫氨酸产量提升28.2%。以PG3启动子为模板建立了包含32个样本的启动子文库,强度范围为11.8%~385.3%。应用p32突变启动子使重组菌株trc-cysK/pA*H-p32-nrdH-glpE的L-甲硫氨酸产量相比trc-cysK/pA*H-nrdH-glpE菌株提升了约12.0%。在此基础上,硫代硫酸钠添加量的提升有效弥补了硫通路代谢酶对催化底物的需求,重组菌株E. coli W3110 JAHFEBL trc-cysK/pA*H-p32-nrdH-glpE发酵48 h生产的L-甲硫氨酸产量提升了约77.0%。本文通过对硫代谢模块的优化提高了L-甲硫氨酸的产量,同时为其他含硫氨基酸的生物合成提供了研究思路。
[1] WILLKE T. Methionine production - a critical review[J]. Applied Microbiology and Biotechnology, 2014, 98(24): 9 893-9 914.
[2] 党万利, 金利群,郑裕国,等. 蛋氨酸生产工艺研究进展[J]. 食品与发酵工业, 2012, 38(4): 152-158.
[3] BECKER J, WITTMANN C. Systems and synthetic metabolic engineering for amino acid production-the heartbeat of industrial strain development[J]. Current Opinion in Biotechnology, 2012, 23(5): 718-726.
[4] GOMES J, KUMAR D. Production of L-methionine by submerged fermentation: A review[J]. Enzyme & Microbial Technology, 2005, 37(1): 3-18.
[5] 李华. 系统代谢工程改造大肠杆菌生产L-蛋氨酸[D]. 无锡:江南大学, 2017.
[6] HUANG J F, SHEN Z Y, MAO Q L, et al. Systematic analysis of bottlenecks in a multibranched and multilevel regulated pathway: The molecular fundamentals of L-methionine biosynthesis in Escherichia coli[J]. ACS Synthetic Biology, 2018, 7(11):2 577-2 589.
[7] NAKATANI T, OHTSU I, NONAKA G, et al. Enhancement of thioredoxin/glutaredoxin-mediated L-cysteine synthesis from S-sulfocysteine increases L-cysteine production in Escherichia coli[J]. Microbial Cell Factories, 2012, 11(1): 62.
[8] KAWANO Y, ONISHI F, SHIROYAMA M, et al. Improved fermentative L-cysteine overproduction by enhancing a newly identified thiosulfate assimilation pathway in Escherichia coli[J]. Applied Microbiology & Biotechnology, 2017, 101(4): 1-11.
[9] MAIER T H P. Semisynthetic production of unnatural L-alpha-amino acids by metabolic engineering of the cysteine-biosynthetic pathway[J]. Nature Biotechnology, 2003, 21(4): 422-427.
[10] ARISTI P, ARNE H, ALEXIOS V G. Protein levels of Escherichia coli thioredoxins and glutaredoxins and their relation to null mutants, growth phase, and function[J]. Journal of Biological Chemistry, 2002, 277(21): 18 561-18 567.
[11] KAWANO Y, ONISHI F, SHIROYAMA M, et al. Improved fermentative L-cysteine overproduction by enhancing a newly identified thiosulfate assimilation pathway in Escherichia coli[J]. Appl Microbiol Biotechnol, 2017, 101(18): 6 879-6 889.
[12] BOGICEVIC B. CysK from Lactobacillus casei encodes a protein with O-acetylserine sulfhydrylase and cysteine desulfurization activity[J]. Appl Microbiol Biotechnol, 2012, 94(5): 1 209-1 220.
[13] HRYNIEWICZ M M, KREDICH N M. Stoichiometry of binding of CysB to the cysJIH, cysK, and cysP promoter regions of Salmonella typhimurium[J]. Journal of Bacteriology, 1994, 176(12): 3 673.
[14] ZHANG C, SEOW V Y, CHEN X, et al. Multidimensional heuristic process for high-yield production of astaxanthin and fragrance molecules in Escherichia coli[J]. Nat Commun, 2018, 9(1): 1 858.
[15] ZHANG C, CHEN X, LINDLEY N D, et al. A "plug-n-play" modular metabolic system for the production of apocarotenoids[J]. Biotechnol Bioeng, 2018, 115(1): 174-183.
[16] CLOMBURG J M, GONZALEZ R. Biofuel production in Escherichia coli: the role of metabolic engineering and synthetic biology[J]. Appl Microbiol Biotechnol, 2010, 86(2): 419-434.
[17] REDDEN H, MORSE N, ALPER H S. The synthetic biology toolbox for tuning gene expression in yeast[J]. Fems Yeast Research, 2014, 15(1): 1.
[18] ZHOU S, DU G, KANG Z, et al. The application of powerful promoters to enhance gene expression in industrial microorganisms[J]. World Journal of Microbiology and Biotechnology, 2017, 33(2): 23.
[19] HUANG J F, LIU Z Q, JIN L Q, et al. Metabolic engineering of Escherichia coli for microbial production of L-methionine[J]. Biotechnology & Bioengineering, 2017, 114(4): 843.
[20] JIANG Y, CHEN B, DUAN C, et al. Multigene editing in the Escherichia coli genome via the CRISPR-Cas9 system[J]. Appl Environ Microbiol, 2015, 81(7): 2 506-2 514.
[21] JIAO S, LI X, YU H, et al. In situ enhancement of surfactin biosynthesis in Bacillus subtilis using novel artificial inducible promoters[J]. Biotechnology & Bioengineering, 2017, 114(4): 832.
[22] 陈可泉, 马江锋,姜岷,等. 氮源对重组大肠杆菌发酵产L-精氨酸的影响[J]. 生物加工过程, 2011, 9(6): 11-14.