α-淀粉酶广泛应用于食品、饲料、造纸等工业中,在整个酶制剂市场中约占25%份额[1]。微生物是α-淀粉酶的主要来源,其中产α-淀粉酶的细菌主要是芽孢杆菌属微生物[2],真菌主要是曲霉和青霉属[3],此外还有一些嗜热真菌产α-淀粉酶,如Scytalidium thermophilum[4]和Thermomyces lanuginosus[5]。细菌α-淀粉酶的最适温度和最适pH分布广泛,真菌α-淀粉酶的作用条件较温和,最适温度一般在50~60 ℃,最适pH一般在5.0~6.0[3]。HAN等[6]研究了嗜热真菌樟绒枝霉(Malbranchea cinnamomea)产α-淀粉酶的产酶条件、纯化及性质,但产酶水平低,无法工业生产应用。
构建工程菌株是实现外源基因高效表达的有效途径,巴斯德毕赤酵母作为较完善的真核表达系统,目前,已有多种来源α-淀粉酶在毕赤酵母中高效表达。WANG等[7]将地衣芽孢杆菌(Bacillus licheniformis)α-淀粉酶在毕赤酵母高效表达,经5 L发酵罐分批补料发酵168 h,α-淀粉酶产量为8.3 mg/mL,在 50 L发酵罐中α-淀粉酶产量为12.2 mg/mL;PARASHAR等[8]克隆来源于Bacillus acidicola和Geobacillus thermoleovorans嵌合的α-淀粉酶基因,成功表达于毕赤酵母,在7 L发酵罐中发酵,最终α-淀粉酶表达量为0.120 mg/mL,比酶活为1 180 U/mg(DNS法,每分钟反应产生1 μmol麦芽糖定义为1个酶活单位)。可以看出α-淀粉酶在毕赤酵母中高效表达具有较大应用潜力,但是目前关于嗜热真菌α-淀粉酶在毕赤酵母中表达的报道较少,仅有Rhizomucor pusillus来源α-淀粉酶。ZHANG等[9]将Rhizomucor pusillus来源α-淀粉酶和糖化酶在毕赤酵母共表达,与单一表达糖化酶相比,共表达淀粉酶的糖化活力提高了79%。
在麦芽糖浆的工业生产中,淀粉需经液化和糖化两个步骤,液化主要采用耐高温α-淀粉酶,糖化采用β-淀粉酶、真菌α-淀粉酶等糖化酶。真菌α-淀粉酶作为生产麦芽糖浆的关键酶之一,已广泛应运于生产,如以大米淀粉为原料,经真菌α-淀粉酶水解制备得麦芽糖含量为45.18%的麦芽糖浆[10]。为制备高麦芽糖浆,常将α-淀粉酶与普鲁兰酶、β-淀粉酶等复配,亢潘潘[11]等将真菌α-淀粉酶与β-淀粉酶复配,制备得到麦芽糖含量为62.1%的麦芽糖浆。此外还采用色谱分离、酵母发酵等方法提高麦芽糖含量,黄伟红[12]等将色谱分离后的麦芽糖浆经活性干酵母发酵,制备得到麦芽糖含量为99%的超高麦芽糖浆。本文将嗜热真菌樟绒枝霉α-淀粉酶基因McAmyA在毕赤酵母GS115中高效表达和高密度发酵,研究重组α-淀粉酶McAmyA的酶学性质,并直接以工业化生产的液化产物为底物,研究该酶在制备麦芽糖浆中的应用。
1 材料和方法
1.1 材料
1.1.1 试验材料
菌株:樟绒枝霉S168由本实验室保存,大肠杆菌E.coli DH5α,购于北京博迈德生物技术有限公司,毕赤酵母GS115和质粒pPIC9K,购于美国Invitrogen公司,淀粉液化液由山东隆科特酶制剂有限公司提供(玉米淀粉为底物,细菌α-淀粉酶高温液化制得)。
液化液原液:干物质含量32%,DE值32,葡萄糖、麦芽糖、麦芽三糖、麦芽四糖的含量分别为(以干物质计):1.5%、11.8%、14.1%、8.7%,残留液化酶活为150 U/mL。
1.1.2培养基
LB、YPD、MD、BMGY、BMMY等培养基的配制方法参照Invitrogen公司的《毕赤酵母表达操作手册》。
PTM1(g /L):CuSO4·5H2O 6,NaI 0.08,MnSO4·H2O 3,Na2MoO4 ·2H2O 0.2,H3BO3 0.02,CoCl2 0.5,FeSO4·7 H2O 65,生物素 0.2,浓硫酸 5 mL。
1.2 方法
1.2.1 樟绒枝霉α-淀粉酶基因McAmyA的克隆和表达载体构建
根据HAN等[6]的报道,以cDNA为模板,设计引物McAmyADNAF(5′—ATGGTTTCAACAGCACTATTCCT—3′)和McAmyADNAR(5′—TCAGTTCTCGCAAAGCCCGGA—3′),克隆樟绒枝霉α-淀粉酶基因McAmyA,然后将PCR扩增回收的DNA片段和巴斯德毕赤酵母表达载体pPIC9K双酶切,酶切位点为SnaBI和AvrⅡ,用试剂盒回收DNA片段和表达载体pPIC9K,T4连接酶连接目的基因片段和表达载体后,转化至大肠杆菌DH5α,涂布于含氨苄青霉素的LB抗性平板培养基,挑取转化子进行菌落PCR和双酶切验证,阳性转化子命名为pPIC9K-McAmyA。
1.2.2 α-淀粉酶基因McAmyA在毕赤酵母中表达
提取阳性转化子质粒,进行线性化,电转化至毕赤酵母感受态GS115,涂布于MD平板培养基,30 ℃培养4 d,待转化子长出后,将其涂布在含不同浓度遗传霉素G418的平板培养基。长出酵母后,挑取单菌落到BMGY培养基,30 ℃恒温摇床培养至OD600=2~6,离心收集菌体,用BMMY培养基重悬并接种至BMMY培养基,使OD600达1.0,30 ℃恒温摇床诱导3 d,每24 h补充甲醇,使甲醇终体积分数为0.5%。
1.2.3 毕赤酵母高密度发酵
选取摇瓶发酵酶活最高的菌株,在5 L发酵罐进行高密度发酵,工作体积为1.5 L,发酵方法和发酵培养基的配制参照Pichia Fermentation Guidelines (Version B,053002,Invitrogen)。发酵过程主要分为分批培养、甘油流加培养和甲醇诱导培养3个阶段。
分批培养:装1.5 L基本培养基,灭菌发酵罐,28%浓氨水调节pH至4.0,加入PTM14.35 mL/L,接种量10%,起始转速600 r/min,温度30 ℃,发酵18~24 h。
甘油流加培养:待分批培养至培养基中的甘油耗尽,流加50%甘油,28%浓氨水调节pH至5.0,流速为18.4 mL/(h·L),流加时间4~5 h,待OD600达180~220,停止流加甘油。
甲醇诱导培养:停止流加甘油后,饥饿30 min左右,28%浓氨水调节pH至6.0,转速调为800 r/min,流加甲醇,诱导产酶,监控溶氧变化,保持DO>20%,发酵过程中取样分析菌体湿重、酶活力和蛋白含量。
1.2.4 α-淀粉酶活力及蛋白含量的测定
α-淀粉酶活力测定:采用DNS法[13]测定酶活力,将900 μL用缓冲液配置的10 g/L可溶性淀粉,于一定温度水浴锅中预热5 min后加入100 μL适当稀释的酶液,在一定温度下,水浴反应10 min,加入1 mL DNS终止反应,沸水浴10 min后测吸光值OD540,以葡萄糖作为标准品。酶活定义:每分钟反应生成1 μmol葡萄糖所需要的酶量定义为1个酶活力单位。
另外,同时采用轻工行业标准(QB 2526—2001)测定酶活,将10 mL可溶性淀粉溶液在40 ℃水浴锅中预热10 min,加入适当稀释的酶液1 mL,40 ℃准确加热30 min后,加入费林试剂4 mL使酶失活,硫代硫酸钠滴定测定生成的还原糖。酶活定义:反应30 min,反应液中产生相当于10 mg葡萄糖的还原糖所需的酶量,定义为1个淀粉糖化酶活力单位。
蛋白含量测定:参照LOWRY等的方法[14],以牛血清蛋白(BSA)作为标准蛋白。
1.2.5 重组α-淀粉酶McAmyA的纯化
重组α-淀粉酶McAmyA经甲醇诱导168 h后,10 000 r/min 离心5 min收集上清液,用50 mmol/L Tris-HCl (pH 8.0)在4 ℃条件下透析过夜,然后10 000 r/min离心10 min,收集上清液即为粗酶液。将粗酶液过QSFF强阴离子交换柱(50 mmol/L pH 8.0 Tris-HCl缓冲液平衡),流速为1.0 mL/min,用0~500 mmol/L 的NaCl溶液洗脱,收集有α-淀粉酶活性的组分,采用SDS-PAGE分析蛋白纯度。
1.2.6 最适pH和最适温度测定
最适pH的测定:选择不同pH的50 mmol/L 6种缓冲液,包括柠檬酸-柠檬酸钠(pH3.0~6.0)、醋酸-醋酸钠(pH4.0~6.0)、MES(pH5.5~7.0)、MOPS(pH6.5~8.0)、CHES(pH8.0~10.0)和CAPS(pH10.0~11.0),配制1%可溶性淀粉底物,在65 ℃条件下,按照DNS法,测定重组α-淀粉酶McAmyA在不同缓冲体系中的酶活,测定酶活最高点设为100%。
最适温度的测定:用最适pH缓冲液配制1%可溶性淀粉底物,在40~90 ℃条件下,按照DNS法测定重组α-淀粉酶McAmyA酶活,测定酶活最高点设为100%。
1.2.7 重组α-淀粉酶McAmyA水解液化液制备麦芽糖浆
1.2.7.1 重组α-淀粉酶McAmyA加酶量对麦芽糖含量的影响
以液化液为底物,在60 ℃和自然pH(pH 5.9)下,按照液化液质量分别添加α-淀粉酶40、60、80、100、120、140、160、180 U/g,水解8 h,HPLC检测麦芽糖含量,考察重组α-淀粉酶McAmyA加酶量对麦芽糖含量的影响,并计算在最优加酶量下的水解率。
1.2.7.2 水解温度对麦芽糖含量的影响
以液化液为底物,按照120 U/g的加酶量,自然pH(pH 5.9),水解温度分别为50、55、60、65、70、75 ℃下水解8 h,HPLC检测麦芽糖含量,考察水解温度对麦芽糖含量的影响,并计算在最佳水解温度下的水解率。
1.2.7.3 水解时间对麦芽糖含量的影响
以液化液为底物,在加酶量为120 U/g、温度60 ℃和自然pH(pH 5.9)的条件下分别水解8、10、12、14、16、20、24 h,HPLC检测麦芽糖含量,考察水解时间对麦芽糖含量的影响,并计算在最佳水解时间下的水解率。
1.2.7.4 糖含量测定和水解率计算
糖含量采用高效液相(HPLC)测定。
色谱柱:氨基键合柱(4.6×250 mm,5 μm);检测器:ELSD 2424 蒸发光检测器;柱温:45 ℃;流动相:乙腈∶水=60∶ 40,流速1 mL/min,进样体积10 μL,糖化液过0.22 μm滤膜,稀释一定倍数备用。
水解液中各糖含量和水解率的计算如下:
糖含量![]()
(1)
水解率![]()
(2)
干物质质量测定:阿贝折光仪直接测定(GB/T 20885—2007)。
2 结果与分析
2.1 α-淀粉酶基因McAmyA的毕赤酵母表达和高密度发酵
α-淀粉酶基因McAmyA在毕赤酵母GS115中成功表达,高拷贝筛选酶活最高的菌株进行5 L发酵罐高密度发酵,测定发酵液的酶活、蛋白含量和菌体湿重,并对发酵上清液进行SDS-PAGE分析,结果如图1所示。
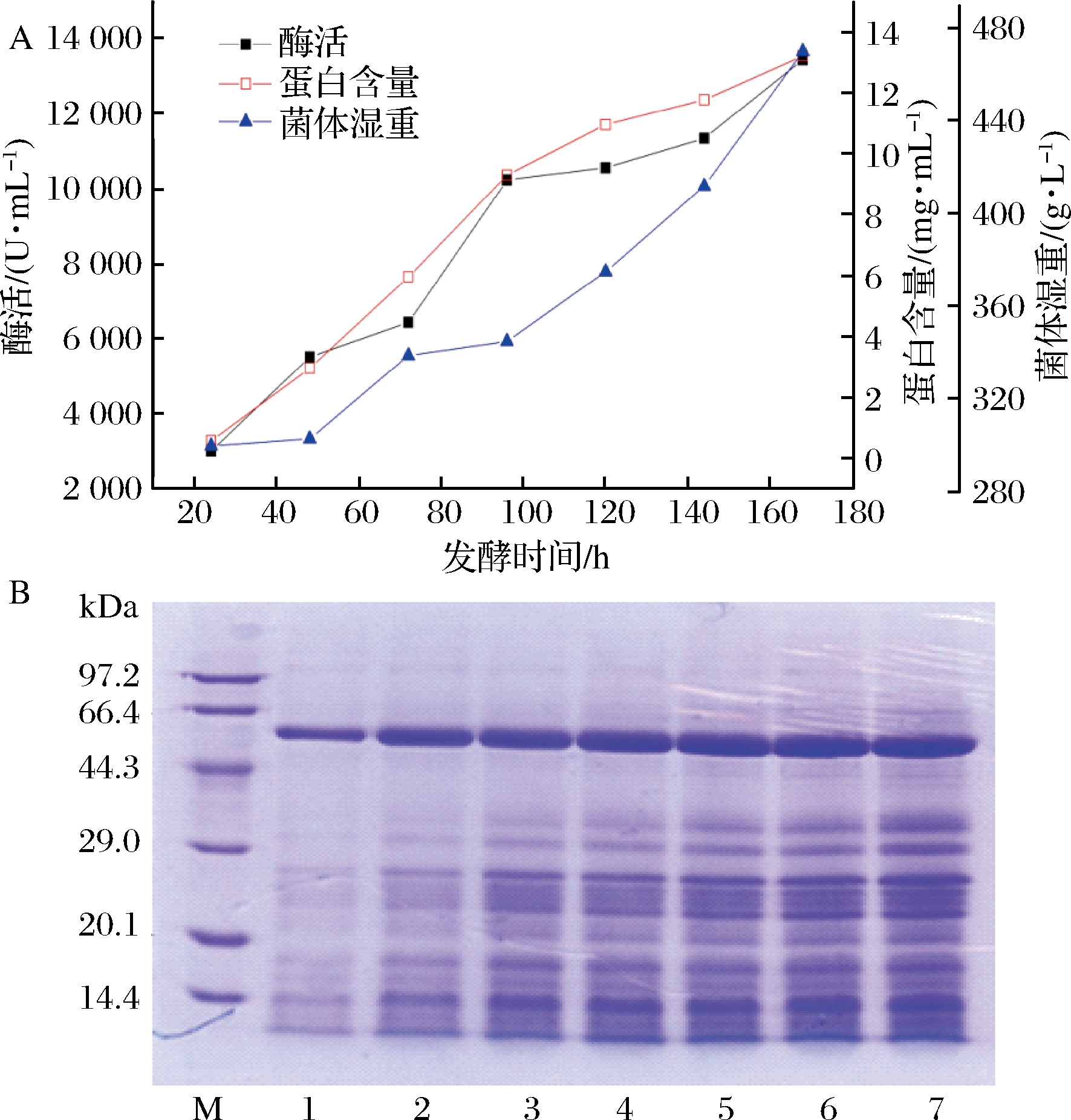
M-低分子质量标准蛋白;1-7分别为甲醇诱导24、48、72、96、118、144、168 h的发酵上清液
图1 毕赤酵母表达重组α-淀粉酶McAmyA的高密度发酵历程(A)及SDS-PAGE(B)
Fig.1 Time-course of recombinantα-amylase (McAmyA) expression in Pichia pastoris by high cell density fermention (A) and SDS-PAGE analysis of curde enzyme (B)
随甲醇诱导时间增加,菌体湿重、蛋白含量和α-淀粉酶酶活力逐渐上升(图1-A),由SDS-PAGE可看出,目标蛋白条带随发酵时间增加逐渐变粗(图1-B)。甲醇诱导168 h时,菌体湿重为470 g/L,胞外酶活力达13 440 U/mL(QB 2526—2001法测定酶活为:253.6 U/mL),蛋白含量为13.2 mg/mL,酶活力相比最初摇瓶发酵(554 U/mL),提高了24.3倍。
野生型樟绒枝霉菌株产α-淀粉酶活力低(308.5 U/mL),α-淀粉酶基因McAmyA在毕赤酵母GS115中成功表达,进行高密度发酵后,相对于原始菌株发酵,酶活提高了43.6 倍。已报道毕赤酵母表达中α-淀粉酶的表达水平较低。米曲霉(Rhizopus oryzae)α-淀粉酶在毕赤酵母中表达,分批补料发酵140 h后,蛋白表达量为0.382 mg/mL[15]。地衣芽孢杆菌(Bacillus licheniformis)α-淀粉酶在毕赤酵母中表达,经5 L发酵罐发酵168 h,蛋白表达量为8.3 mg/mL(酶活8 100 U/mL,DNS法,每分钟水解1 mg淀粉定义为1个酶活单位)[7]。本研究中樟绒枝霉α-淀粉酶在毕赤酵母GS115中高效表达,表达量在α-淀粉酶研究中处于较高水平。
2.2 重组α-淀粉酶McAmyA的纯化
重组α-淀粉酶McAmyA的纯化表如表1所示。
表1 重组α-淀粉酶McAmyA纯化表
Table 1 Purification summary of McAmyA

注:a酶活测定条件:可溶性淀粉为底物,MES缓冲液(pH 6.5),65 ℃;b蛋白质测定采用Lowry法,以牛血清蛋白(BSA)为标准品。
发酵粗酶液经QSFF强阴离子交换柱后一步纯化得到电泳级纯酶,纯化倍数为1.2,比酶活为1 230.2 U/mg,酶活力回收率为63.5%,纯酶在SDS-PAGE上显示为单一蛋白条带(见图2),分子质量约为55 kDa。基因序列预测该蛋白分子质量为51.9 kDa,含有1个可能的N-糖基化位点,纯酶经Endo H处理后,分子质量没有发生明显变化,说明该蛋白可能未发生糖基化。

M-低分子质量标准蛋白;1-纯酶液;2-经Endo H酶切除糖基后的蛋白
图2 重组α-淀粉酶McAmyA的SDS-PAGE分析
Fig.2 SDS-PAGE of recombinant α-amylase McAmyA
2.3 重组α-淀粉酶McAmyA的最适pH和最适温度
重组α-淀粉酶McAmyA的最适pH和最适温度见图3。α-淀粉酶McAmyA的最适pH为6.5 (图3-A),最适反应温度为65 ℃(图3-B),大于65 ℃,酶活降低,在90 ℃基本失活。

图3 重组α-淀粉酶McAmyA的最适pH(A)和最适温度(B)
Fig.3 Optimal pH (A) and optimal temperature (B) of McAmyA
重组α-淀粉酶McAmyA与野生型樟绒枝霉α-淀粉酶的最适pH和最适温度一致,最适pH接近于Fusicoccum sp.来源的α-淀粉酶[16](pH 7.0),高于Paecilomyces sp.来源的α-淀粉酶[17](pH 4.0)。最适温度低于Fusicoccum sp.[16]来源的α-淀粉酶(70 ℃),高于Geomyces pannorum来源的α-淀粉酶[18] (40 ℃)。
2.4 重组α-淀粉酶McAmyA制备麦芽糖浆
2.4.1 重组α-淀粉酶McAmyA加酶量对麦芽糖含量的影响
工业生产中,淀粉液化后直接进入糖化阶段,因此选用液化液为底物,在温度60 ℃和自然pH的条件下水解8 h,重组α-淀粉酶McAmyA加酶量对麦芽糖含量的影响如图4所示。

图4 重组α-淀粉酶McAmyA加酶量对麦芽糖含量的影响
Fig.4 Effect of recombinant α-amylase McAmyA dosage on maltose content
加酶量小于120 U/g时,随加酶量增加,麦芽糖含量明显增加,加酶量大于120 U/g后,麦芽糖含量增加缓慢,同时考虑生产成本和糖化效率,选择120 U/g为最适加酶量,此时的麦芽糖含量为44.3%,葡萄糖含量为14.4%(质量分数),水解率为54.6%。
2.4.2 水解温度对麦芽糖含量的影响
以液化液为底物,在加酶量120 U/g,水解8 h的条件下,水解温度对麦芽糖含量的影响见图5。

图5 水解温度对麦芽糖含量的影响
Fig.5 Effect of hydrolysis temperature on maltose content
温度小于60 ℃时,随温度升高,麦芽糖含量增加,糖化温度60 ℃时,麦芽糖含量达到最大,最大为43.3%,葡萄糖含量为15.7%,此时水解率为54.9%,温度大于60 ℃后,酶活稳定性差,水解率降低,麦芽糖含量减少。
2.4.3 水解时间对麦芽糖含量的影响
以液化液为底物,在加酶量120 U/g和水解温度60 ℃的条件下,水解时间对麦芽糖含量的影响结果如图6所示。随水解时间增加,麦芽糖含量逐渐增加(图6-A),水解时间大于14 h,麦芽糖含量增加缓慢,水解24 h时,主要产物是葡萄糖、麦芽糖、麦芽三糖和少量麦芽四糖(图6-B),麦芽糖含量为50.0%(图6-B),葡萄糖含量为40.4%,此时的水解率为83.44%,达到GB/T 20883—2007对麦芽糖浆的要求,即麦芽糖含量≥50%。

图6 水解时间对麦芽糖含量的影响(A)和水解24 h糖化液的HPLC色谱图(B)
Fig.6 Effect of time on maltose content (A) and HPLC chromatogram of maltose syrup at the optimal condition (B)
与已报道制备麦芽糖浆的研究相比,如张正文等[19]利用真菌α-淀粉酶在60 ℃和pH 5.5的条件下,水解40 h制备得麦芽糖含量为60%,葡萄糖含量为9.0%的啤酒用麦芽糖浆。易翠平等[10]以大米淀粉为原料,利用真菌淀粉酶在58 ℃下,水解10 h,制备得麦芽糖含量为45.18%,葡萄糖含量为4.75%的麦芽糖浆。郭俊珍等[20]在55 ℃下,水解44 h制备得76.8%的麦芽糖浆。重组α-淀粉酶McAmyA制备的麦芽糖浆中葡萄糖虽然含量较高,但是糖化温度较高,时间较短,在糖化过程中具有一定优势。
3 结论
将嗜热真菌樟绒枝霉α-淀粉酶基因McAmyA在毕赤酵母中高效表达,高密度发酵168 h时,蛋白表达量为13.2 mg/mL,胞外酶活力达13 440 U/mL。重组α-淀粉酶McAmyA粗酶液经强阴离子交换层析纯化得到电泳级纯酶,酶学性质研究表明,重组α-淀粉酶McAmyA的最适pH和最适温度分别为6.5 和65 ℃。以淀粉液化液为底物,在60 ℃、加酶量120 U/g和自然pH的条件下,水解24 h,重组α-淀粉酶McAmyA制备得麦芽糖含量为50.0%的麦芽糖浆。表明该酶在制备麦芽糖浆中具有很大应用潜力。
参考文献
[1] SINDHU R, BINOD P, MADHAVAN A, et al. Molecular improvements in microbial α-amylases for enhanced stability and catalytic efficiency[J]. Bioresource technology, 2017.98(4):1-8.
[2] VAN STEERTEGEM B, PAREYT B, BRIJS K, et al. Combined impact of Bacillus stearothermophilus maltogenic α-amylase and surfactants on starch pasting and gelation properties[J]. Food Chemistry, 2013,139(1-4):1 113-1 120.
[3] 李松,王正祥. 真菌α-淀粉酶的研究进展[J]. 生物技术通报, 2011,24(3):66-71.
[4] AQUINO A, JORGE J A, TERENZI H F, et al. Studies on a thermostable α-amylase from the thermophilic fungus Scytalidium thermophilum[J]. Applied Microbiology and Biotechnology, 2003,61(4):323-328.
[5] CHADHA B S, RUBINDER K, SAINI H S. Constitutive α-amylase producing mutant and recombinant haploid strains of thermophilic fungus Thermomyces lanuginosus[J]. Folia Microbiologica, 2005,50(2):133-140.
[6] HAN Peng, ZHOU Peng, HU Song-qing, et al. A novel multifunctional α-amylase from the thermophilic fungus Malbranchea cinnamomea: biochemical characterization and three-dimensional structure[J]. Applied Biochemistry and Biotechnology, 2013,170(2):420-435.
[7] WANG Jian-rong, LI Yang-yuan, LIU Dan-ni, et al. Codon optimization significantly improves the expression level of α -amylase gene from Bacillus licheniformis in Pichia pastoris[J]. BioMed Research International, 2015: 248 680.
[8] PARASHAR D, SATYANARAYANA T. Production of chimeric acidic α-amylase by the recombinant Pichia pastoris and its applications[J]. Frontiers in Microbiology, 2017,8(493):1-10.
[9] HE Zheng-gui, ZHANG Lu-jia, MAO You-zhi, et al. Cloning of a novel thermostable glucoamylase from thermophilic fungus Rhizomucor pusillus and high-level co-expression with α-amylase in Pichia pastoris[J]. BMC Biotechnology, 2014,14(1):3-10.
[10] 易翠平,蔡吉祥,刘瑞兴. 大米淀粉制备麦芽糖浆的工艺研究[J]. 食品科学, 2010,31(24):24-27.
[11] 亢潘潘,胡秋林. 响应曲面法优化小麦淀粉制备麦芽糖浆糖化工艺的研究[J]. 武汉工业学院学报, 2012,31(2):5-9;14.
[12] 黄伟红,赵静静,张亮,等. 超高麦芽糖浆的制备工艺研究[J]. 中国食品添加剂, 2015,118(8):118-124.
[13] MILLER G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Chemistry, 1959,31(3):426-428.
[14] LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the folin phenol reagent[J]. Journal of Biological Chemistry, 1951,193(1):265-275.
[15] LI Song, ZUO Zhi-rui, NIU Dan-dan, et al. Gene cloning, heterologous expression, and characterization of a high maltose-producing α-amylase of Rhizopus oryzae[J]. Applied Biochemistry and Biotechnology, 2011,164(5):581-592.
[16] CHAMPREDA V, KANOKRATANA P, SRIPRANG R, et al. Purification, biochemical characterization, and gene cloning of a new extracellular thermotolerant and glucose tolerant maltooligosaccharide-forming α-amylase from an endophytic ascomycete Fusicoccum sp. BCC4124[J]. Bioscience Biotechnology and Biochemistry, 2007,71(8):2 010-2 020.
[17] MICHELIN M, SILVA T M, BENASSI V M, et al. Purification and characterization of a thermostable α-amylase produced by the fungus Paecilomyces variotii[J]. Carbohydrate Research, 2010,345(16):2 348-2 353.
[18] HE Lei, MAO You-zhi, Zhang Lu-jia, et al. Functional expression of a novel α-amylase from antarctic psychrotolerant fungus for baking industry and its magnetic immobilization[J]. BMC Biotechnology, 2017,17(22):1-13.
[19] 张正文,尹卓容. 利用真菌淀粉酶制备啤酒用麦芽糖浆的研究[J]. 酿酒科技, 2005,133(7):53-56.
[20] 郭俊珍,王泽南,张书光,等. 碎米酶法制备高麦芽糖浆的工艺研究[J]. 食品科学, 2009,30(24):148-151.