羊乳富含蛋白质、脂肪、乳糖、矿物质、维生素以及多种生物活性物质,营养组成更接近母乳,是一种易被人体消化吸收的天然营养食品。由于羊乳的蛋白质组成与牛乳有较大差别,在加工过程中存在一定难度,尤其是在超高温瞬时灭菌(ultra-high temperature instantaneous sterilization,UHT)处理过程中,蛋白质稳定性差,易出现蛋白质沉淀现象[1]。为了提高羊乳的热稳定性,通常采用添加稳定性盐[2]、调节蛋白质组成[3]等方法进行处理,这些方法虽然对羊乳热稳定性有明显改善,但也会存在一定的安全隐患。随着生物技术的发展,人们发现谷氨酰胺转氨酶(transglutaminase, TGase)处理也可有效提高羊乳的热稳定性。
TGase是一种能催化蛋白质间酰基转移反应的酶,在蛋白质间形成共价键,促进蛋白质的交联[4],可改善蛋白质食品的保水性、黏弹性、稳定性等功能特性,已在肉制品、乳制品、水产品、大豆制品等富含蛋白食品中广泛应用[5-6]。乳中蛋白是TGase的良好底物[7],通过TGase交联可有效改善乳制品的热稳定性、凝胶化、持水性、黏度、乳化性等功能性质[8]。TGase交联作用受乳成分的影响较大,乳中的蛋白质主要由酪蛋白和乳清蛋白组成,酪蛋白由于其开放结构,易被TGase交联,而乳清蛋白的球状结构不易被交联,但对乳清蛋白适当的变性处理,可显著提高TGase的交联作用[9]。同时乳中还存在天然TGase抑制剂[10-11],能够抑制TGase的活性,这种抑制剂对热敏感,通过热处理可有效清除。热处理是目前乳制品加工的必经过程,不但可杀灭食品中有害微生物,保障食品安全,同时可使乳中乳清蛋白变性,灭活乳中的天然抑制剂。因此,本文通过研究羊乳的预热处理促进TGase对羊乳蛋白的交联,提高羊乳的热稳定性,进而为液态羊乳产品的开发提供理论基础。
1 材料与方法
1.1 材料与试剂
羊乳,西北农林科技大学试验农场新鲜羊乳;谷氨酰胺转氨酶(活性100 u/g),江苏一鸣生物科技有限公司;Nα-CBZ-Gln-Gly和L-谷氨酸-γ-单羟氧肟酸,美国Sigma公司;SDS-PAGE凝胶制备试剂盒,Solarbio公司。
1.2 仪器与设备
HH-S4型电热恒温水浴锅,北京科伟永兴仪器有限公司;Z206A台式离心机,西安中团生物科技有限公司;BI-90Plus激光粒度分析仪,美国布鲁克海文仪器公司;EYEL4真空冷冻干燥机,上海爱朗仪器有限公司;MULTISKAN GO全波长酶标仪,美国热电公司;Power PacTM基础电泳仪电源和Mini-Protean®Tetra Cell电泳槽,美国BIO-RAD公司;ChemiDoc-It®510化学发光成像仪,美国UVP公司。
1.3 羊乳热稳定性的测定
羊乳热稳定性的测定采用Fox[12]毛细管法,用热凝固时间(heat coagulation time,HCT)表示。将羊乳在3 500×g下离心20 min去除脂肪。取60 μL的样品密封于玻璃毛细管中,浸入140 ℃恒温油浴中加热,并不时旋转玻璃毛细管,记录从开始加热到羊乳沉淀出现挂壁现象所需的时间,即为羊乳的热凝固时间。
1.4 TGase活性的测定
TGase活性的测定采用Crossowicz比色法[13]。以Nα-CBZ-Gln-Gly为作用底物,L-谷氨酸-γ-单羟氧肟酸绘制标准曲线(y = 0.061 3x + 0.046 8,R2 = 0.999 2)。TGase酶活定义为37 ℃时每分钟催化生产1 μmol的L-谷氨酸-γ-单羟氧肟酸所需的酶量。
将预热处理的羊乳用3 mol/L HCl调pH至4.2[14],在15 000×g下离心15 min,去除沉淀的酪蛋白,将上清液用10 kDa滤膜(Amicon)超滤后,除去乳清蛋白[15],得到无乳蛋白的上清液,用于TGase活性的测定。
将试剂A(称100 mg Nα-CBZ-Gln-Gly溶于2 mL 0.2 mol/L NaOH溶液中,加入2 mL 0.1 mol/L盐酸羟胺、2 mL 0.01 mol/L还原型谷胱甘肽、4 mL 0.2 mol/L pH 6.0 Tris-HCl缓冲液)、试剂B(3 mol/L HCl、12% 三氯乙酸、5% FeCl3·6H2O按1∶1∶1体积比混合)在37 ℃下保温15 min。取0.4 mL无乳蛋白上清液,配制成0.01 g/mL的TGase液,添加1 mL试剂A在37 ℃下反应10 min,然后加0.4 mL试剂B终止反应5 min,4 000×g离心5 min,取上清液,在525 nm处比色,测定吸光值。用TGase酶活标准曲线计算TGase活性及残留酶活百分率。
![]()
(1)
式中:U,酶活,μmol/min;A,525 nm处的吸光度值;N,酶稀释倍数;10,反应时间,min;V,参加反应的酶体积,mL。
残留酶活百分率![]()
(2)
式中:U0,预处理前的TGase酶活,μmol/min;Ui,预处理后的TGase酶活,μmol/min。
1.5 酪蛋白胶束粒径的测定
将处理后的乳样在3 500×g下离心去除上层脂肪,取10 mL脱脂乳,用去离子水进行1∶10稀释,用BI-90Plus激光粒度分析仪在25 ℃下测定乳样中的胶束粒径。仪器参数设置为:分散介质:水;黏度:0.890 mPa·s;折光系数:1.330。
1.6 乳清蛋白变性率的测定
参照赵丽丽[16]的方法,将预热处理的乳样用1 mol/L HCl调整pH至4.2,在室温下静置10 min,然后在15 000×g下离心15 min去除酪蛋白,上清液为无酪蛋白液。在无酪蛋白液中加入15%的三氯乙酸(质量浓度),使三氯乙酸最终浓度为12%,在3 500×g下离心使其乳清蛋白沉淀,上清液为非蛋白氮液。用自动凯氏定氮仪分别测定处理后的非酪蛋白氮(NCN)和非蛋白氮(NPN)的含量,然后计算乳清蛋白氮(WPN)和乳清蛋白变性率。
WPN=NCN-NPN
(3)
乳清蛋白变性率![]()
(4)
1.7 SDS-PAGE
参照LAEMMLI[17]的方法,通过十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析羊乳蛋白质的交联程度。将羊乳样品用双蒸水稀释15倍,取1份上样缓冲液与3份样品稀释液混合均匀,在沸水浴中加热3~5 min使蛋白质变性,在12 000×g下离心5 min,取上层溶液为上样液。配制13.5%的分离胶(2.25 mL 30%丙烯酰胺(质量浓度)、1.25 mL pH 8.8 三(羟甲基)氨基甲烷(tris-HCl)、50 μL 10%十二烷基硫酸钠(SDS)(质量浓度)、50 μL 10%过硫酸铵(APS)(质量浓度)、5 μL四甲基乙二胺(TEMED)和1.4 mL双蒸水)和3.75%浓缩胶(0.313 mL 30%丙烯酰胺(质量浓度)、0.313 mL pH 6.8 tris-HCl、25 μL 10% SDS(质量浓度)、37.5 μL 10% APS(质量浓度)、3.75 μL TEMED和1.813 mL双蒸水),完成制胶阶段。在电泳槽内加入电极缓冲液(3.03 g tris、18.7 g甘氨酸、1 g SDS定容至1 L)。取7 μL上样液添加到上样孔中进行电泳,开始电泳电压为75 V,当溴酚蓝进入分离胶后将电压调至200 V,电泳40 min。将凝胶从玻璃板取下,在水平摇床中用染色液(1 g考马斯亮蓝R-250、450 mL甲醇、100 mL冰乙酸定容至1 L)染色2 h。染色后的凝胶用脱色液(甲醇:冰乙酸:双蒸水的体积比为1∶1∶8)摇床脱色,至蛋白质条带清晰为止,最后用Chemi Doc-It化学成像系统扫描进行灰度分析。
1.8 数据处理方法
采用Excel 2016对试验数据进行整理和图表编辑;采用DPS 9.50统计分析软件对试验数据进行显著性分析。
2 结果与讨论
2.1 预热处理对羊乳热稳定性的影响
将羊乳在60、70、80、90 ℃下分别处理10~60 min,添加TGase使羊乳中TGase浓度达到3 u/g蛋白质,在40 ℃保温2 h,测定其热凝固时间(HCT),结果见图1。
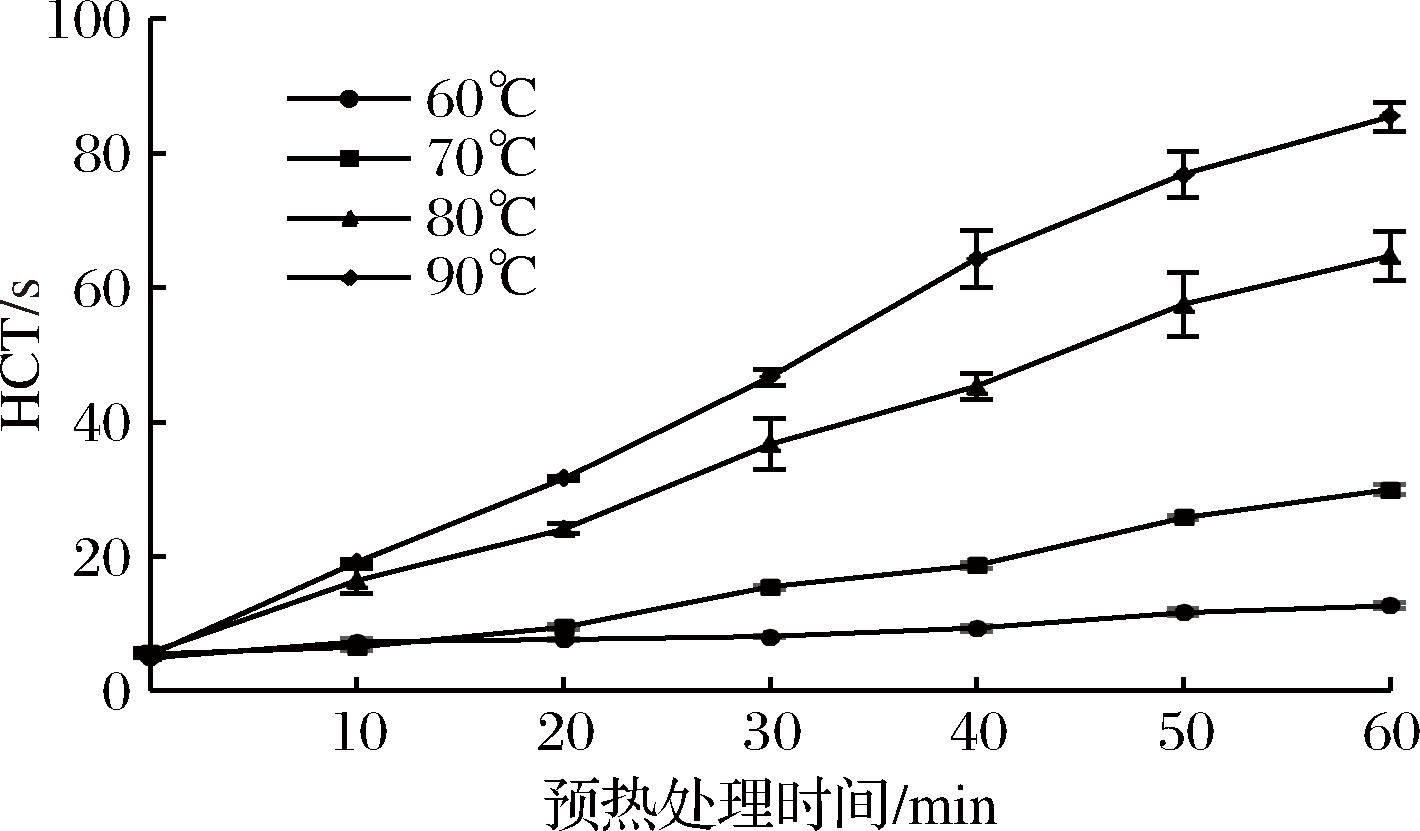
图1 预热处理对羊乳HCT的影响
Fig.1 Effect of preheat treatment on HCT of goat milk
由图1可知,用TGase催化羊乳蛋白交联提高其热稳定性与预热处理条件密切相关,随着预热处理温度的提高和处理时间的延长,羊乳HCT值逐渐增加,热稳定性提高。但预热处理条件对羊乳的热稳定性影响较大,在60~70 ℃预热处理时,羊乳的HCT缓慢上升;而当预热处理温度高于80 ℃时,羊乳的HCT显著提高,表明预热处理可有效地提高羊乳的热稳定性。大量研究表明,乳的热稳定性与TGase对乳蛋白的交联度有关,乳蛋白交联程度越大,乳的热稳定性越高[18]。但乳蛋白交联程度与乳蛋白存在状态有关,尤其是乳中天然存在的球状乳清蛋白,通常不易被TGase交联[7]。同时乳中存在天然的TGase抑制剂[19-20],影响TGase对乳蛋白的交联效果,预热处理提高羊乳的热稳定性可能与TGase抑制剂和乳清蛋白变性有关。
2.2 预热处理对羊乳中TGase抑制剂的影响
将羊乳在60、70、80、90 ℃分别处理5、10、20、30、60 min后,在羊乳中添加0.01 g/mL的TGase,在37 ℃下保温15 min,测定羊乳中TGase的活性,计算残留酶活百分率,并以未经预热处理的羊乳为对照,结果如图2。
由图2可知,当羊乳未经预热处理时,羊乳中残留TGase的活性仅为所添加TGase活性的37.4%,表明羊乳中存在天然的TGase抑制剂,抑制TGase对乳蛋白的交联。然而羊乳经预热处理后,残留的酶活性显著提高,当羊乳在60、70、80、90 ℃下预热处理5 min后,羊乳中残留酶活百分率分别达到56.55%、61.27%、78.35%、83.75%,与未经预热处理的对照组相比,残留TGase活性分别提高了19.15%、23.87%、40.95%、46.35%,表明羊乳预热处理可有效灭活羊乳中TGase抑制剂。同时可以看出,羊乳中TGase活性与预热处理温度和时间有关,当羊乳在80~90 ℃处理30 min时,羊乳中残留TGase活性几乎达到100%,而在60~70 ℃预热处理60 min时,羊乳中残留TGase活性才能达到100%,这表明羊乳在80~90 ℃处理30 min或在60~70 ℃处理60 min才完全使羊乳中TGase抑制剂失活。DE JONG [10]报道,牛乳中TGase抑制剂对热处理敏感,在80 ℃以上热处理即可使TGase抑制剂灭活,这与本研究结果一致。
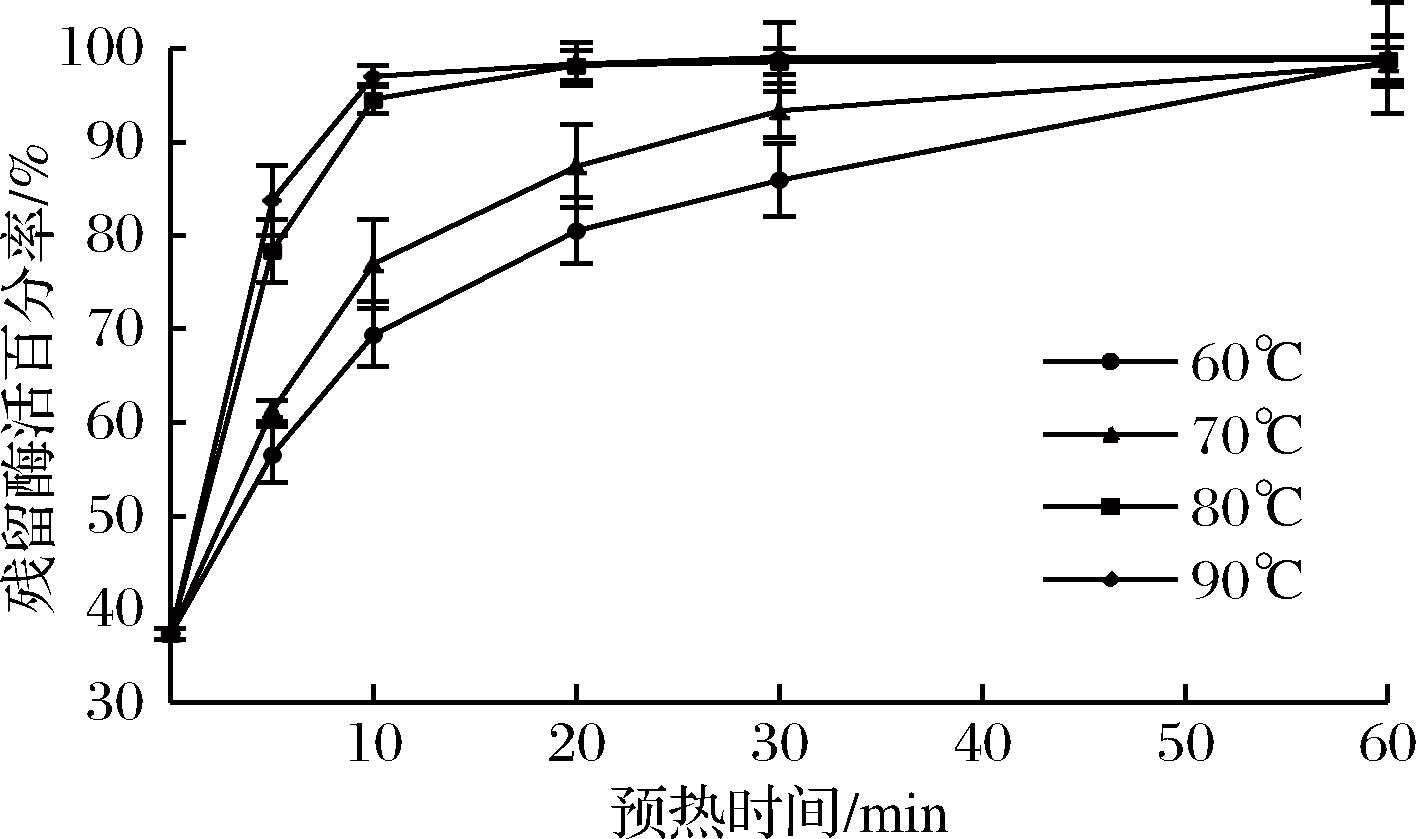
图2 预热处理对羊乳中TGase残留酶活的影响
Fig.2 Effect of preheat treatment on residual TGase activity in goat milk
2.3 预热处理对羊乳乳清蛋白变性率的影响
将羊乳在60、70、80、90 ℃下分别预热处理30 min,测定其乳清蛋白变性率,结果见图3。

图3 预热处理对羊乳乳清蛋白变性率的影响
Fig.3 Effect of preheat on the denaturation of whey protein in goat milk
由图3可知,预热处理温度对羊乳乳清蛋白变性率有显著的影响,随着预热温度的升高,乳清蛋白变性程度显著提高(P<0.05)。羊乳经60 ℃预热处理后有12.77%的乳清蛋白变性,而在80 ℃预热处理后有68.1%的乳清蛋白变性,80~90 ℃处理乳清蛋白变性程度变化不大(P>0.05)。乳中的乳清蛋白是一种热敏性蛋白质,在80 ℃以上热处理时极易变性,同时变性的乳清蛋白会与酪蛋白胶束结合,加速乳清蛋白的变性,这种变性的乳清蛋白更有利于TGase的交联[21],提高羊乳的热稳定性。
2.4 预热处理对羊乳酪蛋白胶束粒径的影响
将羊乳分别在60、70、80、90 ℃下预热处理30 min后立即冷却至40 ℃,添加TGase使其浓度达到3 u/g蛋白质,在40 ℃下保温2 h,测定羊乳中酪蛋白胶束粒径,结果如图4所示。

图4 预热处理对羊乳酪蛋白胶束粒径的影响
Fig.4 Effect of preheat on the size of casein micelles of goat milk
由图4可以看出,未经TGase处理的羊乳酪蛋白胶束平均为117.6 nm,且不受预热处理的影响(P>0.05),但羊乳经60~90 ℃预热处理后,TGase对羊乳中酪蛋白胶束粒径影响较大,且随着预热处理温度的升高,酪蛋白胶束粒径逐渐增大(P<0.05),MARTIN[22]研究表明,乳中酪蛋白在TGase交联时,仅发生分子内交联,酪蛋白胶束粒径无明显变化,而羊乳经预热处理时,由于乳清蛋白变性与酪蛋白胶束结合会形成较大的胶束[23],使TGase交联后酪蛋白粒径增大。
2.5 预热处理对羊乳蛋白质交联的影响
将羊乳在60、70、80、90 ℃下分别预热5 min和30 min,添加TGase使其浓度为3 u/g蛋白质,40 ℃保温2 h,用还原性SDS-PAGE电泳分析预热处理对TGase催化羊乳蛋白质交联的影响。
乳的热稳定性与乳中酪蛋白胶束状态有关,酪蛋白胶束是由αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白和κ-酪蛋白构成的复合物,其中κ-酪蛋白位于胶束表面,对胶束稳定性起关键作用[24],当乳经热处理时,位于表面的κ-酪蛋白易解离,使乳的稳定性降低[21],但当酪蛋白胶束经TGase交联后,可使κ-酪蛋白胶束在受热时稳定,不易从胶束表面脱离,从而提高乳的热稳定性。SDS-PAGE电泳是将交联后的酪蛋白胶束解离成单体酪蛋白,反映乳蛋白的交联程度。羊乳蛋白质在TGase作用下的交联情况见图5。
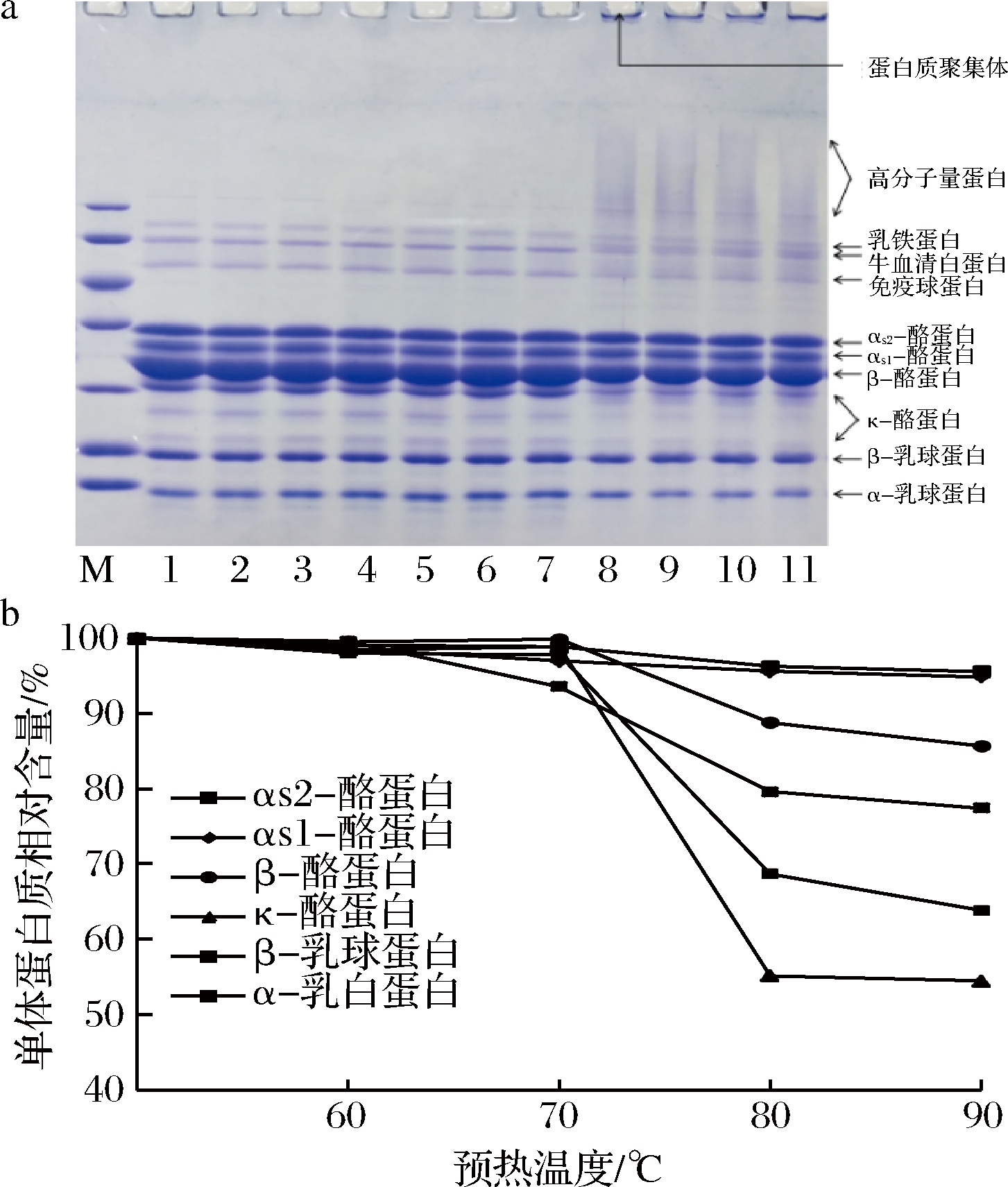
a-SDS-PAGE电泳图;b-预热温度对单体蛋白质相对含量的影响
图5 预热处理对TGase交联羊乳蛋白质的影响
Fig.5 Effect of preheat treatment on cross-linked goat milk protein with TGase
注:M为标准分子质量,范围是14.4~116 kDa;1为未经预热处理和未经TGase处理的脱脂羊乳;2为未预热处理,但经过3 u/g TGase在40 ℃下处理2 h的羊乳;3为未经TGase处理,但经过80 ℃ 30 min预热处理的羊乳;4、5分别为60 ℃预热5、30 min,3 u/g TGase在40 ℃下处理2 h的羊乳;6、7分别为70 ℃预热5、30 min,3 u/g TGase在40 ℃下处理2 h的羊乳;8、9分别为80 ℃预热5、30 min,3 u/g TGase在40 ℃下处理2 h的羊乳;10、11分别为90 ℃预热5、30 min,3 u/g TGase在40 ℃下处理2 h的羊乳。
由图5可以看出,羊乳中的4种酪蛋白(αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白和κ-酪蛋白)和2种乳清蛋白(α-乳白蛋白、β-乳球蛋白)在SDS-PAGE电泳中,可明显分离,形成清晰的条带。同时可以看出,经预热处理后,TGase交联形成的高分子质量蛋白条带。未经预热处理和未经TGase处理的羊乳(条带1)与未经预热处理、但经TGase处理的羊乳(条带2)相比,其4种酪蛋白和2种乳清蛋白条带的色度无明显变化,也未见高分子质量蛋白条带的形成,同时未经TGase处理、但经预热处理的羊乳(条带3)同样没有高分子质量蛋白条带的形成,这进一步证实羊乳中存在天然的TGase抑制剂,抑制TGase对乳蛋白的交联。但经预热和TGase同时处理的羊乳中蛋白质组成和高分子质量蛋白条带有一定变化,表明预热处理可促进乳蛋白的交联。
当羊乳经预热处理后,TGase对羊乳中蛋白的交联程度有一定的差别,尤其是当羊乳经80 ℃以上预热处理后(条带8、9、10、11),κ-酪蛋白条带色度明显降低,同时发现形成的高分子质量条带明显增多,而αs1-酪蛋白、αs2-酪蛋白和β-酪蛋白条带色度变化不大。同时发现乳清蛋白中的α-乳白蛋白和β-乳球蛋白的色度有不同程度的降低,经条带灰度分析,羊乳经80 ℃预热处理30 min时,κ-酪蛋白、α-乳白蛋白和β-乳球蛋白分别降低44.86%、31.33%和21.39%,这表明TGase对羊乳中蛋白交联是有选择性的,主要交联羊乳酪蛋白中的κ-酪蛋白和乳清蛋白中的α-乳白蛋白和β-乳球蛋白。RODRIGUEZ-NOGALES[25]研究表明,乳中酪蛋白对TGase交联敏感性不同,其中κ-酪蛋白处于酪蛋白胶束表面,易被TGase交联,而位于酪蛋白胶束内部的αs1-酪蛋白、αs2-酪蛋白和β-酪蛋白交联程度较低,这与本研究结果一致。关于乳清蛋白,由于其球状结构,通常不易被TGase交联,但经热处理时乳清蛋白变性,TGase可使其交联[26]。RODRIGUEZNOGALES[9]研究表明,当乳经热处理后,变性的α-乳白蛋白会与β-乳球蛋白形成复合物,然后再与κ-酪蛋白形成聚合物,TGase作用于κ-酪蛋白时,同时也稳定了酪蛋白胶束,提高羊乳的热稳定性。
3 结论
羊乳经预热处理后,用TGase对乳蛋白交联,可显著提高羊乳的热稳定性,羊乳中存在天然的TGase抑制剂,在60~70 ℃预热处理60 min或80~90 ℃预热处理30 min可使羊乳中TGase抑制剂完全失活,同时,预热处理可使羊乳中乳清蛋白变性,促使乳蛋白的交联,提高羊乳的热稳定性。SDS-PAGE电泳结果显示,预热处理可促进TGase与羊乳中κ-酪蛋白的交联,使κ-酪蛋白在热处理时不易从酪蛋白胶束表面解离,从而提高羊乳的热稳定性。
参考文献
[1] RAYNAL-LJUTOVAC K, PARK Y W, GAUCHERON F, et al. Heat stability and enzymatic modifications of goat and sheep milk[J]. Small Ruminant Research, 2007, 68(1): 207-220.
[2] WANG C, ZHU Y, WANG J. Comparative study on the heat stability of goat milk and cow milk[J]. Indian Journal of Animal Research, 2015,50(4):610-613.
[3] 乔星,张富新,乌素,等. 羊奶热稳定因素的研究[J]. 农产品加工(学刊), 2012(1): 46-48.
[4] KASHIWAGI T, YOKOYAMA K, ISHIKAWA K, et al. Crystal structure of microbial transglutaminase from Streptoverticillium mobaraense[J]. Journal of Biological Chemistry, 2002, 277(46): 44 252-44 260.
[5] 司晶星,张瑾,翟付群. 谷氨酰胺转氨酶生产及研究进展[J]. 商业文化(下半月), 2009(6): 229.
[6] 寇明钰,赵国华,阚健全. 谷氨酰胺转胺酶及其在食品工业中的作用[J]. 中国食品添加剂, 2004(5): 81-84, 88.
[7] O’SULLIVAN M M, LORENZEN P C, O’CONNELL J E, et al. Short communication: influence of transglutaminase on the heat stability of milk[J]. Journal of Dairy Science, 2001, 84(6): 1 331-1 334.
[8] ROMEIH E, WALKER G. Recent advances on microbial transglutaminase and dairy application[J]. Trends in Food Science & Technology, 2017, 62:133-140.
[9] RODRIGUEZNOGALES J M. Enhancement of transglutaminase-induced protein cross-linking by preheat treatment of cows’ milk: A statistical approach[J]. International Dairy Journal, 2006, 16(1): 26-32.
[10] DE JONG G A H, WIJNGAARDS G, KOPPELMAN S J. Transglutaminase inhibitor from milk[J]. Journal of Food Science, 2003, 68(3): 820-825.
[11] BÖNISCH M P, TOLKACH A, KULOZIK U. Inactivation of an indigenous transglutaminase inhibitor in milk serum by means of UHT-treatment and membrane separation techniques[J]. International Dairy Journal, 2006, 16(6): 669-678.
[12] O’CONNELL J E, FOX P F. Heat-induced coagulation of milk[M]. Boston, MA: Springer US, 2003: 879-945.
[13] GROSSOWICZ N, WAINFAN E, BOREK E, et al. The enzymatic formation of hydroxamic acids from glutamine and asparagine[J]. Journal of Biological Chemistry, 1950, 187(1): 111-25.
[14] ANEMA S G, STANLEY D J. Heat-induced, pH-dependent behaviour of protein in caprine milk[J]. International Dairy Journal, 1998, 8(10): 917-923.
[15] DE JONG G A H, WIJNGAARDS G, KOPPELMAN AND S J. Transglutaminase inhibitor from milk[J]. Food Chemistry and Toxicology, 2003,68(3):820-825.
[16] 赵丽丽. 羊乳热稳定性及凝胶特性的研究[D]. 北京:中国农业科学院, 2014.
[17] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227(5 259): 680-685.
[18] O’SULLIVAN M M, KELLY A L, FOX P F. Effect of transglutaminase on the heat stability of milk: A possible mechanism[J]. Journal of Dairy Science, 2002, 85(1): 1-7.
[19] AALTONEN T, HUUMONEN I, MYLL RINEN P. Controlled transglutaminase treatment in Edam cheese-making[J]. International Dairy Journal, 2014, 38(2): 179-182.
RINEN P. Controlled transglutaminase treatment in Edam cheese-making[J]. International Dairy Journal, 2014, 38(2): 179-182.
[20] IKURA K, MINAMI K, OTOMO C, et al. High molecular weight transglutaminase inhibitor produced by a microorganism (Streptomyces lavendulae Y-200)[J]. Bioscience Biotechnology & Biochemistry, 2000, 64(1): 116-124.
[21] RAJAKARI K. Structure modification of sour milk products by transglutaminase[D]. Helsinki: Aalto University, 2015.
[22] MP B N, M H, K W, et al. Transglutaminase cross-linking of milk proteins and impact on yoghurt gel properties[J]. International Dairy Journal, 2007, 17(11): 1 360-1 371.
[23] TATERKA H, CASTILLO M. The effect of whey protein denaturation on light backscatter and particle size of the casein micelle as a function of pH and heat-treatment temperature[J]. International Dairy Journal, 2015, 48(3): 53-59.
[24] WALSTRA P. On the stability of casein micelles 1[J]. Journal of Dairy Science, 1990, 73(8): 1 965-1 979.
[25] RODRIGUEZ-NOGALES J M. Effect of preheat treatment on the transglutaminase-catalyzed cross-linking of goat milk proteins[J]. Process Biochemistry, 2006, 41(2): 430-437.
[26] SHARMA R, LORENZEN P C, QVIST K B. Influence of transglutaminase treatment of skim milk on the formation of epsilon-(gamma-glutamyl)lysine and the susceptibility of individual proteins towards crosslinking[J]. International Dairy Journal, 2001, 11(10): 785-793.