红曲,在我国已有1000多年历史,是古代食疗两用的中药材[1],红曲中含有多种功能性成分,如红曲色素、氨基丁酸、洛伐他汀、麦角甾醇等[2],还含有淀粉酶、蛋白酶、果胶酶、酯化酶等多种酶类物质[3-5],具有很好的研究意义。
洛伐他汀为日本学者远藤章于1979年从红色红曲霉菌(Monascus rubber)的发酵液中分离出来,发现其具有强烈抑制胆固醇合成的作用,命名为Monacolin K[6]。之后,远藤章又相继分离出Monacolin J、Monacolin L[7]、Monacolin X[8]和Monacolin M[9],将这些物质统称为Monacolins,但Monacolin K还是主要作用物质。
随着人们生活水平的日益提高,患有心血管疾病的人越来越多,洛伐他汀作为治疗心血管疾病的理想药剂[10-11],需求量日益增大,但生产过程中的产量低、周期长、成本高等问题限制了红曲洛伐他汀的实际应用。因此,本文对实验室选育得到的高产洛伐他汀红曲霉突变株R”-30进行液态发酵和分离纯化工艺研究,为工业化生产和应用提供参考依据。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种与试剂
红曲霉突变株R”-30(Monascus R”-30),由福建省海洋酶工程重点实验室利用基因组重排技术选育得到。
蛋白胨购于Oxiod公司;柱层析用硅胶:80~120目,购自青岛海洋化工有限公司; Sephadex LH20,购自西格玛奥德里奇(上海)贸易有限公司;酵母膏、甘油、葡萄糖、乙酸乙酯、MgSO4·7H2O、NaNO3、ZnSO4·7H2O、KH2PO4等均为分析纯,购自国药集团化学试剂有限公司。
1.1.2 主要仪器设备
T6新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司;SW-CJ-2F洁净工作台,苏州安泰空气技术有限公司;HWS24电热恒温水浴锅,上海一恒科技有限公司;SHP-250生化培养箱,上海精宏实验设备有限公司;ZWYR-2102C恒温振荡培养箱,上海智城分析仪器制造有限公司);CF16RXⅡ高速冷冻离心机,日本HITACHI公司; D-2000 Elite型高压液相色谱仪,日本HITACHI。
1.1.3 培养基
PDA培养基:配制方法参照文献[12]。
种子培养基(g/L):葡萄糖30,蛋白胨20,酵母膏20,黄豆粉10,甘油(分析纯)50,MgSO4·7H2O 1,NaNO3 2,ZnSO4·7H2O 2,KH2PO4 1。
液体发酵培养基(g/L):葡萄糖20,甘油(分析纯)50,蛋白胨10,酵母膏10,NaNO32,MgSO4·7H2O 1,ZnSO4·7H2O 2,KH2PO4 1。
无碳源发酵培养基(g/L):蛋白胨10,酵母膏10,MgSO4·7H2O 1,NaNO3 2,ZnSO4·7H2O 2,KH2PO4 1。
无氮源发酵培养基(g/L):葡萄糖20,甘油50,MgSO4·7H2O 1,ZnSO4·7H2O 2,KH2PO4 1。
缺无机盐发酵培养基(g/L):葡萄糖20,甘油50,蛋白胨10,酵母膏10,NaNO3 2。
1.2 实验方法
1.2.1 洛伐他汀测定方法
1.2.1.1 紫外分光光度法
洛伐他汀在229、237和246 nm处有最大紫外吸收,其中以237 nm处吸光值最大,可通过测量OD237来初步判定洛伐他汀含量的高低[13]。取1 mL发酵液,加入9 mL乙醇(70%)振荡混匀,55 ℃,130 r/min 振荡提取1 h;4 200 r/min离心5 min,取上清,适当稀释后测量OD237。
1.2.1.2 高效液相色谱法(HPLC)
(1)HPLC检测条件[14]
色谱柱:HITACHI LaChromUltra C18 (5 μm);流动相:乙腈∶0.01%磷酸=60∶40;检测波长:238 nm;进样体积:10 μL;流速:1 mL/min;柱温:28 ℃。
(2)洛伐他汀(内酯型)标准曲线的绘制
准确称取洛伐他汀内酯型标准品5 mg,用甲醇定容至25 mL,得到200 mg/L的母液,系列稀释得到5,10,50,100,150 mg/L的样品。以洛伐他汀浓度为横坐标,以峰面积值为纵坐标绘制洛伐他汀浓度-峰面积标准曲线,每组实验重复3次。
由图1可知,当洛伐他汀浓度在0~200 mg/L时,线性关系良好,R2 =0.998 4,回归方程为y=16 689x-1 202.6,内酯型洛伐他汀标准品的液相色谱图如图2所示。
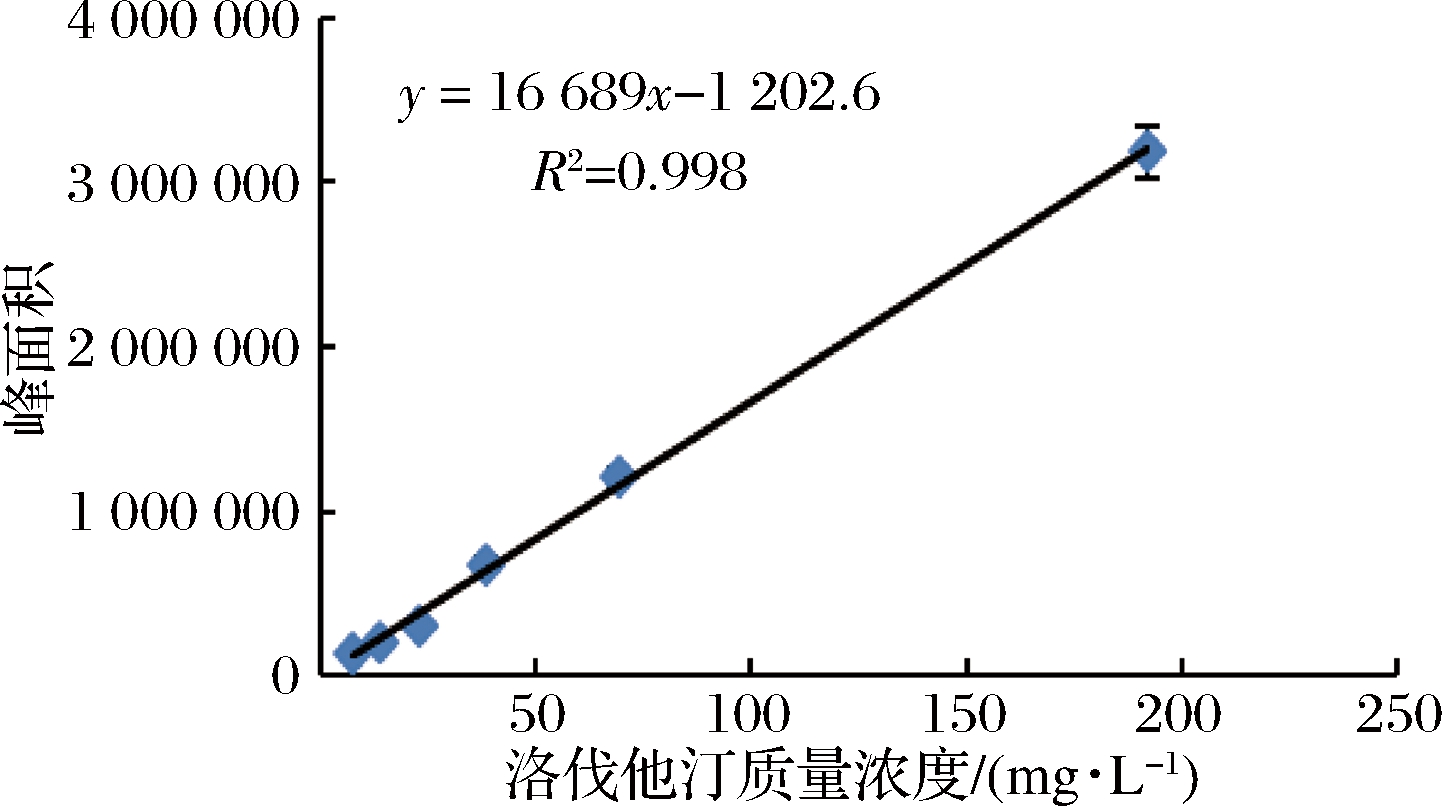
图1 洛伐他汀(内酯型)浓度与峰面积关系曲线
Fig.1 Curve of lovastatin(lactone form) concentration and peak area
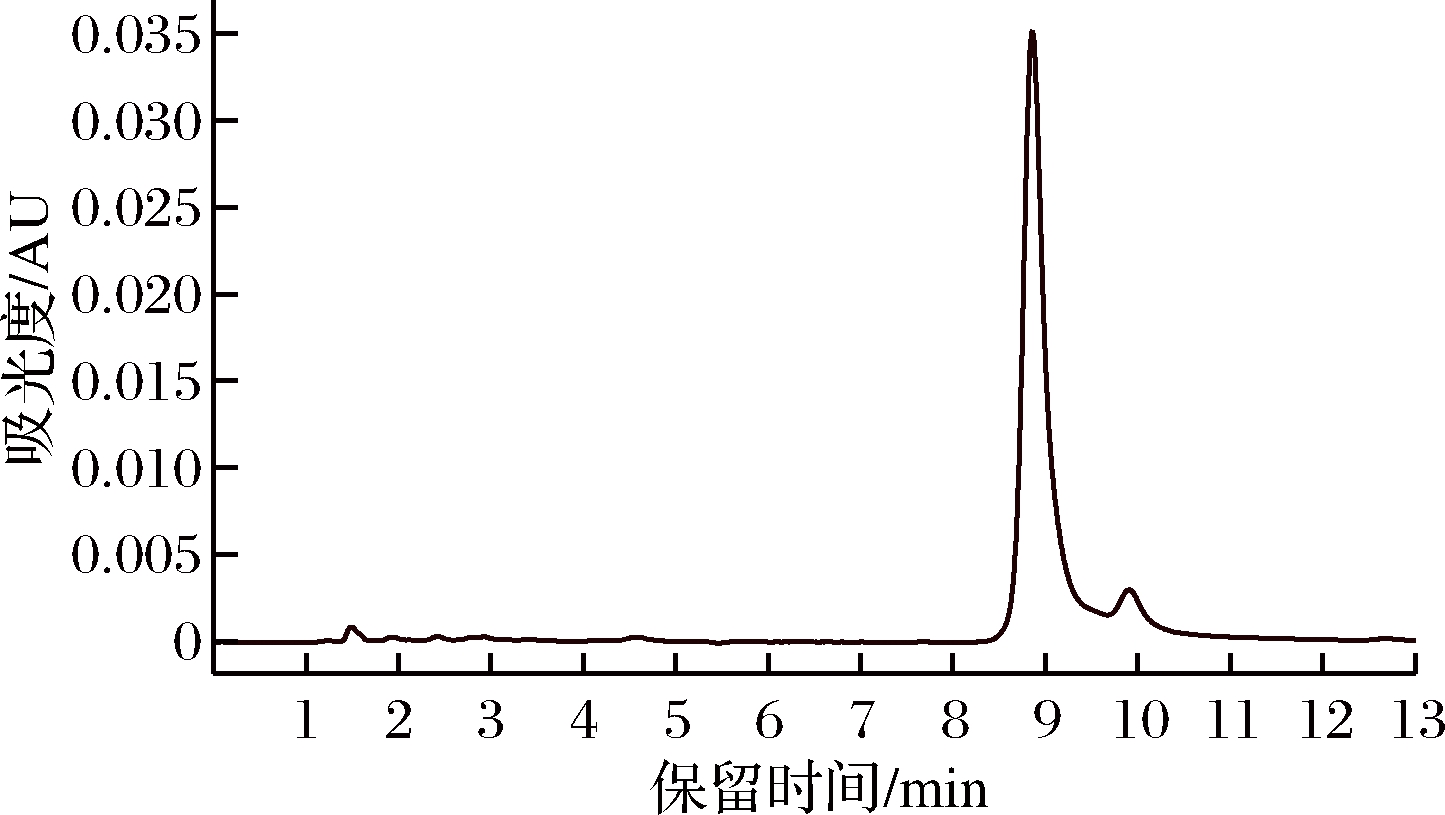
图2 洛伐他汀(内酯型)标准品的液相色谱图
Fig.2 HPLC chromatogram of standard substance concentration and peak area of lovastatin(lactone form)
(3)洛伐他汀开环酸型溶液制备方法
准确称取洛伐他汀内酯型标准品5 mg,加4 mL甲醇溶解,加20 mL 0.2 mol/L NaOH溶液混匀后采用超声波处理30 min,取出冷却,用3 mol/L H3PO4调pH至6左右,加甲醇定容至25 mL,然后进行液相色谱检测,若洛伐他汀内酯型标准品全部转化为开环酸型,则洛伐他汀开环酸型浓度约为200 mg/L。
(4)洛伐他汀(开环酸型)标准曲线的绘制
方法同内酯型标准曲线的绘制。由图3可知洛伐他汀浓度在0~200 mg/L时,线性关系良好,R2 =0.995 32,回归方程:y=20 339x+21 205。开环酸型洛伐他汀标准品的液相色谱图,如图4所示。
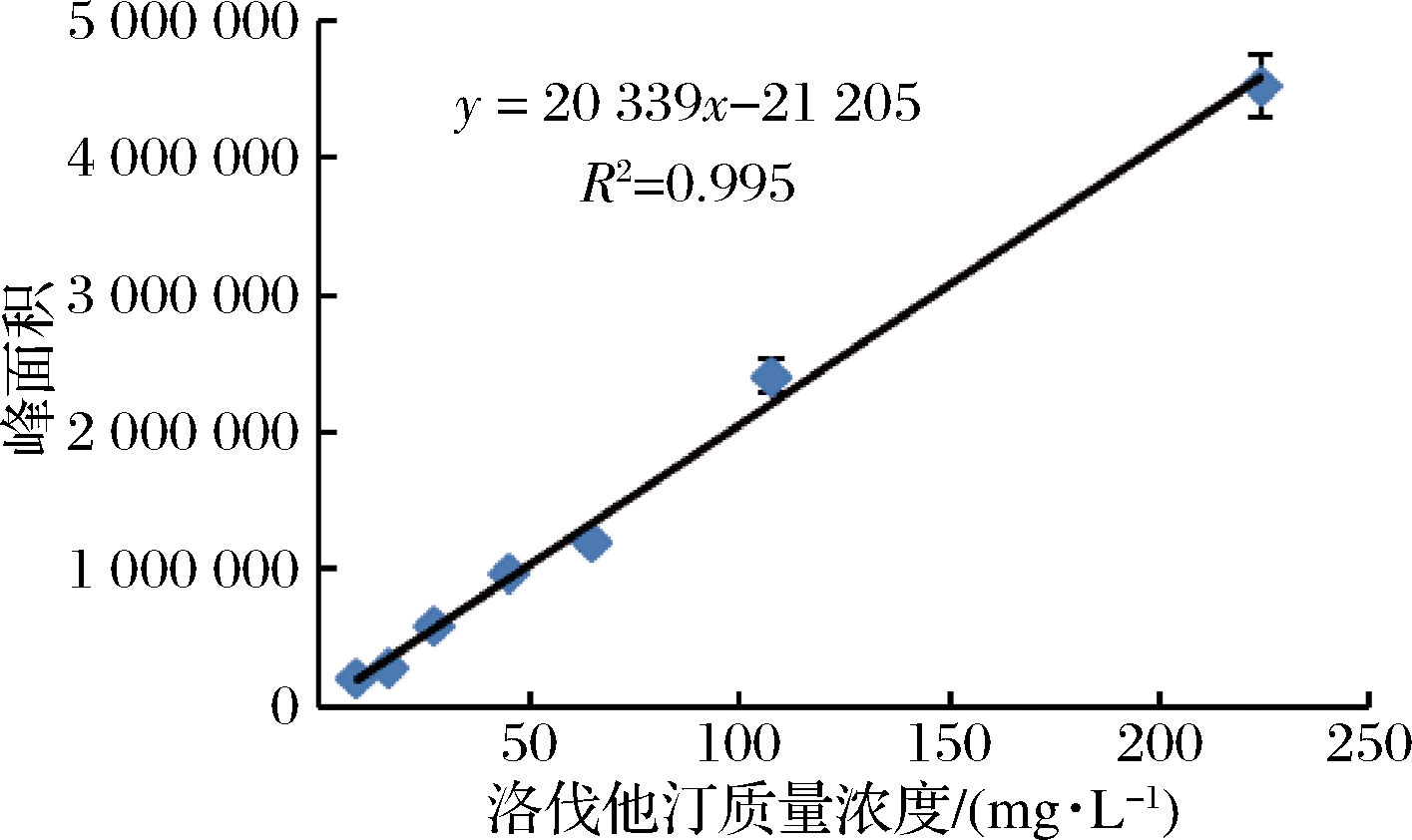
图3 洛伐他汀(开环酸型)浓度与峰面积关系曲线
Fig.3 Curve of lovastatin(acid form) concentration and peak area
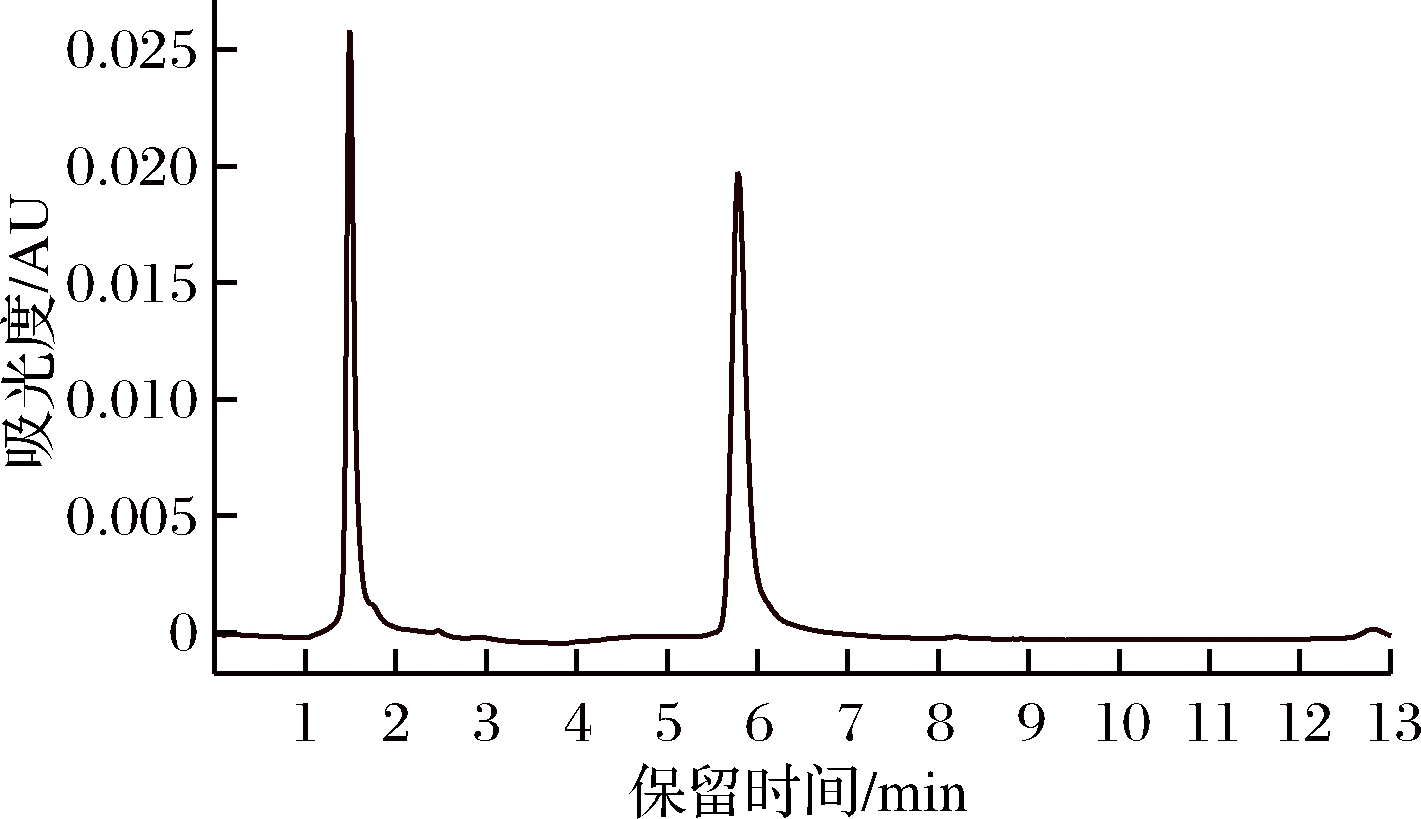
图4 洛伐他汀(开环酸型)标准品的液相色谱图
Fig.4 HPLC chromatogram of standard concentration and peak area substance of lovastatin (acid form)
(5)发酵液中洛伐他汀的检测
取1 mL发酵液,加入70%乙醇9 mL振荡混匀, 55 ℃,130 r/min振荡提取1 h,4 200 r/min离心5 min,取上清液用0.22 μm的有机微孔滤膜过滤,取滤液采用HPLC检测洛伐他汀含量,如方程(1)所示。
ρ(内酯型洛伐他汀)/mg·L-1)=(y+1 202.6)/16 689×稀释倍数
(1)
式中:y—内酯型洛伐他汀峰面积。
ρ(开环酸型洛伐他汀)/(mg·L-1)=(y-21 205)/20 339×稀释倍数
(2)
式中:y—酸型洛伐他汀峰面积。
1.2.2 红曲霉发酵培养基的优化
(1)碳源对洛伐他汀产量的影响:分别选取葡萄糖、蔗糖、可溶性淀粉、甘油、半乳糖、麦芽糖6种碳源添加到缺碳发酵培养基中(添加量均为2%表示100 mL 发酵液添加2 g碳源),考察不同碳源对洛伐他汀产量的影响;确定最适碳源后,进一步研究不同添加量(1%、2%、3%、4%、5%、6%)的影响。
(2)氮源对产洛伐他汀的影响:分别取有机氮源—蛋白胨、牛肉膏、酵母膏、玉米浆、黄豆粉等(添加量1%);无机氮源—NaNO3、NH4NO3、(NH4)2SO4(添加量0.2%)添加到缺氮培养基中,考察不同氮源对洛伐他汀产量的影响。确定最佳氮源后,进一步研究不同添加量(0.5%、1%、1.5%、2%、2.5%、3%)的影响。
(3)无机盐对产洛伐他汀的影响:选择KH2PO4、MgSO4·7H2O、ZnSO4·7H2O、FeSO4(添加量0.1%)添加到缺无机盐培养基中,考察不同无机盐对洛伐他汀产量的影响。确定最佳无机盐后,进一步研究不同添加量(0.05%、0.1%、0.15%、0.2%、0.25%、0.3%)的影响。
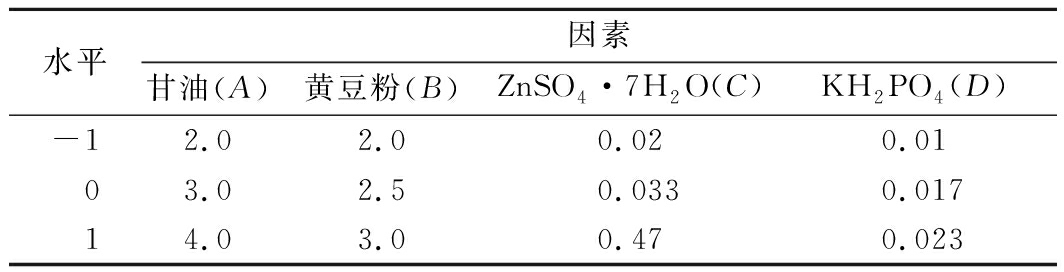
(4)碳源、氮源、无机盐配比的正交试验:在上述实验基础上,对碳源、氮源、无机盐进行正交试验研究各自适宜的添加量。利用L9(34)正交表进行实验设计确定这些因素的最优配比。因素水平编码如表1所示。
表1 正交实验设计因素水平编码表 单位:%
Table 1 Factors and levels of orthogonal experimental design
1.2.3 红曲霉发酵条件的优化
(1)培养基初始pH的影响:调节发酵培养基pH分别为4、5、6、7、8,研究不同初始pH对菌株产洛伐他汀的影响,确定最适初始pH。
(2)种龄的影响:分别将不同菌龄(48、56、64、72、80 h)的种子液接种到发酵液中培养,确定最佳菌龄。
(3)接种量的影响:分别控制接种量为4%、8%、12%、16%、20%,研究最适接种量。
(4)发酵温度的影响:将摇瓶分别置于25、30、35 ℃和变温(28 ℃,2 d;26 ℃,2 d;25 ℃,2 d;23 ℃,数天)的摇床中进行发酵培养,确定适宜的发酵温度。
(5)摇床转速的影响:将摇瓶分别置于转速为100、150、200、230 r/min的摇床中进行发酵培养,确定适宜的转速。
(6)摇瓶装液量的影响:在250 mL锥形瓶中分别装25、50、75、100、125 mL发酵培养基,研究不同装液量对洛伐他汀产量的影响。
1.2.4 洛伐他汀的分离纯化
1.2.4.1 红曲中洛伐他汀提取分离路线
液态发酵液→洛伐他汀提取→离心→上清液浓缩→硅胶柱层析→洛伐他汀粗品→浓缩→LH20柱层析→收集→检测纯度[15-17]。
1.2.4.2 洛伐他汀提取
调节发酵液pH至碱性,于30 ℃、180 r/min的水浴摇床中提取1 h后,4 200 r/min离心5 min,取上清液。
2 结果与分析
2.1 红曲霉液态发酵产物中洛伐他汀类型的判定
采用HPLC检测发酵液中的洛伐他汀,色谱图见图5。
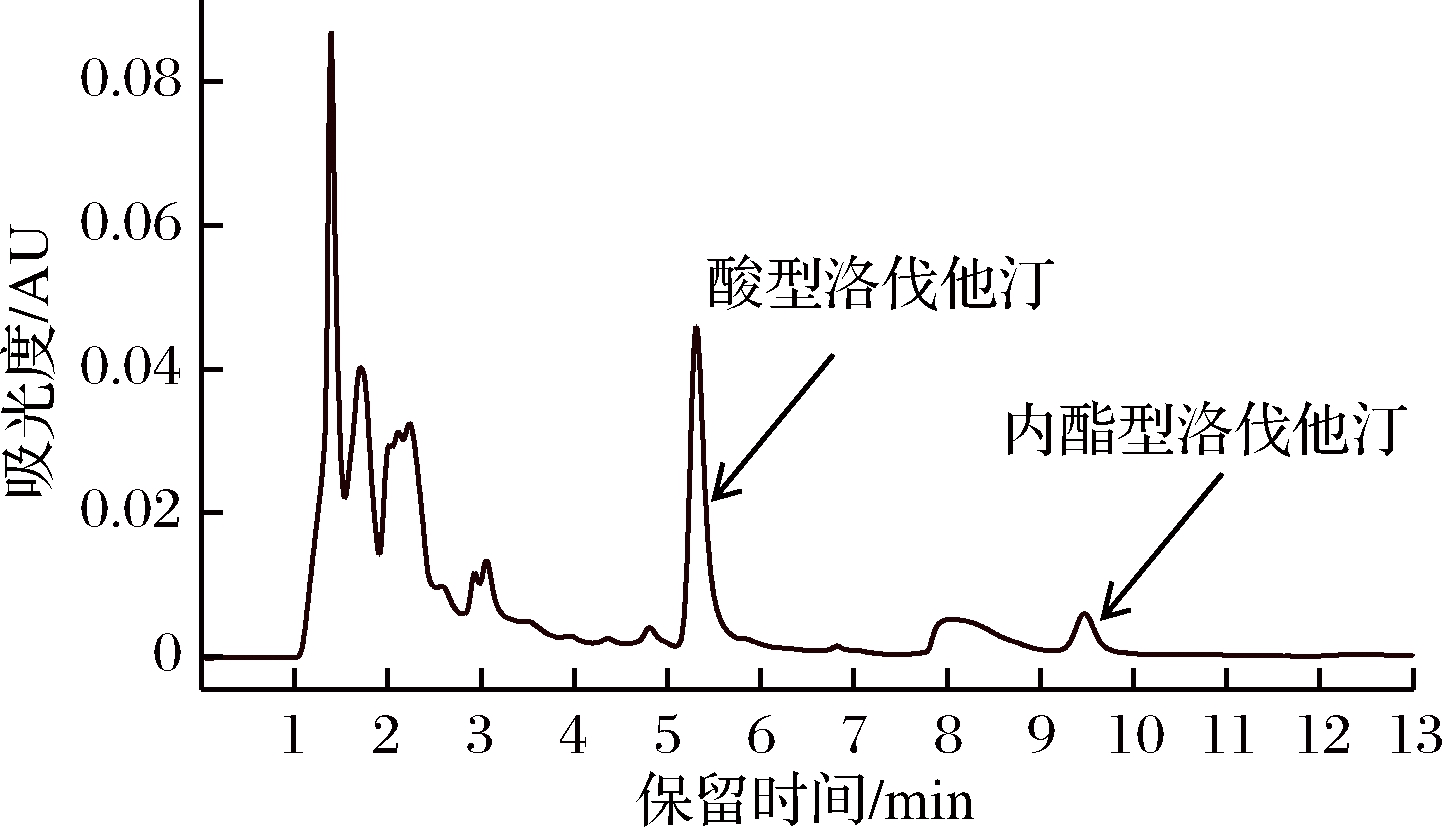
图5 发酵液中洛伐他汀的HPLC检测色谱图
Fig.5 HPLC detection chromatogram of fermentation broth for the content of lovastatin
由图5可知,红曲霉液态发酵所产的洛伐他汀主要为开环酸型。据文献报道,天然红曲产的洛伐他汀多为酸型,其药效约为内酯型的2倍[18],因此红曲霉洛伐他汀具有很好的药用功效。
2.2 洛伐他汀液态发酵工艺研究
2.2.1 发酵培养基优化
2.2.1.1 碳源对洛伐他汀产量的影响
不同碳源对洛伐他汀产量的影响如图6所示,碳源为甘油时洛伐他汀产量最高(定义为100%),确定最佳碳源为甘油。进一步研究其不同添加量甘油对洛伐他汀产量的影响,从图7可以看出,在3%时达到最大值(定义为100%)。
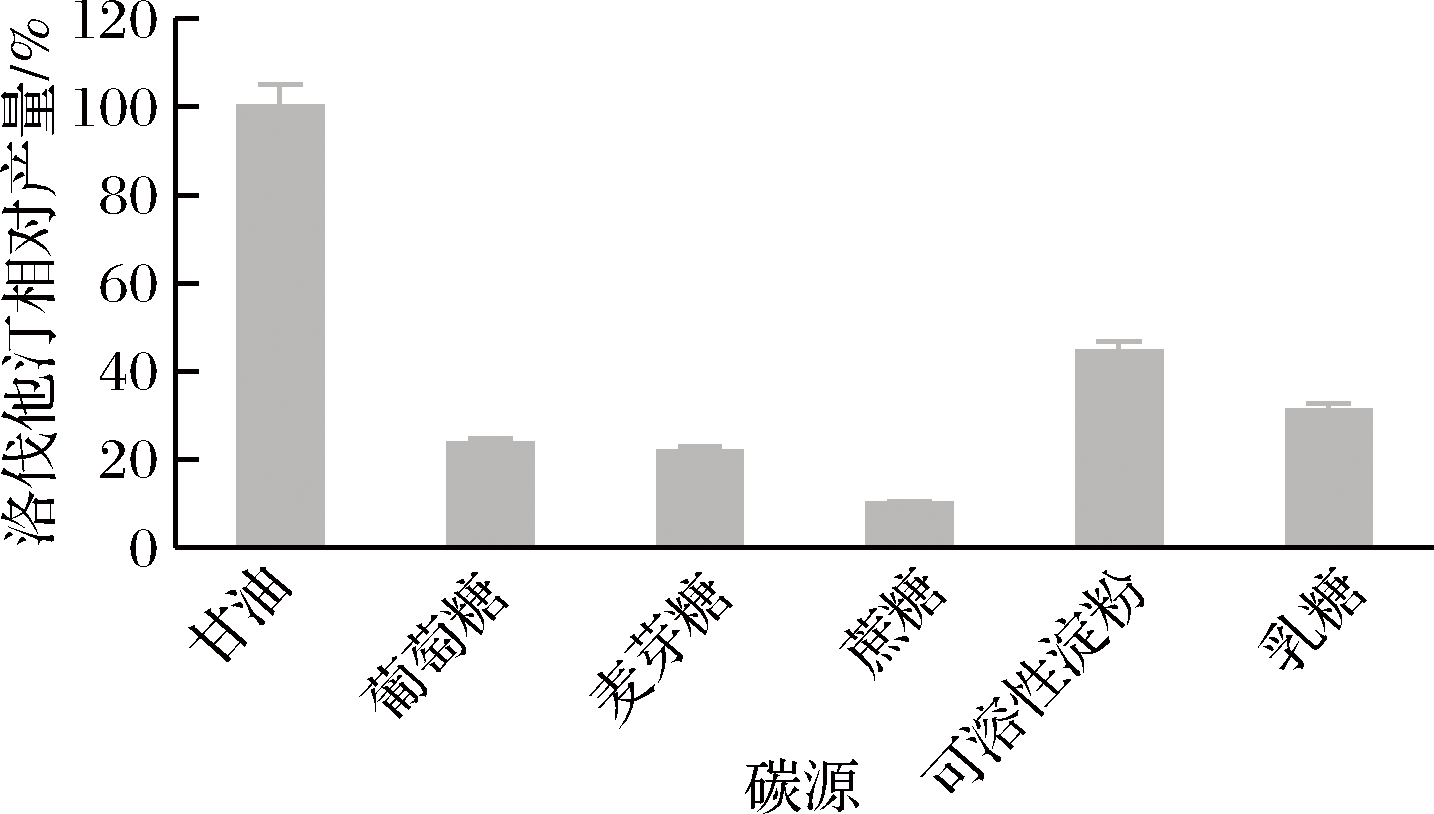
图6 碳源对洛伐他汀产量的影响
Fig.6 Effect of carbon sources on lovastatin yield
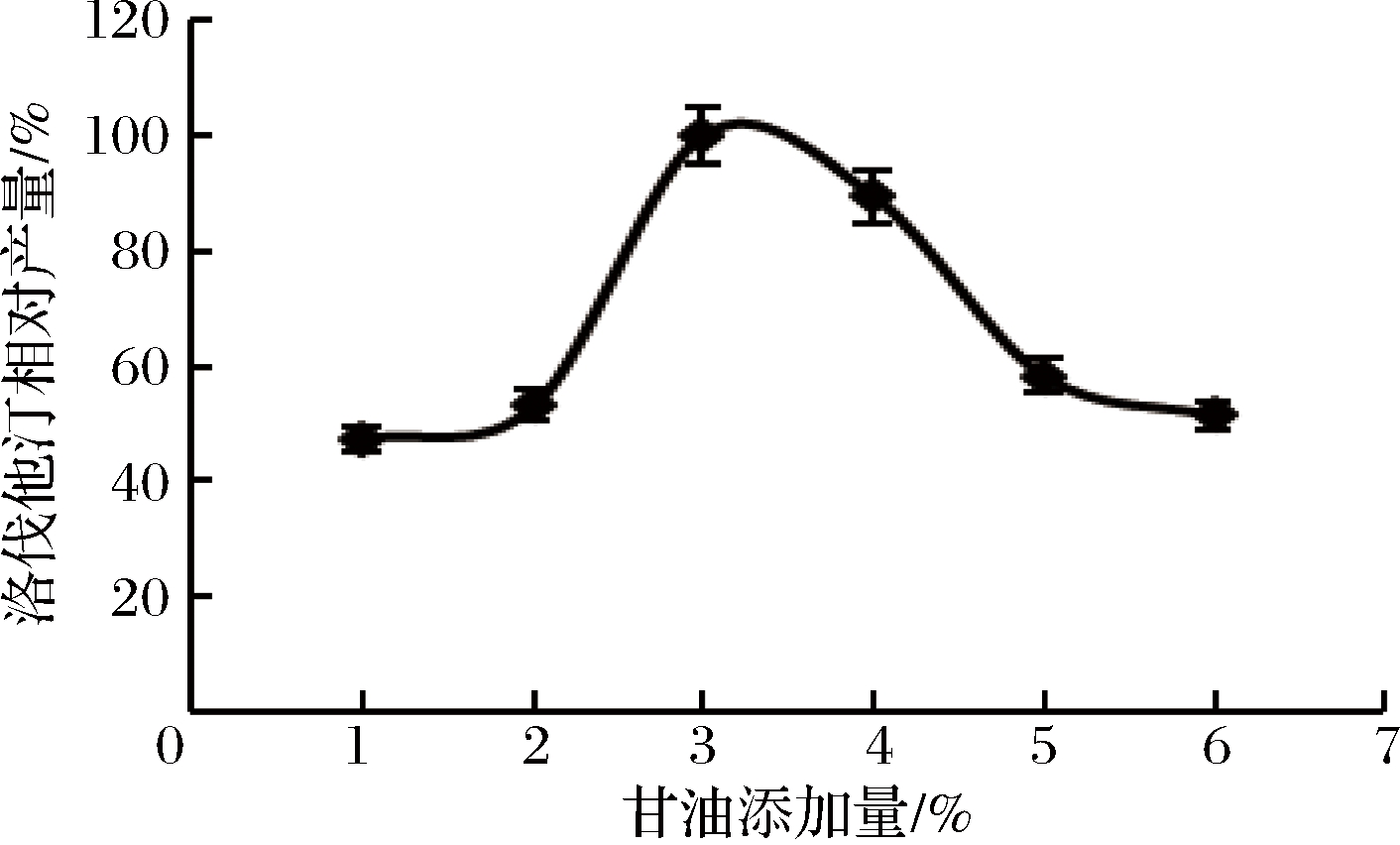
图7 甘油添加量对洛伐他汀产量的影响
Fig.7 Effect of glycerol content on lovastatin yield
2.2.1.2 氮源对洛伐他汀产量的影响
不同氮源对洛伐他汀产量的影响如图8所示,黄豆粉效果最好(定义为100%),确定为最佳氮源。进一步对黄豆粉的最佳添加量进行研究,实验结果见图9,添加量为2.5%时,洛伐他汀产量达到最大(定义为100%),所以确定黄豆粉的最适添加量为2.5%。
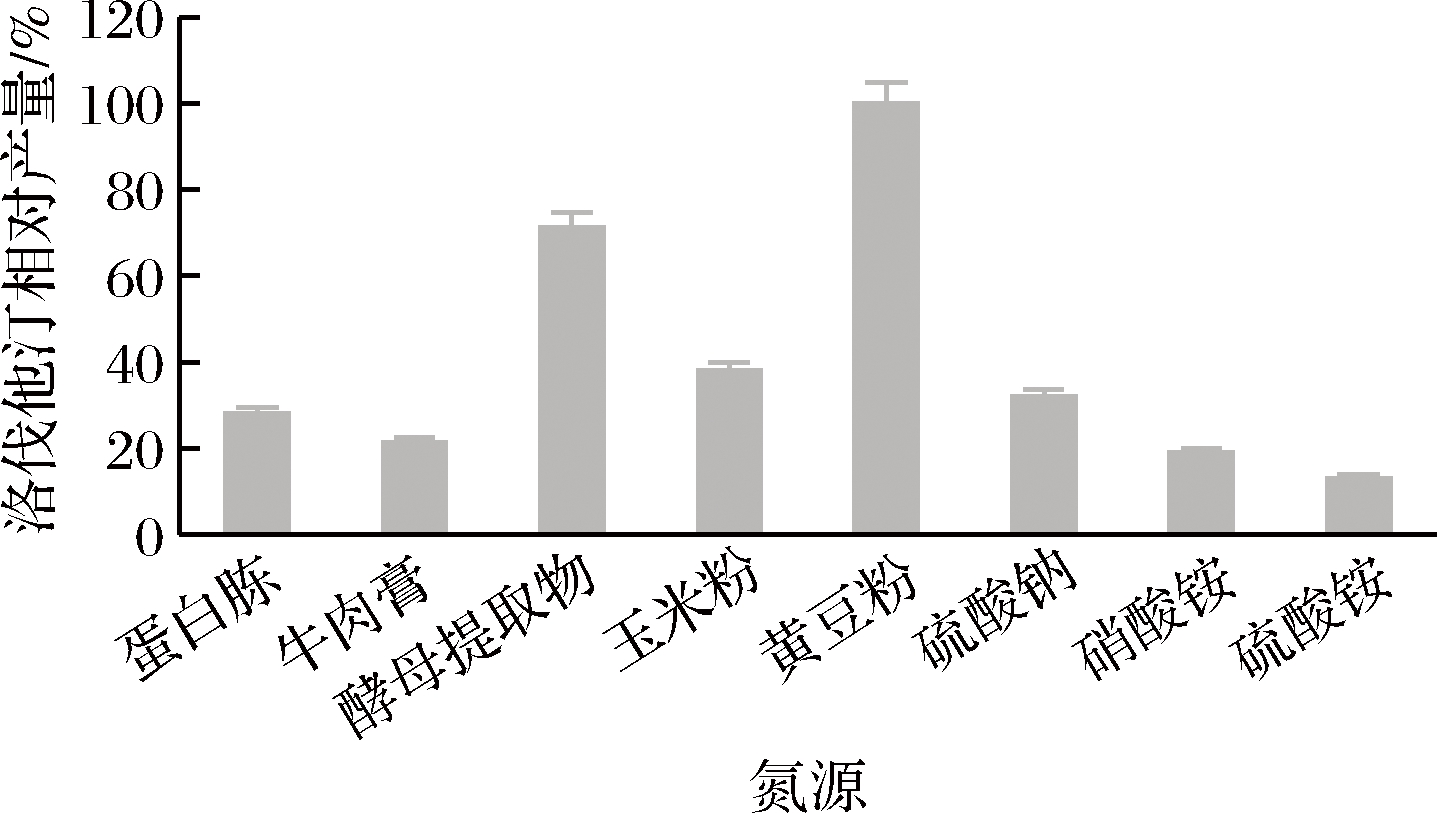
图8 氮源对洛伐他汀产量的影响
Fig.8 Effect of nitrogen sources on lovastatin yield
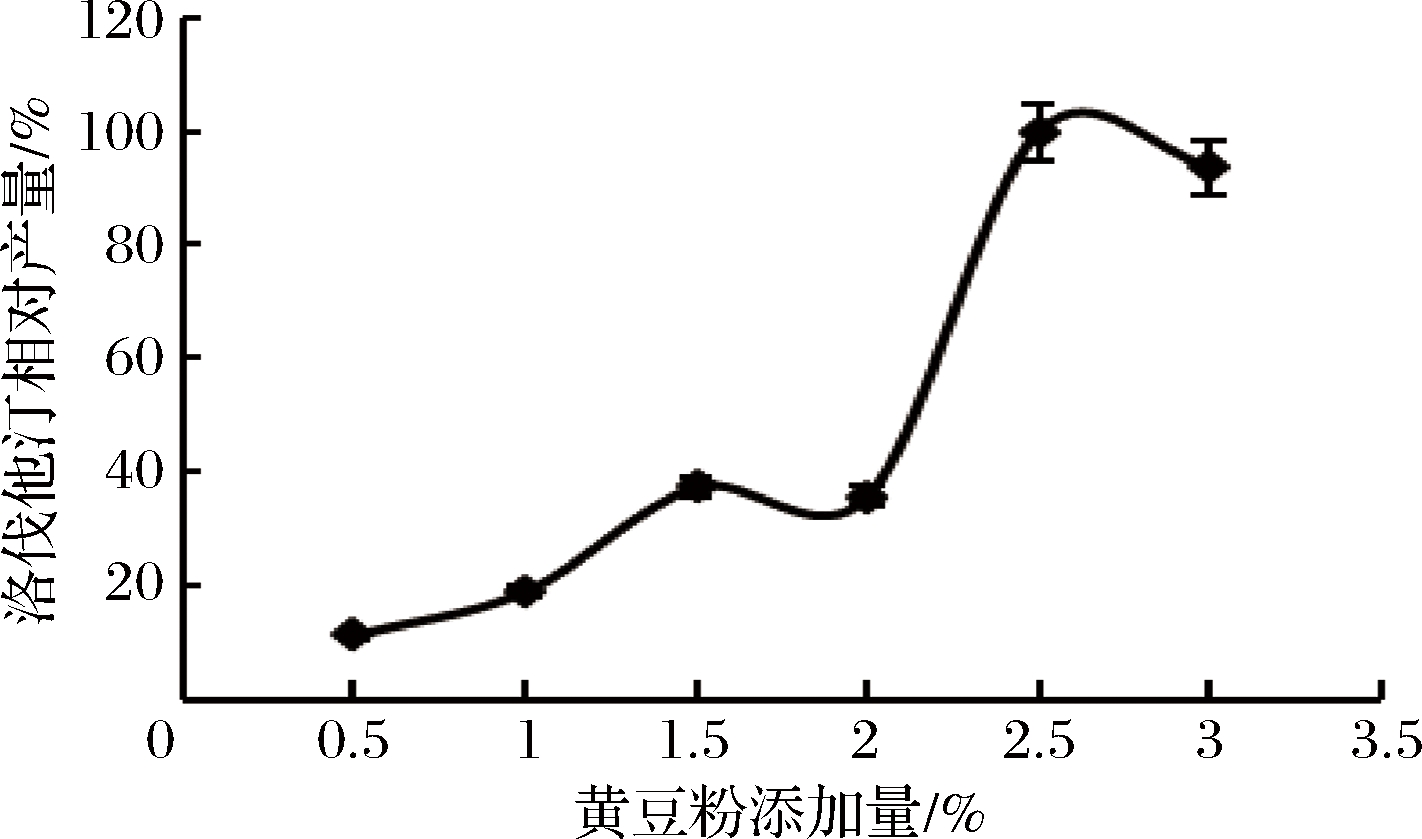
图9 黄豆粉添加量对洛伐他汀产量的影响
Fig.9 Effect of soybean powder content on lovastatin yield
2.2.1.3 无机盐对洛伐他汀产量的影响
无机盐对洛伐他汀产量的影响如图10所示,其中ZnSO4·7H2O最高(定义为100%),ZnSO4·7H2O和KH2PO4的洛伐他汀产量比较接近,所以选择KH2PO4和ZnSO4·7H2O两种无机盐进行后续实验。在后续实验中,无机盐添加量为两种无机盐添加量的总和,其中ZnSO4·7H2O和KH2PO4的添加量按照2∶1的配比来添加。不同无机盐添加量时洛伐他汀产量如图11所示,当添加量为0.05%时,洛伐他汀产量达到最高(定义为100%),可推测少量的无机盐可对洛伐他汀的产量造成显著影响,量太多反而抑制洛伐他汀的合成。确定最佳无机盐添加量为0.05%。
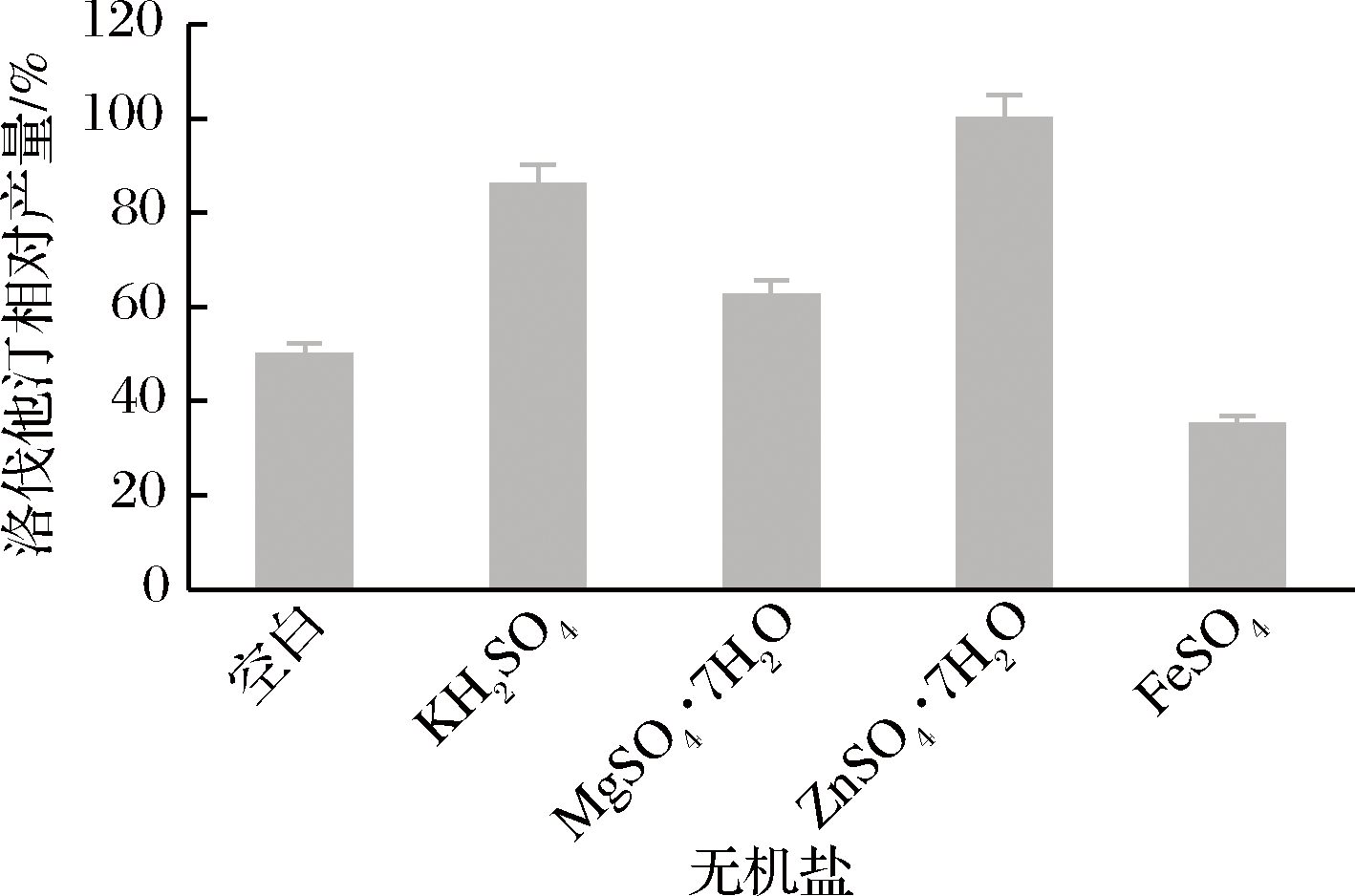
图10 无机盐对洛伐他汀产量的影响
Fig.10 Effect of inorganic salts on lovastatin yield
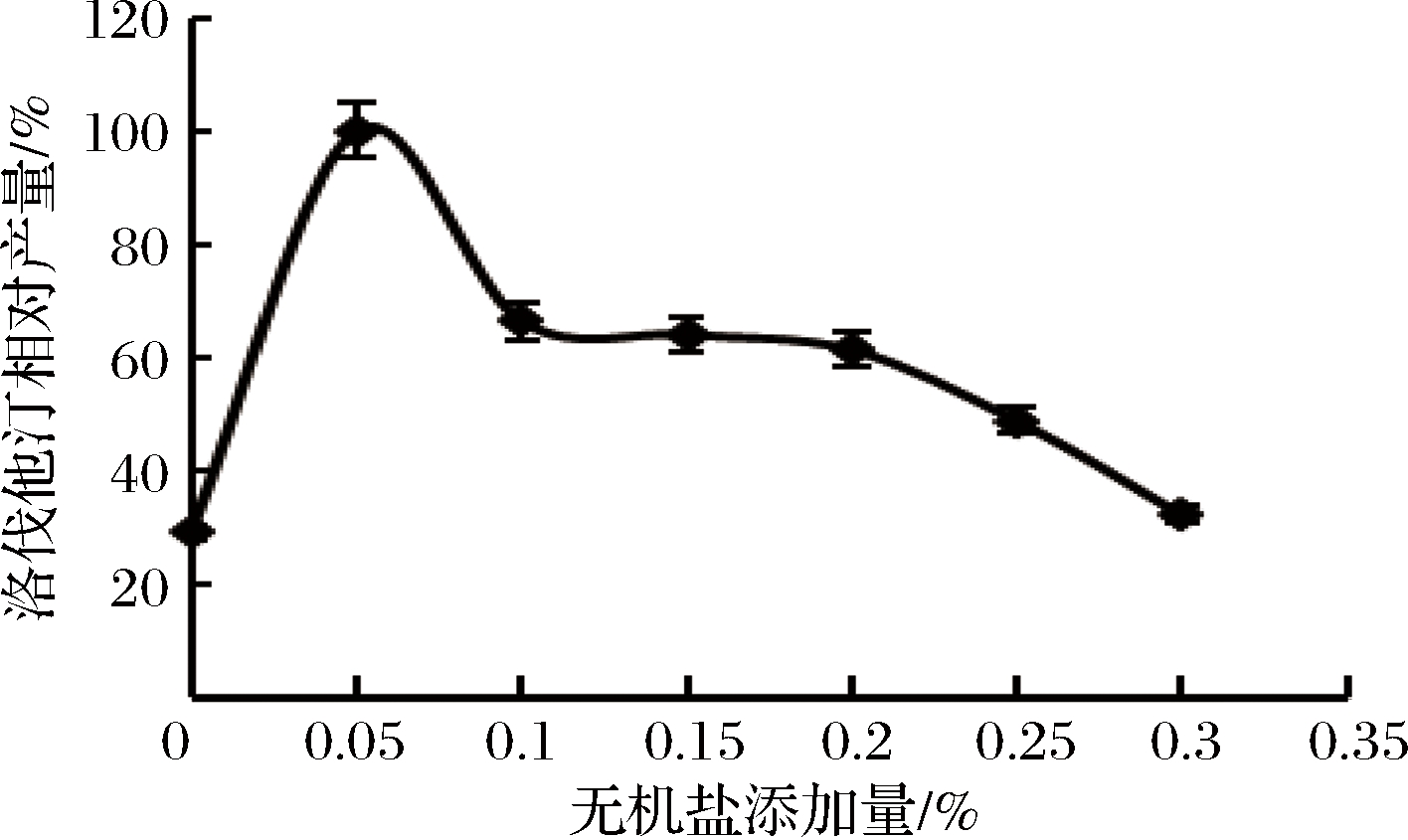
图11 无机盐添加量对洛伐他汀产量的影响
Fig.11 Effect of inorganic salt content on lovastatin yield
2.2.1.4 碳源、氮源、无机盐最佳配比的正交试验
选择甘油、黄豆粉、KH2PO4和ZnSO4·7H2O四个 因素进行L9(34)正交试验,实验结果见表2。
表2 L9(34)正交试验结果
Table 2 Results of L9(34) orthogonal expertments
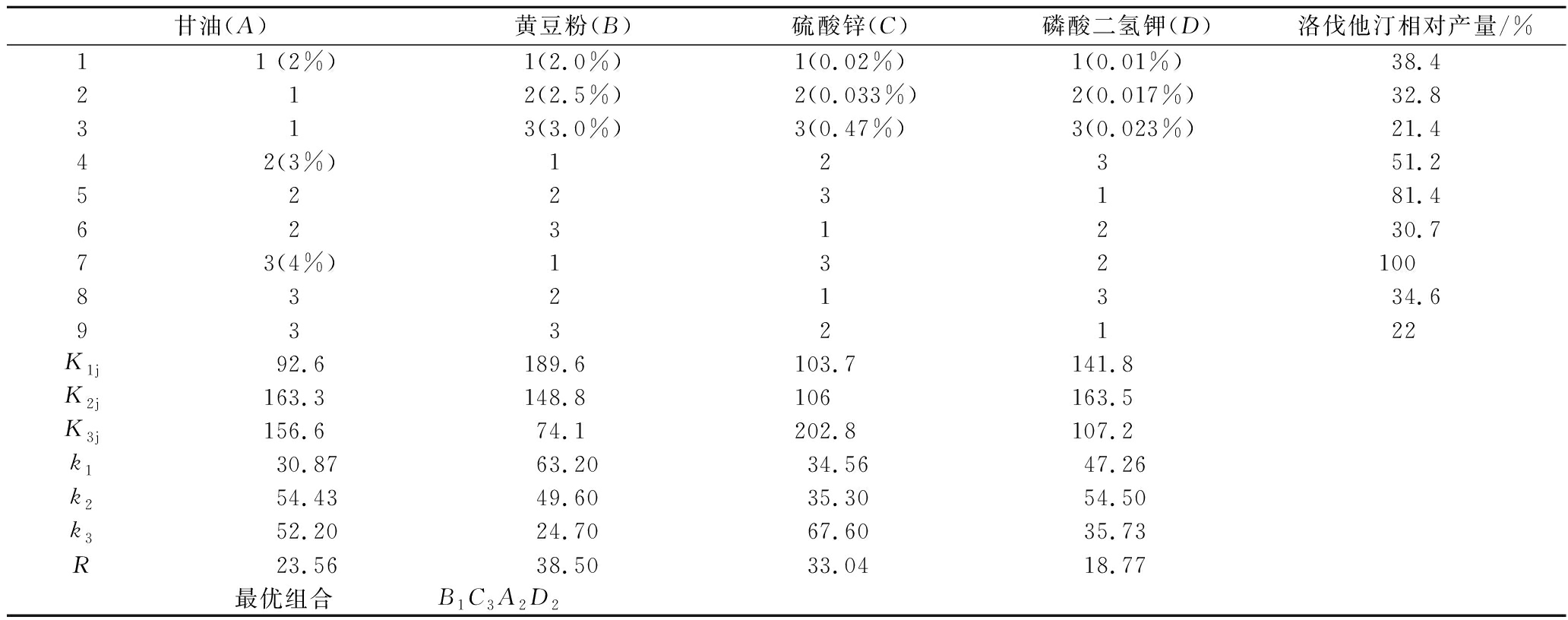
根据上表极差R可知,影响洛伐他汀产量的因素主次顺序为B>C>A>D,最优组合为B1C3A2D2,即甘油3%、黄豆粉2%、ZnSO4·7H2O 0.47%、KH2PO4 0.017%。
验证实验在最优组合中A、D因素添加量不变的基础上,降低因素B两个水平,升高因素C两个水平,得到4个实验组,再取最优组合B1C3A2D2和正交试验中产量最高的第7组(见表2)为参考组,组成6组组合进行验证实验。验证实验结果见表3。
表3 验证实验结果分析表 单位:%
Table 3 Analysis of test results
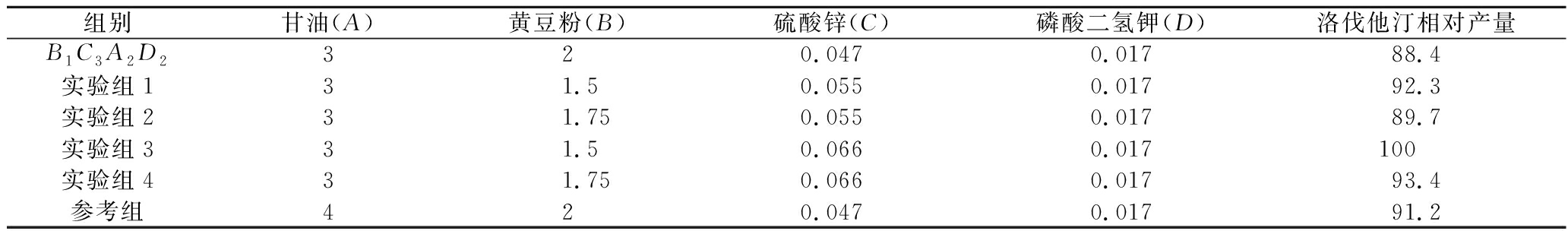
实验组3的洛伐他汀产量最高,但因硫酸镁对洛伐他汀合成也有一定的促进作用(见图10),故在实验组3的基础上添加不同量的硫酸镁,进一步研究其对洛伐他汀产量的影响。结果见图12。
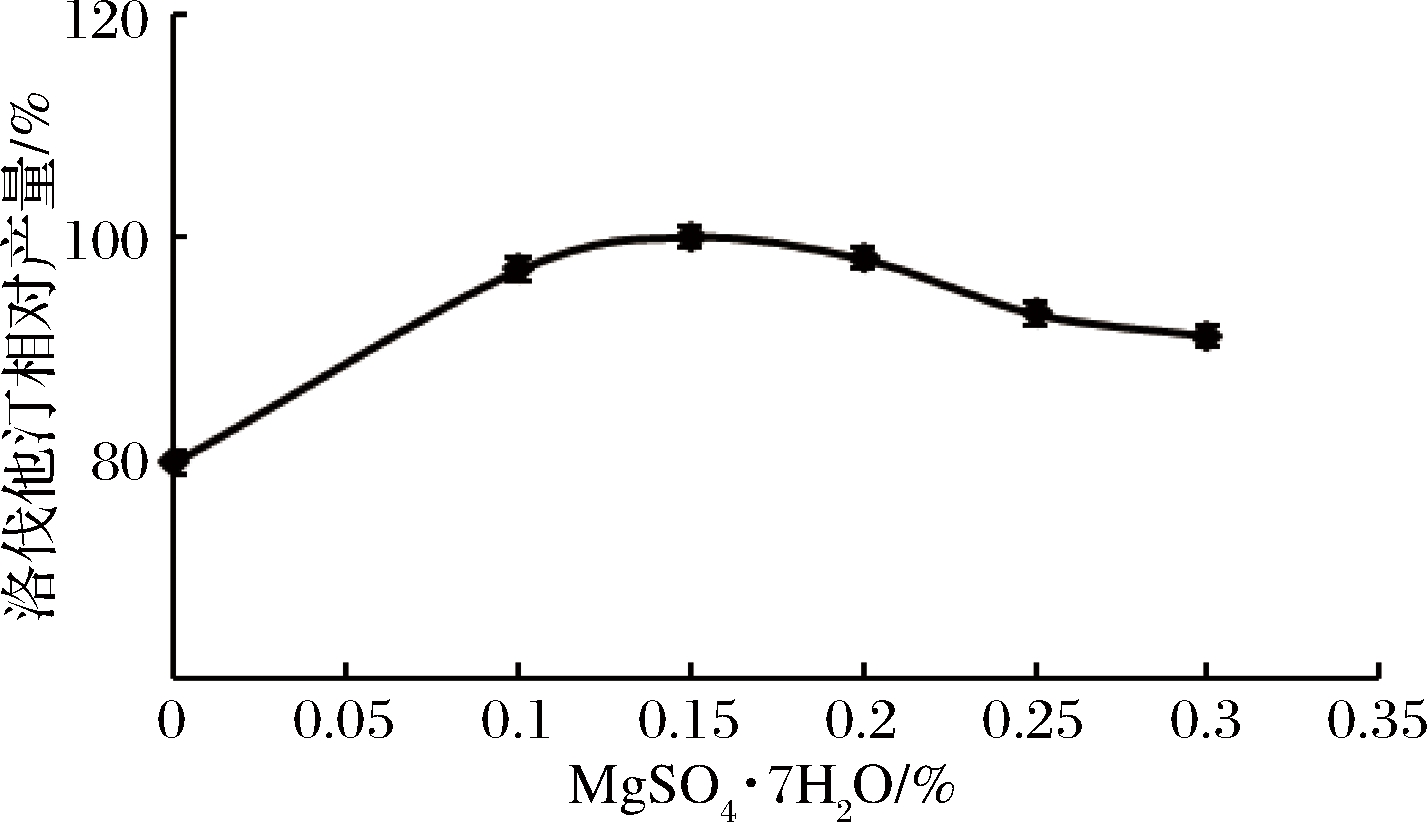
图12 硫酸镁添加量对洛伐他汀产量的影响
Fig.12 Effect of MgSO4·7H2O content on lovastatin yield
由图12可知,当MgSO4·7H2O添加量为0.15%时,洛伐他汀产量最高(定义为100%),所以确定红曲霉R”-30液态发酵最佳培养基配方为:甘油3%,黄豆粉1.5%,ZnSO4·7H2O 0.66%,KH2PO4 0.017%,MgSO4·7H2O 0.15%。
2.2.2 液态发酵条件优化
本实验对几个主要发酵条件进行了研究。实验结果(图13)表明,发酵液最佳初始pH为5,最适接种龄为64 h,最佳接种量为8%;恒温培养的效果优于变温培养,且发现30~35 ℃洛伐他汀产量相对较高,故选择30 ℃恒温培养的方式取代变温培养;最适转速为150 r/min,最佳装液量为50 mL/250 mL。
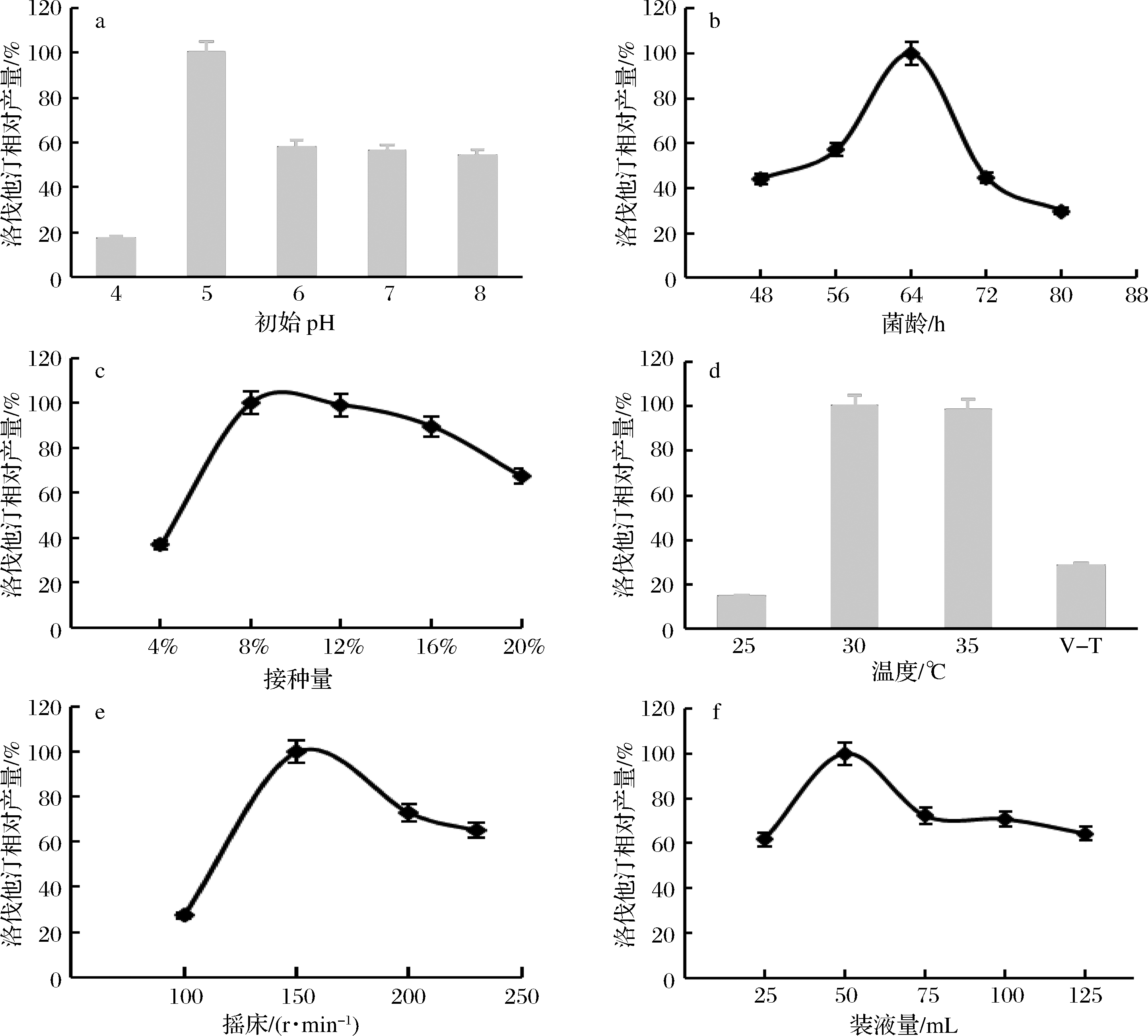
a-培养基初始pH值的影响; b-菌龄的影响; c-接种量的影响;d-温度的影响,V-T:变温; e-摇床转速的影响; f-装液量的影响
图13 摇瓶发酵条件的优化
Fig.13 Optimization of fermentation conditions in shake flask
2.3 红曲菌株R”-30液态发酵洛伐他汀产量测定
将菌株R”-30接种于优化后的发酵培养基中,在优化条件下培养,从第4天开始,每隔24 h取样测定发酵液中洛伐他汀产量,绘制洛伐他汀产量随发酵周期的变化曲线(图14)。
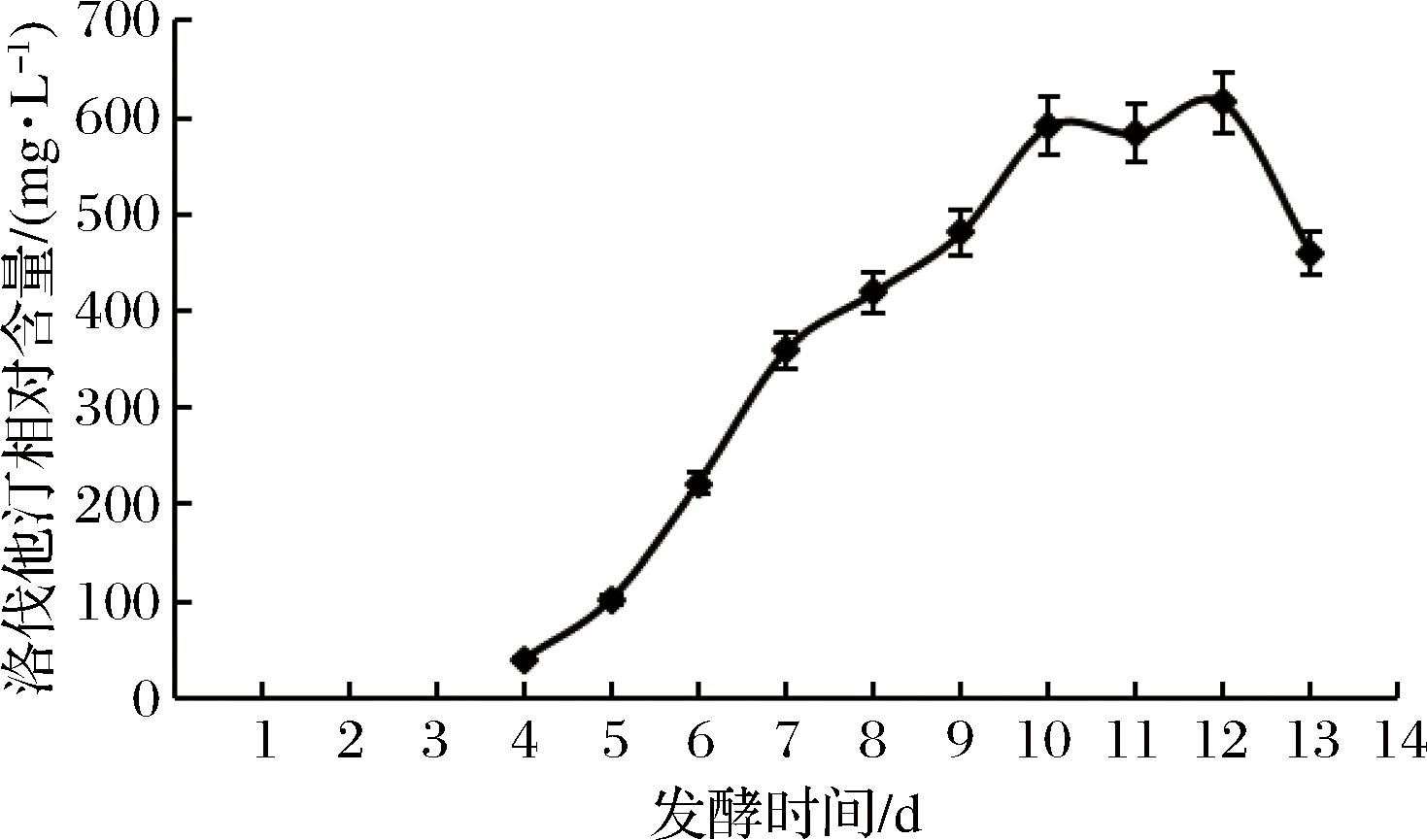
图14 菌株R”-30洛伐他汀产量与发酵周期的关系曲线
Fig.14 The relationship curve of R”-30 lovastatin production and fermentation period
洛伐他汀产量于第10天开始趋于平稳,第12天达到最大值,此时洛伐他汀产量达到615.3 mg/L;与优化前相比,洛伐他汀产量由312 mg/L提高到615.3 mg/L,提高了97.2%。发酵周期没有改变,还是于第12天达到最大值。
2.4 发酵液中洛伐他汀的分离纯化
2.4.1 洛伐他汀提取工艺优化
洛伐他汀在发酵液中以洛伐他汀羧酸的形式存在,主要存在于菌丝体内。以NaOH(6 mol/L)调节发酵液的pH至碱性,将洛伐他汀转化为洛伐他汀酸钠并溶于发酵液中[19]。测定不同pH(9~12.5)对洛伐他汀溶出率的影响,以加70%乙醇,料液比1∶9,55 ℃,130 r/min萃取1 h的溶出率作对照,结果如图15所示。
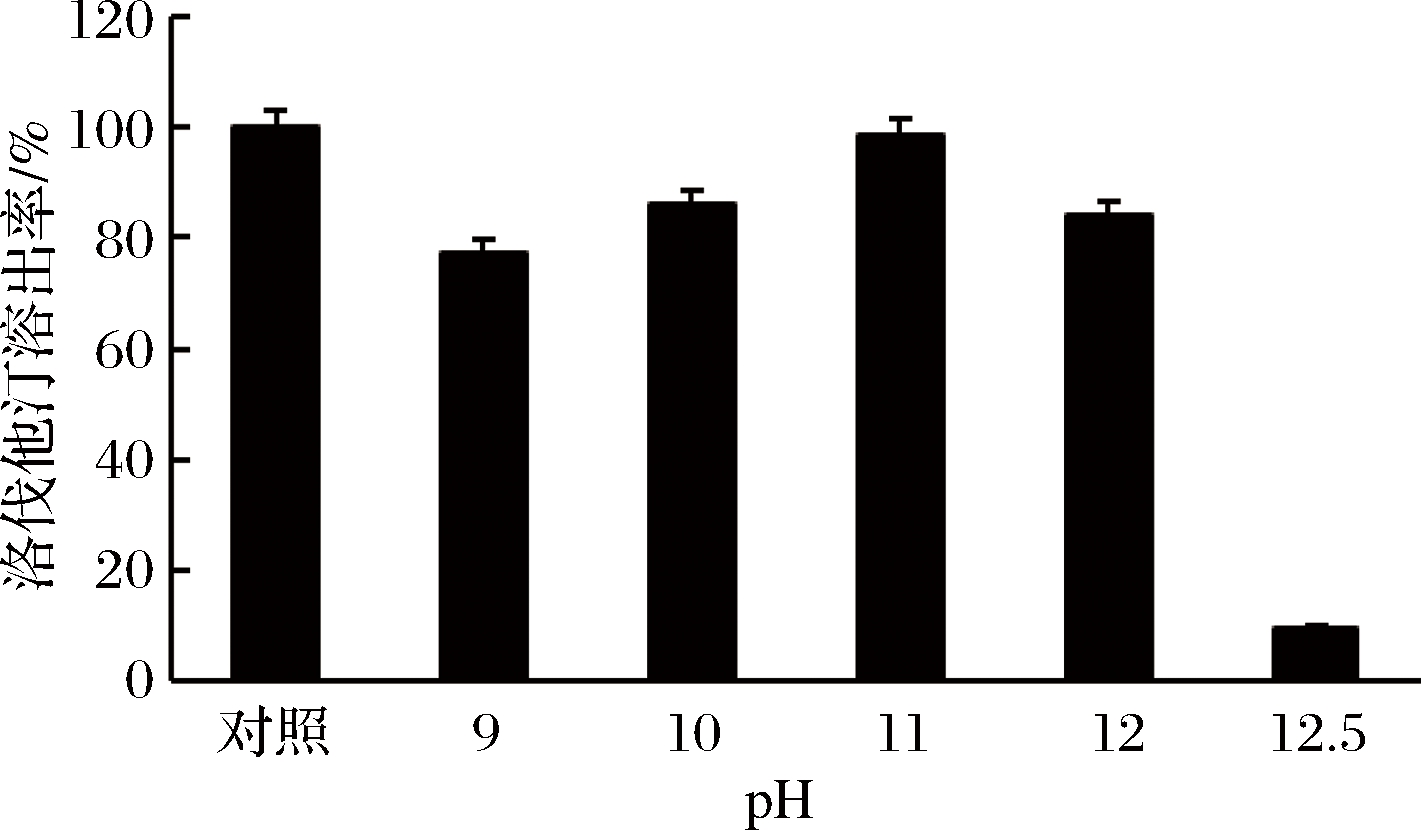
图15 不同pH下洛伐他汀的溶出率
Fig.15 The dissolved quantity of lovastatin at different pH
当调发酵液pH为11时,洛伐他汀的溶出率相对较高,而pH超过12.5时,溶出率急剧下降,可能是强碱条件破坏了洛伐他汀的结构,从而检测不出。故确定pH 11为最佳溶出pH。
2.4.2 硅胶柱洗脱
取适量硅胶(200目)用A溶剂浸泡后湿法装柱,柱子直径9 mm,装柱高度约12~13 cm。上样量0.5 mL,上样后先加14~15 mL A溶剂进行洗脱,再加20 mL B溶剂洗脱,最后加8 mL C溶剂洗脱,控制流速在1~2滴/s。收集各洗脱液,检测洛伐他汀主要分布在哪种溶剂及其纯度。
选择不同极性的有机溶剂,按极性从小到大列出3种洗脱方式,结果见表4。
表4 不同洗脱方式及结果
Table 4 Different elution methods and results

由上表可知方式2得到的洛伐他汀粗品纯度较高,故选择方式2作为硅胶柱层析的洗脱方式,收集B洗脱液浓缩。
2.4.3 LH20柱层析
取Sephadex LH20用60%乙醇浸泡后湿法装柱,柱子直径9 mm,装柱高度4~5 cm,取洛伐他汀粗品浓缩液0.5 mL上样。上样后,先加5 mL超纯水进行洗脱,再加5 mL 20%甲醇洗脱,最后加5 mL 50% 甲醇洗脱,控制流速在1~2滴/s。收集各个洗脱液,检测洛伐他汀在各个溶剂中的含量及其纯度,结果见表5。
表5 不同洗脱液中洛伐他汀含量及纯度
Table 5 Lovastatin content and purity in different elution liquid

洛伐他汀主要集中在20%甲醇洗脱液中,采用HPLC检测纯度,纯度达93%,色谱图见图16。收集5 mL 20%甲醇洗脱液,适当浓缩后得到纯化的洛伐他汀溶解液。
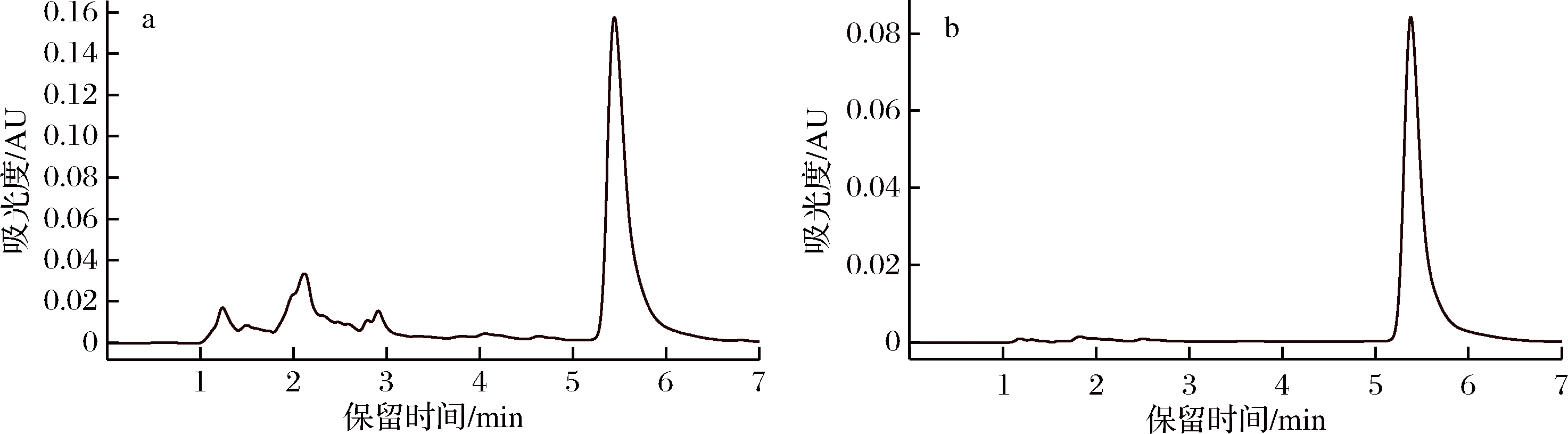
a-发酵液中洛伐他汀色谱图; b-分离纯化后洛伐他汀色谱图
图16 洛伐他汀HPLC图谱
Fig.16 HPLC chromatogram of lovastatin
实验结果表明,经LH20柱层析分离后,洛伐他汀纯度可达93%,得率45%;可见硅胶柱和LH20柱层析可有效去除杂质,获得高纯度的洛伐他汀。
3 结论
对红曲霉R”-30液态发酵产洛伐他汀的培养基组分和培养条件进行优化,得到最适培养基配方和发酵条件为:甘油30 g/L,黄豆粉15 g/L,ZnSO4·7H2O 6.6 g/L,KH2PO4 0.17 g/L,MgSO4·7H2O 1.5 g/L,pH 5.0,装液量50 mL/250 mL,摇床转速150 r/min,30 ℃恒温培养,种子液培养64 h,接种量8%(体积分数)。
对红曲霉R”-30液态发酵过程洛伐他汀产量进行测定,洛伐他汀产量于第12天达到最大值,为615.3 mg/L,比优化前(312 mg/L),提高了97.2%。红曲霉液态发酵所产的洛伐他汀主要为开环酸型。
对红曲霉R”-30液态发酵液中洛伐他汀进行分离纯化。发酵液先用6 mol/L NaOH溶液碱提,离心取上清;再通过硅胶柱和Sephadex LH20柱层析,经HPLC检测,洛伐他汀纯度达93%,得率为45%。
参考文献
[1] 张建文.福建代表性红曲米主要特性的研究及其标准制定[D].福州:福建农林大学,2011.
[2] PATTANAGUL P, PINTHONG R, PHIANMONGKHOL A, et al.Mevinolin citrinin and pigments of adlay angkak fer-mented by Monascus sp.[J].International Journal of Food Microbiology,2008,126(1):20-23.
[3] 李丽,张文学,罗芳,等.红曲药曲的制备工艺及药曲清酒的研究[J].食品工业科技, 2014, 35(18):194-198.
[4] 赵吉兴,李耀,李凯.红曲霉固体发酵生产酿造增香发酵剂的研究与应用[J]. 中国酿造, 2013, 32(3):114-117
[5] 沈士秀.红曲的研究、生产及应用[J].食品工业科技,2001,22(1):85-87.
[6] 王伟平,夏福宝,吴思方.红曲霉发酵法生产Monocline K研究进展[J].药物生物技术,2002,9(5):301-304.
[7] ENDO A,HASUMI K,NEGISHI s. et al, new inhibitors of cholesterol biosynthesis produced by Monascus ruber[J].Antibiotics,1985,38(3):420-422.
[8] ENDO A, HASUMI K, NAKAMURA T, et al. Dihydromonacolin L and monacolin X, new metabolites those inhibit cholesterol biosynthesis[J]. Antibiotics, 1985,38(3): 321-327.
[9] ENDO A.KOUAGATAD D, SHIUADA H. A new inhibitor of cholesterol biosynthesi[J].Antibiotics,1987,39(12):1 670-1 673.
[10] PANDA B P, JAVED S, ALI M. Optimization of fermentation parameters for higher lovastatin production in red mold rice through co-culture of Monascus purpureus and Monascus ruber[J]. Food and Bioprocess Technology, 2010, 3(3):373-378.
[11] 肖连冬,王志强. 降胆固醇红曲霉菌株的分离及其降解性能研究[J]. 中国酿造, 2015, 34(5):74-77.
[12] 徐美爱,林娟,李亮,等. 高产红色素及糖化酶红曲菌株的诱变选育[J]. 中国食品学报, 2015, 15(12):74-82.
[13] 文镜,顾晓玲. 双波长紫外分光光度法测定红曲中洛伐他汀(Lovastatin)的含量[J]. 中国食品添加剂, 2000(4):11-17.
[14] 朱华,许赣荣,陈蕴. HPLC法测定红曲中酸型与内酯型Monacolin K[J]. 食品与生物技术学报, 2003, 22(3):46-52.
[15] 李明起,陈运中,潘叶.柱层析分离纯化功能性红曲米中的有效成分[J].中国酿造, 2011, 30(5):41-45.
[16] 朱虎成.洛伐他汀发酵产物中杂质成分的分离与鉴定[D].重庆:西南大学, 2011.
[17] 周慧,曾品涛,郑一敏,等. 洛伐他汀原料药的萃取、纯化工艺研究[J]. 中国药房, 2012(9):816-818.
[18] ENDO A,NEGISHI Y,IWASHITA T,et al. Biosynthesis of compactin (ML-236B) and MonacolinK [J].The Journal of Antibitotics,1985,38(3):444-448.
[19] 卜光明,康宁.大孔吸附树脂法分离纯化洛伐他汀[J].沈阳药科大学学报,2008, 26(5):493-497.