伽师瓜是厚皮甜瓜(Cucumis melo)的代表性品种,主要产于中国西部地区,其形体匀称饱满、肉厚质细、香甜清脆、含糖量高、风味独特,居新疆甜瓜之首。但伽师瓜采后易发生后熟与软化,贮藏时间短,因此,延缓果实的后熟与软化,对伽师瓜长期贮藏、远运销售、保持良好的食用口感与商品性均有积极的作用。
伽师瓜属于呼吸跃变型果实,其特点为果实从生长停止到开始进入衰老期间,呼吸速率与乙烯释放量出现跃变现象,果实迅速后熟并软化[1]。软化过程中,原果胶水解为可溶性果胶,使果胶与纤维素和半纤维素的整体结构发生解聚而变松散,表现为果实变软和水化[2-3]。推迟或抑制呼吸跃变,减少乙烯释放量,是延缓果实衰老软化的有效措施。
1-氨基环丙烷基羧酸(ACC)氧化酶(ACO)催化ACC转化生成乙烯,是果实内源乙烯产生的主要途径,钙能够抑制ACC合成酶(ACS)活性,使含量处于低水平,同时能抑制ACC氧化酶(ACO)的活性,从而抑制内源乙烯的产生,用钙处理网纹甜瓜,能够降低果实呼吸强度和乙烯释放量[4]。同时,钙是细壁结构的必要物质,CHARDONNET[5]通过钙渗透“金冠”苹果皮质组织,能有效抑制细胞壁组分变化,维持果实的硬度。邓佳等[6]用钙处理葡萄柚果实,细胞壁降解酶活性变化及其相关基因表达量均有所降低,并能有效维持果实的硬度。乙烯对果实具有催熟作用,果实后熟过程又产生大量乙烯[7],1-甲基环丙烯(1-methylcyclopropene,1-MCP)是一种乙烯作用的抑制剂,能竞争性与乙烯受体结合,阻断乙烯信号传导,抑制乙烯的后熟作用[8]。郭子娟用1-MCP处理亚特猕猴桃,呼吸速率与乙烯释放量均显著降低[9]。马文平用1-MCP处理玉金香甜瓜,有效抑制了裂解细胞壁主要酶的活性,延缓了果实的软化[10]。目前,将钙与1-MCP联合使用对伽师瓜采后贮藏期间果实生理代谢方面的研究鲜有报道。因此,本文以甜瓜厚皮品种伽师瓜为材料,研究CaCl2与1-MCP对伽师瓜在贮藏过程中呼吸作用、乙烯释放量、果实硬度与质构特性、果胶水解酶(多聚半乳糖醛酸酶PG、果胶甲酯酶PME和果胶裂解酶PL)活性及酶基因表达量的影响,为延缓伽师瓜采后果实软化、提高其商品性提供参考依据。
1 材料与方法
1.1 实验材料
CaCl2(分析纯),购于天津市鼎盛鑫化工有限公司;1-甲基环丙烯,购于青岛绿诺生物科技有限公司;厚皮甜瓜伽师品种,由新疆大学生物工程研究中心提供。RNAprep Pure多糖多酚植物总RNA提取试剂盒(DP441),Quant One Step RT-PCR kit(KR113)反转录酶,lnRcute lncRNA cDNA第一链合成试剂盒(去基因组) (KR202),Talent荧光定量检测试剂盒(SYBR Green)FP209,天根生化科技(北京)有限公司。
1.2 仪器与设备
3051H型呼吸强度测定仪,杭州绿博仪器有限公司;AGY-1型果实硬度测量计,温州艾力仪器制造有限公司;TEX-100N质构仪,日本JISC公司;Trace GC 1300气相色谱仪,赛默飞世尔科技公司;Line Gene 9600 Plus荧光定量PCR仪,杭州博日科技有限公司。
1.3 方法
1.3.1 对伽师瓜果实进行CaCl2与1-MCP处理浓度筛选
选取达到商品成熟度、无外伤、重量、果型一致的果实,在果实采摘后8 h内完成以下处理:
CaCl2处理:分别用质量分数为0.5%、1%、2%、4%的CaCl2溶液浸泡5 min,通风室温晾干[11];
1-MCP处理:分别用0.25、0.5、1、2 μL/L的1-MCP在20 ℃下熏蒸24 h[12];
处理之后分别进行CaCl2与1-MCP最佳处理浓度筛选实验。
1.3.2 样本处理
选取成熟度、重量、大小、果型一致,没有统计学差异的无外伤果实400个作为样本池,对照组与3个处理组各从样本池中随机抽取100果实做实验样本,对照组不做处理,直接贮藏(样本处理与贮藏在果实采摘后8 h内完成);
CaCl2与1-MCP处理分别用筛选的最优浓度处理果实样本;
CaCl2与1-MCP联合处理:根据CaCl2与1-MCP处理浓度筛选结果,先用最优浓度CaCl2处理,再用最优浓度1-MCP处理,处理后单果套泡沫网袋后装入包装箱,10 个/箱;
对照组与处理组样本均置于温度(20±1) ℃,湿度(50±5)%的保鲜库中贮藏。
1.3.3 呼吸强度与乙烯释放量的测定
果实呼吸强度用气流法测定[13],每次取9个果实,分3组,每组3个果实,放入呼吸强度测定仪(气流速度0.4 L/min)进行测定,每组重复测3次,单位:CO2 mg/(kg·h)。
乙烯释放量的测定:参照LI等[14]的方法,用气相色谱仪进行测定,每次取9个果实,分3组,每组3个果实进行测定,每组重复测3次。
乙烯释放量![]()
(1)
式中:C,待测样品释放的乙烯含量,μL/L;V,干燥器的体积与待测样品体积之差值,mL;m,待测样品质量,kg;t,密闭时间,h。
1.3.4 果实硬度与果肉质构特性的测定
参照CAMPS与李明霞等[15-16]的方法,每次处理用9个果实,使用果实硬度计测定,重复3次,单位:kg/cm2。
果肉剪切形变时间与抵抗力的测定[17-18]:将果肉切为1.5 cm3正方形块状,置于测试夹具中,探头速率为100 mm/min,测试压缩程度设定为30 mm,触发值设定为0.049 N,每个处理用果实9个,在每个果实胴部不同部位对称均取4个位点果肉测定,重复3次。
1.3.5 原果胶与可溶性果胶含量测定
参照纪淑娟等[19]的方法,单位分别以每克鲜重中可溶性果胶和原果胶的毫克数表示,即mg/g FW。
1.3.6 果胶酶活性的测定
多聚半乳糖醛酸酶(polygalacturonase, PG)活性的测定:参照FIGUEROA与刘耀娜的方法[20-21]。以每分钟每克鲜样在37 ℃分解多聚半乳糖醛酸产生1 μmol的半乳糖醛酸的质量表示,即μg/(g·min)。
果胶甲酯酶(pectin methylesterase, PME)活性的测定[21-22]:用NaOH滴定法测定酶活性,以该条件下每分钟每克鲜样催化果胶释放1 mmol的CH3O-为一个酶活性单位,即mmolCH3O-/(g·min)。
果胶酸裂解酶(pectate lyase, PL)活性的测定:参考ANURAG等[23]的方法,以每克鲜质量每分钟在波长235 nm处吸光度值(OD235)的变化表示,即ΔOD235/(g·min)。
1.3.7 果实PG、PME和PL基因的定量表达分析[24-25]
果实总RNA提取:取100 mg果肉在液氮中迅速研磨成粉末,用RNAprep Pure多糖多酚植物总RNA提取试剂盒提取总RNA;
cDNA链合成:将提取的RNA用逆转录酶与反转录试剂盒合成cDNA第一链;
实时荧光定量PCR(quantitative Real- time PCR, qRT-PCR)分析:以Actin作为内参基因,用premier 5.0软件设计酶基因的qPCR引物如表1所示,以合成的cDNA,用荧光定量PCR仪与荧光定量检测试剂盒进行实时荧光定量PCR分析。
表1 实时定量PCR所需引物
Table 1 Primers for qRT-PCR analysis

1.4 数据处理
实验数据采用Excel统计和绘图,用SPSS 17.0软件系统进行方差分析,以P<0.05作为差异显著的标准。
2 结果与分析
2.1 对样本进行CaCl2与1-MCP处理浓度的筛选
2.1.1 不同浓度的CaCl2处理对伽师瓜贮藏过程中呼吸强度与乙烯释放量的影响
分别用0.5%、1%、2%、4%质量分数的CaCl2处理伽师瓜,如图1-A、图1-B所示。4个浓度CaCl2处理样本果实的呼吸强度与乙烯释放量均较对照组低(P<0.05),并且对照组呼吸强度与乙烯释放量有明显的跃变现象,均在第8天出现跃变峰,处理组也出现类似的跃变峰,但跃变幅度较小,且跃变时间有所延迟,0.5%、4%的CaCl2处理样本在第10天出现跃变峰,1%、2%的CaCl2处理样本在第12天出现跃变峰,其中,2%的CaCl2处理样本呼吸强度与乙烯释放量最低,跃变峰值也最小。此外,依次用0.5%、1%、2%的CaCl2处理样本对呼吸强度与乙烯释放量的抑制作用逐渐增强,而4%的CaCl2处理样本,则抑制作用减弱。因此,选择2%的CaCl2处理样本较为适宜。
2.1.2 不同浓度的1-MCP处理对伽师瓜贮藏过程中呼吸强度与乙烯释放量的影响
由图2-A、图2-B可知,4个浓度的1-MCP处理果实均有降低呼吸强度与乙烯释放量的作用,并且随浓度升高,抑制作用增强,但处理浓度超过1 μL/L后,则变化不显著。

图1 不同浓度CaCl2处理对伽师瓜采后贮藏过程中呼吸强度(A)与乙烯释放量(B)的变化影响
Fig.1 Effect ofCaCl2 treatment with different concentration on respiratory rate (A) and ethylene production (B) of Jiashi melon fruit during storage

图2 不同浓度1-MCP处理对伽师瓜采后贮藏过程中呼吸强度(A)与乙烯释放量(B)的变化影响
Fig.2 Effect of 1-MCP treatment with different concentration on respiratory rate (A) and ethylene production (B) of Jiashi melon fruit during storage
0.25与0.5 μL/L的1-MCP处理组分别在第12天与14天出现跃变峰,0.5 μL/L组较0.25 μL/L组呼吸强度与乙烯释放量低,且跃变峰值较小(P<0.05);1 μL/L处理组与2 μL/L处理组的呼吸强度与乙烯释放量均无显著差异(P>0.05),且没有出现跃变现象。因此,从节约使用成本与减少药害方面考虑,用1 μL/L的1-MCP处理样本较为适宜。
根据以上实验结果,后续实验的CaCl2使用2%(质量分数),1-MCP使用浓度为1 μL/L。
2.2 伽师瓜采后贮藏过程中呼吸强度与乙烯释放量的变化
由图3-A与图3-B可知,处理组样本呼吸强度与乙烯释放量较对照组低(P<0.05)。对照组果实呼吸强度与乙烯释放量有跃变现象,贮藏初期变化缓慢,在第6天至第8天,CO2由73.9 mg/(kg·h)迅速增至231 mg/(kg·h),乙烯释放量由10.9 μL/(kg·h)增至25.5 μL/(kg·h);在处理组中,CaCl2处理组在第12天出现类似跃变现象,但变化幅度较对照组小(P<0.05),1-MCP处理组较CaCl2组低,未出现跃变现象。CaCl2与1-MCP结合使用呼吸强度与乙烯释放量最低,变化较为平缓,且没有跃变现象。
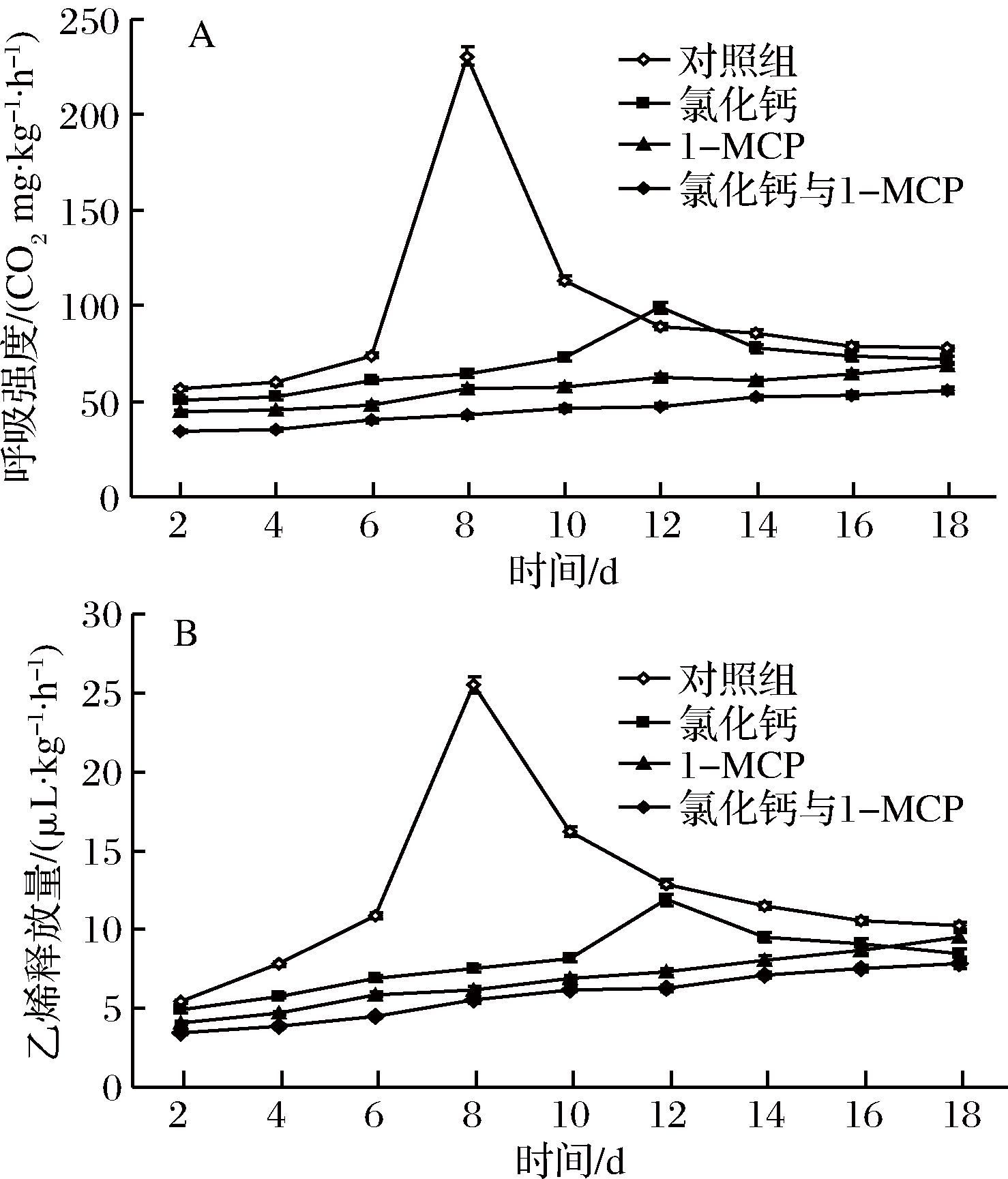
图3 CaCl2与1-MCP处理对伽师瓜采后贮藏过程中呼吸强度(A)与乙烯释放量(B)的变化影响
Fig.3 Effect of CaCl2 and 1-MCP treatment on respiratory rate (A) and ethylene production (B) of Jiashi melon fruit during storage
2.3 伽师瓜贮藏过程中果实硬度与果肉质构性能变化
2.3.1 果实硬度的变化
由图4所示,随着贮藏时间的延长,对照组与处理组果肉的硬度均不断下降。
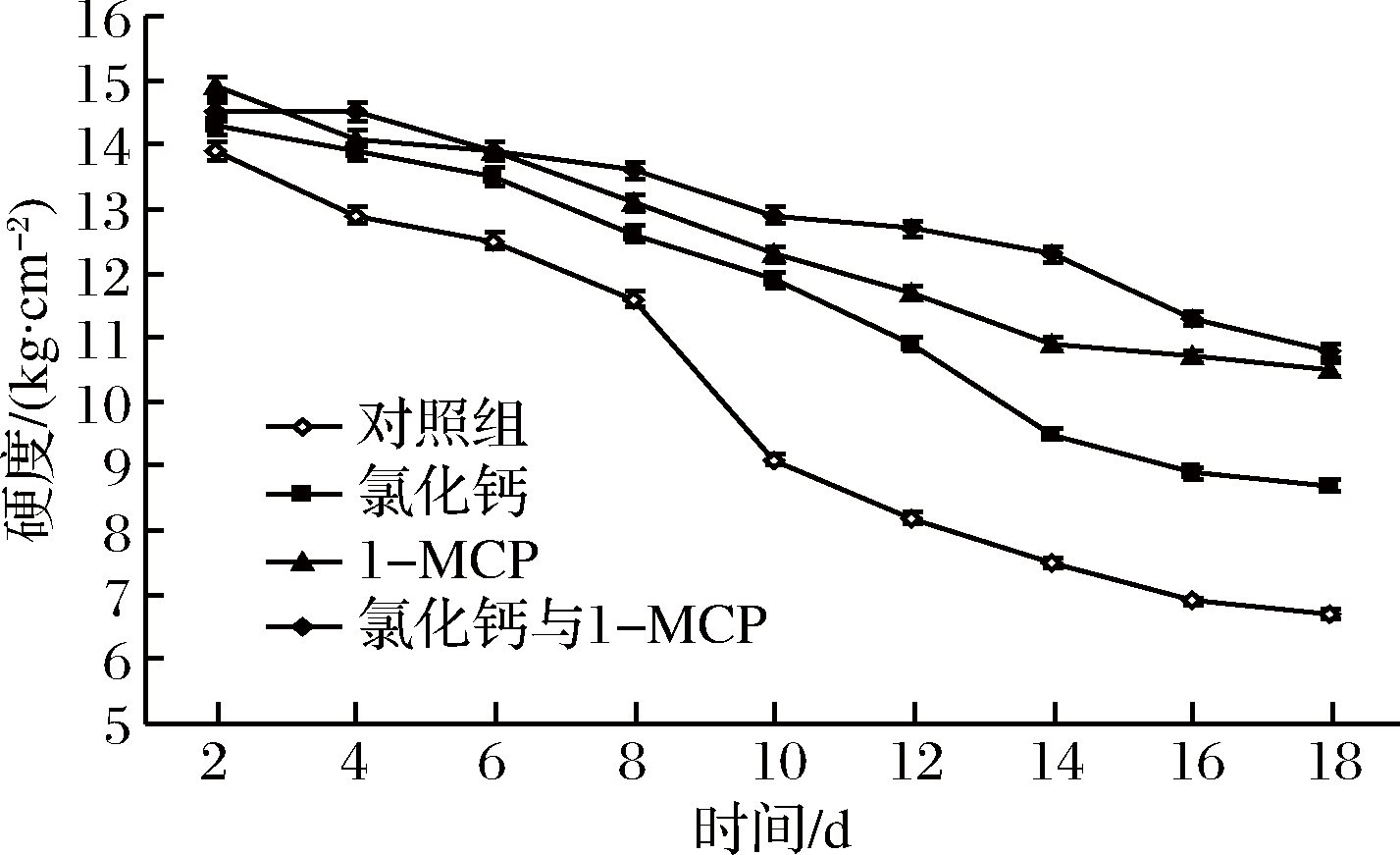
图4 CaCl2与1-MCP处理对伽师瓜采后贮藏过程中果实硬度变化影响
Fig.4 Effect of CaCl2 and 1-MCP treatment on firmness of Jiashi melon fruit during storage
对照组果肉硬度下降较处理组快(P<0.05),由第2天的13.9 kg/cm2下降至第18天的6.7 kg/cm2,并且在第8天至第10天呈加速下降,由11.6 kg/cm2下降至9.1 kg/cm2,之后下降速度缓慢。在处理组中,3种处理方式果肉硬度变化存在差异,CaCl2组下降速度最快,1-MCP组次之,CaCl2与1-MCP联合使用下降最慢(P<0.05),从第2天至第18天,CaCl2组果肉硬度由14.3 kg/cm2下降至8.7 kg/cm2,1-MCP组由14.9 kg/cm2下降至10.5 kg/cm2,CaCl2与1-MCP联合使用组由14.5 kg/cm2下降至10.8 kg/cm2。
2.3.2 伽师瓜贮藏过程中果肉剪切形变时间与抵抗力的测定
果肉质构是衡量伽师瓜食用价值与商品性的重要指标。甜瓜果肉质构特性常用最大抵抗力与剪切变形时间为参考[17],结果由表2可知,伽师瓜在贮藏过程中,随着保鲜时间的延长,对照组与处理组样本果肉的最大抵抗力均不断下降,果肉剪切形变发生时间也不断缩短。在贮藏第2天,对照组果肉最大抵抗力与剪切形变发生时间分别为139.6 N,21.3 s,第18天分别为67.4 N,2.3 s,下降速度显著高于处理组(P<0.05)。
表2 CaCl2与1-MCP处理对伽师瓜贮藏期间果肉剪切形变时间与抵抗力变化影响
Table 2 Effects of CaCl2 and 1-MCP treatment on shear deformation time and resistance of Jiashi Melon during storage
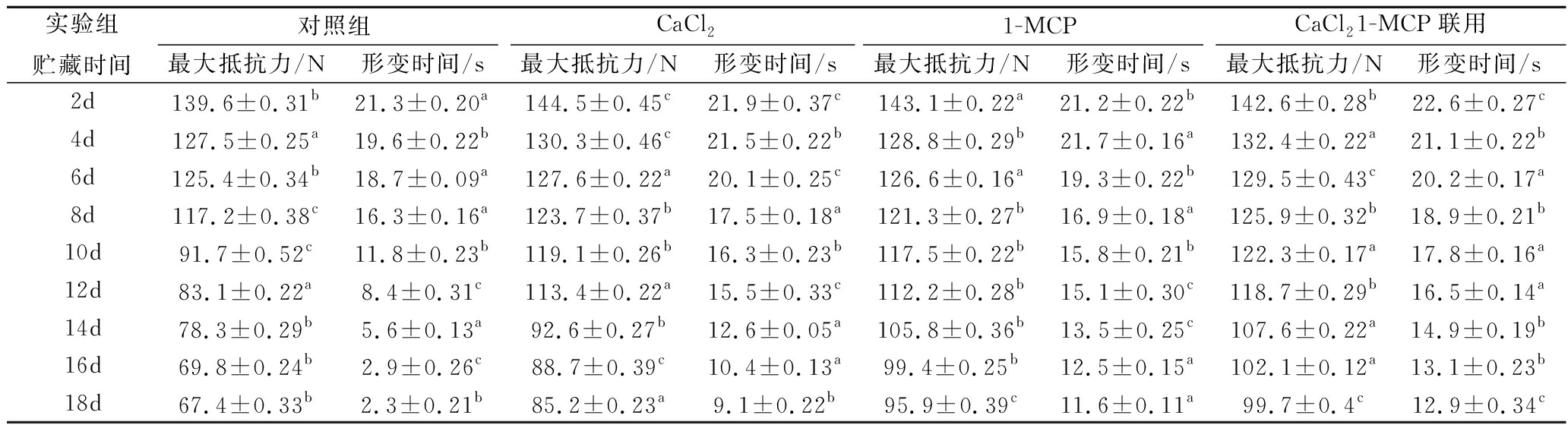
在前12天,CaCl2组样本果肉的最大抵抗力与剪切形变发生时间的下降速度较1-MCP组慢,之后CaCl2组较1-MCP组下降速度快(P<0.05),这是由于钙是乙烯抑制剂,也是构成细胞壁的元素,外源钙对维持果肉的质构特性有积极作用,但钙不能完全抑制跃变现象,因此,CaCl2组果实代谢发生跃变后质构性能加速下降。CaCl2与1-MCP联用组下降速度较单独处理实验组低,并且与对照组差异更为显著(P<0.05),在第18天时CaCl2组果肉最大抵抗力与剪切形变发生时间分别为85.2 N,9.1 s,相应的,1-MCP组分别为95.9 N,11.6 s,CaCl2与1-MCP 联用组分别为99.7 N,12.9 s。
2.4 伽师瓜贮藏过程中果胶含量变化
图5-A与图5-B显示,在贮藏过程中,对照组与处理组原果胶含量均不断下降,可溶性果胶含量则呈不断上升。

图5 CaCl2与1-MCP处理对伽师瓜贮藏过程中原果胶(A)与可溶性果胶(B)含量变化的影响
Fig.5 Effect of CaCl2 and 1-MCP treatment on propectin content (A) and soluble pectin content (B) of Jiashi melon fruit during storage
对照组原果胶含量由第2天的18.5 mg/g下降至第18天的7.7 mg/g,并在第6天至10天快速下降,可溶性果胶由第2天的5.2 mg/g上升至第18天的16.3 mg/g,第6天至10天快速上升,之后变化较为缓慢;处理组中,3种处理方法,原果胶含量下降速度与可溶性果胶含量上升速度均较对照组慢(P<0.05), 其中CaCl2组与1-MCP组变化差异较小,且均有小幅波动。CaCl2与1-MCP联合使用,原果胶含量与可溶性果胶含量变化最缓慢,从第2天至第18天,原果胶含量由19.9 mg/g下降至13.6 mg/g,可溶性果胶由4.1 mg/g上升至8.5 mg/g,并且变化较稳定。
2.5 果胶水解酶活性及相关酶基因表达量的变化
2.5.1 PG酶活性与酶基因表达量的变化
由图6-A与图6-B可知,在贮藏过程中,对照组样本PG活性与酶基因表达量均较处理组高(P<0.05),且对照组酶活性与酶基因表达量均存跃变现象。
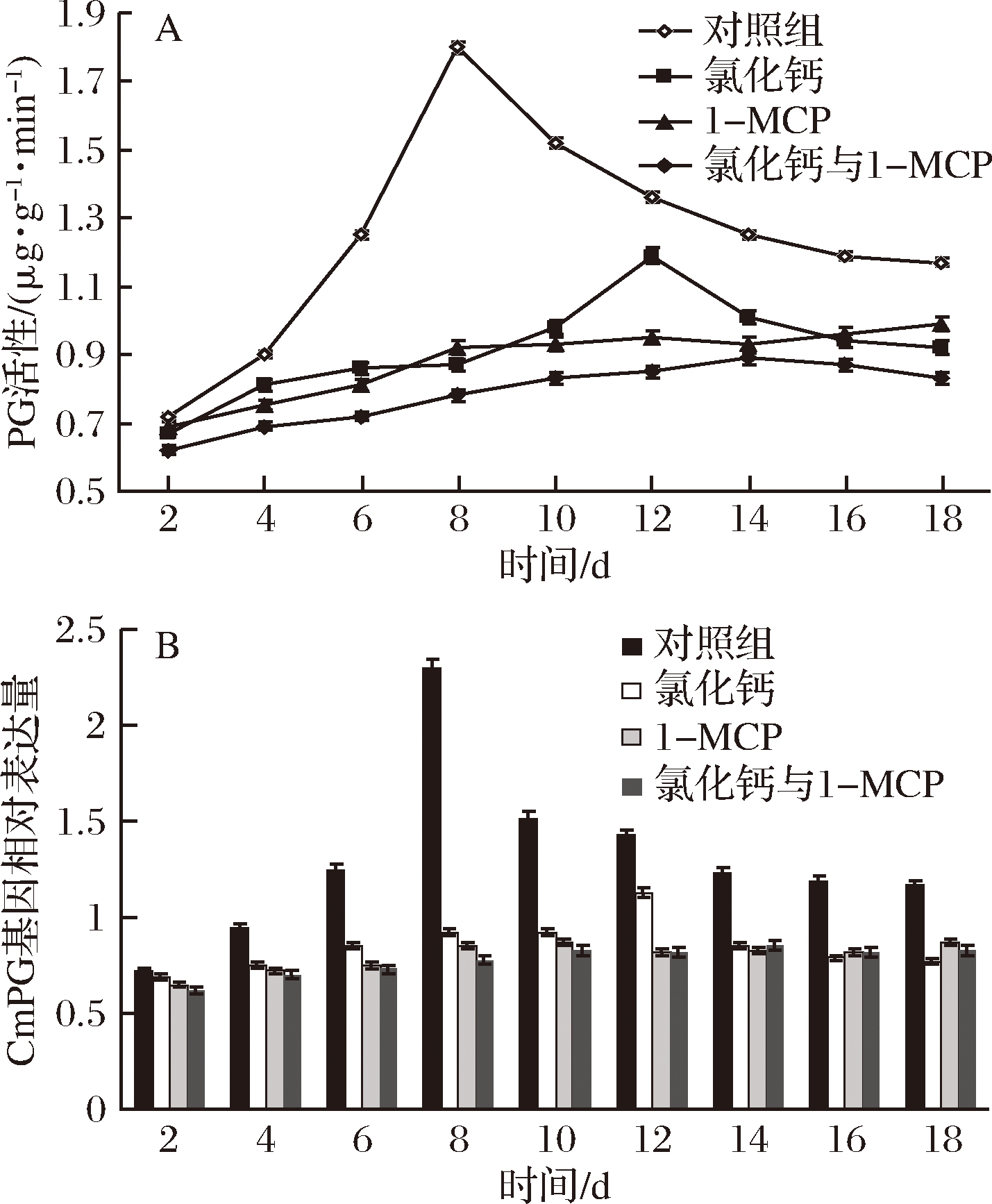
图6 CaCl2与1-MCP处理对伽师瓜贮藏过程中PG酶活性(A)PG酶基因表达量(B)变化的影响
Fig.6 Effect of CaCl2 and 1-MCP treatment on enzyme activity of PG (A) and CmPG gene expression (B) of Jiashi melon fruit during storage
在处理组中,CaCl2组在贮藏第12天出现小幅度的跃变峰,其他处理方式未出现跃变现象,此外,对照组与处理组样本酶活性与酶基因表达量增减均表现出同步性。
2.5.2 PME酶活性与酶基因表达量的变化
由图7-A与图7-B可知,在贮藏初始期,对照组与处理组PME活性无显著差异(P>0.05),随后对照组PME活性出现跃变现象,在第6天达到峰值,之后迅速下降,在第12 天至14 天时下降至处理组水平,在第16天至18天,低于处理组;在处理组中,3种处理方法样本PME活性变化均较对照组缓慢(P<0.05),且均呈不断下降趋势,整体上看,3种处理方法之间PME活性没有显著差异,但变化过程中,CaCl2组变化波动较大,1-MCP组次之,CaCl2与1-MCP 联合使用下降最为平缓。

图7 CaCl2与1-MCP处理对伽师瓜贮藏过程中PME酶活性(A)PME酶基因表达量(B)变化的影响
Fig.7 Effect of CaCl2 and 1-MCP treatment on enzyme activity of PME (A) and CmPME gene expression (B) of Jiashi melon fruit during storage
2.5.3 PL酶活性与酶基因表达量的变化
如图8-A与图8-B所示,在初始期,对照组PL活性与酶基因表达水平均高于处理组,并存在跃变情况,在第8天达到峰值,从第14天开始,低于处理组;处理组PL活性与酶基因表达水平变化较对照组缓慢,CaCl2组在贮藏初期至中期高于1-MCP组和联合处理组,贮藏后期,则差异不显著,1-MCP组和联合处理组之间差异不显著(P>0.05)。
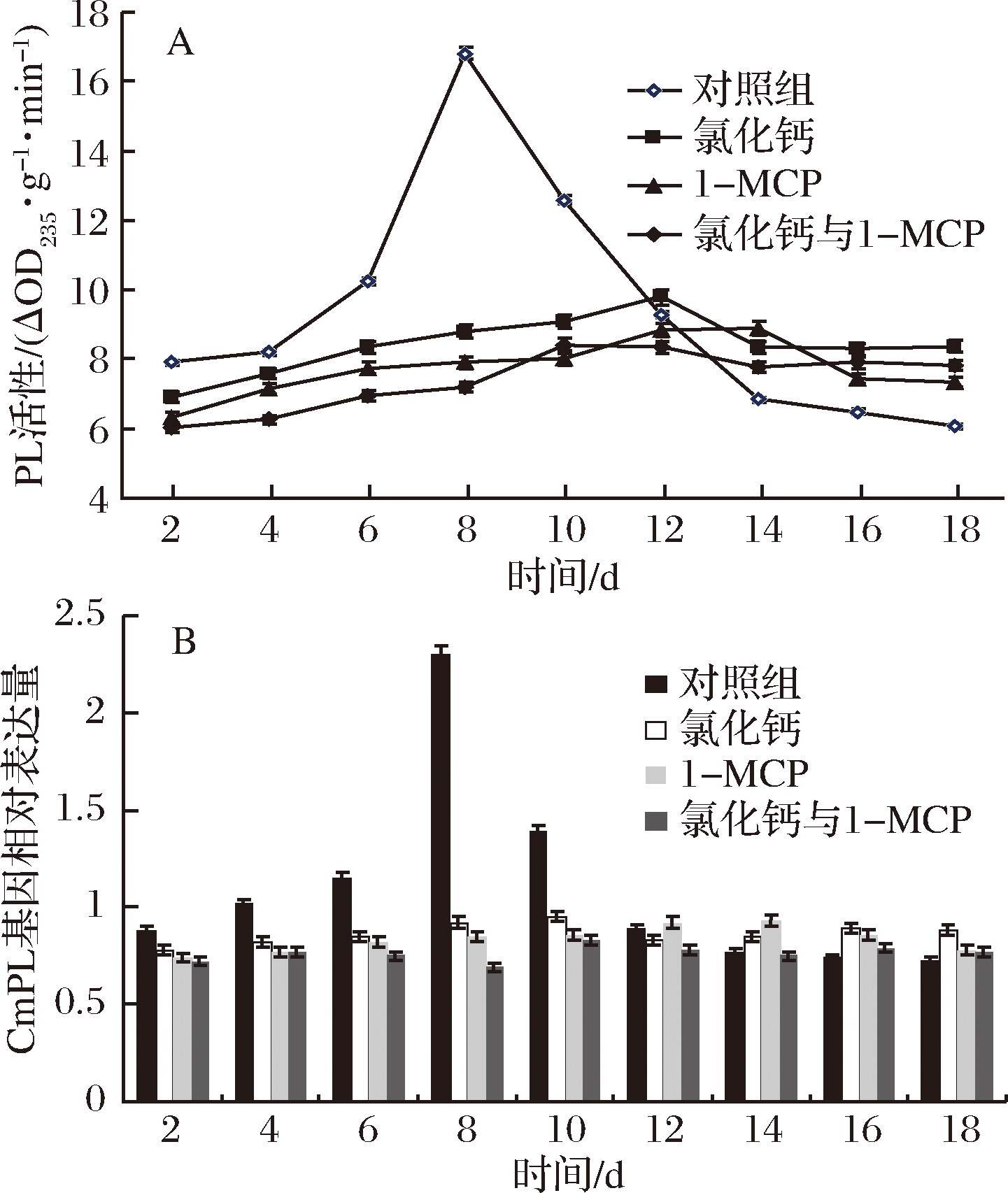
图8 CaCl2与1-MCP处理对伽师瓜贮藏过程中PL酶活性(A)PL酶基因表达量(B)变化的影响
Fig.8 Effect of CaCl2 and 1-MCP treatment on enzyme activity of PL (A) and CmPL gene expression (B) of Jiashi melon fruit during storage
3 讨论
乙烯是果实后熟软化的诱导因素,乙烯能促使呼吸代谢强度增加,上调果胶酶基因的表达,产生果胶水解酶,使原果胶水解导致细胞壁结构改变,表现为果实发生后熟与软化[26]。本实验结果显示,对照组与处理组样本的呼吸强度、果胶酶活性及酶基因表达水平均与乙烯释放量呈正向协同效应。
钙是构成细胞壁的重要元素,有拮抗乙烯催熟与抑制细胞壁物质水解酶活性的作用,能够延缓果实软化[27]。用不同浓度的CaCl2处理样本,果实的呼吸强度、乙烯释放量均有所降低,并且跃变期有所推迟,跃变峰值也显著降低。增加外源钙,有助于抑制果实的后熟、维持细胞壁结构的稳定,李天来等[28]用硝酸钙处理网纹甜瓜,结果显示,5 mmol /L的硝酸钙较1、3 mmol/ L的硝酸钙对乙烯释放量与呼吸强度有更强的抑制作用。钙具备抑制后熟与维持细胞壁结构稳定作用的同时,也是细胞信号重要的传导物质,过多的增加钙又会促进果实后熟生理代谢中信号的传导,本研究结果显示,用2%的CaCl2处理伽师瓜,较0.5%与1%处理浓度对果实后熟的抑制作用强,但用4%的CaCl2处理果实,对后熟的抑制作用反而减弱。1-MCP能够阻断乙烯与受体的正常结合,从而抑制乙烯的催熟作用,并能减少由后熟所导致的乙烯进一步释放。在本实验中,用0.25、0.5、1、2 μL/L的1-MCP处理样本均能降低果实呼吸强度与乙烯释放量,其中用1、2 μL/L的1-MCP处理样本,果实没有出现跃变现象,马文平等[10]用1-MCP处理甜瓜也得到类似结果。但用1、2 μL/L的1-MCP处理样本,果实呼吸强度与乙烯释放量均无显著差异,由此可知,1-MCP对乙烯受体的竞争结合存在饱和性,超过饱和值,并不能进一步增强抑制作用。将CaCl2与1-MCP联合使用,即钙能拮抗乙烯的催熟作用,1-MCP能够阻断残留乙烯的信号传导,使两种抑制后熟的作用机制形成互补。在本实验中,用2%的CaCl2与1 μL/L的1-MCP 联合处理样本,对果实呼吸作用与乙烯释放的抑制作用较单独使用时更强,且更稳定。
原果胶水解成为可溶性果胶,是果实发生软化的重要因素[29]。刘耀娜等[21]对厚皮甜瓜果实后熟软化研究显示,甜瓜果实在软化过程中,原果胶含量不断降低,可溶性果胶含量逐渐上升,而纤维素含量则变化较小[30]。本文参考前人研究,选择果胶为切入点,对果胶含量变化、果胶酶活性与酶基因表达量进行检测。结果显示,在贮藏过程中,对照组与处理组中原果胶含量均逐渐降低,而可溶性果胶含量则均不断上升。在本研究中,对照组果实硬度在第6天至第8天快速下降,这一时期原果胶水解产生可溶性果胶的速度也较快,与WEI等[31]的研究结果类似。
对照组中,PG、PME、PL活性与酶基因表达量均有跃变现象,PG、PL在贮藏第8天出现峰值,且与呼吸强度与乙烯释放量的峰值时间一致,PME峰值出现在第6天,BRUMMELL认为贮藏前期PME首先启动果胶降解,为其他降解酶如PG等提供底物[32],这可能是PME活性与酶基因表达量峰值出现较早的原因。对照组PG活性与酶基因表达水平始终高于处理组,而PME和PL则分别在在第14天与第16天后低于处理组。在处理组中,CaCl2组PG活性与酶基因表达量存在小幅度的跃变情况,在第12天出现峰值,1-MCP与联合处理组没有出现跃变现象。结合样本果胶含量与硬度变化分析可知,酶活性与酶基因表达量发生跃变对原果胶水解与果实硬度下降起至关重要的作用,平稳缓慢的变化则影响较小。
此外,在贮藏初始期,对照组果胶酶活性及其酶基因表达量均高于处理组,说明在用CaCl2与1-MCP处理样本的过程中已对果实的后熟生理代谢产生了影响。
4 结论
CaCl2与1-MCP均能降低伽师瓜贮藏过程中呼吸强度、乙烯释放量,并能有效抑制跃变现象,推迟甜瓜的后熟,同时能够使果胶水解酶活性及酶基因表达量降低,延缓果实的软化;将2%的CaCl2与1 μL/L的1-MCP联合使用,对果实后熟的抑制作用较单独使用时更强,且更稳定,能更好地延缓果实软化。
参考文献
[1] 王玉红,白羽嘉,李梦,等.采后不同果肉类型甜瓜软化相关指标的变化[J].食品科技,2018,43(3):48-54.
[2] 王中凤.细胞壁分解酶与果实软化的关系研究进展[J].中国农学通报,2009,25(18):126-130.
[3] ALI Z M, CHIN L H, LAZAN H.Comparative study on wall degrading enzymes pectin modifications and softening during ripening of selected tropical fruits[J].Plant Science,2004,167(2):317-327.
[4] 李天来,吕双双,许传强,等.钙在乙烯促进网纹甜瓜果实软化过程中的作用[J].园艺学报,2009,36(6):821-828.
[5] CHARDONNET C O,CHARRON C S,SAMS C E,et al.Chemical changes in the cortical tissue and cell walls of calcium-infiltrated ‘Golden Deliciuous’ apples during storage[J].Postharvest Biology and Technology,2003,28(1):97-111.
[6] 邓佳,史正军,王连春,等.钙处理对葡萄柚果实细胞壁物质代谢及其相关基因表达的影响[J].植物营养与肥料学报,2016,22(2):450-458.
[7] 王建军,周雅涵,曾凯芳.乙烯催熟对采后果实贮藏品质的影响[J].食品工业科技,2012,33(21):361-364.
[8] TADIELLO A, ZIOSI V, NEGRI A S,et al.On the role of ethylene, auxin and a GOLVEN-like peptide hormone in the regulation of peach ripening[J].BMC Plant Biology,2016,16(1):44.
[9] 郭子娟,曾凤,李雯.外源乙烯对“橡皮化”番木瓜果实品质及软化的影响[J].热带生物学报,2016,7(2):215-219.
[10] 马文平,倪志婧,任贤,等.1-MCP对“玉金香”甜瓜采后果实软化的作用机理[J].西北农林科技大学学报(自然科学版).2012,40(2):103-108.
[11] 吕双双,李天来,吴志刚,等.采前喷钙和采后浸钙对网纹甜瓜采后果实软化生理的影响[J].江苏农业学报,2009,25(2):346-350.
[12] 李江阔,曹森,张鹏,等.1-MCP采前处理对葡萄采后相关酶活性与品质的影响[J].食品科学,2014,35(22):270-275.
[13] 齐秀东,魏建梅.冷藏和乙烯处理对采后苹果果实糖代谢及关键基因表达的调控[J].现代食品科技,2015,31(7):137-145.
[14] LI X, BI Y, WANG J J,et al.BTH treatment caused physiological, biochemical and proteomic changes of muskmelon (Cucumis melo L.) fruit during ripening[J].Journal of Proteomics,2015,120:179-193.
[15] CAMPS C, GUILLERMIN P, MAUGET J C,et al.Data analysis of penetrometric force/displacement curves for the characterization of whole apple fruits[J].Journal of Texture Studies,2005,36(4):387-401.
[16] 李明霞,韩建群,王琦,等.低强度微波处理对猕猴桃细胞壁降解酶活性的影响[J].食品与发酵工业,2015,41(11):52-58.
[17] 刘莉,高星,华德平,等.不同的质构检测方法对甜瓜果肉质构的评价[J].天津大学学报(自然科学与工程技术版),2016,49(8): 875-881
[18] 袁成龙,董晓颖,李培环,等.TPA质构分析硬肉桃果实采后质地变化[J].食品科学,2013,34(20):273-276
[19] 纪淑娟,卜凤雅,周倩,等.冷藏对蓝莓果实细胞壁组分及其降解酶活性的影响[J].食品与发酵工业,2014,40(6):199-204.
[20] FIGUEROA C R, HERN N G, ROSLI CIVELLO P M,et al.Changes in cell wall polysaccharides and cell wall degrading enzymes during ripening of Fragaria chiloensis and Fragaria xananassa fruits[J].Scientia Horticulturae,2010,124(4):454-462.
N G, ROSLI CIVELLO P M,et al.Changes in cell wall polysaccharides and cell wall degrading enzymes during ripening of Fragaria chiloensis and Fragaria xananassa fruits[J].Scientia Horticulturae,2010,124(4):454-462.
[21] 刘耀娜,王毅,毕阳, 等. 采前乙酰水杨酸处理对厚皮甜瓜果实后熟及软化的影响[J].中国农业科学, 2017,50(10): 1 862-1 872.
[22] LYNGUYEN B, VANLOEY A M, FACHIN D,et al.Partial purification, characterization, and thermal and high-pressure inactivation of pectin methylesterase from carrots (Daucus carrota L.)[J].Journal of Agricultural & Food Chemistry,2002,50(19):37-44,54.
[23] 李圆圆,罗安伟,李琳,等.采前CPPU处理对秦美猕猴桃贮藏期间果实硬度及细胞壁降解的影响[J].食品科学,2017,22(11):1-9.
[24] PAYASI A,MISRA P C,SANWAL G G,et al.Effect of phytohormones on pectate lyase activity in ripening Musa acuminata[J].Plant Physiology and Biochemistry,2004,42(11):861-865.
[25] HAN Y,ZHU Q G,ZHANG Z K,et al.Analysis of Xyloglucan Endotransglycosyl-ase/Hydrolase(XTH) genes and diverse roles of isoenzymes during persimmon fruit development and postharvest softening[J].PLoS One,2015,10(4):e0123 668.
[26] 易美君,孔静,许昕,等.低温贮藏期间‘长富 2’果实细胞壁酶及基因表达的变化[J].食品与发酵工业,2017,43(3):254-258.
[27] 袁沙,李华佳,朱永清,等.‘红阳’猕猴桃乙烯催熟特性[J].食品科学,2018,39(9):244-251.
[28] ORTIZ A, GRAELL J,LARA I,et al.PREHARVEST calcium applications inhibit some cell wall-modifying enzyme activities and delay cell wall disassembly at commercial harvest of ‘Fuji Kiku-8’apples[J].Postharvest Biology and Technology,2011,62(2):161-167.
[29] 李天来,吕双双,吴志刚,等.硝酸钙对网纹甜瓜果实软化及其相关生理因素的影响[J].沈阳农业大学学报,2009,40(4):387-391.
[30] SUNNY G G,SANDY V B,VERLINDEN B E,et al.Pectin modifications and the role of pectin-degrading enzymes during postharvest softening of Jonagold apples.Food Chemistry,2014,158:283-291.
[31] WEI J M,MA F W,W SHI S G,et al.Changes and the postharvest regulation in the activity and gene expression of enzymes related to cell wall degradation in ripening apple fruit[J].Postharvest Biology and Technology,2010,56(2):147-154.
[32] BRUMMELL D A,CIN V D,CRISOSTO C H,et al.Cell wall metabolism during maturation, ripening and senescence of peach fruit[J].Journal of Experimental Botany,2004,55(405):2 029-2 039.