酵子作为一种复合菌种发酵剂,大量用于面包和馒头等的发酵[1]。随着酵子的感官和营养质量的改善,工业烘烤和馒头生产中酵子的使用越来越受到重视。酵子中微生物的种类和数量对发酵产品的营养品质和保质期有着重要影响,完整地解析酵子中微生物菌群多样性,对有效利用酵子中的有益菌群,防止酵子中有害菌群滋生以及提高酵子的质量和安全具有重要意义[2-5]。
国外主要集中于酵子中微生物菌群以及优势菌种对酵子营养成分和发酵机理的研究[6]。LATTANZI等[7]研究表明意大利酵子中Lactobacillus sanfranciscensis和Saccharomyces cerevisiae为其优势菌种。CORSETTI等[8]也从酵子中分离出Lactobacillus alimentarius菌种。我国对于酵子的深入研究及应用还处于初级阶段,吴斯日古冷[9]对内蒙古地区微生物多样性进行了研究。陈军丽[10]研究表明河南地区中植物乳杆菌和嗜热链球菌对面团的持气性能起着重要作用。张国华等[11]研究了我国华东、华北、华中、东北及西北地区的酵子,且不同地区基质微生物菌群结构有所不同,并影响了产品的营养品质。陕西关中区域特色的酵子研究较少,本文以陕西关中地区酵子为原料,进行Illumina PE250测序及代谢组学分析,对酵子中微生物菌群结构及代谢产物进行了分析,解析关中地区酵子中微生物多样性,对酵子中有害微生物的防控具有重要意义,为进一步开展和利用酵子中微生物资源提供了研究基础。
1 材料与方法
1.1 材料与试剂
DNA基因组提取试剂盒,QIAGEN公司;PCR扩增试剂盒,北京天根生化科技有限公司;PCR引物,上海生工生物工程公司;相关生理生化试验中所用试剂均为进口或国产分析纯。
1.2 仪器与设备
ABI Gene Amp® 9700 型号扩增仪,美国ABI公司;CFX型号凝胶成像系统,Bio-RAD公司生产;GCMGU型号水平电泳仪,大连竞迈科技有限公司;LDZX-30KBS型立式压力蒸汽灭菌器,上海申安医疗器械厂;Agilent 7890B型气相色谱仪,美国Agilent公司;Pegasus HT型飞行时间质谱仪,美国LECO公司。
1.3 方法
1.3.1 样品制备与采集
样品采自陕西省关中平原大荔和武功2个地区的酵子。样品均为手工制作,取500 g小麦面粉室温发酵过夜而成。人工采样后对样品进行编号后立即放入无菌试剂瓶中在-20 ℃下保存。
1.3.2 总DNA的提取
参考ZHANG等[6]提取DNA的方法对酵子中DNA进行提取,利用1%琼脂糖凝胶电泳检测抽提后的基因组DNA。
1.3.3 Illumina PE250测序(16S和ITS测序)
本试验以10 ng总DNA稀释液作为PCR扩增反应模板进行目的片段的扩增,以515F-907R作为引物对细菌16S rRNA基因的V4~V5区进行扩增。以ITS1F-ITS2R为引物对真菌ITS1-ITS2区域进行扩增。扩增后,用2 mL PCR产物来验证2%琼脂糖凝胶电泳扩增是否成功。随后用AxyPrep DNA凝胶回收PCR产物,Tris-HCl洗脱后用2%琼脂糖电泳检测。将PCR产物用QuantiFluor TM -ST进行检测定量,使用NEB Next Ultra DNA建库试剂盒进行文库构建,最后用Hisep PE250执行测序。
1.3.4 代谢产物分析
采用蒸馏萃取(SDE)技术富集发酵馒头中的挥发性物质,利用气相色谱-飞行时间质谱(GC-TOFMS)技术进行检验,分析不同地区酵子发酵馒头中挥发性物质的差异。参考苏东民等[12]对馒头样品进行制作的同时进行蒸馏萃取,然后将样品用于GC-TOFMS分析。色谱条件为色谱柱:J&W DB-5石英毛细管柱(30 m×0.25 mm,0.25 μm);使用氦气作为载气,前入口吹扫流速为3 mL/min,通过柱的气体流速为1 mL/min;升温程序:50 ℃保持1 min,以10 ℃/min升至300 ℃,保持14 min;使用氦气作为载气流速为1.2 mL/min,压力2.4 kPa,进样量1 μL,分流比10∶1。质谱条件为注射、传输线和离子源的温度分别为280、270、220 ℃。电子撞击模式下能量为70 eV;质量扫描范围m/z 50~500;溶剂延迟时间为460 s,以20张光谱每秒的速率扫描,使用峰面积归一化方法来计算每个组分的含量。
1.3.5 数据分析
对原始数据进行拼接(FLASH[13],version),将拼接后的序列进行质量过滤(Trimmomatic[14],version),并去除嵌合体(UCHIME[15],version),得到高质量的Tags序列。对序列在相似性97%的水平上进行聚类(UCLUST[16],version 1.2.22),以测序序列数的0.005%作为阈值过滤OTU[17]。通过使用Mothur方法,SILVA[18] (Release119 http://www.arb-silva.de)和UNITE[19](Release 7.0 http://unite.ut.ee/index.php)的数据库对物种进行注释(阈值设定为0.8~1),从而得到分类学信息并在各个水平上进行分类。Chao1、Simpson、Shannon、ACE指数用Qiime软件来计算。此外对代谢产物进行分析,用Origin 8.5软件处理。
2 结果与分析
2.1 样品中序列数的特点
将提取好的样品,合格后进行高通量测序。通过Illumina PE250测序,将所有样品进行聚类,在97%的相似性下对样品进行OTU聚类,然后对OTUs的代表序列进行物种注释。
2.2 样品中细菌多样性分析
2.2.1 样品细菌群体间多样性分析
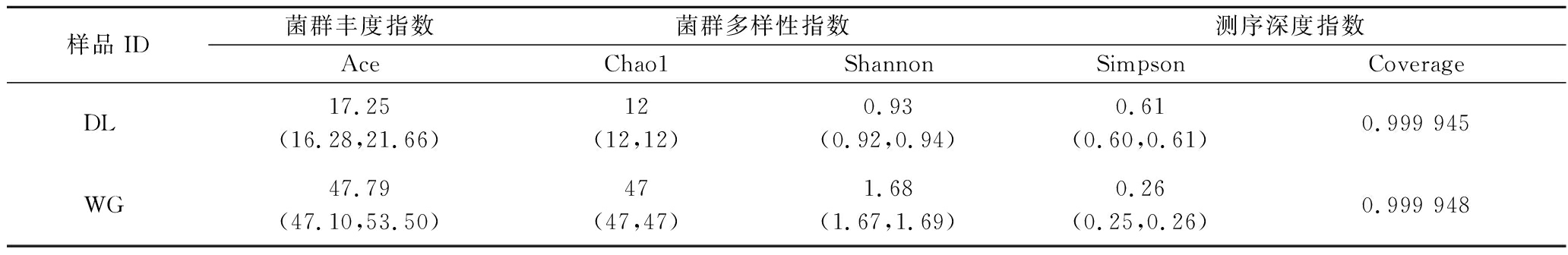
每个样品的Chao1指数和Shannon指数可以用来评估物种丰度和多样性(见表1)。
表1 酵子中细菌群落多样性指数
Table 1 Diversity indices of bacterial communities in Jiaozi
注:DL,WG分别代表陕西渭南市大荔县,陕西咸阳市武功县两个地区的酵子。下同
陕西关中不同地区取得的酵子样品测序深度均在99%以上,能够较好地代表各地区酵子中细菌种群的真实情况。通过对比Ace指数,可以估计样品中的样品总数,大荔和武功地区样品中Ace指数分别为17.25和47.79,表明武功地区酵子中微生物菌群丰度较高,可以估计样品中微生物多样性。大荔和武功地区样品中Shannon指数分别为0.93和1.68,武功地区酵子样品中细菌香农指数明显高于大荔地区样品,表明陕西关中大荔和武功两个地区酵子中微生物群落差异性较大。
2.2.2 细菌群落各水平上的分布
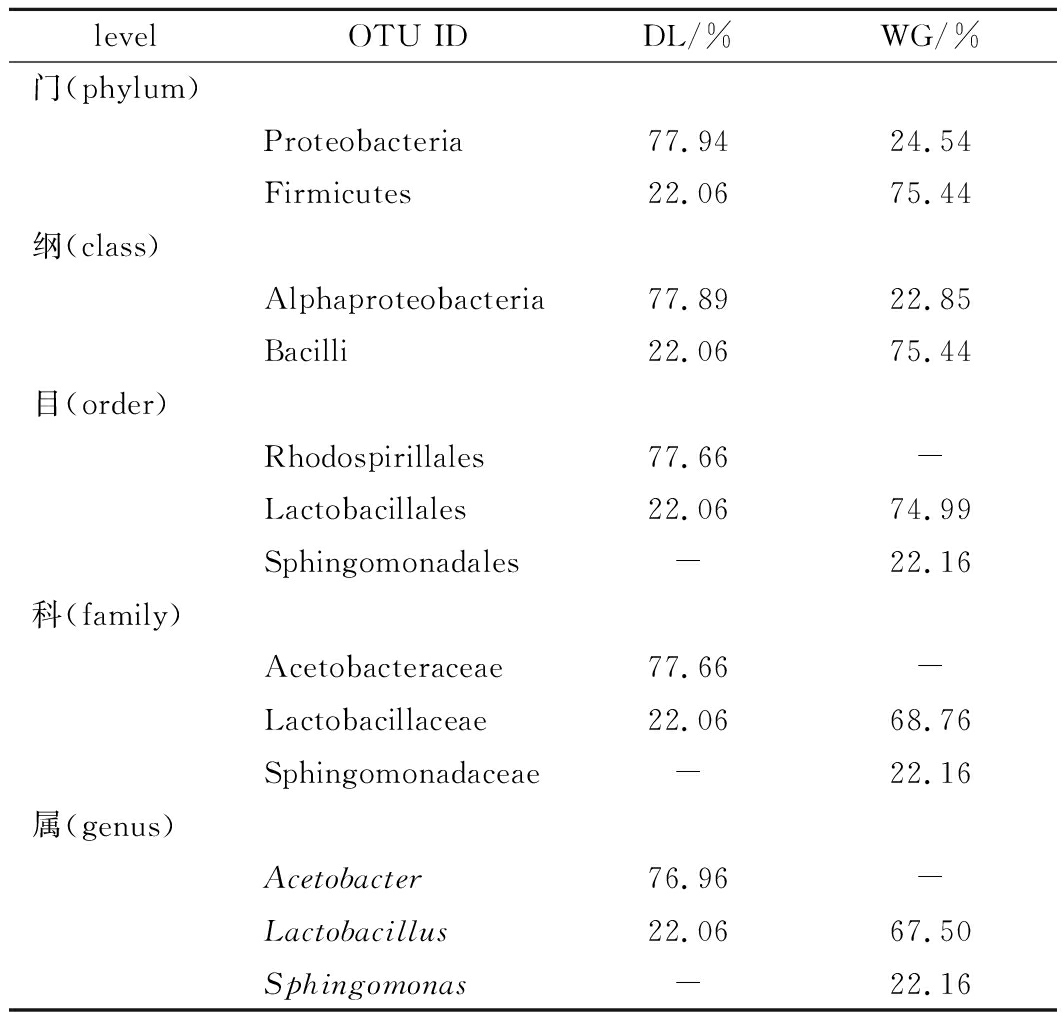
本研究中,在所有酵子样品门、纲、目、科、属5个水平上,其中含量大于5%的细菌菌群见表2。结果显示:在门水平上,Proteobacteria为大荔地区优势菌群门,含量为77.94%。
Firmicutes为武功地区优势菌群,含量为75.44%;在纲水平上,Alphaproteobacteria在大荔地区所占比例最高为77.89%。Bacilli在武功地区占到75.44%;在目水平上,Rhodospirillales为大荔地区优势菌群含量为77.66%。Lactobacillales在大荔和武功地区丰度分别为22.06%和74.99%。而Sphingomonadales为武功地区优势菌群,含量为22.16%;在科水平上,Acetobacteraceae和Lactobacillaceae为大荔地区优势菌群,分别占77.66%和22.06%。Sphingomonadaceae为武功地区优势菌群占22.16%,而Lactobacillaceae在大荔和武功地区样品中含量分别为22.06% 和68.76% 有明显差异;在属水平上,Acetobacter为大荔地区酵子中的优势菌群属,所占比例最高,为76.96%, 而在武功含量小于1%。Sphingomonas在武功地区所占比例较高为22.16%。Lactobacillus在大荔地区和武功的酵子中分别为22.06%和67.50%,为武功地区优势菌属。
表2 酵子中的优势细菌群落在不同水平上的分布
Table 2 The distribution of dominant bacteria communities in different levels of Jiaozi
注:“-”指丰度低于5%,或未检测出的菌群。表中列出了丰度高于5%的细菌菌群。下同。
2.2.3 细菌群落属水平上分布热图
根据OUT数据进行标准化处理(取对数)之后,选取数目最多的前24个物种,基于R-heatmap进行作图,热图中不同色块代表不同属的丰度,横向代表样品,纵向代表物种,如图1所示。在大荔地区的细菌群落中观察到2个富集群,包括Acetobacter和Lactobacillus,但在武功地区中Acetobacter很少被鉴定出来。在武功地区,观察到4个富集群,分别为Lactobacillus,Sphingomanas,Weissella和Pediococcus,但在大荔地区Sphingomanas,Weissella和Pediococcusk菌群属很少。陕西关中大荔和武功地区含量较丰富的细菌菌群仅观察到1个Lactobacillus菌属。
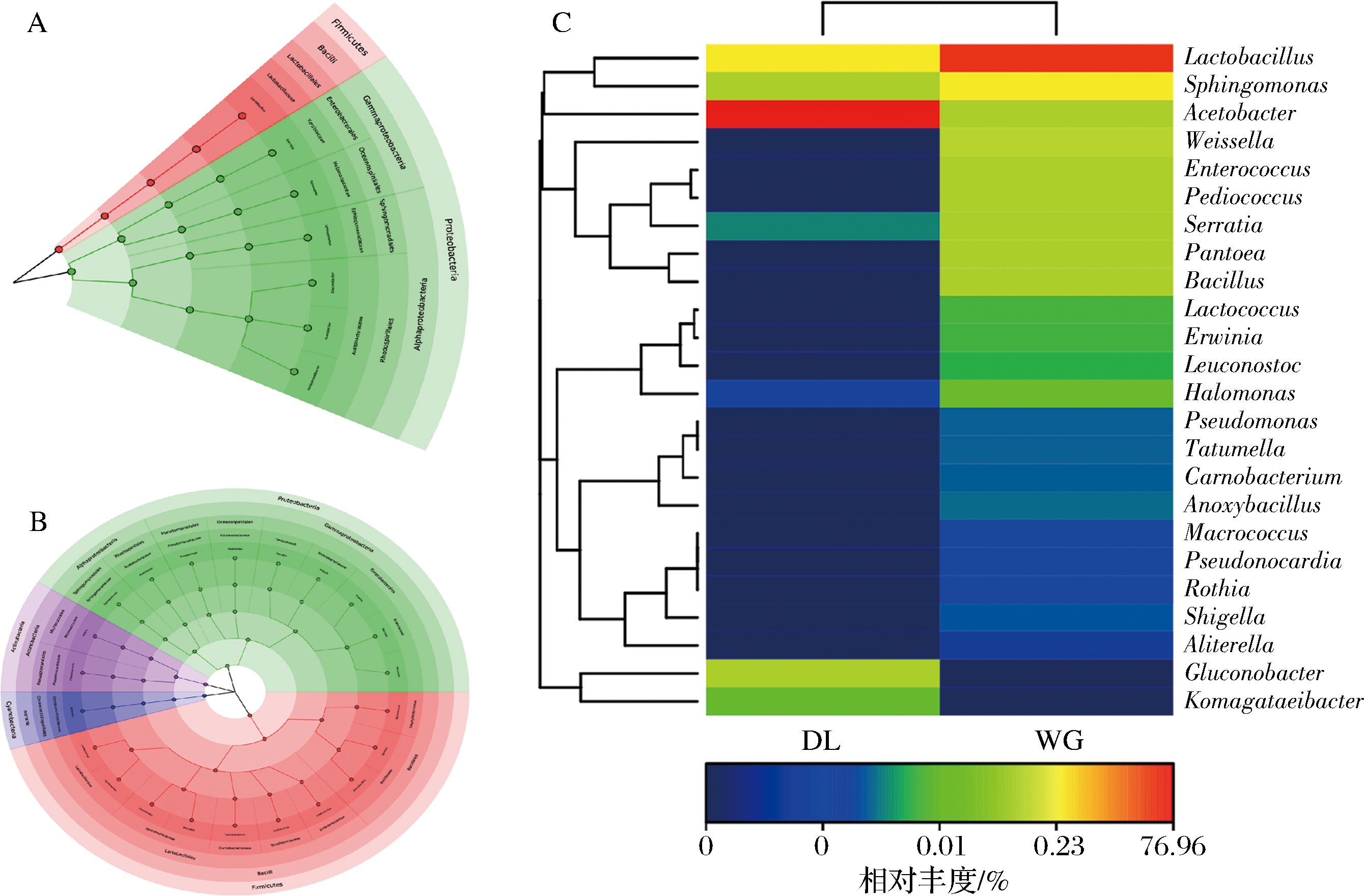
图1 两个地区酵子中前24个丰富属的细菌分布热图
Fig.1 Heatmap showing the bacteria distribution of the top 24 abundant genera among the 2 regions of Jiaozi
2.3 样品中真菌多样性分析
2.3.1 样品真菌群体间多样性分析
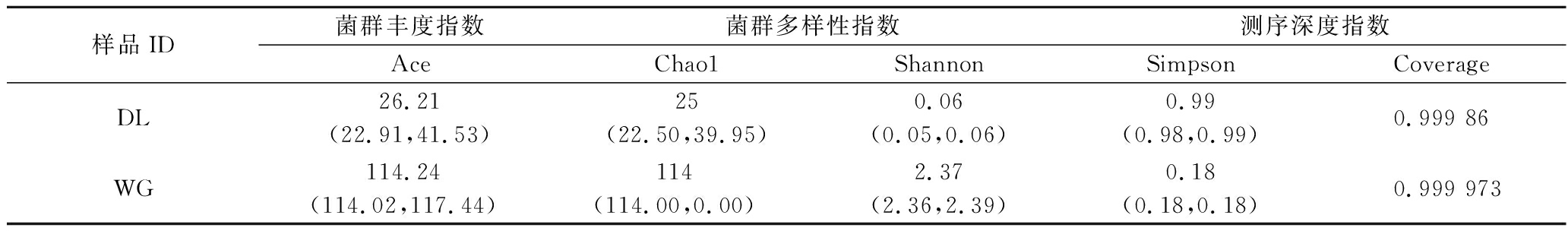
大荔和武功地区样品中Ace指数分别为26.21和114.24,表明武功地区酵子中微生物真菌菌群多样性远高于大荔地区。大荔和武功地区样品中Shannon 指数分别为0.06和2.37,表明2个地区样品中真群落结构差异较大。
表3 酵子中真菌群落多样性指数
Table 3 Diversity indices of fungi communities in Jiaozi
2.3.2 真菌群落各水平上的分析
本研究中含量大于5%的真菌菌群见表4。结果显示:在门的水平上,Basidiomycota为大荔地区优势菌群占99.30%。 Ascomycota在武功地区丰度为97.39%; 在纲水平上,Tremellomycetes为大荔优势菌群纲占99.30%。
表4 酵子中的优势真菌群落在不同水平上的分布
Table 4 The distribution of dominant fungi communities in different levels of Jiaozi

Sordariomycetes,Dothideomycetes和Eurotiomycetes为武功地区优势菌群,分别为41.20%,40.76%,12.35%; 在目水平上,Trichosporonales在大荔地区占到99.30%。Hypocreales和Pleosporales在武功地区丰度分别为35.17%和34.83%;在科水平上,Trichosporonaceae在大荔地区含量为99.30%。武功地区Pleosporaceae和Nectriaceae分别占34.53%和30.51%;在属水平上,Trichosporon在大荔地区所占比例最高,为99.30%,而在武功地区中几乎没有。Alternaria和Nectriaceae_unclassified为武功地区中的优势菌群属,分别为32.84%和24.26%。Gibberella,Sordariomycetes_unclassified在大荔地区含量均小于5%。
2.3.3 真菌群落属水平上分布热图
大荔和武功地区酵子中真菌菌群聚类热图如图2所示。
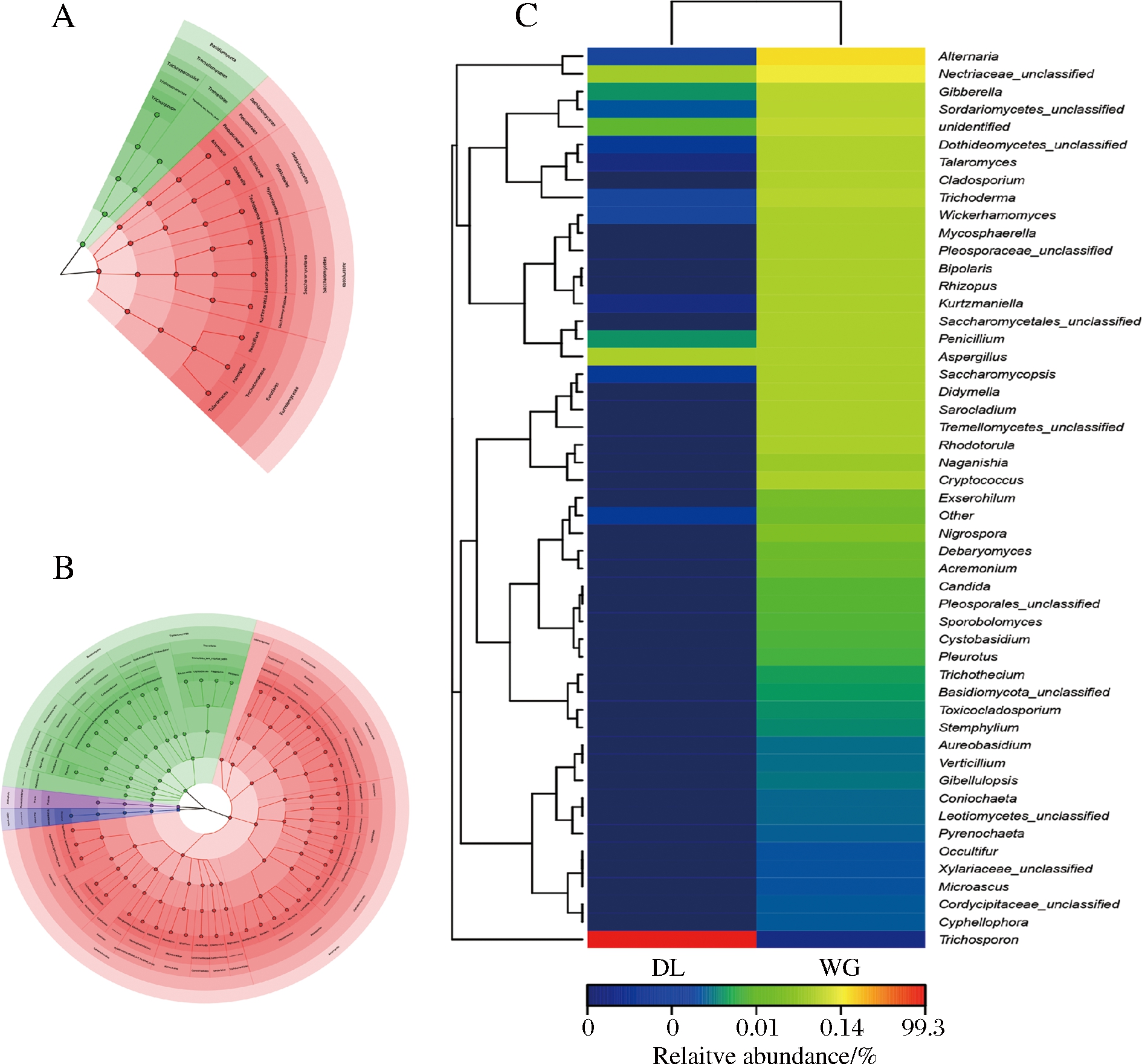
图2 两个地区酵子中前51个丰富属的真菌分布热图
Fig.2 Heatmap showing the fungi distribution of the top 51 abundant genera among the 2 regions of Jiaozi
在大荔地区的真菌群落中观察到1个富集群,为Trichosporon。在武功地区的4个富集群为Alternaria,Gibberella,Nectriaceae和Sordariomycetes,但在大荔地区这些菌群属都很少被鉴定出来。结果表明关中不同地区酵子中真菌菌群差异较大。
2.4 代谢物分析
代谢物:DL地区,2个肽、2个醛、5个嘌呤、1个嘧啶、14个酮、2个酚、2个维生素、3个碱、5个杂环类化合物,23个苷;WG地区,1个醛、1个嘌呤、1个嘧啶、9个酮、4个酚、1个碱、5个杂环类化合物、22个苷。
通过气相色谱飞行时间质谱技术对陕西关中两个不同地区的酵子发酵中代谢产物进行分析(见表5)。大荔和武功地区分别检测出480和314种代谢物,结果表明主要的代谢产物是有机酸和氨基酸类物质。不同地区代谢产物相对种类和含量呈现出一定的差异。胺类和酰胺类在2个样品中含量均较少。
表5 酵子中鉴定出的化学成分分类
Table 5 Classification of chemical constituents identified in Jiaozi

对关中地区鉴定出的相对含量大于1%的代谢物质进行分析(见图3)。

图3 两样品中相对含量大于1%的代谢物质识别
Fig.3 Identification of metabolic substances in two samples with relative content of more than 1%
结合表5可以看出酸类和醇类是酵子中主要代谢物质,在大荔地区的酵子中酸类物质占到了34.12%,其中主要是反油酸(elaidic acid),棕榈酸(palmitic acid),氧脯氨酸(oxoproline);醇类物质占到了15.6%,主要是肌醇(myo-inositol),核糖醇(ribitol),2-脱氧赤藓糖醇(2-deoxyerythritol);糖类物质主要为葡萄糖(glucose)占1.46%,磷酸盐(phosphate)为1.22%,羟胺类物质占到了1.03%。而在武功地区酸类物质主要为琥珀酸(succinic acid),L-苹果酸(L-malic acid)占到了15.44%;醇类物质主要为核糖醇(ribitol),肌醇(myo-inositol)占到了18.91%;糖类物质主要为麦芽糖(maltose)和异麦芽糖(Isomaltose)占到了7.19%, 磷酸盐为1.10%,羟胺类物质占到了2.66%。 大荔和武功地区相比,大荔地区酸类物质和核糖醇含量明显高于武功地区,而武功地区醇类物质总量高于大荔地区大约3%,糖类物质也高于大荔地区,然而羟胺类物质和磷酸盐含量变化较少。
3 讨论
本文以陕西关中不同地区的酵子为研究对象,利用高通量测序技术对酵子中细菌及真菌菌群多样性进行了研究,同时对2个样品酵子中代谢产物进行了分析。目前国内外对于具有地域特色的酵子中真菌多样性及代谢组学的研究较少。ZHANG等[6]对传统面食发酵剂中微生物种类进行了研究,对酵子中细菌多样性进行了分析,其结果显示Leuconostoc,Lactobacillus 和Weissella为酵子中的优势菌群。本研究结果发现,Acetobacter和Lactobacillus为酵子中的优势菌群,与目前研究报道中其他地区酵子中优势菌群一致[20],西北地区中优势菌群为Acetobacter[11]。本研究同时发现武功地区酵子中微生物菌群结构多样性明显比大荔地区复杂。在大荔地区Acetobacter为主要富集菌群,Lactobacillus和Weissella则仅在武功地区含量较为丰富,而Sphingomonas和Weissella这2种菌群在大荔地区没有发现大的聚集。且武功地区乳酸菌含量高达67.50%,与研究表明酵子中的乳酸菌为优势菌株的结果保持一致[20]。武功地区乳酸菌为优势菌种,不但可以发酵产生各种有机酸,且与酵母菌发酵产生的醇类物质作用产生酯类,赋予食品独特的风味,同时作为益生菌群,可以调节肠道菌群平衡,对人体健康存在有益影响。此外,大荔地区优势菌株醋酸杆菌代谢可以赋予酸面团特征风味成分,改善质构,抑制腐败微生物等[21]。
对酵子中真菌多样性进行分析,相关研究表明传统面食发酵剂中以酵母菌为主[22],对发酵食品风味,色泽,质地有着重要的作用。酵子中Saccharomyces-cerevisiae和Candida-krusei等20种酵母菌为优势菌种[7,23]。本研究中Trichosporon是大荔地区优势菌群,与其他研究中酵母菌为优势菌种的结论一致[24],但种类有所差距。而Nectriaceae和Sordariomycetes在武功地区显示出较高的丰度,试验发现的高丰度菌群还包括Alternaria和Gibberella,表明传统面食发酵剂中是酵母菌,乳酸菌,霉菌混和发酵体系[25-26],除此之外结合细菌多样性发现还含有醋酸杆菌在内的其他细菌,甚至可能含有致病菌[21]。Alternaria是一种黑曲霉菌,虽然不是酵子真菌中的常见菌种,但在商业中也有很重要的应用,发酵工业生产过程中用于生产各种蛋白酶,壳聚糖等[27]。结果显示武功和大荔虽然都处于关中地带但是各分类水平上群落组成差异性较大。
酵子中乳酸菌和酵母菌含量比为100∶1[28-29]。本研究表明武功地区乳酸菌含量高于大荔地区,而大荔地区酵母菌含量高于武功地区,大荔地区代谢产物种类高于武功地区。酵母菌可以利用葡萄糖,蔗糖等发酵糖类代谢产生CO2,使得面食制品获得独特的质构,并且代谢过程中会有利于发酵产品形成独特的风味的其他产物[30-31]。醇类物质在武功和大荔地区含量差异不大,而大荔地区由于Acetobacter的大量存在,优势菌株醋酸杆菌代谢产生大量醋酸使得有机酸类物质含量较高[21],武功地区由于乳酸杆菌含量高达67.50%,其发酵产生的有益酸类物质琥珀酸、苹果酸等占据到了15.44%,有助于形成面包独特的风味[20]。大荔地区Trichosporon含量高达99%以上,而在代谢产物中如图4,可以看出葡萄糖含量明显少于武功地区。乳酸菌在代谢过程中产生的氨基酸对发酵面食的风味起着重要作用[32]。且武功地区优势菌群Lactobacillus丰度远大于武功地区,而乳酸菌在发酵过程中产生的氨基酸可以通过脱氨和转氨代谢获得各种风味或风味前体物质[32-33],导致武功地区醛,酯类物质含量大于大荔地区。本研究得知武功地区有益成分远高于大荔地区所检测到的代谢产物含量,更有利于生产营养丰富的面食制品。
4 结论
本研究利用高通量测序技术和代谢产物分析来研究陕西关中地区酵子中真菌和细菌菌群结构多样性,了解关中平原大荔和武功地区中微生物的种类和代谢产物。结果表明酵子中真菌较细菌相比种类更加多样,Trichosporon为大荔地区优势真菌属,Alternaria和Nectriaceae为武功地区优势真菌属。Acetobacter和Lactobacillus为大荔地区优势细菌属,武功地区优势细菌属分别为Lactobacillus。关中不同地区的酵子在菌群结构和多样性差别较大,具有较为明显的区域性特色,结合代谢产物分析,武功地区酵子菌群较为丰富且代谢产物有益于生产面食,具有非常好的研究意义,为进一步开发质量安全,风味优良的食品发酵剂奠定了基础。
参考文献
[1] BRANDT M J. Sourdough products for convenient use in baking[J]. Food Microbiology, 2007, 24(2): 161-164.
[2] ZHAO C J, KINNER M, WISMER W, et al. Effect of glutamate accumulation during sourdough fermentation with Lactobacillus reuteri on the taste of bread and sodium-reduced bread[J]. Cereal Chemistry, 2015, 92(2): 224-230.
[3] THIELE C, GANZLE M G, VOGEL R F. Contribution of sourdough Lactobacilli, yeast, and cereal enzymes to the generation of amino acids in dough relevant for bread flavor[J]. Cereal Chemistry, 2007, 79(1): 45-51.
[4] GOBBETTI M, RIZZELLO C G, DI C R, et al. How the sourdough may affect the functional features of leavened baked goods[J]. Food Microbiology, 2014, 37(5): 30-40.
[5] LIU T J, LI Y, CHEN J C, et al. Prevalence and diversity of lactic acid bacteria in chinese traditional sourdough revealed by culture dependent and pyrosequencing approaches[J]. LWT - Food Science and Technology, 2016, 68: 91-97.
[6] ZHANG G H, HE G Q. Predominant bacteria diversity in chinese traditional sourdough[J]. Journal of Food Science, 2013, 78(8): U1 218-U1 233.
[7] LATTANZI A, MINERVINI F, CAGNO R D, et al. The lactic acid bacteria and yeast microbiota of eighteen sourdoughs used for the manufacture of traditional ltalian sweet leavened baked goods[J]. International Journal of Food Microbiology, 2013, 163(2-3): 71-79.
[8] CORSETTI A, LAVERMICOCCA P, MOREA M, et al. Phenotypic and molecular identification and clustering of lactic acid bacteria and yeasts from wheat (species Triticum durum and Triticum aestivum) sourdoughs of Southern Italy[J]. International Journal of Food Microbiology, 2001, 64(1-2): 95-104.
[9] 吴斯日古冷. 内蒙古西部地区酸面团中酵母菌和乳酸菌的分离鉴定及其生物多样性研究[D]. 呼和浩特:内蒙古农业大学, 2011.
[10] 陈军丽. 乳酸菌对馒头面团发酵影响的研究[D]. 郑州:河南农业大学, 2012.
[11] 张国华,何国庆. 我国不同地区发酵酸面团的菌群组成及差异研究[C]∥中国食品科学技术学会东西方食品业高层论坛.北京:中国食品科学技术学会, 2011: 94-95.
[12] 苏东民,胡丽花,苏东海,等. 不同干酵母发酵对馒头挥发性物质的影响[J]. 河南工业大学学报, 2010, 31(3): 1-4.
![]() T, SALZBERG S L. Flash: Fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011, 27(21): 2 957-2 963.
T, SALZBERG S L. Flash: Fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011, 27(21): 2 957-2 963.
[14] BOLGER A M, LOHSE M, USADEL B. Trimmomatic: A flexible trimmer for illumina sequence data[J]. Bioinformatics, 2014, 30(15): 2 114-2 120.
[15] EDGAR R C, HAAS B J, CLEUENTE J C. UCHIME improves sensitivity and speed of chimera detection[J]. Bioinformatics, 2011, 27(16): 2 194.
[16] EDGAR R C. Search and clustering orders of magnitude faster than BALST[J]. Bioinformatics, 2010, 26(19): 2 460-2 461.
[17] BOKULICH N A, SATHISH S, FAITH J J, et al. Quality-filtering vastly improves diversity estimates from illumina amplicon sequencing[J]. Nature Methods, 2013, 10(1): 57-59.
[18] QUAST C, PRUESSEE, YILUAZ P. The SILVA ribosomal RNA gene database project: Improved data processing and web-based tools[J]. Nucleic Acids Research, 2013, 41(D1): D590-D596.
[19] K LJALG U, GREBENC T. Towards a unified paradigm for sequence-based identification of fungi[J]. Molecular Ecology, 2013, 22(21): 5 271-5 277.
LJALG U, GREBENC T. Towards a unified paradigm for sequence-based identification of fungi[J]. Molecular Ecology, 2013, 22(21): 5 271-5 277.
[20] ZHANG J C, LIU W J, SUN Z H, et al. Diversity of lactic acid bacteria and yeasts in traditional sourdoughs collected from western region in inner mongolia of China[J]. Food Control, 2011, 22(5): 767-774.
[21] 刘同杰,李云,吴诗榕,等. 传统酸面团中细菌与酵母菌的分离与鉴定[J]. 现代食品科技, 2014, 30(9): 114-120.
[22] ARENDT E K, RYAN L A M, BELLO F D. Impact of sourdough on the texture of bread[J]. Food Microbiology, 2007, 24(2): 165-174.
[23] DE V L, VAN K S, HARTH H, et al. Microbial ecology of sourdough fermentations: Diverse or uniform?[J]. Food Microbiology, 2014, 37(2): 11-29.
[24] PULVIRENTI A, SOLIERI L, GULLO M, et al. Occurrence and dominance of yeast species in sourdough[J]. Letters in Applied Microbiology, 2010, 38(2): 113-117.
[25] 刘长虹,杨敬雨,韩俊俊,等. 传统酵子制作过程中微生物数量变化的研究[J]. 食品工业科技, 2007 (2): 76-77.
[26] VOGELMANN S A, HERTEL C. Impact of ecological factors on the stability of microbial associations in sourdough fermentation[J]. Food Microbiology, 2011, 28(3): 583-589.
[27] 黄惠莉,林文銮. 黑曲霉菌体制备壳聚糖[J]. 化学研究与应用, 2004, 16(4): 575-576.
[28] VUYST L D, NEYSENS P. The sourdough microflora: Biodiversity and metabolic interactions[J]. Trends in Food Science & Technology, 2005, 16(1): 43-56.
[29] RANDAZZO C L, TORRIANI S, AKKERMANS A D L, et al. Diversity, dynamics, and activity of bacterial communities during production of an artisanal sicilian cheese as evaluated by 16s rRNA analysis[J]. Applied & Environmental Microbiology, 2002, 68(4): 1 882-1 892.
[30] GIANNOU V, KESSOGLOU V, TZIA C. Quality and safety characteristics of bread made from frozen dough[J]. Trends in Food Science & Technology, 2003, 14(3): 99-108.
[31] VERMEULEN N, CZERNY M, G NZLE M G, et al. Reduction of (E)-2-nonenal and (E,E)-2,4-decadienal During Sourdough Fermentation[J]. Journal of Cereal Science, 2007, 45(1): 78-87.
NZLE M G, et al. Reduction of (E)-2-nonenal and (E,E)-2,4-decadienal During Sourdough Fermentation[J]. Journal of Cereal Science, 2007, 45(1): 78-87.
[32] WILLIAMS A G, NOBLE J, BANKS J M. Catabolism of amino acids by lactic acid bacteria isolated from cheddar cheese[J]. International Dairy Journal, 2001, 11(4): 203-215.
[33] YVON M, RIJNEN L. Cheese flavour formation by amino acid catabolism[J]. International Dairy Journal, 2001, 11(4): 185-201.