果胶是一类广泛存在于植物细胞壁的初生壁和细胞中间片层的杂多糖[1],其结构和化学组成复杂,普遍观点认为果胶结构分为光滑区和毛发区,光滑区由α-D-半乳糖醛酸残基通过α-1,4糖苷键聚合而成,毛发区由高度分支的α-L-鼠李半乳糖醛酸聚糖组成[2-4]。有研究表明不同来源的果胶具有不同的半乳糖醛酸含量、蛋白含量、总糖含量和分子质量,其中分子质量的差别最大[5]。果胶作为天然的大分子多糖,具有优良的增稠、凝胶、稳定和功能特性,广泛应用于食品、医药、化妆品、纺织、烟草等行业[6-11]。但天然果胶由于分子质量较大且不同来源果胶结构上的巨大差异而限制了其在食品及医药工业中的应用[12],为全面满足需求,通常采用化学、生物和物理的改性方法来降低果胶分子质量、改变其甲酯基含量及分布、添加基团对果胶结构进行修饰等[13-15]。其中分子质量是果胶的一项重要指标,大分子质量的果胶不能被人体吸收,而改性之后的小分子质量果胶可被人体吸收,从而扩大了果胶在食品和医药领域的应用范围[16-17]。柑橘皮是果胶的重要来源,果胶含量占其干重的20%~30%[36]。我国柑橘种植面积和产量均居世界首位,按国内柑橘年产量和加工量推算,每年可产生 200万t以上的柑橘皮副产物,除极少数用于陈皮等加工外,大部分被直接丢弃掩埋,造成严重的资源浪费和环境污染[37]。因此,利用我国丰富的柑橘皮果胶资源做研究可在一定程度上提高柑橘皮利用率。
高场强超声技术是利用超声产生的巨大冲击波破碎细胞,目前已被广泛用于果胶提取[18-22]。另外,由于超声处理过程中产生的机械作用、空化作用和热效应[23-24],超声波也被证明是一种生物大分子的有效、绿色地定向降解方法[25]。王博等利用超声波提取水溶性茯苓多糖,表明超声波不会对其单糖种类、组成以及单糖结构造成影响,但是对茯苓多糖的分子链有显著影响[26]。SESHADRI等研究了超声波方法对高甲氧基果胶流变学特性和光学特性影响,结果显示随着超声强度的增强和处理时间的延长,果胶形成凝胶的凝胶力较弱,形成的凝胶更加透明,同时果胶的流变学特性发生了明显变化,逐步趋向于牛顿流体[27]。然而,上述研究主要集中在超声处理对果胶分子结构、理化性质及流变特性的研究,超声处理后果胶乳化特性的变化研究相对较少,超声处理通过影响果胶分子结构及理化性质,进而影响果胶各类功能特性的研究尚缺乏系统性。
本实验重点探究不同超声时间和超声强度条件下柑橘果胶的理化指标、流变性质和乳化性质的变化,以期明确超声对果胶多糖的定向降解规律,为后期低分子果胶生物活性的研究及实际生产应用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
商品柑橘果胶,货号为P9135,购于Sigma- Aldrich上海贸易公司。
四硼酸钠、半乳糖醛酸、间苯基苯酚、浓H2SO4、NaOH、蒽酮试剂、叠氮化钠、右旋糖酐、甲醇、NaNO3等均为国产分析纯,购于国药集团化学试剂有限公司;食用级精制大豆油,购于上海嘉里食品工业有限公司。
1.2 仪器与设备
JY92-IIDN超声波细胞粉碎仪,宁波新芝生物科技有限公司生产;JA12002电子天平,龙腾电子公司生产;BT224S分析天平,赛多利斯科学仪器(北京)有限公司生产;PB-10PH计,德国Sartorius集团生产;紫外可见分光光度计UV-762,北京普析通用仪器有限公司生产;流变仪AR2000,美国TA公司生产;激光粒度分析仪,美国贝克曼库特公司生产;Zeta电位仪,英国马尔文仪器公司生产;内切式匀浆机,宁波新芝生物科技有限公司生产。
1.3 方法
1.3.1 样品超声波处理
采用超声波处理器模型JY92-2D处理样品。准确称取3.00 g柑橘果胶溶于97 mL水中,取25 mL果胶溶液置于频率20 kHz的超声场中。超声作用时间为0、10、20、30和45 min;超声强度为20%、30%、40%、50%和60%;超声探头直径6 mm;探头插入液面下2 cm,液面高度4 cm;温度设置(25±1) ℃;脉冲时间4 s,间歇2 s;单因素实验中改变超声时间时强度为50%,改变超声强度时时间为10 min。试验过程中采用冰浴控温,温度由超声波仪自带的温度探头测定。为减小每次的操作误差,处理完的样品迅速置于4 ℃条件下冷藏并于24 h内测定相关性质。
1.3.2 半乳糖醛酸含量测定
果胶半乳糖醛酸含量的测定依据参考文献[28],略作修改。取果胶溶液1 mL,加入6 mL 0.012 5 mol/L的浓硫酸-四硼酸钠溶液,立即放入冰水浴中。振荡混合均匀后于沸水浴中5 min,并再次放入冰水浴中冷却至室温后加入0.1 mL的0.15%间苯基苯酚溶液,振荡后,放置15 min后用分光光度计在520 nm处测定其吸光值,空白加入的反应试剂为蒸馏水。以半乳糖醛酸标品制备标准曲线,得到吸光度值Y与果胶半乳糖醛酸含量X关系的标准曲线为Y=99.052X+4.584 5,R2=0.993。果胶半乳糖醛酸含量按如下公式计算:
![]()
(1)
式中:Y,从标准曲线中查得的半乳糖醛酸质量浓度,μg/mL;N,稀释倍数;m,溶解的果胶样品重量,μg。
1.3.3 总糖含量测定
果胶总糖含量的测定依据参考文献[29],略作修改。精确量取80 μg/mL的果胶样品1 mL,加入4 mL蒽酮试剂(0.2 g蒽酮溶于100 mL浓H2SO4中,现配现用),迅速浸于冰水浴中冷却,各管加完后一起浸于沸水浴中,煮沸10 min。用冰浴冷却至室温后在620 nm处测其吸光值,空白以1 mL蒸馏水代替样品。以葡萄糖为标准品制备标准曲线,得到吸光度值Y与果胶总糖含量X关系的标准曲线为:Y=0.006 86X+0.009 45,R2=0.995,根据标准曲线当量计算出果胶中的总糖含量。
1.3.4 蛋白质含量测定
将3%果胶溶液用蒸馏水稀释至80 μg/mL,按照Lowry试剂盒的操作步骤测定其吸光值,空白以1 mL蒸馏水代替样品。使用Lowry试剂盒测定绘制吸光度值Y与蛋白质含量X关系的标准曲线为:Y=2.650 4X-0.024 75,R2=0.994,根据标准曲线当量计算果胶中的蛋白含量。
1.3.5 果胶分子质量分布的测定
果胶分子质量分布的测定采用十八角度激光散射仪进行。流动相为0.05 mol/L NaNO3(含0.02%叠氮化钠),流速0.5 mL/min,柱温25 ℃,进样量10 mL。采用20%甲醇做归一化处理,以右旋糖酐为标品,测定样品果胶的分子质量分布。
1.3.6 果胶溶液粒径和电势测定
果胶溶液粒径和电势的测定依据参考文献[30],略作修改。将果胶溶液稀释至质量浓度1 g/L,使用马尔文激光粒度仪Size模式,在25 ℃下测定不同果胶溶液的粒径分布情况。调节果胶溶液pH值分别为3、4、5、6、7,使用马尔文激光粒度仪Zeta potential模式,在25 ℃测定其不同pH下的电位。
1.3.7 果胶溶液流变性质和表观黏度测定
果胶溶液流变性质和表观黏度的测定依据参考文献[30],略作修改。果胶溶液的流变性质和表观黏度测定采用空气轴承旋转流变仪AR2000进行。选用40 mm的2°锥板,温度使用恒温水循环系统控制在25 ℃,果胶浓度3%(质量分数),样品放置时刚好覆盖转子边缘。剪切速率0.01~100 s-1,温度25 ℃,记录检测样品的粘度随剪切速率的变化。
应变扫描:固定频率1 Hz,温度25 ℃,在0.01%~100%进行应变扫描以确定线性黏弹区(LVR),由实验结果可知,为保证测定过程中所有果胶样品均在线性黏弹区内,选择1%作为应变扫描值进行0.1~10 Hz频率扫描,温度25 ℃,记录贮藏模量G′和损耗模量G″。
1.3.8 果胶乳化性质的测定
果胶乳化性质的测定依据参考文献[31],略作修改。果胶乳化性主要从乳液粒度和乳液稳定性两方面进行表征。浓度为1%(质量分数)的果胶溶液20 g中加入15 g精制大豆油于50 mL离心管中,10 000 r/min均质3 min(1 min/次)制备果胶乳化液。乳液粒度测定采用马尔文激光粒度仪进行,测量背景为水,逐步滴加样品使遮光度在75%左右进行测量,每个样品自动重复测定3次。果胶乳液稳定性测定采用储藏期法进行,乳液水平放置在4 ℃冰箱中并加入0.02%叠氮钠防腐,观察乳液稳定情况。
1.3.9 数据处理
所有试验重复3次,以平均值±标准差的形式表示。采用Origin 8.5软件对数据进行方差分析(ANOVA)和T检验并制图,显著性水平0.05。
2 结果与分析
2.1 高场强超声处理对果胶理化指标的影响
2.1.1 果胶溶液半乳糖醛酸、蛋白质及总糖含量
不同处理果胶的半乳糖醛酸、蛋白质及总糖含量如表1和表2所示。由表1和表2结果可知,超声处理后果胶的半乳糖醛酸、蛋白质和总糖含量并未发生显著性变化。
2.1.2 果胶分子质量分布
由图1可知,超声波处理时间和强度使柑橘果胶的分子质量有下降趋势。随着超声时间的增加和超声强度的增强,果胶分子质量分布趋于向小分子质量果胶移动,这可能是由于超声处理过程中产生的空化效应引起果胶分子链的断裂[25-26]。

A-超声时间; B-超声强度
图1 不同超声时间和强度对柑橘果胶分子质量分布的影响
Fig.1 Effect of ultrasonic time and intensity on molecular weight of citrus pectin
由果胶平均分子质量变化结果可知(表1、表2),超声时间较短或超声强度较低时,果胶平均分子质量降低速率较大,而随着时间的延长和强度的增大,果胶平均分子质量降低速率减小。如前所述,超声引起果胶降解主要是由于空化效应,但这种效应对果胶分子质量的影响不会随着处理时间的延长和处理强度的增加而无限制增强,因此超声处理下果胶的平均分子质量逐渐趋于稳定。另外,超声处理效果与反应介质的性质及超声波装置等都有密切关系[32]。
2.1.3 果胶溶液粒径
由表1和表2中果胶溶液粒径数据可知,超声处理会明显影响果胶溶液的粒径,超声时间越长、超声强度越大,果胶溶液粒径越小。一方面,超声处理会通过打断果胶的半乳糖醛酸长链而减小果胶分子粒径,这一结果与果胶分子质量变化趋势相一致;另一方面,超声处理也可通过影响果胶分子的空间构象而影响果胶溶液的粒径大小。王苗苗等的研究发现[30],超声处理会导致芒果果胶伸展的构象趋于聚集而引起果胶粒径减小。
2.1.4 果胶溶液Zeta电势
Zeta电势可有效地表征大分子如果胶的表面电荷性质和胶体体系的稳定性。表1和表2为果胶溶液在不同pH下的Zeta电势,由结果可知各果胶在pH 3~7的Zeta电势均为负值,且呈现出相同的规律。即溶液pH=3时,果胶电势的绝对值最小,随着pH的增大,果胶电势的绝对值也增大,当pH达到6~7时,电势不再发生明显变化。超声处理前后的果胶在相同pH下的电势并未发生显著变化,表明超声处理并未显著改变果胶溶液表面电荷分布情况。
表1 超声时间对柑橘果胶平均分子质量、粒径、Zeta电势及理化性质的影响
Table 1 Effects of ultrasonic time on molecular weight, size, zeta potential and physic-chemical properties of citrus pectin

注:数据为平均值±标准方差。同一行中不同大写字母标注表示0.05水平上有显著性差异;同一列中不同小写字母标注表示在0.05水平上有显著性差异。
表2 超声强度对柑橘果胶平均分子质量、粒径、Zeta电势及理化性质的影响
Table 2 Effects of ultrasonic intensity on molecular weight, size, zeta potential and physic-chemical properties of citrus pectin
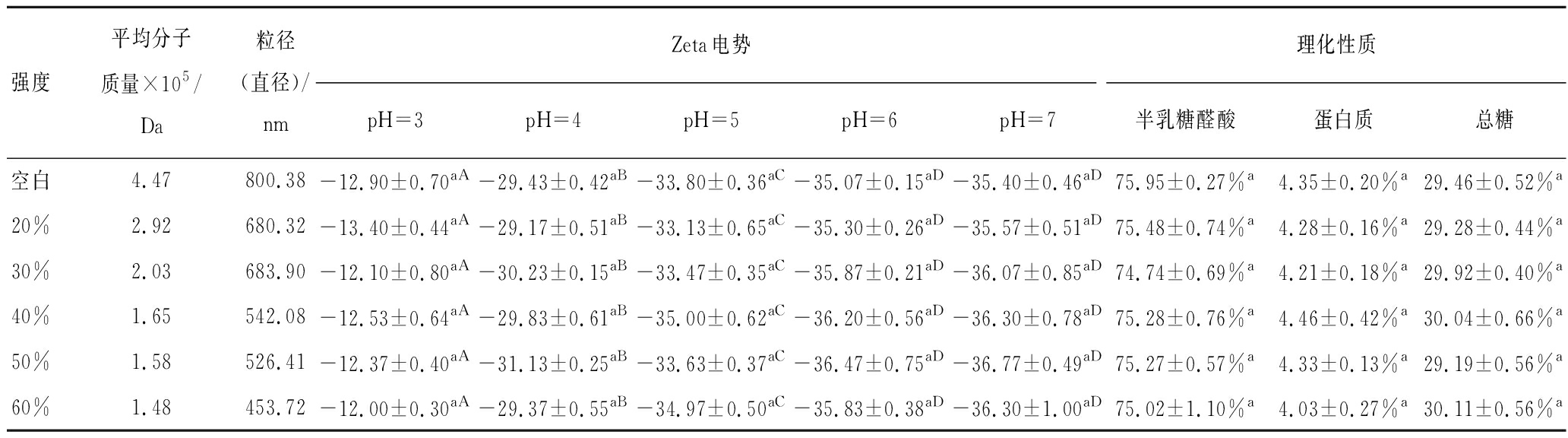
注:数据为平均值±标准方差。同一行中不同大写字母标注表示0.05水平上有显著性差异;同一列中不同小写字母标注表示在0.05水平上有显著性差异。
2.2 高场强超声处理对果胶溶液表观粘度变化的影响
由图2可知,随剪切速率的增加,果胶呈现剪切变稀的趋势即假塑性流体的性质,超声处理后逐渐趋于牛顿流体;且随着超声时间的延长和超声强度的增大,相同剪切速率下果胶溶液的表观黏度下降。该研究与SESHADRI等的研究结果相一致[27]。果胶的黏度与果胶分子质量和半乳糖醛酸含量密切相关[30],如前所述,超声处理后果胶的半乳糖醛酸含量无显著变化,但果胶平均分子质量显著减小,这可能是导致果胶表观黏度下降的主要原因。
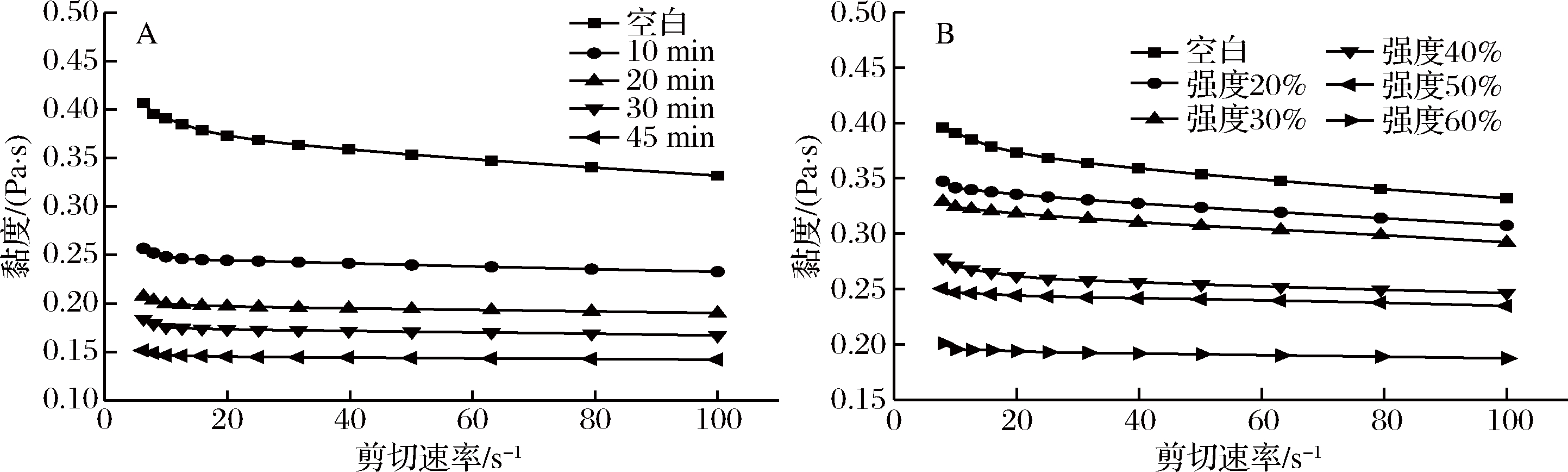
A-超声时间; B-超声强度
图2 不同超声时间和强度对果胶表观黏度的影响
Fig.2 Effects of ultrasonic time and intensity on apparent viscosity of citrus pectin
2.3 高场强超声处理对果胶溶液黏弹性变化的影响
在应力为1%、频率扫描范围为0.1至100 Hz条件下确定超声处理前后果胶溶液的贮存模量G′和损耗模量G″。G′代表样品体系的弹性成分,而损耗模量G″代表样品体系的黏性成分。G′>G″的体系是属于凝胶体系,而G′<G″的体系是属于溶胶体系,G′和G″的交点定义了果胶形成凝胶或果胶弹性行为的开始,是果胶具有较好黏弹特性的证明。图3-A所示,超声处理前柑橘果胶在0.1~100 Hz没有出现交点,且G″>G′一直存在,表明果胶一直处于溶胶状态。随着不同超声时间的处理,列出图3-B和图3-C,G′与G″出现交点,说明果胶凝胶能力增强,即超声处理后果胶表现为弹性特性,更易形成凝胶。随着不同超声强度的处理,图3-D和图3-E中,也出现了G′与G″交点,说明果胶凝胶能力增强。虽然超声波处理后果胶凝胶能力增强,但交点的变化没有显示出规律性。
由图4可知,超声处理后果胶溶液的损耗模量(黏性)/贮存模量(弹性)较原始果胶减小,表明超声处理后果胶溶液更倾向于体现弹性特性。有研究表明,超声波处理果胶会使其酯化度降低,而低酯果胶形成凝胶的速率会随着其酯化度的降低而加快,即更易形成凝胶[12]。

A-空白;B-30 min;C-45 min;D-40%;E-60%
图3 不同超声时间和强度果胶的频率扫描结果
Fig.3 Effects of ultrasonic time and intensity on the storage modulus and the loss modulus with angular frequency in pectin solution

A-超声时间; B-超声强度
图4 不同超声时间和强度对柑橘果胶黏弹性的影响
Fig.4 Effects of ultrasonic time and intensity on viscoelasticity of citrus pectin
2.4 高场强超声处理对果胶乳化性质的影响
2.4.1 果胶乳液粒度
乳液粒度大小是表征乳液稳定性的一项重要指标,通常情况下,乳液粒度越小、分布越均匀,乳液的稳定性越好[29]。如图5所示,超声处理后果胶乳液粒径显著减小,且处理时间越长,强度越大,乳液粒径越小,表明超声处理可能会提高果胶乳液的稳定性。

A-超声时间; B-超声强度
图5 果胶乳液在不同超声时间和强度处理下的粒度
Fig.5 Effects of ultrasonic time and intensity on particle size of pectin emulsion
注:同一处理条件下不同大写字母标注表示0.05水平上有显著性差异;同一天中不同小写字母标注表示在0.05水平上有显著性差异。
已有研究表明,超声处理可以通过降低乳液的粒度的方式提高乳液稳定性[33-35]。
2.4.2 果胶乳液稳定性
图6所示为各果胶乳液在4 ℃条件下贮藏后的乳液照片。由图6可以看出,不同乳液经贮藏后乳化层均发生了肉眼可见的分层现象,但乳化层的高度不同。其中,未处理的果胶乳液分层现象最为严重,而随着超声强度的增大,分层现象趋于不明显,表明超声处理可在一定程度上提高果胶乳液的稳定性。影响乳液稳定性的因素很多,蛋白含量、果胶分子质量分布及构象是其中重要因素,然而,具体的影响机制还需进一步探索研究。

图6 果胶乳液贮藏稳定性
Fig.6 Stability of the O/W emulsions prepared by different citrus pectin over storage
3 结论
本文研究了不同超声条件(时间、强度)对果胶理化性质、流变特性和乳化特性的影响。由结果可知,超声波处理不会影响果胶中半乳糖醛酸、蛋白质和总糖含量及组成,但是可能会影响半乳糖醛酸长链结构,使果胶分子质量下降、粒度减小,由此导致果胶表观黏度下降,逐渐趋于牛顿流体。在试验条件范围内,处理时间越长、强度越大,果胶表观黏度下降越显著。
超声处理后果胶乳液的粒度减小,且处理时间越长、强度越大,粒度减小越显著。乳液粒度大小会显著影响乳液的稳定性,贮藏稳定试验的研究也发现超声时间越长、强度越大,果胶乳液的分层越慢,乳球聚集越慢,表明超声处理可在一定程度上改善果胶的乳化特性。
综上,超声波这一处理方法绿色无污染,条件温和,效果显著,可以作为一种切实可行的果胶定向降解方法。超声波处理能够通过降低果胶分子质量,进而影响果胶表观黏度及其凝胶、乳化等功能特性。同时,已有研究表明,降解后的小分子质量果胶,能更好地被人体吸收,且相对于高分子质量果胶而言具有更好的生理活性。然而,超声改性后的果胶在生理学及医学上的生物利用率及在体内生理活性的变化,还有待我们进一步研究。
参考文献
[1] NOVOSEL SKAYA I L. Trends in the science and applications of pectins[J]. Chemistry of Natural Compounds, 2000, 36(1): 1-10.
[2] 孙元琳,汤坚. 果胶类多糖的研究进展[J]. 食品与机械, 2004, 20(6):60-63.
[3] 谢明勇,李精,聂少平. 果胶研究与应用进展[J]. 中国食品学报, 2013, 13(8):1-14.
[4] SCHELLER H V, KRUGER J, SERNSEN S O. Biosynthesis of pectin [J]. Physiologia Plantarum,2007,129:283-295.
[5] YAPO B M. Pineapple and banana pectins comprise fewer homogalacturonan building blocks with a smaller degree of polymerization as compared with yellow passion fruit and lemon pectins Implication for gelling properties[J]. Biomacromolecules, 2009, 10(4):717-721.
[6] THAKUR B R, SINGH R K, HANDA A K. Chemistry and uses of pectin-A review[J]. Critical Reviews in Food Science and Nutrition, 1997, 37(1): 47-73.
[7] 彭凯. pH和乙醇沉淀时间对微波辅助提取苹果果胶的影响[D]. 北京:中国农业大学农产品加工及贮藏工程, 2008.
[8] 赵利,王杉. 果胶的制备及其在食品工业的应用综述[J]. 食品科技, 1999(5): 32-34.
[9] MISHRA R K, DATT M, PAL K, et al. Preparation and characterization of amidated pectin based hydrogels for drug delivery system [J]. Journal of Materials Science, Materials in Medicine, 2008, 19(6): 2 275-2 280.
[10] HEATHER A R,WAYNE L M,LAURENCE J M,et al. Pectin engineering to modify product qualityin potato[J]. Plant Biotechnology Journal, 2011, 9(8): 848-856.
[11] 苏东林,单杨. 柑橘果皮中功能性成分的作用概述[J]. 现代食品科技, 2006, 22(2):260-262.
[12] 张丽芬,吴倩,陈复生,等. 改性果胶结构、功能及方法的研究进展[J]. 粮食与油脂,2015,28(1):1-5.
[13] 魏子昊,杨伟,刘夫国,等. 改性柑橘果胶研究进展[J]. 中国食品添加剂, 2014(3): 194-200.
[14] SINITSYA A, COPIKOV J, PRUTYANOV V, et al. Amidation of highlymethoxylated citrus pectin with primary amines [J].Carbohydrate Polymers, 2000, 42: 359-368.
[15] KRATCHANOVA M, SLAVOV A, KRATCHANOV C. Interaction of pectin with amino acids and other amino compounds in aqueous solution [J]. Food Hydrocolloids, 2004, 18: 677-683.
[16] MAXWELL E G, BELSHAW N J, WALDRON K W, et al. Pectin-An emerging new bioactive food polysaccharide[J]. Trends in Food Science&Technology, 2012,24(2): 64-73.
[17] SAKURAI M H, MATSUMOTO T, KIYOHARA H, et al. Detection and tissue distribution of anti-ulcer pectic polysaccharides from bupleurum falcatum by polyclonal antibody [J]. Planta Medica, 1996, 62(4): 341-346.
[18] EBRINGEROVA A, HROMADKOVA Z. An overview on the application of ultrasound in extraction, separation and purification of plant polysaccharides[J]. Central European Journal of Chemistry, 2010, 8(2): 243-257.
[19] BAGHERIAN H, ASHTIANI F Z, FOULADITAJAR A, et al. Comparisons between conventional, microwave- and ultrasound-assisted methods for extraction of pectin from grapefruit[J]. Chemical Engineering and Processing, 2011, 50(11-12): 1 237-1 243.
[20] 马亚琴,吴厚玖,周志钦,等. 超声波辅助提取柑桔鲜皮渣果胶的工艺研究[J]. 食品工业科技, 2012, 33(8): 287-290.
[21] 岳贤田. 超声波辅助提取桔皮中果胶的研究[J]. 广东农业科学, 2011, 5: 131-133.
[22] 蔡文,谭兴和,张喻,等. 超声波辅助提取椪柑皮果胶的工艺优化[J]. 食品与机械, 2011,27(5):103-106.
[23] ANET R J, ZORAN H, DRAGO S, et al. Ultrasound effect on physical properties of corn starch[J].Carbohydrate Polymers, 2010,79(1):91-100.
[24] 岳贤田,杨继亮. 超声辅助技术在果胶提取中的研究进展[J].河南化工, 2016,33(1):16-19.
[25] 张丽芬. 果胶多糖超声波定向降解途径及机理研究[D]. 杭州:浙江大学, 2013.
[26] 王博,孙润广,张静. 超声波强化提取对茯苓水溶性多糖结构影响的研究[J]. 应用声学, 2009, 28(3): 195-220.
[27] SESHADRI R, WEISS J, HULBERT G J, et al. Ultrasonic processing influences rheological and optical properties of high-methoxyl pectin dispersions [J]. Food Hydrocolloids, 2003, 17: 191-197.
[28] BLUMENKRANTZ N, ASBOE-HANSEN G. New method for quantitative determination of uronic acids[J]. Analytical Biochemistry, 1973,54(2):484-489.
[29] GUO Xing-feng, ZHAO Wen-ting, PANG Xue-li, et al. Emulsion stabilizing properties of pectins extracted by high hydrostatic pressure, high-speed shearing homogenization and traditional thermal methods: A comparative study[J]. Food Hydrocolloids, 2014, 35:217-225.
[30] WANG Miao-miao, HUANG Bo-hui, FAN Chuan-hui, et al. Characterization and functional properties of mango peel pectin extracted by ultrasound assisted citric acid[J]. International Journal of Biological Macromolecules, 2016, 91:794.
[31] SCHMIDT U S, SCHMIDT K, KURZ T, et al. Pectins of different origin and their performancein forming and stabilizing oil-in-water-emulsions[J]. Food Hydrocolloids, 2015, 46: 59-66.
[32] CHEN Hai-ming, FU Xiong, LUO Zhi-gang. Properties and extraction of pectin-enriched materials from sugar beet pulp by ultrasonic-assisted treatment combined with subcritical water[J]. Food Chemistry, 2015, 168: 302-310.
[33] GAIKWAD S G,PANDIT A B. Ultrasound emulsification: Effect of ultrasonic and physicochemical properties on dispersed phase volume and droplet size[J]. Ultrasonics Sonochemistry, 2008, 15: 554-563.
[34] JULIANO P, KUTTER A, CHENG L J, et al. Enhanced creaming of milk fat globules in milk emulsions by the application of ultrasound and detection by means of optical methods[J]. Ultrasonics Sonochemistry, 2011, 18: 963-973.
[35] JAMBRAK A R, MASON T J, LELAS V, et al. Effect of ultrasound treatment on particle size and molecular weight of whey proteins[J]. Journal of Food Engineering, 2014,121: 15-23.
[36] POURBAFRANI M, FORGACS G, HORVATH I S, et al. Production of biofuels,limonene and pectin from citrus wastes [J].Bioresource Technology, 2010,101(11): 4 246-4 250.
[37] SPREEN T H, GAO Z, GMITTER F, et al. An overview of the citrus industry of China[J]. Proc Fla State Hort Soc, 2012,125:119-121.