拐枣,学名枳椇(Hovenia dulcis),可食部分是其膨大弯曲、形似鸡爪的果梗部分(副果,本实验研究对象),而并非坚硬的种子(枳椇子),原产于东亚地区,特别是在中国、日本、韩国,有着悠久的食用和药用历史,是一种可安全食用和开发利用的果实[1-2]。研究表明,拐枣果梗含丰富的营养成分,糖类、有机酸、维生素,以及生物活性多糖、生物碱、酚类、黄酮类化合物,具有抗氧化、缓解酒精中毒、解酒保肝等功效[3-4]。中医则认为拐枣果梗具有健胃、滋养补血等功效[5]。国内目前多以研究拐枣醋、拐枣酒等产品为主,或是研究拐枣提取物如拐枣多糖、多酚提取物的抗氧化活性为主,少有研究拐枣及其制品的抗氧化活性及其他功能特性,关于乳酸菌发酵拐枣汁及其抗氧化、抗衰老功效的相关研究也甚少。
乳酸菌是指一类能发酵糖类并产生乳酸的革兰氏阳性细菌[6],不仅能增加果蔬汁中有机酸、维生素、氨基酸、蛋白质等营养成分的含量,还能促进某些营养成分,如某些矿物质的吸收,同时能分解脂肪产生脂肪酸,相比于普通果蔬汁,经乳酸菌发酵后的营养更为丰富和完整[7-9]。而果蔬乳酸菌发酵汁一般有活菌型(即未杀灭乳酸菌)和灭菌型(即杀灭乳酸菌)2种,本文利用乳酸菌发酵工艺对拐枣汁进行发酵,制成活菌型和灭菌型2种发酵汁,通过对比其与原汁的不同自由基清除率,来评价乳酸菌发酵拐枣汁的体外抗氧化活性,同时选取果蝇作为体内试验生物,探究活菌型及灭菌型发酵拐枣汁对果蝇寿命是否有延长作用,以及对果蝇体内超氧化物岐化酶(superoncide dismutase,SOD)活力、总抗氧化活力(total antio xisant capacity,T-AOC)活力、丙二醛(malondicaldehyde,MDA)含量的影响,以此评价发酵拐枣汁延缓衰老的功能及体内抗氧化活性,以期为发酵拐枣汁的利用、拐枣保健新产品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
拐枣:购自陕西省安康旬阳县拐枣基地, 4℃冷藏备用;果胶酶:诺维信生物技术有限公司,活性5 000 U/mg;干酪乳杆菌、短乳杆菌、肠膜明串珠菌、酵母菌1383:中国微生物菌种保藏中心;野生型黑腹果蝇:由西南大学生命科学学院动物遗传学教研室供给;二苯基苦肼基自由基(DPPH):美国Sigma公司;SOD试剂盒、T-AOC试剂盒、MDA试剂盒:南京建成生物有限公司;其余均为国产分析纯:成都市科龙华工试剂厂。
1.2 仪器与设备
PAL-1数显糖度仪,上海上天紧密仪器有限公司;WFJ7200可见分光光度计,尤尼柯(上海)仪器有限公司;PHS-3C酸度计,上海仪电科学仪器股份有限公司;HWS-26电热恒温水浴锅,上海齐欣科学仪器有限公司;HDL-4台式离心机,常州市鸿科仪器厂;VD-650超净工作台,苏州净化设备有限公司;SYQ-DSX-280B高压灭菌锅,上海申安医疗器械厂;4K-15冷冻离心机,德国SIGMA公司。
1.3 试验方法
1.3.1 发酵拐枣汁制备工艺
1.3.1.1 拐枣汁工艺流程
新鲜拐枣去籽清洗沥干水分,按照料水比(g∶g)1∶1打浆,于微波炉中火灭酶3~5 min,当物料中心温度达到80~85℃时停止灭酶。冷却至室温后酶解2次,果胶酶添加量0.11%(质量分数)、酶解温度45℃、酶解时间2 h。酶解液用100目细纱布过滤,灌装于马口铁罐中,85℃下杀菌30 min,快速冷却后得到拐枣汁,4℃冷藏备用。
1.3.1.2 灭菌型乳酸菌发酵拐枣汁工艺流程
取拐枣汁按照m(干酪乳杆菌)∶m(短乳杆菌)∶m(肠膜明串珠菌)∶m(果酒酵母1383)=2∶2∶2∶1的复配比例进行接种,接种量为10%、发酵温度35℃、发酵时间41 h。发酵终止后将发酵拐枣汁4 500 r/min条件下离心15 min,过滤并灌装于耐热PET瓶,85℃下灭菌15 min,得到灭菌型发酵拐枣汁。
1.3.1.3 活菌型乳酸菌发酵拐枣汁工艺流程
取发酵拐枣汁,离心过滤后无菌条件下灌装于PET瓶,即得到活菌型发酵拐枣汁,4℃冷藏备用。
1.3.2 果蝇培养基的制备
1.3.2.1 基础培养基
在A杯中加入450 mL蒸馏水,在水温90℃左右时加入72 g葡萄糖,6 g琼脂粉,边缓慢加入边搅拌,煮沸至溶解。在B杯中加入300 mL蒸馏水,72 g玉米粉,搅拌后缓慢加入A杯,待A杯煮沸至黏稠状,停火冷却2 min左右至80℃,加入10 g酵母粉,6 mL丙酸,搅拌均匀。趁热分装到培养指管中,室温放置到凝固后再转移到培养箱中备用。
1.3.2.2 样品培养基
在基础培养基中添加发酵拐枣汁溶液,分别配制浓度梯度为 5、10、15 g/L的低中高3组剂量的培养基,搅拌均匀后立即分装到培养指管中,室温放置到凝固后再转移到培养箱中备用。
1.3.3 体外抗氧化活性的测定
DPPH自由基清除率的测定参考文献[10-11];OH自由基清除率的测定参考文献[12];ABTS阳离子自由基清除率的测定参考文献[11,13];超氧阴离子自由基清除率的测定参考文献[14-15]。
1.3.4 发酵拐枣汁果蝇寿命的测定
参考文献计算果蝇的半数死亡时间、平均寿命、最高寿命、寿命延长率和存活率,并绘制生存曲线,以每组最后10只果蝇寿命的算术平均数作为最高寿命。
半数死亡时间(median lethal time,LT50)如公式(1)所示:
LT50/d=第50只果蝇死亡时间(n=100)
(1)
平均寿命(mean life-span,MLS)如公式(2)所示:
(2)
式中:xi,第i次记录时的果蝇死亡数;di,第i次记录时死亡果蝇的存活天数;n,果蝇总数,100。
平均最高寿命(maximum mean life-span, MMLS)如公式(3)所示:
(3)
式中:xi′,第i次记录时最后10只果蝇的死亡数;di′,第i次记录时最后10只果蝇中死亡果蝇的存活天数;n′,最后存活的10%果蝇总数,10。
寿命延长率如公式(4)所示:
平均寿命延长率![]()
(4)
式中:x1,实验组果蝇平均寿命;x0,空白组果蝇平均寿命。
存活率如公式(5)所示:
存活率![]()
(5)
式中:xi,第i次记录时存活果蝇的数量;n,果蝇总数,100。
1.3.5 果蝇体内SOD活力、总抗氧化T-AOC活力、丙二醛(MDA)含量的测定
分别收集1 600只羽化1 d内未交配的雌雄果蝇,随机分为4个浓度梯度组(0、5、10、15 g/L),每组雌雄果蝇各10管,每管40只,每4 d更换1次培养基,于第20、40天时麻醉雌雄果蝇各5管。称取全部果蝇,用生理盐水(1∶49,g ∶mL)制成20 g/L的组织匀浆,在冰浴条件下用玻璃匀浆器制备匀浆。于4℃,2 500 r/min离心15 min,收集上清液,根据试剂盒按步骤测定每组果蝇组织上清液中总SOD活性、总抗氧化能力T-AOC及MDA含量,单位分别为:U/mg蛋白、L/mg蛋白和nmol/mg蛋白,重复试验3次。
1.3.6 果蝇体内蛋白质含量的测定
采用考马斯亮蓝法[16-17]。以蛋白质质量浓度(g/L)为横坐标,吸光度A为纵坐标绘制标准曲线,得回归方程:y=6.596 5x+0.047 6,R2=0.985 6。
1.4 数据处理
利用Excel 2013进行数据整理及计算, SPSS 19.0 进行数据统计分析, Origin 8.1进行作图。取3次平行实验的平均值作为实验结果,以x±s表示。
2 结果与分析
2.1 发酵拐枣汁的体外抗氧化活性
如图1所示,4种清除率与拐枣汁浓度存在良好的剂量-效应关系,随着拐枣汁浓度的增加,自由基清除率也随之升高。当稀释质量浓度为0.1 g/L时,活菌型、灭菌型及未发酵汁的DPPH自由基清除率最大,分别为95.01%、94.36%、91.69%。同时羟基自由基清除率也达到最大,分别为:92.23%、81.55%、92.23%。在测定范围内,ABTS阳离子自由基清除率最高均达98%以上,与原汁无显著性差异;当稀释质量浓度为0.2 g/L 时,超氧阴离子自由基清除率最大,活菌型、灭菌型及未发酵汁分别为:63.65%、63.65%、70.26%。总体说明发酵拐枣汁具有较强的抗氧化活性,这可能与发酵拐枣汁中的总酚、黄酮、多糖等活性物质的存在有关。
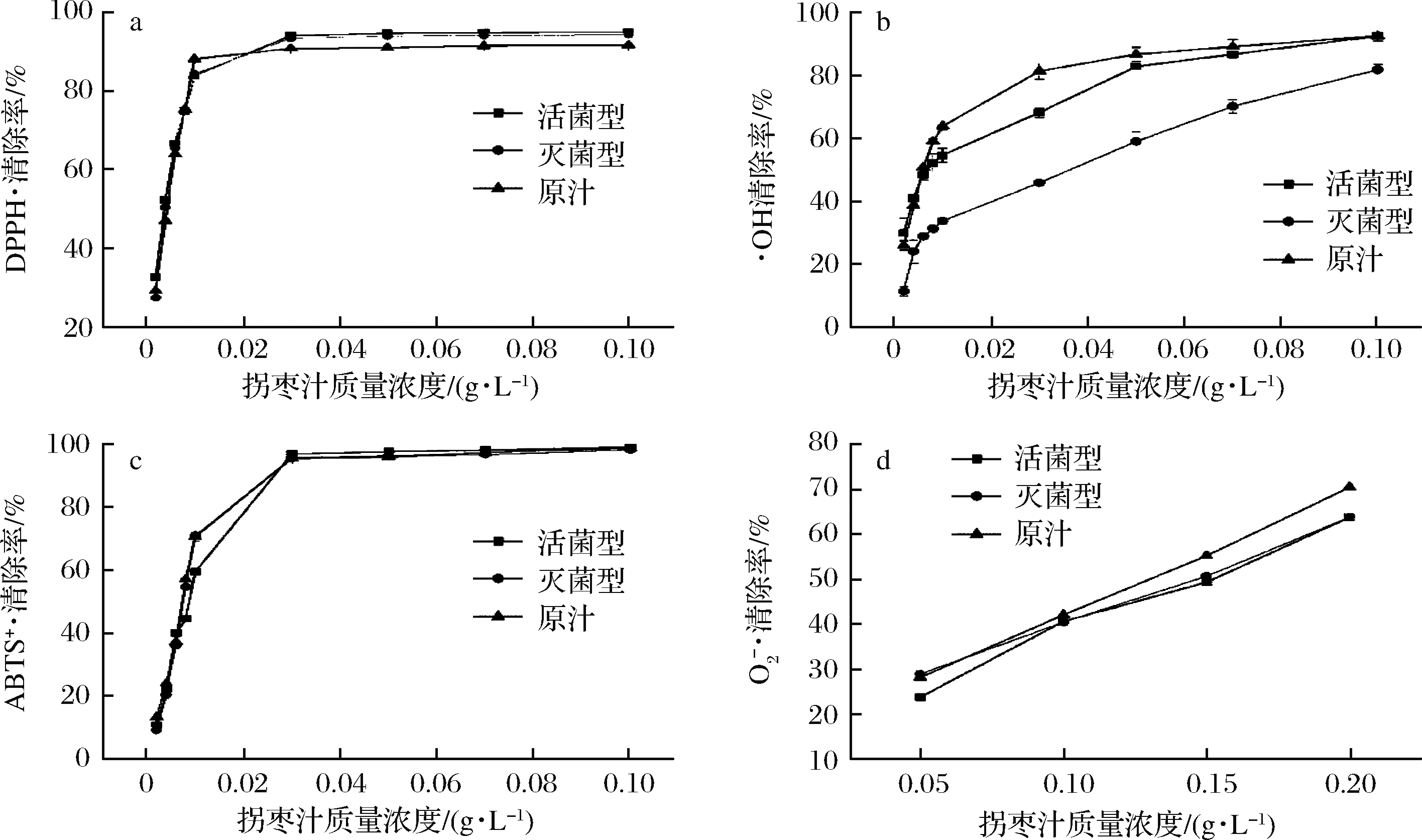
a-DPPH·清除率;b-·OH清除率;c-ABTS+·清除率;![]() 清除率
清除率
图1 发酵拐枣汁对不同自由基的清除能力
Fig.1 The ability of fermented hovenia dulcis juice to clear different free radicals
2.2 发酵拐枣汁对果蝇寿命的影响
果蝇常被作为衰老试验(生存试验)的动物模型,果蝇生存试验是判断保健食品是否具有延缓衰老作用的常用检测方法之一[18]。由表1可知,灭菌型及活菌型发酵拐枣汁饲喂雌雄果蝇的LT50、MLS及MMLS均显著高于CK组(P<0.01或0.05),且寿命随着发酵拐枣汁浓度的增加而不断延长,即存在浓度依赖关系,可见发酵拐枣汁具有显著延长果蝇寿命的作用。其中,活菌型发酵拐枣汁对果蝇的延寿效果明显强于灭菌型发酵拐枣汁,可能是由于活菌型发酵拐枣汁中含有更高的抗氧化、抗衰老等生物活性物质。以活菌型发酵拐枣汁为例,随着浓度的增加,雄果蝇的LT50依次延长了9、23、31 d,雌果蝇的LT50依次延长了6、14、22 d;雄果蝇的MLS依次延长了7.39、18.82、27.62 d,延长率依次为17.79%、45.31%、66.49%,雌果蝇的MLS依次延长了5.07、12.45、20.74 d,延长率依次为14.95%、36.71%、61.16%。此外,由于雌雄果蝇对受试物的敏感性不同[19],造成了发酵拐枣汁对雌雄果蝇的影响效果不同;雄果蝇的MMLS依次延长了8.10、20.30、28.80 d,雌果蝇的MMLS依次延长了6.90、17.80、25.70 d,最高寿命能反映发酵拐枣汁对体质强壮果蝇的延寿效果及果蝇对活性物质的适应性及耐受性[20],可见雌雄果蝇对发酵拐枣汁的适应及耐受性也有所差异。
图2所示为不同剂量组饲喂果蝇的生命周期变化。各组随着饲喂剂量的增加,雌雄果蝇的存活率均不断增大,存活时间均不断增长,呈剂量-效应关系,饲喂发酵拐枣汁的果蝇存活率均明显高于对照组。在饲喂前24 d,由于果蝇处于青年生长期,因此各剂量组果蝇存活率均较高,死亡较为缓慢,各剂量组之间差异不显著(P >0.05)。随后逐渐进入衰老死亡期,存活率也加速降低,死亡速度逐渐加快。
综合表1及图2,可知乳酸菌发酵拐枣汁能显著延缓雌雄果蝇的衰老周期,提高果蝇的存活率,且存在剂量-效应关系,在实验浓度范围内,当饲喂发酵拐枣汁质量浓度为15 g/L时,延寿效果最好。
表1 不同剂量发酵拐枣汁对果蝇寿命的影响
Table 1 Effects of different doses of fermented hovenia dulcis fruit pedicel juice on the lifespan of D. melanogaster
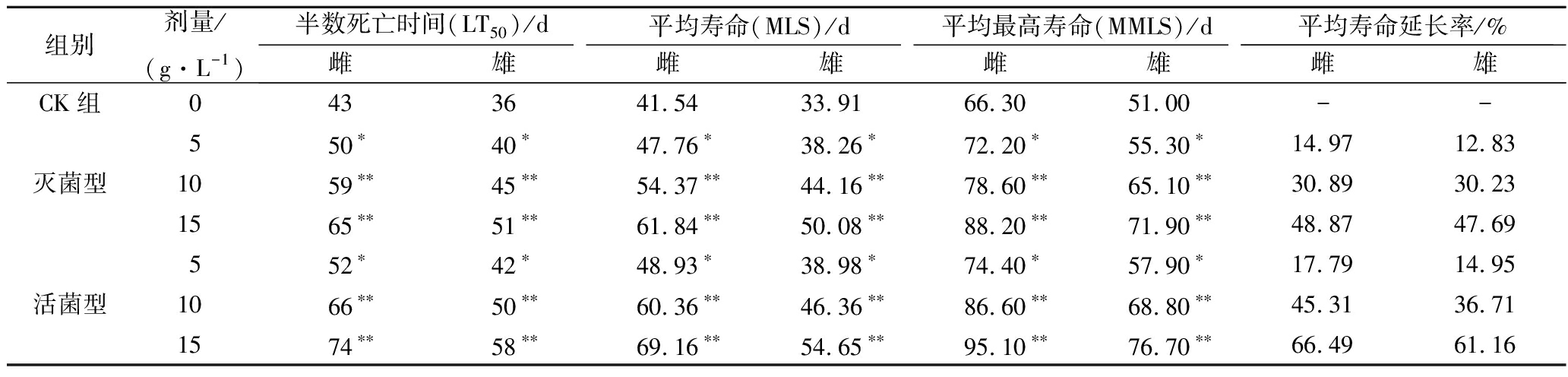
组别剂量/(g·L-1)半数死亡时间(LT50)/d平均寿命(MLS)/d平均最高寿命(MMLS)/d平均寿命延长率/%雌雄雌雄雌雄雌雄CK组0433641.5433.9166.3051.00--550∗40∗47.76∗38.26∗72.20∗55.30∗14.9712.83灭菌型1059∗∗45∗∗54.37∗∗44.16∗∗78.60∗∗65.10∗∗30.8930.231565∗∗51∗∗61.84∗∗50.08∗∗88.20∗∗71.90∗∗48.8747.69552∗42∗48.93∗38.98∗74.40∗57.90∗17.7914.95活菌型1066∗∗50∗∗60.36∗∗46.36∗∗86.60∗∗68.80∗∗45.3136.711574∗∗58∗∗69.16∗∗54.65∗∗95.10∗∗76.70∗∗66.4961.16
注:*表示各剂量组与CK组相比差异显著,P<0.05;**表示各剂量组与CK组相比差异极显著,P<0.01。下同。
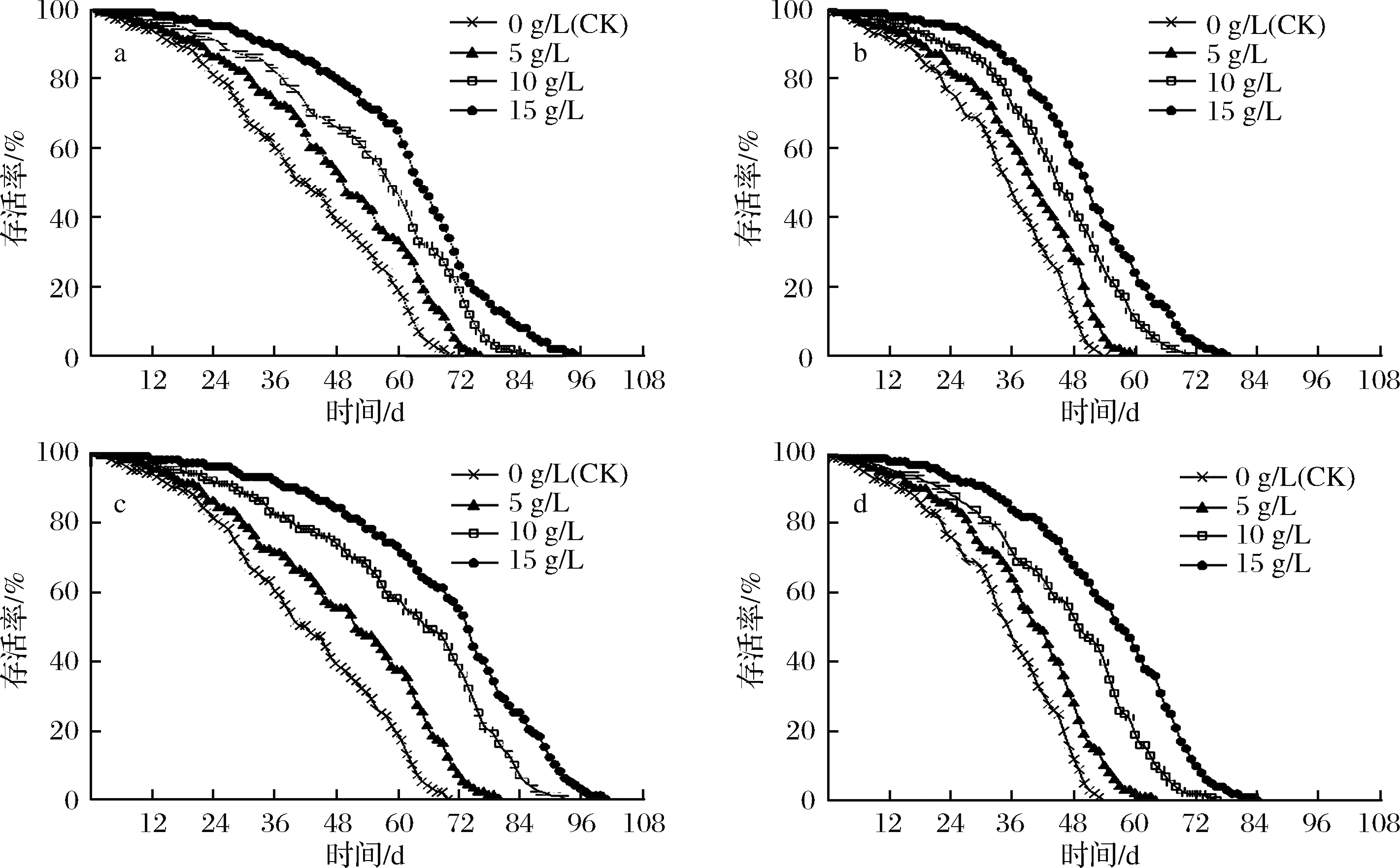
a-灭菌型饲养的雌果蝇存活率;b-灭菌型饲养的雄果蝇存活率;c-活菌型饲养的雌果蝇存活率;d-活菌型饲养的雄果蝇存活率
图2 不同剂量发酵拐枣汁对果蝇存活率的影响
Fig.2 Effects of different doses of fermented hovenia dulcis fruit pedicel juice on the survival rate of D. melanogaster
2.3 发酵拐枣汁对果蝇体内T-SOD酶活力的影响
由表2可知,随着发酵拐枣汁浓度增加,雌雄果蝇在第20天及40天的体内T-SOD活性均不断增强,且与CK组存在极显著差异(P<0.01)。其中,活菌型发酵拐枣汁对雌雄果蝇体内T-SOD酶活力提升又强于灭菌型。以活菌型为例,在饲喂第20天时,当剂量为15 g/L时,雌雄果蝇体内T-SOD活力最大,分别为429.85、431.53 U/mg蛋白;在饲喂第40天时,同样当剂量为15 g/L时,雌雄果蝇体内T-SOD活力最大,分别为248.06、255.60 U/mg蛋白。其中,饲喂40日龄较20日龄果蝇体内T-SOD活力显著降低(P<0.05),这是因为40日龄果蝇开始进入衰老期,而20日龄果蝇正处于青年生长期,因此20 d龄果蝇体内T-SOD酶活力更强。实验结果与张欣文等的研究结果基本一致[21]。
2.4 发酵拐枣汁对果蝇体内T-AOC活性的影响
由表3可知,随着发酵拐枣汁浓度增加,雌雄果蝇在第20天及40天的体内T-AOC活性不断增强。除灭菌型5 g/L饲喂40 d的雌果蝇体内T-AOC活性与CK组相比未显著提高外(P >0.05),其余剂量组基本极显著高于CK组(P<0.01)。其中,活菌型发酵拐枣汁对雌雄果蝇体内T-AOC活性提升又强于灭菌型。以活菌型为例,在饲喂第20天时,当剂量为15 g/L时,雌雄果蝇体内T-AOC活性最大,分别为4.92、5.06 L/g蛋白;在饲喂第40天时,同样当剂量为15 g/L时,雌雄果蝇体内T-AOC活性最大,分别为3.75、3.83 L/g蛋白。表明活菌型及灭菌型均能显著增强雌雄果蝇体内T-AOC活性。
表2 不同剂量发酵拐枣汁对果蝇T-SOD酶活力的影响
Table 2 Effects of different doses of fermented Hoveniadulcis fruit pedicel juice on T-SOD activity in D. melanogaster

组别剂量/(g·L-1)雌果蝇T-SOD活力/[U·(g蛋白)-1]雄果蝇T-SOD活力/[U·(g蛋白)-1]20 d40 d20 d40 dCK组0259.38±1.80143.78±0.00262.42±0.80144.34±0.475283.29±0.00∗∗153.89±0.48∗∗289.68±0.55∗∗158.45±5.58∗∗灭菌型10316.80±0.69∗∗208.86±0.59∗∗340.72±0.61∗∗214.31±0.00∗∗15390.81±1.65∗∗239.37±0.62∗∗397.77±0.68∗∗249.83±0.59∗∗5291.20±0.66∗∗195.57±0.00∗∗314.03±0.58∗∗200.07±0.55∗∗活菌型10349.85±0.76∗∗227.51±0.60∗∗359.41±0.65∗∗231.56±0.00∗∗15429.85±6.00∗∗248.06±0.00∗∗431.53±0.74∗∗255.60±0.66∗∗
表3 不同剂量发酵拐枣汁对果蝇T-AOC活性的影响
Table 3 Effects of different doses of fermented Hoveniadulcis fruit pedicel juice on T-AOC activity in D. melanogaster

组别剂量/(g·L-1)雌果蝇T-SOD活性/[L·(g蛋白)-1]雄果蝇T-SOD活力/[L·(g蛋白)-1]20 d40 d20 d40 dCK组02.74±0.142.19±0.032.81±0.022.66±0.0553.14±0.09∗2.21±0.023.44±0.02∗∗3.15±0.03∗灭菌型103.66±0.37∗∗2.55±0.07∗∗4.30±0.33∗∗3.48±0.03∗∗154.27±0.03∗∗3.27±0.04∗∗4.86±0.09∗∗3.77±0.06∗∗53.31±0.03∗∗2.78±0.07∗∗3.62±0.21∗∗3.24±0.05∗∗活菌型104.34±0.20∗∗3.38±0.02∗∗4.48±0.10∗∗3.60±0.02∗∗154.92±0.13∗∗3.75±0.03∗∗5.06±0.42∗∗3.83±0.04∗∗
2.5 发酵拐枣汁对果蝇体内MDA含量的影响
由表4可知,随着发酵拐枣汁浓度增加,雌、雄果蝇在第20天及40天的体内MDA含量呈降低趋势。当饲喂浓度为15 g/L时,用活菌型饲喂20 d的雌雄果蝇体内MDA含量分别为1.07、0.58 mmol/mg蛋白,饲喂40 d的雌雄果蝇体内MDA含量分别为4.57、2.59 mmol/mg蛋白;用灭菌型饲喂20 d的雌雄果蝇体内MDA含量分别为1.40、0.75 mmol/mg蛋白,饲喂40 d的雌雄果蝇体内MDA含量分别为4.87、3.46,均显著低于对应CK组MDA含量(P<0.05),表明活菌型及灭菌型均能显著降低雌雄果蝇体内MDA含量。
表4 不同剂量发酵拐枣汁对果蝇MDA含量的影响
Table 4 Effects of different doses of fermented Hoveniadulcis fruit pedicel juice on MDA content in D. melanogaster
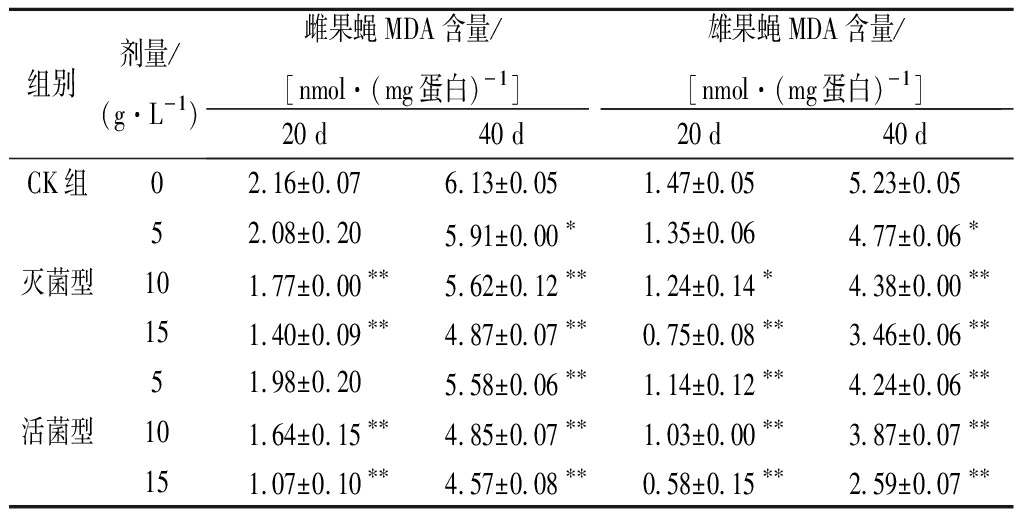
组别剂量/(g·L-1)雌果蝇MDA含量/[nmol·(mg蛋白)-1]雄果蝇MDA含量/[nmol·(mg蛋白)-1]20 d40 d20 d40 dCK组02.16±0.076.13±0.051.47±0.055.23±0.0552.08±0.205.91±0.00∗1.35±0.064.77±0.06∗灭菌型101.77±0.00∗∗5.62±0.12∗∗1.24±0.14∗4.38±0.00∗∗151.40±0.09∗∗4.87±0.07∗∗0.75±0.08∗∗3.46±0.06∗∗51.98±0.205.58±0.06∗∗1.14±0.12∗∗4.24±0.06∗∗活菌型101.64±0.15∗∗4.85±0.07∗∗1.03±0.00∗∗3.87±0.07∗∗151.07±0.10∗∗4.57±0.08∗∗0.58±0.15∗∗2.59±0.07∗∗
3 结论
本文利用DPPH·、·OH、ABTS+·清除率等指标评价乳酸发酵拐枣汁的体外抗氧化活性,同时检测了其对果蝇寿命和体内抗氧化的影响。研究发现随着活菌型及灭菌型拐枣汁饲喂剂量的增大,雌雄果蝇体内T-SOD、T-AOC活性均不断增强,MDA含量不断降低,呈剂量-效应关系。综上活菌型和灭菌型发酵拐枣汁具有较强的抗氧化活性,同时还具有明显延长果蝇寿命、延缓果蝇衰老、提高果蝇体内抗氧化活性的作用,为以后发酵拐枣汁的实际开发利用提供理论基础。
[1] 赵国平.中药大辞典[M].上海:上海科学技术出版社, 2009.
[2] HYUN T K, EOM S H, YU C Y, et al. Hovenia dulcis-an Asian traditional herb[J]. Planta Medica, 2010,76(10):943-949.
[3] 王婷婷,李华,王华,等.拐枣的功效成分及加工利用[J].中国食物与营养,2018,24(10):21-26.
[4] 李寒冰,吴宿慧,王凌潇,等.鲜拐枣汁对酒精致急性肝损伤小鼠的保护作用研究[J].中药药理与临床,2018,34(4):110-115.
[5] 何涛,杜瀛琨,蓝伦礼,等.枳椇子的研究概况[J].云南中医中药杂志, 2009,30(5):64-66.
[6] LEBEER S, VANDERLEYDEN J,DE KEERSMAECKER S C J. Genes and molecules of lactobacilli supporting probiotic action[J]. Microbiol Mol Biol Rev, 2008,72(4):728-764.
[7] 丘裕.益生菌果蔬汁的研究进展[J].现代食品, 2016,7(13):70-73.
[8] 王超,林小晖,杜冰.乳酸菌发酵型饮料的研究现状与前景[J].饮料工业, 2018,21(1):68-70.
[9] 陈历水,丁庆波,吴伟莉,等.发酵果蔬汁的功能特性研究进展[J].食品工业科技, 2012,33(11):418-421.
[10] RUMBAOA R G O, CORNAGO D F, GERONIMO I M. Phenolic content and antioxidant capacity of Philippine sweet potato (Ipomoea batatas) varieties[J]. Food Chemistry, 2009,113(4):1 133-1 138.
[11] 范金波,蔡茜彤,冯叙桥,等.5种天然多酚类化合物抗氧化活性的比较[J].食品与发酵工业, 2014,40(7):77-83.
[12] 綦菁华,王有年,于同泉,等.不同品种桃的酚类活性成分及其抗氧化功能研究[J].食品与发酵工业, 2006,32(1):103-106.
[13] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine, 1999,26(9-10):1 231-1 237.
[14] 潘丽军,孙潇雅,姜绍通.紫薯复合饮料的质量指标、营养成分及抗氧化性分析[J].食品科学, 2013,34(20):165-169.
[15] 张碧莹,钱籽霖,唐玲,等.甘薯汁对果蝇寿命及抗氧化能力的影响[J].食品科学,2019,40(5):197-201.
[16] 王孝平,邢树礼.考马斯亮蓝法测定蛋白含量的研究[J].天津化工, 2009,23(3):40-42.
[17] 中华人民共和国国家质量监督检验检疫总局. SN/T 3926-2014 出口乳、蛋、豆类食品中蛋白质含量的测定考马斯亮蓝法[S].北京:中国标准出版社, 2014.
[18] 陈纯.紫薯提取物对果蝇和线虫抗氧化作用的研究[D].天津:天津科技大学, 2016.
[19] 王娟,任莉萍,屈长青,等.香椿子对果蝇的寿命及其抗氧化相关指标的影响作用[J].天然产物研究与开发, 2015,27(11):1 858-1 861;1 865.
[20] 胡莎.根皮苷对果蝇抗衰老的机理研究[D].天津:天津科技大学, 2012.
[21] 张欣文,徐思红,厉曙光.果蝇体内SOD和MDA随增龄变化及其与寿命的关系[J].中国公共卫生, 2000,16(3):222-223.