酪蛋白(casein, Cas)在牛乳中占牛乳蛋白含量的80%,是一种全价蛋白质,具有较高的营养特性,含人体必需的8种氨基酸,是生物体氨基酸的优质供给源。同时,酪蛋白具备起泡性、乳化性及凝胶性等多种功能特性。随着食品工业的发展及人们日益增长的需求,酪蛋白在食品工业的应用越发广泛。然而,诸如溶解性差等缺点,却成为影响酪蛋白推广应用的短板[1],因此,对酪蛋白进行改性的呼声不断。蛋白改性方法较多,如利用改变或修饰蛋白结构以改善或加强蛋白功能特性的蛋白质改性法[2-3],应用广泛且效果明显的化学改性法[4]。而未添加任何化学物质的美拉德反应糖基化接枝改性蛋白质的方法,反应条件温和安全,是一种绿色有效的蛋白质改性方法[5-6],该方法基于Maillard反应机理,利用蛋白质分子的ε-氨基与糖的还原性末端羰基共价结合的羰氨缩合反应完成对蛋白质的改性[1]。
目前关于蛋白质糖基化改性的研究主要集中在植物性蛋白,如大豆蛋白[7]、小麦蛋白[8]、玉米蛋白[9-10]、花生蛋白[3]、大米蛋白[11]等蛋白与葡萄糖,麦芽糊精,葡聚糖等糖的糖基化改性研究。而利用糖基化改性动物蛋白的研究较少,少数对鸡蛋蛋白、乳清蛋白和酪蛋白糖基化改性的研究,则集中在干法糖基化改性,并且都只针对某一种糖与蛋白质发生美拉德反应的改性研究,而关于不同聚合度及结构差异糖类对酪蛋白发生糖基化接枝改性影响的研究则未见报道。
研究表明,糖作为改性反应物,其聚合度及其结构差异会使糖基化反应活性存在差异[12]。因此,本实验根据聚合度及结构差异选取8种代表性糖,通过分析其接枝及性能差异,探究不同种类糖对酪蛋白发生糖基化接枝改性的影响。从而为糖基化改性蛋白质方法中改性物的选择提供一定的数据支撑,以便酪蛋白糖基化接枝改性工作能够更好的开展。
1 材料与方法
1.1 材料与试剂
酪蛋白、β-环糊精、邻苯二甲醛/OPA(CP)、卵磷脂、β-巯基乙醇(≥99.0%),美国Sigma公司;葡萄糖(分析纯),成都金山化学试剂有限公司;麦芽糖(95%)、D-果糖(99%),源叶生物公司;葡聚糖20 000/右旋糖酐(生物试剂)、葡聚糖40 000/右旋糖酐40(生物试剂)、十二烷基硫酸钠、2-硫代巴比妥酸(生物试剂),国药集团化学试剂有限公司;乳糖,上海博微生物科技有限公司;麦芽糊精(食品级),山东西王食品有限公司;大豆油(食品级),合力超市;甲醇、HCl、FeCl2等其他试剂均为分析纯。
1.2 仪器与设备
CP214电子分析天平,奥豪斯仪器有限公司;Seven2GoTMpH计,梅特勒-托利多仪器(上海)有限公司;HH系列数显恒温水浴锅,江苏科析仪器有限公司;HJ-6A多头磁力搅拌器,金坛市文华仪器有限公司;TG16-WS台式高速离心机,上海卢湘仪离心机仪器有限公司;XHF-DY高速分散器,宁波新芝生物科技股份有限公司;L5S紫外可见分光光度计,上海仪电分析仪器有限公司;SB25-12DT超声清洗器,上海冠特超声仪器有限公司;CTFD-12S冷冻干燥机,青岛永合创信电子科技有限公司;酶标仪(SpectraMAX190),美国Molecular Devices公司。
1.3 试验方法
1.3.1 酪蛋白糖基化处理
准确称取一定量酪蛋白于pH为7.4的缓冲溶液中搅拌2 h充分溶解,制备质量浓度为60 g/L的均一蛋白溶液,按照质量比为3∶2加入糖溶解混合后超声20 min[13-14]。将体系置于90℃恒温水浴锅中加热并搅拌反应180 min,结束后迅速冷却至室温终止反应,冷冻干燥得到酪蛋白糖基化改性产物待用。
1.3.2 接枝度测定
接枝度(degree of graft, DG)的测定采用OPA法[15],精确称取邻苯二甲醛(O-Phthalaldehyde)40 mg于1 mL甲醇溶液中,充分溶解后加入2.5 mL 20%(质量分数)十二烷基硫酸钠(sodium dodecyl sylfate),25 mL 0.1 mol/L-1的硼砂溶液和100 μL的β-巯基乙醇混匀后用蒸馏水定容至50 mL的容量瓶中。测定时,取200 μL/mL质量浓度为3 g/L的样品溶液于试管中加入4 mL OPA试剂,同时以蒸馏水代替样品溶液作空白对照;充分混匀后放置35℃的恒温水浴锅中避光反应2 min后在340 nm下测定吸光值A340。分别测定酪蛋白与糖糖基化接枝前后的吸光度值分别为A0和At。测定时,以蒸馏水调零。按照公式(1)计算酪蛋白与糖的接枝度DG:
(1)
式中:DG,接枝度,%;A0,接枝前的吸光度值;At,接枝后的吸光度值。
1.3.3 褐变指数的测定
参照GU和PIRESTANI等的方法[16-17]略作调整,取反应后的样品溶液1 mL,加入5 mL 1 g/L SDS稀释液,混合均匀,在420 nm下测定吸光值A420,以稀释液作为空白。通过测定美拉德糖基化反应产物在420 nm处的吸光度。测定时,以蒸馏水调零。以吸光度的大小反映美拉德糖基化反应的褐变程度。
1.3.4 抗脂质氧化能力测定
参照ZHANG等[18]的方法,精确称取卵磷脂溶解于0.01 mol/L、pH 7.4的磷酸缓冲溶液中配制质量浓度为10 g/L的卵磷脂溶液,标记为LLS溶液。精确称量三氯乙酸(trichloroacetic acid,TCA)15 g、2-硫代巴比妥酸(thiobarbituric acid,TBA)0.37 g,溶解后加入浓HCl 2 mL,以蒸馏水定容至100 mL,标记为TCA/TBA/HCl。
测定时向试管中依次加入1 mL样品溶液、1 mL LLS和1 mL 400 μmol/L的FeCl3,同时以蒸馏水代替样品溶液作为空白对照,混匀后将体系置于37℃恒温水浴中水浴60 min后加入2 mL TCA/TBA/HCl溶液混匀,煮沸15 min后取出迅速冷却,将冷却后的溶液于8 400 r/min离心10 min,取上清液于532 nm测定其吸光度,样品组的吸光度记为AS,空白管的吸光度记为AC。测定时,以蒸馏水调零。抗脂质氧化能力I按公式(2)计算:
(2)
式中:I,抗脂质氧化能力,%;AS,样品组的吸光度值;AC,空白组的吸光度值。
1.3.5 乳化活性及乳化稳定性测定
参照PEARCE的方法[19],略有改动。将样品0.6 g溶于15 mL浓度为0.1 mol/L、pH 7.4的磷酸缓冲溶液中,取6 mL于在试管中加入2 mL大豆油,使最终油相体积分数为25%,以10 000 r/min的高速剪切均质分散1 min,因蛋白质产生大量泡沫影响精准度,故分别于静置1、3、6、10、15 min后从乳浊液底部吸取100 μL加入5 mL 0.1%的SDS溶液中,混匀后在500 nm处测定样品吸光度值,以0.1%的SDS溶液作为空白组。测得吸光度分别记为A1、A3、A6、A10、A15。乳化活性用EAI来表示;乳化稳定性用乳化稳定指数ESI表示,分别如公式(3)、(4)计算:
(3)
式中:EAI,每克蛋白质的乳化面积,m2/g;T,2.303;A0,起始的吸光值;N,稀释倍数,50;φ,体系中油相所占的体积分数,25%;C,蛋白质的浓度,g/mL;L,比色光径,1 cm。
(4)
式中:ESI,乳化稳定性;A0,起始的吸光值;At,t时刻的吸光值;Δt,时间差。
1.4 数据统计与分析
实验均同时设置3组平行,结果以均值±标准差表示。采用SPSS 20.0软件进行数据统计分析并进行Duncan多重比较,以显著性水平为0.05进行差异显著性分析,以Origin 2018软件绘图。
2 结果与分析
2.1 不同种类糖与酪蛋白糖基化接枝度的测定
根据检测结果,经分析后对酪蛋白-葡萄糖共价接枝产物(Cas-Glc)、酪蛋白-D-果糖共价接枝产物(Cas-Fru)、酪蛋白-麦芽糊精共价接枝产物(Cas-Md)、酪蛋白-麦芽糖共价接枝产物(Cas-Mal)、酪蛋白-葡聚糖20 000共价接枝产物(Cas-Dex20 000)、酪蛋白-葡聚糖40 000共价接枝产物(Cas-Dex40 000)、酪蛋白-β-环糊精共价接枝产物(Cas-β-Cd)、酪蛋白-乳糖共价接枝产物(Cas-Lac)的接枝度进行表征,结果如图1所示。

图1 不同种类糖的酪蛋白糖基化产物接枝度
Fig.1 Grafting degree of products glycosylation modifiedby casein with different kinds of sugar注:图中标注不同小写字母表示样品间差异显著(P<0.05)。下同。
相同糖基化接枝条件下,Cas-Glc的接枝度最高,达到(25.03±1.01)%,显著高于其他7种糖(P<0.05),其次是Cas-Mal、Cas-Dex20 000、Cas-Dex40 000,接枝度分别为(18.06±1.01)%、(15.27±1.06)%和(13.23±0.65)%;其中,Cas-Dex20 000的接枝度显著高于Cas-Dex40 000 (P<0.05)。
在醛糖Mal和Glc中,Glc分子量最小,Cas-Dex20 000分子量小于Cas-Dex40 000,可见糖基化接枝度可能与糖的分子量大小密切相关,有研究报道物质的分子量较小,在溶液中的迁移速率更快[7, 20]。糖分子尺寸增大,还原性末端的亲电性降低会减小蛋白糖基化速率和程度,因此,相同接枝条件和时间下,糖分子量越小,糖基化程度也就越完全,陈颖佳[12]等人的研究结果也很好的说明了这一点。然而,同属于单糖的D-果糖却未得到如上效果,推测出现这样的原因很可能与其分子结构有关系,因葡萄糖有醛基(-CHO)属醛糖,而D-果糖含有羰基(-CO-)属酮糖,不同结构糖糖基化位点选择不同则糖基化程度也会出现差异,这与施振华[21]等人的研究结果一致,醛糖的糖基化反应高于酮糖。
2.2 不同种类糖与酪蛋白糖基化接枝改性褐变指数测定
随着美拉德糖基化接枝反应的进行,体系会发生一定的褐变。反应程度越大,褐变也将会随之加重,褐变程度过高,会影响产物色泽,不利于产品的进一步应用。因此接枝进程的控制尤为重要,既要获得尽可能高的接枝度,同时应最大限度地保证产品色泽。实验酪蛋白加热前后及与不同种类糖进行糖基化接枝改性后的指数变化结果如图2所示。
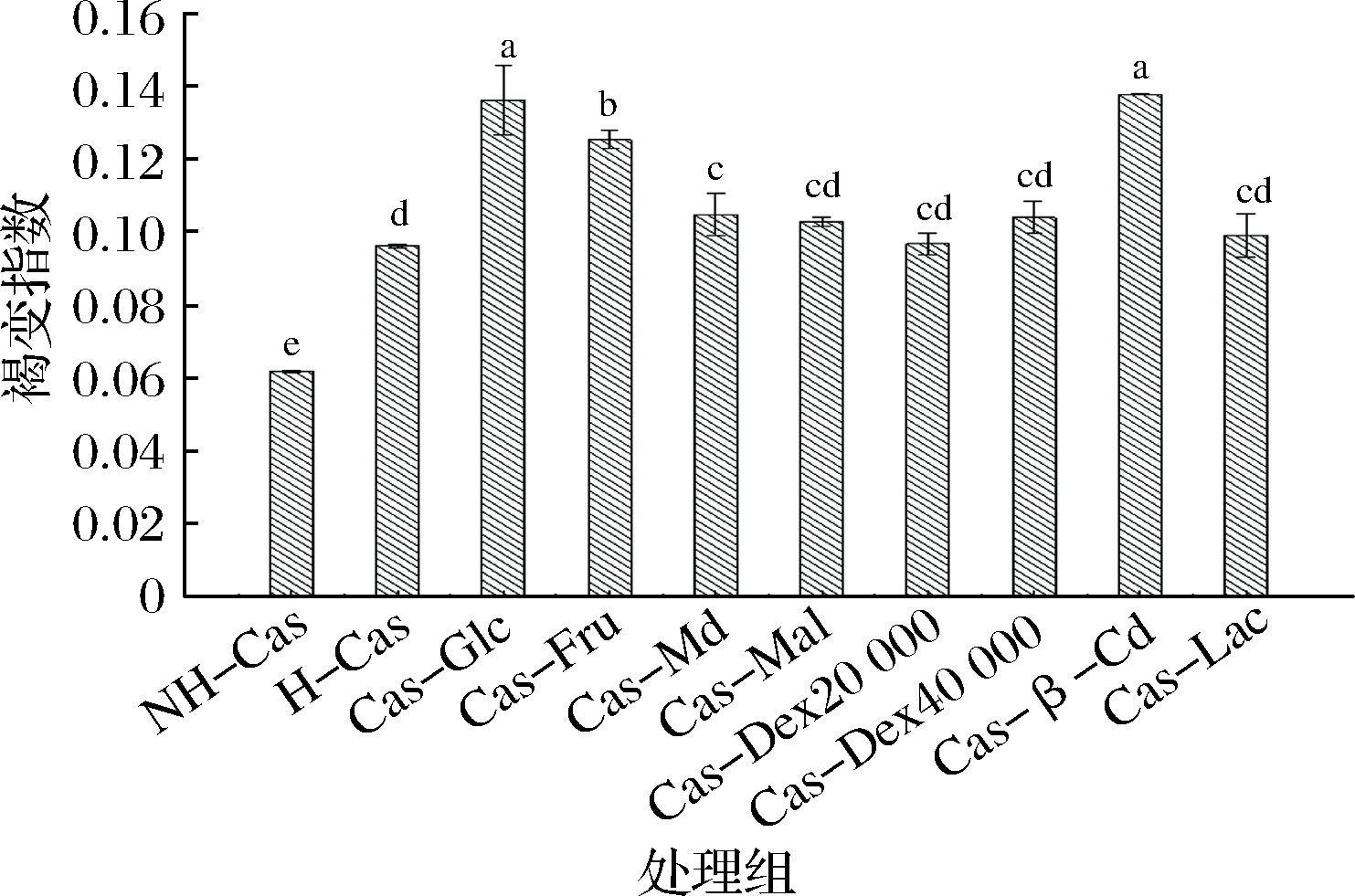
图2 不同种类糖的酪蛋白糖基化接枝改性产物褐变指数
Fig.2 The browning of products glycosylation modifiedby casein with different kinds of sugar
结果显示,酪蛋白加热后(H-Cas)褐变指数显著高于加热前(NH-Cas),可见在酪蛋白溶解-加热这个过程其自身会发生一定程度的褐变。与H-Cas褐变指数相比,具有一定接枝度的Cas-Mal、Cas-Dex20 000、Cas-Dex40 000褐变指数相对较小且差异不显著(P>0.05)。而具有最好接枝度的Cas-Glc与接枝度较低的Cas-β-Cd之间的褐变指数差异不显著(P>0.05),且显著高于其他种类糖(P<0.05),这可能与糖的种类有关。不同糖的分子质量、结构和性质也各有差异,如β-环糊精由7个D-吡喃葡萄糖基单位,以α-1,4-键组合的非还原性环状多糖,微溶于冷水和乙醇,不具有还原性末端,而具有一定抗氧化性。由此可得Cas-Mal、Cas-Dex20 000和Cas-Dex40 000在一定程度上能够满足有一定接枝度且褐变指数较低的糖基化产物需求,加之其营养和功能特性,在食品中应用前景广阔。
2.3 不同种类糖与酪蛋白糖基化接枝改性产物抗脂质氧化能力测定
卵磷脂常被用作细胞模型来研究体外脂质过氧化,是因为卵磷脂中的C-2位上的低密度脂蛋白(low density lipoprotein, LDL)和极低密度脂蛋白(very low density lipoprotein,VLDL)的不饱和脂肪酸在铁离子的催化下发生过氧化,因此建立以铁离子诱发卵磷脂C-2位上的LDL和VLDL、过不饱和脂肪酸的氧化模型,用来评价糖基化产物的抗脂质氧化能力[22]。由图3可知,酪蛋白与不同种类糖进行糖基化接枝所得产物,除Cas-Fru具有促进脂质氧化能力外,其他皆具有一定抗脂质氧化能力。
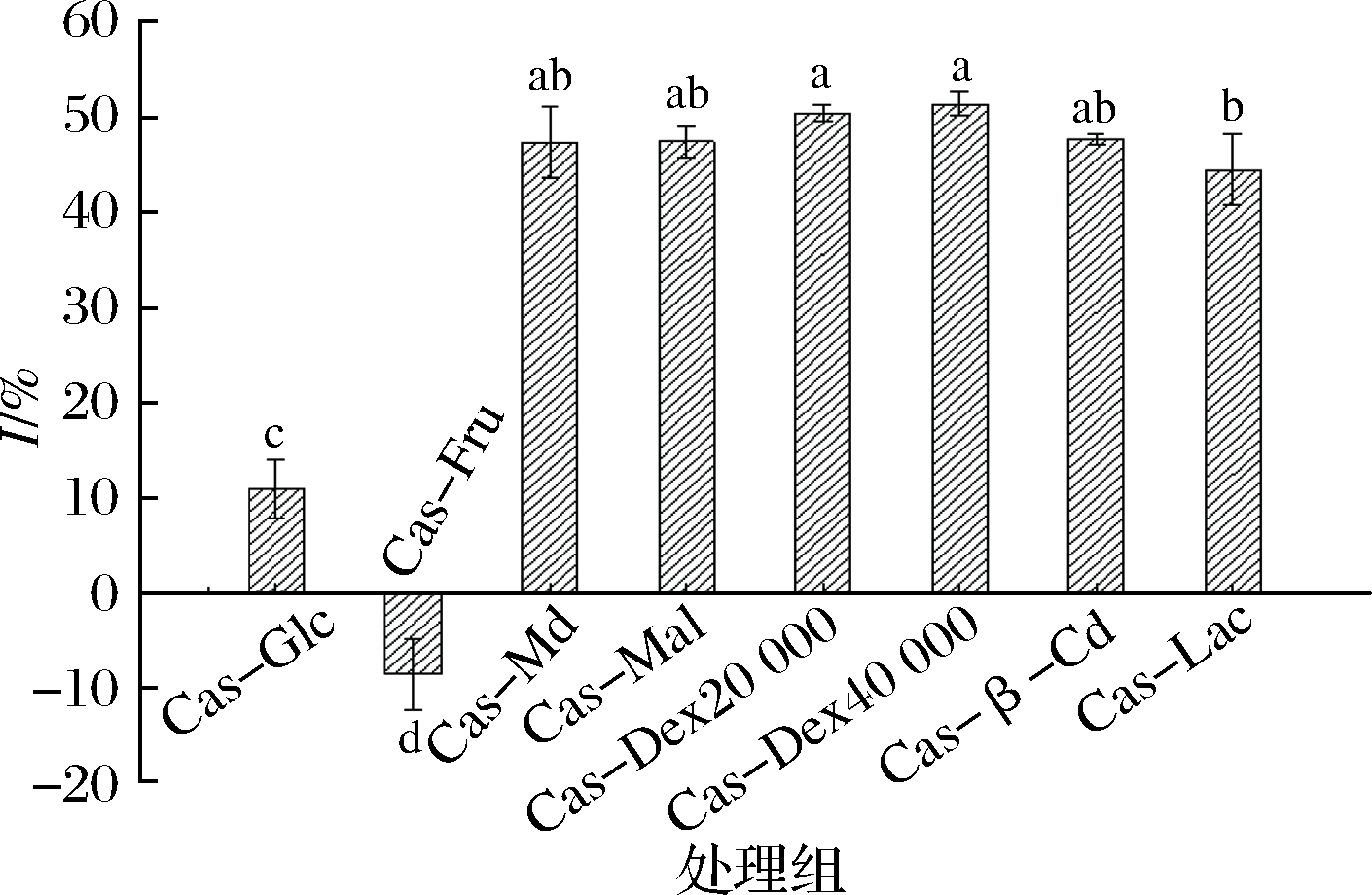
图3 不同种类糖与酪蛋白糖基化改性产物的抗脂质氧化能力
Fig.3 The anti-lipid oxidation ability of products glycosylation modified by casein with different kinds of sugar
这是由于果糖在体外比葡萄糖更具活性,能产生更高水平的自动氧化。这与SEMCHYSHYN等[23]的研究结果一致。Cas-Glc抗脂质氧化能力显著低于其他糖类(P<0.05),这可能与其分子质量较小、难以形成稳定的抗脂质氧化物质有关[20]。而分子质量较大的Cas-Dex20 000、Cas-Dex40 000、Cas-β-Cd、Cas-Md等的抗脂质氧化能力不存在显著性差异(P>0.05),且具有较强的抗脂质氧化能力。而接枝度较低的Cas-β-Cd因β-环糊精本身具有一定的抗氧化特性,而表现出较高抗脂质氧化能力。可见,糖基化产物能够一定程度上抑制Fe2+引发的卵磷脂分散体系过氧化。
2.4 不同种类与酪蛋白糖基化接枝改性产物乳化活性及乳化稳定性测定
乳化活性指的是蛋白参与乳浊液形成的能力。乳化稳定性指的是乳浊液保持分散,保持在一定时间内没有发生油脂上浮、聚沉或者絮凝的能力。在蛋白质糖基化接枝改性中,糖的种类,不但会影响糖基化反应的程度,还会影响糖基化产物的性能[11, 24]。酪蛋白与不同糖发生美拉德糖基化接枝的产物乳化活性及乳化稳定性情况及显著性差异分析如表1和表2所示。
表1 酪蛋白与糖糖基化接枝改性产物静置1~15min的乳化活性(EAI)的差异性分析
Table 1 The difference analysis of emulsified active EAI between casein and glycosylation graft modified products for 1-15 min
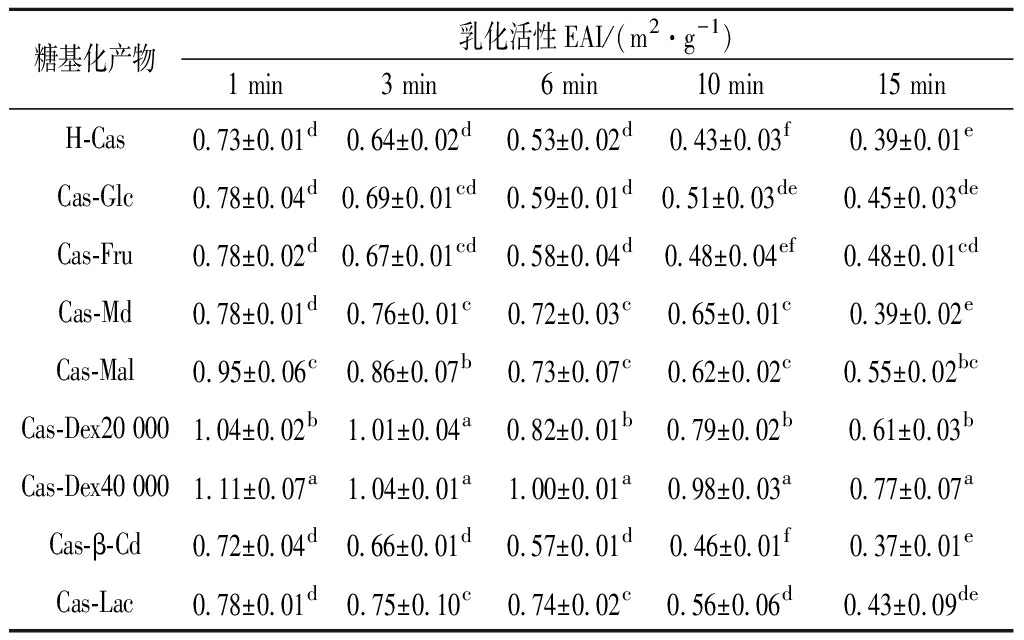
糖基化产物乳化活性EAI/(m2·g-1)1 min3 min6 min10 min15 minH-Cas0.73±0.01d0.64±0.02d0.53±0.02d0.43±0.03f0.39±0.01eCas-Glc0.78±0.04d0.69±0.01cd0.59±0.01d0.51±0.03de0.45±0.03deCas-Fru0.78±0.02d0.67±0.01cd0.58±0.04d0.48±0.04ef0.48±0.01cdCas-Md0.78±0.01d0.76±0.01c0.72±0.03c0.65±0.01c0.39±0.02eCas-Mal0.95±0.06c0.86±0.07b0.73±0.07c0.62±0.02c0.55±0.02bcCas-Dex20 0001.04±0.02b1.01±0.04a0.82±0.01b0.79±0.02b0.61±0.03bCas-Dex40 0001.11±0.07a1.04±0.01a1.00±0.01a0.98±0.03a0.77±0.07aCas-β-Cd0.72±0.04d0.66±0.01d0.57±0.01d0.46±0.01f0.37±0.01eCas-Lac0.78±0.01d0.75±0.10c0.74±0.02c0.56±0.06d0.43±0.09de
注:结果表示为均值±标准差;同一列中不同小写字母表示差异显著(P<0.05)。下同。
由表1可知,与H-Cas相比,酪蛋白糖基化接枝改性产物的乳化活性均得到不同程度的改善或提高。其中Cas-Dex40 000、Cas-Dex20 000和Cas-Mal,分别显著(P<0.05)提高了52.05%、42.47%和30.14%。酪蛋白糖基化接枝处理能够在一定程度上改善或提高其乳化活性,这可能是蛋白糖基化共价接枝后,引入多糖使其原有紧密的蛋白结构被不同程度破坏,同时引入了糖链上的亲水基团,使蛋白溶解性增加[25],蛋白能够充分舒展开,暴露更多疏水基团,二级结构更加有序,在离子液体中具有更大的流体动力学半径,能有效吸附到油—水界面,降低了界面张力,利于乳化活性提高[26-27]。而接枝度较高的Cas-Glc却未见较好的乳化活性。这可能与糖自身性质和较大接枝度引入了更多亲水基团,影响对油-水界面的平衡,从而使其乳化活性降低[28]等因素有关。
同时,随静置时间的延长,乳浊液乳化活性都出现不同程度的下降。在静置15 min内H-Cas、Cas-β-Cd、Cas-Fru、Cas-Glc呈线性下降,拟合方程为:EAI=-0.023 4t+0.740 2(R2=0.934 6),而其他糖类与酪蛋白糖基化产物呈现阶段性、间歇式下降;直到静置15min时,H-Cas、Cas-Glc、Cas-β-Cd、Cas-Md及Cas-Lac的乳化活性不存在显著性差异(P>0.05),相对其他较低。
表2 酪蛋白糖基化接枝改性产物在不同时间段的乳化稳定性情况
Table 2 The emulsification stability of casein glycosylation graft modified products at different time periods
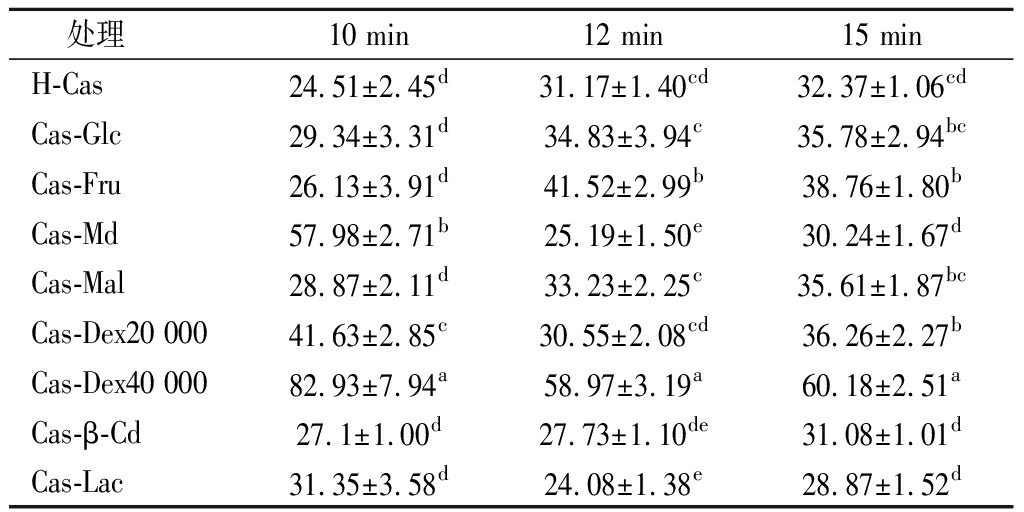
处理 10 min12 min15 minH-Cas24.51±2.45d31.17±1.40cd32.37±1.06cdCas-Glc29.34±3.31d34.83±3.94c35.78±2.94bcCas-Fru26.13±3.91d41.52±2.99b38.76±1.80bCas-Md57.98±2.71b25.19±1.50e30.24±1.67dCas-Mal28.87±2.11d33.23±2.25c35.61±1.87bcCas-Dex20 00041.63±2.85c30.55±2.08cd36.26±2.27bCas-Dex40 00082.93±7.94a58.97±3.19a60.18±2.51aCas-β-Cd27.1±1.00d27.73±1.10de31.08±1.01dCas-Lac31.35±3.58d24.08±1.38e28.87±1.52d
由表2知,酪蛋白糖基化产物乳浊液静置15 min后,接枝产物乳化稳定性由高到低依次为Cas-Dex40 000、Cas-Dex20 000、Cas-Mal、Cas-Fru和Cas-Glc。其中Cas-Lac虽然有效提高了其乳化活性,但乳化稳定性却有所下降,这与张亚婷[29]的研究结果一致。而分子质量较大的Cas-Dex40 000表现出良好的乳化活性及乳化稳定性。其乳化稳定性较H-Cas显著提高了85.91%(P<0.05),且显著高于其他接枝产物(P<0.05)。蛋白糖基化接枝反应后能够显著提高乳化稳定性,主要是因为两方面原因,一是因为糖类物质在油-水乳化体系中一定程度能够增加水相的黏度[30]。另一个就是,蛋白表面共价接枝的糖分子的空间位阻作用会使乳化剂形成的保护膜厚度增加,从而有利于乳化体系的稳定性[31]。与酪蛋白糖基化接枝的葡聚糖分子量越大,越有利于提高空间位阻效应,故Cas-Dex40 000表现出良好的乳化活性及乳化稳定性。而分子质量较小的糖类较分子质量大的糖类乳化稳定性较低,这可能是因为其与酪蛋白糖基化不能够提供足够的稳定作用[32]。
3 结论
利用湿法糖基化的改性方法,将酪蛋白分别与不同聚合度和结构差异的葡萄糖、D-果糖、麦芽糖、葡聚糖20 000、葡聚糖40 000、乳糖、麦芽糊精、β-环糊精8种糖进行糖基化共价接枝改性,探究酪蛋白与糖共价接枝改性后各特征指标的变化情况。接枝度测定结果表明醛糖中分子量较小的葡萄糖与酪蛋白共价接枝度最高。酪蛋白糖基化接枝改性产物的抗脂质氧化能力检测发现,接枝物Cas-Mal、Cas-Dex20 000和Cas-Dex40 000抗脂质氧化能力较好;乳化性及乳化稳定性考察发现,酪蛋白糖基化接枝改性后乳化活性得到不同程度提高,其中Cas-Dex40 000的乳化性较H-Cas显著提高了85.91%(P<0.05),显著高于其他糖类接枝化产物。在静置15 min内,H-Cas、Cas-β-Cd、Cas-Fru、Cas-Glc的乳化活性呈线性下降,拟合方程为:EAI=-0.023 4t+0.740 2(R2=0.934 6)。
综上所述,在不同聚合度和结构差异糖中,分子质量较大的酪蛋白与葡聚糖20 000、葡聚糖40 000和麦芽糖美拉德糖基化共价接枝改性后具有一定的接枝度,且有良好的抗脂质氧化能力和乳化能力及乳化稳定性;在单糖中,属醛糖的葡萄糖与酪蛋白接枝情况明显优于属酮糖的果糖。酪蛋白糖基化共价接枝改性条件要求不高,可操作性强。酪蛋白及麦芽糖的原料来源非常广泛,并且具有特殊营养价值。实验结果为糖基化改性蛋白质方法中原料糖的选择和复配提供一定的数据支撑,以便酪蛋白糖基化接枝改性工作能够更好的开展。同时对酪蛋白与糖的营养价值提升及在食品领域中的开发应用有积极的影响。
[1] DE OLIVEIRA F C, COIMBRA J S, DE OLIVEIRA E B, et al. Food protein-polysaccharide conjugates obtained via the Maillard reaction: A review[J]. Crit Rev Food Sci Nutr, 2016, 56(7):1 108-1 125.
[2] 魏彦杰,杨斌. 食品蛋白质改性研究[J]. 肉类研究, 2010 (5):24-27.
[3] 奥文芳,王承明,李克超,等. 超声辅助花生蛋白-低聚异麦芽糖接枝改性的研究[J]. 中国油脂, 2017, 42(12):26-31.
[4] KASRAN M, CUI S W, GOFF H D. Covalent attachment of fenugreek gum to soy whey protein isolate through natural Maillard reaction for improved emulsion stability[J]. Food Hydrocolloids, 2013, 30(2):552-558.
[5] 冯燕英,牟代臣,祁文磊,等. 蛋白质糖基化接枝改性研究进展[J]. 食品与机械, 2019, 35(2):196-201.
[6] WANG L, WU M, LIU H M. Emulsifying and physicochemical properties of soy hull hemicelluloses-soy protein isolate conjugates[J]. Carbohydrate Polymers, 2017, 163:181-190.
[7] 王鲁慧,肖军霞,徐同成,等. 湿热条件下大豆分离蛋白与葡萄糖、麦芽糖的美拉德反应[J]. 食品科学, 2018, 39(16):19-26.
[8] 臧艳妮. 物理预处理对小麦蛋白糖基化改性的影响[D].合肥:合肥工业大学, 2017.
[9] 张慧君,陈又铭,辛德慧,等. 麦芽糖浆糖基化改性玉米醇溶蛋白及在胶囊壳中的应用[J]. 食品科学, 2018, 39(14):29-35.
[10] 赵城彬,张浩,许秀颖,等. 不同分子质量葡聚糖对玉米醇溶蛋白糖基化产物结构和功能性的影响[J]. 食品科学, 2018, 39(16):68-73.
[11] LI Y, ZHONG F, JI W, et al. Functional properties of Maillard reaction products of rice protein hydrolysates with mono-, oligo- and polysaccharides[J]. Food Hydrocolloids, 2013, 30(1):53-60.
[12] 陈颖佳. 中间水分体系中β-乳球蛋白糖基化的研究[D].无锡:江南大学, 2013.
[13] 葛伟,李晓东,曲佳林,等. 超声预处理对酪蛋白美拉德反应产物抗氧化性和结构的影响[J]. 中国食品学报, 2018, 18(2):125-133.
[14] BI W, GE W, LI X, et al. Effects of ultrasonic pretreatment and glycosylation on functional properties of casein grafted with glucose[J]. Journal of Food Processing & Preservation, 2017, 41(5):1-8.
[15] CHURCH F C, SWAISGOOD H E, PORTER D H, et al. Spectrophotometric assay using o-phthaldialdehyde for determination of proteolysis in milk and isolated milk proteins[J]. Journal of Dairy Science, 1983, 66(6):1 219-1 227.
[16] GU F, KIM J M, HAYAT K, et al. Characteristics and antioxidant activity of ultrafiltrated Maillard reaction products from a casein-glucose model system[J]. Food Chemistry, 2009, 117(1):48-54.
[17] PIRESTANI S, NASIRPOUR A, KERAMAT J, et al. Preparation of chemically modified canola protein isolate with gum Arabic by means of Maillard reaction under wet-heating conditions[J]. Carbohydrate Polymers, 2017, 155:201-207.
[18] ZHANG Y, TAN C, ZHANG X,et al. Effects of maltodextrin glycosylation following limited enzymatic hydrolysis on the functional and conformational properties of soybean protein isolate[J]. European Food Research and Technology, 2014, 238(6):957-968.
[19] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins: Evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978, 26(3):716-723.
[20] JING H, NAKAMURA S. Production and use of Maillard products as oxidative stress modulators[J]. Journal of Medicinal Food, 2005, 8(3):291-298.
[21] 施振华,曾茂茂,何志勇,等. 单糖的类型对模拟体系中晚期糖基化终末产物生成的影响[J]. 食品工业科技, 2019, http://doi.org:http://kns.cnki.net/kcms/detail/11.1759.ts.20190402.1449.029.html.
[22] 金鸣,蔡亚欣,李金荣,等. 邻二氮菲-Fe2+氧化法检测H2O2/Fe2+产生的羟自由基[J]. 生物化学与生物物理进展, 1996, 23(6):553-555.
[23] SEMCHYSHYN H M, MIEDZOBRODZKI J, BAYLIAK M M, et al. Fructose compared with glucose is more a potent glycoxidation agent in vitro, but not under carbohydrate-induced stress in vivo: Potential role of antioxidant and antiglycation enzymes[J]. Carbohydr Res, 2014, 384(1):61-69.
[24] 管军军,裘爱泳,刘晓亚,等. 微波辐射大豆分离蛋白-糖接枝反应条件的研究[J]. 食品与生物技术学报, 2005, 24(5):16-20.
[25] QU W, ZHANG X, CHEN W, et al. Effects of ultrasonic and graft treatments on grafting degree, structure, functionality, and digestibility of rapeseed protein isolate-dextran conjugates[J]. Ultrasonics Sonochemistry, 2018, 42:250-259.
[26] NG S P, LAI O M, ABAS F, et al. Stability of a concentrated oil-in-water emulsion model prepared using palm olein -based diacylglycerol/virgin coconut oil blends:Effects of the rheological properties,droplet size distribution and microstructure[J]. Food Research International, 2014, 64(10):919-930.
[27] XU W, ZHAO X H. Structure and property changes of the maltose-glycated caseinate prepared through the Maillard reaction in an ionic liquid medium[J]. LWT - Food Science and Technology, 2019, 99:483-489.
[28] SPOTTI M J, MARTINEZ M J, PILOSOF A M R, et al. Influence of Maillard conjugation on structural characteristics and rheological properties of whey protein/dextran systems[J]. Food Hydrocolloids, 2014, 39:223-230.
[29] 张亚婷. 大豆蛋白酶解/糖基化接枝复合改性制备微胶囊壁材的研究[D].无锡:江南大学, 2015.
[30] COIA K A, STAUFFER K R. Shelf life study of oil/water emulsions using various commercial hydrocolloids[J]. Journal of Food Science, 1987, 52(1):166-172.
[31] HENNOCK M, RAHALKAR R R, RICHMOND P. Effect of xanthan gum upon the rheology and stability of oil-water emulsions[J]. Journal of Food Science, 1984, 49(5):1 271-1 274.
[32] 夏秀芳,洪岩,郑环宇,等. 湿法糖基化改性对大豆分离蛋白溶解性和乳化能力的影响[J]. 中国食品学报, 2016, 16(1):167-172.