胶原蛋白是一种重要的功能性多糖蛋白质,与细胞再生分化等有密切关系[1]。胶原蛋白肽是胶原蛋白的降解产物,由3~20个氨基酸组成[2],具有抗菌、抗氧化、降血压血脂、调节免疫等作用[3-5]。与胶原蛋白相比,胶原蛋白肽分子质量小、水溶性强、易消化吸收。因其显著的生理活性,广泛应用于食品,医药,化妆品等领域。与哺乳动物相比,鱼类胶原蛋白在来源的广泛性、生物安全性和产品成本等方面均具有更大的优势。目前国内外研究者已成功从鱼皮[6]、鱼骨[7]、鱼鳞[8]等副产物中制备胶原蛋白肽。
中国是世界上鲟鱼种类较多的国家,产量占世界总产量的80%以上[9]。鲟鱼目前主要用于鱼子酱的生产,在生产加工过程中鱼皮、鱼鳞和内脏等副产物利用率低,造成了严重的资源浪费和环境污染问题[10]。因此利用酶法将鲟鱼皮胶原蛋白转化为生物活性肽具有重要的经济价值和社会意义。本文采用碱性蛋白酶水解鲟鱼皮,通过单因素及正交试验优化鲟鱼皮制备胶原蛋白肽的制备工艺,并对其抗氧化活性进行了研究,旨在为鲟鱼皮的高值化加工利用提供理论依据。
1 材料与方法
1.1 材料与试剂
西伯利亚鲟鱼皮,由浙江新昌来益生态农业发展有限公司提供,除去鱼肉及非胶原组织后剪成约 2 cm×2 cm的块状,于-20℃冰箱保存备用;碱性蛋白酶(1.69×105U/g),丹麦诺维信公司;乙腈为色谱纯,其他试剂均为分析纯,上海生工生物工程有限公司。
1.2 仪器与设备
AE323型电子分析天平,上海舜宇恒平科学仪器有限公司;DK8S型消化炉、UDK152型定氮仪,意大利VELP公司; DHG-9140A型电热恒温鼓风干燥箱,杭州蓝天化验仪器厂;SX2-4-10型马沸炉,江苏骏辉电器源头厂;索氏抽提器,上海垒固仪器有限公司;Ultrospec 2100 pro型紫外分光光度计,美国GE公司;SYKAM S-433D型全自动氨基酸分析仪,德国Sykam公司;Waters 1525型液相色谱仪,美国Waters公司;Zenix-c SEC-80型色谱柱,苏州赛分科技有限公司;10000/5000/1000 Da超滤膜,美国密理博公司。
1.3 试验方法
1.3.1 基本成分分析
采用直接干燥法[12]测定水分含量;采用凯氏定氮法[13] 测定粗蛋白含量,氮换算系数为6.25; 采用羟脯氨酸测定法[14] 测定胶原蛋白含量,胶原蛋白与羟脯氨酸的转化系数为14.113; 采用索氏抽提法[15] 测定粗脂肪含量;采用高温马沸炉灼烧法[16]测定灰分含量。采用石油醚回流提取法除去鱼皮中的脂肪,于70℃下挥发除去石油醚。取0.2 g试样于水解管中,向其中加入12 mL 6 mol/L的HCl拧紧水解管螺丝盖,放入110℃烘箱中水解24 h。取出待其冷却至室温,将水解液经滤纸过滤至50 mL容量瓶中,用水进行多次润洗水解管一并过滤至容量瓶中,最后定容、混匀,水解液分析前稀释5~10倍。经氨基酸分析仪进行鱼皮中蛋白质的氨基酸组成分析。
1.3.2 鲟鱼皮预处理
将鱼皮经绞肉机搅碎,自来水清洗,纱布过滤洗去游离的脂肪。采用英国丹尼悦公司DENIE-DEG NL-L脂肪酶对鲟鱼皮进行脱脂处理,脂肪酶添加量为0.05%(质量分数),在pH 8,温度35℃,搅拌速度200 r/min的条件下处理3 h。利用1 mol/L NaCl溶液,在料液比1∶5(g∶mL),低温条件下搅拌12 h,以去除鲟鱼皮中杂蛋白。
1.3.3 酶解工艺研究
1.3.3.1 单因素试验
以水解度(degree of hydrolysis,DH)为指标进行单因素试验,分别研究料液比(1∶2、1∶3、1∶4、1∶5、1∶6、1∶7)(g∶mL)、酶解温度(40、45、50、55、60℃)、pH(7、8、9、10、11)、反应时间(1、2、3、4、5、6 h)、酶添加量(质量分数1%、2%、3%、4%、5%)对水解度的影响。
1.3.3.2 正交试验
在单因素的基础上,选择对水解度影响较强的4个因素(温度、pH、反应时间、酶添加量)进行正交试验。
1.3.4 鲟鱼皮胶原蛋白肽分子质量分析
基于多肽分子质量与自身的体积具有正相关性,利用高效凝胶排阻色谱法对酶解制备的多肽进行凝胶排阻分离测定其分子质量分布情况。色谱条件如下,凝胶色谱柱:Zenix-c SEC-80(7.8 mm×300 mm),流动相:V(乙腈)∶V(水)∶V(三氟乙酸)=40∶60∶0.05;进样量:10 μL;检测波长:220 nm。
标准品分别为抑肽酶(6 512 Da)、VB12(1 355 Da)、醋酸血管紧张素(1 091 Da)、谷胱甘肽(307 Da)、甲硫氨酸(149 Da)。在液相色谱条件相同的条件下,以相对分子质量对数对色谱保留时间作线性回归曲线,并对该曲线进行校正计算出线性回归方程。将样品的色谱数据代入校正后的线性回归方程计算出样品中多肽的分子质量大小及分布情况。
1.3.5 超滤分离
酶解液通过截留分子质量分别10 000、5 000、1 000 Da的超滤膜进行超滤分离。控制物料进口压力<0.4 MPa,收集各截留组分,分别命名为酶解分子质量组分(分子质量>10 000 Da) SSCP-I、(分子质量=5 000~10 000 Da) SSCP-II、(分子质量=1~5 000 Da) SSCP-III、(分子质量<1 000 Da) SSCP-Ⅳ,将4个不同分子质量的组分进行冷冻干燥制备。
1.3.6 抗氧化活性研究
1.3.6.1 超氧阴离子自由基清除试验
将上述4个组分的鲟鱼皮胶原蛋白肽冻干粉分别配制成质量浓度为1、3、5、10、15、20、25 g/L的溶液。采用邻苯三酚法[17],取上述样品溶液0.1 mL(对照组用水代替)置于2.0 mL的EP管中,加入1.3 mL的50 mmol/L Tris-HCl缓冲溶液(pH 8.20)振荡混合,于 25℃水浴保温 10 min;加入0.1 mL已预热10 min的3 mmol/L邻苯三酚溶液(邻苯三酚用10 mmmol/L HCl配制)快速摇匀后于320 nm处每隔30 s测定1次OD值,总时间为3 min,每个试验重复3次。超氧阴离子自由基清除率计算如公式(1):
(1)
式中:S,超氧阴离子自由基清除率;V0,对照组邻苯三酚自氧化速率;V1,样品组邻苯三酚自氧化速率。
1.3.6.2 DPPH自由基的清除试验
将4个组分的鲟鱼皮胶原蛋白肽冻干粉用体积分数为50%的乙醇分别配制成质量浓度为1、3、5、10、15、20 g/L的样品溶液。另外用50%的乙醇溶液配制质量浓度为1、3、5、10、15、20、25、30 μg/mL的BHT溶液。按照文献所述方法进行DPPH自由基清除试验[18]。试验结果用清除率CR来表示,如公式(2):
(2)
式中:A1,样品组;A0,对照组。
1.3.7 数据分析
数据结果以平均值±标准偏差的形式表示,数据分析采用SPSS 24.0软件,图形数据采用Origin Pro 8.5软件制作。
2 结果与分析
2.1 鲟鱼皮的基本成分分析
鲟鱼皮的主要组成成分(湿重计)如表1所示。鲟鱼皮中水分含量较高,为 56.5%(质量分数)左右。其粗蛋白含量较高,为36.3%(质量分数)左右。胶原蛋白含量高达29.4%(质量分数),占总蛋白含量约81%,因此可以作为胶原蛋白肽的制备原料。而鲟鱼皮脂肪含量较高,约为4.2%(质量分数)左右。另外鱼皮中含灰分质量分数为3.4%。
表1 鲟鱼皮的基本成分
Table 1 The basic components of sturgeon skin
成分水分脂肪粗蛋白胶原蛋白灰分质量分数/%56.5±0.54.2±0.436.3±0.129.4±1.53.4±0.3
鲟鱼皮经6 mol/L HCl彻底水解后,产物进行氨基酸分析仪分析,结果如表2所示。由表2可知,鲟鱼皮蛋白被检测出19种氨基酸,其中含量最多的氨基酸按顺序依次为Gly、Ala、Pro,而Gly含量最高为34.0%(质量分数),占胶原蛋白含量约1/3。这完全符合胶原蛋白Gly-x-y的结构组成特点[19]。
表2 鲟鱼皮蛋白氨基酸组成
Table 2 Amino acid composition of sturgeon skin protein
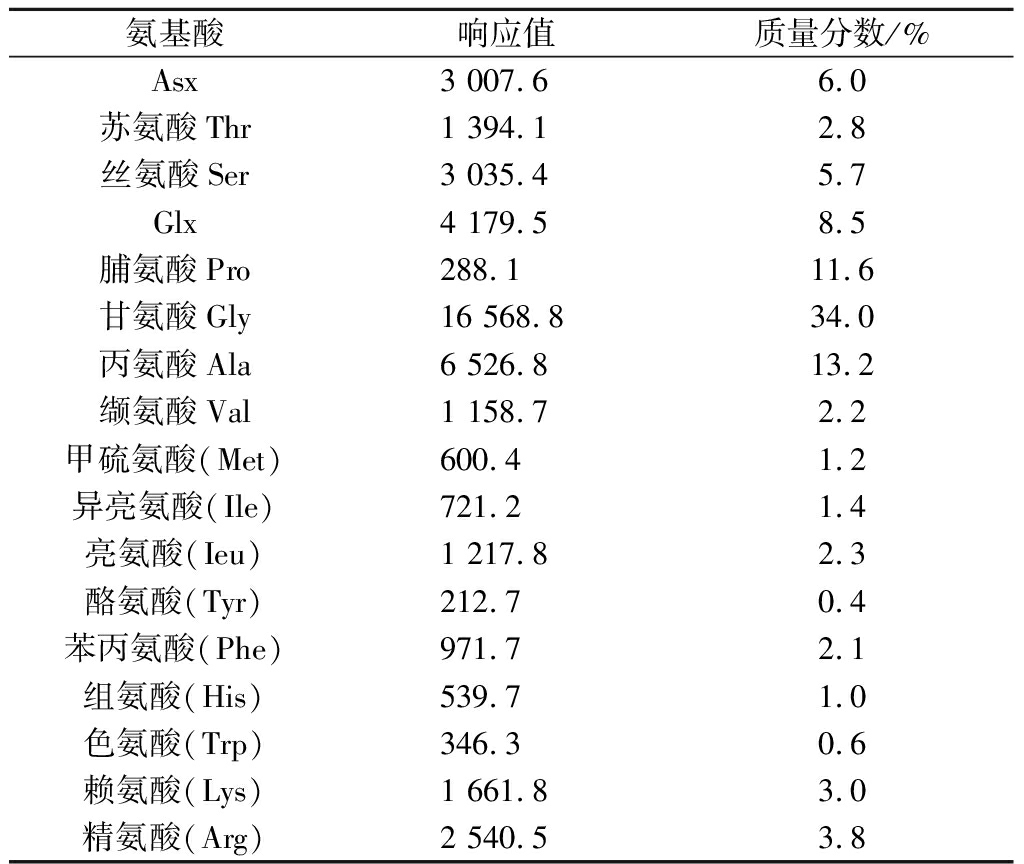
氨基酸响应值质量分数/%Asx3 007.66.0苏氨酸Thr1 394.12.8丝氨酸Ser3 035.45.7Glx4 179.58.5脯氨酸Pro288.111.6甘氨酸Gly16 568.834.0丙氨酸Ala6 526.813.2缬氨酸Val1 158.72.2甲硫氨酸(Met)600.41.2异亮氨酸(Ile)721.21.4亮氨酸(Ieu)1 217.82.3酪氨酸(Tyr)212.70.4苯丙氨酸(Phe)971.72.1组氨酸(His)539.71.0色氨酸(Trp)346.30.6赖氨酸(Lys)1 661.83.0精氨酸(Arg)2 540.53.8
注:Asx表示天冬酰胺(Asu)、天冬氨酸(Asn);Glx表示谷氨酸(Glu)、谷氨酰胺(Gln)。
从氨基酸种类分析,由表3可知,鲟鱼皮蛋白中疏水氨基酸含量较高,约31.7%(质量分数),CHEN等[20]与MENDIS等[21]研究表明疏水性氨基酸对抗氧化活性起着重要作用。此外,鱼皮中8种必须氨基酸总(质量分数)达15.7%,这可为人体提供丰富的营养,也进一步说明鲟鱼皮胶原蛋白具有较高的开发利用价值。
表3 鲟鱼皮氨基酸组成分类
Table 3 Classification amino acid composition in sturgeon skin protein

氨基酸种类氨基酸组成 质量分数/%疏水氨基酸Tyr、Trp、Val、Ile、Ieu、Pro、Ala31.7芳香氨基酸Phe、Trp、Tyr3.1必需氨基酸Phe、Met、Lys、Thr、Trp、Ile、Ieu、Val15.7碱性氨基酸Arg、His、Lys6.8酸性氨基酸Asx、Glx14.5
2.2 碱性蛋白酶酶解鲟鱼皮制备胶原蛋白肽单因素试验
在1∶2至1∶7考察料液比对水解度的影响,结果如图1-a所示。随着料液比的变化,水解度在18%左右,基本没有变化。这表明料液比在一定的比例范围内对水解度的影响不大。图1-b表明,pH值为 9.0时,水解度最大。这与SUTTIWICHAIPORN等[22]的试验结果一致,当使用碱性蛋白酶水解鲟鱼的pH为9.0时,水解度最大。这可能是由于酶具有最适pH,pH过高或过低都会使蛋白质结构变性,降低酶的活力。如图1-c所示,随着反应温度的升高,水解度呈先上升后下降的趋势。过高的温度会引起酶的变性失活,因此最佳反应温度为55℃。这与MAHMOUDREZA[23]研究结果一致,碱性蛋白酶的最适温度为55℃。较长的反应时间有利于酶对鱼皮起更广泛的作用。由图1-d可知,随着反应时间的延长,水解度越来越高。然而,超过4 h后水解度没有显著增加。基于所得结果,最佳反应时间为4h。蛋白酶添加量对水解度的影响如图1-e所示。水解度随酶添加量的增加呈先升高后降低的趋势。这可能是由于酶量的增加抑制了底物扩散,反而使反应速率降低。因此,该碱性蛋白酶酶解鲟鱼皮的最佳添加量为3%(质量分数)。
2.3 碱性蛋白酶酶解鲟鱼皮制备胶原蛋白肽正交试验
在单因素的基础上设计正交试验分析各个因素之间的相互关系,最终确立碱性蛋白酶水解鲟鱼皮的最佳酶解条件。由于在单因素试验中发现,料液比在一定的比值范围内使碱性蛋白酶对鲟鱼皮的水解程度并没有产生明显的影响,所以在设计正交试验时只考虑酶解pH、温度、时间、酶添加量这4个因素。以水解度为分析指标,正交试验的结果如表4所示。由极差R得知,各因素对鱼皮水解度的影响程度顺序依次为:pH>温度>酶添加量>时间,所选的因素中pH对水解度的影响较为显著。由正交试验得出最佳酶解条件:pH 9,温度55℃,时间5 h,酶添加量3%。根据正交试验得到的最佳酶解工艺条件进行验证试验,3组平行试验3次计算出水解度为22.0%。
2.4 鲟鱼皮胶原蛋白肽的分子质量分布
酶解反应结束后,进行高效凝胶排阻色谱检测鲟鱼皮胶原蛋白肽分子质分布情况。由图2可知,在最佳酶解工艺条件下,水解液中多肽的分子质量基本在5 000 Da以下,分子质量分布在500~3 000 Da的多肽含量高,并且分子质量在1 000 Da以下的含量高达67%。研究表明分子质量越小的短肽具有更好的水溶性,易于被人体肠胃吸收并直接利用,分子质量越小的多肽尤其是二肽、三肽等寡肽根据氨基酸组成以及排列顺序的不同,具有非常重要的生物活性[24]。
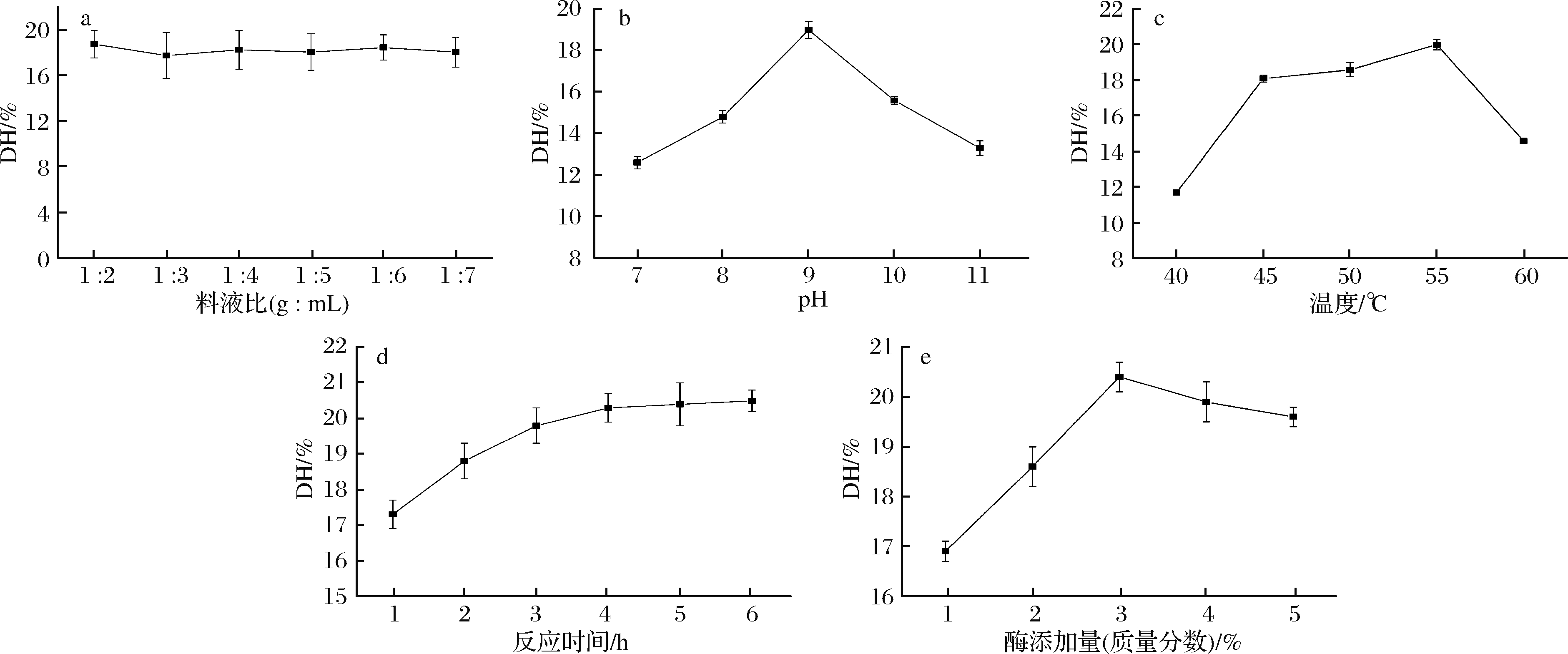
a-料液比对水解度的影响;b-pH对水解度的影响;c-温度对水解度的影响;d-反应时间对水解度的影响;e-酶添加量对水解度的影响
图1 料液比、pH、温度、反应时间和酶添加量对水解度的影响
Fig.1 Effect of liquid-to-solid ratio, pH, temperature, reaction time and enzyme concentration on the degree of hydrolysis
表4 鲟鱼皮胶原蛋白肽制备工艺的L9(34)正交试验结果
Table 4 Result of L9 (34) orthogonal experiment for preparation of collagen polypeptide from sturgeon skin
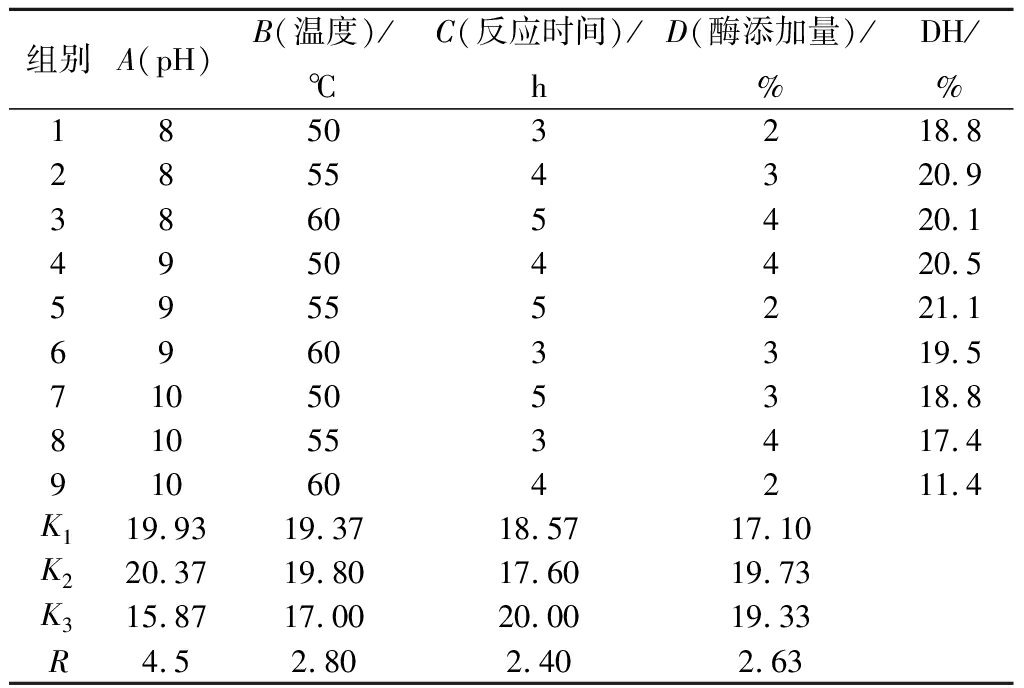
组别A(pH)B(温度)/℃C(反应时间)/hD(酶添加量)/%DH/%18503218.828554320.938605420.149504420.559555221.169603319.5710505318.8810553417.4910604211.4K119.9319.3718.5717.10K220.3719.8017.6019.73K315.8717.0020.0019.33R4.52.802.402.63

图2 鲟鱼皮胶原蛋白肽的分子质量分布
Fig.2 Molecular weight distribution of collagenpeptide in the skin of sturgeon
2.5 鲟鱼皮胶原蛋白肽的抗氧化活性试验
2.5.1 超氧阴离子自由基清除试验
超氧阴离子是由人体内线粒体的电子传递而产生的人体第一个氧化自由基,过量的超氧阴离子将导致细胞的损伤[25]。本文对超滤分离得到的4种组分在不同浓度下,通过邻苯三酚自氧化进行超氧阴离子自由基的清除试验,试验结果见图3。
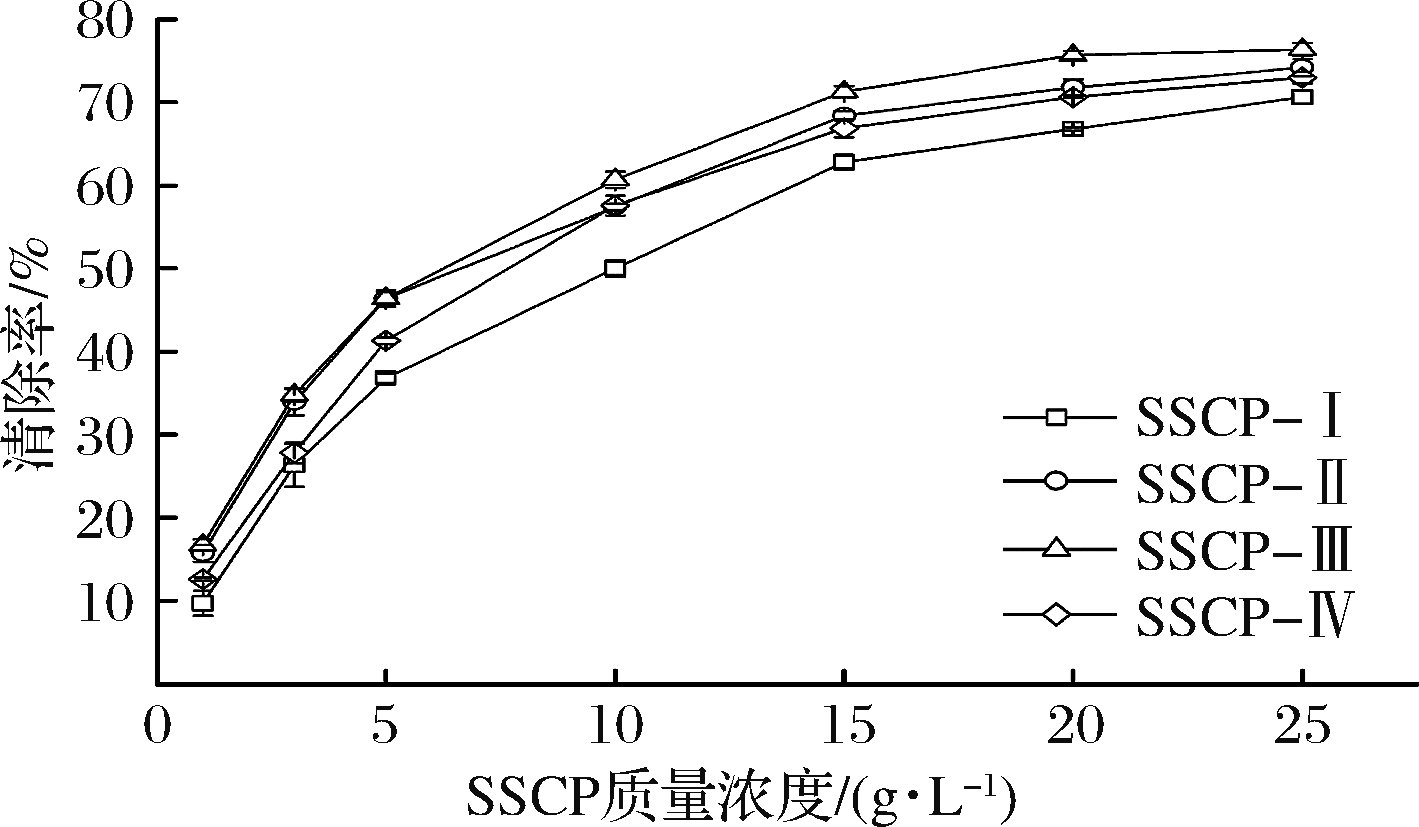
图3 不同分子质量SSCP对超氧阴离子自由基清除效果
Fig.3 Superoxide anion radical scavenging activityof different molecular weight of SSCP
由图3可知,4种不同分子质量范围的鱼皮胶原蛋白肽都具有一定的超氧阴离子自由基的清除能力,并且随着各自浓度的升高,清除超氧阴离子的能力也随之增强,当质量浓度超过20 g/L时,对超氧阴离子自由基的清除能力增强趋势开始趋缓;通过OriginPro8.5软件数据拟合4种组分的半抑制浓度(IC50)分别为8.918 g/L(SSCP-Ⅰ)、7.051 g/L(SSCP-Ⅱ)、5.938 g/L(SSCP-Ⅲ)、7.050 g/L (SSCP-Ⅳ)。所以SSCP-Ⅲ(分子质量=1 000~5 000 Da)对超氧阴离子自由基的清除能力最强。这与KIM等[26]对阿拉斯加鳕鱼皮明胶酶解液进行超滤膜反应器分离,最终与确定相对分子质量分布在1 500~4 500 Da的多肽具有较高的超氧阴离子自由基清除活性的结论相符合。
2.5.2 DPPH自由基清除试验
由于DPPH自由基有单电子,在517 nm处有一强吸收,其醇溶液呈紫色。当有自由基清除剂存在时,能与其单电子配对而使其吸收逐渐消失。DPPH醇溶液的褪色程度与自由基清除剂自身提供的电子数量成定量关系。经超滤分离的4种鲟鱼皮胶原蛋白肽组分分别在不同浓度下对DPPH自由基的清除效果如图4所示。
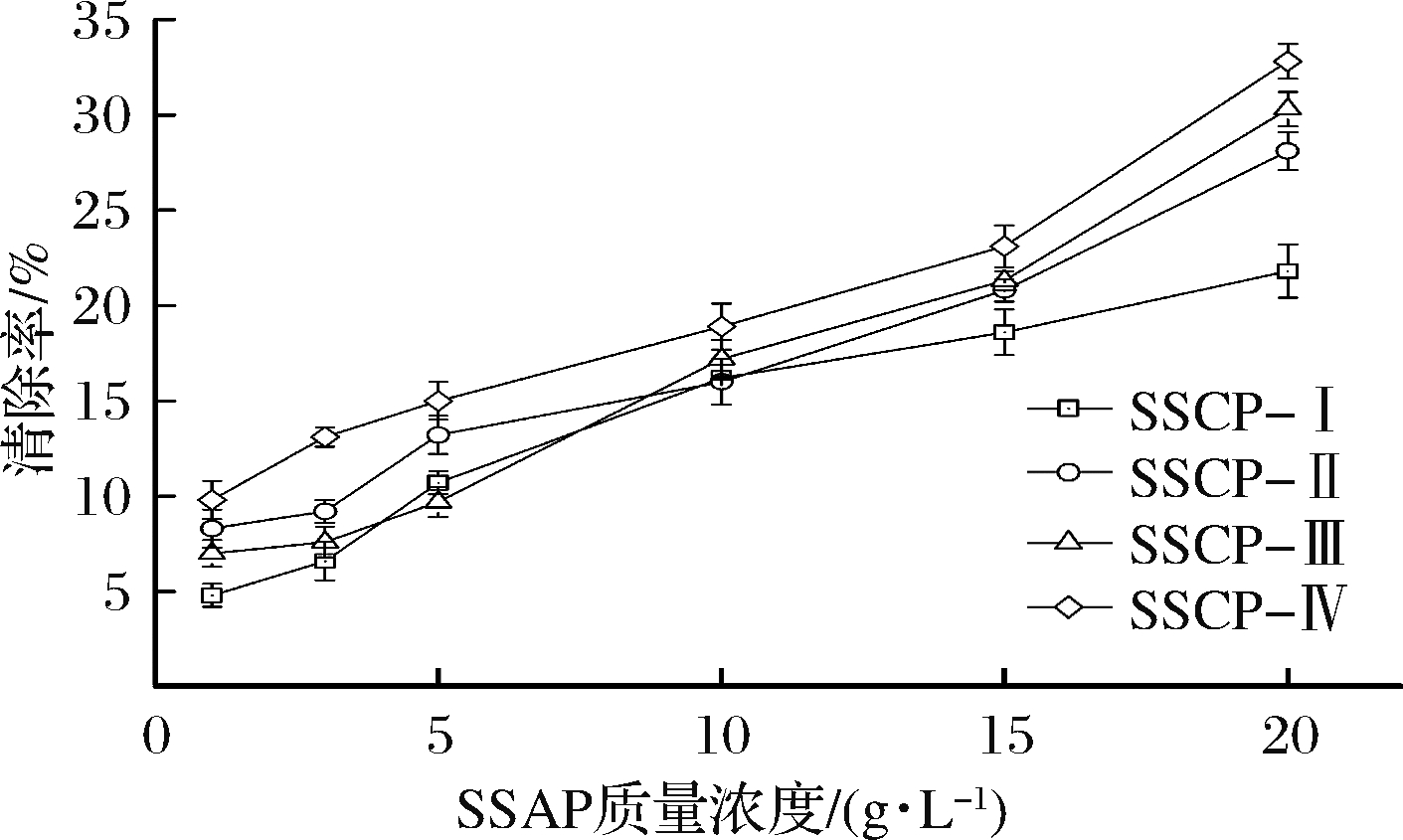
图4 不同分子质量SSCP对DPPH自由基清除效果
Fig.4 DPPH radical scavenging activity of differentmolecular weight of SSCP
由图4可知,4种不同分子质量的酶解液SSCP对DPPH自由基的清除能力随着各自浓度的升高而增强。在质量浓度为20 g/L时,4种不同分子质量的SSCP对DPPH的清除能力大小顺序为SSCP-Ⅳ(分子质量<1 000 Da)>SSCP-Ⅲ(分子质量=1 000~5 000 Da)>SSCP-Ⅱ(分子质量=5 000~10 000 Da)>SSCP-Ⅰ(分子质量>10 000 Da)。这表明分子质量越小的多肽对DPPH自由基的清除效果越好[27]。此外,由图5可知,BHT在质量浓度为25 μg/mL时对DPPH自由基的清除率达65.1%,而对DPPH自由基清除活性最佳的SSCP-Ⅳ(分子质量<1 000 Da)在浓度为20 g/L时清除率只有32.8%,明显低于BHT阳性对照。
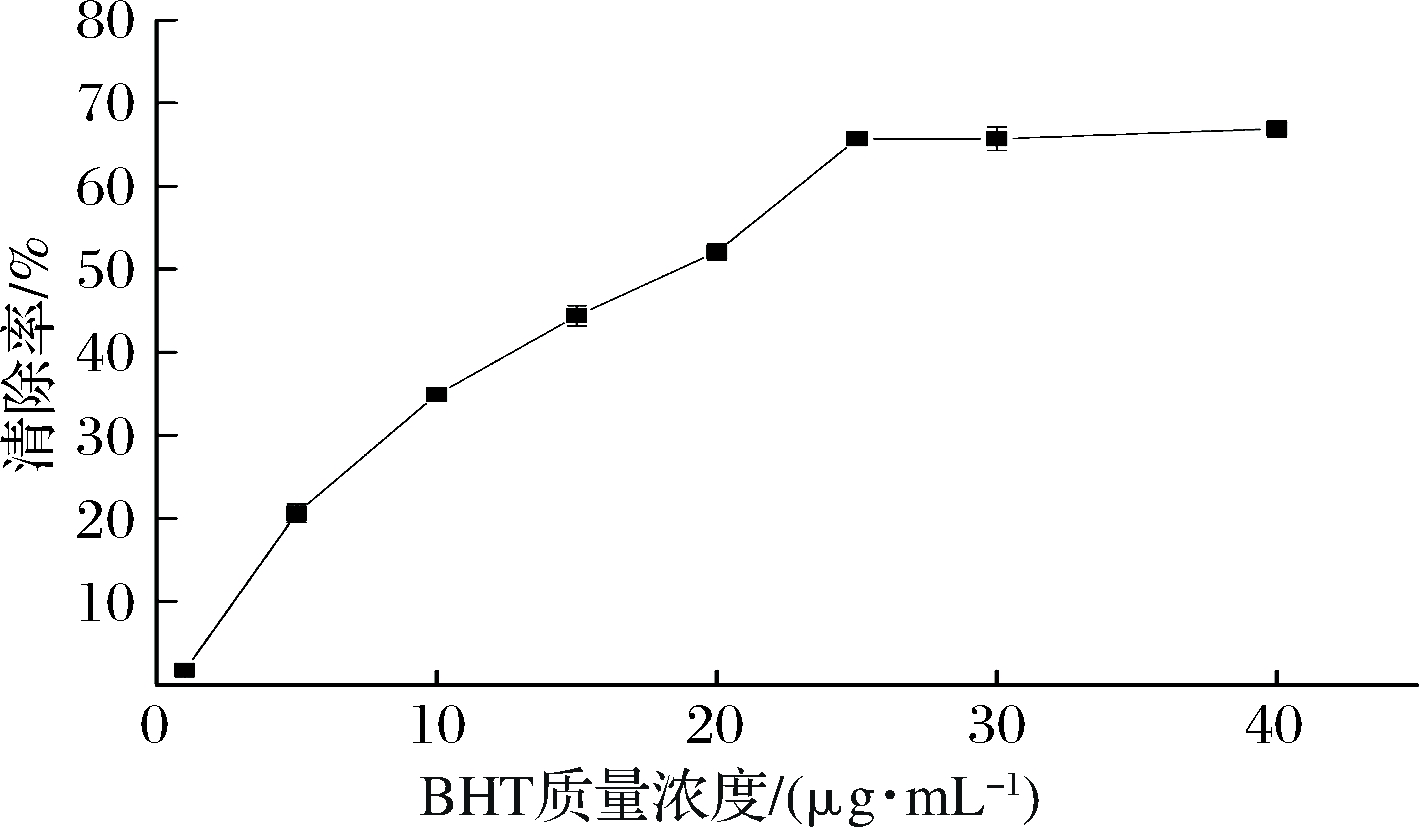
图5 BHT对DPPH自由基清除效果
Fig.5 DPPH radical scavenging activity of BHT
3 结论
本研究在单因素试验的基础上,利用正交试验得到碱性蛋白酶酶解鲟鱼皮胶原蛋白的最佳酶解工艺:酶解温度55℃,pH 9,酶添加量3%,酶解时间5 h。对最佳酶解工艺条件进行验证试验,该酶解条件下水解度为22.0%。酶解液的不同分子质量组分抗氧化活性研究发现,SSCP-Ⅲ(分子质量=1 000~5 000 Da)组分对超氧阴离子具有最强的清除能力,半抑制清除浓度IC50为5.938 g/L。本研究为鲟鱼皮及其相关资源的加工和高值化利用提供了理论依据,对胶原蛋白肽的抗氧化活性进行初步分析,其抗菌、改善皮肤、增强免疫力和降血压等生物活性有待进一步研究。
[1] SAMARANAYAKA A G P, LI-CHAN E C Y. Food-derived peptidic antioxidants: A review of their production, assessment, and potential applications [J]. Journal of Functional Foods, 2011, 3(4):229-254.
[2] HE R, GIRGIH A T, MALOMO S A, et al. Antioxidant activities of enzymatic rapeseed protein hydrolysates and the membrane ultrafiltration fractions [J]. Journal of Functional Foods, 2013, 5(1):219-227.
[3] RAJAPAKSE N, MENDIS E, BYUN H G, et al. Purification and in vitro antioxidative effects of giant squid muscle peptides on free radical-mediated oxidative systems [J]. Journal of Nutritional Biochemistry, 2005, 16(9):562-569.
[4] SIMMACO M, MINGOGNA G,CANOFENI S, et al. Temporins, antimicrobial peptides from the European red frog Rana temporaria[J]. European Journal of Biochemistry, 1996, 242(3):788-792.
[5] BYUN H G, KIM S K. Purification and characterization of angiotensin I converting enzyme (ACE) inhibitory peptides from Alaska pollack (Theragra chalcogramma) skin [J]. Process Biochemistry, 2001, 36(12):1 155-1 162.
[6] KETNAWA S, MART NEZ-ALVAREZ O, BENJAKUL S, et al. Gelatin hydrolysates from farmed giant catfish skin using alkaline proteases and its antioxidative function of simulated gastro-intestinal digestion [J]. Food Chemistry, 2016, 192: 34-42.
NEZ-ALVAREZ O, BENJAKUL S, et al. Gelatin hydrolysates from farmed giant catfish skin using alkaline proteases and its antioxidative function of simulated gastro-intestinal digestion [J]. Food Chemistry, 2016, 192: 34-42.
[7] 瞿叶辉,丁利君,郑正男,等. 马面鱼骨胶原多肽粉功能性质的研究[J]. 食品工业, 2016(2): 167-170.
[8] NGO D H, QIAN Z J, RYU B M, et al. In vitro antioxidant activity of a peptide isolated from Nile tilapia (Oreochromis niloticus) scale gelatin in free radical-mediated oxidative systems [J]. Journal of Functional Foods, 2010, 2(2):107-117.
[9] WEI Q, HE J, YANG D, et al. Status of sturgeon aquaculture and sturgeon trade in China: A review based on two recent nationwide surveys [J]. Journal of Applied Ichthyology, 2004, 20(5):321-332.
[10] PIKITCH E K, DOUKAKIS P, LAUCK L, et al. Status, trends and management of sturgeon and paddlefish fisheries [J]. Fish and Fisheries, 2005, 6(3):233-265.
[11] 王群,郑海涛,葛尧,等. 酶法制备鲽鱼鱼皮胶原蛋白肽及其清除超氧阴离子自由基的研究[J]. 中国农学通报, 2011, 27(14):87-93.
[12] GB 5009.3—2016 食品安全国家标准食品中水分的测定[S].北京:中国标准出版社,2016.
[13] GB 5009.5—2010 食品安全国家标准食品中蛋白质的测定[S].北京:中国标准出版社,2016.
[14] GB/T 9695.23—2008 肉与肉制品羟脯氨酸含量测定[S].北京:中国标准出版社,2008.
[15] GB 5009.6—2016 食品安全国家标准食品中脂肪的测定[S].北京:中国标准出版社,2016.
[16] GB/T 5009.4—2003 食品中灰分的测定[S].北京:中国标准出版社,2003.
[17] 胡娟. 酶解鱼鳞明胶制备生物活性肽的研究[D]. 广州:华南理工大学, 2010.
[18] CHEN Y,WANG M,ROSEN R, et al. 2, 2-Diphenyl-1-picrylhydrazyl radical-scavenging active components from Polygonum multiflorum thunb[J].Journal of Agricultural and Food Chemistry,1999,47 (6):2 226-2 228.
[19] BELLA J, BRODSKY B, BERMAN H M. Hydration structure of a collagen peptide [J]. Structure, 1995, 13(9):893-907.
[20] CHEN H M, MURAMOTO K, YAMAUCHI F, et al. Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein [J]. Journal of Agricultural & Food Chemistry, 1998, 46(1):49-53.
[21] MENDIS E, RAJAPAKSE N, BYUN H G, et al. Investigation of jumbo squid (Dosidicus gigas) skin gelatin peptides for their in vitro antioxidant effects [J]. Life Sciences, 2005, 77(17):2 166-2 178.
[22] SUTTIWICHAIPORN W, THANACHASAI S, GARNJANAGOONCHORN W. Production of fish protein hydrolysate using immobilized alcalase[C]. Kasetsart University Conference. Bangkok, 2008:521-528.
[23] OVISSIPOUR M, ABEDIAN A, MOTAMEDZADEGAN A, et al. The effect of enzymatic hydrolysis time and temperature on the properties of protein hydrolysates from Persian sturgeon (Acipenser persicus) viscera [J]. Food Chemistry, 2009, 115(1): 238-242.
[24] 孔令明,李芳,陶永霞,等.多肽的功能活性与研究进展[J]. 中国食品添加剂, 2009(3): 71-73; 67.
[25] RABHAVAN S, KRISTINSSON H C. ACE-inhibitory activity of tilapia protein hydrolysates [J]. Food Chemistry, 2009, 117(4): 582-588.
[26] KIM S K, KIM Y T, BYUN H G, et al. Isolation and characterization of antioxidative peptides from gelatin hydrolysate of alaska pollack skin [J]. Journal of Agricultural and Food Chemistry, 2001, 49(4):1 984-1 989.
[27] WANG B, LI L, CHI C F, et al. Purification and characterisation of a novel antioxidant peptide derived from blue mussel (Mytilus edulis) protein hydrolysate [J].Food Chemistry,2013,138 (2-3):1 713-1 719.