低聚果糖(fructooligosaccharide,FOS)是公认典型的益生元,具有改善肠道功能、促进矿物质吸收、降低胆固醇和血脂等多种功能,并可以调节肠道菌群、调节增殖双歧杆菌[1]。目前低聚果糖在食品方面的产品已达500多种,在乳酸饮料、酸奶、蛋糕、面包等多种食品中广泛应用[2-3]。
目前工业上生产低聚果糖主要以菊芋或菊苣为原料,热水浸提后,经菊粉酶水解制备β-2,1糖苷键连接的菊粉型低聚果糖[4]。近年来,β-2,6糖苷键连接的低聚果糖因具有更优的益生元特性而受到越来越多关注[5-6]。但是已报导的酶法催化合成β-2,6键型低聚果糖的转化率都普遍较低,难以应用于实际。本实验室自行筛选获得Arthrobacter arilaitensis NJEM01来源的β-呋喃果糖苷酶(Fru6),该酶能够以蔗糖为底物特异性合成β-2,6键连接的6-蔗果三糖[7]。在此基础上通过对该酶进行分子改造提高了6-蔗果三糖的转化率,并得到了新的产物6-蔗果四糖[8]。
因游离酶在反应体系中易与水溶性的产物混合,导致难以将催化剂酶与产物分离。通过合适的颗粒载体将游离酶固定化后,可以易于实现酶的回收和多个批次的重复利用,降低酶催化剂的投入成本。多官能团固定化是一种将共价法和吸附法相结合的固定化方案。这种固定化方法可以针对酶的敏感区域进行多点共价固定化,从而产生更稳定的固定化酶[9]。
因为大孔树脂具有较强的机械强度和较稳定的孔状结构,本文在大孔树脂MI-BN4表面修饰多官能团基团,对β-呋喃果糖苷酶Fru6进行固定化试验。对固定化条件及酶学性质进行研究,并研究固定化酶Fru6催化合成低聚果糖及可重复反应的能力。实现新型低聚果糖的批次制备,使其更好地应用于工业化生产。
1 材料与方法
1.1 试剂与设备
β-呋喃果糖苷酶(Arthrobacter arilaitensis NJEM01,本试验室自主筛选);大孔树脂MI-BN4,杭州创科生物科技有限公司;乙腈(色谱纯),其他试剂均为分析纯。
PYX-DHS-40*50-BS恒温摇床培养箱,江苏太仓试验设备厂;ALPHA 1-2LD PLUS冷冻干燥机,德国CHRIST;SBA-40C生物传感仪,山东科学院。Ultimate 3000高效液相色谱仪,赛墨飞公司。
1.2 试验方法
1.2.1 果糖苷酶制备
重组菌在37 ℃条件下生长2 h后,在低温条件下(25 ℃)经IPTG(1 mmol/L)诱导表达分泌至胞外,发酵12 h后在4 ℃、8 000 r/min条件下离心收集上清粗酶液,放置于4 ℃条件下备用。
1.2.2 大孔树脂MI-BN4预处理及多官能团修饰
将20 g大孔树脂MI-BN4用过量蒸馏水冲洗3次,真空干燥后待用。
对经过预处理后的大孔树脂进行羟基化处理。称取10 g大孔树脂置于250 mL的圆底烧瓶中,加入100 mL食人鱼溶液V(H2SO4)∶V(30%H2O2)=30∶70。在90 ℃搅拌的条件下,加热回流1 h,冷却至室温,弃去上清,用蒸馏水将树脂洗涤至中性待用。
将树脂表面的羟基反应为环氧基团以及乙二醇基团[9]。称取10 g羟基化后的大孔树脂于250 mL的锥形瓶中。在常温条件下,依次加入H2O 44 mL、丙酮16 mL、NaOH 3.28 g、NaBH4 0.2 g,环氧氯丙烷11 mL,磁力搅拌16 h后,用水冲洗除去剩余反应液。
使用浓H2SO4除去树脂表面的环氧基团,将乙二醇基团反应为乙醛基。在处理后的载体中加入100 mL的H2SO4(0.5 mol/L),在常温条件下搅拌反应2 h。倒掉上清液,用大量水冲洗除去剩余浓H2SO4,加入高碘酸钠溶液(0.1 mol/L、20 mL)和乙二醇基团在常温条件下搅拌反应3 h。用水冲洗除去剩余反应液待用。
在大孔树脂表面修饰亲核基团,将其修饰为不同性质的多官能团树脂[9]。
(1)制备阳离子载体:将带有乙醛基基团的树脂用1 mol/L的三乙胺在V(H2O)∶V(丙酮)=1∶1、pH 12.0、25 ℃的条件下搅拌反应24 h。反应结束后,用水冲洗除去剩余反应液,将修饰后的载体真空干燥后待用。
(2)制备阴离子载体:将带有乙醛基基团的树脂用0.5 mol/L的亚胺基二乙酸在pH 8.0、25 ℃条件下搅拌反应24 h。反应结束后,用水冲洗除去剩余反应液,将修饰后的载体真空干燥后待用。
(3)制备金属螯合载体:将阴离子载体用30 g/L的3种不同金属盐(CuSO4、NiCl2和CoCl2)溶液在pH 7.0, 25 ℃下搅拌反应1 h。反应结束后,用水冲洗除去剩余反应液,将修饰后的载体真空干燥后待用。
1.2.3 果糖苷酶Fru6固定化方法
将1 mL(30U)酶液与0.2 g树脂在25 ℃、中性条件下置于混匀仪中以200 r/min振荡反应4 h后,移除上清,检测上清中残余的酶活力和蛋白含量。
然后加入Gly-NaOH(50 mmol/L、pH 10.0),在25 ℃条件下反应3 h后,去除上清,用蒸馏水冲洗直至中性。将得到的固定化酶在4 ℃条件下保存在Na2HPO4-KH2PO4(50 mmol/L、pH 6.5)中待用。
1.2.4 酶活性和蛋白质含量检测
酶活力单位定义:一个酶活力单位即在35 ℃,pH 6.5条件下,每分钟催化蔗糖水解产生1 μmol葡萄糖所需的酶量为1 U(U即μmol/(mL·min))。
测定酶活力的方法:将蔗糖(1 mol/L)溶解在Na2HPO4-KH2PO4(50 mmol/L、pH 6.5)缓冲液中,取50 μL酶液加入到950 μL蔗糖底物溶液中,于35 ℃混匀仪中200 r/min振荡反应 15 min,反应完成后立即煮沸15 min终止反应。将反应液适当稀释后用生物传感仪(SBA-40E) 测定反应产生的葡萄糖的量。固定化酶则是将2 mg的固定化酶加入到1 mL的蔗糖底物溶液中,在相同的条件下反应,然后检测其酶活。
蛋白质含量的测定参照Brad法[10]。本文中采用Brad法分别对固定化前酶液和固定化后上清与洗涤液中的蛋白含量进行测定,计算固定化过程中蛋白质的吸附量。
1.2.5 果糖苷酶Fru6固定化条件的优化
1.2.5.1 固定化温度的优化
分别在25、30、35、40、45和50 ℃条件下加入30 U果糖苷酶进行固定化,反应4 h。反应结束后取出MI-BN4大孔树脂,用Na2HPO4-KH2PO4(50 mmol/L、pH 6.5)缓冲液冲洗除去残留酶液,测定固定化酶活和吸附蛋白量,考察温度对酶固定化效果的影响。
1.2.5.2 固定化加酶量的优化
分别加入15、20、25、30、35、40、45、50、55和60 U的果糖苷酶在25 ℃条件下固定化4 h,固定化后取出大孔树脂,用Na2HPO4-KH2PO4(50 mmol/L、pH6.5)缓冲液冲洗除去残留酶液,测定固定化酶活和吸附蛋白量,考察加酶量对酶固定化效果的影响。
1.2.5.3 固定化时间的优化
在25 ℃条件下加入40 U果糖苷酶进行固定化,固定化时间为 2、4、6、8、10和12 h,结束后取出大孔树脂,用Na2HPO4-KH2PO4(50 mmol/L、pH 6.5)缓冲液冲洗除去残留酶液,测定固定化酶活和吸附蛋白量,考察固定化时间对酶固定化效果的影响。
1.2.6 固定化果糖苷酶酶学性质
通过单因素试验优化后的固定化条件制备固定化果糖苷酶,经真空干燥后,对其酶学性质,包括最适pH及pH稳定性、最适温度及温度稳定性进行研究。
1.2.6.1 最适温度及温度稳定性
为了研究比较固定化酶和游离酶的最适反应温度,将50 μL的游离酶和10 mg的固定化酶分别加入到950 μL和1 mL蔗糖(1 mol/L、pH 6.5)底物溶液中,两者的加酶量一致,分别在25、30、35、40、45、50、55、60 ℃下反应15 min,反应结束后立即煮沸15 min和取出固定化酶来终止反应,测定酶活。以最高酶活力作为对照,计算相对酶活力,绘制酶活随着温度变化而变化的曲线。
为了研究比较固定化酶和游离酶的温度稳定性,分别将游离酶和固定化酶放入 25、30、35、40、45、50、55、60 ℃水浴12 h后,检测残余酶活,并计算残余酶活与初始酶活的比值。
1.2.6.2 最适pH及pH稳定性
为了研究比较固定化酶和游离酶的最适反应pH,配制不同浓度pH的缓冲溶液,分别为柠檬酸缓冲液(0.1 mol/L、pH 4.0~6.0)、Na2HPO4-KH2PO4缓冲液(50 mmol/L、pH 5.0~8.5)、Tris-HCl缓冲液(50 mmol/L、pH 8.5~9.0)和Gly-NaOH缓冲液(50 mmol/L、pH 9.0~10.0)。将50 μL游离酶及2 mg固定化酶分别加入到 950 μL和1 mL用特定pH值缓冲液配制的1 mol/L蔗糖底物溶液中,两者的加酶量一致。45 ℃反应15 min,反应结束后立即煮沸 15 min和取出固定化酶来终止反应,测定酶活。以最高酶活力作为对照,计算相对酶活力。
为了测定游离酶和固定化酶的pH稳定性,将游离酶与不同pH值的缓冲液(pH 4.0~10.0)以体积比1∶1混合,固定化酶则是将其加入到不同缓冲中,在25 ℃条件下放置12 h,检测残余酶活,并计算残余酶活与初始酶活的比值。
1.2.7 产物低聚果糖的液相色谱分析
样品预处理:将灭活后的反应液用 25%乙腈稀释4倍,用0.22 μm的有机微孔滤膜过滤后上样。色谱条件为:色谱柱(Kromasil),氨基柱(250 mm×4.6 mm);流动相V(乙腈)∶V(水)=88∶12;流速为0.7 mL/min;柱温为30 ℃。
1.2.8 固定化酶和游离酶催化合成低聚果糖反应进程比较
将游离酶和固定化酶在pH 8.0、35 ℃、1.5 mol/L蔗糖、2 U/g蔗糖加酶量的条件下催化合成低聚果糖[8],反应时间72 h,每12 h取样1次,样品取出后立即取出固定化酶终止反应,再用25%乙腈稀释4倍,HPLC检测产物。
1.2.9 固定化酶重复使用性研究
固定化酶以2 U/g蔗糖的加酶量进行连续催化合成低聚果糖的反应,反应时间72 h,反应条件为pH 8.0,35 ℃,1.5 mol/L蔗糖。每12 h取样1次,样品取出后再用25%乙腈适当稀释,HPLC检测产物。一次反应结束后用Na2HPO4-KH2PO4缓冲溶液(50 mmol/L,pH 6.5)冲洗除去残留产物后再投入到下一次反应中。
2 结果与分析
2.1 多官能团树脂固定化结果
不同类型的多官能团树脂对Fru6的固定化效果比较如表1所示。其中金属离子载体(Co2+)与阳离子载体![]() 具有较好的蛋白吸附能力。但金属离子载体(Co2+)的酶回收率只有0.1%,这可能是因为载体表面的Co2+影响了酶的活力。而阳离子载体
具有较好的蛋白吸附能力。但金属离子载体(Co2+)的酶回收率只有0.1%,这可能是因为载体表面的Co2+影响了酶的活力。而阳离子载体![]() 的酶活回收率达到了86.3%,所以选用阳离子载体
的酶活回收率达到了86.3%,所以选用阳离子载体![]() 作为固定化载体。
作为固定化载体。
表1 多官能团固定化效果比较
Table 1 Comparison of multi-functional immobilization effects
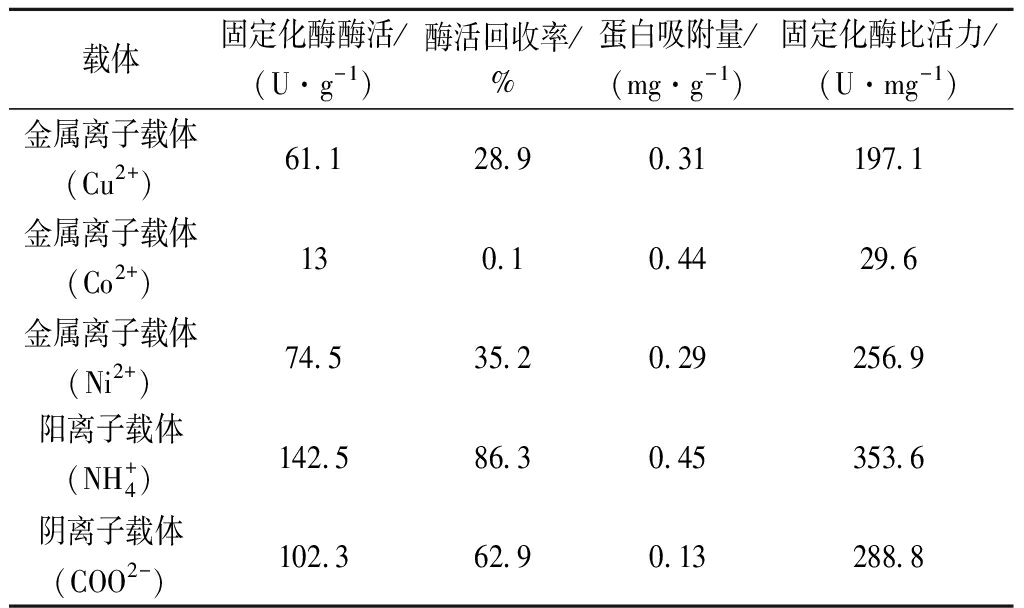
载体固定化酶酶活/(U·g-1)酶活回收率/%蛋白吸附量/(mg·g-1)固定化酶比活力/(U·mg-1)金属离子载体(Cu2+)61.128.90.31197.1金属离子载体(Co2+)130.10.4429.6金属离子载体(Ni2+)74.535.20.29256.9阳离子载体(NH+4)142.586.30.45353.6阴离子载体(COO2-)102.362.90.13288.8
2.2 固定化条件优化
2.2.1 温度
温度对于载体吸附酶蛋白有重要影响,结果如图1所示,在25~50 ℃,温度对蛋白吸附量影响不大,但50 ℃时固定化酶酶活力有了明显的降低,这可能是高温引起了果糖苷酶的构象变化,并影响了果糖苷酶分子的活性中心,导致酶活力下降。考虑到试验操作和经济效益选择25 ℃作为最适温度,此时固定化酶酶活力为163 U/g。
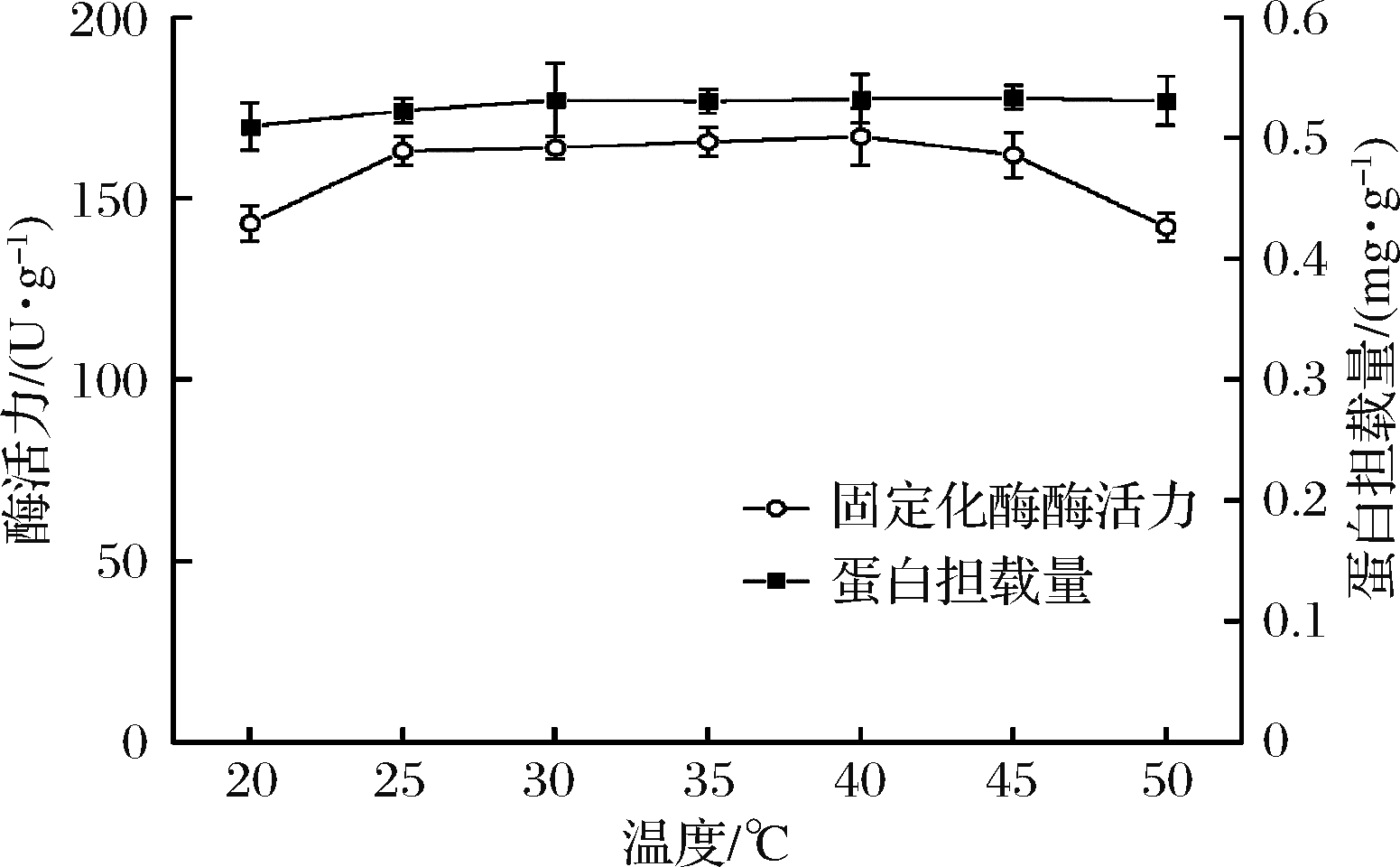
图1 温度对固定化效果的影响
Fig.1 The effect of temperature on the immobilization effect
2.2.2 加酶量
在固定化体系中,加酶量是影响固定化效率的重要因素之一。如图2所示,在加酶量从15 U增加到40 U时,固定化酶酶活力和蛋白吸附量随着加酶量的增加而逐渐增加,在40 U到60 U时,固定化酶酶活力和蛋白吸附量几乎趋于平衡,这表明该载体已达到饱和状态。所以选择40 U作为加酶量条件,此时固定化酶酶活力为182.5 U/g。
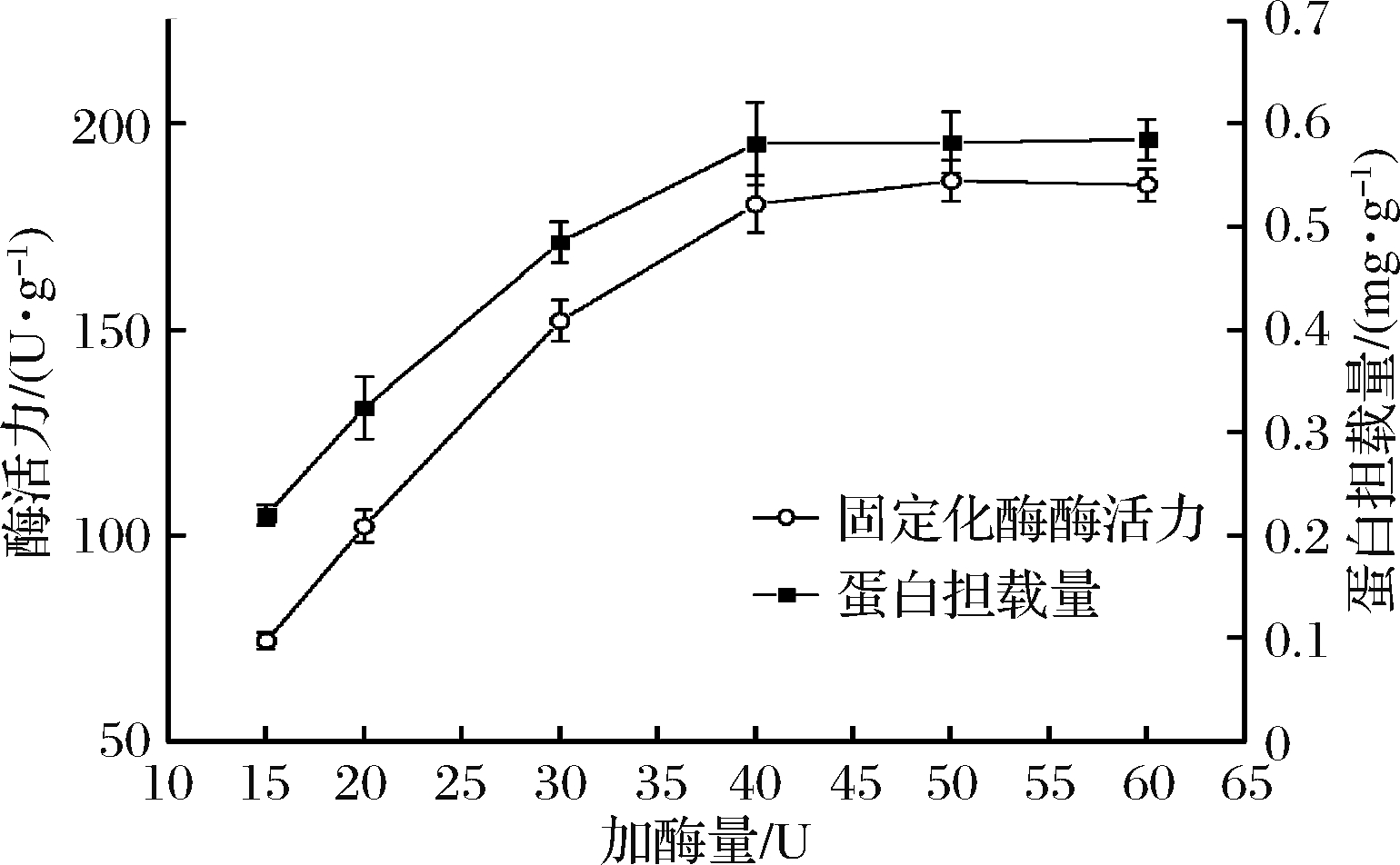
图2 加酶量对固定化效果的影响
Fig.2 Effect of enzyme amount on immobilization effect
2.2.3 时间
时间对于多官能团树脂固定化Fru6的影响如图3所示,可以发现蛋白的吸附量随着时间的增加而增加,当时间超过6 h后,蛋白吸附量趋于稳定,不再有明显的增加。固定化果糖苷酶在6 h时的酶活力约为 205.2 U/g,之后固定化果糖苷酶酶活力也没有明显的改变。因此考虑到制备效率,选择6 h作为吸附条件。
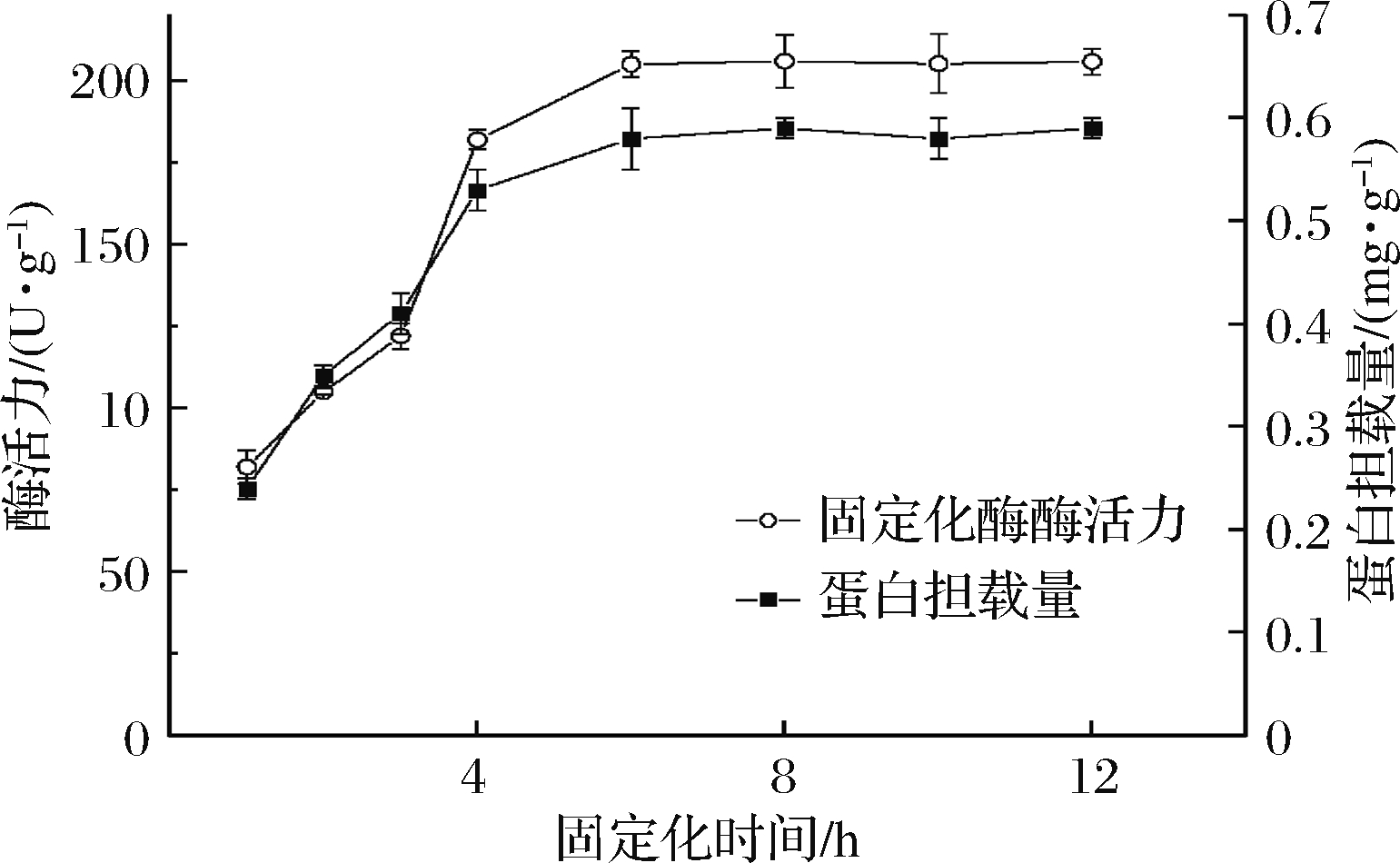
图3 固定化时间对固定化效果的影响
Fig.3 Effect of immobilization time on immobilization effect
2.3 固定化酶酶学性质
2.3.1 固定化酶和游离酶最适温度
如图4所示,固定化酶与游离酶在低于45 ℃条件下,酶活力随着温度的升高而升高。当反应温度超过45 ℃时,酶活力开始出现了快速下降的趋势,到50 ℃时,固定化酶与游离酶的酶活均只有最大活力的50%左右。所以固定化酶和游离酶的催化蔗糖水解的最适反应温度一致,均为45 ℃。这说明固定化酶对温度的敏感性与游离酶基本一致。

图4 固定化酶与游离酶的最适温度比较
Fig.4 Comparison of optimum temperaturebetween immobilized enzyme and free enzyme
2.3.2 固定化酶和游离酶最适pH
结果如图5所示,固定化酶和游离酶的最适pH均为6.5,在pH 8.0~9.0,固定化酶和游离酶的酶活力均开始下降,但固定化酶的酶活力的下降速度要慢许多,其可以保持最适活力的90%以上,而游离酶则下降到了80%以下。固定化酶在碱性条件下比游离酶表现出更好的活力,这说明固定化酶的pH适应性相比游离酶变得更宽。
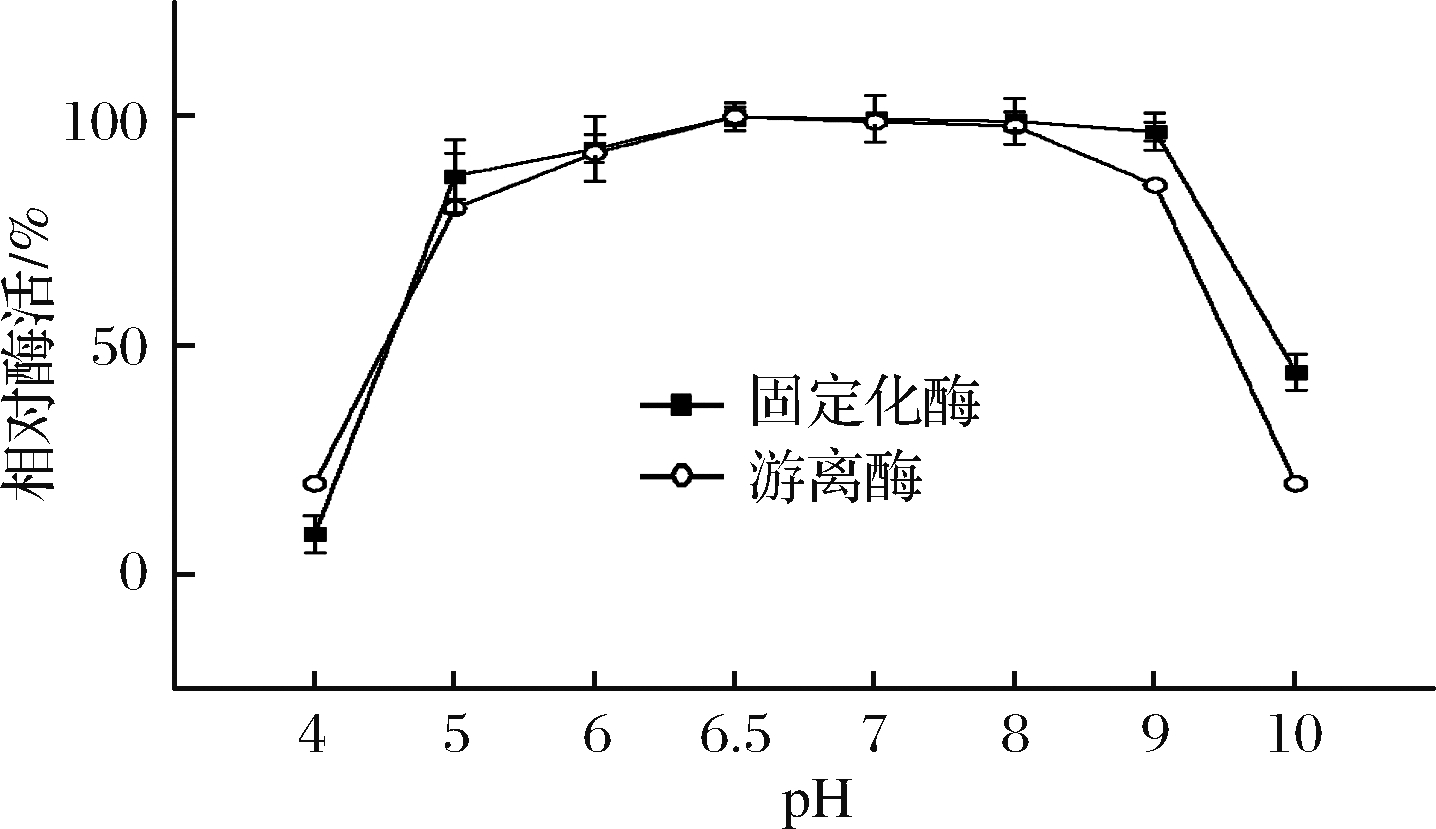
图5 固定化酶与游离酶最适pH比较
Fig.5 Comparison of the optimum pH of immobilizedenzyme and free enzyme
2.3.3 固定化酶和游离酶温度稳定性
固定化酶和游离酶在不同温度条件下保留12 h后的活力保留结果如图6所示。游离酶的活力自40 ℃开始下降,到45 ℃时就已经损失了50%的酶活力,而固定化酶在低于45 ℃时酶活力保持在90%以上,45 ℃后开始呈现下降趋势,固定化酶在55 ℃时酶活力下降到了50%。这表明固定化酶相对于游离酶有着更好的温度稳定性。这可能是因为在多点共价连接的情况下,酶的固定化可以使得酶的结构更加稳定。GUERRERO等[11]使用经多官能团修饰后的琼脂糖为载体,对β-半乳糖苷酶进行固定化试验后,该固定化酶在50 ℃的半衰期达到了100 h。
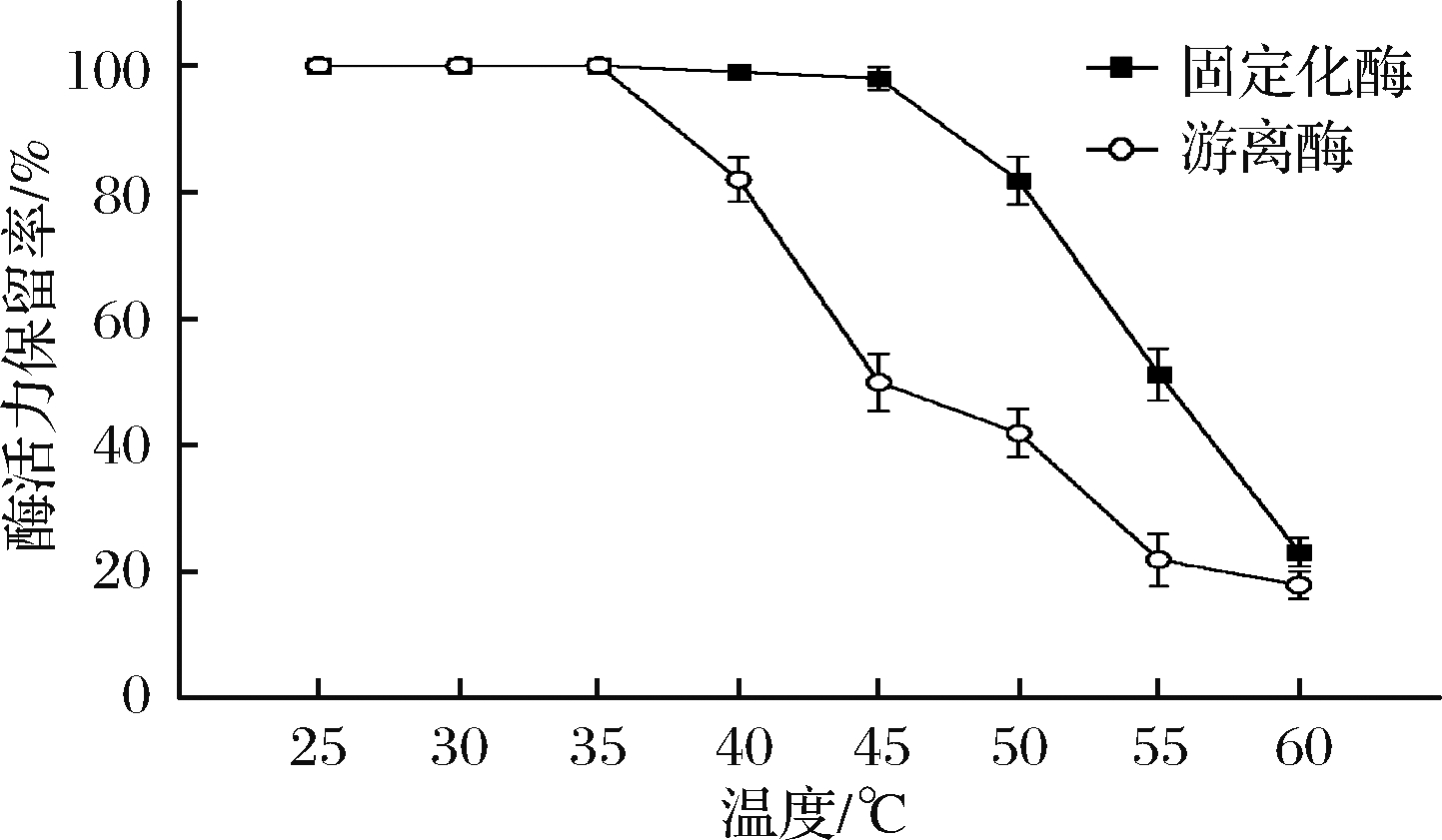
图6 固定化酶与游离酶温度稳定性比较
Fig.6 Comparison of temperature stabilitybetween immobilized enzyme and free enzyme
2.3.4 固定化酶和游离酶pH稳定性
如图7所示,在不同pH缓冲液中保存12 h后,固定化酶和游离酶在pH 4.0~5.0时,酶活力损失很多。固定化酶在pH 6.0~8.0时较为稳定,而游离酶的酶活力自pH 6.0之后就开始下降,至pH 9.0时,仅有50%的活力保留,固定化酶在pH 9.0~10.0仍保留了80%以上的活力。这说明相对游离酶,固定化酶在碱性条件下有着更好的pH稳定性。在很多情况下,固定化载体可以充当一个离子交换剂,对于酶的活力保留可以起到很大的保护作用[12]。
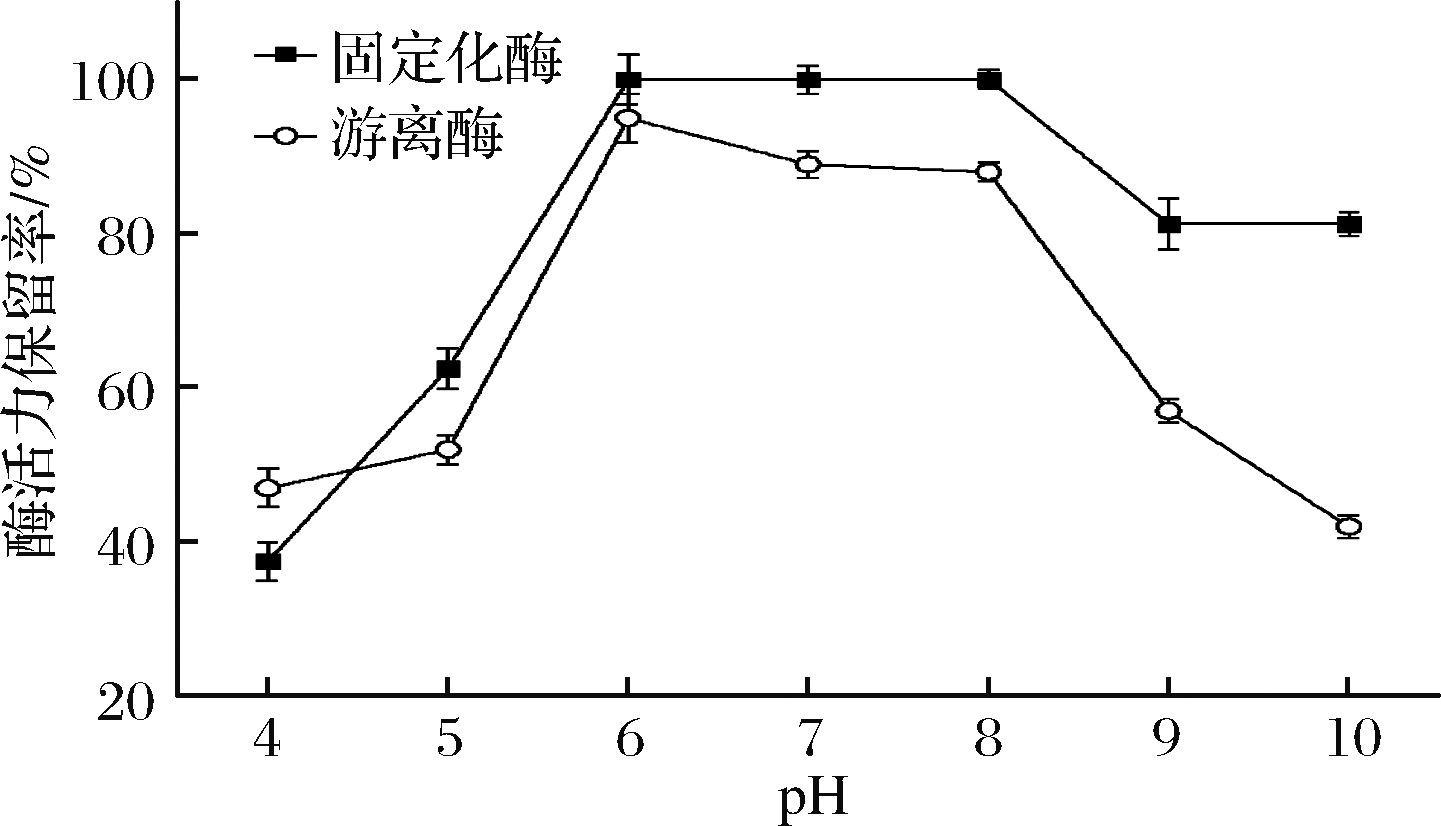
图7 固定化酶及游离酶pH稳定性比较
Fig.7 Comparison of pH stability betweenimmobilized enzyme and free enzyme
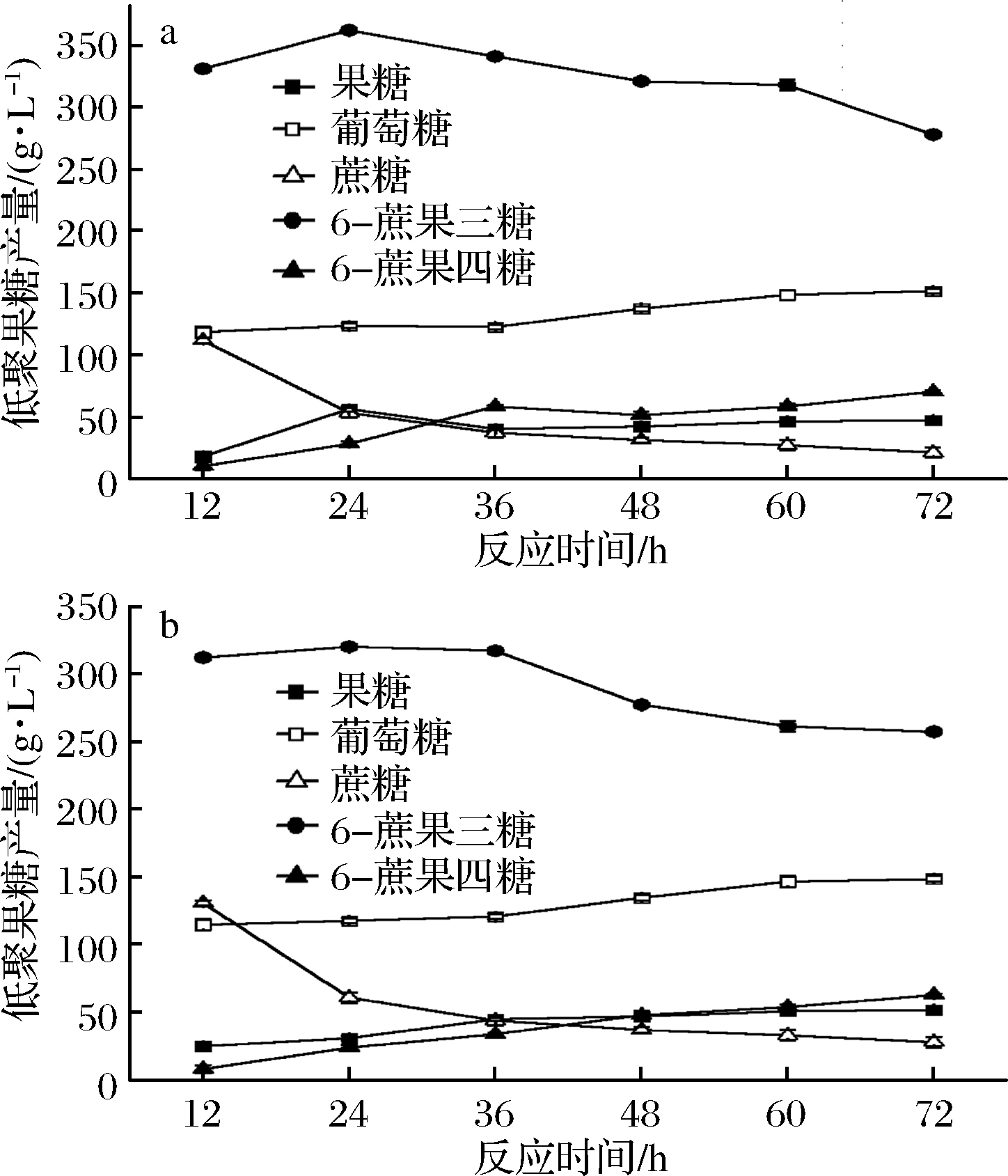
2.4 固定化酶和游离酶催化进程比较
固定化对于果糖苷酶催化合成低聚果糖的影响是衡量该固定化试验效果的重要标准。结果如图8所示,固定化酶和游离酶的反应趋势总体一致,固定化酶催化合成低聚果糖转化率在24 h达到了最高,合成的低聚果糖转化率约为72%,总低聚果糖约 360 g/L,其中蔗果四糖约为37 g/L。而游离酶同样在24 h达到了最高,合成的低聚果糖转化率约62%,其中 6-蔗果三糖约 323 g/L,蔗果四糖约23 g/L。固定化酶合成的蔗果四糖在72 h时最大约为 71 g/L,而游离酶最大为60 g/L。GUERRERO等[11] 使用表面修饰多官能团的载体对β-半乳糖苷酶进行固定化后,使其催化能力得到提高。
a-固定化酶催化合成低聚果糖反应进程;b-游离酶催化合成低聚果糖反映进程
图8 固定化酶与游离酶催化合成低聚果糖反应进程比较
Fig.8 Comparison of the reaction process between immobilizedenzyme and free enzyme catalyzed synthesis of oligofructose
2.5 固定化酶Fru6可重复利用次数
固定化酶重复催化合成低聚果糖的能力如图9所示,在重复催化12个批次后,低聚果糖的转化率略有降低,这表明固定化酶在重复使用的过程中,酶活没有明显的损失,依然具有较高的低聚果糖转化能力。说明该固定化果糖苷酶具有较好的稳定性,可以进行多批次催化合成低聚果糖。
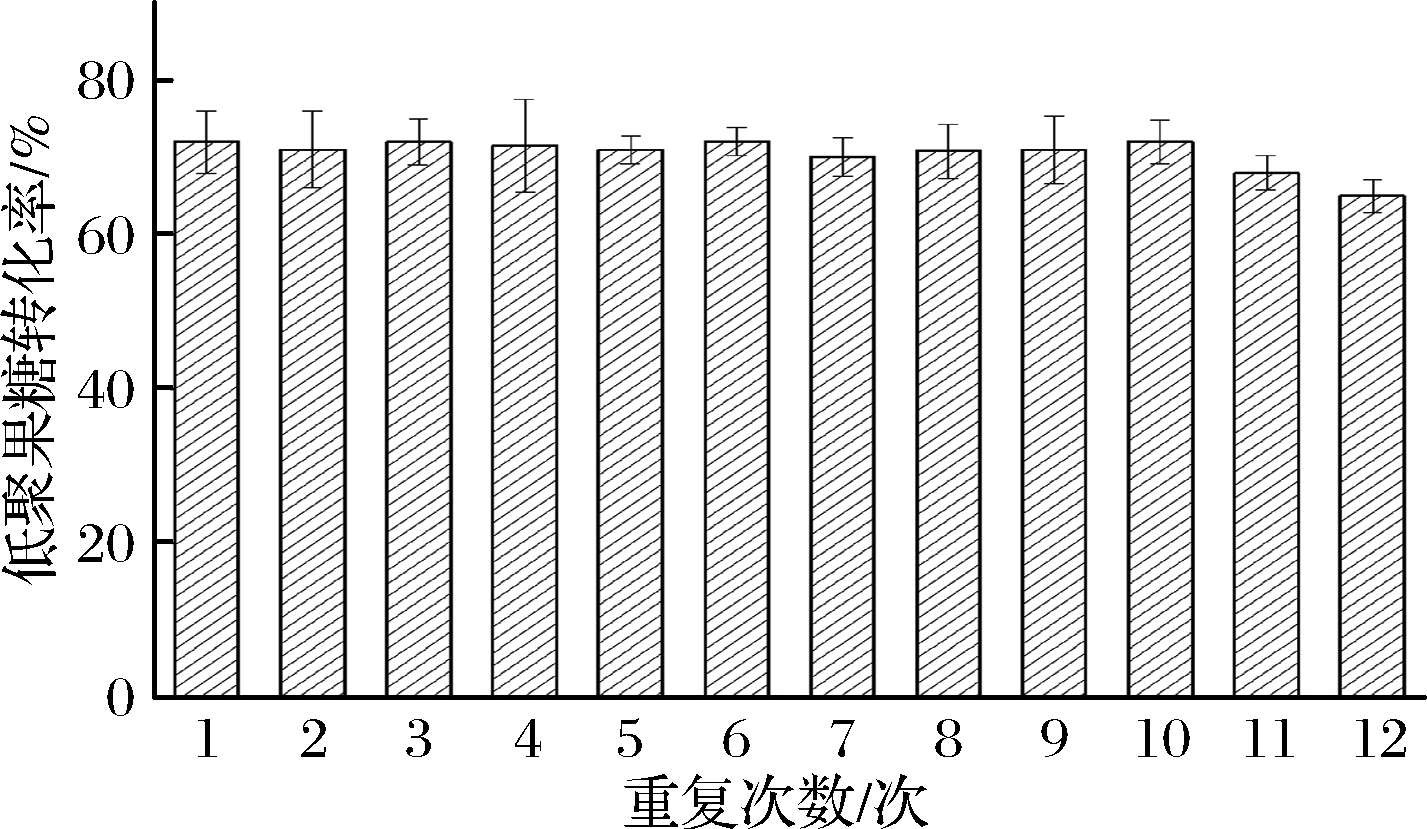
图9 固定化酶重复催化合成低聚果糖
Fig.9 Repeated catalytic synthesis ofoligofructose by immobilized enzyme
3 结论
使用来源于Arthrobacter arilaitensis的β-呋喃果糖苷酶,以大孔树脂MI-BN4为载体,研究了多官能团大孔树脂对果糖苷酶的固定化效果。对固定化条件进行优化,并研究了固定化酶酶学性质、催化合成低聚果糖能力以及可重复使用次数。总结如下:
(1)使用将吸附法和共价法结合的多官能团固定化后,经分析比较,发现Amino-glyoxyl-MI-BN4对酶活的回收率可以达到86.3%。对固定化过程进行优化后,在吸附时间6 h,温度25 ℃,加酶量40 U的条件下进行固定化,得到了酶活力205.7 U/g,酶活回收率95.2%,蛋白吸附量0.6 mg/g的固定化果糖苷酶。
(2)比较固定化酶和游离酶催化合成低聚果糖的反应进程曲线后发现,它们的催化进程并无明显区别。固定化酶低聚果糖的产量要高于游离酶的产量,达到了360 g/L,转化率为72%,游离酶为323 g/L,转化率为62%。经过12次的重复试验后,固定化酶的低聚果糖转化率略有下降,说明其具备了较好的操作稳定性。
[1] 熊伟,张健. 低聚果糖(FOS)-超强双歧因子[J]. 宁夏师范学院学报, 2005,26(6):292-294.
[2] LORENZONI A S G, AYDOS L F, KLEIN M P, et al. Fructooligosaccharides synthesis by highly stable immobilized β-fructofuranosidase from Aspergillus aculeatus[J]. Carbohydrate Polymers, 2014,103:193-197.
[3] NAWAZ A, BAKHSH J A, IRSAD S, et al. The functionality of prebiotics as immunostimulant: Evidences from trials on terrestrial and aquatic animals[J]. Fish Shellfish Immunol, 2018,76:272-278.
[4] SHEU D C, CHANG J Y, CHEN Y J, et al. Production of high-purity neofructooligosaccharides by culture of Xanthophyllomyces dendrorhous[J]. Bioresource Technology, 2013,132(3):432-435.
[5] BRUNO S N F,VAITSMAN D S,KUNIGAMI C N,et al.Influence of the distillation processes from Rio de Janeiro in the ethyl carbamate formation in Brazilian sugar cane spirits[J].Food Chemistry,2007,104(4):1 345-1 352.
[6] KILIAN S, KRITZINGER S, RYCROFT C, et al. The effects of the novel bifidogenic trisaccharide, neokestose, on the human colonic microbiota[J]. World Journal of Microbiology & Biotechnology, 2002,18(7):637-644.
[7] 苏汇,陈琼珍,何冰芳. 耐有机溶剂果糖苷酶的胞外表达、纯化和结晶[J]. 微生物学通报, 2015,42(11):2 126-2 132.
[8] 何冰芳.β-呋喃果糖苷酶突变体及其应用:中国, CN 201810405006.5 [P]. 2018-09-28.
[9] MATEO C, BOLIVAR J M, GODOY C A, et al. Improvement of enzyme properties with a two-step immobilizaton process on novel heterofunctional supports[J]. Biomacromolecules, 2010,11(11):3 112-3 117.
[10] LARRE S, CAMPARO P, COMPERAT E, et al. Diagnostic, staging, and grading of urothelial carcinomas from urine: Performance of BCA-1, a mini-array comparative genomic hybridisation-based test[J]. Eur Urol, 2011,59(2):250-257.
[11] GUERRERO C, VERA C, SERNA N, et al. Immobilization of Aspergillus oryzae β-galactosidase in an agarose matrix functionalized by four different methods and application to the synthesis of lactulose[J]. Bioresource Technology, 2017,232:53-63.
[12] RODRIGUES R C, ORTIZ C, BERENGUER-MERCIA A, et al. Modifying enzyme activity and selectivity by immobilization[J]. Chem Soc Rev, 2013,42(15):6 290-6 307.