醋是我国传统的调味品,深受消费者的喜爱[1-2]。然而因其固态发酵的特点,在酿制过程中会产生大量的醋糟[3-4]。醋糟数量较大,如果被当作废物丢弃,不仅污染环境,而且浪费资源,更严重的是影响了酿造行业的健康发展[5-6]。目前如何高价值利用醋糟成了研究热点,其再利用的途径主要有生产饲料、栽培基质和生物能源等[7-8]。醋糟用于饲料生产可提高饲料的营养价值和适口性,但此法会有副产物的产生,环境污染问题依旧没有彻底解决[9-12]。醋糟作为栽培基质可以降低栽培生产成本,提高经济效益,但主要集中应用在普通价值的平菇和景观植物[13-14]。醋糟在生物质能方面的利用主要有生产沼气、热裂解和厌氧发酵[15],这些研究仅限于机理和过程方面,实际生产中的应用仍需进一步的技术突破。
如何高值化的利用酿醋行业的发酵副产物,实现变废为宝,做到醋糟的零排放,实现发酵产业形成合理的生态产业链及副产物资源化高效利用模式,对我国的资源开发与环境保护具有十分重要的意义,也是今后酿造行业的重要课题。本试验主要探析醋糟分步降解为酒精,希望为醋糟的有效循环利用提供新的突破。
1 材料与方法
1.1 试验材料
鲜醋糟(为工厂淋醋完成后,未经其他任何处理的湿醋渣,冷冻保存)、棉籽壳、麸皮:宜宾市S醋业有限公司;葡聚糖淀粉酶NS22035(酶活为21.17 IU/mL)、木聚糖酶NS22083(酶活为17.08 IU/mL)、纤维素酶NS22086(酶活为25.47 IU/mL)、复合酶NS22002(其中主要的β-葡萄糖苷酶酶活为6.77 U/mL):诺维信天津分公司;南阳五号酵母(1300):四川省菌种保藏中心;NaOH、蔗糖、木糖、间苯三酚、柠檬酸、柠檬酸钠(分析纯):成都市科隆化学品有限公司。
1.2 仪器与设备
101C-3B型电热恒温鼓风干燥箱,上海市崇明试验仪器厂;BS210S型电子分析天平,北京赛多利斯天平有限公司;SW-CJ-2FD型超净工作台,苏州净化设备有限公司;UV-1100型紫外分光光度计,上海美普达仪器有限公司;HZO-X100型气浴摇床,太仓豪诚实验仪器制造有限公司;PHs-3c型精密pH计,上海理达仪器厂;KH19A型离心机,湖南凯达离心机厂;QP2010型气-质联用仪,日本岛津公司;TR-5MS型色谱柱(30.0 m×320 μm×0.25 μm),美国Thermo公司。
1.3 试验流程
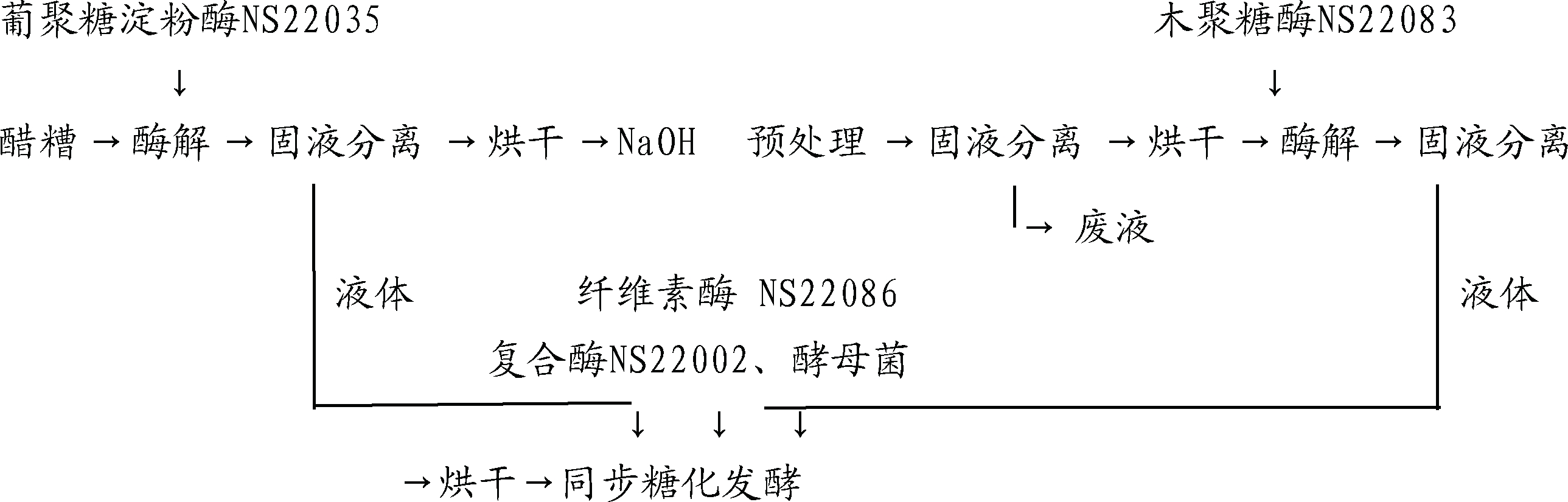
1.4 试验方法
1.4.1 回收鲜醋糟中粗淀粉的试验
按照刘跃红等[16]降解白酒丢糟的方法,将100 g鲜醋糟(含水质量分数68%)装入500 mL玻璃三角瓶中,加入100 mL浓度为0.05 mol/L的柠檬酸盐缓冲溶液,用NaOH溶液调节pH值为5.0。加入不同含量的葡聚糖淀粉酶NS22035,三角瓶放置于气浴摇床内处理72 h,摇床的条件设定为温度50 ℃,转速150 r/min。反应结束后,用真空抽滤的方法进行固液分离,固体经60 ℃烘干后用于后续试验,回收得到的液体用于后续同步糖化酒精发酵补充糖液。
1.4.2 NaOH预处理回收粗淀粉后干醋糟的单因素试验
将回收残余淀粉后的干醋糟经粉碎后与一定浓度的NaOH溶液混合均匀,NaOH浓度0.5~2.5 mol/L,固液比1∶6~1∶16(g∶mL),反应时间在30~90 min,反应温度45~85 ℃。待反应结束后,用真空抽滤的方法进行固液分离,并在60℃下烘干至恒重。将干醋糟、木聚糖酶NS22083(木聚糖酶与干醋糟质量比为0.1∶100)、100 mL浓度为0.05 mol/L的柠檬酸盐缓冲溶液放入250 mL三角瓶中,用NaOH溶液调节pH值至5.0,放入温度为50 ℃、转速150 r/min的气浴摇床内反应96 h。反应结束后进行固液分离,并测定液体中还原糖的浓度,固体在60 ℃恒温下干燥至恒重待用,液体回收用于后续同步糖化酒精发酵。
1.4.3 NaOH预处理条件优化响应面试验
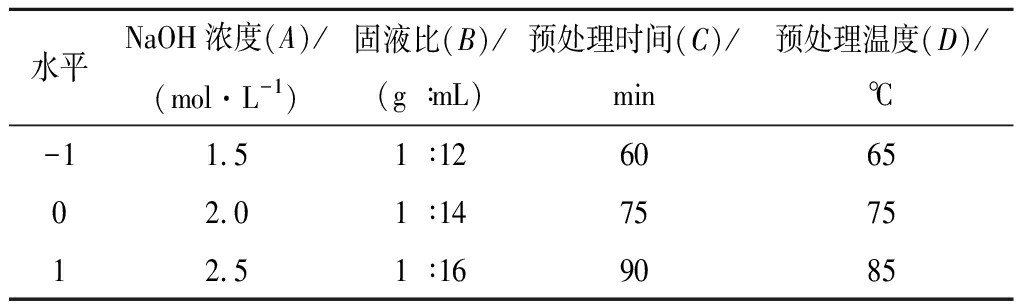
在单因素试验的基础上,选取NaOH浓度(A)、固液比(B)、预处理时间(C)、预处理温度(D)为考察因素,以还原糖产率(Y)为评价指标,根据Box-Benhnken的中心组合试验设计原理[17],进行4因素3水平的响应面分析试验,确定NaOH预处理干醋糟的最佳工艺条件,因素与水平见表1。
1.4.4 酵母菌种培养
菌种活化:将南阳五号酵母(1300)菌种转接至10 °Brix 的米曲汁斜面培养基,30℃恒温培养48 h待用。
表1 NaOH预处理工艺条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface experiments for process conditions optimization of NaOH pretreatment
水平NaOH浓度(A)/(mol·L-1)固液比(B)/(g∶mL)预处理时间(C)/min预处理温度(D)/℃-11.51∶12606502.01∶14757512.51∶169085
种子制备:取250 mL三角瓶,加入10 °Brix的米曲汁100 mL,并在121℃条件下灭菌15 min,冷却后挑取活化斜面培养基上的新鲜酵母菌苔1饵接入培养基中,纱布封口,27 ℃、150 r/min振荡培养24 h。之后将种子液进行扩培,每次扩培取出种子液都是10%,培养温度每次提高3 ℃,120 r/min培养72 h,使酵母菌数达到107CFU/mL以上后待用。
1.4.5 同步糖化发酵正交试验设计
将纤维素酶及复合酶加入到经木聚糖酶降解后的干醋糟进行同步糖化发酵。将经木聚糖酶NS22083降解后的干醋糟、回收残余淀粉收集到的糖液、木聚糖酶NS22083降解后的糖液放入500 mL三角瓶中,同时加入3.56 mL纤维素酶NS22086 (0.2 mL酶/g固体)、0.89 mL复合酶NS22002 (0.05 mL酶/g固体)与适量的酵母菌种子液,三角瓶口用1个橡胶套住,用来收集发酵过程中产生的CO2,三角瓶放入气浴摇床中,恒温处理若干小时。选择酵母菌接种量(G)、摇床转速(H)、处理温度(I)、处理时间(J)为4因子,以酒精产率为优化目标,进行正交试验(见表2)。
表2 正交试验设计表
Table 2 Orthogonal test design table

水平酵母菌接种量(G)/%摇床转速(H)/(r·min-1)处理温度(I)/℃处理时间(J)/h110100287221212030843141403296
1.5 分析方法
醋糟主要成分中,粗淀粉、灰分、水分等按照GB/T 5009.9—2016[18]、GB/T 6438—2007[19]和GB/T 6435—2014[20]测定;纤维素、半纤维素和木质素的分析参照NREL法测定[21];还原糖采用DNS法测定[22];酒精采用气相色谱异丙醇内标法测定[23]。经过3次平行试验得到试验数据,醋糟主要成分如表3所示。
表3 醋糟主要组成
Table 3 Composition of the vinegar residue

成分质量分数/%水分68.12±0.79粗淀粉5.22±0.13 纤维素8.36±0.24 半纤维素7.86±0.11 木质素5.35±0.18 灰分3.14±0.29 其他2.08±0.15
还原糖产率、酒精产率的计算方法[16]如公式(1)、(2)所示:
(1)
式中:SY是还原糖的产率,mg/g;WTSP是经过酶降解后的还原糖的质量,g;WPDVR是经过烘干后的醋糟质量。
(2)
式中:EP是酒精产率,g/100 g;WEPF是同步糖化发酵后酒精质量,g;WCDVR是经过NaOH预处理后的醋糟质量,g。
实验数据以![]() 表示,采用Origin Pro 10.2软件进行数据制图,PASW Statistics 18软件统计分析,Design Expert 11.1.0.1软件进行响应面设计及结果分析。
表示,采用Origin Pro 10.2软件进行数据制图,PASW Statistics 18软件统计分析,Design Expert 11.1.0.1软件进行响应面设计及结果分析。
2 结果与分析
2.1 葡聚糖淀粉酶对回收鲜醋糟粗淀粉的影响
利用葡聚糖淀粉酶NS22035回收鲜醋糟中的粗淀粉,测定在不同葡聚糖淀粉酶NS22035用量的条件下溶液中还原糖的浓度,结果如图1所示。由图1可知,溶液中还原糖浓度随着酶用量增加而升高;当葡聚糖淀粉酶NS22035用量为0.22 mL/100 g时,溶液中还原糖的质量浓度达到最高的(18.6±0.1)g/L。当酶用量在0.19 mL/100 g时,溶液中还原糖的浓度较酶用量在0.22 mL/100 g时略低,但两者差异不显著(P>0.05)。故考虑酶用量成本,选择0.19 mL/100 g作为回收鲜醋糟中粗淀粉的酶用量。在此酶用量下,可回收液体96 mL,还原糖质量浓度为(18.2±0.2)g/L,鲜醋糟中30.1%(质量分数)的粗淀粉被回收;回收固体为(27.8±0.6)g,固体回收率为87.2%。
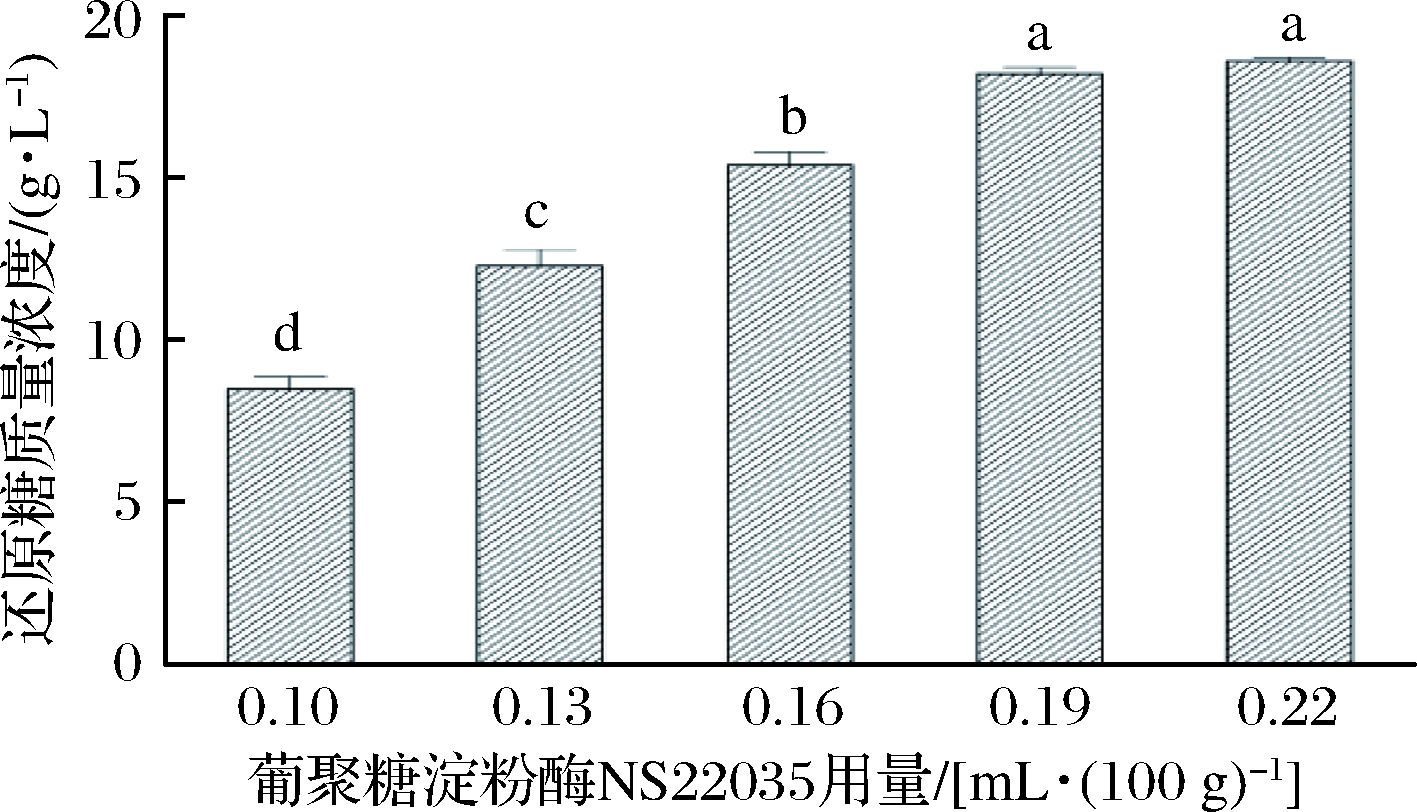
图1 淀粉酶用量对回收鲜醋糟粗淀粉的影响
Fig.1 Effects of the amount of amylase on crudestarch recovery from fresh vinegar residue注:不相同字母表示差异显著(P<0.05)。下同。
2.2 NaOH浓度对酶降解醋糟的影响
在固液比为1∶10(g∶mL)、预处理温度65 ℃、预处理时间60 min的条件下,考察NaOH浓度在0.5、1.0、1.5、2.0、2.5 mol/L时的变化,处理回收淀粉后的干醋糟对酶解的影响,结果如图2所示。由图2可知,随着NaOH浓度的不断增加,还原糖的产率也逐渐提高,还原糖的产率最高达到(395.7±4.2)mg/g。其原因可能是NaOH浓度越高,其溶解原料中木质素的能力就越强,同时醋糟中纤维素等物质损耗也随着NaOH浓度升高而增多。当NaOH浓度为2 mol/L时,还原糖的产率为(388.7±7.0)mg/g,与还原糖最高产率之间无显著性差异(P>0.05)。因此,选择1.5~2.5 mol/L的NaOH浓度用于后续响应面试验。
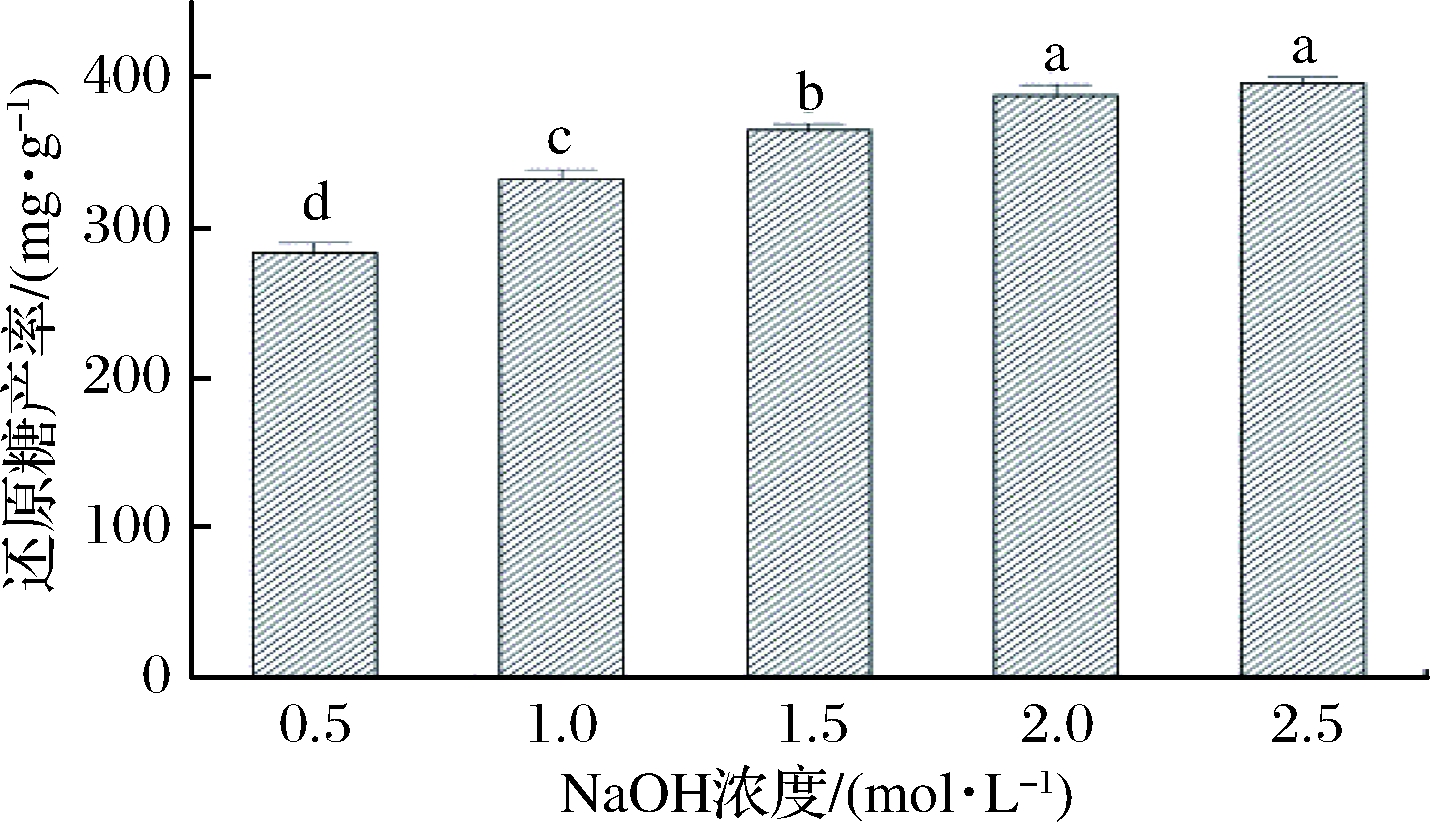
图2 NaOH浓度对酶降解醋糟的影响
Fig.2 Effects of NaOH concentration onenzymatic degradation of vinegar residue
2.3 固液比对酶降解醋糟的影响
在NaOH浓度为2 mol/L、预处理温度65 ℃及预处理时间60 min条件下,探讨固液比分别为1∶6、1∶8、1∶10、1∶12、1∶14、1∶16(g∶mL)对酶降解醋糟效果的影响,结果如图3所示。溶液中还原糖的产率随着液体比例的增加而增加,最高产率达到(476.0±2.3)mg/g。由于NaOH溶液的增多,增大了原料与溶液接触的面积,使其反应更加充分。故选择较高的液体比例对后续酶解反应越为有利,当固液比达到1∶14 后,继续增加液体比例虽能增加酶解溶液中还原糖的产率但增加的数值不显著(P>0.05)。因此,选择1∶12、1∶14、1∶16的固液比用于后续响应面试验。
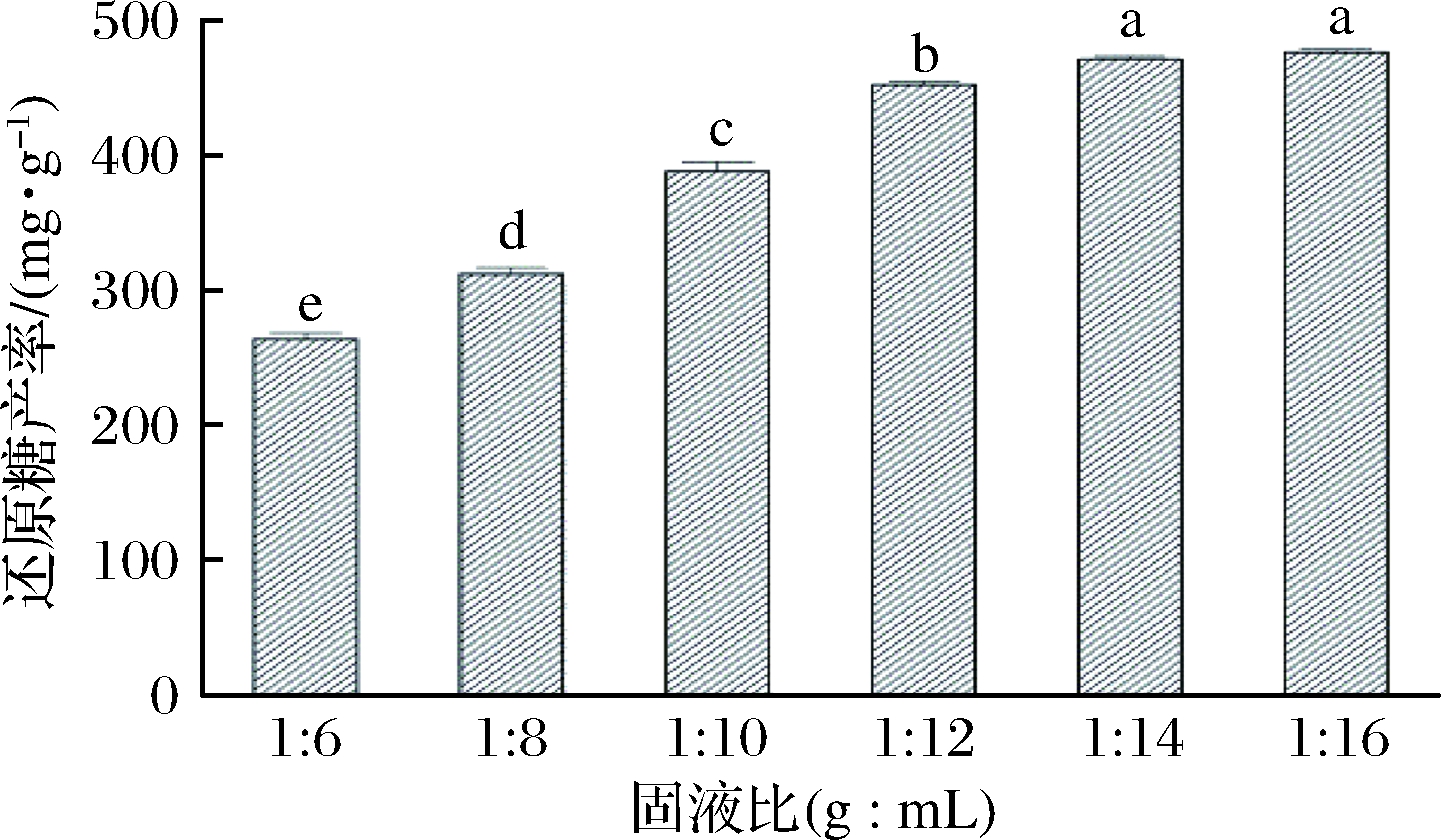
图3 固液比对酶降解醋糟的影响
Fig.3 Effect of solid-to-liquid ratio on enzymaticdegradation of vinegar residue
2.4 预处理时间对酶降解醋糟的影响
在NaOH浓度为2 mol/L、固液比1:14(g∶mL)及预处理温度为65℃时,分别考察预处理时间30、45、60、75、90 min对酶降解醋糟效果的影响,结果如图4所示。由图4可知,随着预处理时间的延长,还原糖的产率逐渐提高,预处理时间越长对原料的溶解越充分。当预处理时间为75 min时,酶水解液中还原糖的产率为(548.7±7.5)mg/g,虽较预处理时间为90 min时还原糖的(557.7±3.5)mg/g产率低,但二者之间无显著性差异(P>0.05)。考虑到成本问题,选择预处理时间为60~90 min用于响应面试验。

图4 预处理时间对酶降解醋糟的影响
Fig.4 Effect of pretreatment time on enzymaticdegradation of vinegar residue
2.5 预处理温度对酶降解醋糟的影响
在NaOH浓度为2 mol/L、固液比1∶14(g∶mL)及预处理时间75 min时,研究预处理温度分别在45、55、65、75、85 ℃时对酶降解醋糟效果的影响,试验结果如图5所示。由图5知,随着NaOH预处理温度的升高,溶液中还原糖的产率呈现先升高后降低的趋势。当预处理温度为75 ℃时,酶解液中还原糖的产率达到最高的(627.0±5.6)mg/g,表明75 ℃是NaOH预处理醋糟较佳的温度,当体系的温度高于或低于75 ℃时,还原糖的产率均低于627.0 mg/g。因此选择65~85 ℃用于后续响应面试验。
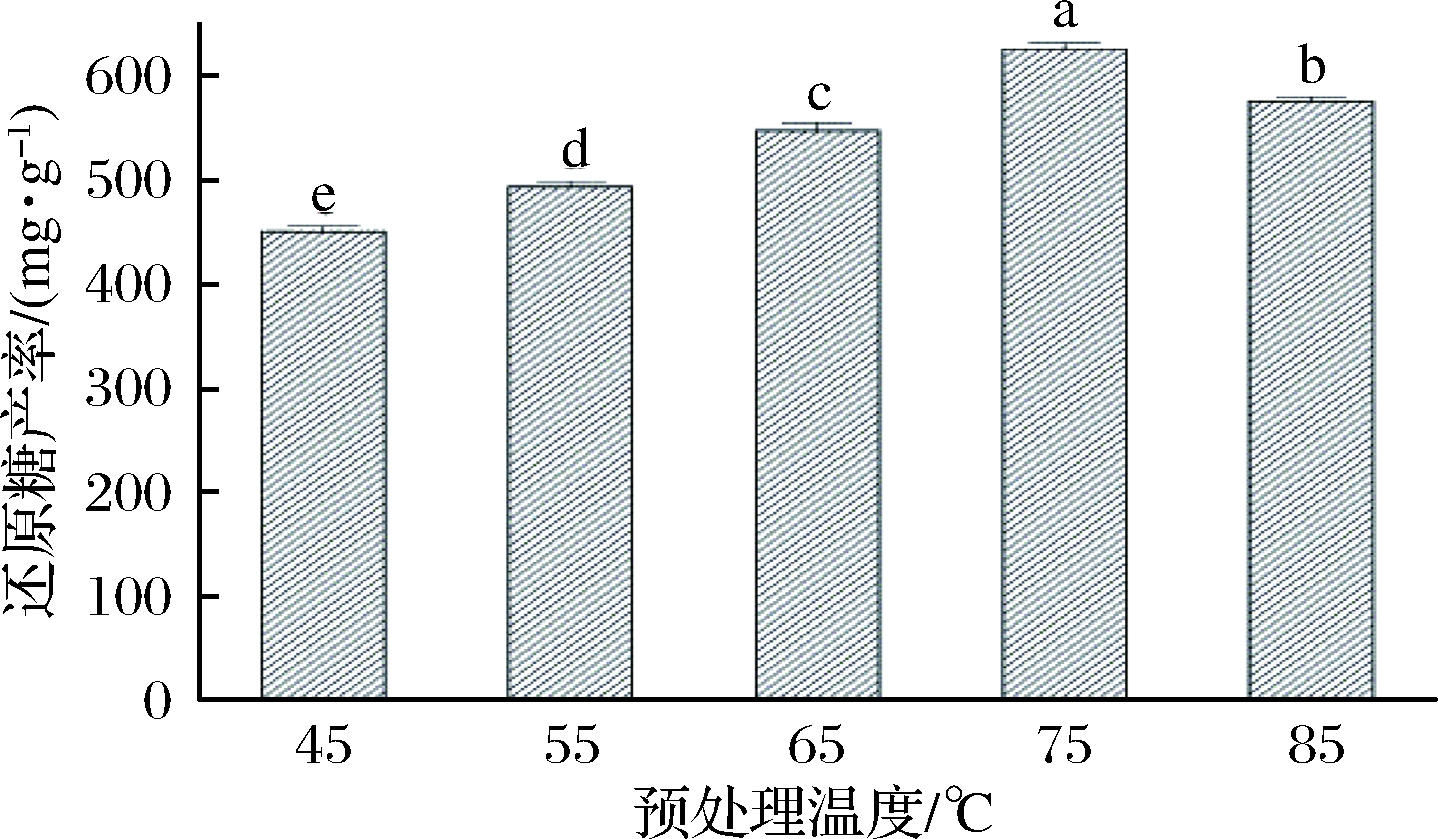
图5 预处理温度对酶降解醋糟的影响
Fig.5 Effect of pretreatment temperature onenzymatic degradation of vinegar residue
2.6 NaOH预处理干醋糟工艺条件优化响应面试验结果
在单因素试验的基础上,根据Box-Benhnken中心组合试验设计原理[24-25],考察4个因素对酶解液中还原糖产率的影响,响应面试验结果见表4,方差分析见表5。
表4 NaOH预处理工艺条件优化响应面试验设计及结果
Table 4 Design and results of response surface experiments for process conditions optimization of NaOH pretreatment
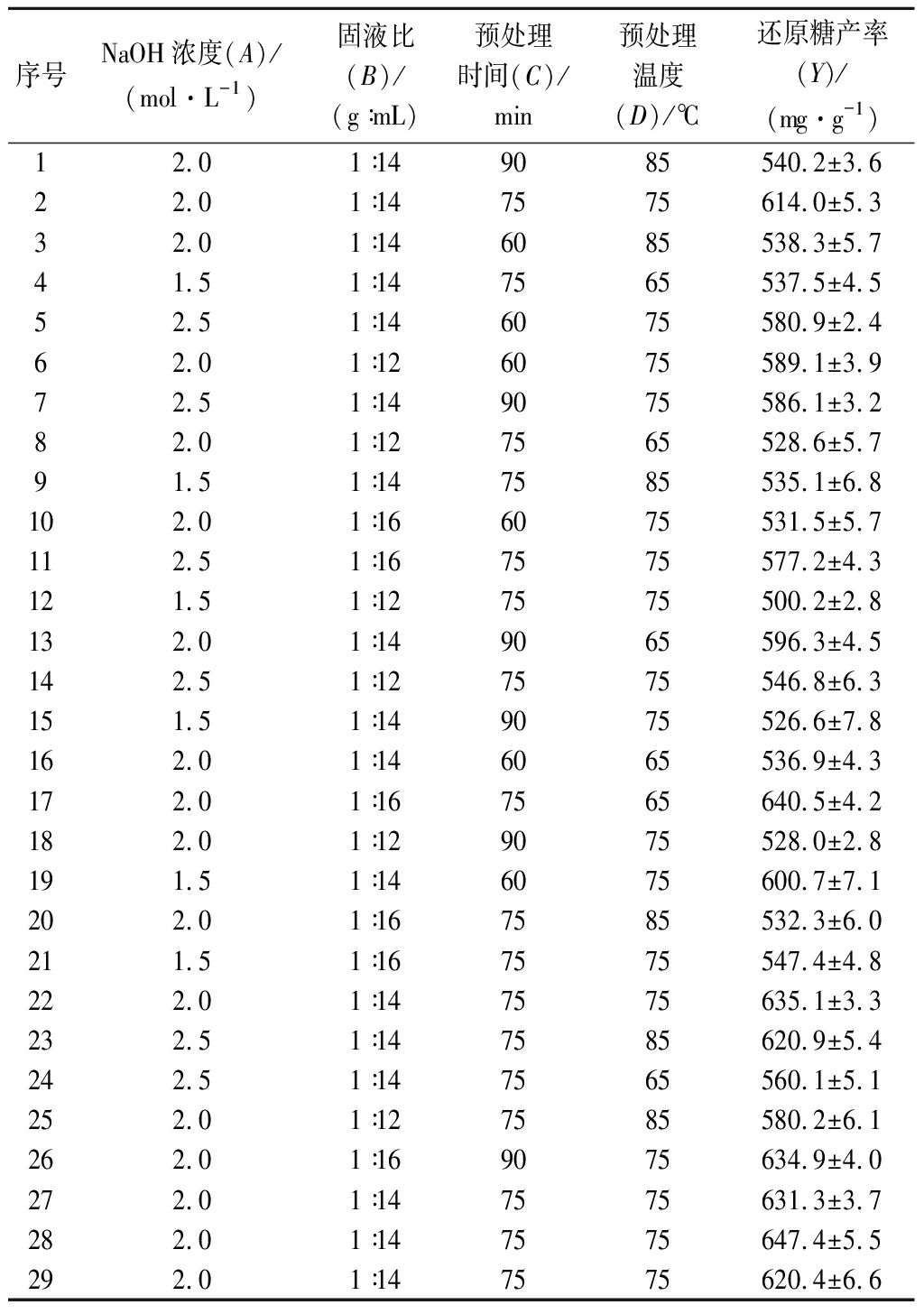
序号NaOH浓度(A)/(mol·L-1)固液比(B)/(g∶mL)预处理时间(C)/min预处理温度(D)/℃还原糖产率(Y)/(mg·g-1)12.01∶149085540.2±3.6 22.01∶147575614.0±5.3 32.01∶146085538.3±5.7 41.51∶147565537.5±4.5 52.51∶146075580.9±2.4 62.01∶126075589.1±3.9 72.51∶149075586.1±3.2 82.01∶127565528.6±5.7 91.51∶147585535.1±6.8 102.01∶166075531.5±5.7 112.51∶167575577.2±4.3 121.51∶127575500.2±2.8 132.01∶149065596.3±4.5 142.51∶127575546.8±6.3 151.51∶149075526.6±7.8 162.01∶146065536.9±4.3 172.01∶167565640.5±4.2 182.01∶129075528.0±2.8 191.51∶146075600.7±7.1 202.01∶167585532.3±6.0 211.51∶167575547.4±4.8 222.01∶147575635.1±3.3 232.51∶147585620.9±5.4 242.51∶147565560.1±5.1 252.01∶127585580.2±6.1 262.01∶169075634.9±4.0 272.01∶147575631.3±3.7 282.01∶147575647.4±5.5 292.01∶147575620.4±6.6
表5 回归模型的方差分析
Table 5 Variance analysis of regression model
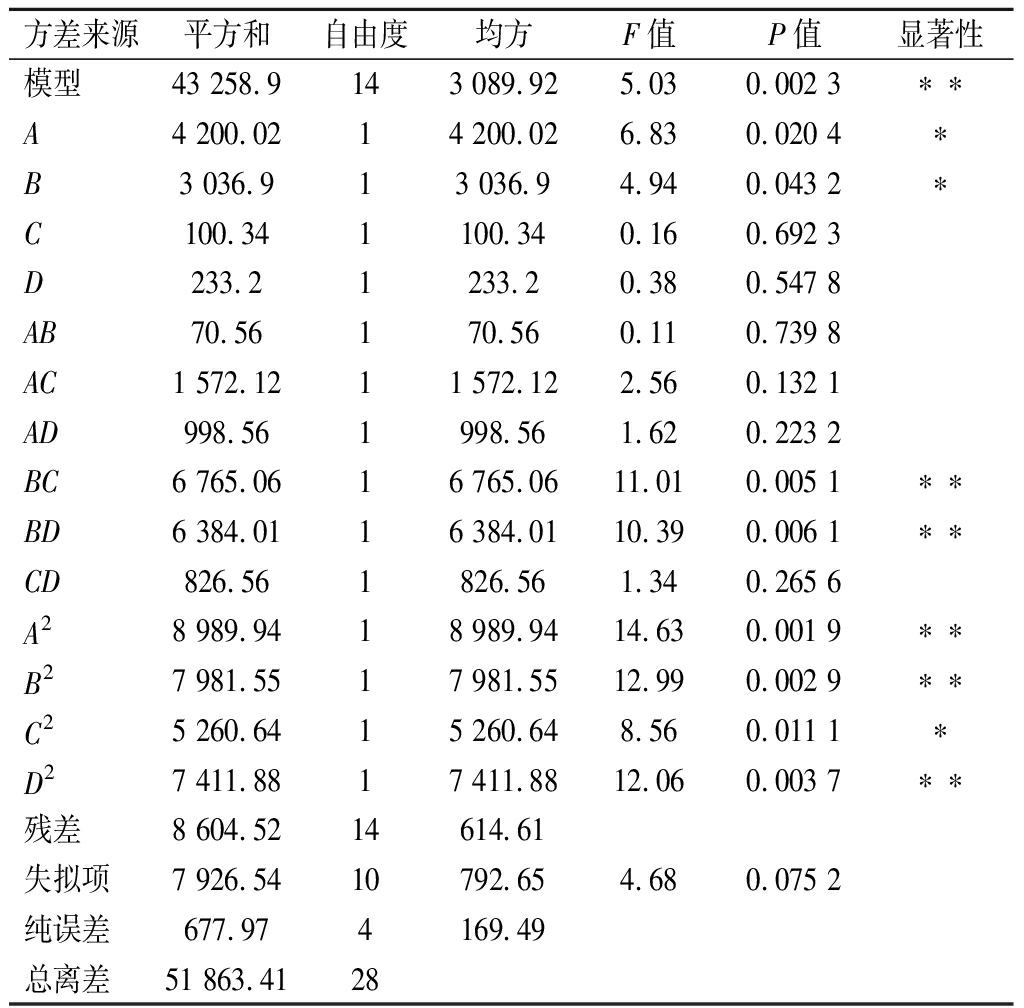
方差来源平方和自由度均方F值P值显著性模型43 258.9143 089.925.030.002 3∗∗A4 200.0214 200.026.830.020 4∗B3 036.913 036.94.940.043 2∗C100.341100.340.160.692 3D233.21233.20.380.547 8AB70.56170.560.110.739 8AC1 572.1211 572.122.560.132 1AD998.561998.561.620.223 2BC6 765.0616 765.0611.010.005 1∗∗BD6 384.0116 384.0110.390.006 1∗∗CD826.561826.561.340.265 6A28 989.9418 989.9414.630.001 9∗∗B27 981.5517 981.5512.990.002 9∗∗C25 260.6415 260.648.560.011 1∗D27 411.8817 411.8812.060.003 7∗∗残差8 604.5214614.61失拟项7 926.5410792.654.680.075 2纯误差677.974169.49总离差51 863.4128
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著(P<0.01)。
由表5可知,4个因素对还原糖产率影响的主次顺序依次为A>B>D>C,其中交互项BC和BD对结果影响极显著(P<0.01),一次项A、B对结果影响显著(P<0.05);二次项A2、B2、D2对结果影响极显著(P<0.01),C2对结果影响显著(P<0.05)。
通过Design Expert软件分析确定NaOH预处理醋糟的最佳工艺条件为NaOH浓度2.2 mol/L、固液比1∶14(g∶mL)、预处理时间88 min及预处理温度70 ℃。在此最优工艺条件下,进行3次平行验证,得到还原糖产率为(653.7±4.3)mg/g;固液分离后,得到液体94 mL,回收固体17.8 g,固体回收率为64.0%。
2.7 酵母菌接种量对同步糖化发酵的影响
酵母菌接种量的大小直接影响同步糖化发酵酒精的产量,在发酵容器中分别按糖液的6%、8%、10%、12%、14%接入酵母菌种子液,在摇床转速120 r/min及发酵温度30℃的条件下发酵72 h后测得酒精的产量,结果如图6所示。
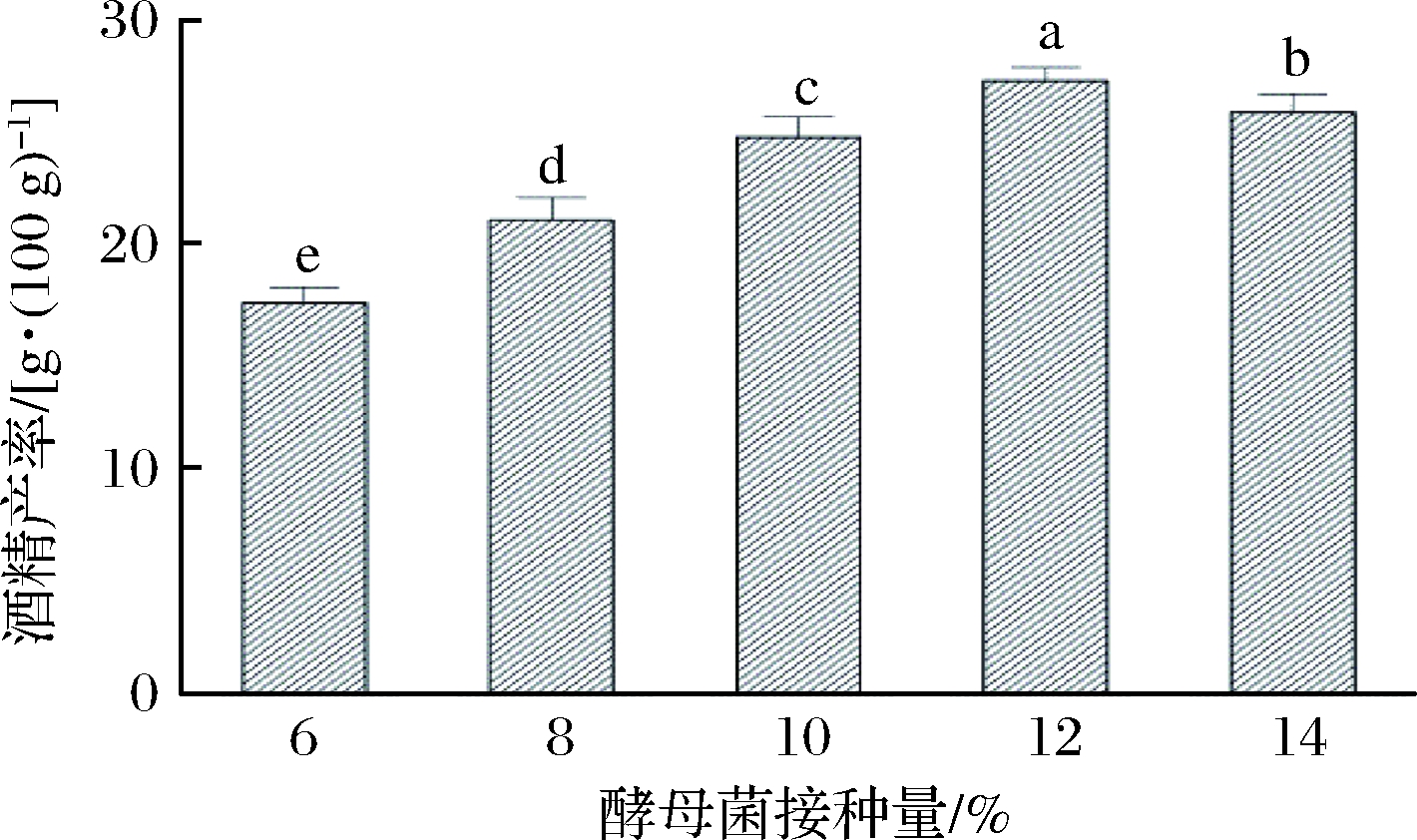
图6 酵母菌接种量对同步糖化发酵的影响
Fig.6 Effect of inoculum concentration of saccharomyceteson simultaneous saccharification and fermentation
由图6知,随着酵母菌接种量的提高,酒精的产率呈先上升后下降趋势。当接种量为12%时,酒精的产率达到最高的(27.3±0.6)g/100 g。之后开始下降,这可能是由于接种量过大,酵母菌大量繁殖所致,使原料部分用于酵母的生长繁殖,而影响酒精的产率。故选择最优酵母接种量为12%用于后续试验。
2.8 摇床转速对同步糖化发酵的影响
发酵容器中按糖液的12%接入酵母菌种子液,在处理温度30 ℃、处理时间72 h的条件下,考察摇床转速分别为60、80、100、120、140 r/min时同步糖化发酵酒精的产率,结果如图7所示。
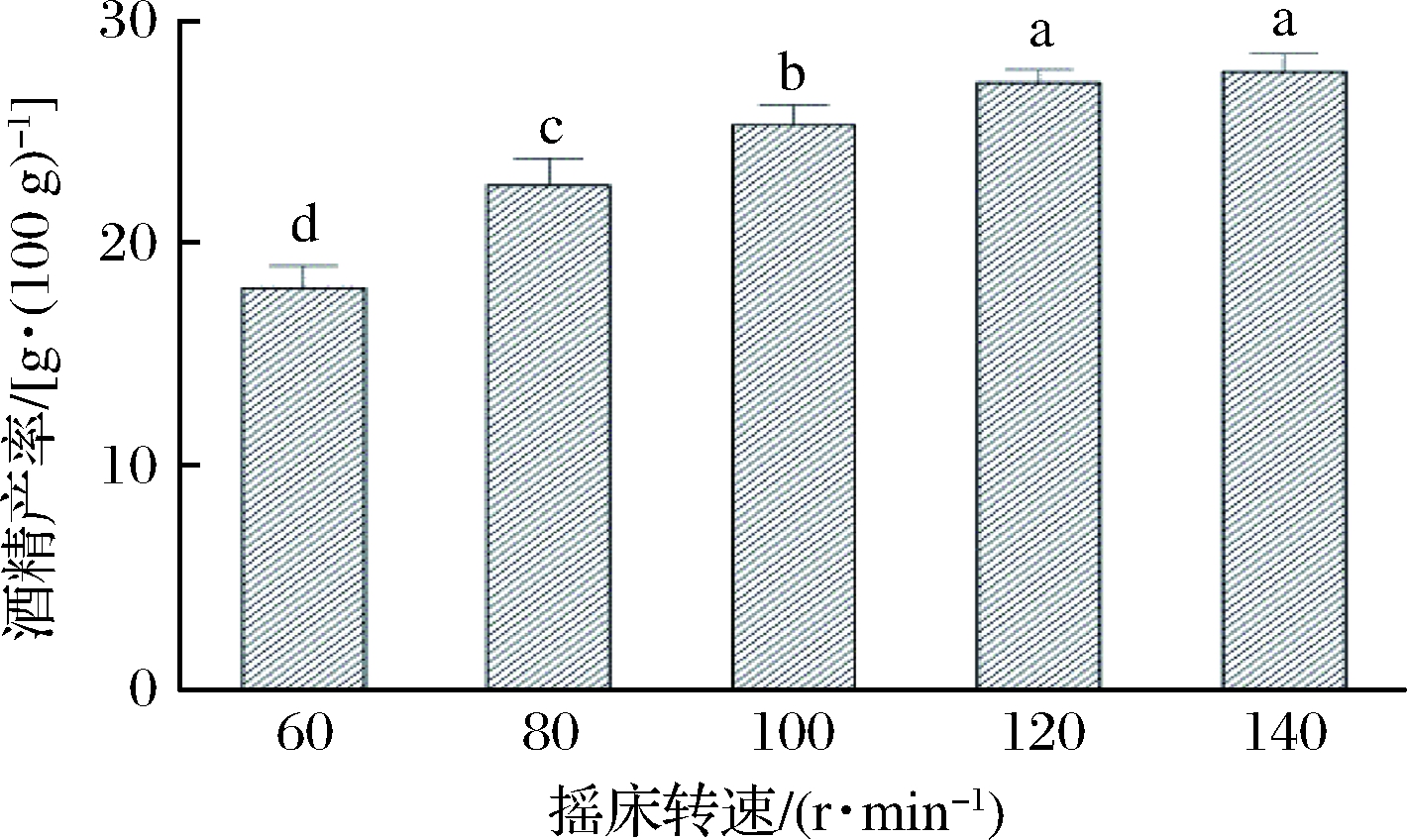
图7 摇床转速对同步糖化发酵的影响
Fig.7 Effect of table rotational speed on simultaneoussaccharification and fermentation
由图7可知,酒精的产率随着摇床转速的升高而升高,最高达到(27.8±0.8)g/100 g。摇床转速的不断升高促进了发酵醪液中反应速率的提升,但提升的幅度随着转速的升高而逐渐减小。当摇床转速为120 r/min时,其酒精的产率虽略低于140 r/min时的酒精产率,但二者无显著性差异(P>0.05)。从节能角度考虑选择摇床转速为120 r/min用于后续试验。
2.9 处理温度对同步糖化发酵的影响
发酵容器中按糖液的12%接入酵母菌种子液,在摇床转速120 r/min、处理时间72 h的条件下,探讨处理温度分别为26、28、30、32、34 ℃时同步糖化发酵酒精的产率,结果如图8所示。
由图8可知,酵母菌、复合酶同步糖化发酵的最适温度为30 ℃,在此条件下,酒精产率为(27.3±0.6)g/100 g。当反应体系的温度高于或低于30 ℃时,都未能使酵母菌与复合酶发挥最佳的处理效果,导致酒精产率均低于27.3 g/100 g。因此,选择处理温度为30 ℃用于后续试验。
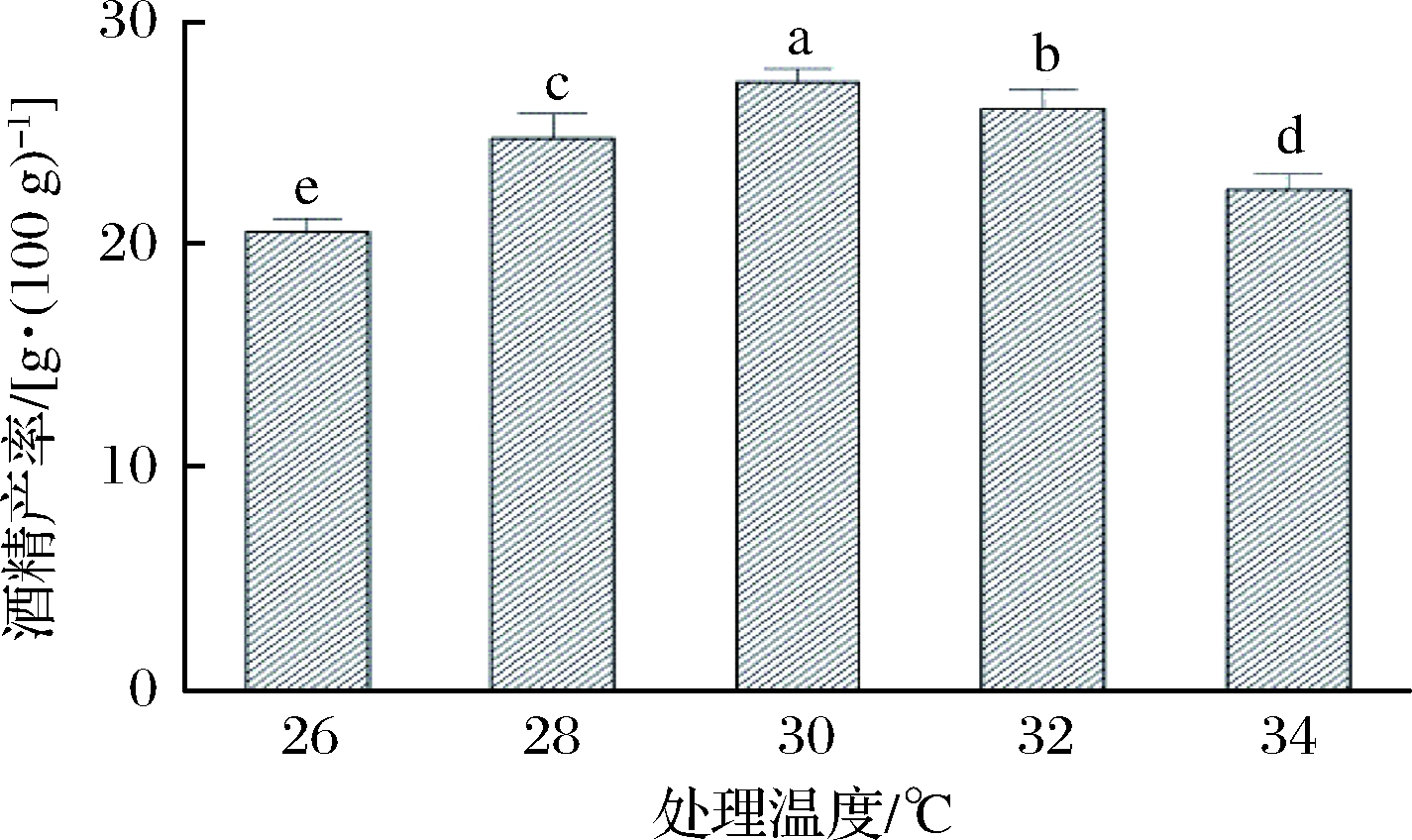
图8 处理温度对同步糖化发酵的影响
Fig.8 Effect of treatment temperature onsimultaneous saccharification and fermentation
2.10 处理时间对同步糖化发酵的影响
在酵母菌接种量12%、摇床转速120 r/min、处理温度30 ℃的条件下,分别研究处理时间为48、60、72、84、96 h时同步糖化发酵酒精的产率,结果如图9所示。
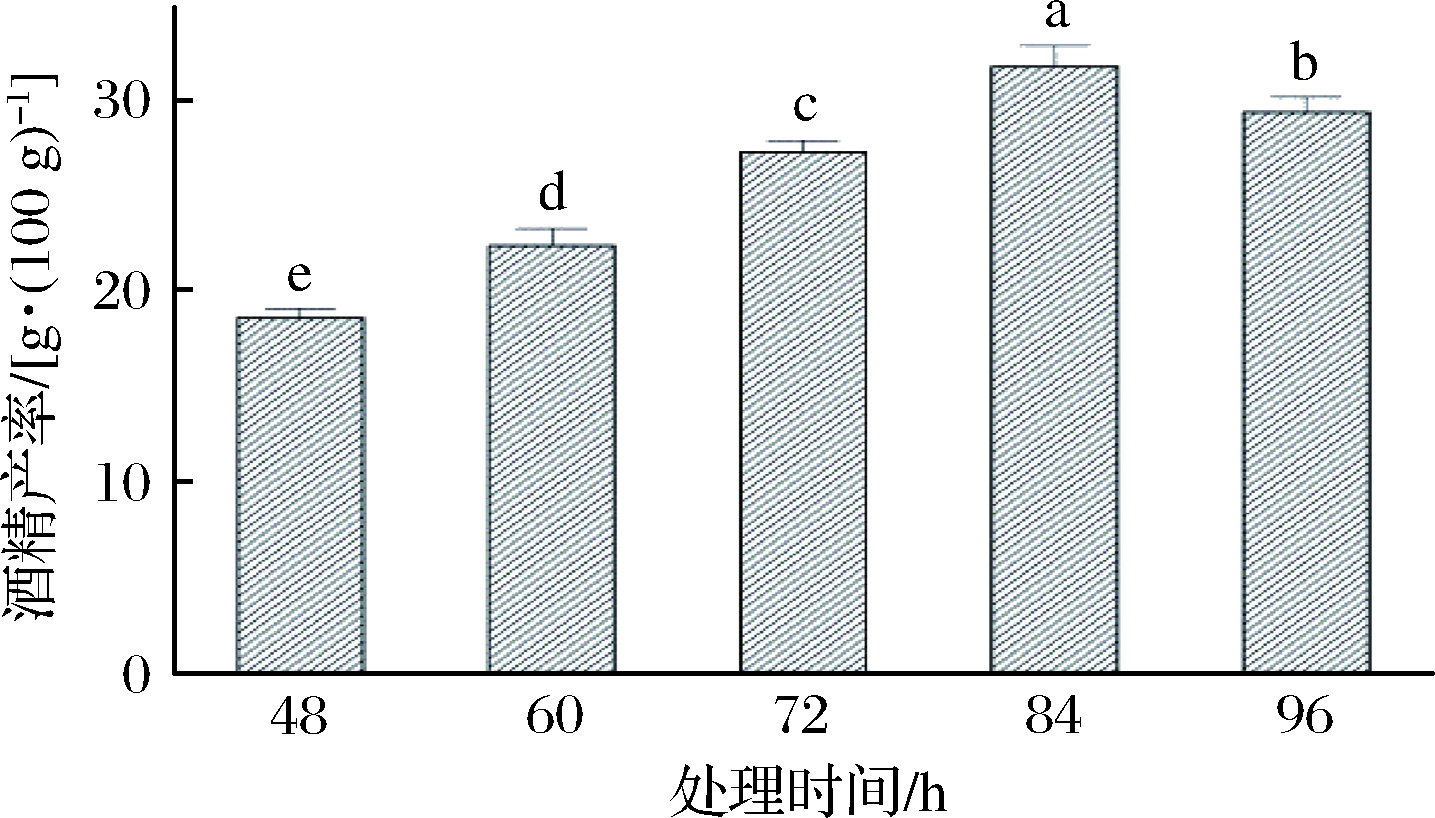
图9 处理时间对同步糖化发酵的影响
Fig.9 Effect of treatment time on simultaneoussaccharification and fermentation
由图9可知,随处理时间的增加,反应体系中酒精的产率呈现先上升后下降趋势,处理时间为84 h时,酒精的产率最高达到了(31.8±1.1)g/100 g。随着处理时间的延长,酒精可能被转化为酸等其他代谢产物,致使酒精产率下降[26]。因此,选择处理时间为84 h用于后续试验。
2.11 同步糖化发酵的正交试验结果
根据单因子试验结果选取酵母菌接种量、摇床转速、处理温度和处理时间为4因子,以酒精产率为优化目标,进行L9(34)正交试验。试验设计方案及结果见表6,方差分析结果见表7。
由表6知,影响酒精产率的主次因素为I>G>H>J,即处理温度对同步糖化发酵酒精产率的影响最强,其次是酵母菌接种量,再次为摇床转速。从k值的大小可知,最优组合为G3H3I2J2,即酵母菌接种量14%、摇床转速140 r/min、处理温度30 ℃、处理时间84 h。但该条件不在表6所示的9组实验中,故对该条件进行3次验证试验,得到酒精产率为(34.7±0.9)g/100 g,表明G3H3I2J2为最优条件。
表6 同步糖化发酵正交试验结果与分析
Table 6 Orthogonal test and analysis of simultaneous saccharification and fermentation
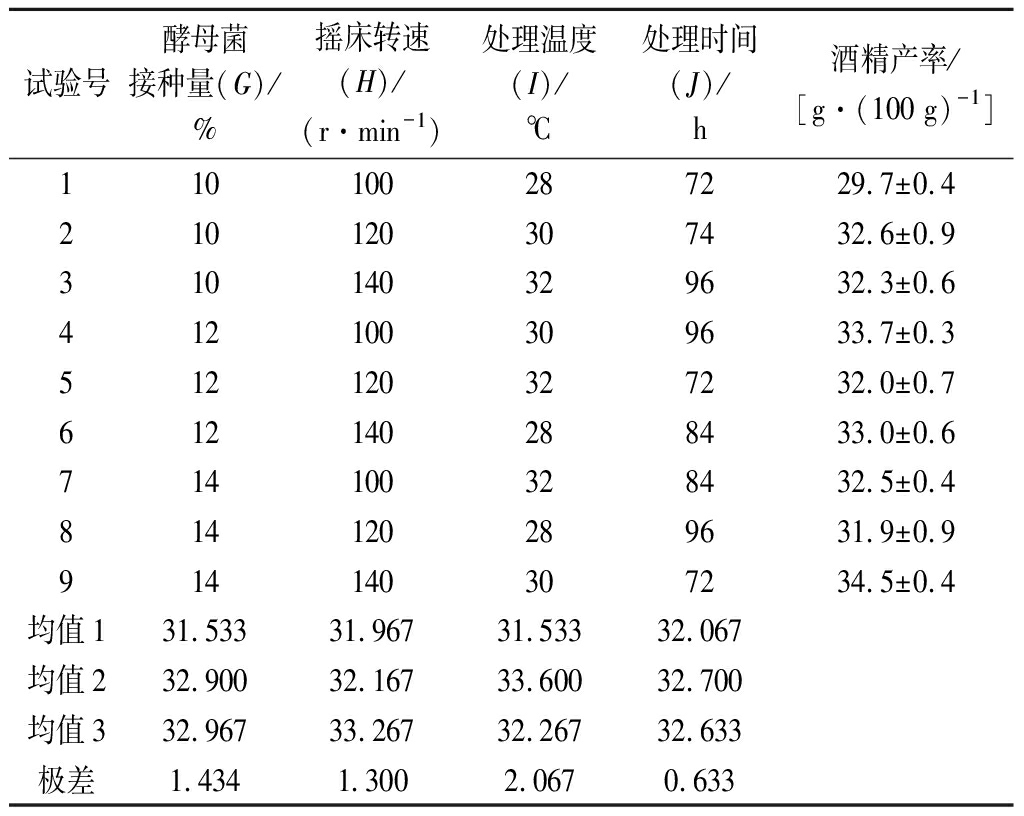
试验号酵母菌接种量(G)/%摇床转速(H)/(r·min-1)处理温度(I)/℃处理时间(J)/h酒精产率/[g·(100 g)-1]110100287229.7±0.4 210120307432.6±0.9 310140329632.3±0.6412100309633.7±0.3 512120327232.0±0.7 612140288433.0±0.6 714100328432.5±0.4 814120289631.9±0.9 914140307234.5±0.4 均值131.53331.96731.53332.067均值232.90032.16733.60032.700均值332.96733.26732.26732.633极差1.4341.3002.0670.633
为进一步验证以上分析结果,以酒精产率为考察对象对其进行方差分析,由于J(处理时间)这个因素均方值较小,因此将其作为误差项计算F值。由表7可知,I因素(处理温度)对酒精产率的影响显著(P<0.10)。因此,选择G3H3I2J2作为同步糖化酒精发酵的最优条件。
表7 正交试验方差分析
Table 7 Variance analysis of orthogonal test
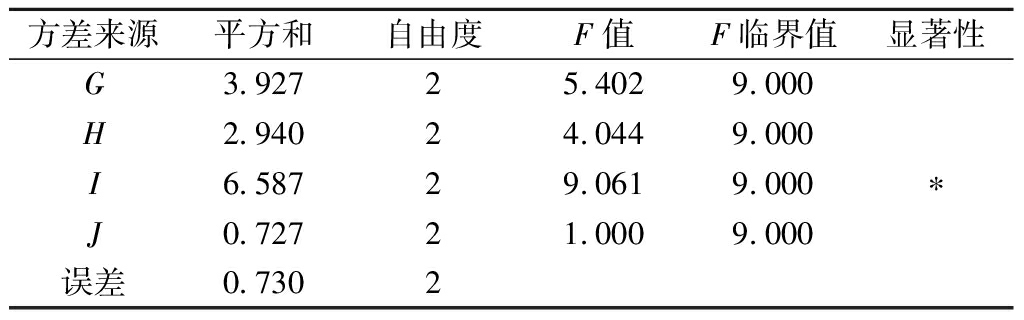
方差来源平方和自由度F值F临界值显著性G3.92725.4029.000H2.94024.0449.000I6.58729.0619.000∗J0.72721.0009.000误差0.7302
注:“*”表示对结果影响显著(P<0.10)。
3 讨论
试验利用醋糟中粗淀粉和纤维质含量较多的特点,采用复合酶法酶解纤维质原料的方法,将醋糟中的纤维质原料转化为糖类物质,进而转化为酒精。在同步化糖化生产酒精环节中,摇床转速在一定范围内与酵母菌的增殖成正相关,摇床转速越快,供氧量越高,菌体量越高,进而代谢产生的乙醇浓度也越高;当转速超过一定水平后,菌体增殖可能已经达到上限,因而其代谢能力并未显著提高。酵母菌的最适生长温度为28~30 ℃[27],酵母菌与复合酶NS22002同步化糖化生产酒精的最适温度在30 ℃左右,表明复合酶NS22002并未对酵母菌的生长代谢产生不良影响。
通过优化试验,可得到34.7 g/100 g的酒精产率,高于刘跃红等[16]利用白酒丢糟生产酒精28.7 g/100 g的酒精产率,同时也高于徐友海等[28]利用木薯渣生产酒精16 g/100 g的酒精产率,初步实现了醋糟生产酒精的可能。
在最优试验条件下,实验室生产1 L酒精所消耗各种酶、NaOH等试验材料的总费用为27.4元(见表8)。对比市场中1 L酒精(食品级)25~30元的售价,表明该试验方法具有一定的经济价值。后续对醋糟同步糖化生产酒精工艺中的其他环节进一步优化,例如优化试验菌种、复合酶的种类等,使其具备工业化生产酒精的可行性。
表8 生产1 L酒精所需耗材
Table 8 Consumables for production of 1 L alcohol

序号耗材数量单价金额/元1葡聚糖淀粉酶NS220354.3 mL35 元/L0.22木聚糖酶NS220832.3 mL68 元/L0.23纤维素酶NS2208680.0 mL72 元/L5.84复合酶NS2200220.0 mL88 元/L1.85NaOH2.7 kg6元/kg16.26柠檬酸盐缓冲溶液4.4 L0.1 元/L0.4710 °Brix的米曲汁314.5 mL9元/L2.8
4 结论
利用葡聚糖淀粉酶NS22035回收鲜醋糟中的残余淀粉,得到富含葡萄糖的糖液用做后续同步糖化发酵前期酵母菌糖液的消耗,该部分回收淀粉所得还原糖浓度为18.2 g/L,鲜醋糟中30.1%的粗淀粉被回收。经响应面试验设计优化后的NaOH预处理醋糟的各个因素条件为NaOH浓度2.2 mol/L、固液比1∶14(g∶mL)、预处理时间88 min及预处理温度70 ℃。在该条件下,后续采用正交试验优化同步糖化发酵生产酒精的试验条件,在酵母菌接种量14%、摇床转速140 r/min、处理温度30 ℃、处理时间84 h的条件下可得到34.7 g/100 g的酒精产率,经成本核算后,初步实现了醋糟生产酒精的可行性。
[1] 李明华,陆莹,孟秀梅. 醋的营养保健功能及其产品形式[J]. 农产品加工(学刊), 2014(10): 67-69.
[2] 徐清萍,敖宗华,陶文沂. 食醋功能研究进展(下)[J]. 中国调味品, 2004, 28(1): 19-23.
[3] 宋增廷,董晓芳,佟建明,等. 醋糟的营养价值及其在饲料生产中的应用[J]. 中国畜牧杂志, 2011, 47(9): 73-76.
[4] 宋增廷. 醋糟的营养价值及其对蛋鸡氮排泄的影响[D]. 北京:中国农业科学院, 2012: 10-29.
[5] 王芳,张变英,上官明军,等. 醋糟对育肥羊生产性能、屠宰性能及营养物质消化率的影响[J]. 黑龙江畜牧兽医, 2019(10): 120-123.
[6] 邓永平,艾瑞波,刘晓兰,等. GRAS真菌好食脉孢霉固态发酵醋糟产类胡萝卜素的优化[J]. 饲料工业, 2018, 39(18): 43-47.
[7] 陈晓寅,王振斌,马海乐,等. 醋糟的利用现状及前景[J]. 中国酿造, 2010, 29(10): 1-4.
[8] 蔡永敏. 中药药名辞典[M]. 北京:中国中医药出版社, 1996: 379.
[9] 王芳,上官明军,张变英,等. 山西省醋糟资源现状及其在动物生产中的应用[J]. 畜禽业, 2014, (10): 44-46.
[10] 宋春雪. 醋糟的研究与利用现状[J]. 中国调味品, 2011, 36(12): 1-4.
[11] 马希景,李中利. 醋糟饲喂肉兔的效果试验[J]. 中国养兔, 2003(4): 14-15.
[12] 于磊娟,杨小姣,马业准,等. 多菌偶联发酵樱桃醋糟生产蛋白饲料的工艺[J]. 饲料工业, 2009, 30(4): 39-41.
[13] WANG Z H, DONG X F, ZHANG G Q, et al. Waste vinegar residue as substrate for phytase production[J]. Waste Management & Research, 2011, 29(12): 1 262-1 270.
[14] 杨光,刘光磊,张春刚,等.醋糟新饲料原料开发利用研究进展[J].中国奶牛, 2014(9): 51-53.
[15] 周云龙,许之扬,赵明星,等. 醋糟高效厌氧消化体系构建[J]. 环境科学, 2017, 38(10): 4 340-4 347.
[16] 刘跃红,张文学,谭力,等. 浓硫酸降解白酒丢糟制备降解糖液的条件研究[J]. 中国酿造, 2011, 30(1): 82-85.
[17] 刘琨毅,王琪,冯雨辰,等. 响应面法优化黑豆米酒发酵工艺[J]. 中国酿造, 2018, 37(2): 179-183.
[18] 国家卫生和计划生育委员会国家食品药品监督管理总局. GB/T 5009.9—2016食品安全国家标准食品中淀粉的测定[S]. 北京:中国标准出版社, 2016.
[19] 中国人民共和国国家质量监督检验检疫总局. GB/T 6438—2007饲料中粗灰分的测定[S]. 北京:中国标准出版社, 2007.
[20] 中国人民共和国国家质量监督检验检疫总局. GB/T 6435—2014饲料中水分的测定[S]. 北京:中国标准出版社, 2014.
[21] 张红漫,郑荣平,陈敬文,等. NREL法测定木质纤维素原料组分的含量[J].分析试验室, 2010, (29)11: 15-18.
[22] 王平,王朋朋,左瑞雨,等. 牛瘤胃中米曲霉的分离鉴定及对玉米秸秆降解效果的研究[J]. 河南农业大学学报, 2010, 44(3): 295-299.
[23] CHEN Y, SHARMA-SHIVAPPA R R, KESHWANI D, et al. Potential of agricultural residues and hay for bioethanol production[J]. Applied Biochemistry and Biotechnology, 2007, 142(3): 276-290.
[24] 侯学敏,李林霞,张直峰,等. 响应面法优化薄荷叶总黄酮提取工艺及抗氧化活性[J]. 食品科学, 2013, 34(6): 124-128.
[25] 黄壹杨,刘琨毅,王琪,等. 基于响应面法优化红豆米酒发酵工艺的研究[J]. 食品与发酵工业, 2018, 44(5):130-134.
[26] 李进,吴冬梅. 泸州晚熟龙眼果酒酿造工艺研究[J]. 食品工业, 2017, 38(6):1-4.
[27] 杨天英,赵金海. 果酒生产技术[M]. 北京:科学出版社, 2010.
[28] 徐友海,岳军,朱庆伟,等. 木薯酒精渣同步糖化发酵制乙醇的工艺研究[J]. 化工科技, 2014, 22(2):16-19.