随着人们生活水平提高与健康意识加强,通过饮食调整促进自身健康的观念日益得到认同。乳酸菌发酵可赋予产品更为丰富的口感,同时赋予其更丰富的健康功能。近几十年来,乳酸菌发酵饮品的消费量日益扩大,呈倍数增长[1]。乳酸菌发酵产品也不再限于发酵乳制品。发酵果蔬汁饮料概念自2014年提出后逐渐被行业所关注[2]。发酵后的果蔬汁相比一般果蔬汁具有更为丰富的营养和功能成分,如VC、VK、叶酸、β-胡萝卜素、多酚类物质等[3-4]。乳酸菌作为人及动物肠道的益生菌,具有维持肠道生态平衡、提高机体免疫力等多种生理功能[5]。开发具有多种功能的乳酸菌发酵饮品,强化其保健作用将成为未来的发展方向[1]。同时,这对于可应用于果蔬汁发酵的成熟发酵剂产品也提出了更为迫切的需求。
乳酸菌本身的益生功能可为消费者提供更多的有益因素。随着现代人饮食结构的变化、心理因素和社会因素的影响,便秘的发病率有增高趋势。全球约16%的人群被功能性便秘困扰[6]。益生菌在发挥其润肠通便等肠道调节功能时,相比其他药物具有安全、无副作用等明显优势[7]。本研究从四川地区自然发酵的农家泡菜样品中分离乳酸菌,筛选获得1株同时具有良好植物基发酵性能与良好益生特性的菌株,为开发安全、有效且可应用于果蔬汁发酵的功能发酵剂产品提供基础。
1 材料与方法
1.1 菌种
8株植物乳杆菌,植物乳杆菌553、557、566、573、578、581、590、596分离自四川甘孜藏族自治州、阿坝藏族羌族自治州、凉山彝族自治州等地区农户采用传统方法制作的自然发酵泡菜样品。植物乳杆菌581(Lactobacillus plantarum 581)保藏于中国微生物菌种保藏管理委员会普通微生物中心,微生物保藏号CGMCC No.13121。
1.2 仪器与材料
Type B2 Steril GARD Ⅲ生物安全柜,美国Baker公司; Delta 320 pH计,瑞士Mettler Toledo公司;5810 R离心机,日本Olympus株式会社;DNP-111电热恒温培养箱,上海海向仪器的设备厂。
MRS培养基,英国Oxoid生物试剂有限公司;牛胆盐分析纯试剂,广州市金华大化学试剂有限公司;HT-29细胞株,中国科学院上海生命科学研究院细胞资源中心;ICR雄性SPF级小鼠,浙江省中医药大学动物试验中心;麻仁丸,杭州胡庆余堂药业有限公司;复方地芬诺酯,常州康普药业有限公司;活性炭、阿拉伯树胶,北京宝瑞杰科技有限公司。
紫薯汁、胡萝卜汁、大蒜浓缩汁、姜汁,金乡县金得利食品有限公司;香蕉汁、芒果汁,山东佳美食品工业有限公司;芦荟汁,云南万绿生物股份有限公司。
1.3 菌株培养
于-80℃条件下冷冻保存的乳酸菌种子液,室温解冻后,以2%接种比例接种于MRS液体培养基中,于37℃下培养16 h,连续活化2代。
1.4 耐酸性试验
植物乳杆菌581菌株培养至对数末期后,取适量菌液。4 000 r/min离心10 min后,弃上清,分别加入pH值为2.0和2.5的MRS液体培养基,37℃培养,于0、1、2、4 h后采用平板计数法测定其活菌数,每组3次平行。
1.5 耐胆盐试验
植物乳杆菌581菌株培养至对数末期后,取适量菌液。4 000 r/min离心10 min后,弃上清,分别加入含有0.3%和0.6%(质量分数)胆盐的MRS液体培养基,37 ℃培养,于0、4、8 h后用平板计数法测定其活菌数,每组3次平行。
1.6 通便功能评价试验
1.6.1 动物饲养与分组
参照《保健食品检验与评价技术规范》2003版中通便功能检验方法[8]。
试验动物选择6周龄ICR雄性小鼠220只。动物饲养保持环境温度为(21±2)℃,湿度为 30%~70%,12 h光照交替,自由饮水,自由摄入小鼠维持饲料。试验小鼠自购入起适应1周后,按体重进行随机分组。排便试验与小肠运动性试验各分为11组,每组10只。
11组包括阴性对照组、模型组、阳性对照组与8组给药组。8组给药组分别灌胃植物乳杆菌581、553、557、566、573、578、590、596。分别制备上述8株植物乳杆菌菌株的冷冻干燥菌粉,采用平板培养法对冻干菌粉进行活菌计数。取一定量菌粉,重悬于无菌生理盐水,用于小鼠灌胃。菌粉给药剂量为3×109CFU/kg小鼠体重。阳性对照组灌胃麻仁丸试液,灌胃剂量为2 g/kg小鼠体重。剂量换算依据如表1所示。阴性对照组与模型组分别灌胃等量的无菌生理盐水。受试样品连续给喂7 d。
表1 人体服用量与小鼠灌胃量换算
Table 1 The dosage for human body and mice

样品小鼠灌胃量人体服用量#菌株3×109 CFU/kg1.8×1010CFU/d麻仁丸2 g/kg12 g/d
注:#小鼠服用剂量按人体服用量10倍进行换算,正常人体体重按60 kg进行换算。
1.6.2 模型的建立
排便试验组:第1组小鼠于受试样品给喂7 d后,各组小鼠禁食不禁水16 h,模型组、阳性对照组与给药组灌胃复方地芬诺酯悬液(10 mg/kg小鼠体重)进行造模,阴性对照组给予等量的蒸馏水。
小肠运动性试验组:第2组小鼠于受试样品给喂7 d后,禁食不禁水,模型组、阳性对照组与给药组灌胃复方地芬诺酯悬液(5 mg/kg小鼠体重)进行造模,阴性对照组给予等量的蒸馏水。
1.6.3 指标的测量
排便试验组:给予复方地芬诺酯0.5 h后,各组小鼠灌胃墨汁(含5%活性碳粉,10%阿拉伯树胶),观察并记录每只小鼠的首粒排黑便时间、6 h内排黑便的粒数及重量。
小肠运动性试验组:给予复方地芬诺酯0.5 h后,灌胃墨汁,25 min后立即处死并打开腹腔,测量小肠总长度与墨汁推进长度,计算墨汁推进率(%)=墨汁推进长度(cm)/小肠总长度(cm)×100。
1.7 发酵果蔬汁试验
分别取芒果汁、香蕉汁、紫薯汁、芦荟汁、胡萝卜汁、大蒜汁、姜汁,稀释至Brix=12后,于95℃下灭菌5 min。待料液冷却至30℃后,将植物乳杆菌581以0.002%(1.0×107CFU/mL)的添加量接种到发酵基料中,37℃下进行发酵。在发酵后16 h测定基料的pH变化与活菌数,对发酵后果蔬汁进行感官品尝。
1.8 统计分析
试验结果以“平均值±标准差”表示。显著性分析采用SPSS 19.0软件,利用单因素方差分析(ANOVA)两两比较中的Duncan法进行分析,以P<0.05作为差异具有统计学意义的判断标准。
2 结果与分析
2.1 耐酸性试验
植物乳杆菌581的耐酸性结果如表2所示。经过4 h的孵育试验,植物乳杆菌581在pH 2.5与pH 2.0的酸环境下都呈现了较强的耐酸性。在pH 2.5的条件下作用4 h后,581的活菌数降低(0.157±0.104)个数量级。当pH值下降到2.0时,581的活菌数在孵育4 h后降低(0.243±0.035)个数量级。食物在胃部停留的时间一般为2~4 h。人体胃液中的pH值因饮食不同波动较大,空腹或食用酸性食品时pH值最低可达到1.5时,食用碱性食物时pH可达4.0~5.0,通常pH值为3.0左右[9]。以上结果表明植物乳杆菌581具有良好的耐酸特性。
表2 植物乳杆菌 581对酸的耐受性
Table 2 Acid-tolerance of L.plantarum 581
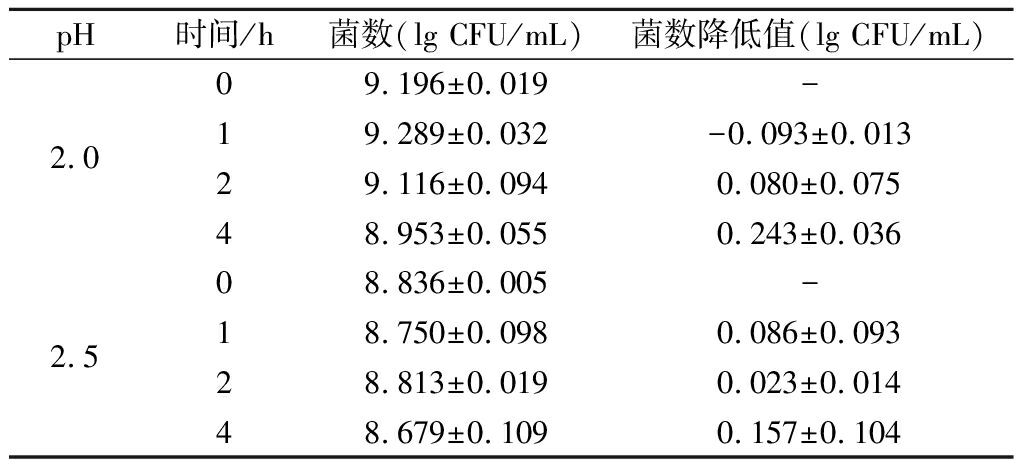
pH时间/h菌数(lg CFU/mL)菌数降低值(lg CFU/mL)2.009.196±0.019-19.289±0.032-0.093±0.01329.116±0.0940.080±0.07548.953±0.0550.243±0.0362.508.836±0.005-18.750±0.0980.086±0.09328.813±0.0190.023±0.01448.679±0.1090.157±0.104
注:“—”表示无。
2.2 耐胆盐试验
由表3可知,植物乳杆菌 581 在0.3%(质量分数)胆盐作用4 h后,菌数降低(0.994±0.168)个数量级。延长作用时间至8 h后,菌数降低(1.084±0.257)个数量级,仍在1个数量级左右。将胆盐质量分数提升至0.6%后,植物乳杆菌581的菌数在4和8 h作用时间下分别降低(1.205±0.096)和(1.378±0.205)个数量级。延长作用时间和提升胆盐浓度对 581菌数影响不大。人体内胆盐质量分数一般在0.3%以下波动[10],因此植物乳杆菌 581在体内环境下能更好的存活。
表3 植物乳杆菌581对胆盐的耐受特性
Table 3 Bile salt-tolerance of L.plantarum 581

胆盐质量分数/%时间/h菌数(lg CFU/mL)菌数降低值(lg CFU/mL)06.661±0.260—0.345.667±0.0920.994±0.16885.577±0.0031.084±0.25704.811±0.047—0.643.606±0.1431.205±0.09683.434±0.2531.377±0.206
注:—表示无。
2.3 通便功能评价试验
2.3.1 排便试验
试验期间,各处理组小鼠均未出现不良症状。排便试验结果如表4所示。与阴性对照组相比,模型组小鼠的首次排黑便时间显著增加(P<0.01),6 h排黑便粒数和排黑便质量均显著降低(P<0.01),表明使用复方地芬诺酯构建小鼠便秘模型成功。
与模型组相比,灌胃581菌株的小鼠首次排黑便时间(P<0.01)、 6 h排黑便粒数(P<0.01)和排黑便质量(P<0.01)均得到显著改善。同样分离自四川泡菜样品的其余7株植物乳杆菌中,仅566和596菌株灌胃组小鼠的首次排便时间、 6 h排便粒数与排便质量显著改善(P<0.05),但效果均不及581菌株。同时,581菌株对首次排黑便时间(P<0.01)与6 h排黑便粒数(P<0.05)2项指标的改善效果也显著优于阳性对照的麻仁丸药物服用组。
表4 不同菌株对便秘小鼠各排便指标的影响
Table 4 Effects of different strains of lactobacillus on defecation in constipation rice model
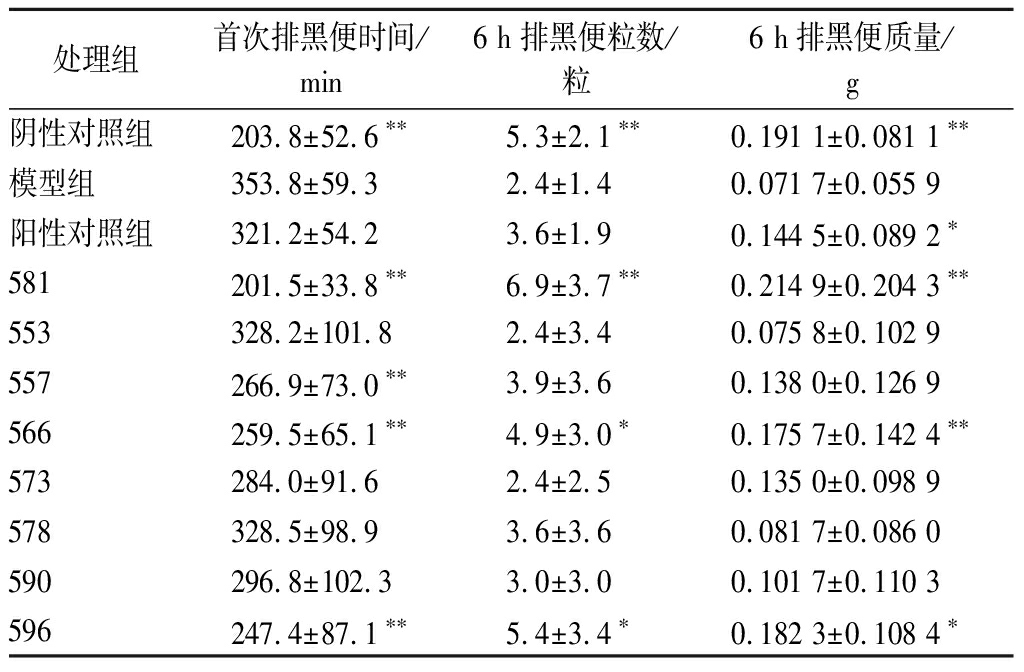
处理组首次排黑便时间/min6 h排黑便粒数/粒6 h排黑便质量/g阴性对照组203.8±52.6∗∗5.3±2.1∗∗0.191 1±0.081 1∗∗模型组353.8±59.32.4±1.40.071 7±0.055 9阳性对照组321.2±54.23.6±1.90.144 5±0.089 2∗581201.5±33.8∗∗6.9±3.7∗∗0.214 9±0.204 3∗∗553328.2±101.82.4±3.40.075 8±0.102 9557266.9±73.0∗∗3.9±3.60.138 0±0.126 9566259.5±65.1∗∗4.9±3.0∗0.175 7±0.142 4∗∗573284.0±91.62.4±2.50.135 0±0.098 9578328.5±98.93.6±3.60.081 7±0.086 0590296.8±102.33.0±3.00.101 7±0.110 3596247.4±87.1∗∗5.4±3.4∗0.182 3±0.108 4∗
注:平均值±标准差。标注*表示与模型组相比具有显著性差异,P<0.05;标注**表示与模型组相比具有极显著性差异,P<0.01。
2.3.2 小肠运动性试验
试验期间,各处理组小鼠均未出现不良症状。小肠运动性试验结果如表5所示。模型组小鼠的墨汁推进率与阴性对照组相比显著降低(P<0.01),表明造模成功。与模型组相比,灌胃植物乳杆菌581可显著提高小肠的墨汁推进率(P<0.01),其作用效果与阳性对照组相当(P>0.05)。
表5 不同菌株对小鼠墨汁推进率的影响
Table 5 Effects of different strains on the ink propelling rates in mice model
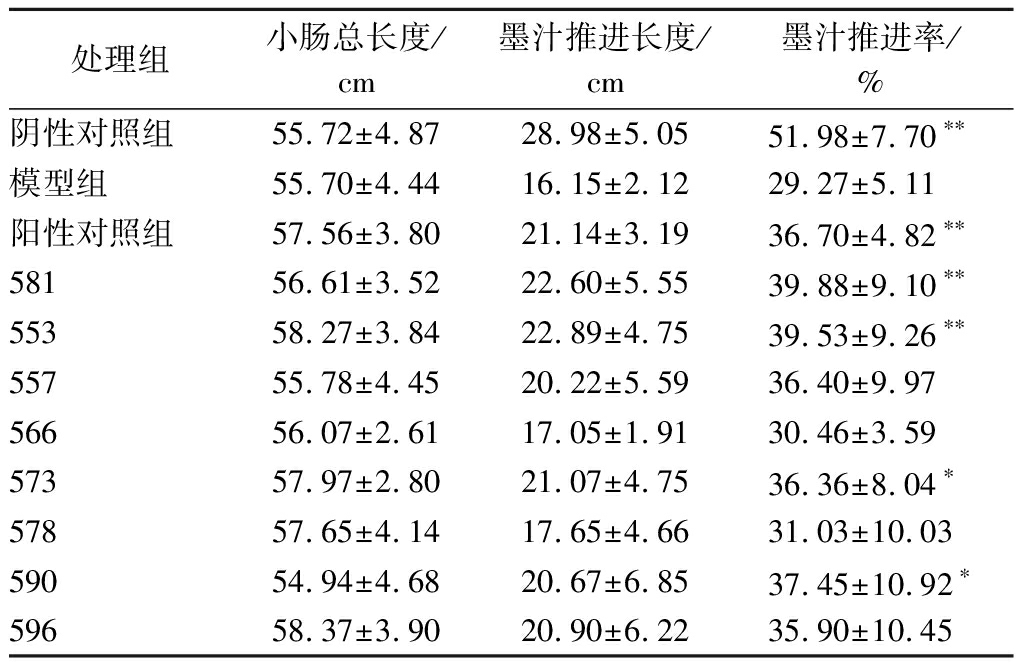
处理组小肠总长度/cm墨汁推进长度/cm墨汁推进率/%阴性对照组55.72±4.8728.98±5.0551.98±7.70∗∗模型组55.70±4.4416.15±2.1229.27±5.11阳性对照组57.56±3.8021.14±3.1936.70±4.82∗∗58156.61±3.5222.60±5.5539.88±9.10∗∗55358.27±3.8422.89±4.7539.53±9.26∗∗55755.78±4.4520.22±5.5936.40±9.9756656.07±2.6117.05±1.9130.46±3.5957357.97±2.8021.07±4.7536.36±8.04∗57857.65±4.1417.65±4.6631.03±10.0359054.94±4.6820.67±6.8537.45±10.92∗59658.37±3.9020.90±6.2235.90±10.45
2.4 发酵果蔬汁试验
植物乳杆菌581在多种果蔬汁中的发酵情况如表6所示。经581菌株发酵后,果蔬汁本身的体系与色泽无显著影响,也未观察到任何不良风味。在pH值较低的高酸性果汁体系中,581菌株也可以进行发酵。芒果汁发酵前pH=3.91,发酵后pH=3.28,发酵液中活菌数达1.57×109 CFU/mL。对于胡萝卜汁、大蒜汁、生姜汁,发酵后料液中原本带有的生冲味道明显减少,口感更加柔和绵厚,醇香可口。同时,发酵产生的乳酸以及其他风味物质也为多款果蔬汁增加了清新、酸爽的口感。
高的活菌数是益生菌发酵产品的品质标准之一。本研究中发现植物乳杆菌581在胡萝卜汁中发酵活力最强,发酵后活菌数可达1.24×109CFU/mL。安兴娟等[11]以胡萝卜和枸杞为原料,经单因素试验与正交优化,制作的发酵果蔬汁中最终活菌数为7.1×107 CFU/mL。活菌数的高低是益生菌发挥益生功效的前提与基础,但前期一些相关研究未关注发酵果蔬汁中的活菌数[12-13]。
表6 植物乳杆菌581在多种果蔬汁中的发酵情况
Table 6 Use of L.plantarum 581 in fermented fruit and vegetable juice
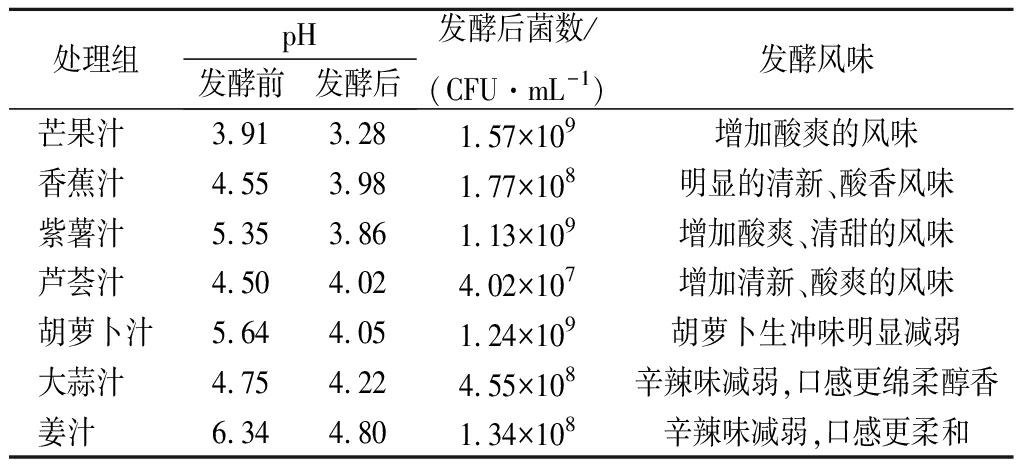
处理组pH发酵前发酵后发酵后菌数/(CFU·mL-1)发酵风味芒果汁 3.913.281.57×109增加酸爽的风味香蕉汁 4.553.981.77×108明显的清新、酸香风味紫薯汁 5.353.861.13×109增加酸爽、清甜的风味芦荟汁 4.504.024.02×107增加清新、酸爽的风味胡萝卜汁5.644.051.24×109胡萝卜生冲味明显减弱大蒜汁 4.754.224.55×108辛辣味减弱,口感更绵柔醇香姜汁 6.344.801.34×108辛辣味减弱,口感更柔和
3 结论与讨论
乳酸菌的分离鉴定和筛选工作对选育优良菌株至关重要,乳酸菌对胃肠道环境是否具有耐受性、能否顺利到达肠道是其发挥益生功能的前提条件[14-15]。植物乳杆菌581在pH=2.0酸环境下胁迫4 h后活菌数降低(0.243±0.035)个数量级,在0.3%(质量分数)胆盐作用8 h后,活菌数降低(1.084±0.257)个数量级。吕源玲[16]从婴儿粪便中筛选获得的1株具有最强耐酸耐胆盐能力的植物乳杆菌,在pH=3.0条件下1、2、3 h后的存活率分别为75%、64%、46%。便秘是由于肠道功能紊乱引起的慢性疾病,主要临床症状有排便困难、排便频率低、粪便干硬和延长肠道排空时间[17]。本研究表明,服用植物乳杆菌581可以缩短便秘小鼠的首次排便时间,增加小鼠的排便粒数、排便质量,并提高小鼠的小肠墨汁推进速率。根据《保健食品检验与评价技术规范》,植物乳杆菌581具有润肠通便的功能。研究同时比较了分离自四川泡菜样品的8株植物乳杆菌,植物乳杆菌581菌株在通便功能评价中的各项指标均优于其他菌株,表明植物乳杆菌在发挥通便功能方面也表现出明显的菌株特异性。
植物乳杆菌581在多种果蔬汁中均表现出良好的发酵性能,在胡萝卜汁中发酵活力最强,发酵后活菌数可达1.24×109CFU/mL。根据动物试验结果,服用14.5 mL胡萝卜汁发酵液即可达到581菌株的有效剂量。胡萝卜中含有丰富的膳食纤维。高昂等[18]利用挤压喷雾技术从胡萝卜中提取的可溶性膳食纤维占原料质量的27.3%。可溶性膳食纤维能通过增加粪便持水力发挥润肠通便的功能,膳食纤维经乳酸菌分解利用,产生乙酸、丁酸、丙酸等代谢产物,能进一步刺激肠道蠕动[19]。张敏佳等[20]报道了发酵果蔬汁对功能性便秘与肥胖都具有改善作用。某些植物乳杆菌在发酵过程中还可提高游离酚、抗坏血酸的含量,增加果蔬汁的抗氧化能力[21-22]。后续将针对581菌株发酵果蔬汁的成分变化与益生功能做进一步研究。植物乳杆菌581具备润肠通便的益生特性和良好的果蔬汁发酵性能,该菌株可用于功能性发酵果蔬汁产品的开发,在提供良好风味的同时为消费者提供更多的有益因素。
[1] 杭锋,陈卫.益生乳酸菌的生理特性研究及其在发酵果蔬饮料中的应用[J].食品科学技术学报,2017,35(4):33-41.
[2] 王宁.发酵果蔬汁饮料发展现状及趋势分析[J].农业科技与装备,2017,275(5):75-76.
[3] 陈历水,丁庆波,吴伟莉,等.发酵果蔬汁的功能特性研究进展[J].食品工业科技,2012,33(11):418-422.
[4] 赖婷,刘汉伟,张名位,等.乳酸菌发酵对果蔬中主要活性物质及其生理功能的影响进展研究[J].中国酿造,2015,34(3):1-4.
[5] 曹振辉,刘永仕,潘洪彬,等.乳酸菌的益生功能及作用机制研究进展[J].食品工业科技,2015,36(24):366-370;377.
[6] SUARES N C,FORD A C.Prevalence of,and risk factors for,chronic idiopathic constipation in the community: systematic review and meta-analysis[J].Am J Gastroenterol,2011,106(9):1 582-1 591;1 593.
[7] LI Chuan,NIE Shaoping,ZHU Kexue,et al.Effect of Lactobacillus plantarum NCU116 on loperamide-induced constipation in mice[J].Int J Food Sci Nutr,2015,66(5):533-538.
[8] 保健食品检验与评价技术规范[S].北京:中华人民共和国卫生部,2003.
[9] 李平兰.长寿老人源双歧杆菌优良菌株的筛选及生理功能研究[D].北京:中国农业大学,2004.
[10] 陈仪婷,张红星,谢远红,等.降胆固醇乳酸菌的筛选鉴定及其耐酸耐胆盐性能研究[J].食品与发酵工业,2018,44(5):29-33.
[11] 安兴娟,张瑶,姬阿美,等.植物乳杆菌发酵枸杞胡萝卜汁工艺的优化[J].天津科技大学学报,2016,31(3):20-24.
[12] 徐萌萌.益生菌发酵胡萝卜饮料营养特性及其储藏稳定性研究[D].南昌:南昌大学,2016.
[13] 余翔,冯艳丽,高峰,等.黄瓜胡萝卜发酵果蔬汁的工艺研究[J].饮料工业,2010,13(11):26-29.
[14] KOU Xiaohon,CHEN Qiong,JU Xiaoying,et al.A tolerant lactic acid bacteria, Lactobacillus paracasei, and its immunoregulatory function[J].Can J Microbiol,2014,60:729-736.
[15] MARCO T,ROBERTA D G,LUCA P,et al.A consumer′s guide for probiotics: 10 golden rules for a correct use[J].Digestive and Liver Disease,2017,49(11):1 177-1 184.
[16] 吕源玲.耐酸耐胆盐益生乳酸菌的筛选与鉴定[J].食品与机械,2017,33(6):42-45.
[17] WANG Linlin,HU Lujun,XU Qi,et al.Bifidobacterium adolescentis exerts strain-specific effects on constipation induced by loperamide in BALB/c mice[J].Int J Mol Sci,2017,18(2):E318.
[18] 高昂,梁文明,徐兴阳,等.挤压喷雾提高胡萝卜渣膳食纤维含量及其性质评价[J].食品研究与开发, 2016,37(2):97-101.
[19] 蒋欣容.单一及混合乳酸菌发酵果蔬乳饮料对小鼠润肠通便作用的影响[D].扬州:扬州大学,2017.
[20] 张敏佳,欧阳道福,王晓宁,等.发酵果蔬汁的通便和减肥功能[J].食品与发酵工业,2019,45(1):77-82.
[21] DICAGNO R, SURICO R F, MINERVINI G,et al. Exploitation of sweet cherry (Pnmus avhnn L.) puree added of stem infusion through fermentation by selected autochthonous lactic acid bacteria[J].Food Microbiol,2011,28(5):900-909.
[22] DICAGNO R, SURICO R F, PARADISO A,et al.Effect of autochthonous lactic acid bacteria starters on health-promoting and sensory properties of tomato juices[J].Int J Food Microbiol,2009,128(3):473-483.