膳食纤维(dietary fiber,DF),根据其在水中的溶解性可以分为不可溶性膳食纤维(insoluble dietary fiber,IDF)和可溶性膳食纤维(soluble dietary fiber,SDF),且都具有预防肥胖[1]、降低血清胆固醇含量和餐后血糖含量[2]、抗肿瘤[3],且能够预防和治疗糖尿病[4]及心血管疾病[5]等药用功效。膳食纤维的正常摄入已成为日常饮食中不可或缺的组成部分。膳食纤维的提取方法主要可以分为化学分离法、机械分离法、膜分离法及化学试剂和酶结合分离法这四类[6-7],其中最常用的提取方法是化学分离法中的碱法和酶法。与酶法提取相比,碱法提取由于操作简单、成本较低且易于控制,因此是膳食纤维提取最广泛使用的方法[8]。
木耳作为一种广泛食用的大型真菌,其种类较多,但我国常见的食用种类仅为毛木耳(Auricularia cornea)与黑木耳(Auricularia heimuer)两种[9]。玉木耳(Auricularia cornea var. Li)是吉林农业大学李玉院士团队驯化已形成稳定遗传的毛木耳自然突变纯白色菌株[10]。玉木耳子实体通体洁白如玉、口感爽脆、营养丰富,富含多糖、膳食纤维、氨基酸与各种微量元素[11-12]。而玉木耳根却因其口感粗糙、易携带栽培时的杂质,常被作为废物丢弃。这既没有充分合理利用资源,又对环境造成了污染。因此,本实验以玉木耳根作为原料,采用碱法提取其中膳食纤维,通过设计单因素实验分别考察料液比、浸提温度、浸提时间和碱液浓度4个因素对玉木耳根膳食纤维提取率的影响,并在此基础上,采用响应面法来确定提取的最佳工艺。且最终测定了其持水力、持油力、膨胀性、吸附胆固醇、胆酸钠与亚硝酸根离子等多方面的理化性质,为玉木耳根膳食纤维的提取方法和应用选择提供科学依据。
1 材料与方法
1.1 材料与试剂
玉木耳根,来自吉林农业大学李玉院士团队;胆固醇标准液、牛黄胆酸钠标准品,索莱宝生物科技有限公司;邻苯二甲醛(OPA)等试剂,均为分析纯,重庆川东试剂公司。
1.2 仪器与设备
FW100-高速万能粉碎机,天津泰斯特仪器有限公司;TY92-ⅡN-超声波细胞破碎仪,宁波新芝生物科技股份有限公司;ML503-精密电子天平,梅特勒-托利多(常州)精密仪器有限公司;3K15-台式冷冻离心机,德国SIGAM公司;RE-52AA-旋转蒸发器,上海亚荣生化仪器厂;RaedMax-1800-可见光吸收型全波长酶标仪,上海闪谱生物科技有限公司;100目滤筛,胜迪公司等。
1.3 方法
1.3.1 玉木耳根膳食纤维制备
玉木耳根清洗,在55℃烘箱中 24 h烘干、高速粉碎机粉碎过100目筛,称取5.000 g样品,按一定料液比加入一定浓度的NaOH碱液,在一定浸提时间和温度条件,抽滤得到滤液和滤渣。滤液调节至pH=7、浓缩至原液体积的1/5,加入4倍体积95%乙醇沉淀,抽滤得到沉淀为玉木耳根可溶性膳食纤维。滤渣调节至pH=7、抽滤得到沉淀,将滤渣用水洗,乙醇洗脱干燥后即为玉木耳根不可溶膳食纤维。
1.3.2 单因素试验
选择料液比(1∶120、1∶160、1∶200、1∶240、1∶280(g∶mL))、碱液浓度为NaOH质量浓度(0.5、1.0、1.5、2.0、2.5 g/L)、浸提温度(60、70、80、90、100℃)、浸提时间(60、120、180、240、300 min)4个因素做单因素试验,考察各单因素对玉木耳根中SDF和IDF得率的影响,确定相关的提取工艺。
1.3.3 正交试验设计优化
以料液比、碱液浓度、浸提时间和浸提温度作为考察因素,设计4因素3水平的正交试验,每个试验重复3次,取平均值作为结果,对碱法提取工艺进行优化。因素水平设计见表1。
表1 工艺优化L9(34)正交试验因素水平表
Table 1 Factors and their levels in L9(34)orthogonal array design
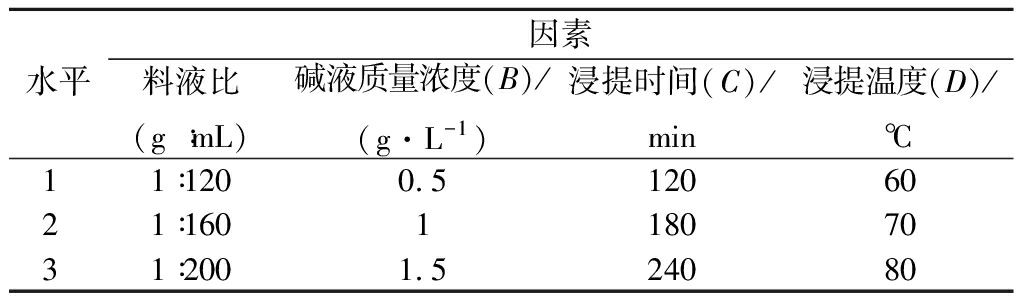
水平因素料液比(g ∶mL)碱液质量浓度(B)/(g·L-1)浸提时间(C)/min浸提温度(D)/℃11∶1200.51206021∶16011807031∶2001.524080
玉木耳根SDF和IDF提取计算如公式(1)和(2):
SDF提取率![]()
(1)
IDF提取率![]()
(2)
1.3.4 玉木耳根膳食纤维理化性质测定
1.3.4.1 持水力、持油力和膨胀力测定
参照CHAU等[13]方法进行改进。对膳食纤维样品进行精准称重,并且在100 mL烧杯里置入1.000 g样品,而后加入50 mL去离子水,室温振荡匀称,再将其安静置放2 h,通过0.75 mm尼龙网进行过滤,一直到不再有水滴下,即可对样品湿重量加以称重。持水力计算如公式(3)所示:
持水力![]()
(3)
按照SANGNARK等[14]的方法进行改进。对膳食纤维样品进行精准称重,并且在100 mL烧杯里置入1.000 g样品,而后加入25 g食用花生油,并将其混合匀称,在37℃的环境中安静置放1 h,在完成2 500 g/min离心20 min后,将上层油清除,再将残渣游离的花生油通过滤纸吸取干净,对吸附花生油之后的样品重量加以记载,持油力计算如公式(4)所示:
持油力![]()
(4)
按照FEMENIA等[15]的方法进行改进。对膳食纤维样品进行精准称重,并且在25 mL刻度试管里置入1.000 g样品,对样品最初的体积加以记载,而后将20 mL去离子水加入其中,并将其混合匀称,在室温中安静置放24 h,将其膨胀后的体积加以记载,膨胀力计算如式(5)所示:
膨胀力![]()
(5)
1.3.4.2 吸附胆固醇能力测定
在去离子水当中置入新鲜的鸡蛋蛋黄,充分搅拌之后获取10%的鸡蛋黄乳液。分别精准称重1.00 g的SDF和IDF过50目筛的粉末,并将其置入100 mL的锥形瓶里,将25 g蛋黄乳液加入其中,调整溶液体系pH=2.0(模拟人体胃液环境)和pH=7.0(模拟人体小肠环境),放置于180 r/min的水浴振荡器中,37℃振荡 4 h,3 000r/min离心30 min,吸取 0.1 mL上清液,在550 nm波长下对定胆固醇含量进行检测的时候选择使用OPA法[16]。单股陈吸附能力计算如公式(6)所示:
胆固醇吸附能力/(mg·g-1)=
(6)
1.3.4.3 吸附胆酸钠能力测定
分别精准称重1.000 g的SDF和IDF过50目筛的粉末,并将其置入250 mL的锥形瓶里,加入含有0.20 g胆酸钠的0.15 mo1/L NaCl溶液100 mL并调节pH值7.0和2.0,通过电磁搅拌器进行2 h的充分搅拌,并将其置于37℃恒温环境当中,而后借助移液管获取1 mL样品溶液,在620 nm波长下测定胆酸钠的含量[17]。胆固醇吸附能力计算如公式(7)所示:
胆酸钠吸附能力/(mg·g-1)=
(7)
1.3.4.4 吸附亚硝酸根离子![]() 能力测定
能力测定
取1.000 g样品于100 mL烧杯中,加入50 mL 100 μmol/L NaNO2溶液,pH调至2.0和7.0,置于200 r/min的水浴振荡器中,37℃振荡4 h,3 000 r/min离心30 min,取2 mL上清液,根据![]() 在GB/T 5009.33—2010 测定溶液里的含量,按照浓度在反应之前与之后的变化对吸附量加以运算,同时做空白试
在GB/T 5009.33—2010 测定溶液里的含量,按照浓度在反应之前与之后的变化对吸附量加以运算,同时做空白试![]() 吸附能力计算如公式(8)所示:
吸附能力计算如公式(8)所示:
![]() 吸附能力/(mg·g-1)=
吸附能力/(mg·g-1)=
(8)
1.4 数据处理
各试验组重复3次,试验数据采用SPSS 17软件完成相应的统计分析处理。
2 结果与分析
2.1 膳食纤维提取工艺单因素试验结果
2.1.1 料液比对膳食纤维含量的影响
由图1可知,当料液比达到1∶160时玉木耳根SDF和IDF提取率可达到最大,分别为38%和59%,从而玉木耳根总膳食纤维提取率最高,当料液比增大时,玉木耳根SDF和IDF提取率减少,在提取过程中对溶液的浪费相应增加。
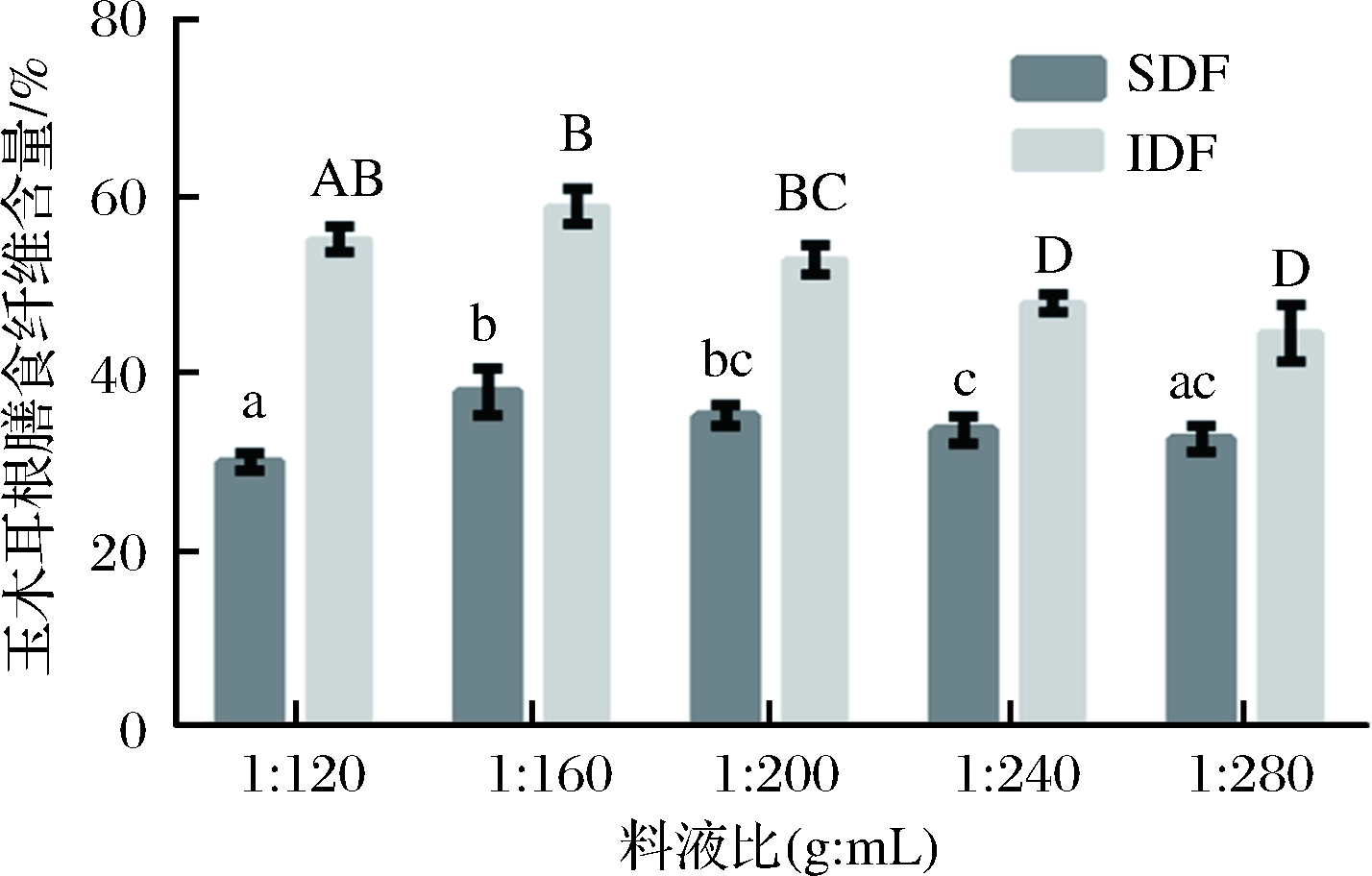
图1 料液比对SDF和IDF的影响
Fig.1 Effects of solid-liquid ratio on SDF and IDF contentof A. cornea var. Li root注:图中不同大小写字母表示各处理组差异显著。下同。
2.1.2 碱液浓度对膳食纤维含量的影响
由图2可以发现,当NaOH碱液质量浓度为0.5~1 g/L的时候,玉木耳根SDF和IDF的提取率与碱液质量分数成正比,达到1 g/L碱液浓度时提取率最大分别为35.67%和56%,玉木耳根总膳食纤维提取率最多。当其浓度为1.5~2.5 g/L的时候,玉木耳根膳食纤维提取率出现下滑,然而其总提取效率也高于75%。
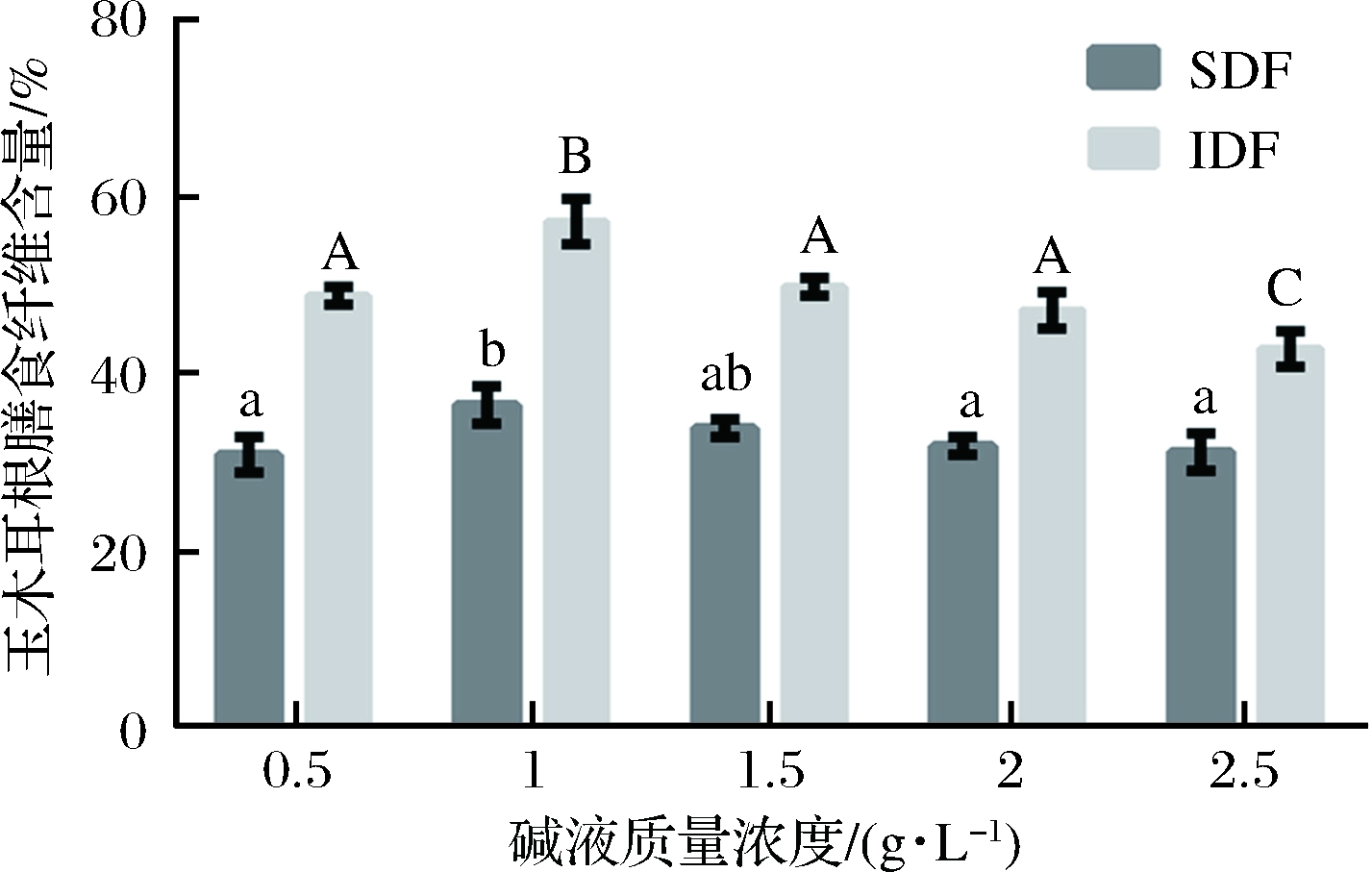
图2 碱液浓度对SDF和IDF的影响
Fig.2 Effects of alkali solution concentration onSDF and IDF content of A. cornea var. Li root
2.1.3 提取温度对膳食纤维含量的影响
由图3可以发现,在提取温度上升的过程中,玉木耳根SDF和IDF的提取率先快速上涨,而后又缓缓下降。当温度为60~70℃时,二者的提取效率上升,而当70℃的时候,二者的提取效率达到峰值,分别是35%与55%,而玉木耳根总膳食纤维的提取效率则高达90%,温度在70℃以上,随着温度升高,提取率反而下降。由于玉木耳根膳食纤维在高温当中会被损坏,所以导致提取效率下降。
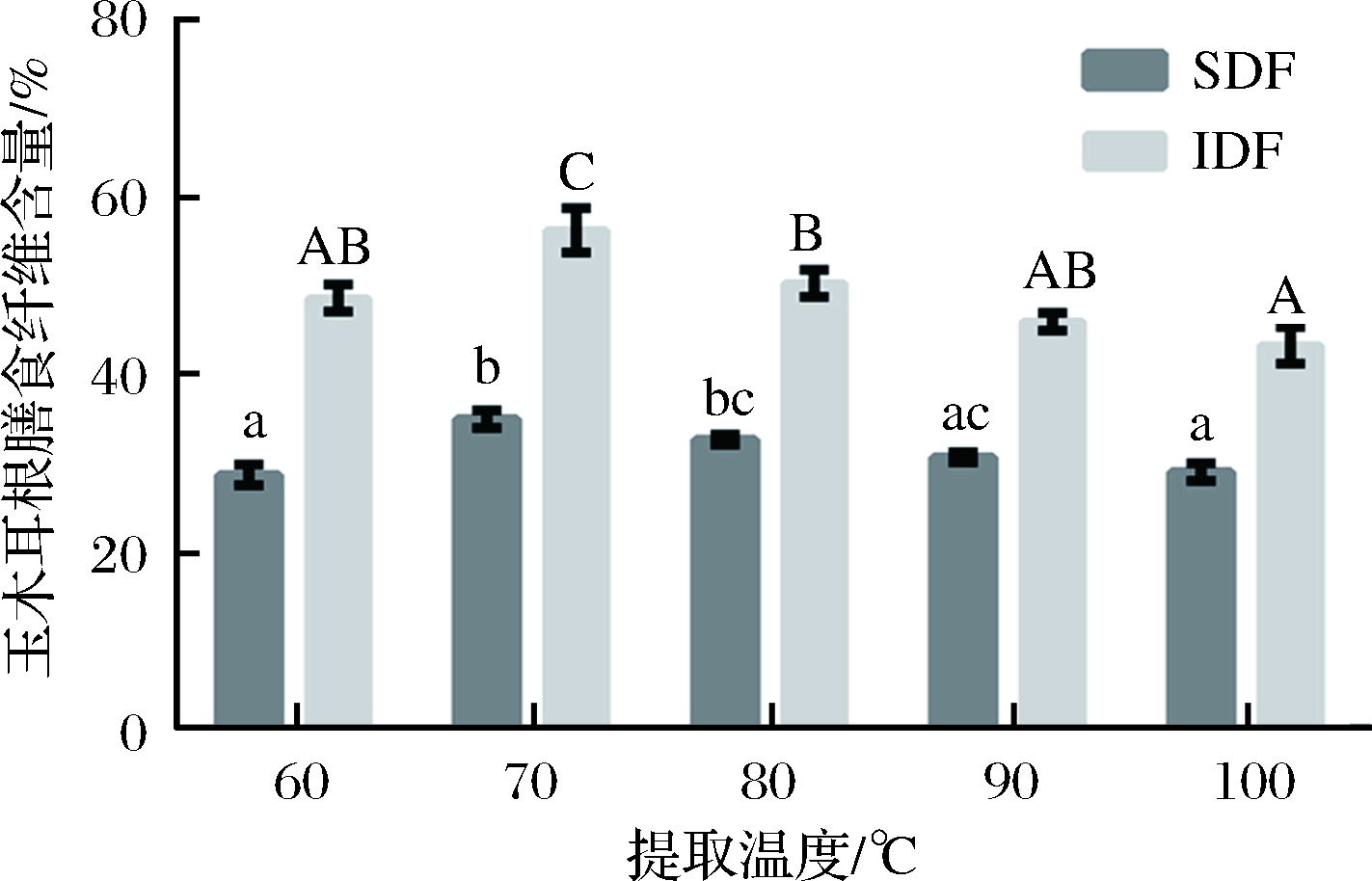
图3 提取温度对SDF和IDF的影响
Fig.3 Effect of extraction temperature on SDFand IDF content of A. cornea var. Li root
2.1.4 提取时间对膳食纤维含量的影响
由图4可以发现,在浸提时间不断延长的过程中,玉木耳根SDF和IDF的提取效率先出现上升,而后又缓缓下降,其峰值出现于180 min的时候。当其处于60~180 min时,随着时间的延长,二者的含量持续上升,并达到峰值,分别是35%与53.67%,而总膳食纤维的提取效率则为88.67%;在浸提时间处于180~300 min时,其膳食纤维含量逐步减少。所以选取180 min为最合适的提取时间。
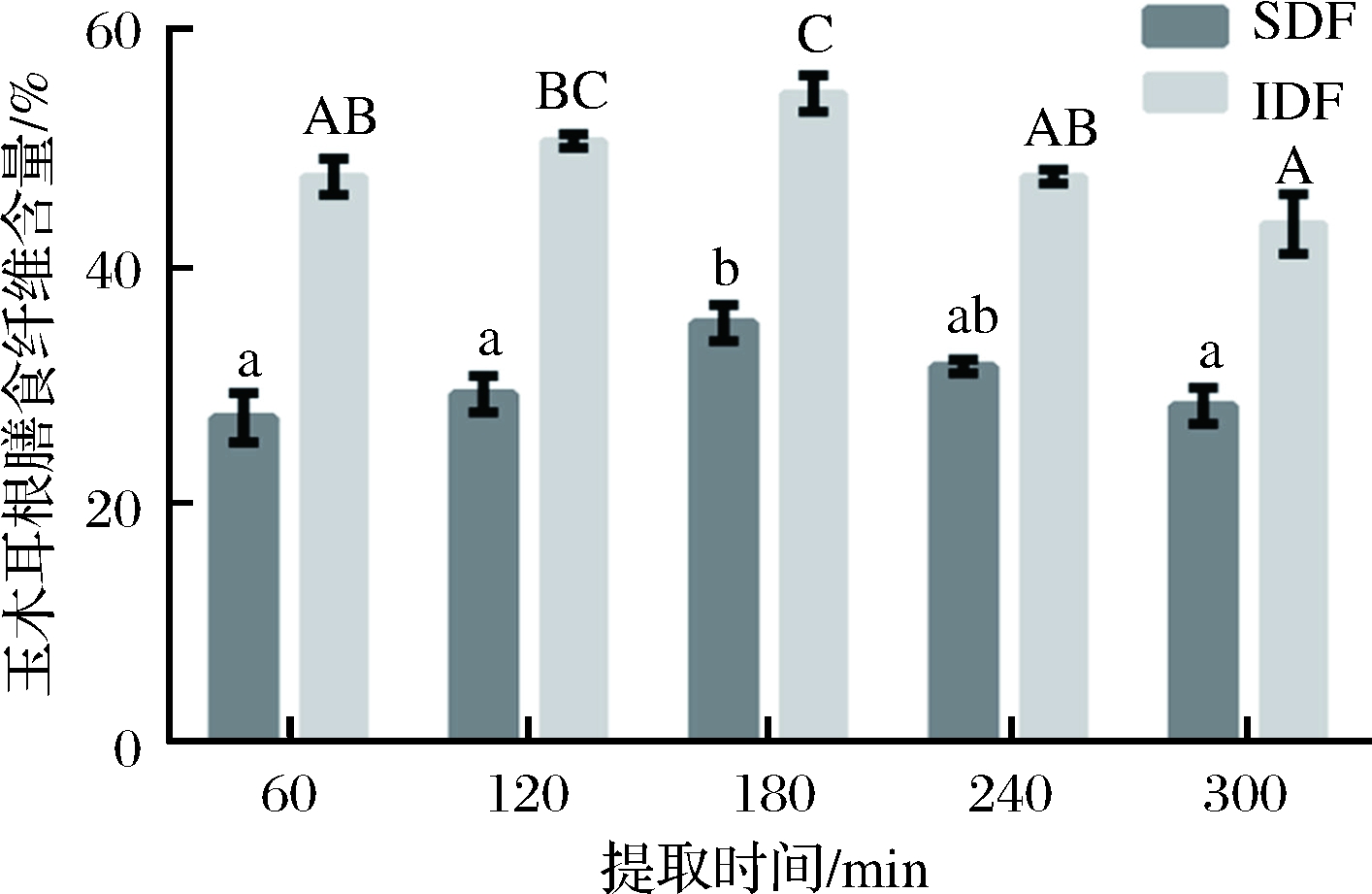
图4 提取时间对SDF和IDF的影响
Fig.4 Effect of extraction time on SDF andIDF content of A. cornea var. Li root
2.2 膳食纤维提取工艺正交试验结果
玉木耳根膳食纤维提取的正交试验的极差分析和方差分析结果分别见表2和表3。极差分析表2显示,影响玉木耳根SDF得率的最佳条件为:A3B3C2D3,即料液比为1∶200,NaOH碱液质量浓度为1.5 g/L,浸提时间为160 min,浸提温度为80℃,在此最佳条件下SDF的得率为22.21%;而影响IDF得率的最佳条件为:A3B3C2D1,即料液比为1∶200 (g∶mL),NaOH碱液浓度为1.5%,浸提时间为160 min,浸提温度为60℃,在此最佳条件下IDF的得率为37.52%。
表2 玉木耳根膳食纤维L9(34)正交试验设计及结果
Table 2 L9(34) orthogonal array design arrangement and experimental results
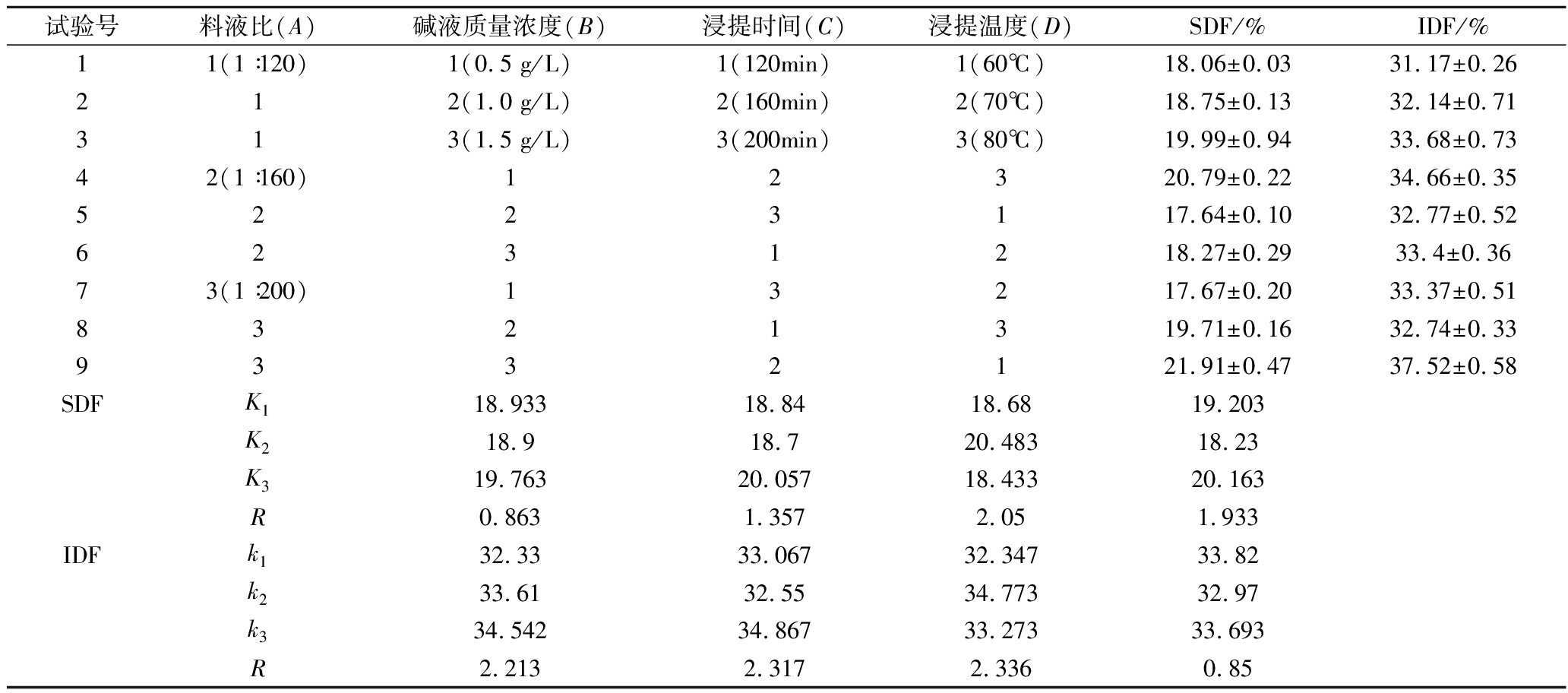
试验号料液比(A)碱液质量浓度(B)浸提时间(C)浸提温度(D)SDF/%IDF/%11(1∶120)1(0.5 g/L)1(120min)1(60℃)18.06±0.0331.17±0.26212(1.0 g/L)2(160min)2(70℃)18.75±0.1332.14±0.71313(1.5 g/L)3(200min)3(80℃)19.99±0.9433.68±0.7342(1∶160)12320.79±0.2234.66±0.355223117.64±0.1032.77±0.526231218.27±0.2933.4±0.3673(1∶200)13217.67±0.2033.37±0.518321319.71±0.1632.74±0.339332121.91±0.4737.52±0.58SDFK118.93318.8418.6819.203K218.918.720.48318.23K319.76320.05718.43320.163R 0.8631.3572.051.933IDFk132.3333.06732.34733.82k233.6132.5534.77332.97k334.54234.86733.27333.693R 2.2132.3172.3360.85
表3 方差分析表
Table 3 Table of variance analysis
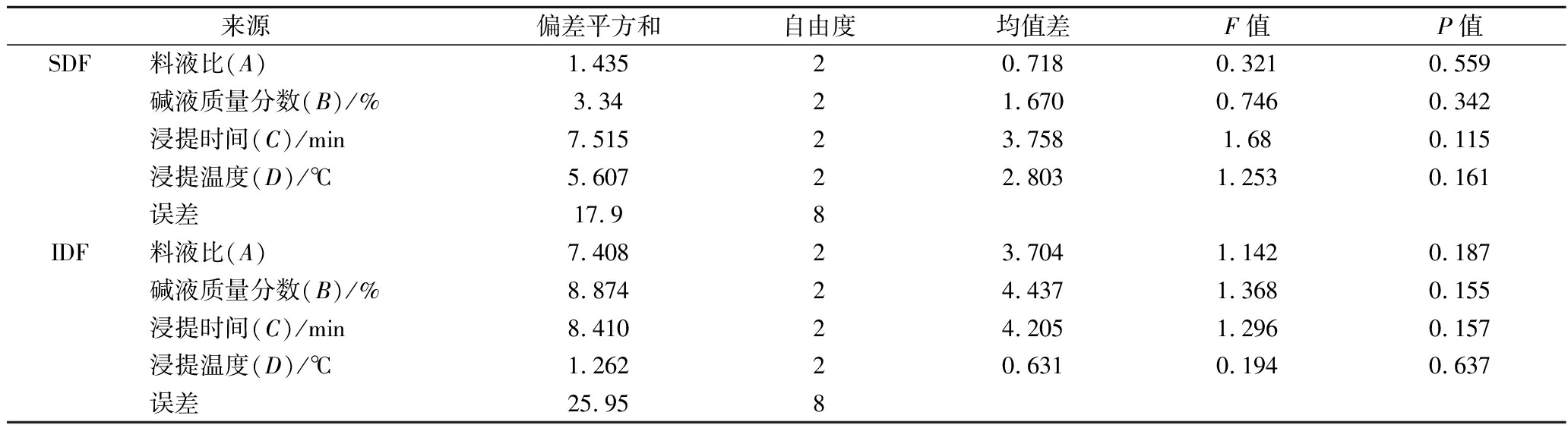
来源偏差平方和自由度均值差F值P值SDF料液比(A)1.43520.7180.3210.559碱液质量分数(B)/% 3.3421.6700.7460.342浸提时间(C)/min7.51523.7581.680.115浸提温度(D)/℃5.60722.8031.2530.161误差17.98IDF料液比(A)7.40823.7041.1420.187碱液质量分数(B)/% 8.87424.4371.3680.155浸提时间(C)/min8.41024.2051.2960.157浸提温度(D)/℃1.26220.6310.1940.637误差25.958
2.3 玉木耳根膳食纤维性质测定
由表4可得出,玉木耳根IDF的持水力、持油力和膨胀力约为SDF的3.4倍、1.5倍和1.9倍,持油力显著高于已报道黑木耳水提法、纤维素酶法和碱法提取IDF,持水力和膨胀力与之相当[20-22],持水力通常与其分子中亲水基团的暴露量有关,亲水基团暴露得越多,持水力越高[23]。玉木耳根SDF持油力显著高于已报道脱色木耳SDF和木耳SDF的指标水平[20],持油力和膨胀力均高于纤维素酶法提取黑木耳SDF,持水力与之相当[21]。人们常吃富含膳食纤维的食物,其持油、持水和膨胀的特性可以增加饱腹感从而减少进食和热量的吸收。
由表5可得出,玉木耳根IDF对胆酸钠吸附能力约为SDF的2倍;在pH=2.0和pH=7.0条件下,SDF对吸附胆固醇能力均高于IDF,约为其1.5倍;在pH∶2.0和pH=7.0条件对SDF和IDF对亚硝酸根离子吸附能力相当,不存在显著差异。玉木耳根SDF吸附胆酸钠能力显著高于已报道纤维素酶法、碱法和水提法黑木耳SDF,在pH=7.0时,亚硝酸根离子吸附能力也远远超过已报道碱法与水提法黑木耳SDF,在pH=2.0时,胆固醇与亚硝酸根离子吸附能力相差无几。玉木耳根IDF在酸性环境和中性环境下对胆固醇吸附力均高于碱法提取黑木耳IDF。在酸性条件下,酚类物质可以和亚硝酸根离子进行反应,而膳食纤维中存在一部分阿拉伯糖,而在阿拉伯糖上结合着阿魏酸,阿魏酸即是可以在胃环境的酸性条件与亚硝酸根离子发生反应的酚类物质,从而防止致癌物质亚硝胺的形成[24-25],当pH值升高达到中性,含羧基化合物中的羧基发生解离,会增大膳食纤维表面负电荷密度,排斥![]() 将原本吸收的
将原本吸收的![]() 释放出来[26]。本实验研究得到玉木耳根SDF和IDF对持油力、胆固醇、胆酸钠亚硝酸根离子在酸性环境的胃中和中性环境的小肠中都有较高的吸附能力,推测其应该富含羧基、羟基等亲水性基团,且存在较大的比表面积和较多的空隙,从而表现出良好的吸水、纳油、增大体积等特征[27],可做为很好的富含食物纤维的选择。
释放出来[26]。本实验研究得到玉木耳根SDF和IDF对持油力、胆固醇、胆酸钠亚硝酸根离子在酸性环境的胃中和中性环境的小肠中都有较高的吸附能力,推测其应该富含羧基、羟基等亲水性基团,且存在较大的比表面积和较多的空隙,从而表现出良好的吸水、纳油、增大体积等特征[27],可做为很好的富含食物纤维的选择。
表4 玉木耳根膳食纤维持水性、持油性和膨胀性对比
Table 4 Water-holding capacity,oilr-holding capacity,swelling capacity of dietary fiber from A. cornea var. Li root

样品持水力/(g·g-1)持油力/(g·g-1)膨胀力/(mL·g-1)SDF7.84±0.14a3.2±0.17a9.1±0.56aIDF26.46±1.05b4.86±0.29b17.9±1.56b
注: P<0.05,不同字母表示各组差异水平显著。下同。
表5 玉木耳根膳食纤维吸附能力
Table 5 Adsorbability of dietary fiber from A. cornea var. Li root

样品吸附胆酸钠能力/%吸附胆固醇能力/(mg·kg-1)吸附NO-2能力/(mg·kg-1)pH=2.0pH=7.0pH=2.0pH=7.0SDF10.72±0.71a14.5±0.50a15.5±1.22a23.41±1.26a21.73±1.32aIDF19.72±1.11b10.71±1.11b11.49±1.30b20.45±1.30a19.82±1.43a
3 结论
采用碱法对玉木耳根中的膳食纤维进行提取,并借助单因素实验对料液比、碱液质量浓度、温度和时间进行了考察,通过正交试验对可溶性和不可溶性膳食纤维提取工艺条件进行了优化,并且SDF与IDF最佳提取条件。其中SDF的最优提取工艺为料液比1∶200,NaOH碱液质量浓度1.5 g/L,浸提时间160 min,浸提温度80℃,得率为22.21%;而IDF的最佳提取工艺为料液比1∶200,NaOH碱液质量浓度1.5 g/L,浸提时间160 min,浸提温度60℃,得率为37.52%。
在最佳提取条件下,玉木耳根SDF的持水力为7.84 g/g,比报道的香菇SDF(6.32 g/g)、银耳SDF(7.26 g/g)等持水力好,比黑木耳SDF(7.92 g/g)持水力略低[22],玉木耳根SDF的持油力(3.2 g/g)高于香菇SDF(2.63 g/g)和银耳SDF(2.25 g/g),玉木耳根SDF膨胀力为9.1 mL/g,均高于香菇SDF和银耳SDF[24]。而玉木耳根CIDF的持水力、持油力和膨胀力分别为26.46 g/g、4.86 g/g和17.9 mL/g。玉木耳根SDF和IDF对于胆酸钠的吸附分别为10.72%和19.92%,均高于黑木耳SDF(3.01%)和IDF(5.12%),而其在中性环境下玉木耳根SDF对亚硝酸根离子吸附15.55 mg/kg远高于黑木耳SDF(2.81 mg/kg),在酸性环境下玉木耳根IDF对胆固醇吸附能力(10.71 mg/kg)高于黑木耳IDF(7.32 mg/kg)[22]。本次研究利用碱法制备玉木耳根的膳食纤维具有良好的实际操作性,且提取出的膳食纤维品质优良,因而本研究可为玉木耳根的开发利用提供应用依据。
[1] 权美云,候云云. 膳食纤维的生理保健功能及其提取工艺研究进展[J]. 保鲜与加工, 2013, 13(1): 49-51.
[2] ALEIXANDRE A, MIGUEL M. Dietary fiber and blood pressure control[J]. Food & Function, 2016, 7(4):1 864-1 871.
[3] MIRMIRAN P, BAHADORAN Z, KHALILI M S, et al. A prospective study of different types of dietary fiber and risk of cardiovascular disease: Tehran lipid and glucose study[J]. Nutrients, 2016, 8(11):686.
[4] 丁莉莉,彭丽,孔庆军. 膳食纤维与糖尿病的研究进展[J]. 医学综述, 2014, 20(7):1 265-1 268.
[5] FERNANDEZ M. Soluble fiber and nondigestible carbohydrate effects on plasma lipids and cardiovascular risk[J]. Current Opinion in Lipidology, 2001, 12(1):35-40.
[6] 付全意,刘冬,李坚斌,等. 膳食纤维提取方法的研究进展[J]. 食品科技, 2008, 33(2):225-228.
[7] MAPHOSA Y, JIDEANI V A. Dietary fiber extraction for human nutrition—A review[J]. Food Reviews International, 2016, 32(1):98-115.
[8] 曹银,杨芳,周露,等. 碱法与酶法提取大麦糟膳食纤维的比较[J]. 现代食品科技, 2011, 77(3): 317-320.
[9] QIN J, FENG B, YANG Z L, et al. The taxonomic foundation, species circumscription and continental endemisms of Singerocybe: Evidence from morphological and molecular data[J]. Mycologia, 2014, 106(5):1 015-1 026.
[10] 任梓铭,方宏阳,孟秀秀,等. 白色毛木耳新品种“玉木耳”的选育[J]. 分子植物育种, 2018(3): 954-959.
[11] 李玉,李晓. 图说玉木耳优质高产栽培[M]. 北京:中国农业出版社, 2016:1-12.
[11] 张严磊,施欢贤,唐志书,等. 碱法同时提取酸枣渣可溶性与不溶性膳食纤维及其性能研究[J]. 纤维素科学与技术, 2015, 23(4):43-48.
[12] 黄群,杨万根,余佶,等. 超声波辅助碱法提取杜仲籽粕可溶性膳食纤维的工艺优化[J]. 食品科学, 2013, 34(22):70-74.
[13] CHAN C F, HUANG Y L. Comparison of the chemical composition and physicochemical properties of different fibers prepared from the peel of Citrus sinensis L. Cv. Liucheng[J]. Journal of Agricultural & Food Chemistry, 2003, 51(9):2 615-2 618.
[14] SANGNARK A, NOOMHORM A. Effect of particle sizes on functional properties of dietary fibre prepared from sugarcane bagasse[J]. Food Chemistry, 2003, 80(2):221-229.
[15] FEMENIA A, LEFEBVRE A C, THEBAUDIN J Y, et al. Physical and sensory properties of model foods supplemented with cauliflower fiber[J]. Journal of Food Science, 2010, 62(4):635-639.
[16] 黄才欢,欧仕益,张宁,等. 膳食纤维吸附脂肪、胆固醇和胆酸盐的研究[J]. 食品科技, 2006, 31(5):133-136.
[17] 胡国华,黄绍华. 米糠膳食纤维对胆酸钠吸附作用的研究[J]. 中国食品添加剂, 2001(2):10-12.
[18] GB 5009.33—2010 食品中亚硝酸盐与硝酸盐的测定[S].北京:中国标准出版社,2010.
[19] 牛广财,朱丹,肖盾,等. 沙果膳食纤维对胆固醇和亚硝酸根离子吸附作用的研究[J]. 中国酿造, 2011, 30(9):47-50.
[20] 王庆庆,刘通,刘婷婷,等. 碳酸钠脱色对木耳可溶性膳食纤维性质的影响[J]. 食品安全质量检测学报, 2016, 7(3):1 269-1 274.
[21] 付娆,徐曼旭,孙安敏,等. 纤维素酶提取黑木耳残渣中膳食纤维的条件优化[J]. 食品工业, 2014, 35(1):41-44.
[22] 王庆庆. 三种食用菌可溶性膳食纤维提取工艺优化及功能特性研究[D]. 长春:吉林农业大学, 2016.
[23] 蓝海军,刘成梅,涂宗财,等.大豆膳食纤维的湿法超微粉碎与干法超微粉碎比较研究[J].食品科学, 2007, 28 (6):171-174.
[24] WALKER E A, PIGNATELLI B, FRIESEN M. The role of phenols in catalysis of nitrosamine foemation[J]. Journal of the Science of Food and Agriculture, 1982, 33(1), 81-88.
[25] MØLLER M  , DAHL R, BØCKMAN O C. A possible of the dietary fibre product, wheat bran, as a nitrite scavenger[J]. Food and Chemical Toxicology. 1988, 26(10): 841-845.
, DAHL R, BØCKMAN O C. A possible of the dietary fibre product, wheat bran, as a nitrite scavenger[J]. Food and Chemical Toxicology. 1988, 26(10): 841-845.
[26] 牛广财,朱丹,肖盾,等. 沙果膳食纤维对胆固醇和亚硝酸根离子吸附作用的研究[J]. 中国酿造, 2011, 30(9):47-50.
[27] 周小理,钱韻芳,周一鸣,等.植物性膳食纤维抗氧化活性的研究与应用[J].食品与机械, 2010, 26 (3):158-160.