柚皮素(4′,5,7-三羟基二氢黄酮)是柚皮苷的苷元,广泛存在于芸香科植物中,在降血脂、镇静、抗氧化、抗真菌、抗肿瘤、抗动脉粥样硬化等方面具有较强的药理活性[1-4]。黄酮类化合物之所以一直受到广泛的关注,是因为其代谢后能够改变药物的生物活性和细胞透过能力[5]。因此认为黄酮类天然药物是以前药的形式存在,真正起作用的是其代谢产物[6]。研究表明,柚皮苷通过口服或灌胃给药后在动物体内主要水解生成柚皮素,且相比口服柚皮苷,直接口服柚皮素具有更好的药动学效应[7-8]。
柚皮素虽在天然植物中来源广泛,但含量极低,通过提取法得率较低[9],且需要使用大量有机溶剂,易造成环境污染。基于这些问题,目前工业上主要通过水解柚皮苷来大量制备柚皮素。丰都红心柚是中国十大名柚之一,以其深红鲜艳的汁胞和丰富的营养而深受消费者喜爱。柚子生长过程中,由于疏果处理及生理原因常造成果园大量的落果,种植者一般任其腐烂。但研究表明[10],掉落的幼果果皮中柚皮苷含量远高于成熟果,是制备柚皮素的理想原料。因此,本文以红心柚落果为原料提取柚皮苷进而水解制备柚皮素,能够极大程度地实现资源综合利用、减轻落果丢弃造成的环境问题。
柚皮素的水解制备方法包括酶法、微生物法及酸解法。酶解法在实际生产应用中成本高,且存在柚皮苷溶解度小、反应时间过长的问题,经济效益较低[11-12]。有研究者为了避免酶的复杂的分离纯化步骤,采用产柚苷酶霉菌与柚皮苷混合,通过霉菌直接水解柚皮苷[13-14]。该法虽反应条件温和、专一性强,但仍存在操作繁琐、耗时长的问题。酸解法是指将柚皮苷与酸的水溶液混合,在高温或高温高压情况下催化反应,将柚皮苷水解掉一分子葡萄糖和鼠李糖得到最终产物柚皮素的过程,高温条件下柚皮苷能在溶剂中较好地溶解,与酸充分反应,产物得率高[15-16]。目前很少有研究者从柚子果园落果中提取柚皮苷,并以其制备苷元柚皮素,而关于不同酸解条件对柚皮素得率和柚皮苷水解率影响的文献鲜见报道。本文以丰都红心柚落果为原料,提取柚皮苷并运用酸解法制备柚皮素,通过单因素试验探究各反应条件对柚皮素得率及柚皮苷水解率的影响,并通过正交设计优化,确定了最佳的工艺条件,为丰都红心柚落果高价值利用,开发简便、低成本的柚皮素制备工艺提供理论依据。
1 材料与方法
1.1 材料与试剂
丰都红心柚落果,采购于重庆市丰都县;柚皮苷标准品(含量≥95%,Sigma公司)、柚皮素标准品(含量≥97%,Sigma公司)、浓HCl(分析纯)、NaOH(分析纯)甲醇(分析纯)、乙醇(分析纯),成都科龙化工试剂厂;甲醇(色谱纯),Sigma公司。
1.2 仪器与设备
BT224S 电子分析天平,赛多利斯科学仪器有限公司;DF-101S 集热式恒温磁力搅拌器,郑州长城科工贸有限公司;UltiMate3000 高效液相色谱仪,戴安中国有限公司;恒温水浴锅,上海双舜实业发展有限公司;LGJ-10 台式真空冷冻干燥机,长沙市恒和科技仪器有限公司;6202 型高速粉碎机,北京燕山正德机械设备有限公司;旋转蒸发仪,瑞士BUCHI公司;真空泵,南京真空泵厂。
1.3 实验方法
1.3.1 柚皮苷的提取及纯化
参考孙胜亮[17]的方法并稍作修改,将丰都红心柚落果切块后于60 ℃烘箱中干燥24 h,经粉碎机粉碎,过60目筛,得落果粗粉。取一定量落果粉于圆底烧瓶中,按液料比20∶1(mL∶g)加入体积分数为70%的乙醇,在70 ℃水浴条件下回流提取1 h,过滤得提取液;过滤后的滤渣再按液料比10∶1(mL∶g)加入体积分数为70%的乙醇,在70 ℃水浴下继续回流提取1 h,过滤得第2次提取液。合并2次滤液,50 ℃下真空浓缩至原体积1/10,室温下冷却后于4 ℃冰箱静置24 h,过滤得沉淀,即为柚皮苷粗品。
在柚皮苷粗品中按液料比3∶1(mL∶g)加入无水乙醇,充分溶解后过滤,滤液于4 ℃放置24 h,过滤得结晶物;结晶物中按液料比2∶1(mL∶g)加入蒸馏水,70 ℃水浴充分溶解30 min,趁热过滤,滤液放冷后于4 ℃静置24 h,过滤,结晶物冷冻干燥得柚皮苷纯品。取适量柚皮苷纯品溶解于甲醇中,测得其纯度为88.23%。
1.3.2 柚皮苷和柚皮素含量测定方法的建立
1.3.2.1 色谱条件
Venusil MP C18色谱柱(4. 6 mm×250 mm,5μm);柱温30 ℃;检测波长:283 nm;检测器:紫外检测器;流动相;1% 冰乙酸(A)-甲醇(B),梯度洗脱(0~25 min,38% B; 25~55 min,38%~45% B; 55~60 min,45%~38% B);进样量:20 μL;流速:1 mL/min。
1.3.2.2 对照品溶液的制备
精密称取对照品柚皮素5.00 mg于10 mL容量瓶中,对照品柚皮苷1.00 mg于100 mL容量瓶中,加适量甲醇溶解并定容至刻度,配制得质量浓度分别为500 mg/L和10 mg/L的对照品溶液。
1.3.2.3 供试品溶液的制备
取1.0 g柚皮苷纯品于100 mL圆底烧瓶中,加入25 mL质量分数为3.5%的HCl,110 ℃油浴条件下搅拌(200 r/min)回流酸解1.5 h。酸解液冷却至室温,用2 mol/L NaOH将其pH调至7,将液体转移至250 mL容量瓶,用甲醇定容至刻度线,稀释40倍,在1.3.2.1的方法进行含量测定。
1.3.2.4 标准曲线的建立
分别准确吸取柚皮素和柚皮苷对照品溶液0.2、0.6、1.0、1.4、1.8 mL;0.4、1.0、1.6、2.2、2.8 mL于10 mL容量瓶中,加甲醇稀释至刻度,摇匀,使其质量浓度分别为10、30、50、70、90 mg/L;0.4、1.0、1.6、2.2、2.8 mg/L。以对照品质量浓度X为横坐标,峰面积Y为纵坐标进行线性回归,得到回归方程。
1.3.2.5 精密度试验
分别取柚皮素和柚皮苷对照品溶液1 mL,按1.3.2.1色谱条件进样分析,重复进样6次,记录柚皮素和柚皮苷峰面积,计算相对标准偏差。
1.3.2.6 重复性试验
分别精密称取柚皮苷纯品6份,按1.3.2.3的方法制备供试品溶液,进样测定,记录柚皮素和柚皮苷峰面积,计算相对标准偏差。
1.3.2.7 稳定性试验
精密称取柚皮苷纯品1份,按1.3.2.3的方法制备,将供试品溶液在室温下放置,分别在0、2、4、8、12、24 h时测定,记录柚皮素和柚皮苷峰面积,计算相对标准偏差。
1.3.2.8 加样回收率试验
取已测含量的酸解液10 mL 9份,每3份中分别准确加入柚皮苷对照品溶液0.4、0.6、0.8 mL;柚皮素对照品溶液0.4、0.6、0.8 mL,稀释40倍后进样,测定柚皮苷和柚皮素的平均回收率。
1.3.3 柚皮素得率及柚皮苷水解率计算
柚皮素及柚皮苷水解率计算如公式(1)和公式(2)。
柚皮素得率![]()
(1)
式中:ρ,柚皮素的质量浓度,mg/L;40,稀释倍数;V,容量瓶体积,L;m,柚皮苷纯品质量,mg;R,柚皮苷纯品纯度, %。
柚皮苷水解率![]()
(2)
式中:A2,反应后柚皮苷峰面积,mAU·min;A1,反应前柚皮苷峰面积,mAU·min。
1.3.4 单因素试验
通过单因素试验对柚皮素制备过程中影响柚皮素得率和柚皮苷水解率的各因素进行分析,确定最佳工艺参数。
1.3.4.1 酸解温度的影响
取5份1.0 g柚皮苷,分别置于100 mL圆底烧瓶中,并分别加入20 mL质量分数为3.5%的HCl,酸解时间为1 h,研究酸解温度分别为90、100、110、120、130 ℃时对柚皮素得率、柚皮苷水解率的影响。
1.3.4.2 酸解时间的影响
取5份1.0 g柚皮苷,分别置于100 mL圆底烧瓶中,并分别加入20 mL质量分数为3.5%的HCl,酸解温度为110 ℃,研究酸解时间分别为0.5、1.0、1.5、2.0、2.5 h时对柚皮素得率、柚皮苷水解率的影响。
1.3.4.3 HCl质量分数的影响
取5份1.0 g柚皮苷,分别置于100 mL圆底烧瓶中,并分别加入20 mL不同质量分数的HCl,固定酸解时间为1 h,酸解温度为110 ℃,研究HCl质量分数分别为1.5%、2.5%、3.5%、4.5%、5.5%时对柚皮素得率、柚皮苷水解率的影响。
1.3.4.4 液料比的影响
取5份1.0 g柚皮苷,分别置于100 mL圆底烧瓶中,并分别加入不同体积质量分数为3.5%的HCl,固定酸解时间为1 h,酸解温度为110 ℃,研究液料比分别为10∶1、15∶1、20∶1、25∶1、30∶1(mL∶g)时对柚皮素得率、柚皮苷水解率的影响。
1.3.5 正交试验优化酸解制备柚皮素工艺参数
通过单因素试验,选择酸解温度、酸解时间、HCl质量分数、液料比4个因素作为优化的单因素,以柚皮素得率为指标,进行4因素3水平正交试验设计,优化柚皮素的制备工艺。用SPSS 17.0软件对实验数据进行回归分析,确定最佳工艺参数。
表1 正交试验因素与水平
Table 1 Factors and levels used in response surface analysis

水平因素酸解温度(A)/℃酸解时间(B)/hHCl质量分数(C)/%液料比(D)(mL∶g)11101.02.520∶121201.53.525∶131302.04.530∶1
1.4 数据处理
采用Microsoft Office Excel 2016进行数据处理和表的绘制,使用Origin 2018软件制图,采用SPSS 17.0软件进行多因素方差分析(Duncan法,P<0.05)。
2 结果与分析
2.1 标准曲线
实验得到的柚皮素和柚皮苷的标准曲线回归方程分别为Y=0.906 5X-3.716 8,R2=0.999 2;Y=0.565 3X-0.0118,R2=0.999 7,由此可知柚皮素和柚皮苷分别在10~90 mg/L、0.4~2.8 mg/L有良好的线性关系,可做为含量测定的标准曲线。
2.2 方法学考察
2.2.1 精密度试验
对照品溶液进样6次,柚皮素和柚皮苷峰面积相对标准偏差分别为0.81%和1.12%,表明本测定方法具有较好的精密度。
2.2.2 稳定性试验
放置不同时间测得柚皮素和柚皮苷峰面积RSD分别为0.94%和0.87%,表明供试品溶液在24 h内稳定。
2.2.3 重复性试验
重复制备并测定供试品溶液6次,柚皮素和柚皮苷含量RSD分别为1.85%和2.13%,表明本方法重现性好。
2.2.4 加标回收率试验
如表2所示,经加入不同体积对照品溶液,测得柚皮素和柚皮苷平均回收率分别为99.63%(RSD为1.05%)和98.87%(RSD为1.21%)。
表2 加标回收率试验结果
Table 2 Results of recovery test
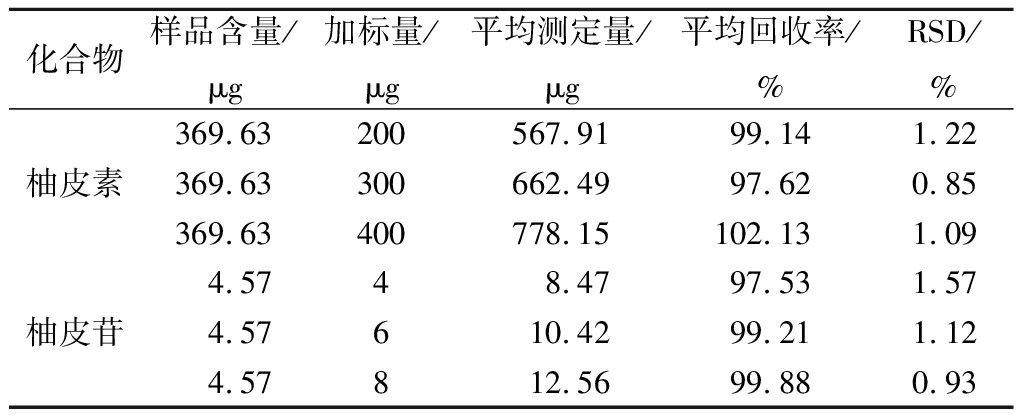
化合物样品含量/μg加标量/μg平均测定量/μg平均回收率/%RSD/%369.63200567.9199.141.22柚皮素369.63300662.4997.620.85369.63400778.15102.131.094.5748.4797.531.57柚皮苷4.57610.4299.211.124.57812.5699.880.93
2.3 酸解前后样品的HLPC图
由图1、图2比较可见,最优条件下反应后,酸解液中柚皮苷(峰1)含量极低,仅为最初含量的0.69%,这表明在此条件下原料得到充分利用,水解效率高。图2中峰2保留时间与图3柚皮素标品峰保留时间基本相同,可以初步判断其即为柚皮素。
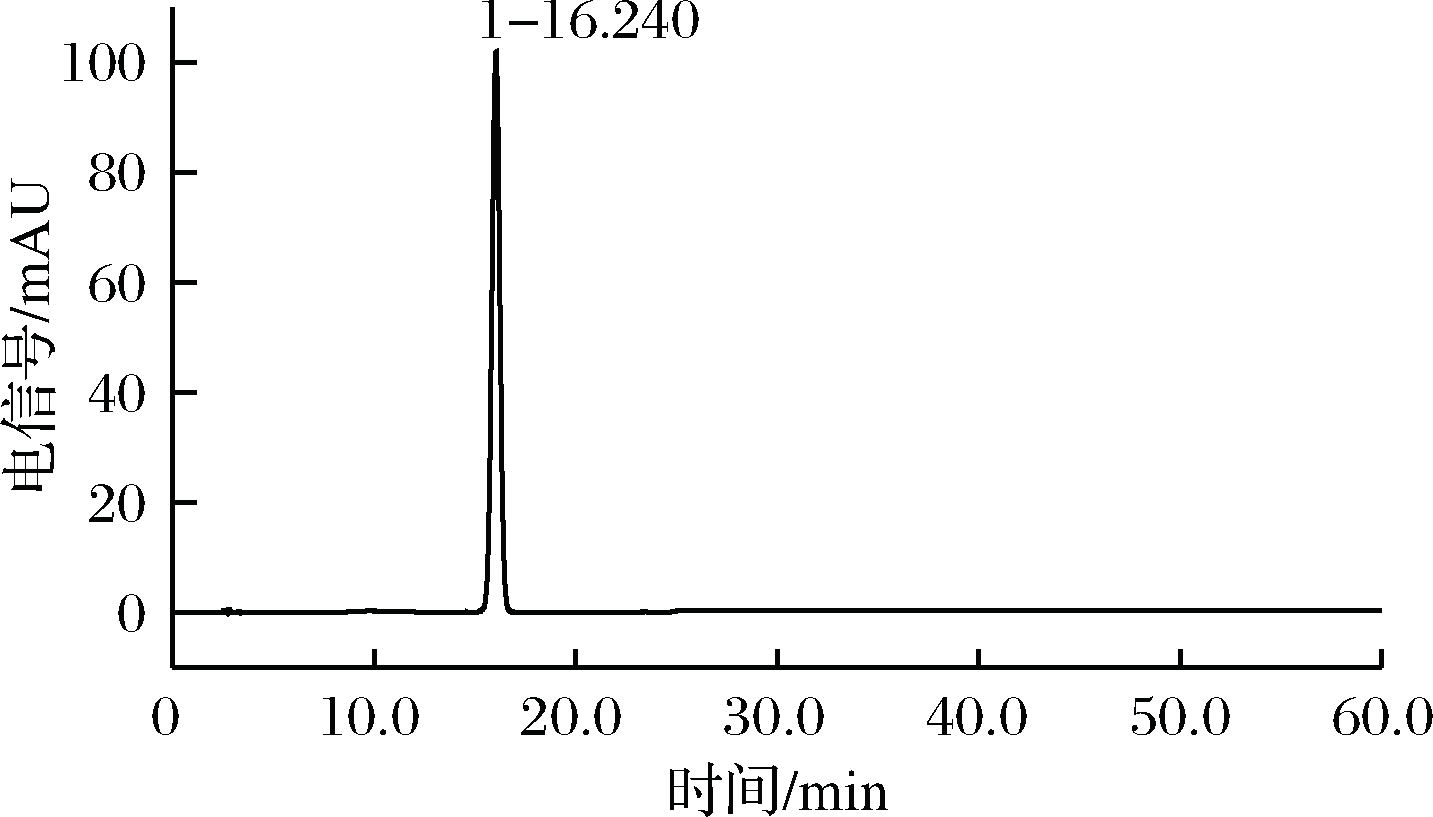
图1 样品酸解前高效液相色谱图
Fig.1 HPLC diagram of the sample before acidic hydrolysis
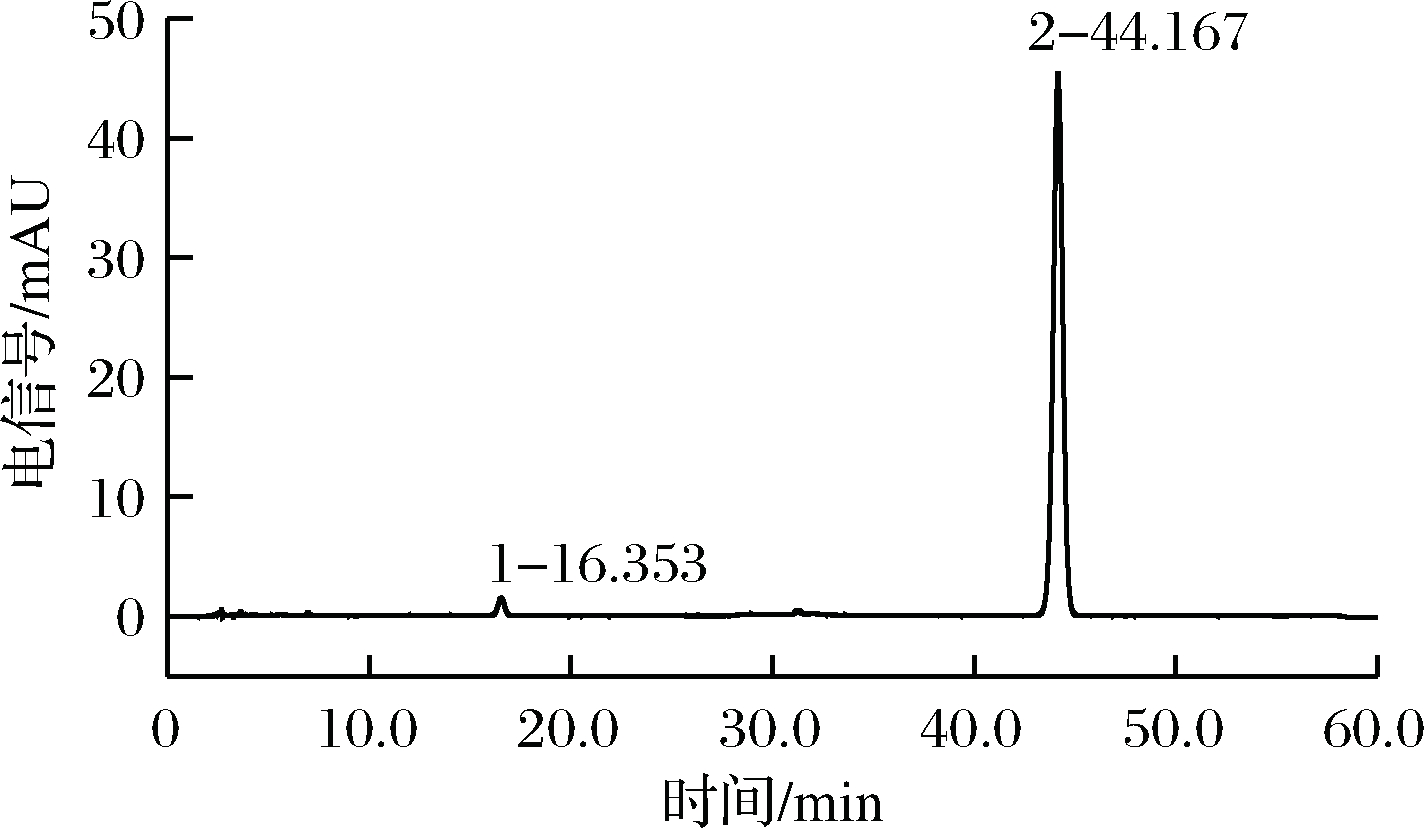
图2 样品酸解后高效液相色谱图
Fig.2 HPLC diagram of the sample after acidic hydrolysis

图3 柚皮素标准品高效液相色谱图
Fig.3 HPLC diagram of naringenin standard
2.4 单因素实验结果
2.4.1 酸解温度的选择
由图4可知,随着温度的升高,柚皮素得率和柚皮苷水解率也逐渐升高。当温度从100 ℃升至110 ℃时,柚皮素得率的升高程度明显大于柚皮苷水解率,这说明温度的升高不仅增加了柚皮苷水解的质量,还大大提高了柚皮苷的水解程度。当温度达到110 ℃时柚皮素得率最高,温度继续上升时,柚皮素得率开始逐渐下降,柚皮苷水解率变化较为平缓,因此选择110 ℃较为适宜。
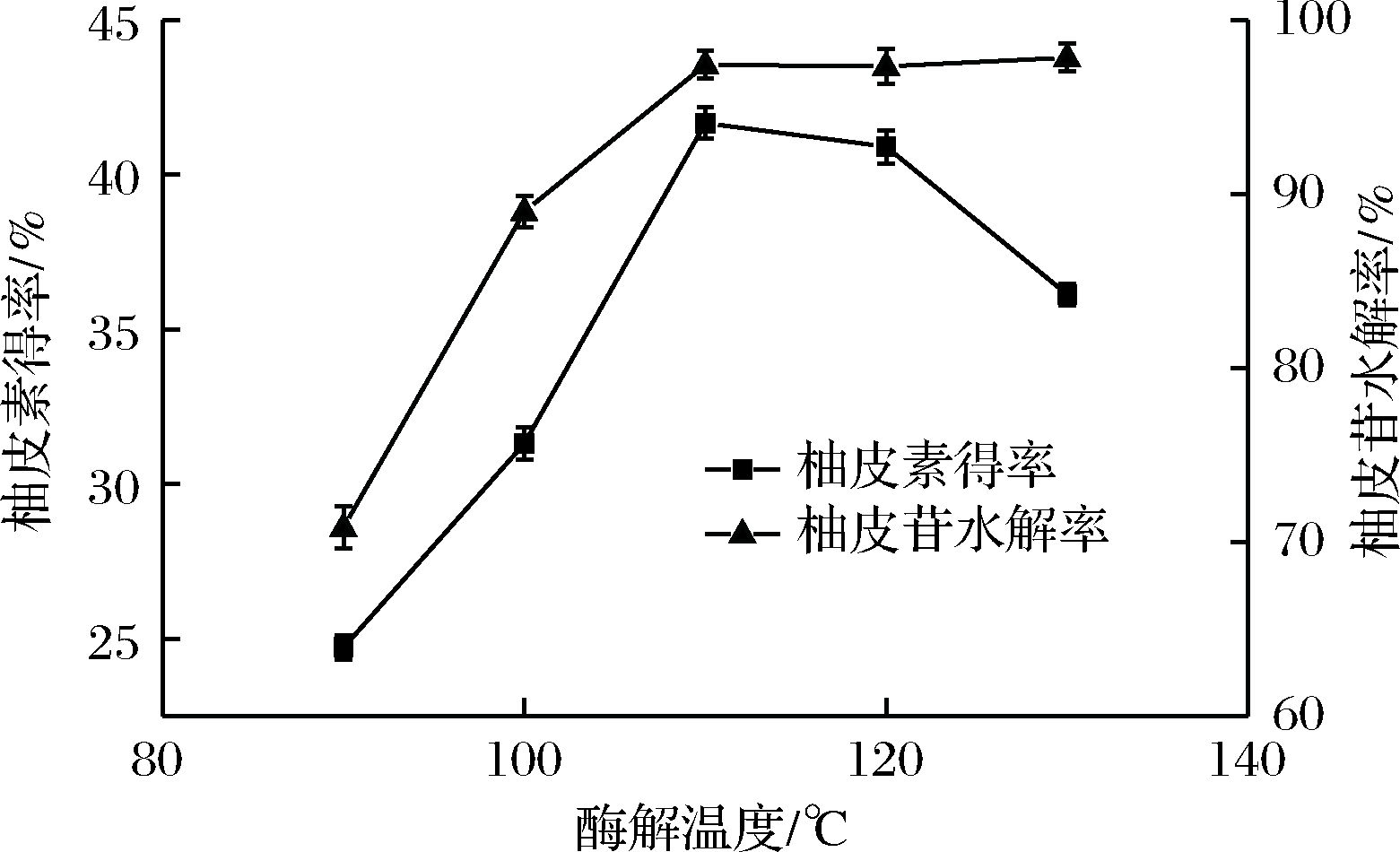
图4 酸解温度对柚皮苷水解率及柚皮素得率的影响
Fig.4 Effect of temperature on the yield of naringeninand hydrolysis percent of naringin
2.4.2 酸解时间的选择
如图5所示,酸解时间对柚皮苷水解率和柚皮素得率有一定影响。当酸解时间为1.5 h时柚皮素得率和柚皮苷水解率均达到最大值,分别为99.16%和40.58%。继续延长反应时间时,柚皮苷水解率几乎保持不变而柚皮素得率开始下降,这可能是由于时间的延长柚皮素被破坏所致[18]。但因1.0 h时两指标与1.5 h时相差并不大,考虑到时间成本,酸解时间选择1.0 h较为适宜。
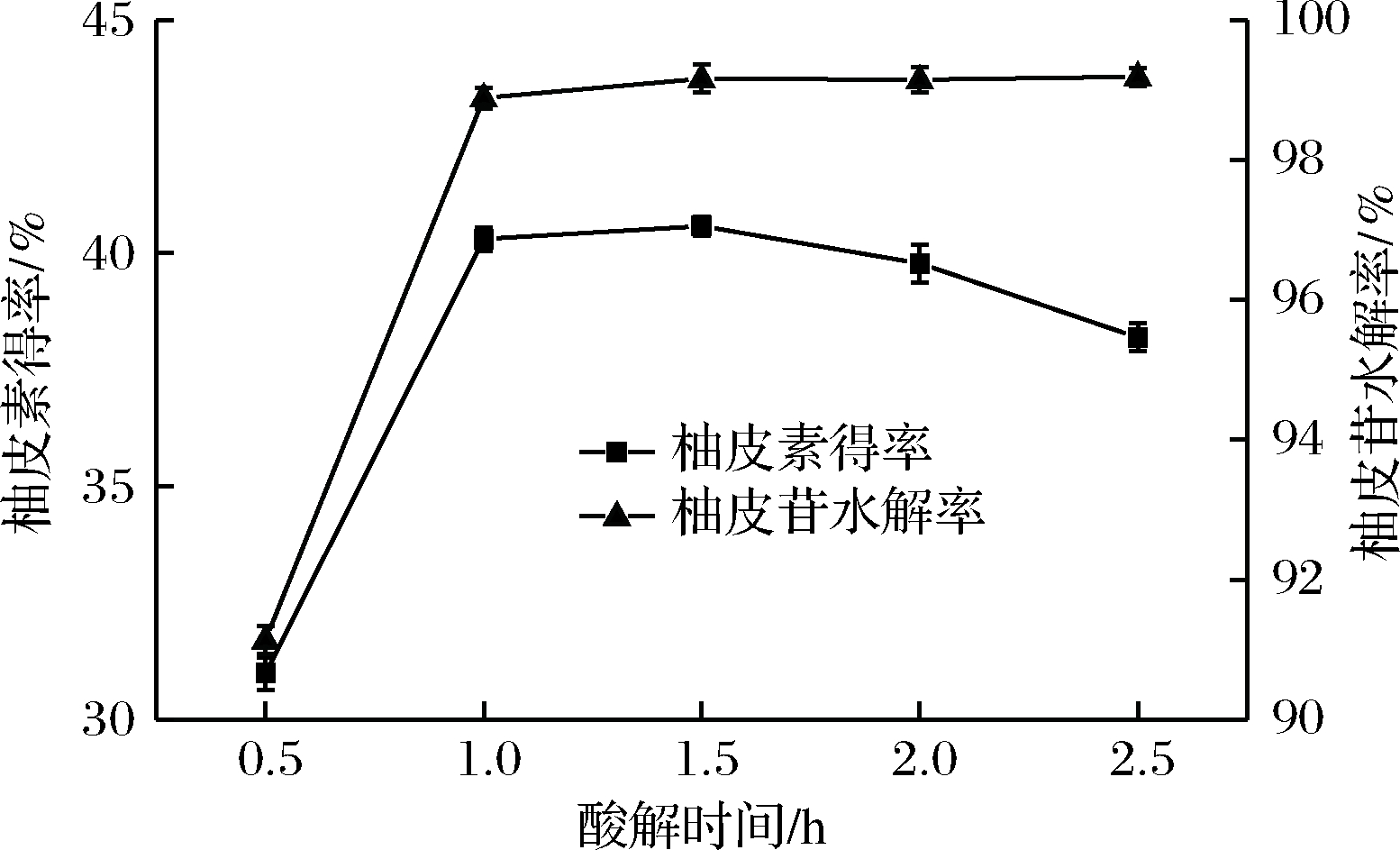
图5 酸解时间对柚皮苷水解率及柚皮素得率的影响
Fig.5 Effect of time on the yield of naringenin andhydrolysis percent of naringin
2.4.3 HCl浓度的选择
由图6可知,当HCl质量分数低于2.5%时,柚皮苷的水解数量和程度均不高,这可能与缺少反应底物有关[19]。在质量分数到达3.5%时,随着质量分数的升高,柚皮素和柚皮苷含量的变化并不明显,说明此时反应物充足。故选择3.5%为最佳HCl质量分数。
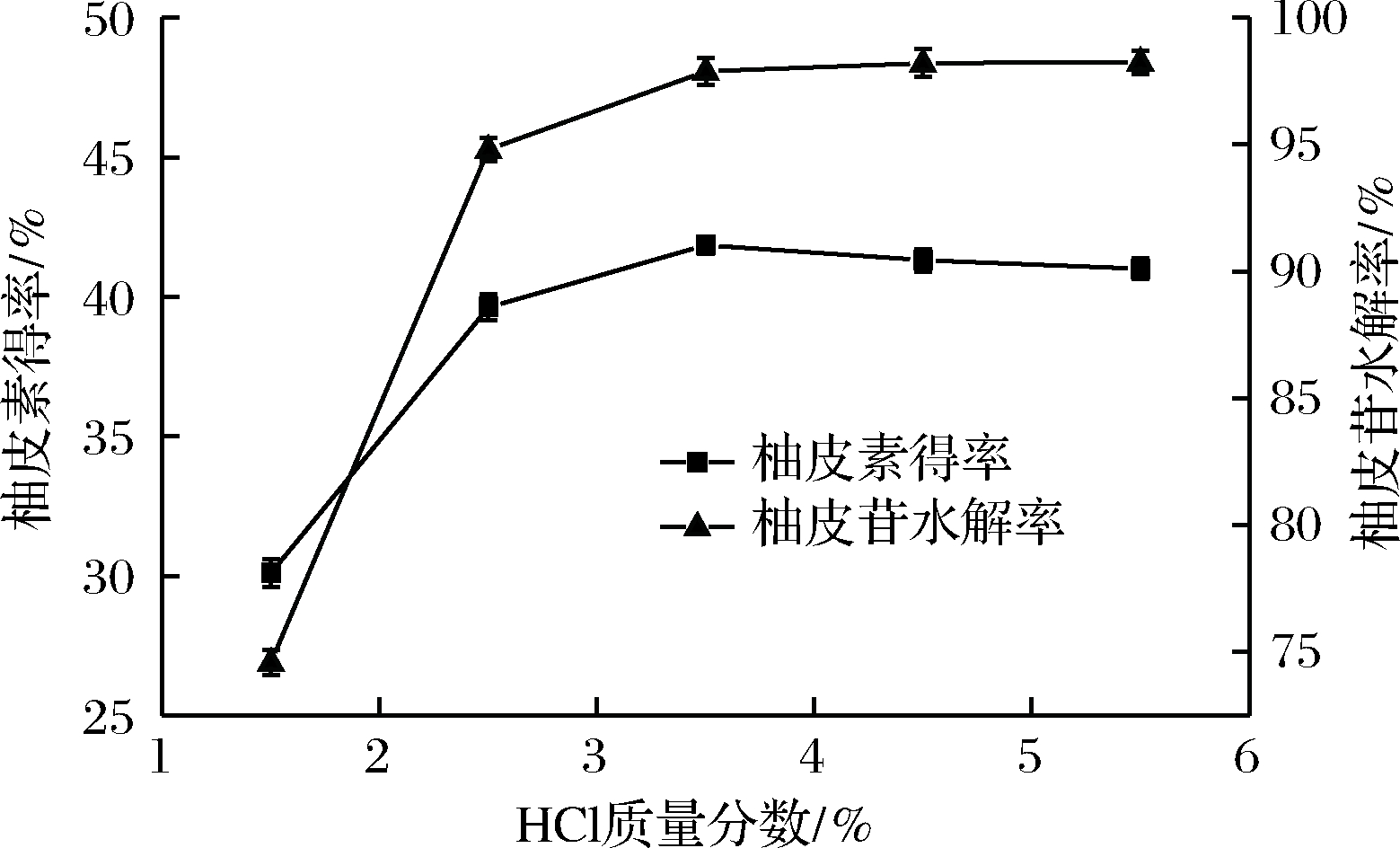
图6 HCl质量分数对柚皮苷水解率及柚皮素得率的影响
Fig.6 Effect of concentration of hydrochloric acid onthe yield of naringenin and hydrolysis percent of naringin
2.4.4 液料比的选择
由图7可以看出,液料比对柚皮素得率和柚皮苷水解率有较大影响。酸解过程中随着稀HCl体积的增加,柚皮素得率和柚皮苷水解率逐渐增高。当液料比为20∶1(mL∶g)时,柚皮素得率达到最大值,为41.02%,但若继续增加液料比,柚皮素得率有所下降,同时柚皮苷水解率升高缓慢。因此本实验选用最佳液料比为20∶1(mL∶g)。
2.5 正交实验优化酸解制备柚皮素工艺的结果
由酸解制备柚皮素优化正交试验极差分析结果可知,对柚皮素得率的影响大小依次为:酸解温度>酸解时间>HCl质量分数>液料比,优化的最佳酸解条件为A1B2C2D2,即在酸解温度为110 ℃、酸解时间为1.5 h、HCl质量分数为3.5%、液料比为25∶1(mL∶g)时柚皮素得率最高,为42.39%,此时柚皮苷水解率为99.31%。由表中方差分析可知,对柚皮素得率的影响大小为酸解温度、酸解时间、液料比对柚皮素得率影响极显著,而HCl质量分数对柚皮素得率有显著影响(表3、表4)。
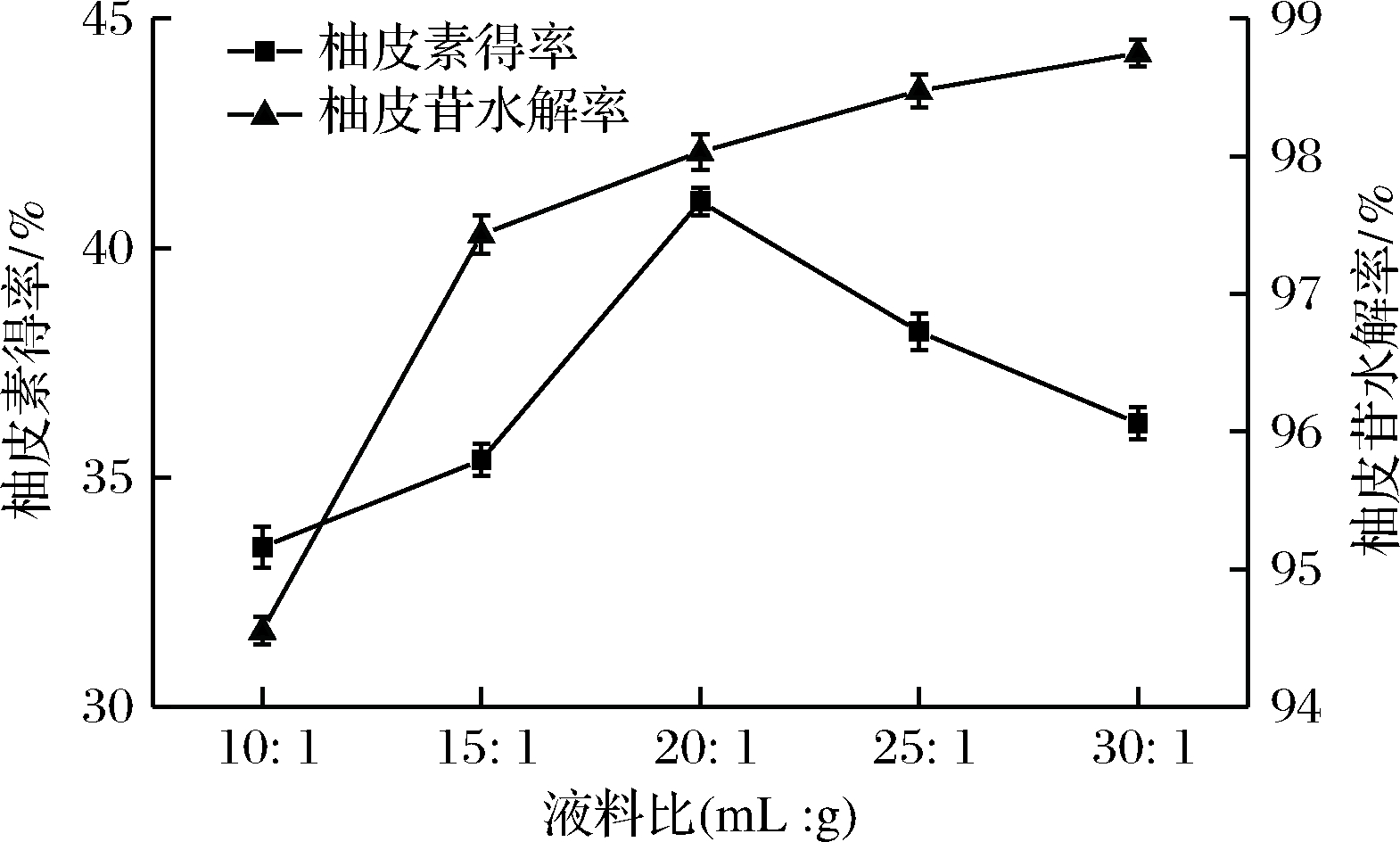
图7 液料比对柚皮苷水解率及柚皮素得率的影响
Fig.7 Effect of liquid-solid ratio on the yield ofnaringenin and hydrolysis percent of naringin
表3 正交试验结果
Table 3 Result of orthogonal test

试验酸解温度(A)酸解时间(B)HCl质量分数(C)液料比(D)柚皮素得率/%11(110℃)1(1.0 h)1(2.5%)1(20∶1)36.12±0.63212(1.5 h)2(3.5%)2(25∶1)42.39±0.54313(2.0 h)3(4.5%)3(30∶1)36.11±0.3342(120℃)12331.81±0.205223134.36±0.436231229.76±0.3273(130℃)13229.44±0.708321333.15±0.379332128.16±0.57K138.20732.45733.01332.883K231.98036.64034.12033.863K330.25331.34333.30733.693R7.9545.2971.1070.980最优方案A1B2C2D2
表5 正交实验方差分析表
Table 5 Variance analysis of orthogonal test

变异来源平方和自由度均方F值P值显著性A210.1762105.088456.2970.000∗∗B93.294246.647202.5430.000∗∗C3.98921.9948.6600.008∗∗D3.32721.6637.2220.013∗误差2.07390.230总变异20 487.23618
注:*为差异显著,P<0.05;**为差异极显著,P<0.01。
3 讨论
在天然活性物质的利用过程中,往往将其中的低效成分转化为高效成分[20]。目前,将柚皮苷转化为柚皮素的方法主要包括酸水解法和酶水解法。酶水解法的反应条件较为温和,可以较好地保持产物的结构。由于酶对化学键的专一性强,酶水解法能够达到较高的水解率和产物得率。但在酶的作用温度下(<60℃)柚皮苷的溶解度较低,酶解速率慢,导致较长的反应时间(24~48 h)[21]。崔莉等[22]通过在酶解液中添加聚山梨酯80,将柚皮苷的溶解度提高了21倍,反应时间缩短到了12 h,大大提高了酶解法的效率。与酶解法相比,酸水解法工艺简单,时间短,成本低,更适合工业化生产。伍毅[23]在70℃下,HCl的80%甲醇溶液中将银杏黄酮水解4 h制备其苷元,在此条件下黄酮水解率为93.8%。本实验在达到更高水解率的前提下,水解时间更短,原因可能是在更高的温度下,分子运动加快,有利于水解反应进行[24]。目前国内外关于柚皮素的酸水解制备方法的研究非常有限,以各种酶催化水解制备的研究较多,这可能与HCl和H2SO4等无机酸属于高危险管制药品有关,因此使用苹果酸、酒石酸等食品级有机酸作为替代品可能会成为今后发展的方向。
落果是树体生长过程中的正常生理现象,果实之间的养分竞争易导致落果现象发生,农民也常通过疏果来提高果实品质、避免果实遭受病虫害[25]。早期落地幼果果皮中黄酮含量远高于成熟果,其中柚皮苷的含量大于总黄酮含量的70%[26]。然而处理大量落果的方式通常为深埋或堆积沤肥,这不仅造成巨大的资源浪费,同时导致严重的环境污染。因此,以田间废弃物丰都红心柚落果为原料提取柚皮苷、制备柚皮素具有较高的实际应用价值,同时为柚皮苷、柚皮素工业化量产的原料来源提供思路。
4 结论
本试验研究了不同因素对柚皮素得率及柚皮苷水解率的影响,并以柚皮素得率为指标,选取酸解温度、酸解时间、HCl质量分数、液料比进行工艺优化,得出对柚皮素得率的影响大小为:酸解温度>酸解时间>HCl质量分数>液料比,优化的工艺条件为:酸解温度110 ℃、酸解时间1.5 h、HCl质量分数为3.5%、液料比为25∶1(mL∶g),柚皮素得率为42.39%,柚皮苷水解率为99.31%。在此条件下,原料得到充分利用、残余量较低,柚皮素的得率高。该方法操作简便、酸用量少,较为经济环保,以期对柚皮素低成本产业化生产提供参考。
[1] ORHAN I E, NABAVI S F, DAGLIA M, et al. Naringenin and atherosclerosis: A review of literature[J]. Curr Pharm Biotechnol, 2015,16(3):245-251.
[2] ZAKI H F, ABD-EL-FATTAH M A, ATTIA A S. Naringenin protects against scopolamine-induced dementia in rats[J]. Bulletin of Faculty of Pharmacy, Cairo University, 2014,52(1):15-25.
[3] HWANG S, SHIH P H, YEN G C. Neuroprotective effects of citrus flavonoids[J]. Journal of Agricultural and Food Chemistry, 2012,60(4):877-885.
[4] ZENG W, JIN L, ZHANG F, et al. Naringenin as a potential immunomodulator in therapeutics[J]. Pharmacological Research, 2018,135:122-126.
[5] 马燕.柚皮素口服吸收机制及改善其生物利用度的研究[D]. 沈阳:沈阳药科大学, 2006.
[6] BENAVENTE-GARCíA O,CASTILLO J. Update on uses and properties of citrus flavonoids: New findings in anticancer, cardiovascular, and anti-inflammatory activity[J]. Journal of Agricultural and Food Chemistry, 2008,56(15):6 185-6 205.
[7] HSIU S, HUANG T, HOU Y, et al. Comparison of metabolic pharmacokinetics of naringin and naringenin in rabbits[J]. Life Sciences, 2002,70(13):1 481-1 489.
[8] LI X H, XIONG Z L, LU S, et al. Pharmacokinetics of naringin and its metabolite naringenin in rats after oral administration of rhizoma drynariae extract assayed by UPLC-MS/MS[J]. Chinese Journal of Natural Medicines, 2010,8(1):40-46.
[9] 陈雪峰,班黎黎,吴丽萍. 有机溶剂提取桃叶中柚皮素的工艺研究[J]. 食品科技, 2009,34(5):209-212.
[10] 苏卿. 中国特有柑橘属植物生理落果和疏果酚类物质组成及其抗氧化活性评价研究[D].重庆:西南大学,2014.
[11] 陈剑兵,郑美瑜,陆胜民,等. 柚皮苷的酶水解工艺[J]. 浙江农业科学, 2016,1(9):1 492-1 494.
[12] RIBEIRO I A, ROCHA J, SEPODES B, et al. Effect of naringin enzymatic hydrolysis towards naringenin on the anti-inflammatory activity of both compounds[J]. Journal of Molecular Catalysis B: Enzymatic, 2008,52:13-18.
[13] 陈虹,陈蔚青,陆胤等. 黑曲霉HC306及在转化柚皮苷制备柚皮素中的应用:中国,201610234720.3[P].2016-08-10.
[14] 刘成有,肖丹,韩寒冰等. 一种微生物转化化橘红叶黄酮制备柚皮素和芹菜素的方法:中国,201611158619.0[P].2017-05-10.
[15] GROHMANN K, MANTHEY J A, CAMERON R G. Acid-catalyzed hydrolysis of hesperidin at elevated temperatures[J]. Carbohydrate Research, 2000,328(2):141-146.
[16] 季鹏,赵文明,于桐. 柚皮素的最新研究进展[J]. 中国新药杂志, 2015,24(12):1 382-1 386.
[17] 孙胜亮.柚皮活性成分提取分离及其在降血脂方面研究[D].重庆:西南大学, 2011.
[18] MAGIERA S, KWIETNIOWSKA E. Fast, simple and efficient salting-out assisted liquid-liquid extraction of naringenin from fruit juice samples prior to their enantioselective determination by liquid chromatography[J]. Food Chemistry, 2016,211:227-234.
[19] LIU Z, QIAO L, GU H, et al. Development of Brõnsted acidic ionic liquid based microwave assisted method for simultaneous extraction of pectin and naringin from pomelo peels[J]. Separation and Purification Technology, 2017,172:326-337.
[20] 崔福顺,史得君,李官浩,等. 盐酸水解法制备人参茎叶黄酮苷元的工艺研究[J]. 食品科技, 2015,40(8):208-211.
[21] 朱必玉,钱伟,王先锋,等. 交联柚苷酶聚集体水解柚皮苷制备柚皮素[J]. 安徽工程大学学报, 2016,31(2):31-35.
[22] 崔莉,张振海,孙娥,等.聚山梨酯80辅助酶法制备柚皮素的研究[J].中草药,2012,43(12):2 412-2 416.
[23] 伍毅.银杏黄酮苷元制备的研究[D].无锡:江南大学,2008.
[24] RUEN-NGAM D, QUITAIN A T, TANAKA M, et al. Reaction kinetics of hydrothermal hydrolysis of hesperidin into more valuable compounds under supercritical carbon dioxide conditions[J]. The Journal of Supercritical Fluids, 2012,66:215-220.
[25] 庄远红,刘静娜,费鹏,等. 蜜柚落果黄酮提取物的抑菌及抗氧化作用研究[J]. 河南工业大学学报(自然科学版), 2019,40(2):75-80.
[26] 方波.中国特有柚类资源类黄酮含量变化及抗氧化活性研究[D]. 重庆:西南大学, 2013.