金黄色葡萄球菌(Staphylococcus aureus) 是一种常见的食源性致病菌,由其引起的食物中毒在革兰氏阳性菌中高居首位,其致病能力主要取决于该菌产生的肠毒素(Staphylococcal enterotoxins,SEs)[1]。SEs是由S.aureus分泌产生的一类结构相似的可溶性胞外毒素蛋白质,分子质量为 27.5~30 kDa,热稳定性好,经 100 ℃煮沸 30 min而不被破坏,因此,经S.aureus污染的食物经过一般加热处理后,虽然细菌菌体可被杀死,但其产生的SEs仍然具有活性和致病力[2-3]。SEs按血清学分类,主要有SEA、SEB、SECs、SED、SEE等血清型,其中SEB因对免疫细胞有严重的毒性作用,半致死剂量仅为 20 ng/kg,因此被认定为Ⅱ类毒物,并且易以喷雾的形式用作生化武器[4]。SEB主要存在于肉类、乳及乳制品等蛋白质含量较高的动物性食品中,鉴于此,建立一种简单、快速、准确、灵敏且低成本的SEB检测技术显得尤为重要。
目前,检测SEB的方法主要有分子生物学检测法、免疫学检测法以及生物传感器法,其中,分子生物学检测法主要是对SEB的基因进行检测,但并不能直接检测蛋白本身[5-8]。基于抗原抗体特异性识别的免疫学检测技术是实现复杂食品基质中SEB定量检测的常用技术,酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA) 是其中一种相对较为成熟的检测方法,国内外已经有很多的相关研究报道,但是真正商业化的产品并不多[9-10]。目前的ELISA方法多采用多克隆抗体或单克隆抗体作为识别元件,但传统单克隆抗体存在制备耗时耗力、产量低、以及由于金黄色葡萄球菌表面存在或分泌的金黄色葡萄球菌蛋白A (Staphylococcal protein A,SpA) 会与单克隆抗体的Fc端高亲和力结合而产生假阳性结果等问题,进而阻碍ELISA方法的应用[11-12]。近年来,基因工程抗体得到了蓬勃发展,抗体的小型化是基因工程抗体的一个主要研究方向,其中单域重链抗体(variable domain of heavy chain of heavy-chain antibody,VHH) 为骆驼科(骆驼、羊驼或美洲驼)及鲨鱼体内存在的天然缺失轻链的单链抗体,由3个互补决定区(complementarity determining regions,CDRs) 构成,其晶体结构呈椭圆形,直径为2.5 nm,长为4 nm,所以又称为纳米抗体(nanobody,Nb)[13-14]。纳米抗体与单克隆抗体相比,由于天然缺乏Fc端识别位点,因此可有效避免与SpA结合导致的假阳性问题[15]。另外,纳米抗体还具有以下优点:具有更长的CDR3区,故具有较多的柔韧性和凸面性,使其更好地与抗原表面的裂缝和腔隙相结合,从而提高纳米抗体的亲和力和抗原特异性;体积小、稳定性高、水溶性好,可在微生物系统中大量合成表达,为纳米抗体低成本、高效率的生产创造了条件。基于以上优点,纳米抗体已被广泛应用于食品安全检测及临床诊断中,如黄曲霉毒素B1、Cry1Ac蛋白和赭曲霉毒素A等的检测[16-22]。
本实验室在前期工作中,已采用生物淘选策略从SEB纳米抗体噬菌体展示文库中淘选得到2株SEB的纳米抗体配对组合。以其中1株纳米抗体作为捕获抗体,以另一株噬菌体展示的纳米抗体作为检测识别元件,建立一种基于纳米抗体的灵敏度高、特异性强且适用于食品及农产品样品中SEB检测的ELISA方法。该方法以纳米抗体作为识别元件,避免了以单克隆抗体作为识别元件的传统ELISA方法存在的与SpA结合导致的假阳性问题,具有较好的应用前景。
1 材料与方法
1.1 试验材料
1.1.1 菌株
SEB纳米抗体噬菌体展示文库、抗SEB B6噬菌体、抗SEB B7纳米抗体、M13 KO7辅助噬菌体、金黄色葡萄球菌CATCC 29213、金黄色葡萄球菌CATCC 26111、金黄色葡萄球菌CATCC 25925、E.coli Top10 、E.coli TG1,由本实验室保存。
1.1.2 试剂
细胞裂解液(B-PERTM Bacterial Protein Extraction Reagent),Thermo Fisher公司;辣根过氧化物酶标记M13 单克隆抗体,Santa Cruz公司;Ni2+ - NTA亲和层析柱,GE Healthcare公司;脱脂奶粉,上海生工生物工程技术服务有限公司;异丙基硫代半乳糖苷(isopropyl-D-thiogalactopyranoside,IPTG)、低分子质量蛋白质Marker、卡那霉素(Kanamycin,Kana)、氨苄青霉素(ampicillin,Amp),北京索莱宝公司;其他试剂均为分析纯,sigma公司。
1.1.3 主要仪器与设备
Bio-Rad Gel Doc 凝胶成像系统、迷你型垂直凝胶电泳仪,美国伯乐公司;全温度恒温培养摇床、微量移液器,美国 Thermo 公司;2K-15低温离心机,Sigma 公司; SpectraM axM酶标仪,美国Molecular Devices 公司。
1.2 试验方法
1.2.1 噬菌体的扩增
在含 100 μg/mL Amp的LB平板上挑取E.coli TG1接种于 5 mL含 100 μg/mL Amp的LB液体培养基中, 37 ℃,静置培养 12 h;按 1% 接种量接种于含 100 μg/mL Amp的LB液体培养基中,37 ℃,220 r/min培养至OD600 约为 0.3,按 20∶1 (感染复数)加入M13 KO7辅助噬菌体,静置 15 min后,37 ℃,220 r/min培养 1 h;将培养液在 4 ℃、5 000 r/min条件下离心5 min,去上清,用等体积的含 100 μg/mL Amp、30 μg/mL Kana的LB培养基重悬,30 ℃、220 r/min培养 5~8 h; 4 ℃、8 000 r/min离心 10 min,取上清,加入 0.2体积的PEG/NaCl溶液,4 ℃静置过夜;4 ℃、12 000 r/min离心 20 min,弃上清,加入1 mL 50%(体积分数)甘油重悬噬菌体沉淀,即得到抗SEB B6噬菌体,并于-80 ℃条件下保存。
1.2.2 纳米抗体的表达与条件优化
将纳米抗体B7的载体转入E.coli TOP10 感受态细胞中,涂布于含 100 μg/mL Amp的LB平板上,37 ℃、250 r/min培养 12 h;在该平板上挑取一个单菌落接种于 5 mL含 100 μg/mL Amp的LB液体培养基中,37 ℃、250 r/min培养过夜;按 1% 接种量接种于含 100 μg/mL Amp的LB液体培养基中,37 ℃、250 r/min培养至OD600 约为 0.6,加入终浓度为 1 mmol/L的IPTG进行诱导表达;4 ℃、5 000 r/min离心 8 min,弃上清,按每克菌体加入 5 mL B-PER细胞裂解液,静置 15 min;4 ℃、10 000 r/min离心 10 min,收集上清,用 0.22 μm滤器过滤上清,再经Ni2+-NTA柱纯化,具体步骤参考产品说明书,而后透析得到纳米抗体B7,SDS-PAGE分析纯化后的纳米抗体纯度,BCA蛋白浓度测定试剂盒测定纳米抗体B7浓度。此外,并对诱导表达的温度(20、24、28、32、37 ℃) 和时间(2、4、6、8、10 h) 2个关键条件进行优化。
1.2.3 棋盘滴定
用PBS将纳米抗体B7稀释至 16、8、4、2、1、0.5、0 μg/mL,加入 96 孔酶标板中,100 μL/孔,4 ℃包被过夜;PBST洗板 3次,加入体积分数3% 的脱脂牛奶,300 μL/孔,37 ℃封闭 2 h;PBST洗板 3次,加入 100 ng/mL的SEB,100 μL/孔,37 ℃孵育45 min;PBST洗板 3次,用PBS稀释抗SEB B6噬菌体至滴度为 1010、109、108、107 PFU/mL,100 μL/孔,37 ℃孵育 45 min;PBST洗板 6次,加入HRP标记的抗M13 噬菌体的单克隆抗体,100 μL/孔,37 ℃孵育 45 min;PBST洗板 3次,加入TMB显色液,100 μL/孔,37 ℃孵育 10 min;加入 2 mmol/L的H2SO4,50 μL/孔,终止反应,立即用酶标仪读取OD450 值。
1.2.4 标准曲线绘制
将纳米抗体B7稀释至8 μg/mL,加入96孔酶标板中,100 μL/孔,4 ℃包被过夜;PBST洗板3次,加入 3% 的脱脂牛奶,300 μL/孔,37 ℃封闭 2 h;PBST洗板体积分数3次,加入用PBS溶液稀释至终浓度为 0、0.125、0.25、0.5、1、2、4、8、16、32、64、128、256、512、1 024 ng/mL的SEB标准品,100 μL/孔,37 ℃孵育 45 min;PBST洗板 3次,加入滴度为 109 PFU/mL的抗SEB B6噬菌体,100 μL/孔,37 ℃孵育 45 min;PBST洗板 6次,加入HRP标记的抗M13 噬菌体的单克隆抗体,100 μL/孔,37 ℃孵育 45 min;PBST洗板 3次,加入TMB显色液,100 μL/孔,37 ℃孵育 10 min;加入 2 mmol/L的H2SO4,50 μL/孔,终止反应,用酶标仪读取OD450 值。
1.2.5 最低检出限的测定
随机选取 20 份经商业化试剂盒确证为SEB阴性的牛奶、牛肉以及西瓜汁样品,用本研究建立的ELISA方法检测上述阴性样品(每个样品重复测定 5次),根据所构建的定量检测标准曲线计算出每个阴性样品中SEB的浓度,以 20 个阴性样品计算获得的SEB平均浓度加上3倍的标准偏差即为该方法检测牛奶中SEB的最低检出限。
1.2.6 特异性分析
配制终质量浓度为 0、0.125、0.25、0.5、1、2、4、8、16、32、64、128、256、512、1 024 ng/mL的SEA、SEB、SEC,并将金黄色葡萄球菌CATCC 29213、金黄色葡萄球菌CATCC 26111、金黄色葡萄球菌CATCC 25925 稀释至终浓度为 107、106、105、104、103、102 CFU/mL,用本研究建立的ELISA方法进行检测,记录OD450 值,以评价该方法的特异性。
计算交叉反应率,如公式(1)所示:
(1)
式中:Cr,交叉反应率,%;SC50analog,类似物半饱和信息值浓度;SC50SEB,SEB半饱和信息值浓度。
1.2.7 加标回收实验
取经商业化试剂盒确证为SEB阴性的样品提取液,分别添加SEB标准品至终质量浓度为 1 600、800、400、200 ng/mL,稀释 10 倍后分别用本研究建立的ELISA方法检测其中的SEB浓度,每个样品测定 6次,得出每个加标浓度的平均回收率,以评价该方法的准确度。
2 结果与分析
2.1 纳米抗体表达条件优化
诱导温度不仅会影响菌体的生长,同时也影响着重组蛋白的诱导表达水平和蛋白的可溶性[23]。本研究在培养基中加入 1 mmol/L IPTG,分别在不同的温度下(20、24、28、32、37 ℃) 诱导表达 8 h后,通过全菌体的SDS-PAGE图谱对纳米抗体B7表达量进行分析。结果如图1所示,当诱导温度为 32 ℃时,表达量最大,因此确定 32 ℃为最佳表达温度。
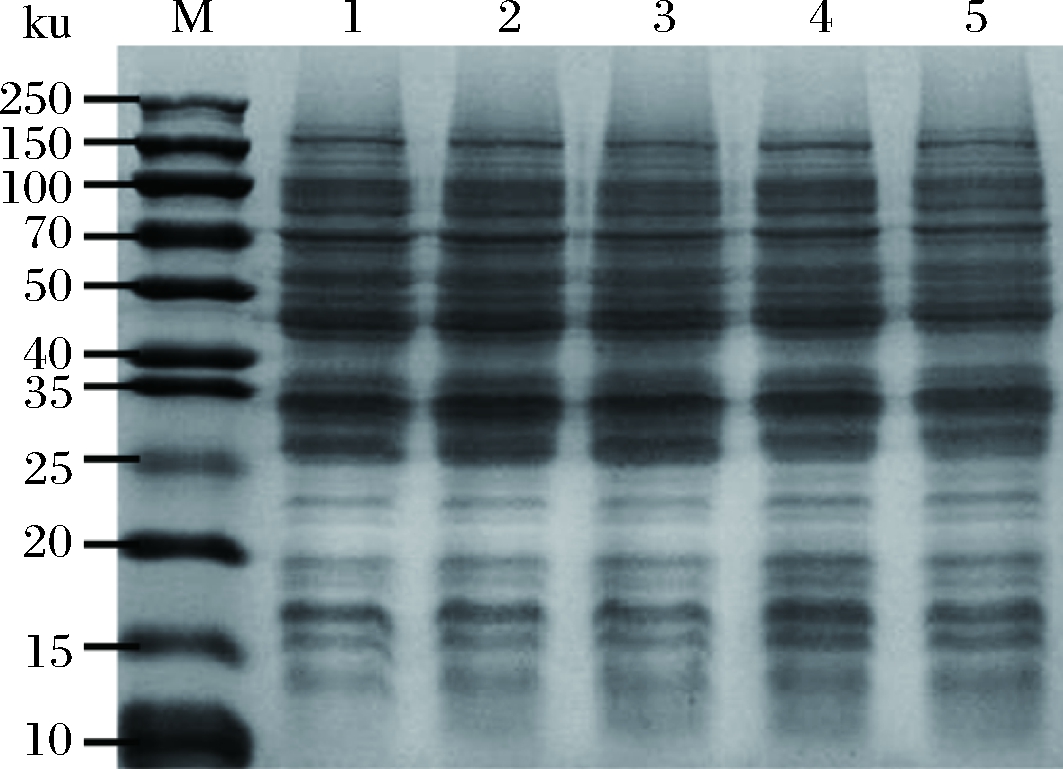
M-蛋白质Marker; 1~5- 20、24、28、32,37 ℃下的全菌体
图1 不同诱导温度下纳米抗体B7表达量的SDS-PAGE分析
Fig.1 SDS-PAGE analysis of nanobody B7 expressionat different induction temperatures
随着诱导表达时间的延长,纳米抗体的表达量趋于平稳,为了使纳米抗体的表达量达到最大且耗时最短,本研究在培养基中加入 1 mmol/L的IPTG、于最优诱导温度 32 ℃的条件下分别诱导表达不同时间(2、4、6、8、10 h),通过全菌体的SDS-PAGE图谱分析纳米抗体表达量。结果如图2所示,当诱导表达 8 h时纳米抗体表达量达到最大,因此在后续表达实验中诱导表达最佳时间为 8 h。
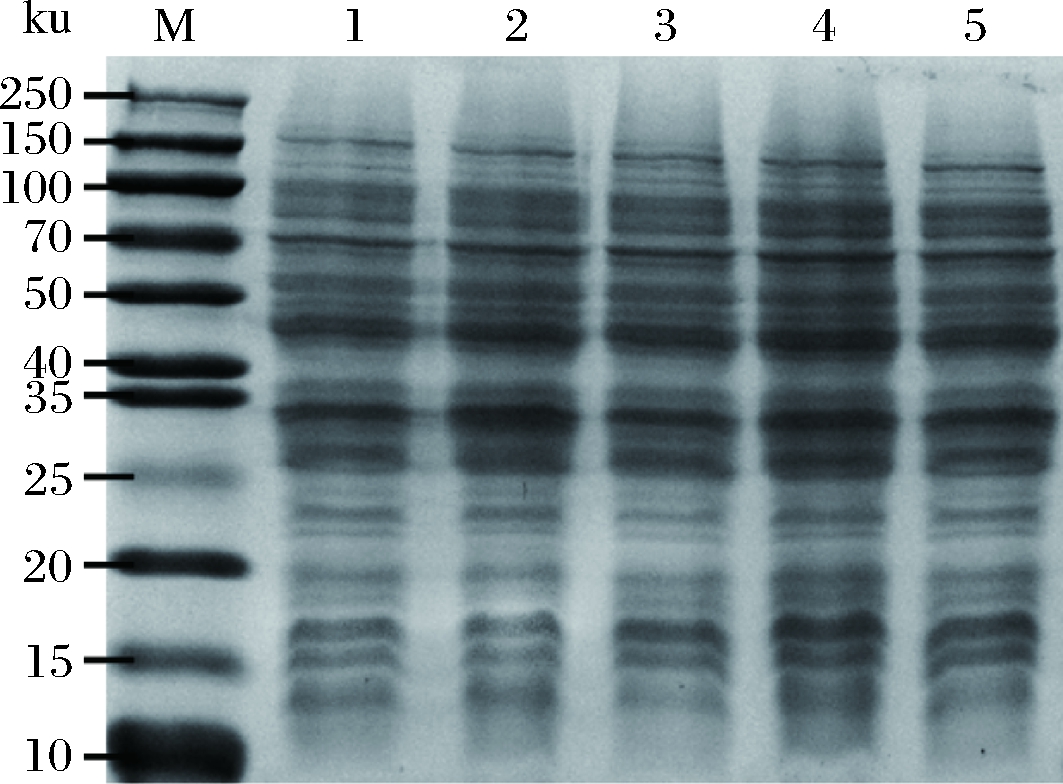
M-蛋白质Marker; 1~5-诱导时间为 2、4、6、8、10 h下的全菌体
图2 不同诱导时间纳米抗体B7表达量的SDS-PAGE分析
Fig.2 SDS-PAGE analysis of nanobody B7 expression indifferent induction time
2.2 纳米抗体的纯化
将宿主菌E.coli Top10 于最优的条件下进行表达,1 mmol/L的IPTG,32 ℃诱导表达 8 h,离心收集菌体经细胞裂解液裂解后,收集上清进行镍柱纯化,纯化后的纳米抗体进行SDS-PAGE分析,结果如图3所示,蛋白分子质量约为 17 kDa,与理论分子质量大小相符,纯化后条带单一、无杂带,说明具有较高的纯度,并且对纳米抗体浓度进行检测,得出纳米抗体B7的表达量为 6.2 mg/L。

M-蛋白质Marker; 1-纯化后的纳米抗体
图3 纳米抗体纯化的SDS-PAGE分析
Fig.3 SDS-PAGE analysis of nanobody B7 after purification
2.3 棋盘滴定
要实现ELISA方法的高灵敏检测,抗原抗体的结合部位应以充分暴露在抗原表面且配对抗体抗原识别位点相对较远为宜,在此基础上,摸索出抗体的最佳使用浓度。本研究在前期研究中已确定了SEB的纳米抗体配对组合,现通过棋盘滴定法确定纳米抗体B7和抗SEB B6噬菌体的最佳用量。结果如图4所示,最佳纳米抗体的浓度为 8 μg/mL,最佳抗SEB B6噬菌体的滴度为 109 PFU/mL。
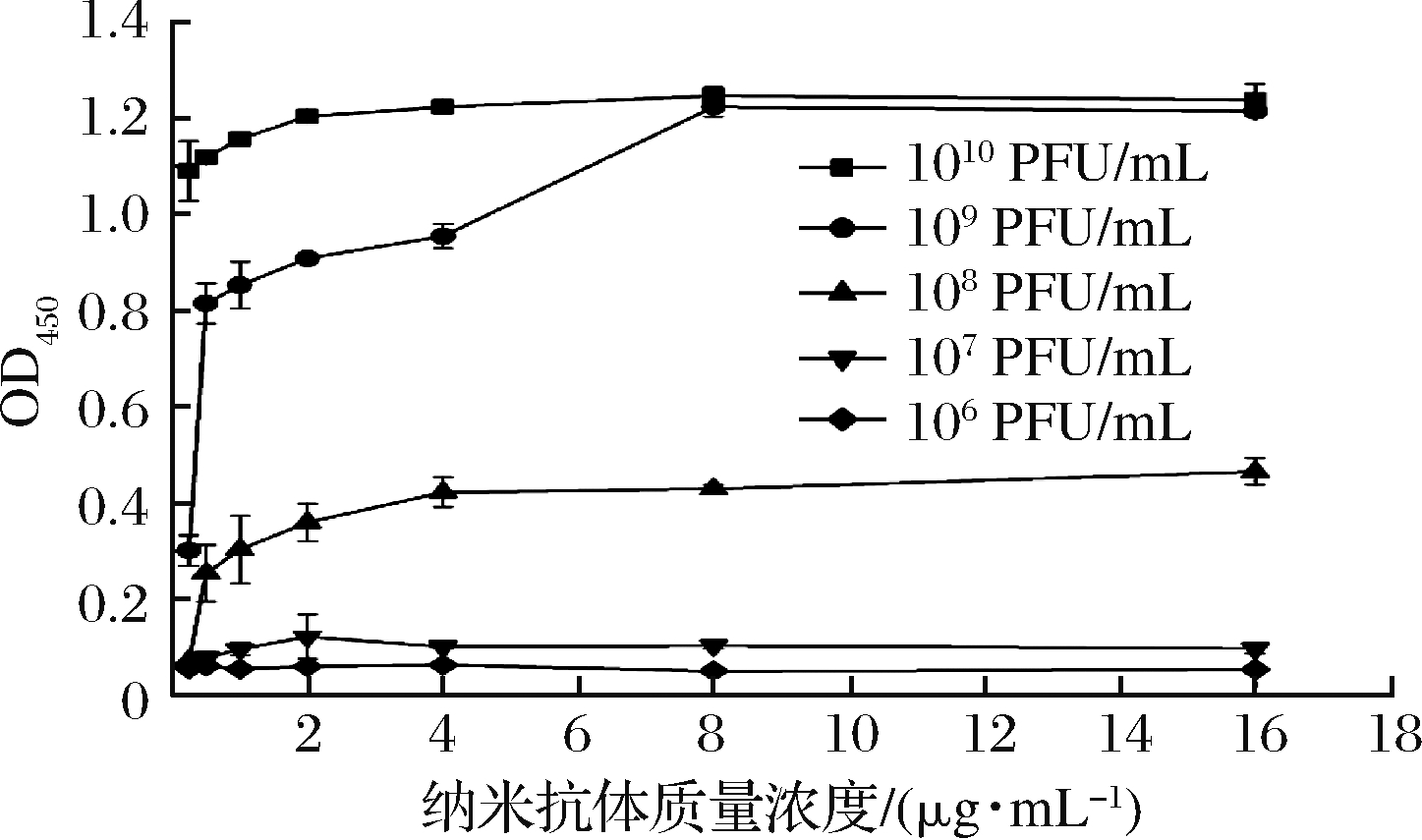
图4 棋盘滴定法确定纳米抗体和噬菌体的最优工作条件
Fig.4 Checking the optimal working conditions ofnanobody and phage by checkerboard titration
2.4 标准曲线的绘制
在最适条件下,利用ELISA方法检测 16 个不同SEB加标质量浓度的阴性样品,结果显示随着SEB质量浓度的增加,OD450 值逐渐增加,并且以SEB质量浓度为横坐标,OD450 值为纵坐标绘制标准曲线,该ELISA方法的定量线性范围为 16~1 024 ng/mL。线性回归方程为y=0.239 4 lnx-0.490 1,线性相关系数(R2) 为 0.99。随机检测 20 个阴性样品,经标准曲线计算获得该方法检测实际食品样品中SEB的最低检出限为(9.58±0.07) ng/mL,以上结果表明,该方法在食品样品中加标SEB具有较高的检测灵敏度。
2.5 特异性实验
为评估该方法的特异性,本研究选取3株金黄色葡萄球菌(CATCC 29213、CATCC 26111和CATCC 25925)、SEA及SEC作为检测对象,用已确证为阴性的样品提取液配制系列加标溶液,采用本研究建立的ELISA方法进行检测,并依据交叉反应率公式评价ELISA的特异性。
结果如表1所示,该方法与SEC有 42.18% 的交叉,与SEA及3株金黄色葡萄球菌无明显交叉。目前,基于ELISA的肠毒素检测方法已经较为成熟,但是始终无法避免与SpA结合导致的假阳性问题[24]。国家标准SN/T 1763. 2-2006(2010) 规定采用ELISA方法检测进出口食品中的SEB,但该方法是以单克隆抗体作为识别元件,可导致与金黄色球菌SpA高亲和性结合出现假阳性的结果[25],使得检测数据不准确。该方法因纳米抗体无Fc端可有效避免与spA结合导致的假阳性问题,可用于特异性检测食品样品中的SEB污染,且不受其他物质干扰。
表1 ELISA与其他结构类似物及其产生菌的交叉反应率
Table 1 The cross-reactivity of ELISA with other agonists and SAs

结构类似物名称 交叉反应率/%SEA 4.21SEB 100SEC 42.18金黄色葡萄球菌CATCC 29213<0.01金黄色葡萄球菌CATCC 26111<0.01金黄色葡萄球菌CATCC 25925<0.01
2.6 加标回收实验
采用SEB加标回收实验评价所建立的ELISA方法的准确度,实验结果如表2所示,分别在阴性的牛奶、牛肉和果汁中添加终质量浓度为 200、400、800、1 600 ng/mL的SEB标准品,经样品前处理后,用本研究建立的ELISA方法进行检测,结果显示该方法在牛奶、牛肉和西瓜汁样品的回收率分别为 87.26%~108.43%,79.36%~106.56% 和 83.81%~99.43%,变异系数为2.77%~16.15%,表明该方法具有较好的准确性及重现性。
3 结论
SEB是牛乳等食品中常见的生物毒素之一,半致死剂量仅为 20 ng/kg,实现在食品基质中的SEB高灵敏检测对于维护食品安全具有重要意义。基于抗原抗体特异性反应原理的酶联免疫检测方法,本身就具有特异性强、灵敏度高的特点,加之纳米抗体的低免疫原性、高水溶性、低成本以及天然缺失Fc端的特点,可实现对SEB的准确定量,使得该方法具有很高的实际应用价值。
表2 加标回收实验结果
Table 2 Results of sample spiked recovery experiment
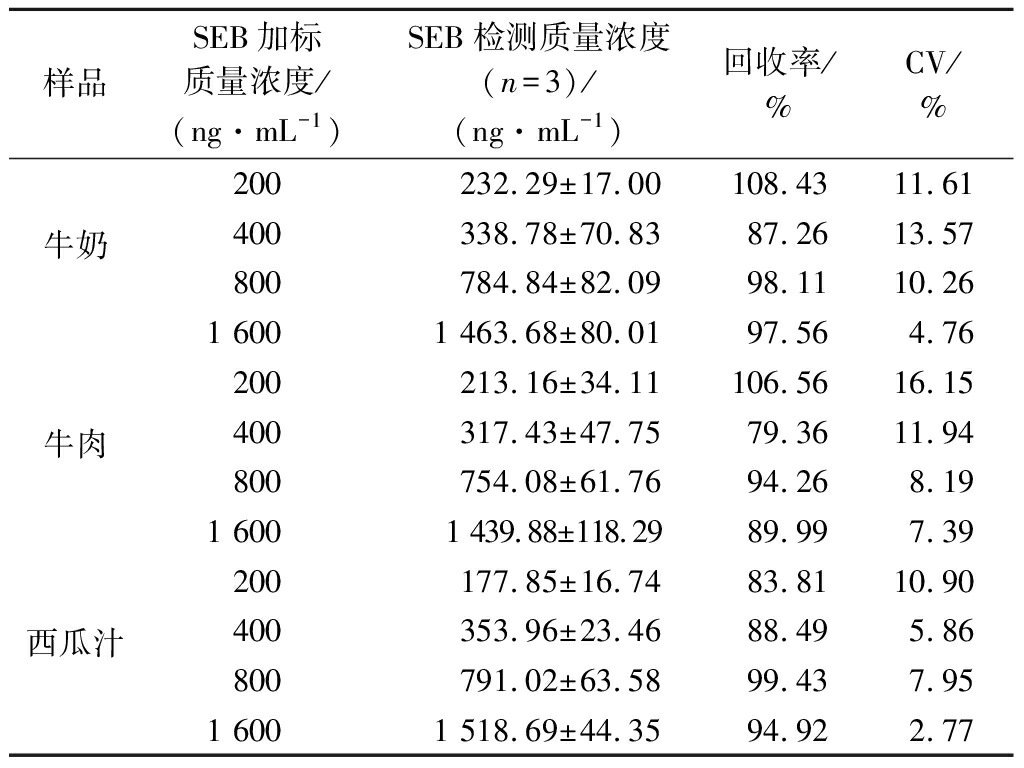
样品SEB加标质量浓度/(ng·mL-1)SEB检测质量浓度(n=3)/(ng·mL-1)回收率/%CV/%牛奶200232.29±17.00108.4311.61400338.78±70.8387.2613.57800784.84±82.0998.1110.261 6001 463.68±80.0197.564.76牛肉200213.16±34.11106.5616.15400317.43±47.7579.3611.94800754.08±61.7694.268.191 6001 439.88±118.2989.997.39西瓜汁200177.85±16.7483.8110.90400353.96±23.4688.495.86800791.02±63.5899.437.951 6001 518.69±44.3594.922.77
本研究建立的纳米抗体-噬菌体夹心ELISA方法,在 16~1 024 ng/mL具有良好的线性关系,最低检出限为(9.58±0.07)ng/mL。由于SEB和SEC同源性较强,而与SEA同源性弱,故该方法表现出与SEC存在一定的交叉,而与SEA无明显交叉。该方法可用于食品中SEB的初步定量及高通量筛查,为检测食品中的SEB污染及筛选SEB阳性菌株提供了有效方法,也为准确检测食品中SEB的含量提供了新思路。随着基因工程抗体技术的发展,有望通过定向突变的方法进一步提高2株纳米抗体的亲和力及特异性,以期实现食品中SEB的高灵敏检测。
[1] 徐振波,刘晓晨,李琳,等. 金黄色葡萄球菌肠毒素在食源性微生物中的研究进展[J]. 现代食品科技, 2013, 29(9): 2 317-2 324.
[2] GUIDI F, DURANTI A, GALLINA S, et al. Characterization of a staphylococcal food poisoning outbreak in a workplace canteen during the post-earthquake reconstruction of central Italy[J]. Toxins, 2018, 10(12): 523.
[3] NODOUSHAN S M, NASIRIZADEH N, AMANI J, et al. An electrochemical aptasensor for staphylococcal enterotoxin B detection based on reduced graphene oxide and gold nano-urchins[J]. Biosensors and Bioelectronics, 2019, 127: 221-228.
[4] WHITE J, HERMAN A, PULLEN A M, et al. The Vβ-specific superantigen staphylococcal enterotoxin B: Stimulation of mature T cells and clonal deletion in neonatal mice[J]. Cell, 1989, 56(1): 27-35.
[5] XU Y, HUO B, LI C, et al. Ultrasensitive detection of staphylococcal enterotoxin B in foodstuff through dual signal amplification by bio-barcode and real-time PCR[J]. Food Chemistry, 2019, 283: 338-344.
[6] MONDAL B, RAMLAL S, KINGSTON J. Colorimetric DNAzyme biosensor for convenience detection of enterotoxin B harboring Staphylococcus aureus from food samples[J]. Journal of Agricultural and Food Chemistry, 2018, 66(6): 1 516-1 522.
[7] WANG W, WANG W, LIU L, et al. Nanoshell-enhanced Raman spectroscopy on a microplate for staphylococcal enterotoxin B sensing[J]. ACS Applied Materials & Interfaces, 2016, 8(24): 15 591-15 597.
[8] TAN F, XIE X, XU A, et al. Fabricating and regulating peroxidase-like activity of eggshell membrane-templated gold nanoclusters for colorimetric detection of staphylococcal enterotoxin B[J]. Talanta, 2019, 194: 634-642.
[9] SAPSFORD K E, FRANCIS J, SUN S, et al. Miniaturized 96-well ELISA chips for staphylococcal enterotoxin B detection using portable colorimetric detector[J]. Analytical and Bioanalytical Chemistry, 2009, 394(2): 499-505.
[10] NIA Y, RODRIGUEZ M, ZELENY R, et al. Organization and ELISA-based results of the first proficiency testing to evaluate the ability of european union laboratories to detect staphylococcal enterotoxin type B (SEB) in buffer and milk[J]. Toxins, 2016, 8(9): 268.
[11] REDDY P K, SHEKAR A, KINGSTON J J, et al. Evaluation of IgY capture ELISA for sensitive detection of Alpha hemolysin of Staphylococcus aureus without staphylococcal protein A interference[J]. Journal of Immunological Methods, 2013, 391(1-2): 31-38.
[12] NAGARAJ S, RAMLAL S, KINGSTON J, et al. Development of IgY based sandwich ELISA for the detection of staphylococcal enterotoxin G (SEG), an egc toxin[J]. International Journal of Food Microbiology, 2016, 237: 136-141.
[13] DE MEYER T, MUYLDERMANS S, DEPICKER A. Nanobody-based products as research and diagnostic tools[J]. Trends in Biotechnology, 2014, 32(5): 263-270.
[14] MUYLDERMANS S. Nanobodies: natural single-domain antibodies[J]. Annual Review of Biochemistry, 2013, 82: 775-797.
[15] BANNAS P, HAMBACH J, KOCH-NOLTE F. Nanobodies and nanobody-based human heavy chain antibodies as antitumor therapeutics[J]. Frontiers in Immunology, 2017, 8: 1 603.
[16] MODI S, HIGGS N F, SHEEHAN D, et al. Quantum dot conjugated nanobodies for multiplex imaging of protein dynamics at synapses[J]. Nanoscale, 2018, 10(21): 10 241-10 249.
[17] REN X, ZHANG Q, WU W, et al. Anti-idiotypic nanobody-phage display-mediated real-time immuno-PCR for sensitive, simultaneous and quantitative detection of total aflatoxins and zearalenone in grains[J]. Food Chemistry, 2019,297:124 912.
[18] QIU Y L, HE Q H, XU Y, et al. Deoxynivalenol-mimic nanobody isolated from a naïve phage display nanobody library and its application in immunoassay[J]. Analytica Chimica Acta, 2015, 887: 201-208.
[19] LIU X, XU Y, WAN D, et al. Development of a nanobody-alkaline phosphatase fusion protein and its application in a highly sensitive direct competitive fluorescence enzyme immunoassay for detection of ochratoxin a in cereal[J]. Analytical Chemistry, 2015, 87(2): 1 387-1 394.
[20] HE T, WANG Y, LI P, et al. Nanobody-based enzyme immunoassay for aflatoxin in agro-products with high tolerance to cosolvent methanol[J]. Analytical Chemistry, 2014, 86(17): 8 873-8 880.
[21] LIU Y, JIANG D, LU X, et al. Phage-mediated immuno-PCR for ultrasensitive detection of Cry1Ac protein based on nanobody[J]. Journal of Agricultural and Food Chemistry, 2016, 64(41): 7 882-7 889.
[22] SUN Z, LYU J, LIU X, et al. Development of a nanobody-AviTag fusion protein and Its application in a streptavidin-biotin-amplified enzyme-linked immunosorbent assay for Ochratoxin A in cereal[J]. Analytical Chemistry, 2018, 90(17): 10 628-10 634.
[23] 曹冬梅,许杨,涂追,等. 抗黄曲霉毒素B1纳米抗体的原核表达、纯化及活性分析[J]. 食品与发酵工业, 2016, 42(5): 19-24.
[24] 沈菊泉,欧杰,林露,等. 应用ELISA和ELFA定量检测牛奶中葡萄球菌肠毒素A方法的建立[J]. 微生物学杂志, 2018, 38(3): 42-46.
[25] 中华人民共和国广东出入境检验检疫局. SN/T 1763. 2—2006(2010) 出入境口岸生物毒素检验规程[S]. 北京:中国标准出版社, 2010.